摘要
背景
来自亚麻韧皮部组织的韧皮纤维具有科学意义和经济价值,部分原因是次生细胞壁沉积的动态系统。为了更好地理解亚麻细胞壁发育过程的分子机制,我们从次生细胞壁发育早期的韧皮部纤维(即单个细胞)中提取了蛋白质,并使用荧光(DiGE)标签和2d凝胶电泳将这些提取物与周围皮层非纤维细胞的蛋白质提取物进行了比较,并通过质谱鉴定了一些蛋白质。
结果
纤维中许多蛋白质的丰度与皮层周围的非纤维细胞明显不同,1850个可检测点中约13%显著富集于纤维(> 1.5倍,p≤0.05)。通过质谱分析,我们鉴定了114个位点,其中51个位点纤维含量显著丰富。我们观察到K+通道亚基、膜联蛋白、孔蛋白、分泌途径成分、β-淀粉酶、β-半乳糖苷酶、果胶和半乳糖生物合成酶是发育中的亚麻纤维中检测到的富集程度最高的蛋白质,其中许多蛋白质显示出与翻译后修饰一致的电泳模式。
结论
我们发现的富含纤维的蛋白质与先前组织学和生化分析所提出的二次壁沉积的动态过程一致,特别是半乳聚糖和分泌途径在这一过程中的重要性。β-淀粉酶的富集表明淀粉可能是亚麻韧皮纤维细胞壁生物发生的一种未被重视的物质来源。此外,我们的观察证实了先前的报道,即积累蛋白如膜联蛋白和特异性热休克蛋白与继发性细胞壁沉积有关。
背景
亚麻(亚麻属植物usitatissimumL.)自农业开始以来就引起了人类的注意[1,2].这部分是由于韧皮(即韧皮部)纤维的不同寻常的性质,由于其长度大,抗拉强度高,已被用于纺织品和许多其他产品[3.].纤维的长度几乎完全是通过侵入式生长来实现的,这一过程仅限于植物中极少数的细胞类型[4,5].延伸阶段由二次壁沉积的动态过程接替,在此过程中,新生壁中富含半乳糖的聚合物基质逐渐向心地被高结晶性纤维素取代[6].由于次级壁沉积增加了细胞的抗拉强度,因此,即使是经历了细胞壁增厚的最初阶段的纤维,在机械上也可以通过其在茎的“断裂点”处的抗断裂性来加以区分[7].因此,快照点定义了从细胞伸长到细胞壁增厚的重要发育转变。
在此之前,我们和其他人已经从亚麻和大麻茎的纤维皮中产生了cdna文库[8,9].这些皮除了含有不同发育阶段的韧皮纤维外,还含有许多其他类型的细胞,包括与形成层和运输韧皮部有关的细胞。通过cDNA微阵列杂交和其他技术对这些文库进行分析,发现在纤维伸长和细胞壁沉积过程中,茎皮中多糖相关酶转录物的表达存在明显的模式。然而,由于固有的技术和生物学限制,已知在许多情况下,某一特定基因的转录物和蛋白质的丰度可能不是高度相关的[10,11].转录组分析的生物学相关性的这一公认的局限性使我们对次级壁沉积开始时发育中的亚麻纤维中存在的蛋白质进行了调查,以补充我们之前的工作。这类似于用于研究其他物种中其他细胞类型的次级细胞壁发育的蛋白质组学方法[12- - - - - -16].对于蛋白质组的这项研究,我们还通过从生长茎的断裂点分离的韧皮部纤维中提取蛋白质,并将其丰度与来自同一茎的皮层的周围非纤维细胞中的蛋白质进行比较,从而增加了分析的特异性。因此,本研究的目的是鉴定那些有助于亚麻纤维细胞壁沉积的有趣模式的蛋白质。
结果与讨论
纤维蛋白和非纤维蛋白的分离
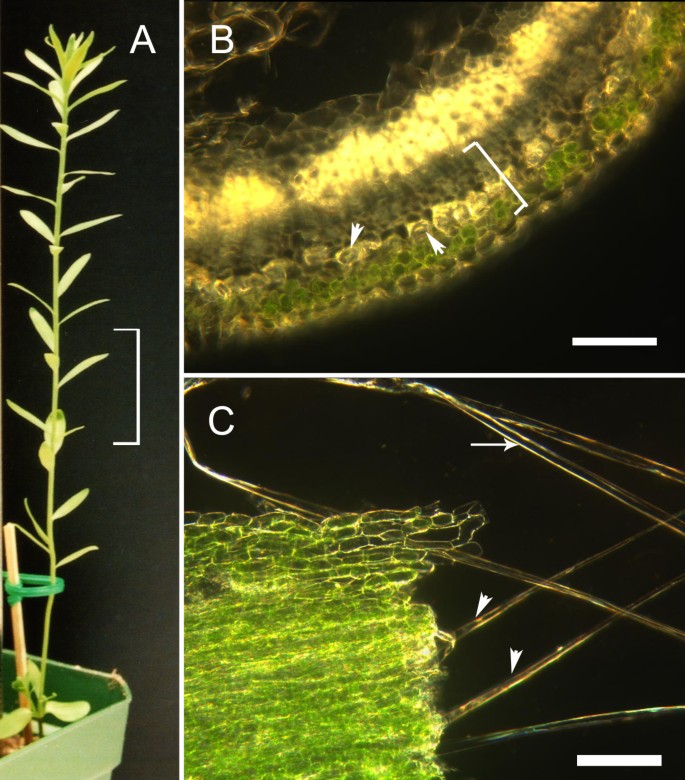
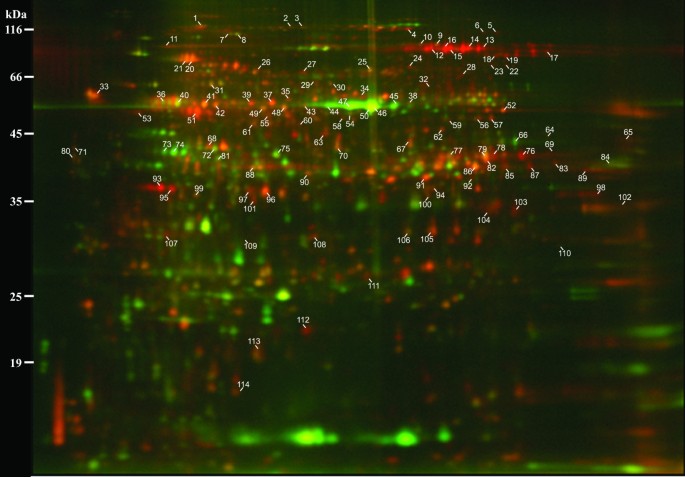
为了加深我们对促成亚麻皮纤维独特特性的蛋白质的理解,我们从营养茎(萌发后21-24天)的断裂点区域分离的最终纤维(即单个细胞)中提取蛋白质(图1).快照点是次级壁沉积开始的茎部区域[7].我们还从快照点的皮层中收集了周围的非纤维细胞(主要由薄壁组织、筛元和伴细胞组成)。在本报告的其余部分中,我们将从抓拍点收集到的最终韧皮纤维简单地称为“纤维”,而皮质周围的非纤维细胞则称为“非纤维部分”。通过用对比的荧光染料标记来自纤维和非纤维部分的蛋白质,并同时使用2D凝胶电泳(DiGE)分离两个样品的混合物,我们能够识别出纤维中比非纤维部分更丰富的蛋白质(图2).
一个典型的亚麻植物在纤维提取的时候.(A)支架表示茎干3cm处纤维被剥离的区域。(B)收获时新鲜茎组织的横切面细节。这张手切片是在抓拍点下方获得的,以演示茎内组织的排列,即在获取组织进行蛋白质分析时不使用横切面。支架表示皮层的区域,纤维和非纤维部分将从中获得。箭头所示为皮层内代表性纤维的位置。比例尺为100 μm。(C)解剖过程中的茎组织。周围的非纤维细胞被部分去除的纤维用箭头表示。箭头所示为由单个细胞组成的完全解剖纤维。 This fibre is representative of the cells from which proteins were extracted. The scale bar is 100 μm.
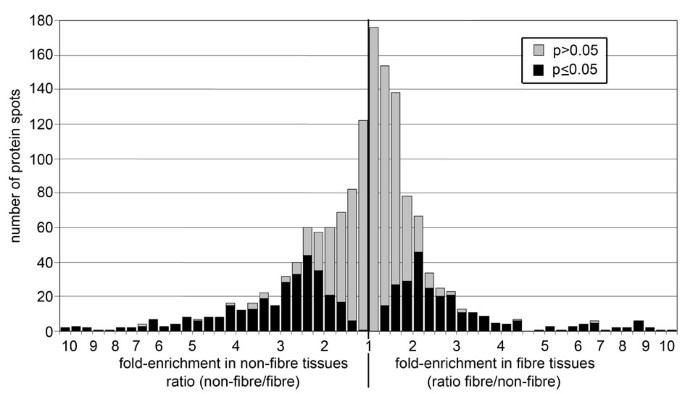
在4个复制凝胶中,我们从纤维中平均检测到1850个不同的蛋白质斑点,从非纤维部分中检测到1695个斑点。总的来说,558个蛋白质点的荧光信号强度在样品之间相差至少1.5倍(p≤0.05),其中246个点(占检测到的总数的13%)富集在纤维部分,312个点(占检测到的总数的18%)富集在非纤维部分(图3.).从DiGE凝胶图像的目视检查中,纤维和非纤维部分的独特蛋白质分布也很明显(图2).因此,韧皮部纤维似乎表达了一种与茎中周围细胞类型不同的蛋白质补体。
蛋白质的LC/MS鉴定
我们挑选了190个富集在纤维样品中的蛋白质点,用于质谱鉴定。根据光斑体积大、信号折叠富集程度高、光斑形态聚焦良好等标准选择光斑。为了进行比较,我们还选择了另外50个富含非纤维成分或在两种蛋白质样本中同样丰富的点。虽然我们报告的折叠富集模式在统计参数范围内是可重复的(表1),个体比例不应定量地推断到整个蛋白质,部分原因是某些蛋白质可能由多个点表示。
我们对240个点进行了LC/MS分析。其中,126个点产生的光谱不能被分配到现有序列中,而来自其余114个点的光谱产生了显著的匹配(即MOWSE得分40-675;每个点匹配两个或更多肽)与Genbank蛋白质数据库的预测光谱(表1).四个点(#7,#41,#72,#89)含有预测的多肽,与不止一种不同的蛋白质匹配,表明凝胶上的一些点存在多种蛋白质。在我们指定的蛋白质特征点中,76个在纤维样本中富集了至少1.5倍(即1.5倍),其中51个在统计上比非纤维部分的纤维含量更高(p≤0.05)。相反,我们能够为17个非纤维成分富集1.5倍或更多的点分配身份;其中至少有7个与光合作用有关(斑点#44 - #47,#73,#74,#81)。因为光合作用是一个在非纤维部分中主导代谢的过程,这些观察结果与我们希望通过解剖实现的纤维和非纤维组织的物理分离是一致的。我们将把本报告的其余部分集中在富含纤维的斑点上。
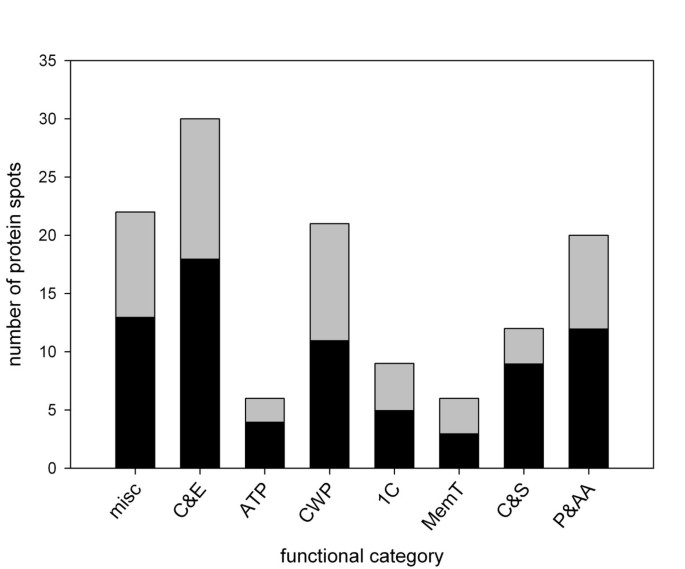
我们能够赋予假定身份的富含纤维的蛋白质被分为八个功能类别(图4).除了我们称之为“杂”的类别,它代表了一组不同的功能,在纤维样品中鉴定的大多数蛋白质可以被分配到与碳水化合物转化为能量或聚糖生物合成相关的三个类别之一,即:初级碳和能量代谢;一个碳代谢;细胞壁和多糖代谢(图4).这些蛋白质在碳水化合物和相关化合物的代谢中占主导地位,这与我们预期在次级壁生物发生中活跃的细胞内观察到的主要生化活动是一致的。此外,我们将少量的蛋白质分配到每个剩余类别:膜转运;细胞骨架及分泌;atp酶;蛋白质和氨基酸代谢。表中显示了在八个功能类别中分配到每个点的蛋白质的成员关系1,并将在下面的部分中更详细地讨论。
初级碳和能量代谢
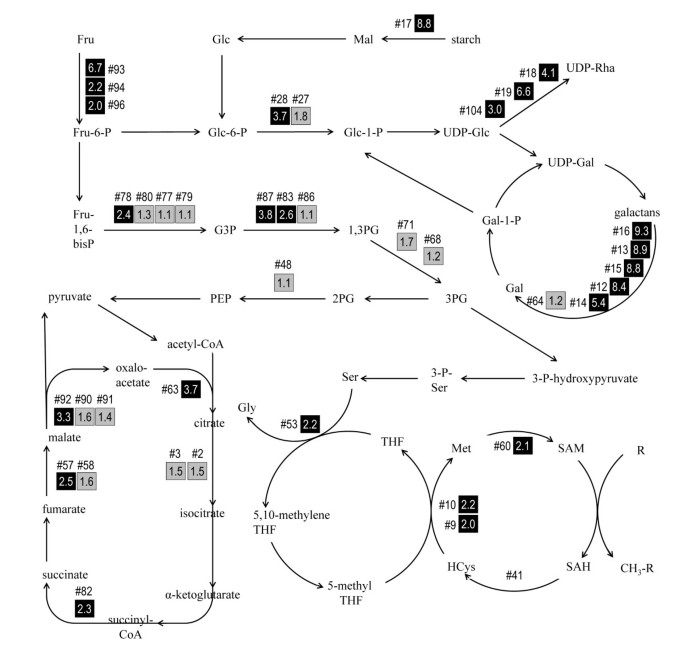
单糖和淀粉转化为能量是由纤维中富集的蛋白质(> 1.5倍)比例最大的函数推断出来的,与茎断裂点的非纤维部分相比(图)4).这些反应也总结在图中5.在所有功能类别中,我们检测到的两种富集度最高的蛋白质是β-淀粉酶(spot #17;8.8×倍富集纤维)和果糖激酶(# 93,6.7 ×;# 94, 2.2×;#96, 2.0×),分别催化淀粉和果糖分解代谢的第一步(表1).这些酶在纤维中相对丰度的增加为次生壁生物发生的碳和能量的直接来源提供了一些见解。糖酵解及相关过程的酶(果糖-二磷酸醛缩酶(#78,2.4×)、甘油醛3-磷酸脱氢酶(#83,2.6×;#87, 2.8×)和磷酸葡萄糖转化酶(#27,1.8×;#28, 3.7×),以及磷酸甘油酸激酶(#68,#71)的存在。最后,我们鉴定了富含纤维的蛋白点,它们代表了三羧酸循环中8种酶中的5种,在三羧酸循环中,糖酵解的产物产生了进一步的能量和代谢前体。纤维中显著富集的三羧酸循环相关蛋白包括柠檬酸合成酶(# 63,3.7 ×)、琥珀酰辅酶a -连接酶(# 82,2.3 ×)、富马酶(# 57,2.5 ×)和苹果酸脱氢酶(# 92,3.3 ×)。同时检测到乌头酸水合酶(#2,#3),尽管其折叠富集无统计学意义(p > 0.05)。
在选定的碳水化合物和单碳代谢反应中被鉴定为酶的富含纤维的蛋白质的相对丰度.符号“#”后面的数字是表1和整个文本中使用的唯一点标识符。方框中的值表示折叠富集(即纤维/非纤维中的信号强度)。灰色和黑色填充框分别表示在纤维和非纤维组织强度差异显著性t检验中p > 0.05和p≤0.05的点。没有显示#41的强度比,因为在这个点内鉴定出多种蛋白质。所示路径基于KEGG和AraCyc的数据[37,38]。并不是所有的反应物或辅因子都被显示出来。底物名称中使用的缩写包括果糖(Fru)、半乳糖(Gal)、葡萄糖(Glc)、甘油醛-3-磷酸(G3P)、同型半胱氨酸(HCys)、麦芽糖(Mal)、磷酸甘油酸(PG)、磷酸烯醇丙酮酸(PEP)、鼠李糖(Rha)、s -腺苷同型半胱氨酸(SAH)、四氢叶酸(THF)。
atp酶
在纤维或非纤维部分中鉴定出atp酶/合酶复合物的许多亚基,包括α-亚基(#35),β-亚基(#42,#43)和γ-亚基(#99)。这些不同亚基的组织特异性丰度模式令人惊讶地复杂:γ-亚基和一个β-亚基(#42)在两种样品类型中与相等的斑点强度相关,而另一种ATP合成酶β-亚基(#44)在非纤维部分中丰度高1.8倍。纤维中α-亚基含量较高(1.6×)。
除了上述的atp酶/合成酶,我们还从其他几种推定的atp酶中鉴定出肽,包括三个含有空泡型atp酶(v-ATPase)的蛋白点,其中,两个点(# 24,2.6 ×;#105, 1.8×)在纤维中富集显著(p≤0.05)。v- atp酶是液泡和内膜系统中最丰富的膜蛋白之一,它们的富集可能反映了纤维中这些细胞器结构相对丰度的增加[17].我们还在纤维中检测到一种推定的质膜相关的aaa - atp酶(#1,1.6×),尽管根据我们通常的统计标准,这并不被认为在纤维中含量更高。v- atp酶和aaa - atp酶先前已被证明对囊泡运输至关重要,因此可能在发育纤维的次生壁特异性过程中活跃[17,18].
细胞壁与多糖代谢
细胞壁由多种类型的聚合物组成,包括纤维素、半纤维素和果胶。然而,除了一种与udp -木糖合成酶(#76,6.1×)和gdp -4-酮-6-脱氧-d -甘露糖-3,5- epiimerase -4-还原酶(GME, #101, 2.3×)相似的nadd依赖的外,我们发现的几乎所有富含纤维的细胞壁相关酶都最有可能与果胶样物质的代谢有关。例如,我们从6个位点鉴定出β-半乳糖苷酶。其中5个(#12 - #16)位于电荷序列中,第6个(#64)是一个表观分子量较低的孤立点。电荷序列中的5个点在纤维中明显更强(5.4 ~ 9.3×),而低分子量点在两种组织中几乎相似(1.15×)。在电荷序列中,来自三个点的多肽与鹰嘴豆β-半乳糖苷酶排列为最高得分匹配。这种鹰嘴豆β-半乳糖苷酶先前已经证明了对果胶侧链的外裂解和内裂解活性,并在延长的下胚轴中发现[19,20.].在亚麻纤维发育过程中,由55-85%半乳糖组成的鼠李糖半乳糖型果胶的沉积先于结晶性纤维原纤维的形成,这些纤维原纤维是成熟次级壁的特征[6].由于鼠李糖半乳糖醛酸的半乳糖残基是β-半乳糖苷酶的假定底物之一,我们推测,这种酶在发育纤维中的丰度证明了它在重塑、去除或半乳糖循环中发挥重要作用,这是细胞壁沉积动态过程的一部分。然而,我们检测到的β-半乳糖苷酶也有可能水解其他半乳糖键,例如修饰阿拉伯半乳糖蛋白的那些键[21].最后,沿着电泳凝胶第一维度分离轴的β-半乳糖苷酶斑点的出现与这种丰富蛋白质的广泛翻译后修饰一致。
除了β-半乳糖苷酶外,我们还鉴定出了在果胶多糖代谢中可能起作用的一种或多种酶的其他位点。3个点(#18,4.1×;# 19, 6.6×;#104, 3.0×)与非纤维部分相比,纤维含量更高,与udp -鼠李糖合酶同源。因为这些酶通常被认为有助于鼠李糖半乳糖聚糖的生长,有趣的是,在β-半乳糖苷酶可能水解这些聚合物中的半乳糖键的相同细胞中观察它们的富集。半乳聚糖代谢的分解代谢和合成代谢过程的潜在共存与这些聚合物在细胞壁沉积期间的快速翻转是一致的,尽管推断的酶活性的存在仍然必须通过实验来证实。
一个碳代谢
在我们的研究中,在富含纤维的蛋白质点中发现了四种与单碳(1C)代谢相关的酶。其中三种:蛋氨酸合成酶(#9,#10;2.0×, 2.2×),蛋氨酸腺苷转移酶(#60;2.1×)和腺苷同型半胱氨酸酶(#41;1.6×)是s -腺苷甲硫氨酸(SAM)循环的组成部分,而剩余的蛋白质,丝氨酸羟甲基转移酶(#53;2.2×),通过叶酸催化碳转移到SAM循环。由于这些酶的累积功能是为转移到受体提供活化的甲基,因此纤维中主要甲基转移酶及其底物的身份是一个明显的问题。在植物中,活化甲基的潜在受体包括各种各样的分子,其中包括果胶或木质素组分[22].由于亚麻纤维中木质素的含量与其他类型的schlerenchma相比较低,特别是在与断裂点相关的细胞壁发育早期阶段,[23,24],似乎木质素不太可能是通过SAM循环的甲基通量的主要汇。因此,果胶或其他积极积累的物质可能是sam介导的甲基化在发育纤维中的靶点。
膜运输
在我们的研究中,只有少数与跨膜转运相关的蛋白质被检测到。这可能部分是由于提取和分解某些膜相关蛋白的困难。尽管如此,我们确定了一个K+通道β-亚基高度富集(#97;纤维中的8.6×),以及两个孔隙蛋白(#102,#102;分别为1.7×、3.9×)。孔蛋白的生物学意义尚不清楚,但K+通道在发育棉纤维过程中与蔗糖吸收有关。因此K+我们观察到的通道蛋白可能反映了亚麻纤维吸收还原碳的类似过程[25,26].
细胞骨架和分泌
与周围组织相比,纤维蛋白提取物中细胞骨架的结构成分以及与囊泡运输相关的蛋白质也相对更丰富。我们观察到纤维中肌动蛋白(#69,#70)和微管蛋白(#37)相对富集至少1.5倍。与非纤维部分的细胞相比,这些蛋白质可能富集在纤维中,部分原因是这些细胞的结构和表面/体积比的差异。此外,在细胞壁增厚的纤维中,细胞骨架蛋白的相对丰度增加可能反映了细胞骨架在纤维素和其他细胞壁成分沉积中的作用。活跃的分泌系统,将非纤维素多糖成分传递到细胞壁,也预计存在于发育亚麻纤维中;肌球蛋白(#5,2.5×;#6, 3.6×),动态样蛋白(#22,3.1×), gdp -解离抑制剂(#55,2.0×;因此,这些细胞中的#56,1.9×)与我们采样的细胞中假定活跃的发育过程一致。我们还注意到,在上述结构背景中提到的细胞骨架的其他成分(即肌动蛋白和微管蛋白)可能具有与分泌和次级壁沉积的其他方面特别相关的额外功能[27- - - - - -29].
蛋白质和氨基酸代谢
与非纤维组分相比,纤维组分中与蛋白质代谢(如蛋白质合成和折叠)有关的酶含量中等(1.5× - 2.7×)。两种翻译起始因子在纤维样品中含量较高:eIF-4A (#62, 1.6×)和eIF-5A (#114, 2.0×)。eIF-4A家族中的蛋白质构成核糖体机制的一部分,并参与mRNA的结合和解卷以进行翻译,而一些eIF-5A亚型家族成员在细胞分裂和相关过程中具有更多样化的功能[30.].在纤维中,平动伸长因子EF2 (# 4,2.5 ×)也更丰富,而含有EF1á的斑点在纤维中也同样丰富(#67,1.2×)或比非纤维部分少2.3倍(#54)。
热休克蛋白HSP60 (#29, 2.7×;# 30日1.5×;#32, 2.1×), hsp70 (#20, 1.9×;# 21日1.7×;#23, 2.0×)和HSP90 (#11, 1.7×)也富集于纤维中。这些蛋白质可能在细胞质蛋白质折叠和蛋白质导入线粒体和叶绿体的过程中起作用,这些过程通常与HSP60、HSP70和HSP90家族成员有关[31].此外,由于hsp70已被证明在酵母细胞壁发育中具有特定功能,我们不能排除在亚麻纤维次级壁沉积过程中,其中一些蛋白质在质膜上具有活性的可能性[32,33].
杂项
我们发现的一些蛋白质不能被归类到我们已经描述过的更大的功能类别中。其中8种蛋白在纤维中富集1.5倍(p≤0.05)或更多,因此可能在纤维发育中发挥特定作用。这些包括附件(#97,2.2×;#98, 4.1×),烯酰- acp还原酶(#100,2.1×),成熟酶K (#112, 3.4×), 14-3-3蛋白(#108,2.6×),过氧化物酶(#85,2.4×),蛋白激酶C抑制剂(#107,2.8×)。其中,膜联蛋白在发育纤维中的富集特别有趣,因为它以前在棉纤维的结构和蛋白质组学研究中与纤维素合酶有关[16,34].
与转录组分析的比较
本研究中使用的实验方法在许多方面不同于我们之前报道的亚麻茎的微阵列分析[8].重要的是,在之前的报告中,我们没有从其他茎组织中解剖纤维;相反,我们比较了不同发育阶段含有纤维的茎段的转录丰度。因此,不需要对这些数据集进行全局比较。尽管存在这些限制,我们注意到三种碳水化合物相关的酶被检测到,它们都是富集在茎的快照点区域的纤维中的蛋白质,以及之前在茎的包含快照点的区域中表达的转录物,包括β-半乳糖苷酶(#12 - 16,# 64)、果糖激酶(#93,#94)和GME(#101)(表12 - 16,# 64)1).在转录组数据中,β-半乳糖苷酶和果糖激酶在突变点区域的丰度明显高于茎尖或茎基部附近的片段,而GME在茎尖-最顶端段的转录丰度最高,这可能是由于这些不同基因产物的周转差异。另一方面,我们之前的工作也发现了许多其他在之前的研究中没有作为蛋白质检测到的快照点富集转录本。这些蛋白包括阿拉伯半乳聚糖蛋白和脂质转移蛋白,通过qRT-PCR进一步证实,与叶片或茎的木质部相比,它们在捕捉点的韧皮部组织中特异性富集。转录组学和蛋白质组学分析之间的差异已经被我们自己和其他人记录下来,可能是由于各种蛋白质的提取和检测效率的差异,以及许多其他技术和生物学因素[35].例如,Bayer等人在他们的蛋白质组学分析中特别注意到agp和其他细胞壁蛋白的代表性,这可能是由于这些蛋白的高度糖基化[12].因此,对发育中的亚麻纤维中基因表达的全面描述似乎不能仅通过转录本或蛋白质分析来提供,而是必须将许多不同实验方法的结果放在一起考虑。
方法
植物材料
皮层的纤维(即单个细胞)和周围的非纤维细胞从茎中分离亚麻属植物usitatissimumL., var. Norlin从四个独立生长的群体中共收获了495株植物。种子每10厘米播种两粒,按上述方法种植[8].生长3周后,茎尖到速效点的平均距离为5.9 cm,平均株高为19 cm。一段3厘米的茎,从快照点以下2厘米到5厘米,进一步解剖以分离皮层的单个纤维和周围的非纤维细胞(即。用于蛋白质组学分析的“非纤维部分”,主要由薄壁组织、筛元和伴生细胞组成,但不包括表皮、木质部和髓。解剖后,纤维和周围组织用去离子水冲洗,吸干,然后在液氮中冷冻,-80°C保存。
从组织中分离蛋白质
将组织在液氮中研磨成粉末,然后在1 mL冷TCA/丙酮缓冲液(20 mM DTT, 10%三氯乙酸在冷丙酮中)中进一步研磨1分钟。匀浆与额外的1ml缓冲液一起转移到微量离心管中,并在-20°C下沉淀过夜。离心(13000 rpm, 10°C, 15分钟)后,用1ml 20 mM DTT丙酮在-20°C下冲洗1小时,然后在-20°C下晾干2小时,在200 μL尿素/硫脲缓冲液(7 M尿素,2 M硫脲,4% (w/v) CHAPS, 30 mM Tris-Cl)中室温涡流溶解30分钟。通过离心(13000 rpm, 17°C, 5分钟)澄清溶液,使用2D清理试剂盒(Amersham Biosciences)进一步处理上清液。沉淀物在60 μl尿素/硫脲缓冲液中重新溶解,使用2D Quant Kit (Amersham Biosciences)和NanoDrop测定蛋白质样品的浓度®ND-1000分光光度计(NanoDrop Technologies)对BSA标准曲线。
蛋白质的荧光标记
四个独立的水池,每个水池大约有125株植物,在名义上相同的条件下生长,但在空间和时间上彼此分离。蛋白质分别从每个植物池的解剖组织中分离出来,从纤维和非纤维部分中产生四个成对的蛋白质样本,其中每对样本在生物学上独立于其他每对样本。我们使用CyDye™DiGE荧光(最小染料)标记试剂盒(Amersham Biosciences),用240 pmol的Cy2、Cy3或Cy5荧光染料标记每个30 μg蛋白质样品(pH调整为8.5)。在每个试管中加入1 μl 10 mM赖氨酸,停止标记反应,在冰上孵育10分钟后,加入样品缓冲液(7 M尿素,2 M硫脲,2% (v/v)双电解质,2% (w/v) DTT, 4% (w/v) CHAPS),使样品体积增加一倍,为IEF准备样品。标签样品混合在一起,如表所示2创建四种分析凝胶,每个凝胶都包含一个内部标准和两个组织样本。内部标准是通过混合从每种生物独立收获的纤维和非纤维馏分中提取的等量蛋白质来制备的。
2DE的CyDye标记蛋白混合物
2DE的所有后续处理和分离步骤都是在避光条件下进行的。24 cm, 3-10 NL Immobiline™干条(Amersham Biosciences)在(8 M尿素,4% (w/v) CHAPS, 1% (v/v)双电解质3-10,13 mM DTT,微量溴酚蓝)中被动再水合10小时。使用IPGphor™II (Amersham Biosciences)在20°C下总共56 kVh聚焦蛋白质。在基本端的纸芯上加了13mm DTT,并在运行过程中更换了三次。在IEF之后,通过在6 M尿素、50 mM三氯乙酸(pH 8.8)、30% (v/v)甘油、2% (w/v) SDS、微量溴酚蓝加上0.5% (w/v) DTT中缓慢搅拌15分钟来平衡SDS- page分离,然后用4.5% (w/v) IAA代替DTT,在相同的溶液中搅拌15分钟。平衡后,用密封液(1%低熔点琼脂糖,1X运行缓冲液中微量溴酚蓝)将条带密封在自铸、大尺寸、12.5%丙烯酰胺凝胶的顶部边缘。在SDS-PAGE过程中,使用etan™Dalt同时按分子量分离四种分析凝胶六个(Amersham生物科学)。凝胶以2w /凝胶的速度运行30分钟,然后以8w /凝胶的速度运行,直到溴酚蓝染料前端刚刚接触凝胶的末端。
成像与分析
PMT电压为50000 ~ 63558 V,荧光标记凝胶在100 μm分辨率下成像。DeCyder™6.5 (Amersham Biosciences)用于匹配、规范化和统计分析斑点。在使用差异凝胶分析(DIA)进行凝胶归一化后,使用生物变异分析(BVA)模块对所有分析凝胶进行统计分析和归一化。
点选和胰蛋白酶消化蛋白质
制备凝胶,装载约125 μg蛋白质,用Deep Purple™总蛋白染色(Amersham Biosciences)后染色,并与分析凝胶斑点匹配。凝胶斑点切除和随后的胰蛋白酶消化使用eten™斑点采摘器(Amersham生物科学公司)和ProteomeWorks™MassPREP™机器人处理站(Bio-Rad实验室和Waters公司)进行,最终得到的肽提取液为2% ACN, 0.1%甲酸在H20.
蛋白质识别
LC MS/MS分析使用在线1100系列XCT离子阱(安捷伦科技)进行。自动进样器以85%溶剂a(0.1%甲酸,H)为起始溶剂,按肽分离梯度,将每个样品18 μL注入到Zorbax 300SB-C18 5 μm 5 × 0.3 mm的富集柱(Zorbax 300SB-C18 5 μm 150 × 0.3 mm)上,该富集柱与第二色谱柱(Zorbax 300SB-C18 5 μm 150 × 0.3 mm)相连2O),以55%溶剂B(0.1%甲酸,5% H)结束2ACN的O)超过42分钟。接着用90%溶剂B清洗柱10分钟,然后再用97%溶剂A清洗下一个样品。MS进行了300-2200 m/z扫描,然后对最强烈的离子进行MS/MS分析。在ChemStation data Analysis模块中使用默认方法将原始光谱数据处理为Mascot Generic File (.mgf)格式,并在Mascot中完成离子搜索[36],搜索参数为:肽耐受性为2 Da,母体离子耐受性为0.8 m/z,离子电荷为+1、+2和+3。
缩写
- 1 c:
-
一个碳
- 消化:
-
差示凝胶电泳
- dTDP:
-
胸腺嘧啶二磷酸脱氧核苷酸
- 英孚:
-
平动伸长因子
- 如果遇到:
-
平动引发因子
- 国内生产总值:
-
二磷酸鸟嘌呤
- 山姆:
-
S-adenosyl蛋氨酸
- UDP:
-
尿苷二磷酸。
参考文献
纤维革命:古代美索不达米亚的纺织品扩张、异化和社会分层。当代人类学。1997,38(4):517-549。10.1086/204643。
Vanzeist W, Bakkerheeres JAH:公元前6000年之前亚麻籽栽培的证据。考古学报,1975,2(3):215-219。10.1016 / 0305 - 4403 (75) 90059 - x。
Mohanty AK, Misra M, Hinrichsen G:生物纤维,可生物降解聚合物和生物复合材料:综述。高分子材料与工程,2000,27(3):1-24。10.1002 / (SICI) 1439 - 2054 (20000301) 276:1 < 1:: AID-MAME1 > 3.0.CO; 2 w。
Linum III营养芽的血管分化。-韧皮纤维的起源。植物学报,2004,30(8):579-586。10.2307 / 2437468。
入侵生长-植物类似于动物的树突和轴突生长。植物学报,2001,30(3):344 - 344。10.1046 / j.1469-8137.2001.00143.x。
高什科瓦TA, Morvan C:亚麻韧皮部纤维的次级细胞壁组装:半乳聚糖的作用。植物学报,2006,23(2):344 - 344。10.1007 / s00425 - 005 - 0118 - 7。
Gorshkova TA, Sal'nikova VV, chemickosova SB, Ageeva MV, Pavlencheva NV, van Dam JEG: snap point:亚麻韧皮纤维发育的过渡点。工业作物与产品,2003,18(3):213-221。10.1016 / s0926 - 6690(03) 00043 - 8。
Roach M, Deyholos M:对亚麻(Linum usitatissimum L.)茎的微阵列分析鉴定了富含纤维韧皮部组织的转录本。分子遗传学与基因组学研究,2007,27(2):379 - 379。10.1007 / s00438 - 007 - 0241 - 1。
Day A, Addi M, Kim W, David H, Bert F, Mesnage P, Rolando C, Chabbert B, Neutelings G, Hawkins S:亚麻(Linum usitatissimum L.)含纤维茎组织的ESTs:细胞壁发育相关序列的表达分析植物学报,2005,7(1):23-32。10.1055 / s - 2004 - 830462。
Mooney BP, Miernyk JA, Greenlief CM, Thelen JJ:利用拟南芥根和叶的定量蛋白质组学预测代谢活性。植物生理学报,2006,28(2):357 - 357。10.1111 / j.1399-3054.2006.00746.x。
分子与细胞蛋白质组学,2004,3(10):960-969。10.1074 / mcp.M400055-MCP200。
Bayer EM, Bottrill AR, Walshaw J, Vigouroux M, Naldrett MJ, Thomas CL, Maule AJ:拟南芥细胞壁蛋白质组研究。蛋白质组学,2006,6(1):301-311。10.1002 / pmic.200500046。
Blee KA, Wheatley ER, Bonham VA, Mitchell GP, Robertson D, Slabas AR, Burrell MM, Wojtaszek P, Bolwell GP:蛋白质组学分析揭示了转化烟草细胞培养物中一组新的细胞壁蛋白,由生化和形态学参数决定其合成次生壁。植物学报,2001,29(4):344 - 344。10.1007 / s004250000407。
Vander Mijnsbrugge K, Meyermans H, Van Montagu M, Bauw G, Boerjan W:杨树木材形成:木质部蛋白的鉴定、表征和季节变化。植物学报,2000,20(4):589-598。10.1007 / s004250050048。
Watson BS, Lei ZT, Dixon RA, Sumner LW:苜蓿细胞壁蛋白质组学研究。植物化学学报,2004,29(3):379 - 379。10.1016 / j.phytochem.2004.04.026。
姚勇,杨玉文,刘建勇:一种用于显影棉纤维蛋白质组学分析的高效蛋白制剂。电泳,2006,27(22):4559-4569。10.1002 / elps.200600111。
舒马赫K:内膜质子泵:连接膜和囊泡运输。植物学报,2006,26(6):595-600。10.1016 / j.pbi.2006.09.001。
Haas TJ, Sliwinski MK, Martinez DE, Preuss M, Ebine K, Ueda T, Nielsen E, Odorizzi G, Otegui MS:拟南芥AAA atp酶SKD1参与多泡核内体功能并与其正调控因子LYST-INTERACTING PROTEIN5相互作用。植物细胞学报,2007,19(4):1295-1312。10.1105 / tpc.106.049346。
Esteban R, Labrador E, Dopico B:与西葫芦营养组织发育相关的半乳糖苷酶cdna家族。植物科学学报,2005,26(2):457-466。10.1016 / j.plantsci.2004.09.009。
Esteban R, Dopico B, Munoz FJ, Romo S, Martin I, Labrador E:具有果胶降解功能的西葫芦β -半乳糖苷酶的克隆。植物生理学报,2003,44(7):718-725。10.1093 /卡式肺囊虫肺炎/ pcg087。
Kotake T, Dina S, Konishi T, Kaneko S, Igarashi K, Samejima M, Watanabe Y, Kimura K, Tsumuraya Y:萝卜中特异性水解阿拉伯半乳聚糖蛋白{beta}-(1->3)-和{beta}-(1->6)-半乳糖残基的酶的分子克隆。中国生物医学工程学报,2005,29(3):344 - 344。10.1104 / pp.105.062562。
Moffatt BA, Weretilnyk EA:维持植物细胞s -腺苷-l-蛋氨酸依赖的甲基转移酶活性。植物生理学报,2001,26(4):344 - 344。10.1034 / j.1399-3054.2001.1130401.x。
Day A, Ruel K, Neutelings G, Cronier D, David H, Hawkins S, Chabbert B:亚麻茎中的木质化:韧皮纤维中不寻常木质素的证据。植物学报,2005,22(2):234-245。10.1007 / s00425 - 005 - 1537 - 1。
Gorshkova TA、Salnikov VV、Pogodina NM、Chemikosova SB、Yablokova EV、Ulanov AV、Ageeva MV、Van Dam JEG、Lozovaya VV:亚麻(Linum usitatissimum L.)茎组织细胞壁酚类化合物的组成与分布植物学报,2000,44(4):477-486。10.1006 / anbo.1999.1091。
阮丽丽:金田纸:胞间连丝和糖调节的细胞快速膨胀和纤维素合成:来自单细胞棉纤维的见解。功能植物学报,2007,34(1):1-10。10.1071 / FP06234。
阮玉玲,刘维林,傅班,等:通过调控胞间连丝发育可逆门控、蔗糖、K+转运蛋白和扩张蛋白的表达调控单细胞棉纤维伸长。植物细胞学报,2001,13(1):47-60。10.1105 / tpc.13.1.47。
陈志伟,李志刚,李志刚,等。植物细胞分泌途径与细胞质膜组织的关系。中国生物医学工程学报,2007,29(3):344 - 344。10.1016 / j.cellbi.2007.01.006。
田田,张志刚,张志刚:木质部细胞分化过程中的细胞骨架组织。植物学报,2006,29(3):357 - 357。10.1007 / s10265 - 006 - 0260 - 8。
robert AW, Frost AO, Roberts EM, Haigler CH:微管和纤维素微纤维组装在发育管状元件中次生细胞壁沉积定位中的作用。中国生物工程学报,2004,29(4):344 - 344。10.1007 / s00709 - 004 - 0064 - 4。
王文涛,王志勇,王志勇,王文涛:真核翻译起始因子5A对植物衰老的调控作用。植物科学进展,2004,9(4):174-179。10.1016 / j.tplants.2004.02.008。
杨志刚,刘志刚,刘志刚,刘志刚:伴侣蛋白介导的胞浆蛋白折叠的研究进展。中国生物医学工程学报,2004,26(3):344 - 344。10.1038 / nrm1492。
Lopez-Ribot JL, Chaffin WL:酿酒酵母细胞壁蛋白Hsp70家族的成员。中国生物医学工程学报,1996,15(3):344 - 344。
郭文杰,郭文杰,王文杰,王文杰。酵母蛋白分泌的研究进展。微生物学进展,2006,14(1):15-21。10.1016 / j.tim.2005.11.009。
Hofmann A, Delmer DP, Wlodawer A:绒毛棉膜联蛋白Gh1的晶体结构揭示了一个不寻常的S-3簇——与纤维素合成酶复合物的形成和氧化应激反应有关。生物化学学报,2003,27(3):357 - 357。10.1046 / j.1432-1033.2003.03612.x。
蒋艳,杨波,李志强,李志强,杨晓明:拟南芥根系NaCl胁迫响应蛋白的比较分析。实验植物学杂志,2007,38(4):357 - 357。10.1093 / jxb / erm207。
张普芬,Foerster H, Tissier CP, Mueller L, Paley S, Karp PD, Rhee SY: MetaCyc和AraCyc。植物研究的代谢途径数据库。植物生理学杂志,2005,38(1):344 - 344。10.1104 / pp.105.060376。
Kanehisa M, Goto S: KEGG:京都基因和基因组百科全书。核酸研究,2000,28(1):27-30。10.1093 / nar / 28.1.27。
确认
我们感谢Anthony Cornish, Ana lopez - campi和Paul Semchuk的技术建议。这项工作由NSERC(自然科学和工程研究委员会)的发现补助金,艾伯塔省独创性新教员补助金和艾伯塔省创新和科学加速补助金资助。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
NSCH设计并进行了所有实验,包括质谱仪的操作和质谱的解释,并撰写了这篇手稿的原始草稿。MKD监督了所有的研究,并对手稿的写作和编辑做出了贡献。
电子辅助材料
12870 _2007_260_moesm1_esm.xls
附加文件1:附加信息(如肽序列;米r,数据库匹配pI, PFAM域)在表中没有传达的点识别上1.(xls 78 kb)
权利和权限
本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用属性许可协议(http://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
hote, n.s., Deyholos, M.K.亚麻纤维蛋白质组:在韧皮纤维中富集的蛋白质的鉴定。BMC植物生物学8日,52(2008)。https://doi.org/10.1186/1471-2229-8-52
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-8-52
关键字
- 果胶
- 次级细胞壁
- 亚麻纤维
- 韧皮纤维
- 壁沉积