摘要
背景
染色质动力学和稳定性是控制多细胞生物正常发育所必需的。染色质组装因子caf1是一种组蛋白伴侣,促进染色质形成和特定染色质状态的维持。在植物和动物中,caf1对正常发育至关重要,但目前尚不清楚哪些发育途径需要caf1的功能。
结果
所有三个caf1亚基的突变都会影响拟南芥的毛状体形态,caf1功能的缺失会导致毛状体的形成和多分支。外源性蔗糖可部分缓解这种表型。相比之下,caf1突变表型的其他方面,如分生组织功能缺陷和器官形成,会因外源蔗糖而加剧。双突变体分析显示CAF-1突变体与stichel,但CAF-1突变体与glabra3而且kaktus.此外,caf1突变可部分抑制强过分支和多倍体表型kaktus突变体。
结论
caf1是细胞分化所必需的,并与STICHEL一起通过独立于内复制的途径调节毛状体的发育。外源蔗糖可部分替代caf1的这一功能。最后,caf1也是高核内重复的必要条件kaktus变种人因而为实现kaktus“极端过分支表型。
背景
染色质的稳定性和动态必须得到很好的平衡才能保证正常的发育。虽然染色质结构的灵活性允许生物生命周期中必要的发育转变,但表观遗传和遗传信息必须在特定的发育阶段内可靠地传播。各种蛋白质复合物已被描述参与染色质调节[1- - - - - -3.].染色质复制的一个生物化学特征良好的复合物是染色质组装因子caf1,它以复制依赖的方式将组蛋白H3和H4沉积在DNA上(参见[4,5].该复合物最初被认为是人类细胞提取物中的一种负性超卷诱导因子[6,7]并且在所有主要的真核生物谱系中是保守的。在酵母中也发现了同源物(亚基CAC1, CAC2, CAC3;[8],在哺乳动物中(p150, p60, p48;[9],在昆虫中(p180, p105/75, p55;[10- - - - - -12]在植物中(FASCIATA (FAS) 1, FAS2, MSI1;[13,14].
酵母caf1突变体在交配型位点和端粒附近的沉默维持能力受损,对紫外线辐射的敏感性增加[8,15- - - - - -20.].在高等真核生物中,caf1特异于H3.1变体的复制耦合沉积,而其他组蛋白伴侣蛋白以复制无关的方式沉积H3.3变体(植物中称为H3.2) [21,22].因为大部分H3.3存在于活性染色质中,H3.1较少[23],有人提出cafa -1介导的染色质组装通过H3.1沉积促进转录抑制[24].最近的一份报告表明,含h3.1的核小体比含h3.3的核小体更稳定,这支持了这一模型[25].cafa -1复制偶联沉积H3.1在后生动物中至关重要,因为cafa -1功能的丧失会导致小鼠和人类细胞染色质代谢的严重缺陷并最终导致细胞死亡[26- - - - - -30.].cafa -1的缺失导致发育停滞非洲爪蟾蜍光滑的[31]、果蝇[32]和斑马鱼[33].
拟南芥是唯一具有可行的caf1突变体的高等真核生物(详见[34])。拟南芥caf1的两个较大亚基FAS1和FAS2缺失突变体,最初因其叶向性改变和茎扁平分叉而被分离出来[35,36],这是一种被称为着迷的表型[37].着迷与改变的表达有关WUSCHEL,这是一个关键的调节基因,在茎尖分生组织(SAM)中定义干细胞生态位[13].错误说明WUSCHEL结构域改变了分生组织的大小和形状,从而改变了原基间距,从而导致叶向性的扭曲。的零突变体相反FAS1而且FAS2cafa -1最小亚基MSI1的可行零突变体是致命的[38].然而,这种致命性不是由caf1功能的丧失引起的,而是由受精独立种子发育复合体(INDEPENDENT SEED DEVELOPMENT, FIS)的丧失引起的,MSI1也是FIS的一个亚基[39].
初步研究fas在分生组织中关注caf1功能的突变体[13,35,36然而,最近的研究表明,对于异染色质的完全压实和转录基因沉默的维持也需要caf1 [40,41],同源重组[42,43],核内重复调控[34],以及细胞分化[44].
毛状体或叶毛从叶表面突出来保护植物免受不利的环境条件和食草昆虫的侵害[45,46].根据植物的种类和功能,毛状体是单细胞或多细胞的,代谢活跃或不活跃的结构。在拟南芥在美国,毛状体是具有复杂结构的单个活细胞,这使得它们非常适合研究细胞的测定和分化。毛状体起源于表皮细胞层,通过横向抑制均匀分布(概述见:[47])。经鉴定后,毛状体祖细胞停止分裂并转换为核内重复。细胞从表皮细胞层扩大并突出。在莲座叶上,两个分支事件使毛状体具有典型的三端形态。遗传分析揭示了一个复杂的调节网络,控制毛状体的间距和分化。两组主要的基因控制着分支。一些基因直接影响分支,而另一些基因则以内源性重复依赖的方式控制分支数量(由:[48])。
我们之前报道过毛状体分化需要一个功能性的caf1复合体,但在这一过程中caf1基因通路的作用仍然是开放的[44].在这里,我们提供了caf1和STICHEL (STI),其编码一种与atp结合真菌dna聚合酶iii亚基相似的蛋白质[49],共同控制毛状体分化的独立途径。
结果
蔗糖抑制caf1突变体的毛状体表型
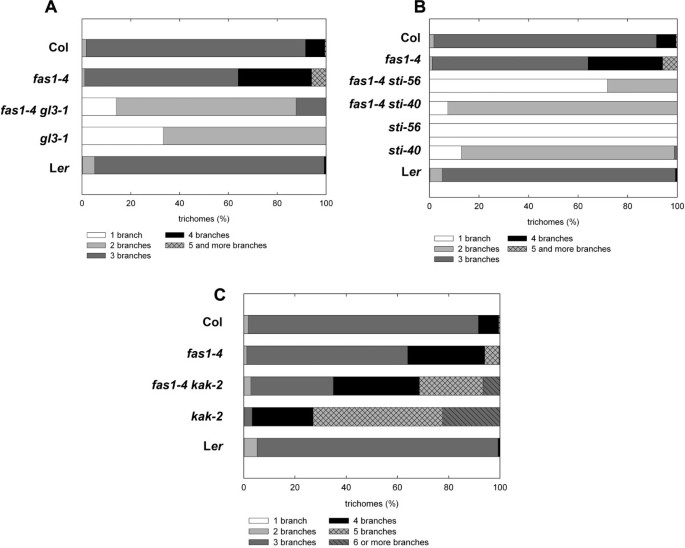
在分析caf1突变体的毛状体发育过程中,我们观察到fas2-1在含蔗糖的MS培养基上生长的幼苗比单独在MS培养基上生长的幼苗具有更少的带有多余分支的毛状体(数据未显示)。碳水化合物控制细胞周期活动,已知影响植物发育和器官形成(有关综述见:[50,51]),但其在毛状体发育中的作用尚未见报道。为了测试蔗糖是否普遍影响毛状体发育,野生型和caf1突变株在MS培养基上添加1%蔗糖。对照植物在含1%非代谢糖山梨醇的MS培养基上生长。记录了第一个和第二个莲座丛叶的毛状分支的数量。1).在野生型植物哥伦比亚(Col), Enkheim (En)和Landsbergerecta(左呃),蔗糖导致毛状体向分支较少的毛状体的小而一致的转变。对于Col,分支数量的减少具有统计学意义(卡方检验,p < 0.05)。fas2-4,msi1-as, En和fas2-1.在CAF-1突变体中,蔗糖至少部分地抑制了多生分支表型。这种影响在……最强msi1-as,最弱的fas1-4.突变的STI而且GLABRA3 (GL3),分别通过核内重复独立通路和核内重复依赖通路正向调节毛状体的分支,通常产生无分支的毛状体(sti)或只有一个分支事件(gl3).两种突变体都不受蔗糖的影响(图。1).因此,蔗糖在毛状体分化过程中影响分枝,并可部分替代caf1的损失。
蔗糖影响caf1突变体的毛状体形态.在含蔗糖的培养基中,caf1突变体莲座叶毛状体的过分枝减少。对野生型Col(294、342)、En(161、136)和L的第1和第2初生叶的毛状体分支数进行了测定呃(119,449)和突变体fas1-4(223, 171),fas2-4(164, 121),fas1-1(123, 98),fas2-1(66, 124),gl3-1(42, 55)和sti-56(129, 171)。括号内的数字分别表示在山梨醇和蔗糖上分析的毛状体的数量。请注意,gl3-1在初级莲座丛叶上只产生有限数量的毛状体。植物在MS培养基上生长,培养基中添加1%山梨醇(未标记条)或1%蔗糖(黄色条)。
蔗糖一般不会减弱caf1突变体的表型
蔗糖可能通常抑制caf1突变表型。然而,对CAF1突变体的详细分析表明,蔗糖只减弱了CAF1突变体的毛状体分支,而没有减弱其他方面的表现型。事实上,叶向性扭曲在fas2-1在含蔗糖的MS培养基上生长的突变体(图;2).连续叶片之间的角度高度不规则,一些原基没有完全分化成叶片,但表现出微弱的辐射(数据未显示)。此外,节间拉长,莲座通常紧凑的外观也消失了(表1).此外,即使在fas2-1将幼苗从蔗糖培养基转移到土壤中,约10%的植株出现花发育缺陷(图2)。2 f, G).这些植物的花瓣和雄蕊缺失或严重畸形,心皮不融合。此外,有时在茎生叶边缘产生异位胚珠。在对照植物中未观察到这种表型。这种突变表型的强烈增强在实验中未观察到fas1-1,fas1-4而且fas2-4caf1等位基因突变,提示L呃当其他因素如蔗糖干扰早期发育时,CAF-1功能的丧失尤其敏感。
caf1突变部分抑制kaktus多分支表型
我们之前认为,caf1通过独立于内复制的途径控制毛状体分支[44].为了进一步验证这一假设,我们首先分析了fas2-1 kak-2双突变体。KAKTUS(谷湖)编码一个假定的heht结构域E3连接酶[52),而谷湖突变的毛状体具有增加的倍性水平和高度多余的分支[53].属莲座丛叶毛状体形态的研究fas2-1 kak-2双突变植株表明,这两个等位基因不是上位性的(图。3).这一结果与caf1控制毛状体分支的假设是一致的谷湖包含路径。的分支表型fas2-1 kak-2毛状体是两个单一突变体的中间体,而不是相加体,表明KAK和caf1可以相互影响。
CAF1功能的丧失限制了DNA核内重复kak-2突变体
而fas2-1突变体和野生型植物的毛状核DNA含量相同[44],基因突变谷湖在叶毛核中允许额外的核内重复[53].然而,caf1功能是染色质完整性所必需的,并被认为在细胞周期进程中是必需的[40].因此,caf1功能的丧失是可能的fas2-1 kak-2突变体限制谷湖核内再复制的潜力,从而限制毛状体的分支fas2-1 kak-2突变体。DNA含量分析表明,毛状体fas2-1 kak-2突变体的核DNA平均比毛状体少三分之一kak-2单突变体(图;3 b).这一水平介于观察到的内环数之间fas2-1而且kak-2.一种可能的解释是,在毛状体中,caf1是通过内循环有效进展所必需的。这样的限制与caf1突变体通过s期的缓慢进展相一致[40,54].
caf1和STICHEL共同作用于毛状体分化的内复制独立途径
分析fas2-1 kak-2(这项工作)和fas2-1 gl3-1[44双突变体表明FAS2作用于平行于谷湖而且GL3并以独立于内复制的方式控制毛状体分支。STICHEL (STI),一种与真菌dna聚合酶iii亚基相似的蛋白质[49],也控制着毛状体在一种独立于内复制的途径上的分支。为了测试caf1是否在毛状体分化的sti途径中起作用,fas2-1一个强一个弱sti等位基因。而sti-56几乎完全消除了毛状体的分支,sti-40发育许多毛状体,有一个分支[49,55].毛状体的形态分析fas2 sti双突变体表现出较强但不完全的上位性sti-56零等位基因fas2(无花果。4).有趣的是,fas2强化了弱智的弱表现型sti-40等位基因。总之,这些结果表明FAS2而且STI在毛状体分化的同一途径中共同发挥作用。
我们之前报道过FAS2在caf1复合物的背景下控制毛状体分支[44].为了验证caf1和STI在同一途径中,我们产生了两个突变体fas1而且gl3,谷湖而且sti.各种双突变体的毛状体分支表型fas1而且fas2是类似的:fas1-4 gl3-1表现为中间表型(图;5)与单个突变体相比,而fas1-4 sti-40而且fas1-4 sti-56又表现出了强上位性sti在fas1(无花果。5 b).此外,fas1-4 kak-2双突变体具有相似的部分抑制谷湖表型一样fas2-1 kak-2双突变体(图;5 b).这些结果与我们的观点一致,即caf1和STI在毛状体分化的同一途径中发挥作用。
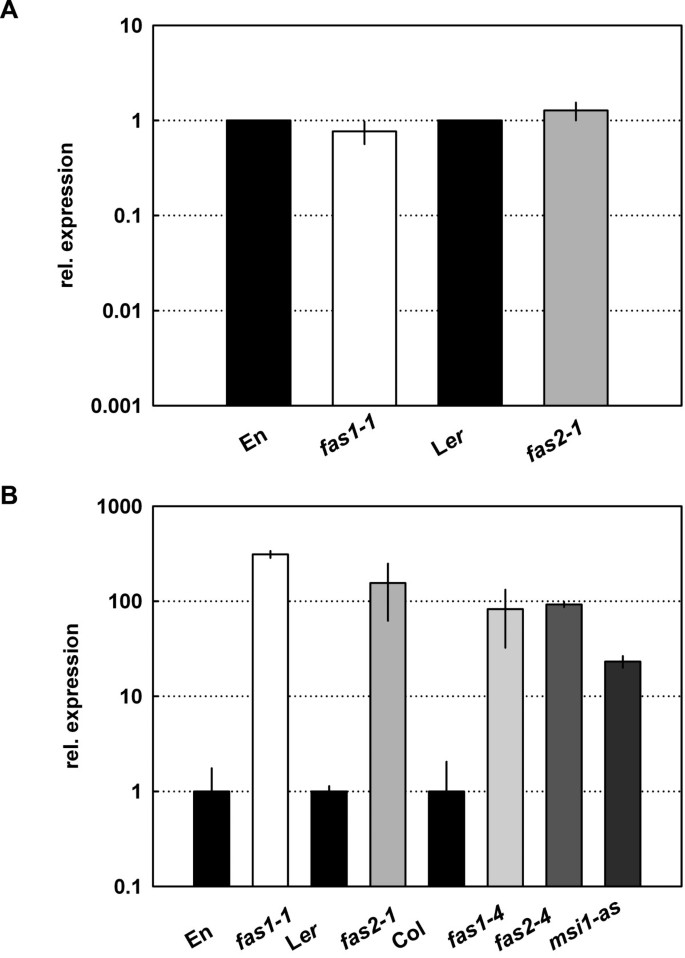
因为sti显示对caf1突变等位基因的上位性,STI很可能作用于caf1的下游。一种可能是需要caf1来纠正错误STI毛状体分化过程中的表达。为了验证这个假设,我们进行了测量STI定量RT-PCR检测caf1突变体的mRNA水平。然而,STI中转录水平无明显升高fas1而且fas2毛状体(无花果。6).得到了类似的结果STI表达fas1而且fas2幼苗和尖顶(数据未显示)。这些结果表明,caf1影响STI功能,而不是调节STI功能STI表达式。
H3.2在中上调fasciata突变的毛状体
我们先前的研究表明,组蛋白变体H3.2的基因转录上调fas1-1,fas2-1而且msi1-as苗(40].H3.2通过一个独立于caf1的途径合并到染色质的核小体中,这些核小体主要存在于转录活性较弱的染色体区域(由[4,56])。我们询问了CAF-1突变体中毛状体分化的改变是否与CAF-1表达的增加相关H3.2毛状体。RNA是从野生型,caf1突变体和毛状体中提取msi1-as植物,以及H3.2基因的mRNA水平At1g13370均采用RT-PCR定量检测。这个分析表明H3.2在caf1突变体的毛状体中,转录水平确实增加了约100倍msi1-as植物(图。6 b).这些结果表明,caf1功能的丧失导致CAF-1表达增加H3.2不仅在整个幼苗中,而且在毛状体中。因此,caf1突变体毛状体的染色质中可能含有增加的H3.2变异组蛋白。
讨论
毛状体细胞的规格和成熟为研究细胞分化提供了一个很好的模型系统拟南芥.对毛状体分化的分析揭示了一个复杂的基因网络,该基因网络指导和控制细胞的决定、规范和分化过程[48,57,58].在这里,我们报道了染色质重塑复合物caf1突变对毛状体发育的影响,以及caf1突变等位基因与毛状体调节因子的遗传相互作用GL3,STI而且谷湖.
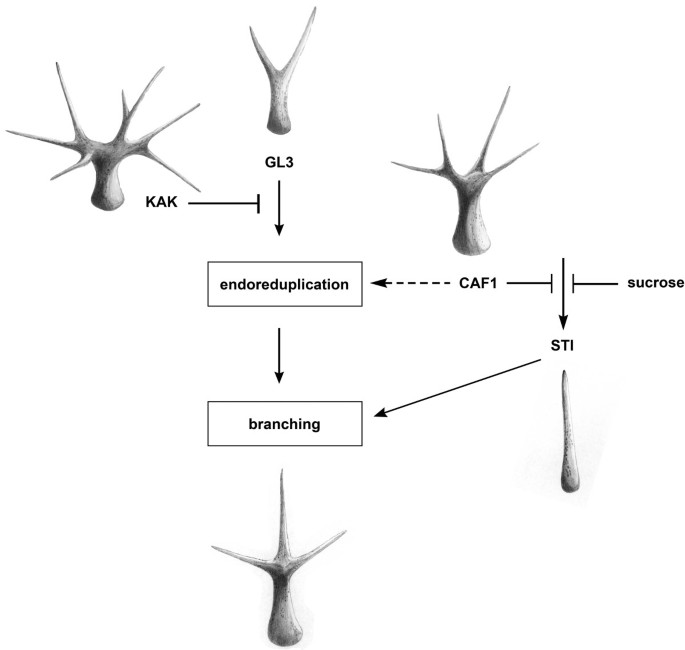
因为CAF-1突变体增加了毛状体分支,但正常的核内重复[44], caf1限制毛状体成熟过程中独立于核内重复的分支。遗传证据表明,caf1的作用与GL3-KAK通路(图7),通过控制核内重复来促进毛状体的分支([44,59],这项工作)。然而,caf1对于GL3-KAK通路功能正常,因为谷湖表型部分被抑制kak-2 fas2-1双突变体。的kak-2 fas2-1双突变体不仅毛状体分支较少,而且DNA含量也较低kak-2单突变体。这些结果表明,caf1是细胞内核内重复周期增加所必需的kak-2毛状体。对这一观察结果的一种可能解释是,有丝分裂细胞周期中S期的进展较慢,这是我们之前对caf1突变体提出的[40],会阻碍细胞内核内重复活动的增加kak-2突变的毛状体。在幼苗和叶片中,caf1抑制核内重复[34,42- - - - - -44],缺乏caf1可能会在某些低核内重复的细胞类型中触发额外的内循环,但在高核内重复的细胞类型中,也需要caf1来维持多轮内循环,如kak-2毛状体。
外源蔗糖可减轻野生型植物caf1突变体的毛状体分支表型,而对野生型植物的毛状体分支有弱抑制作用。由于生长在土壤上的caf1突变体的分支表型(土壤构成了一种不那么明确但丰富的介质)与生长在山梨醇上的caf1突变体的毛状体表型更相似(数据未显示),我们认为毛状体分支的抑制来自蔗糖信号,而不是饥饿效应。蔗糖是一种有效的信号分子,控制基因表达、细胞周期和发育[50,51].然而,据我们所知,以前没有蔗糖对毛状体发育的影响的报道。蔗糖促进细胞周期进程[60]并可诱导核内重复[61],但这些影响很可能不能解释所观察到的毛状体分支减少。在caf1突变体中,细胞周期中更快速的进展和在含蔗糖介质上的更快生长可以放大与s期染色质组装相关的缺陷。我们发现蔗糖极大地促进了器官发育表型fas2L中的-1呃,并温和地增强了其他caf1突变等位基因的这种表型。我们认为,在毛状体发育过程中,蔗糖信号可以通过一种目前未知的机制部分替代caf1的需求。
结论
我们共同观察到(i)野生型背景下的caf1突变体增加了毛状体分支,但没有增加核内重复;(ii) caf1突变体和gl3突变体(在核内重复依赖通路中存在缺陷)显示出一种加性相互作用,(iii) caf1突变体和sti-56无效突变体(在核内重复独立通路中存在缺陷)表现出一种上位性相互作用,(iv) caf1突变体增强了低胚性的表型sti-40等位基因(部分缺陷在核内复制独立途径)和(v) caf1突变和谷湖突变体(在核内重复依赖通路中存在缺陷)不表现出上位性相互作用。我们得出结论,解释所有结果的最简约的模型是CAF-1与STI在与核内重复复制依赖通路平行的核内重复复制独立通路中GL3而且谷湖(无花果。7).此外,虽然在WT毛状体中正常的核内重复不需要caf1,但在kak突变体中发生的大量核内重复则需要caf1。基因证据表明caf1与STI,一种不影响DNA含量的毛状体分支激活剂[49].STI与真菌dna聚合酶III的atp结合亚基具有序列相似性,但这种相似性的功能相关性尚未建立,尚不清楚STI是否为核蛋白。caf1不通过调节影响毛状体的分支STI表达,但作为一个负调节STI通路(图7).目前尚不清楚CAF-1是如何负向调节的STI途径。一种可能是caf1介导的染色质组装和压实[40]是正常毛状体成熟所直接需要的。或者,caf1有可能抑制其他限制性成分的表达STI途径。caf1突变体表达增加H3.2,它独立于caf1被合并到染色质中。如果染色质中有其他基因STI途径中H3.2的富集,形成的不太稳定的核小体可以促进转录的增加,最终导致的活性增加STI途径。总之,我们得出结论,caf1是支持异常高的核内重复的必要条件kak-2野生型毛状体的正常核内复制除外。在野生型毛状体中,caf1限制了毛状体的活性STI途径。
方法
植物材料和生长条件
哥伦比亚种子(Col), Landsbergerecta(左呃)和Enkheim (En)拟南芥的野生型种质和fas1-1(accession En) [13,35),fas2-1(加入L呃) [13,36),fas1-4(增补Col) [44),fas2-4(增补Col) [44),gl3-1(加入L呃) [62,63]突变体从诺丁汉拟南芥种群中心获得。注意,除了使用fas1-4在Col中的等位基因,在[44),另一个fas1等位基因被描述为同名(fas1-4),由Kirik及其合作者提交,附文件C24 [43].的msi1-as线之前已经描述过[44].突变体的kak-2(加入L呃) [52),sti-40(加入L呃) [55),sti-56(加入L呃) [49]由M. Hülskamp提供。种子播种在无菌基盐Murashige和Skoog (MS)培养基上(Duchefa, Brussels, Belgium),根据需要添加1%蔗糖或1%山梨醇。植物在发芽后10天在平板上分析或转移到土壤中(“Einheitserde”,H. Gilgen optima-Werke, Arlesheim, Switzerland)。或者,种子直接播种在土壤上。在长日照(LD, 16 h光照)条件下,将植株置于低温荧光和白炽灯(110 ~ 140 μmol/m2s, 21±2°C)混合光照的Conviron生长室中,或在温室中交替饲养。
毛状体分支分析
为了确定分枝模式,我们分析了平均六种植物前两个叶片正面的所有毛状体。
倍性分析
毛状体核倍性测定方法如下[44,64].简单地说,将植物组织固定在FAA(50%乙醇,5%冰醋酸,10%甲醛)中,用McIlvaines缓冲液(60 mM柠檬酸,80 mM磷酸钠,pH 4.1)中130 μg/ml DAPI染色90分钟。样品用McIlvaines缓冲液洗涤两次(15分钟和60分钟),并以50%甘油装入McIlvaines缓冲液中。使用MagnaFire CCD相机(Optronics, Goleta, CA)或Apogee Alta U32 CCD相机(Apogee Instruments, Roseville, CA)记录DAPI荧光。图像使用ImageJ进行量化。每次实验至少测定30个代表性细胞核的总荧光,并使用保护细胞核(n≥30)进行校准,这些保护细胞核被认为是严格的二倍体[64].
RNA分离,RT-PCR和Real - Time PCR
如前所述,从幼苗中提取RNA [65].在RT-PCR分析中,0.4-1 μg总RNA用DNase i处理。无dna RNA (0.2 - 1.0 μg)按照制造商说明书(Fermentas, Nunningen, Switzerland)使用RevertAid第一链cDNA合成试剂盒进行反转录。用于RNA提取的毛状体被收获成几微升的RNA晚些时候(Ambion, Austin, TX),然后像其他样品一样处理。将所生成的cDNA等份作为模板,用基因特异性引物进行PCR。对于qPCR分析,Universal ProbeLibrary系统(Roche Diagnostics, Rotkreuz, Switzerland)被用于7500 Fast Real-Time PCR仪(Applied Biosystems, Lincoln, CA)。所用测定方法的细节见表2.对结果的分析是根据Simon [66].
参考文献
李志刚,李志刚,李志刚。果蝇组蛋白修饰及其异色基因沉默的控制。染色体,2006,14:377-392。10.1007 / s10577 - 006 - 1066 - 1。
Santoro R, De Lucia F:许多玩家,一个目标:在细胞分裂过程中染色质状态是如何遗传的。中国生物医学工程学报,2005,30(3):332-343。10.1139 / o05 - 021。
李志刚,李志刚,李志刚:染色质重塑与记忆因子的关系。植物发展的新调节器。植物科学学报,2002,29(4):489 - 497。10.1104 / pp.006791。
Loyola A, Almouzni G:组蛋白伴侣,聚光灯下的配角。生物化学学报,2004,16(3):344 - 344。
陈志刚,陈志刚,陈志刚,陈志刚:DNA复制与修复过程中的染色质挑战。电子学报,2007,29(4):721-733。10.1016 / j.cell.2007.01.030。
Stillman B: SV40 DNA复制过程中的染色质组装。细胞学报,1986,45:555-565。10.1016 / 0092 - 8674(86) 90287 - 4。
Smith S, Stillman B:体外DNA复制过程中染色质组装所需的人类细胞因子cafi的纯化和表征。细胞学报,1989,58:15-25。10.1016 / 0092 - 8674 (89) 90398 - x。
考夫曼PD,小林R, Stillman B:紫外线辐射敏感性与端粒沉默的降低酿酒酵母缺乏染色质组装因子- i的细胞。基因工程学报,1997,11:345-357。10.1101 / gad.11.3.345。
Verreault A, Kaufman PD, Kobayashi R, Stillman B: caf1和乙酰化组蛋白H3/H4复合物的核小体组装。细胞科学,1996,37(4):344 - 344。10.1016 / s0092 - 8674(00) 81326 - 4。
Bulger M, Ito T, Kamakaka RT, Kadonaga JT:果蝇染色质组装因子1和56-kDa组蛋白结合蛋白组装规则间隔核小体阵列。美国国家科学研究院。1995, 42(1): 1 - 4。10.1073 / pnas.92.25.11726。
张志刚,张志刚,张志刚。果蝇增殖后染色质组装与人染色质组装因子1的关系。中国生物医学工程学报,1996,16:810-817。
Tyler JK, Bulger M, Kamakaka RT, Kobayashi R, Kadonaga JT:果蝇染色质组装因子1的p55亚基与组蛋白去乙酰化酶相关蛋白同源。中国生物医学工程学报,1996,26(3):344 - 344。
嘉雅H柴原KI陶冈KI岩渊M斯蒂尔曼B荒木T:FASCIATA拟南芥中染色质组装因子-1的基因维持着顶端分生组织的细胞组织。细胞科学,2001,44(3):344 - 344。10.1016 / s0092 - 8674(01) 00197 - 0。
Ach RA, Taranto P, Gruissem W:在植物和动物中,一个保守的WD-40蛋白家族与视网膜母细胞瘤蛋白结合。植物科学学报,1997,26(3):357 - 357。10.1105 / tpc.9.9.1595。
Enomoto S, McCune-Zierath PD, Gerami-Nejad M, Sanders MA, Berman J: RLF2,酵母染色质组装因子- i的亚单位,体内端粒染色质功能的需要。基因工程学报,1997,11:358-370。10.1101 / gad.11.3.358。
Monson EK, de Bruin D, Zakian VA:酵母Cac1蛋白是端粒转录抑制染色质稳定遗传所必需的。美国国家科学研究院。1997, 94: 1381 -13086。10.1073 / pnas.94.24.13081。
Enomoto S, Berman J:染色质组装因子I有助于酵母沉默交配位点沉默的维持,但不是重新建立。基因工程学报,1998,18(4):344 - 344。10.1101 / gad.12.2.219。
Smith JS, Caputo E, Boeke JD:核糖体DNA沉默缺陷的遗传筛查可以识别多种DNA复制和染色质调节因子。中国生物医学工程学报,1999,19:3184-3197。
陈志强,陈志强,陈志强,陈志强,陈志强。异染色质结构域的复制与维持。中国生物医学工程学报,1999,27(3):344 - 344。10.1083 / jcb.147.6.1153。
游戏JC, Kaufman PD:角色酿酒酵母染色质组装因子- i在紫外线损伤修复中的作用在活的有机体内.中国生物医学工程学报,1999,29(3):344 - 344。
Ahmad K, Henikoff S:组蛋白变体H3.3通过不依赖复制的核小体组装标记活性染色质。生物化学学报,2002,9:1191-1200。10.1016 / s1097 - 2765(02) 00542 - 7。
Tagami H, Ray-Gallet D, Almouzni G, Nakatani Y:组蛋白H3.1和H3.3复合物介导依赖或独立于DNA合成的核小体组装途径。细胞学报,2004,44(3):344 - 344。10.1016 / s0092 - 8674 (03) 01064 - x。
Mito Y, Henikoff JG, Henikoff S:组蛋白H3.3替换模式的基因组尺度分析。中国科学院学报,2005,37:1090-1097。10.1038 / ng1637。
赫尼考夫,艾哈迈德,K:不同组蛋白组装成染色质。中国生物医学工程学报,2005,29(3):344 - 344。10.1146 / annurev.cellbio.21.012704.133518。
Jin C, Felsenfeld G:组蛋白变异H3.3和H2A.Z介导的核小体稳定性。基因开发,2007,21:1519-1529。10.1101 / gad.1547707。
侯伟德,李志刚,李志刚,李志刚,李志刚。caf1在多能性胚胎细胞异染色质组织中的作用。公共科学学报,2006,2:e181-10.1371/journal.pgen.0020181。
Tchenio T, Casella JF, Heidmann T:人类caf1 p150亚基的截断形式破坏了哺乳动物细胞转录基因沉默的维持。中国生物医学工程学报,2001,29(3):344 - 344。10.1128 / mcb.21.6.1953 - 1961.2001。
Hoek M, Stillman B:染色质组装因子1是必不可少的,并将染色质组装与DNA复制耦合在体内。美国国家科学研究院。2003, 30(4): 457 - 457。10.1073 / pnas.1635158100。
Nabatiyan A, Krude T:人类细胞中染色质组装因子1的沉默导致细胞死亡和DNA合成过程中染色质组装的丢失。中国生物医学工程学报,2004,24:2853-2862。10.1128 / mcb.24.7.2853 - 2862.2004。
Ye X, Franco AA, Santos H, Nelson DM, Kaufman PD, Adams PD:缺陷S期染色质组装导致DNA损伤,S期检查点激活,S期阻滞。生物化学学报,2003,11:341-351。10.1016 / s1097 - 2765(03) 00037 - 6。
奎维JP,葛兰迪P, Almouzni G:染色质组装因子1的最大亚单位二聚化:在体外和非洲爪蟾早期发育中的重要性。中国生物工程学报,2004,20(3):374 - 374。10.1093 / emboj / 20.8.2015。
宋燕,何峰,谢刚,郭霞,徐勇,陈勇,梁霞,Stagljar I, Egli D,马娟,焦锐:caf1对果蝇发育和表观遗传记忆的维持至关重要。中国生物工程学报,2007,31(2):344 - 344。10.1016 / j.ydbio.2007.08.039。
Fischer S, Prykhozhij S, Rau MJ, Neumann CJ:斑马鱼的突变caf-1b在器官发生过程中导致S期阻滞、分化缺陷和p53介导的凋亡。中国生物医学工程学报,2007,26(3):344 - 344。
Ramirez-Parra E, Gutierrez C: E2F调控FASCIATA1这是一种染色质组装基因,其缺失会开启内环,并通过改变表观遗传状态激活基因表达。中国农业科学,2007,27(3):344 - 344。10.1104 / pp.106.094979。
Reinholz E:辐射诱导突变体显示出改变的花序特征。《阿拉伯信息学报》,1966,3:19-20。
三种茎尖分生组织突变体的特征拟南芥.《发展与发展》,1992,16:397-403。
沃斯代尔W:着迷:它的意义和起源。新植物学报,1905,4:55-74。10.1111 / j.1469-8137.1905.tb05881.x。
Köhler C, Hennig L, Bouveret R, Gheyselinck J, Grossniklaus U, Gruissem W:拟南芥MSI1是MEA/FIE Polycomb基团复合体的组成部分,是种子发育所必需的。中国生物医学工程学报,2003,26(4):344 - 344。10.1093 / emboj / cdg444。
Leroy O, Hennig L, Breuninger H, Laux T, Köhler C: Polycomb group蛋白在雌性配子体中决定植物种子发育的功能。发展。2007,134:3639-3648。10.1242 / dev.009027。
Schönrock N, Exner V, Probst A, Gruissem W, Hennig L: caf1突变体的功能基因组分析拟南芥.中国生物医学工程学报,2006,29(2):344 - 344。10.1074 / jbc.M513426200。
Ono T, Kaya H, Takeda S, Abe M, Ogawa Y, Kato M, Kakutani T, Mittelsten Scheid O, Araki T, Shibahara K:染色质组装因子1确保了拟南芥沉默染色质状态的稳定维持。基因工程学报,2006,11:153-162。10.1111 / j.1365-2443.2006.00928.x。
Endo M, Ishikawa Y, Osakabe K, Nakayama S, Kaya H, Araki T, Shibahara K, Abe K, Ichikawa H, Valentine L, Hohn B, Toki S:拟南芥caf1突变体中同源重组和T- dna整合频率的增加。环境科学学报,2006,26(3):357 - 357。10.1038 / sj.emboj.7601434。
Kirik A, Pecinka A, Wendeler E, Reiss B:染色质组装因子亚单位FASCIATA1参与植物同源重组。植物学报,2006,18:2431-2442。10.1105 / tpc.106.045088。
Exner V, Taranto P, Schönrock N, Gruissem W, Hennig L:植物发育过程中细胞分化需要染色质组装因子caf1。发展,2006,133:4163-4172。10.1242 / dev.02599。
植物的短柔毛:生态学的视角。机械工程学报,2004,27(4):344 - 344。10.1007 / BF02860838。
毛里西奥·R, Rausher M:假设选择性因子的实验操作为自然敌人在植物防御进化中的作用提供了证据。生物学报,1997,38(4):357 - 357。10.2307 / 2411196。
谢晓明,杨晓明,杨晓明,等。拟南芥根和茎叶表皮模式的形成。生物化学学报,2007,35:146-148。10.1042 / BST0350146。
Schellmann S, Hülskamp M:表皮分化:拟南芥的毛状体作为模型系统。中国生物医学工程学报,2005,29(4):589 -584。10.1387 / ijdb.051983ss。
Ilgenfritz H, Bouyer D, Schnittger A, Mathur J, Kirik V, Schwab B, Chua NH, Jürgens G, Hülskamp M:拟南芥STICHEL基因是毛状体分支数的调节因子,编码一种新型蛋白质。植物科学学报,2003,31(4):344 - 344。10.1104 / pp.014209。
Gibson SI:通过糖信号控制植物发育和基因表达。植物学报,2005,8:93-102。10.1016 / j.pbi.2004.11.003。
李志强,李志强,李志强,等。植物糖信号的研究进展。植物学报,2006,29(3):344 - 344。10.1146 / annurev.arplant.57.032905.105441。
Downes BP, Stupar RM, Gingerich DJ, Vierstra RD:拟南芥HECT泛素蛋白连接酶(UPL)家族:UPL3在毛状体发育中具有特定作用。植物学报,2003,35(3):344 - 344。10.1046 / j.1365 - 313 x.2003.01844.x。
El Refy A, Perazza D, Zekraoui L, Valay JG, Bechtold N, Brown S, Hülskamp M, Herzog M, Bonneville JM:拟南芥KAKTUS该基因编码一种HECT蛋白,并控制核内重复循环的数量。中国生物医学工程学报,2003,27(3):344 - 344。10.1007 / s00438 - 003 - 0932 - 1。
高美Y,小野T,深川T, Shibahara K,中山T:染色质组装因子-1介导的核小体快速组装在脊椎动物细胞DNA复制和细胞分裂中的重要作用。分子生物学杂志,2007,18:129-141。10.1091 / mbc.e06 - 05 - 0426。
杨晓明,杨晓明,杨晓明,Hülskamp M:拟南芥毛状体细胞形态发生的研究进展:分枝启动调控因子对初生分枝和次生分枝的影响。发展,1997,124:3779-3786。
Loyola A, Almouzni G:标记组蛋白H3变体:如何,何时和为什么?生物化学进展,2007,32:425-433。10.1016 / j.tibs.2007.08.004。
彭丽娟,杨晓明,杨晓明,杨晓明,杨晓明,等拟南芥至少有五个基因突变就能抑制。遗传学杂志,1999,152:461-476。
拟南芥毛状体发育的分子遗传学分析。植物化学学报,1997,33(4):357 - 357。10.1146 / annurev.arplant.48.1.137。
Hülskamp M:植物毛状体:细胞分化的模型。中国生物医学工程学报,2004,5:471- 481。10.1038 / nrm1404。
riu - khamlichi C, Menges M, Healy JM, Murray JA:糖对植物细胞周期的调控:拟南芥d型细胞周期蛋白基因表达的差异调控。中国生物医学工程学报,2000,30(4):344 - 344。10.1128 / mcb.20.13.4513 - 4521.2000。
杨晓明,杨晓明,王晓明:蔗糖对水稻愈伤组织多倍体化的影响茄属植物tuberosum.植物科学学报,1990,21(3):344 - 344。
Koornneef M, Dellaert LW, VeJ van der: EMS和辐射诱导的单个基因座突变频率拟南芥(l)Heynh。穆特决议,1982,93:109-123。
佩恩·CT,张峰,劳埃德·AM:GL3编码一种bHLH蛋白,该蛋白通过与拟南芥的相互作用调节毛状体的发育GL1而且TTG1.中国生物工程学报,2000,29(3):344 - 344。
Walker JD, Oppenheimer DG, Concienne J, Larkin JC:暹罗,一种控制细胞内复制周期的基因拟南芥毛状体。科学进展。2000,27(3):349 - 349。
Hennig L, Taranto P, Walser M, Schönrock N, Gruissem W:拟南芥MSI1是生殖发育表观遗传维持所必需的。《科学进展》,2003,30(3):344 - 344。10.1242 / dev.00470。
Simon P: Q-Gene:实时定量RT-PCR数据处理。生物信息学,2003,19:1439-1440。10.1093 /生物信息学/ btg157。
Czechowski T, Stitt M, Altmann T, Udvardi MK, Scheible WR:拟南芥转录规范化优势内参基因的全基因组鉴定和检测。植物学报,2005,39(1):1 - 5。10.1104 / pp.105.063743。
确认
我们感谢Claudia Köhler和Cristina Alexandre对手稿的批判性阅读,以及Bartosz Urbaniak对qPCR的技术帮助。作者实验室的工作得到了SNF项目3100AO-116060和ETH项目TH-16/05-2的支持。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
VE进行了植物分析,进行了分子和遗传研究,并起草了手稿。LH参与了研究设计,并帮助撰写了手稿。WG帮忙写了手稿。
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
艾克斯纳,V., Gruissem, W. & Hennig, L.染色质组装因子-1对毛状体分支的控制。BMC植物生物学8日,54(2008)。https://doi.org/10.1186/1471-2229-8-54
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-8-54
关键字
- 组蛋白伴侣
- 毛状体发展
- 通用ProbeLibrary
- 毛状体表型
- 毛状体形态