摘要
背景
拟南芥发病相关基因的组成表达子(CPR5)基因先前与抗病、细胞增殖、细胞死亡和糖感知有关,并编码一种未知生化功能的膜蛋白。毛状体的发育也受到影响cpr5植物,其叶片毛状体的大小和分枝数都减少了。
结果
在这里介绍的工作中,的作用CPR5观察毛状体的发育情况。毛状体在cpr5突变体的双折射性降低,表明两种细胞的细胞壁结构不同cpr5还有野生型的毛状体。与此一致的是,叶细胞壁cpr5植物含有显著减少的副晶纤维素和改变的壁碳水化合物组成。我们还发现cpr5突变对毛状体大小和毛状体核DNA内复制的影响是上位性的triptychon(试一试)或过度表达GLABRA3表明这些毛状体发育调节因子依赖于CPR5它们对毛状体扩张和内复制的作用。
结论
我们的研究结果表明CPR5不太可能是病原体反应途径或衰老的特异性调节剂,而是在细胞壁生物发生或多种细胞信号传导或转录反应途径中起作用。
背景
基因突变发病相关基因的组成表达子(CPR5)基因拟南芥具有高度多效性,影响病原体反应、细胞增殖、细胞扩增和衰老。该基因最初是根据突变体的构成型病原体反应表型确定的[1,2],似乎在病原体识别的下游和水杨酸的上游起作用NPR1-依赖于疾病的抵抗力[1]。此外,Boch及其同事[2表明CPR5激活致病性相关(PR)基因的表达RPS2介导的途径而不是RPM1介导的通路。然而,CPR5似乎在植物生长发育中也起着更广泛的作用,因为cpr5突变体在细胞增殖和细胞扩增方面表现出缺陷,并且该基因被假设在程序性细胞死亡中发挥作用[3.]。此外,cpr5突变体对葡萄糖和蔗糖高度敏感,并过早积累衰老调控转录物[4]。的CPR5该基因编码一种假定的膜蛋白,在羧基端具有五个假定的跨膜结构域,在氨基端具有假定的二部核定位信号,并且与其他已知蛋白质没有序列相似性[3.,4]。
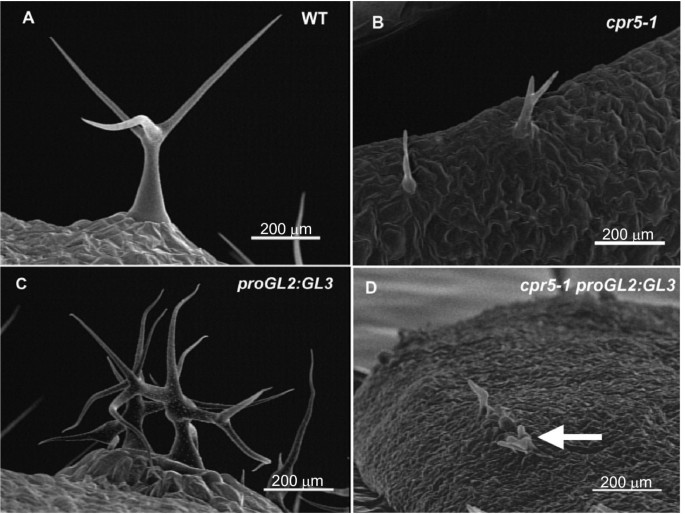
与其他组成型病原体反应突变体相比,cpr5突变影响毛状体形态。拟南芥叶片上的毛状体是从表皮突出的特化单细胞,在野生型中它们具有不寻常的分枝形状。此外,野生型毛状体在发育过程中不分裂地复制其DNA,这一过程称为内复制或内重复,达到核DNA水平为16C-32C [5,6]。毛状体的cpr5突变体比野生型更小,分支更少,核DNA含量更低[3.]。这种毛状体表型表明,与其他组成型病原体反应突变体不同,CPR5可能在毛状体发育中起更具体的作用。
拟南芥毛状体被用作植物细胞分化和细胞生物学的模型[7,8],对早期毛状体发育的控制也很好理解。毛状体发育的启动需要一个转录因子复合体,该复合体由碱性-螺旋-环-螺旋转录因子GLABRA3 (GL3)、Myb转录因子GLABRA1 (GL1)和WD-repeat蛋白TRANSPARENT TESTA GLABRA (TTG)组成。这些基因的突变导致毛状体缺失或毛状体数量减少,这些蛋白质之间的相互作用已在酵母中得到证实。tritychon (TRY)蛋白作为毛状体发育的负调控因子,被认为通过胞间连丝扩散到邻近细胞中,并以经典的侧抑制机制抑制毛状体的发育,从而阻止邻近细胞发育为毛状体。TRY具有Myb dna结合结构域,但缺乏转录激活结构域,在酵母中可以与GL3结合,这表明它直接抑制生长中的毛状体周围细胞中GL1/GL3/TTG复合物的功能[j]。9]。
几种突变体影响毛状体的内复制水平,这些突变体揭示了核DNA含量、毛状体大小和毛状体分支高度相关,导致DNA含量较高的突变体通常毛状体更大、分支更多[5,10,11]。在控制毛状体扩张和内复制程度的基因中,有毛状体细胞命运调节因子本身。内复制减少gl3失去功能的突变体,这些突变体的毛状体更小,分支减少,而试一试突变体增加了毛状体的内复制水平,增加了毛状体的大小和分支[5]。含有功能增益的植物毛状体gl3-sst等位基因也有大的、多分枝的毛状体,细胞核增大表明DNA含量增加[9]。这些观察结果表明,GL3对于毛状体的持续发育是必需的,并且除了阻止邻近细胞发育为毛状体外,TRY还在毛状体发育中起作用,以限制扩张和内复制的程度。
为了深入了解CPR5的功能,我们研究了该基因在毛状体发育的良好途径中的作用。这里,我们展示一下cpr5突变体改变了叶片和毛状体中纤维素含量降低的细胞壁,这是以前未认识到的表型方面。我们还发现cpr5突变是上位性的毛状细胞的额外扩张由任何条件GL3函数的增益和试一试功能丧失。的cpr5突变还会增加相邻毛状体的数量,这是由于侧抑制信号通路失败而导致的试一试突变体。我们的工作表明,多效性cpr5突变是由于基因产物在一般细胞过程中的主要作用,如细胞壁生物发生或影响许多细胞途径的完整性,而不是在病原体反应信号传导或衰老中起特定作用。
结果
突变表型
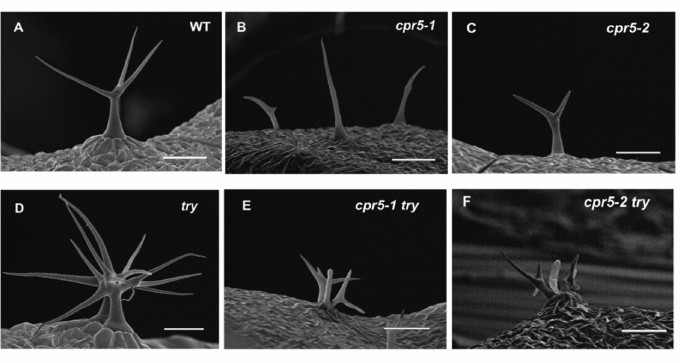
本研究使用了两个隐性等位基因,cpr5-1(1),cpr5-2(2]。如前所述,总体规模cpr5突变植株比野生型小,子叶cpr5植物比野生型早衰老,有损伤cpr5与野生型相比,莲座叶片的表皮细胞大小和细胞数量都大大减少[1- - - - - -4]。对于表现型的各个方面,cpr5-1植物具有比植物更严重的突变表型cpr5-2突变体植物。的cpr5-1突变是第4外显子的错义突变(G420D)cpr5-2突变在第4外显子密码子477处产生一个过早终止。与这项工作最相关的是,在纯合的植物中,毛状体的分支和大小都减少了cpr5等位基因(图a, b, c;表格1)。为cpr5-1在纯合子中,超过60%的毛是不分枝的,基本上与Kirik等人报道的不分枝毛的比例相同。[3.强者用cpr5-T1等位基因,表明cpr5-1结果与最强特征等位基因的功能损失相当。
cpr5突变体的细胞壁发生了改变
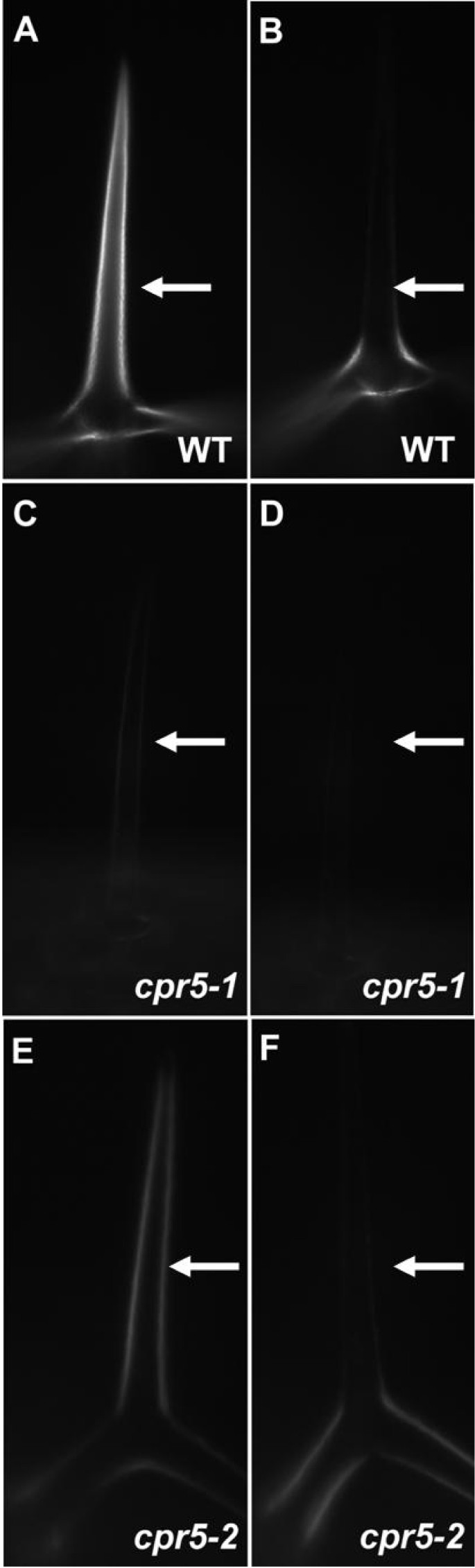
毛状体的cpr5突变体比野生型更透明,呈玻璃状,表明突变体的毛状细胞壁与野生型不同。植物细胞壁的一个很容易观察到的特性是,由于植物细胞壁的主要成分——准晶纤维素的存在,它们在偏振光下表现出双折射。在野生型毛状体细胞壁中观察到的高度双折射是由准晶纤维素造成的[12]。这种双折射取决于样品相对于照明光的偏振平面的方向。
我们检查了野生型和cpr5偏振光显微镜下的毛状体。正如预期的那样,野生型毛具有高度的双折射,这表明当毛分支相对于偏振面适当定向时,光的透射(图2)2),而cpr5-1毛状体几乎没有可检测到的双折射(图2)2摄氏度),cpr5-2毛状体表现出减少的双折射(图2)2 e)。最大透射光量的定量比较(图2a, c, e)和最小透射光量(图1)b, d, f),野生型毛状体的差异为36.0±7.8倍,野生型毛状体的差异为2.0±2.0倍cpr5-1毛状体,和16.0±11.0倍的差异cpr5-2毛状体。
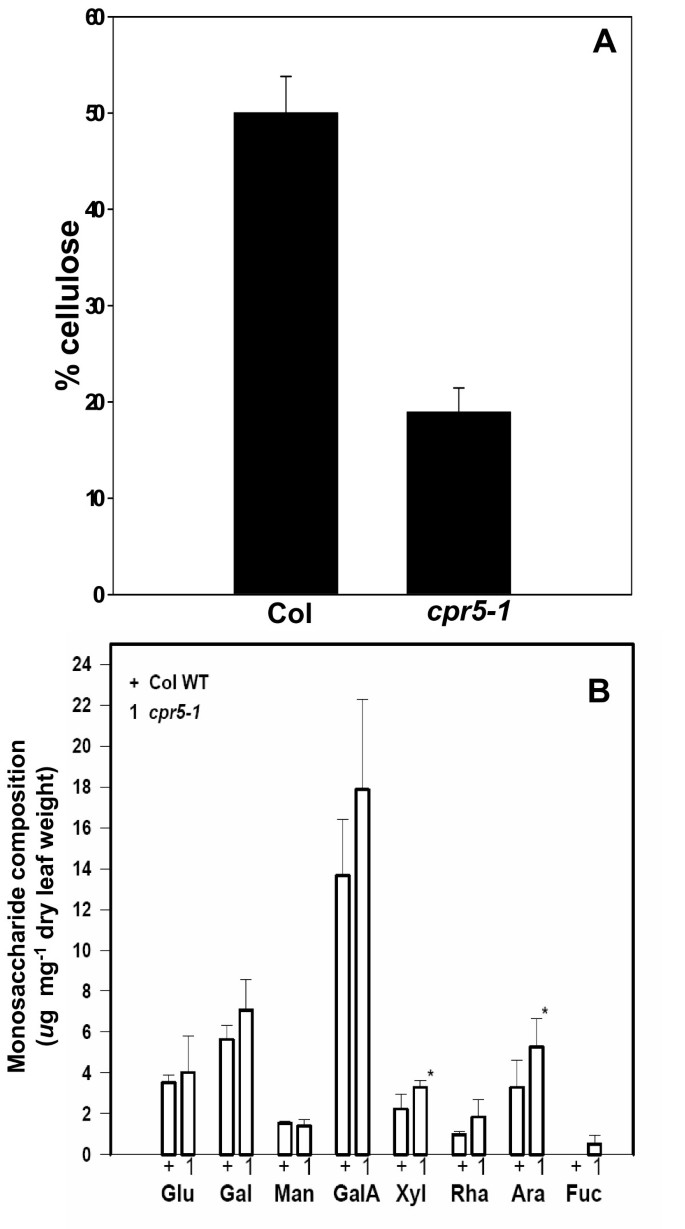
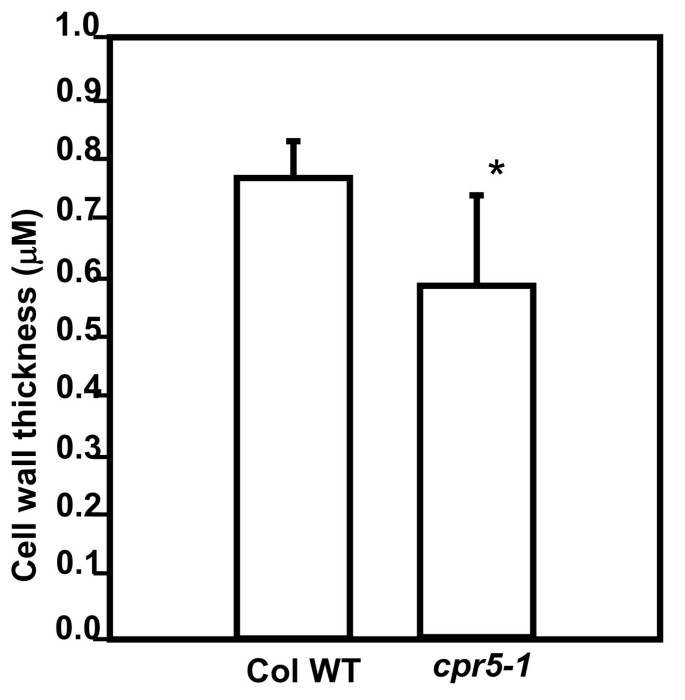
已经描述了其他几种具有透明“玻璃状”毛的突变体[5,12]。对于其中最典型的,毛状体双折射(为),毛状体细胞壁双折射的减少与叶片中副晶纤维素的减少有关[12]。由Updegraff的化学方法测定[13],细胞壁中的准晶纤维素含量明显减少cpr5-1(p < 0.002),突变体的壁面含有大约38%的野生型壁面的旁晶纤维素(图2)3)。同时测定了莲座叶细胞壁单糖组成。木糖含量(p < 0.05)和阿拉伯糖含量(p < 0.01)略有增加cpr5-1相对于野生型(图2)3 b)。细胞壁的厚度相邻表皮细胞之间的细胞壁的厚度cpr5-1用透射电镜直接检测野生型。的cpr5-1突变体的细胞壁比野生型薄(p < 0.01)。4)。
基因相互作用cpr5以及参与毛状体形成的基因
为了进一步了解…的作用CPR5在毛状体发育过程中,cpr5-1和cpr5-2将突变体与突变植株杂交获得毛状体发育调节剂试一试,它对毛状体的大小、分支和内复制有相反的影响cpr5突变体。的试一试基因编码Myb蛋白,作为毛状体发育的抑制剂。基因突变try-JC这里使用的等位基因导致保守的Myb dna结构域中间的蛋白质被截断[14],并且在表型上是一个强大的功能丧失等位基因。
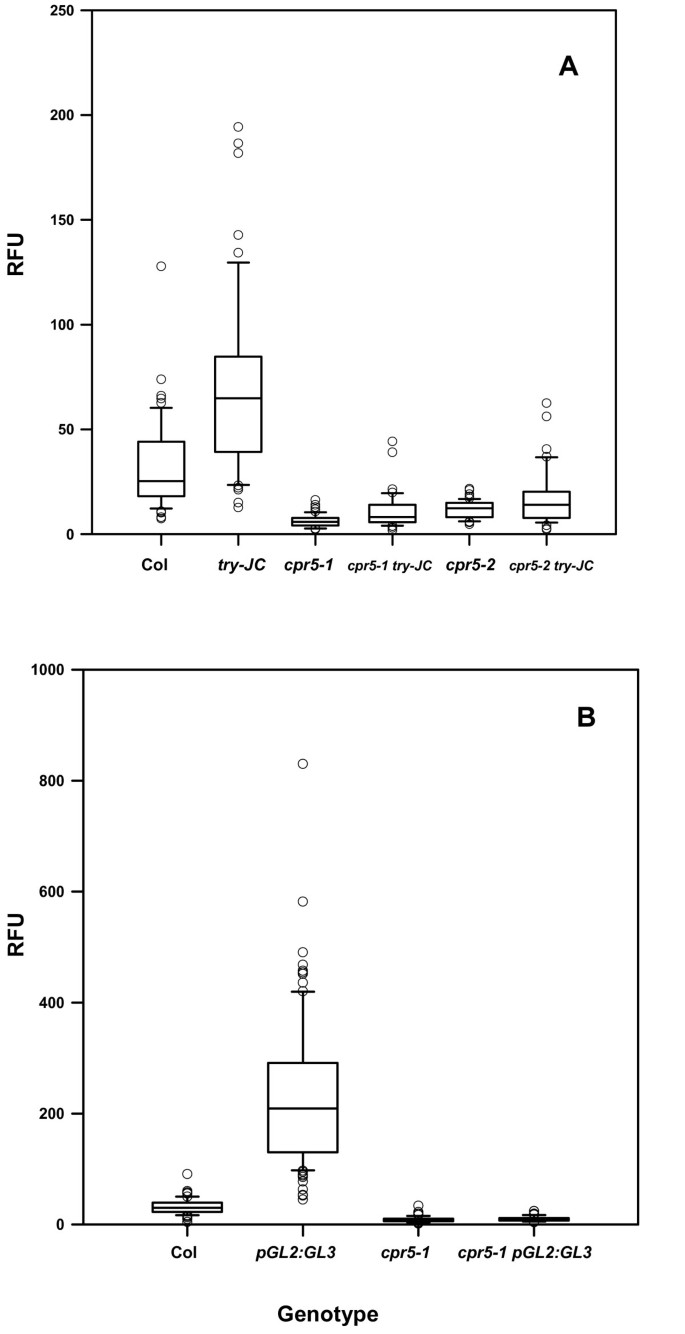
毛状体的try-JC植物比野生型植物更大,分枝更多,双折射性强(图2)。1 a, D)。相反,双突变体的毛状体cpr5-1 try-JC和cpr5-2 try-JC植物的大小与相应的植物相似cpr5等位基因(无花果。b c e f),表明cpr5是上位性的试一试关于毛的大小。的DNA含量降低cpr5毛状核也明显上位性地增加DNA含量try-JC毛状核(图2)5、表2)。
毛状体DNA含量的原位测量cpr5单和双突变体。(A)相互作用cpr5等位基因和试一试。(B)相互作用cpr5-1和proGL2: GL3。dapi染色细胞核的DNA含量以相对荧光单位(RFU)表示,基于假设野生型毛核的DNA含量为32C,对Col-0归一化为32 RFU。因此,测得的RFU值应与DNA含量近似对应。数据以箱形图的形式呈现,其中箱形图包含数据的第25到75个百分位数,箱内的线是中位数(第50个百分位数),误差条表示第5(下条)和第95(上条)百分位数。统计分析见表2和表4。为proGL2: GL3(B)中的基因型,为了表述清晰,图中省略了RFU = 1600的单个数据点,尽管表4中的分析中包含了这一点。
与野生植物的毛状体不同,试一试由于侧抑制信号传导失败,毛状体经常出现在紧邻毛状体的簇中(图2)。1 d)。就像野生型的毛一样cpr5突变叶片很少发生在簇中(图2)。a, b, c、表3.)。毛状体cpr5试试双突变体经常出现在集群中(图2)。1 e, F),表明cpr5这不是上位论的这一方面吗试一试表现型。然而,仔细观察发现了一种意想不到的合成基因相互作用cpr5突变增加了每个毛状体簇中毛状体的数量try-JC单(表3.)。毛状体在cpr5-1 try-JC和cpr5-2 try-JC叶子上的百分比大约是两倍try-JC叶子(表3.)。这种差异主要是由于每一簇中毛状体的数量增加cpr5试试双突变体相对于try-JC(p < 0.001)双突变体与try-JC),平均每簇有近3个毛状体,而在美国,每簇有2个毛状体try-JC单突变体(表3., p < 0.001,双突变体与try-JC,图。1 d, E, F)。
表达毛状体发育调节因子的植物GL3从强和相对特定的毛GL2启动子(proGL2: GL3)具有大的、高度双折射的毛状体,分枝增加(图2)。6摄氏度),类似于try-JC毛状体。该基因型的植物cpr5-1 proGL2: GL3有类似的小毛cpr5-1植物(图。6 b, D),表明cpr5也是上位性的增加毛大小的条件下,这种结构。野生型植物含有proGL2: GL3构建的毛状核DNA内复制的水平非常高,是野生型的十倍(图2)。5 b、表3.)。的cpr5-1 proGL2: GL3双突变体的DNA含量与双突变体相似cpr5-1单突变体,说明cpr5是上位性的proGL2: GL3关于内复制的程度(图2)。5 b、表4)。
讨论与结论
CPR5已被提出在病原体反应信号传导中发挥特定作用[1],衰老[4],以及细胞增殖和细胞死亡[3.]。本研究发现了一种以前未被识别的细胞壁缺陷cpr5突变体,导致副晶纤维素的缺失。同时,上位的cpr5表型与遗传相互作用试一试和proGL2: GL3表明CPR5功能的增加是必要的细胞扩增和内复制条件下的损失试一试的功能或过度表达GL3。这两个基因编码的转录因子在毛状体发育中起相反的作用。出乎意料,cpr5突变似乎也增强了侧抑制信号缺陷试一试通常阻止毛状体彼此相邻形成的突变体2)。
很难使我们的结果与其他人提出的作为联合国最基本职能的具体作用相一致CPR5基因产物,如病原体反应信号或内复制和程序性细胞死亡。没有其他组成型病原体反应突变体影响毛状体的报道,我们在检查中没有观察到毛状体缺陷发病相关基因的组成表达因子,PR基因的非表达者(npr1),加速细胞死亡2(acd2),加速细胞死亡(acd6),这些突变体似乎具有正常的双折射毛状细胞壁(J. C. Larkin,未发表的观察结果)。同样的,gl3功能丧失突变体内复制减少,产生正常双折射的毛状体壁[5],和植物的毛状体壁表达proGL2: ICK1 / KRP1一种在毛状体中诱导程序性细胞死亡的结构[15],也似乎是正常的(R. Kasili和J. C. Larkin,未发表的观察)。因此,似乎有可能CPR5基因产物间接参与毛状细胞扩增、病原体反应信号传导、抑制过早衰老和细胞程序性死亡的一般过程,而不是这些过程中任何一个特定的组成部分。
一个吸引人的行动场所CPR5我们的数据提示的基因产物是细胞壁本身。细胞壁直接参与了与细胞凋亡有关的几个过程cpr5突变表型,包括细胞扩增和病原体反应[16]。最近,通过病毒诱导的UDP-D-apiose/ udp - d -木糖合酶基因的基因沉默(VIGS)减少烟草细胞壁的鼠李糖半乳糖酸II成分,导致植物矮化,诱导几种病原体反应基因,产生活性氧和细胞死亡[qh]17]。一个cev1拟南芥的一个突变体,它在CES3A纤维素合酶基因,也被证明导致病原体反应基因的组成性表达,并增强了病原体的抵抗力[18]。该突变体最初被鉴定为茉莉酸信号通路的激活剂,并过量产生茉莉酸和乙烯。此外,另一种纤维素合成酶基因的突变,rsw1,也导致茉莉酸信号的激活,而纤维素生物合成抑制剂可以模拟cev1野生型植物的突变表型,包括病原反应基因的激活[18]。已知茉莉酸依赖性病原体反应途径在cpr5突变体(1,19]。毫不奇怪,纤维素合酶基因的突变会影响细胞形态和扩张[20.,21]。确实,细胞膨胀缺陷见于cpr5突变体的严重程度与纤维素合酶突变体相当[3.,22]
综上所述,这些结果表明,细胞壁本身的缺陷可以导致许多特定的方面cpr5突变表型,包括其命名的构成病原体反应信号。与细胞壁耦合不太明显的表型的一个方面是内复制的减少cpr5(3.]。然而,内复制的程度往往与细胞大小密切相关[6对细胞扩增的限制有可能对内复制产生反馈效应。
另一个模型来解释极端多效性cpr5突变型即CPR5蛋白可能是多种转录因子参与多种不同过程的功能所直接需要的。我们观察到cpr5表现型的上位性是由试一试功能丧失或GL3过度表达表明CPR5功能是细胞扩增和增加内复制所必需的,由这两个转录因子调节。的CPR5基因产物为IIIa型膜蛋白,具有5个跨膜结构域和一个胞质n端。这个n端结构域包含一个二部核定位序列(NLS),有人提出该蛋白可能参与了一个信号级联反应,其中细胞质结构域被蛋白水解裂解并转运到细胞核中[3.],有大量先例的信号过程[23,24]。最近的研究提出了另一种选择,表明酵母中一些定位于内膜的膜蛋白通过NLS靶向内膜,并使用依赖核细胞蛋白的途径进入细胞核[25]。在这种情况下,全长CPR5蛋白可能直接需要在细胞核中发挥多种转录因子的功能。
这些模型中的任何一个,CPR5在细胞壁生物发生中的主要作用或CPR的主要作用5在核转录的调控中,可以为侧抑制降低(即毛状体簇大小增加)提供解释cpr5试试双突变体(表3.)。细胞壁结构的改变可能通过改变胞间连丝,减少TRY蛋白家族中功能冗余成员CPC、ETC1和ETC2的细胞间转运,从而减少抑制信号的传递。或者,如果细胞核中GL3-TTG-GL1转录激活复合体的功能需要CPR5,则该复合体的活性降低可能导致发育中的毛状体中这些TRY同源物的低效上调,从而降低邻近细胞对毛状体发育的抑制程度。
很明显,测试这些模型需要对CPR5蛋白的定位和功能进行生化分析。也许因为它是一种膜蛋白,在这方面的报道进展很少,我们自己在这方面的尝试也没有成果。例如,荧光蛋白融合到CPR5生成的编码序列完全补充了cpr5突变表型,但在任何转基因系中均未检测到荧光(V. Kirik,未发表观察结果)。尽管如此,这里的工作表明细胞壁可能是CPR5功能的统一位点,并将为进一步的研究提供指导。的重要作用CPR5在植物生长发育的多个重要方面,其机制有待进一步研究CPR5函数。
方法
植物材料和生长条件
如前所述,植物在恒定光照下生长。所有等位基因都起源于哥伦比亚生态型,该生态型在本研究中被用作野生型,并且所有等位基因在本研究中使用之前至少两次回交哥伦比亚。的cpr5-1等位基因获得自董新年博士[1];cpr5-2源自我们以前的工作[2]。的try-JC等位基因先前已被描述过[14,26];谢尔曼等人的研究[14],它被错误地贴上了“try-5C”等位基因。的身份cpr5 try-JC双突变体在杂交后不能与亲本突变体互补,证实了双突变体的存在。的早期衰老cpr5在双突变体中保留子叶,并有助于识别它们。的proGL2: GL3构造先前已被描述[27]。
碳水化合物分析
为了进行碳水化合物分析,在抽苔前将未拥挤的植株置于黑暗中24-48小时,以减少叶片中的淀粉含量。用Updegraff方法测定莲座叶片乙醇洗涤细胞壁(70%乙醇在70℃下洗涤三次)的晶旁纤维素含量[13],以Sigma的纤维素为标准。
对于非纤维素壁单糖的分析,将叶片组织用80%乙醇研磨,用80%乙醇洗涤残渣,再用100%乙醇洗涤残渣,用甲醇:氯仿(1:1 v/v)处理残渣30分钟,用丙酮洗涤残渣,风干残渣,制备细胞壁材料。进一步的制备和单糖组成分析由乔治亚州雅典市乔治亚大学的复合碳水化合物研究中心提供。这包括使用新鲜制备的1m甲醇- hcl在80°C下水解16小时,并用Tri-Sil衍生化释放的糖。样品采用Supelco色谱柱进行气相色谱分析。加入肌醇作为内标。
电子显微镜
用FAA(3.7%甲醛,50%乙醇,5%醋酸)固定样品,按标准方法制备扫描电镜,如前所述[26]。透射电镜(TEM):将叶片用2%戊二醛和1%多聚甲醛溶液在0.2 M羧酸盐缓冲液(pH 7.4)中室温固定2小时,然后用0.1 M羧酸盐缓冲液冲洗,再用1%四氧化锇(OsO)缓冲液固定4)一小时。1%醋酸铀酰染色1小时后,用乙醇系列脱水,包埋于LR White树脂(中等等级)中。薄切片(70-90 nm)用柠檬酸铅染色,用JEOL 100 X透射电镜观察和拍照。
光学显微镜
测量了野生型毛状核的核DNA含量,并将其归一化至32℃的水平,基本如上所述[28,29],使用徕卡DM RXA2显微镜的200倍物镜观察样品,使用senicam QE 12位冷却CCD相机拍摄图像,并使用3I的Slidebook软件进行分析。在设置图像捕获参数时要注意,在一组样品中DNA含量最高的细胞核不会使图像的动态范围饱和。使用SigmaStat进行非参数统计(Kruskal-Wallis One Way ANOVA和Dunn’s all两两多重比较)。使用配备SpotCam的尼康FXA显微镜检测双折射。样品用95%乙醇清洗,并放置在两个偏振过滤器(偏振器和分析仪)之间的圆形旋转台上,两个偏振过滤器彼此成直角。
参考文献
- 1.
Bowling SA, Clarke JD, Liu Y, Klessig DF, Dong X:拟南芥cpr5突变体表达npr1依赖性和npr1非依赖性抗性。植物学报,1997,9(3):559 - 564。
- 2.
Boch J, versky ML, Robertson TL, Larkin JC, Kunkel BN:抗性基因介导的拟南芥CPR5基因突变的防御反应分析。植物与微生物学报,1998,11:1196-1206。
- 3.
Kirik V, Bouyer D, Schobinger U, Bechtold N, Herzog M, Bonneville JM, Hulskamp M: CPR5参与细胞增殖和细胞死亡控制及编码一种新的跨膜蛋白。当代生物学,2001,11(23):1891-1895。
- 4.
Yoshida S, Ito M, Nishida I, Watanabe A:拟南芥叶片衰老和病原菌防御反应抑制基因HYS1/CPR5的鉴定。植物学报,2002,29(4):427-437。
- 5.
王晓明,王晓明,王晓明,等。拟南芥毛状细胞发育的基因分析。细胞。1994,76:555-566。
- 6.
Melaragno JE, Mehrota B, Coleman AW:拟南芥表皮组织内倍性与细胞大小的关系。植物学报,1993,5:1661-1668。
- 7.
Larkin JC, Brown ML, Schiefelbein J:细胞如何知道它们长大后想成为什么?拟南芥表皮模式的启示。植物生态学报,2003,25(4):444 - 444。
- 8.
植物细胞形状的发育。植物科学进展,2004,9(12):583-590。
- 9.
Esch JJ, Chen M, Sanders M, Hillestad M, Ndkium S, Idelkope B, Neizer J, Marks MD:一个矛盾的GLABRA3等位基因有助于确定控制拟南芥毛状体发育的基因相互作用。发展,2003,130(24):5885-5894。
- 10.
Larkin JC, Brown ML, Churchman ML:从毛状体发育看内循环。细胞周期控制与植物发育。编辑:inzise D. Blackwell;2007:249 - 268。
- 11.
Perazza D, Herzog M, Hulskamp M, Brown S, Dorne AM, Bonneville JM:拟南芥毛细胞生长可通过至少5个基因突变抑制。遗传学报,2009,32(1):461-476。
- 12.
Potikha T, Delmer DP:拟南芥纤维素沉积模式改变的突变体。植物学报,1995,7:453-460。
- 13.
Updegraff DM:生物材料中纤维素的半微量测定。生物化学学报,2009,32(2):432 -424。
- 14.
Schellmann S, schnitger A, Kirik V, Wada T, Okada K, Beermann A, Thumfahrt J, Jurgens G, Hulskamp M: tritychon和CAPRICE介导的拟南芥毛和根毛的横向抑制。中华生物医学工程学报,2002,21(6):559 - 564。
- 15.
王晓明,王晓明,王晓明,等。细胞周期蛋白依赖性激酶抑制剂ICK1/KRP1在拟南芥单细胞毛状体中的表达及其调控作用。植物学报,2003,15(2):303-315。
- 16.
张建军,张建军,张建军,张建军,张建军,张建军,张建军,张建军,张建军,张建军,张建军,张建军。科学通报,2004,36(5):2206-2211。
- 17.
Ahn JW, Verma R, Kim M, Lee JY, Kim YK, Bang JW, Reiter WD ., Pai HS .:鼠李糖半乳糖醛酸- ii缺乏、细胞壁增厚和细胞死亡的研究进展。生物化学学报,2006,28(9):13708-13716。
- 18.
王晓明,王晓明,王晓明,等。拟南芥突变体cev1细胞壁信号通路对茉莉酸盐和乙烯的响应。植物学报,2002,14(7):1557-1566。
- 19.
Clarke JD, Volko SM, leford H, Ausubel FM, Dong X:水杨酸、茉莉酸和乙烯在拟南芥抗病性中的作用。植物学报,2000,12(11):2175-2190。
- 20.
李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,等:拟南芥纤维素合成的分子分析。科学通报,1998,27(3):717-720。
- 21.
王晓明,王晓明,王晓明,王晓明,等。拟南芥根系和暗生下胚轴中纤维素合成酶的研究进展。植物学报,2000,12(12):2409-2424。
- 22.
CPR5在促进拟南芥细胞扩增中的作用。生物科学。路易斯安那州立大学巴吞鲁日分校;2003:95 -
- 23.
叶静,叶静,张建平,张建平,等。细菌和人类的膜内蛋白水解调控机制。生物医学工程学报,2000,31(4):391-398。
- 24.
Hoppe T, Rape M, Jentsch S:膜结合转录因子:通过RIP或RUP调控释放。中国生物医学工程学报,2001,13(3):344-348。
- 25.
Lusk CP, Blobel G, King MC:通往核膜的高速公路:道路规则。中华生物医学工程学报,2007,31(5):414- 419。
- 26.
Larkin, Walker JD, Bolognesi-Winfield AC, Gray JC, Walker AR:拟南芥毛状体发育中ttg和gl1等位基因特异性相互作用。遗传学报,2009,31(2):591- 596。
- 27.
Kirik V, Schnittger A, Radchuk V, Adler K, Hulskamp M, Baumlein H:拟南芥AtMYB23基因异位表达诱导毛状细胞分化。中国生物医学工程学报,2001,35(2):366-377。
- 28.
张晓明,张晓明,张晓明,张晓明,张晓明,张晓明,张晓明。拟南芥细胞周期调控因子SIAMESE基因的克隆与表达。植物学报,2006,18(11):3145-3157。
- 29.
Walker JD, Oppenheimer DG, Concienne J, Larkin JC:拟南芥毛状体内复制细胞周期调控基因SIAMESE。发展,2000,27(18):3931-3940。
致谢
作者希望感谢Ying Xiao和Alex Hellman对TEM, David Burk和Ron Bouchard对光学显微镜,M. Cindy Henk对扫描电镜的专家协助。我们还希望感谢Jim Moroney博士和Kirsten pr
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
GB回传cpr5等位基因,产生了cpr5试试双突变体,进行细胞壁生物化学,做了很多电子显微镜,准备了几张图,并起草了手稿。RK做了扫描电子显微镜pGL2: GL3并有助于DNA含量的测定。LAS进行了DNA含量测定和统计分析,并制作了最终版本的数据。VK构造了pGL2: GL3 cpr5-1对这条线做了初步的分析,并参与了手稿的起草。MH参与了最初研究的设计pGL2: GL3 cpr5-1帮我写稿子。JCL参与了研究的设计,做了双折射的工作cpr5并帮助起草了手稿。所有作者都阅读并批准了最终稿件。
权利和权限
开放获取本文由BioMed Central Ltd.授权发表。这是一篇开放获取的文章,在知识共享署名许可(https://creativecommons.org/licenses/by/2.0),允许在任何媒体上不受限制地使用、分发和复制,前提是正确引用原创作品。
关于本文
引用本文
布林纳斯特尔,G.,卡西利,R.,西蒙斯,洛杉矶et al。发病相关基因的组成表达子影响细胞壁生物发生和毛状体发育。BMC Plant Biol8,58(2008)。https://doi.org/10.1186/1471-2229-8-58
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-8-58
关键字
- 病原体的反应
- 细胞壁生物发生
- 毛状体发展
- 毛状体的细胞
- 推定膜蛋白