摘要
背景
叶绿素b绿色植物中主要的光合色素是由叶绿素合成的吗一个加氧酶(曹)。叶绿素的调节b生物合成是光系统天线大小的重要决定因素。叶绿素b的表达在转录水平上部分调控合成曹基因。此外,叶绿素的合成b在蛋白质水平上受到CAO酶稳定性的严格调控。CAO由三个域组成,从N端依次命名为A、B和C域。CAO的A结构域参与了CAO蛋白稳定性的调控。
结果
为了阐明A结构域的生理功能,我们构建了转基因拟南芥(拟南芥这些植物要么过度表达完整的CAO,要么缺乏a结构域的截断型CAO。过度表达a域缺失CAO的转基因植株积累了过量的叶绿素b在绿化。缺乏A结构域的转基因植株在黄化后立即暴露于持续光照下,要么死亡,要么发育明显迟缓。此外,CAO中A结构域的缺失破坏了叶绿素生物合成的另一个步骤,即二乙烯基-原叶绿素的转化一个变成单乙烯基原叶绿素一个在黑暗的条件下。
结论
CAO的A畴调控CAO的水平,从而防止叶绿素的过量积累b.A结构域的这一功能在黄化苗的绿化阶段尤其重要。在这个阶段,植物很容易受到光损伤,这可能是由过量的叶绿素引起的b积累。此外,CAO水平的去调控通过未知机制影响黑暗中单乙烯基-原叶绿素的生物合成。综上所述,CAO的A结构域对叶绿素生物合成的控制和幼苗在强光照下脱黄化过程中存活至关重要。
背景
叶绿素分子是光合作用的主要组成部分,在获取光能和电荷分离方面发挥着重要作用。叶绿素在绿化过程中积极合成,并与各种载脂蛋白组装形成叶绿素-蛋白质复合物。核心天线复合物的载脂蛋白只与叶绿素结合一个,而外周天线复合物的载脂蛋白结合这两种叶绿素一个和叶绿素b[1].由于这些叶绿素-蛋白质复合物在化学计量学上组装以形成功能性光系统,叶绿素代谢必须被严格调节以配合这些复合物的形成。从光损伤的角度来看,叶绿素代谢的调控是重要的。大部分叶绿素中间体是光反应性化合物[2].如果由于调节因子突变导致5-氨基乙酰丙酸(ALA)(四吡咯合成前体)的调节缺陷,则在黑暗条件下原叶绿素会大量积累[3.].因此,原叶绿素的过量会导致活性氧(ROS)的产生,最终导致在绿化过程中生长迟缓或细胞死亡[3.].
在叶绿素生物合成的最后一步,叶绿素b由叶绿素合成一个通过脱植基叶绿素一个加氧酶(曹)4].因为曹mRNA水平刺激叶绿素b合成时,CAO活性被认为部分受曹基因表达[5- - - - - -7].除了在转录水平上的调节,叶绿素b合成也受蛋白质稳定性的调节。CAO由三个域组成,从N端依次命名为A、B和C域[8].C结构域包含Rieske中心和非血红素铁的结合基序,并催化叶绿素的转化一个对叶绿素b[4,8,9].虽然B域的确切功能尚不清楚,但它被认为可能是a域和C域之间的连接器[10].A结构域虽然不参与催化功能,但可调节CAO蛋白的稳定性[8,11].当从CAO中去除A结构域,只引入BC结构域并在拟南芥中过表达(拟南芥), CAO蛋白和叶绿素含量显著升高b过度积累[11].我们最近确定叶绿体Clp蛋白酶在CAO蛋白稳定性中起重要作用[12].然而,过量的叶绿素b积累不会导致光合作用活性的明显改变,也不会对绿叶造成光损伤[13].因此,目前还不清楚为什么CAO的蛋白水平受到A结构域的严格调控。
为了回答这个问题,我们在拟南芥中引入了CAO完整序列或BC结构域对应的基因。随后,我们研究了这些转基因植物在不同光照条件下的绿化过程。有趣的是,只表达BC结构域的转基因植物在黄化的幼苗暴露在持续的光照下时死亡。此外,在幼苗黄化和变绿过程中,叶绿素合成受到干扰。我们讨论了A结构域在叶绿素合成和叶绿体发育调控中的作用。
结果
没有A畴的CAO在绿化过程中造成光损伤
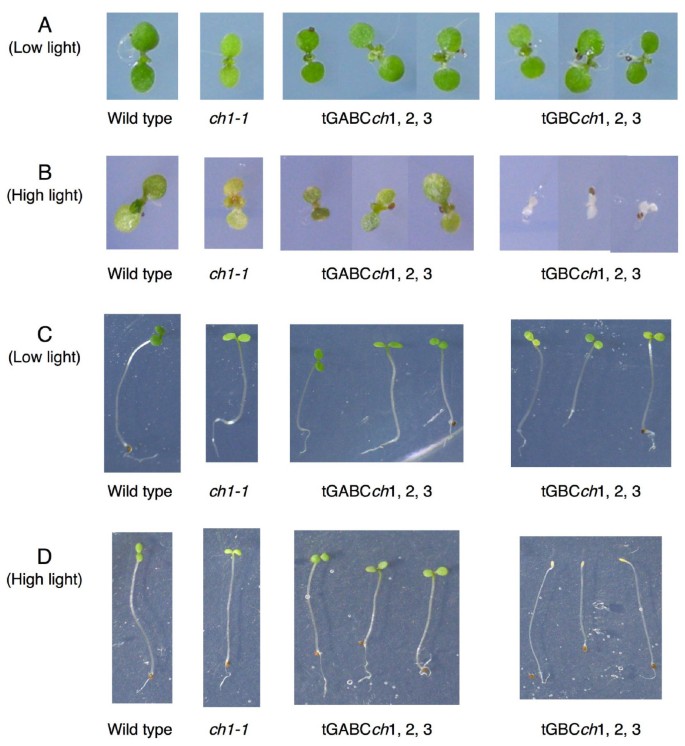
为了阐明A结构域的生理作用,我们研究了两种我们命名为tGBC的转基因植物的光敏感性ch和tGABCch在ch1-1突变体的背景。的ch1-1中的删除曹基因,不含叶绿素b[14].的tGBCch线过度表达嵌合转基因包含绿色荧光蛋白吉恩和曹缺乏a域编码序列的基因[11].相比之下,tGABCch过表达另一种编码GFP和全长CAO蛋白的嵌合转基因[11].两种转基因植物在不同光照条件下生长,并将其表型与野生型和野生型进行比较ch1-1突变体。当种子在弱光条件下发芽和生长时,所有四种菌株都生长得很好ch1-1表现为淡绿色表型(图;1).当黄化苗转移到弱光条件下,大部分tGBCch植物被漂白,tGBC生长ch幼苗发育迟缓(图;1 c).当暴露在强光条件下,没有黄化和绿色的幼苗ch(图幸存下来。1 b而且1 d).相反,其他三个品系的幼苗在低光和强光条件下正常发育和生长。1 b, C而且1 d).这些结果证实了蛋白的过表达曹基因缺失A结构域导致拟南芥幼苗的光损伤。
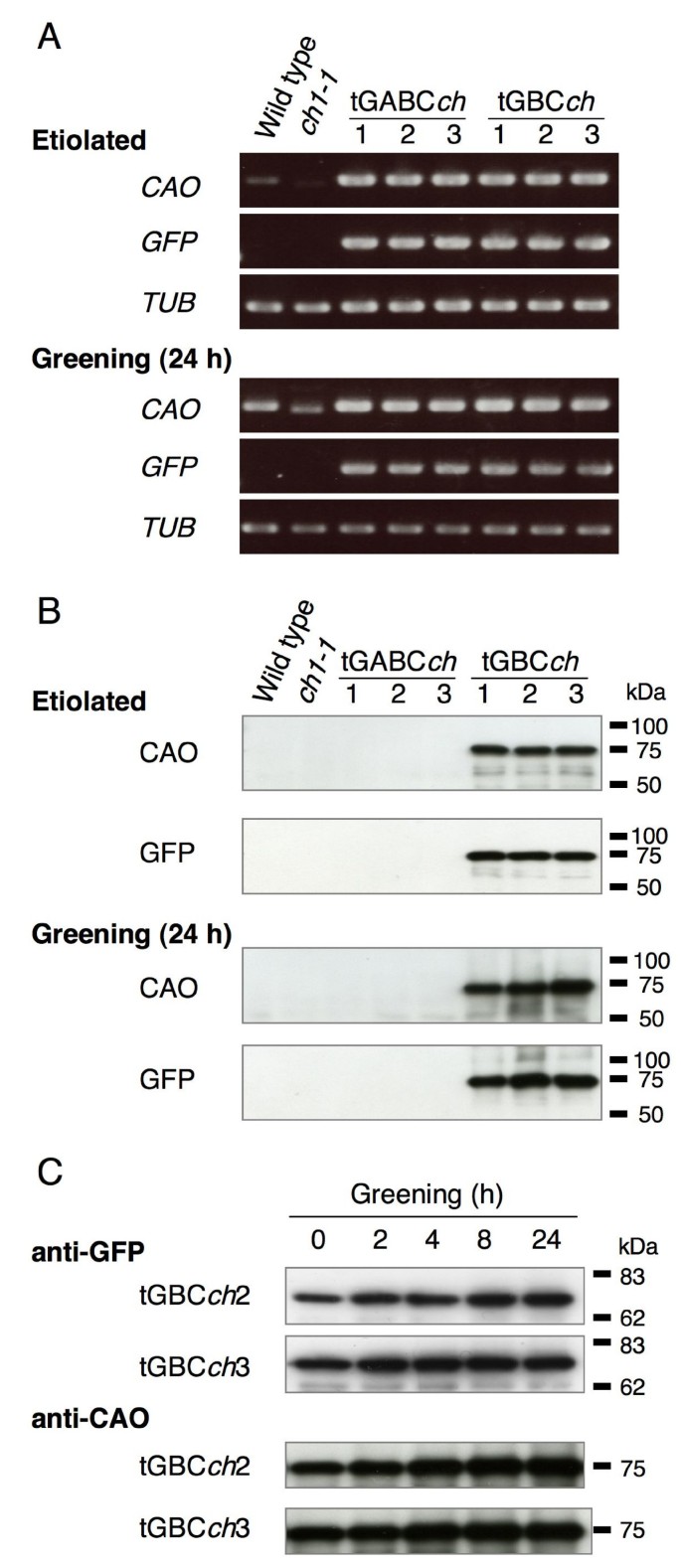
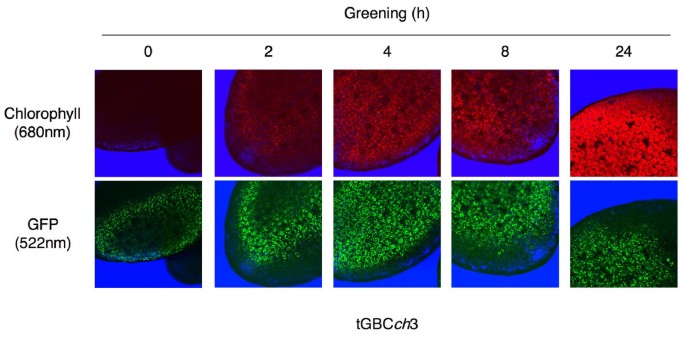
GFP-CAO融合基因在所有转基因tGABC的黄化和绿色幼苗中均高度过表达ch和tGBCch植物系(图;2).转基因基因GFP-ABC或GFP-BC在野生型幼苗中的表达水平高于全长CAO(图2)。2).的tGBCch转基因系在黄化和绿色幼苗中都积累了大量的GFP- bc蛋白(CAO的GFP和B-C结构域的融合)(图。2 b而且2摄氏度).GFP-BC蛋白定位于黄体体和叶绿体(图。3.).相比之下,在黄化和绿化幼苗中,通过免疫印迹检测,全长CAO (a - b - c结构域)和GFP全长CAO (CAO的GFP和a - b - c结构域的融合)蛋白均处于可检测水平(图。2 b).结果表明,全长度CAO蛋白和gfp全长度CAO蛋白由于叶绿素的作用在绿叶中积累到一定的水平b在转基因植物中被积极合成[11].然而,通过免疫印迹检测,幼苗中CAO蛋白水平过低。这些数据表明,低水平的CAO积累足以合成叶绿素b.我们应该注意到,在GFP-BC过表达的植物中融合蛋白的过量积累并不是由于这些植物的转录或翻译激活[11].很可能是A结构域的缺失削弱了Clp蛋白酶对CAO的降解[12].
CAO在黄化和绿化幼苗中的表达水平.答:表达水平内化曹基因和GFP-CAO采用半定量PCR法检测4日龄黄化苗和绿化苗的转基因。表达水平来自微管蛋白(TUB2)基因监测,作为定量对照。内部曹野生型和野生型表达量增加ch1-1绿化期间的幼苗。的曹文字记录的ch1-1在tGABC中没有检测到31 bp的缺失ch和tGBCch植物。B:测定了4日龄黄化苗和绿化苗中CAO蛋白和GFP-CAO融合蛋白的积累水平。全长CAO、GFP-ABC和不含转运肽的GFP-BC蛋白的分子大小分别为56、83和70 kDa, C: GFP-BC蛋白在4天黄化tGBC中的积累水平ch测定24 h绿化期的幼苗。在野生型中未检测到全长CAO或GFP-CAO融合蛋白,ch1-1和tGABCch幼苗(数据未显示)。
如图所示。1而且2,我们的转基因株系之间没有表现出明显的表型差异。在本研究中描述的后续实验中,我们还检查了图中所示的所有转基因株系。1而且2.所有的测试结果几乎完全相同。
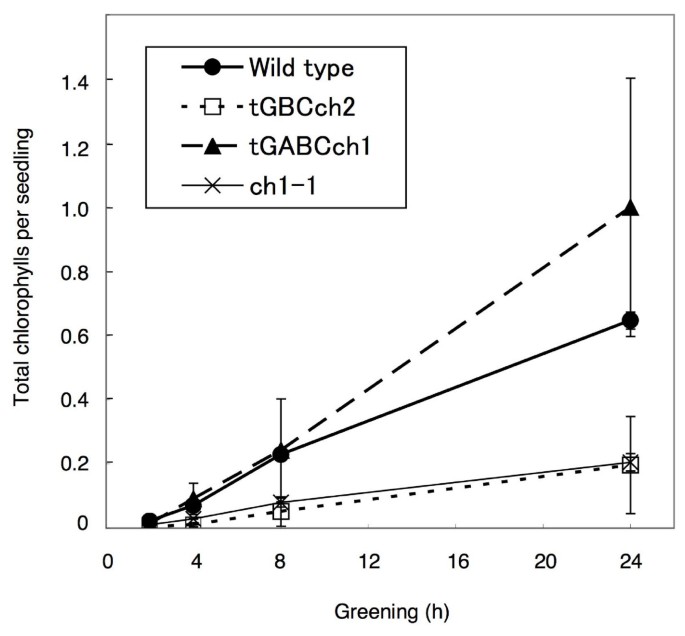
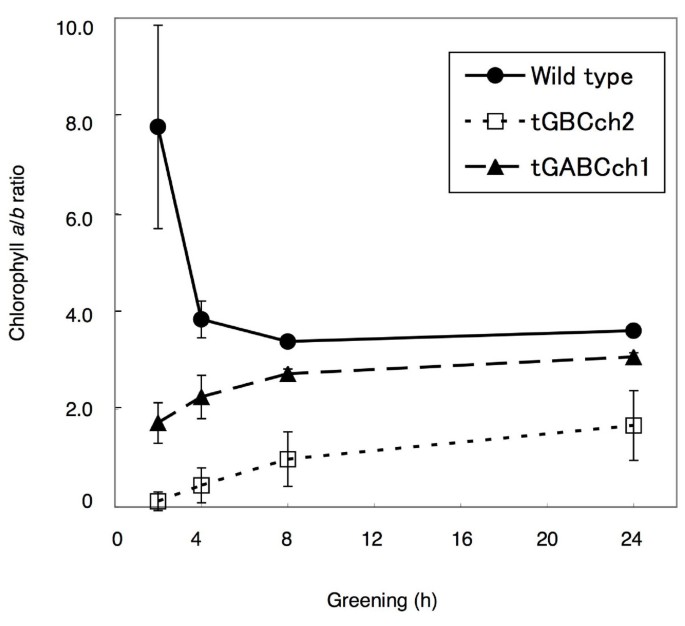
接下来,我们研究了当黄化苗转移到持续光照条件下时叶绿素的积累。与野生型相比,tGBC的叶绿素水平较低ch而且ch1-1但tGABC略高ch(无花果。4).在tGABC中,Lhcb蛋白的含量较高,与叶绿素的积累高度一致chtGBC更低ch与野生型相比(图;5).叶绿素a / b野生型在光照开始后比值很高,在绿化过程中逐渐降低(图2)。6).相反,叶绿素a / b光照后比值较低,绿化后比值逐渐升高ch和tGBCch(无花果。6).在tGBCch,叶绿素a / b比率极低。无花果。7为野生型和两种转基因植物光照5min后叶绿素积累的HPLC谱图。在此条件下,大部分叶绿素分子来源于原叶绿素一个这是在黑暗条件下预先积累的。野生型幼苗积累叶绿素一个但不是叶绿素b(无花果。7).需要注意的是,野生型在25 min时出现的小峰不是叶绿素b因为光谱显示不同的峰(数据未显示)。相比之下,tGBCch只累积叶绿素b表明叶绿素一个(或脱植基叶绿素一个)在tGBCch立即转化为叶绿素b(或脱植基叶绿素b)后进行原叶绿素的光转化一个到脱植基叶绿素一个(无花果。7).两个叶绿素一个和叶绿素btGABC累积ch叶绿素的含量一个几乎相当于野生型的水平(图;7).
有趣的是,我们发现tGBC完全变绿的叶子ch积累了大量的7-羟甲基叶绿素,这是叶绿素之间转换的中间分子b和叶绿素一个(无花果。8).7-羟甲基叶绿素含量异常高表明GFP-BC蛋白过量或叶绿素过量b可能会激活叶绿素之间的转换一个而且b[15].
A结构域的缺失导致叶绿素代谢紊乱
的tGBCch幼苗在绿化过程中积累了低水平的叶绿素(图。4).这些数据与tGBC中黄化苗中叶绿素合成的最终产物原叶绿素含量下降的观察结果一致ch转基因植物(表1).当植物被喂食ALA时,在野生型和转基因植物之间观察到类似的趋势(表2)1).这些结果可能表明,ALA和原叶绿素形成之间的某些酶的步骤被干扰,这种干扰限制了tGBC中的叶绿素合成ch绿化期间的幼苗。
在我们的下一个研究方向中,我们检查了在短暂光照后,原叶绿素在黑暗中的重新积累,作为分析幼苗中原叶绿素合成动力学的手段。在此条件下,野生型tGBC的原叶绿素含量与野生型tGBC相近ch和tGABCch在第一天的黑暗(表2).然而,只有tGBC在随后的2天黑暗期中水平下降ch(表2).虽然黄化tGBCch幼苗在黑暗条件下能正常合成原叶绿素,色素在黑暗条件下的分解机制不明。或者,也可能是二乙烯基-原叶绿素一个可以反馈方式抑制叶绿素生物合成的一个早期步骤。
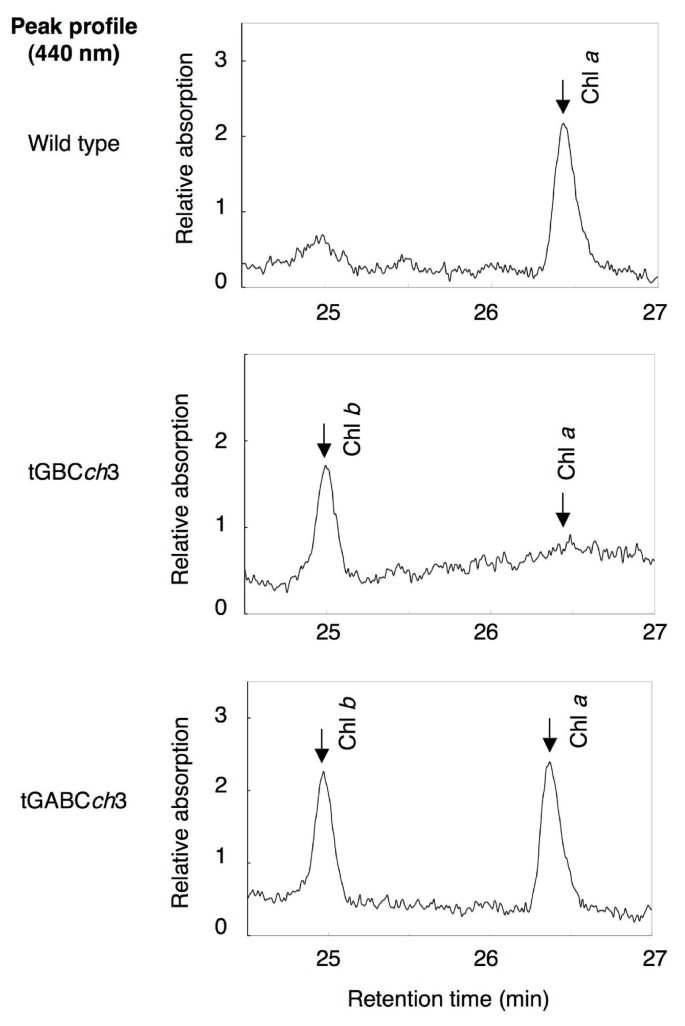
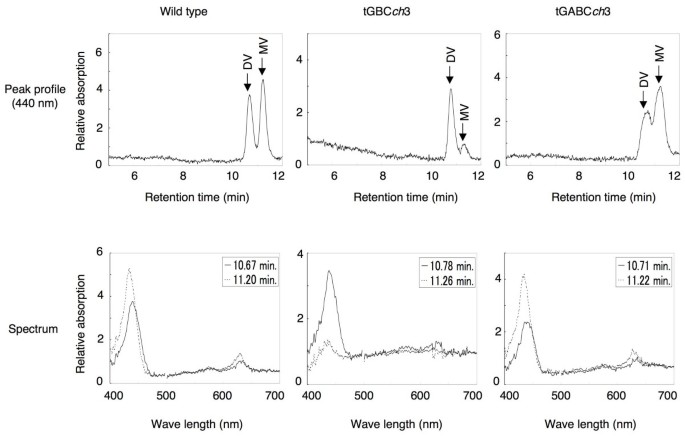
为了研究叶绿素btGBC的合成途径ch,比较了野生型tGBC的叶绿素中间产物组成ch和tGABCch.尽管CAO在tGBC中积累ch,原叶绿素酸脂b在黄化苗中未检测到。9).这些数据表明,CAO不能催化原叶绿素的转化一个对原叶绿素酸脂b在拟南芥。有趣的是,二乙烯基-原叶绿素的积累比例存在显著差异一个总原叶绿素一个野生型中tGBCch和tGABCch(无花果。9和表1).野生型和tGABC的黄化苗ch主要积累单乙烯基-原叶绿素一个(表1).相反,monovinyl-protochlorophyllide一个在tGBC中积累到非常低的水平ch(表1).这一观察结果表明,CAO中A结构域的损失导致3,8 -二乙烯基原叶绿素的失活一个8-乙烯基还原酶[16].
讨论
A结构域在变绿过程中保护细胞免受光损伤
我们此前报道了转基因拟南芥植株过表达不具有A结构域的原核CAO的光敏感性。这些转基因植物积累了更多的叶绿素b比tGBCch植物(13].在之前的报告中,我们得出结论,叶绿素的过量积累b不会对转基因植物完全变绿的叶片造成光损伤[13].然而,在本研究中,我们发现大部分tGBC黄化ch幼苗在绿化过程中不仅在强光条件下死亡,在弱光条件下也会死亡。没有叶绿素的一个、叶绿素b不会与载脂蛋白结合。结果,游离叶绿素b可能产生ROS [2].与tGBC相反ch过表达全长CAO的转基因植株积累了两种叶绿素一个和叶绿素b在照明开始后立即。不像tGBCch在植株中,cao全长过表达系未表现出光损伤。有可能叶绿素b在叶绿素存在的情况下与载脂蛋白组装一个.因此,ROS的生成可能受到抑制。总的来说,这些结果表明,A域在防止可能由过量叶绿素引起的光损伤方面是必不可少的b在绿化过程中积累。过表达原核CAO的转基因拟南芥黄化苗可能引起明显的光损伤。
异常高水平的7-羟甲基叶绿素一个是叶绿素和叶绿素之间转换的中间分子b对叶绿素一个,积累在tGBC的绿叶中ch(无花果。8).这一观察结果可能表明叶绿素过量b重新转化为叶绿素一个通过叶绿素循环[15].7-羟甲基叶绿素不太可能是在叶绿素的过程中形成的一个对叶绿素b转换。因为CAO催化了叶绿素的两步反应一个对叶绿素b中间分子7-羟甲基叶绿素本身应该与CAO酶有关,在反应过程中不被释放[14].在我们的研究中,在黄化苗开始光照后没有发现7-羟甲基叶绿素,尽管叶绿素b主动合成(图;7).因此,可以合理地假设7-羟甲基叶绿素主要是在叶绿素的过程中形成的b对叶绿素一个转换。
GFP-BC蛋白的积累干扰叶绿素生物合成的调节
与野生型植物相比,tGBC在绿化过程中叶绿素积累受到抑制ch幼苗,即使在低光照条件下。这种抑制可能是由于游离叶绿素产生的氧化应激所致b.过多的原叶绿素会产生ROS,导致植物在绿化过程中生长迟缓或细胞死亡流感突变体(3.].最近,我们发现叶绿素生物合成途径是氧化应激的靶标[17].然而,tGBC的所有表型ch不能仅用氧化应激来解释。例如,原叶绿素的水平一个在tGBC的黄化组织中ch低于野生型。由于这些植物没有暴露在光照下,因此可以排除ROS对原叶绿素积累的抑制作用。我们还观察到二乙烯基原叶绿素在tGBC中占总原叶绿素的比例增加ch转基因植物。这些数据表明,CAO BC结构域的积累抑制了3,8 -二乙烯基原叶绿素的活性一个8-vinyl还原酶。反之,过表达GFP-ABC蛋白可促进叶绿素积累。这些现象在生物调控方面非常有趣,因为CAO和截短的CAO不仅影响叶绿素b合成以及其他叶绿素代谢步骤。这些结果是合理的,因为据报道,一些与叶绿素生物合成有关的酶可以形成复合物或与其他酶相互作用。例如,谷氨酰胺- trna还原酶和谷氨酰胺-1-半醛转氨酶形成复合物,使两种酶之间有效的底物运输[18].此外,BchH, Mg螯合酶的三个亚基之一Rhodobacter capsulatus,加速mg -原卟啉IX单甲基转移酶活性[19].如果CAO确实与其他酶相互作用,截断CAO的积累可能会潜在地干扰目标酶的活性。
此外,CAO中A结构域的缺失阻碍了二乙烯基-原叶绿素的转化一个变成单乙烯基原叶绿素一个,并明显降低总原叶绿素一个黑暗条件下的水平。tGBC中原叶绿素积累减少的可能场景ch这些幼苗中过量积累的CAO干扰了催化单乙烯基-原叶绿素形成的酶一个从divinyl-protochlorophyllide一个,后者可能以反馈的方式抑制叶绿素生物合成的早期步骤。为了澄清这个问题,有必要进行进一步的研究。
CAO不催化原叶绿素的转化一个对原叶绿素酸脂b
当野生型的黄化苗暴露在持续的光下,叶绿素一个光照开始后立即累积。光照之后的叶绿素一个而且b在几个小时的滞后阶段后,水平逐渐上升。相反,在tGBC中ch植物叶绿素b累积的只有叶绿素一个光照5分钟后未检测到(图;7).考虑到原叶绿素b在黄化苗中没有发现,这些数据表明叶绿素一个立即转化为叶绿素b在tGBCch在绿化早期阶段的幼苗(图;9).
几个研究小组报告说,原叶绿素b不存在于叶成体[20.,21].与这些报道相反,另一个小组声称原叶绿素b可在黄化苗中检测到,当它们使用含二乙基吡罗碳酸酯的丙酮提取色素时[22].也有人提出原叶绿素b是通过独立于CAO蛋白的途径合成的[23].此外,蓝藻还具有转化菌的作用曹而且奇迹转基因,积累的原叶绿素b[24].这说明CAO具有转化原叶绿素的能力一个对原叶绿素酸脂b.在本研究中,我们使用100%丙酮作为叶绿素中间体的提取溶剂,以避免人为形成叶绿素衍生物,并最大限度地从幼苗中提取叶绿素中间体[21].因此,我们没有检测到任何原叶绿素b在黄化tGBC中ch幼苗,即使大量的CAO蛋白积累。这些结果表明原叶绿素b不是叶绿素的主要中间产物吗b合成在足底.
结论
综上所述,我们的结果证明了叶绿素的过度积累b对植物有害。这种有害影响可能会干扰叶绿素中间体的正常合成和光合蛋白质的积累。因此,我们认为A结构域对CAO蛋白的调控对于黄化苗在光照条件下的存活至关重要。因为A结构域的作用是维持适当的叶绿素b植物发育过程中的水平[11],可以合理地假设CAO蛋白水平的调节在植物发育和适应光照条件的各个方面都是必不可少的。进一步研究CAO的调控机制,有助于阐明该机制在植物生命周期中的生理作用。
方法
植物材料和生长条件
拟南芥CAO蛋白由三个结构域组成,分别命名为A (V37-L170)、B (P171-G200)和C (A201-G537)结构域[8].在这项研究中,我们使用拟南芥哥伦比亚野生型和ch1-1中包含删除的突变体曹基因(14].此外,我们还使用了两种过表达CAO蛋白和GFP嵌合融合的转基因植物。两个拟南芥转化体,tGBCch和tGABCch,表达了转运肽- gfp - b - c结构域和转运肽- gfp - a - b - c结构域对应的融合转基因ch1-1背景,分别[11].每个转基因植株tGBC有3个纯合子系ch和tGABCch,均用于本研究。所有转基因植物都是独立分离出来的。拟南芥幼苗在22℃条件下,在含有1/2稀释Murashige-Skoog培养基的琼脂板(0.7% [w/v])上生长。植物在低光(70 μE m)下生长-2年代-1从荧光灯)或强光(300 μE m-2年代-1来自配备ND滤光片的氙气灯泡[3.6 kW], TGE-2S3, Tabai,大阪,日本)条件。
逆转录酶PCR
使用RNeasy Plant Mini Kit (Qiagen, Hilden, Germany)从200株在黑暗条件下生长4天的黄化幼苗中提取总RNA。黄化后的幼苗在绿化24小时后提取RNA。将1 μg分离的RNA使用SuperScript III Kit (Invitrogen, Carlsbad, CA)反转录为cDNA。利用合成的第一链cDNA样本,在25 μl的反应中进行PCR检测基因表达量。PCR条件:96°C (2 min);25个循环,96°C(30秒),55°C(30分钟),72°C(1分钟)。cDNA模板的数量由β-归一化微管蛋白(TUB2)基因表达水平。用于RT-PCR的引物如下TUB2、5'-CTC AAG AGG TTC TCA GCA GTA-3'和5'-TCA CCT TCT TCA TCC GCA GTT-3';为曹, 5'-AAC GAG GGA CGT ATT CAA TGT CCG-3'和5'-AGA AGA AGG TAA ACA GAC ATG G-3';为绿色荧光蛋白、5'-ATG GTG AGC AAG GGC GAG G-3'和5'-TTA CTT GTA CAG CTC GTC CA-3'。
免疫印迹
10株幼苗用100 μl提取缓冲液(50 mM Tris [pH 6.8]、2 mM EDTA、10% [w/v]甘油、2% [w/v] SDS、6% [v/v] 2-巯基乙醇)均质。分离的上清液(25 μl)进行SDS-PAGE检测。溶解的蛋白质被吸到氢键- p膜上(GE Healthcare, Buckinghamshire, UK)。1/5000稀释的抗gfp (Invitrogen)抗体,1/2000稀释的抗cao抗体[11]和1/5000稀释的抗lhcb [6]兔抗体用于检测上述特定蛋白质[11].交叉反应蛋白条带使用与辣根过氧化物酶相关的抗兔IgG开发(GE Healthcare)。ECL + western blotting分析试剂盒用于抗原化学发光检测(GE Healthcare)。
共焦显微镜
荧光图像记录在Axioplan荧光显微镜(× 20物镜,卡尔蔡司,耶拿,德国)上,该显微镜集成在MRC 1024共聚焦激光扫描显微系统(Bio-rad laboratories, Hercules, CA)中。样品用氩激光(25 mW)在488 nm激发,在522 nm和680 nm分别记录了GFP和叶绿素荧光。使用Adobe Photoshop 4.0软件(Adobe, San Joze, CA)处理图像。
高效液相色谱分析
首先用100%丙酮从幼苗中提取叶绿素,然后用水稀释到80%丙酮。将稀释后的提取物进行HPLC分析(Shim-pack CLC-ODS柱,6.0 × 150 mm;Shimadzu,京都,日本)使用甲醇作为洗脱剂,流速为1.7 ml min-1.叶绿素的组成由650 nm处的色谱峰剖面计算[6].
采用高效液相色谱法(HPLC),以4.6 × 150 mm的Symmetry C8柱为色谱柱;Waters Corporation, MA, USA)根据先前描述的Zapata等人的方法。[25].在400 ~ 700 nm范围内,用SPD-M10A连续记录了被洗脱颜料的洗脱谱图和光谱AV(日本岛津公司)。原叶绿素的组成由440 nm的色谱峰谱计算[26].
参考文献
- 1.
Green BR, Durnford DG:叶绿素-类胡萝卜素蛋白的产氧光合作用。植物化学学报,2004,27(4):366 - 366。10.1146 / annurev.arplant.47.1.685。
- 2.
Vavilin DV, Vermaas WFJ:植物和蓝藻中导致血红素和叶绿素的四吡咯生物合成途径的调控。中国生物医学工程学报,2002,29(3):344 - 344。10.1034 / j.1399-3054.2002.1150102.x。
- 3.
Meskauskiene R, Nater M, Goslings D, Kessler F, Camp Ro-d, Apel K: FLU:叶绿素生物合成的负调控因子拟南芥.美国国家科学研究院。2001, 29(3): 344 - 344。10.1073 / pnas.221252798。
- 4.
田中A,伊藤H,田中R,田中N,吉田K,冈田K:叶绿素一个加氧酶(曹)参与叶绿素b叶绿素形成一个.美国国家科学研究院。1998, 95: 12719-12723。10.1073 / pnas.95.21.12719。
- 5.
埃斯皮内达·CE,林福德·AS,迪瓦恩·D,布鲁斯兰JAAtCAO编码叶绿素的基因一个氧合酶是叶绿素所必需的b合成的拟南芥.美国国家科学研究院。1999, 26(4): 457 - 457。10.1073 / pnas.96.18.10507。
- 6.
田中R, Koshino Y, Sawa S, Ishiguro S, Okada K,田中A:叶绿素过表达一个氧合酶(CAO)可增大光系统II的天线尺寸拟南芥.植物学报,2001,26:366 - 366。10.1046 / j.1365 - 313 x.2001.2641034.x。
- 7.
Harper AL, von Gesjen SE, Linford AS, Peterson MP, Faircloth RS, Thissen MM, Brusslan JA:叶绿素一个加氧酶mRNA和蛋白质水平与叶绿素相关a / b比例拟南芥.光子学报,2004,29(3):344 - 344。10.1023 / B: PRES.0000015375.40167.76。
- 8.
永田N,佐藤S,田中R,田中A:叶绿素畴结构一个绿色植物的加氧酶Prochlorothrix hollandica与催化功能有关。植物学报,2004,29(3):349 - 349。10.1007 / s00425 - 003 - 1181 - 6。
- 9.
富谷A,冈田K,宫下H, Matthijs HCP,大野T,田中A:叶绿素b藻胆素是蓝藻和叶绿体的共同祖先。自然科学,1999,30(4):344 - 344。10.1038/22101。
- 10.
Sakuraba Y, Yamasato A, Tanaka R, Tanaka A:拟南芥叶绿素n端结构域的功能分析一个加氧酶。植物化学学报,2007,29(4):344 - 344。10.1016 / j.plaphy.2007.07.016。
- 11.
山中A,永田N,田中R,田中A:叶绿素的N端结构域一个加氧酶对叶绿素的反应使蛋白质不稳定b在拟南芥中积累。中国生物医学工程学报,2005,27(3):344 - 344。10.1105 / tpc.105.031518。
- 12.
中原E,樱叶Y,山中A,田中R,田中A: Clp蛋白酶控制叶绿素b通过调节叶绿素水平来合成一个加氧酶。植物学报,2007,29(4):489 - 497。10.1111 / j.1365 - 313 x.2006.02996.x。
- 13.
平岛M,佐藤S,田中R,田中A:表达原核叶绿素的天线系统色素洗牌一个加氧酶在拟南芥.中国生物医学工程学报,2006,29(3):388 - 388。10.1074 / jbc.M602903200。
- 14.
杨晓明,杨晓明,杨晓明,Rüdiger W:叶绿素关键酶基因的克隆及功能表达b生物合成(CAO)从拟南芥.植物学报,2000,21(3):344 - 344。10.1046 / j.1365 - 313 x.2000.00672.x。
- 15.
大贺,伊藤,田中A:叶绿素的转化b对叶绿素一个通过分离出的叶绿体,叶绿素与载脂蛋白的组装。植物科学学报,1997,33(3):357 - 357。
- 16.
田田N,田中R,佐藤S,田中A:叶绿素合成乙烯还原酶基因的鉴定拟南芥以及对原绿球藻物种进化的影响。植物科学学报,2005,27(3):344 - 344。10.1105 / tpc.104.027276。
- 17.
黄志刚,张志刚,张志刚:氧化胁迫对黄瓜叶绿素合成的影响(Cucumis巨大成功子叶。中国生物医学工程学报,2006,29(3):366 - 366。10.1111 / j.1399-3054.2006.00720.x。
- 18.
Nogaj LA, Beale SI:谷氨酰胺- trna还原酶和谷氨酰胺-1-半醛转氨酶的物理和动力学相互作用衣藻reinhardtii.中国生物医学工程学报,2005,29(4):344 - 344。10.1074 / jbc.M502483200。
- 19.
Gibson LC, Willows RD, Kannangara CG, von Wettstein D, Hunter CN: Rhodobacter speroides的镁-原卟啉螯合酶:结合bchH, -I和-D基因产物的活性重建大肠杆菌.美国国家科学研究院。1995, 92: 1941-1944。10.1073 / pnas.92.6.1941。
- 20.
Scheumann V, Klement H, Helfrich M, Oster U, Schoch S, Rudiger W:原叶绿素b在大麦胚质体中不存在。中国农业科学,1999,30(4):344 - 344。10.1016 / s0014 - 5793(99) 00169 - 6。
- 21.
Kolossov VL, Rebeiz CA:叶绿体生物发生88原叶绿素b发生在绿色植物中,但不发生在黄化植物中。中国生物医学工程学报,2003,27(3):357 - 357。10.1074 / jbc.C300449200。
- 22.
Reinbothe S Pollmann S Reinbothe C原位原叶绿素的转化b对原叶绿素酸脂一个在大麦。7-甲酰基还原酶在黄成体前层体中新作用的证据。中国生物医学工程学报,2003,27(3):344 - 344。10.1074 / jbc.M209737200。
- 23.
Reinbothe S, Quigley F, Gray J, Schemenewitz A, Reinbothe C:原叶绿素氧化还原酶A导入大麦叶绿体所需质体包膜蛋白的鉴定。美国国家科学研究院。2004, 30(4): 457 - 457。10.1073 / pnas.0307284101。
- 24.
许华,Vavilin D, Vermaas W:叶绿素的存在b在集胞藻属sp. PCC 6803干扰四吡咯生物合成,增强叶绿素降解。中国生物医学工程学报,2002,27(4):344 - 344。10.1074 / jbc.M205237200。
- 25.
萨帕塔M, Rodríguez F,加里多JL:海洋浮游植物中叶绿素和类胡萝卜素的分离:反相C8柱和含流动相吡啶的高效液相色谱法。生态环境学报,2004,19(3):344 - 344。10.3354 / meps195029。
- 26.
永田N,田中R,田中A:叶绿素合成的主要途径包括[3,8-二乙烯基]-叶绿素一个减少拟南芥.中国生物医学工程学报,2007,29(3):344 - 344。10.1093 /卡式肺囊虫肺炎/ pcm153。
确认
本研究由创新科学研究资助计划(No. 17GS0314 to AT)和科学研究资助计划(No. 18770025 to AY;No. 68700307 to RT)来自日本文部科学省。我们要感谢博士。感谢R. Hellens和P. Mullineaux(英国John Innes中心)提供pGreen II质粒。我们也要感谢Niwa博士(日本静冈县大学食品科学系)为我们提供了sGFP (S65T)质粒。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
AY参与了研究的设计和手稿的撰写,并进行了所有的实验研究。RT参与了研究的设计、HPLC和生理分析以及手稿的撰写。AT参与了研究的设计和稿件的撰写。所有作者都阅读并批准了最终的手稿。
权利和权限
本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用属性许可协议(http://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
山中,A.,田中,R. &田中,A.叶绿素n端结构域的丢失一个加氧酶诱导拟南芥幼苗绿化过程中的光损伤。BMC植物生物学8,64(2008)。https://doi.org/10.1186/1471-2229-8-64
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-8-64
关键字
- 叶绿素
- 转基因植物
- 叶绿素生物合成
- 脱植基叶绿素
- 变苍白幼苗