摘要
背景
尽管茎尖分生组织(SAM)在植物发育和器官形成中具有重要作用,但我们对其控制功能的分子机制了解有限。基因组工具有可能解开SAM的分子奥秘,豆科系统由于其独特的固氮、次生代谢和荚果发育等特性,越来越多地用于植物发育研究。豌豆(Pisum一)是自孟德尔时代以来一直用于遗传学研究的一个成熟的经典模式物种。此外,大量发育突变体的可用性使豌豆成为基因组学研究的理想作物豆类。本研究旨在利用基因组学工具分离在SAM活性调控中发挥潜在作用的基因。
结果
为了识别SAM中差异表达的基因,我们从3个cDNA文库中生成了2735个ESTs,这些cDNA文库来自10天龄的花园豌豆的新鲜微解剖SAM (Pisum一简历Torsdag)。定制设计的寡核苷酸阵列用于比较豌豆sam和非分生组织的转录谱。在豌豆SAM中,共有184和175个转录本被显著上调或下调。正如预期的那样,在公共数据库中发现了近61%在SAM中下调的转录本,而来自同一来源的序列只包含了12%在SAM中表达较高水平的基因。这突出了目前公共豌豆蛋白数据库中分生组织转录本的代表性不足,并证明了我们的SAM EST收集作为揭示这一发育过程调控的进一步信息的必要遗传资源的实用性。除了未知因素外,已知许多上调的转录本编码与细胞分裂和增殖、表观遗传调控、生长素介导的反应和microRNA调控相关的产物。
结论
所提供的数据提供了豌豆SAM转录谱的图像,并揭示了差异表达的转录本在分生组织功能和维持中的可能作用。
背景
器官的形成不仅限于胚胎发育,而且可以发生在植物的整个生命周期中。胚后发育新器官的潜力归因于位于植物生长尖端的分生组织,根尖分生组织产生植物的地下部分,芽尖分生组织(SAM)在种子萌发后产生整个芽系统。
像其根对应物一样,SAM包含一个多能干细胞池,可以自我维持,并产生可以分化成多种细胞和组织类型的细胞[综述于[1]]。虽然侧部器官如叶片起源于SAM的周围区域,但SAM的基底区域有助于茎的形成。因此,SAM的干细胞必须补充细胞被招募的区域,同时保持干细胞的数量。这通常归因于干细胞微环境中邻近SAM细胞之间的积极通信过程[2- - - - - -4].
在模型植物中进行了优雅的遗传工作,拟南芥,加深了我们对这一重要发展过程的认识[由[5]]。这可以通过在拟南芥WUSCHEL (WUS)是一种同源域转录因子,对维持干细胞池处于未分化状态至关重要[6],以及CLAVATA一组共同作用限制干细胞增殖的基因[7].而拟南芥属为我们加深对植物生物学的理解提供了宝贵的模式植物,但它并不代表植物王国中所有不同的发育、环境和生理过程。因此,仍然需要将所获得的知识扩展到其他植物物种,特别是作物植物。
将现代基因组学研究技术应用于作物改良需要新的知识和新的基因组资源的开发。豆科的豆科植物因其富含蛋白质的种子而被种植,是世界许多地区饮食的重要组成部分,尤其是豌豆、扁豆和大豆。豆科植物因其固氮、次生代谢和荚果发育等独特的特性而受到生物学家的关注,而这些都是无法研究的过程拟南芥物种。另一方面,豌豆(Pisum一)一直是遗传学中常用的经典模式物种[8,9和植物发育研究。它在开花起始和发育研究中的广泛应用为这一过渡过程提供了重要的见解[10- - - - - -13].此外,各种发育和开花豌豆突变体的可用性[11,14- - - - - -18使得基因组学研究更容易处理。
在这项研究中,我们应用转录组学方法研究了与豌豆SAM相关的基因表达谱,豌豆是一种农业和商业上重要的模式豆类。我们还研究了微解剖SAM的使用,以解开SAM的转录组谱。通过识别SAM和非分生组织(NM)之间表达差异的基因,我们的目标是阐明SAM的转录特征,从而识别可能在调节SAM活性中发挥重要作用的基因。
为此,使用从花园豌豆中仔细解剖的sam构建了三个定向cDNA文库。这些文库包括标准cDNA文库加上标准化文库和减法文库,以增加回收稀有cDNA的可能性,允许对豌豆SAM中表达的广泛多样性的基因进行采样。从这些文库中获得的EST序列被用于CombiMatrix CustomArray™4 × 2 K寡核苷酸阵列的后续设计,该阵列代表了SAM的基因含量。
在本文中,我们介绍了该基因组学项目的EST和转录谱数据。转录谱分析实验首次分析了豌豆SAM和NM之间表达差异的基因。数据显示,与细胞分裂和增殖、表观遗传调控、生长素介导的反应和microRNA (miRNA)调控相关的转录本在SAM中比在NM中更丰富。相反,与光合作用、非生物或生物应激反应、活性氧(ROS)稳态和一般细胞壁维持相关的序列在SAM中下调。
结果与讨论
生成的ESTs特征
从3个cDNA文库中筛选出3000个克隆,从5'端开始进行单次测序。材料和方法中概述的序列清洗过程产生了2735个ESTs。这些序列平均修剪长度为519个碱基对,被组装成348个簇和1332个单核苷酸,最终注释了1686个unigenes。分组成员从67个est(1个)到2个est(253个)不等。标准化库、标准库和减法库的冗余度分别为15.0%、20.3%和62.8%。一个高冗余度的cDNA文库构建使用类似减法从Thellungiella植物在非生物胁迫条件下也曾被观察到[19].
1686个unigenes的翻译产物在GenBank提供的非冗余蛋白数据库中进行检索[20.以假定的方式分配它们的功能。在撰写本文时,918个unigenes(54.4%)表现出显著相似性(E10的值截断5),而549个(32.6%)ESTs被分配到功能未知的转录本,其中包括模式生物基因组中预测的假设基因(表2)1).其余219条ESTs(13.0%)在公共蛋白质序列数据库中无同源信息。进一步对GenBank EST集合进行BLASTN搜索,发现219个EST中有62个可能是新序列。
sam衍生cDNA文库中可能表达的基因概述
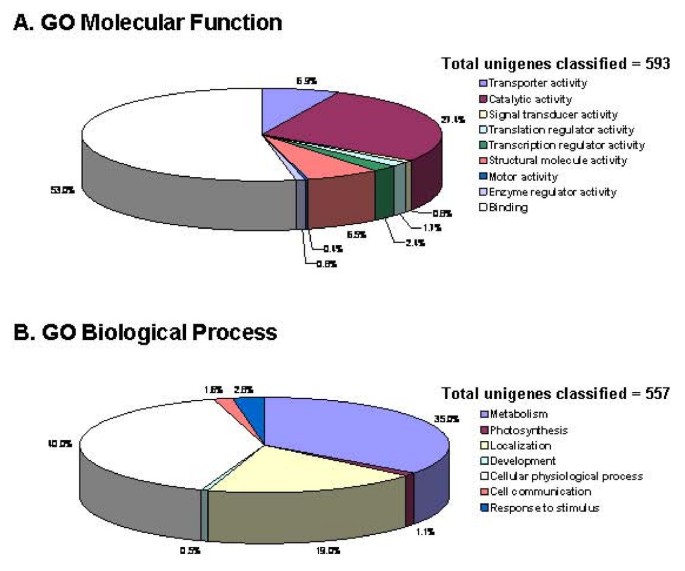
根据序列相似性,超过50%的SAM unigenes可以被指定为具有已知或假定功能的基因。然而,由于缺乏编码产物的信息,许多转录本无法按照基因本体论联盟(GO)进行功能分类。使用BLAST2GO [21],我们成功地对593和557个unigenes进行了GO分子功能分类(图1)和生物过程(图1 b),分别。单个基因产物可能被分配到多个GO项,因此每个本体中的GO映射总数超过了ESTs的数量。
基于基因本体(GO)的SAM unigenes分类。BLASTX评分< 10的Unigenes5使用BLAST2GO自动化系统[21].请注意,在GO分类系统中,单个基因可以被分配到多个类别。
成功分类的unigenes涵盖了广泛的GO功能类别(图1).在分子功能分类下,大多数基因(53%)被分配到“结合”类(图1).这类包括假定主要参与核酸结合的序列,其中相当多的序列被预测编码转录因子,已知这些转录因子对植物发育的调控至关重要。预测编码组蛋白亚基和组蛋白修饰蛋白、染色质重塑因子和DNA甲基转移酶的Unigenes代表了与核酸结合相关的另一组序列。
为了研究我们的EST文库所代表的不同类型的转录因子家族,使用最佳匹配进行搜索拟南芥SAM unigenes的基因座(基于BLASTX搜索TAIR拟南芥蛋白质数据库)在拟南芥基因调控信息服务器[22].目前数据库中列出了50个转录因子家族,其中19个由SAM unigenes表示(表2)2).在发育调控中起关键作用的同源盒转录因子家族中的6个成员可能是值得进一步研究的候选基因。
在生物过程类别中,40%和35%的unigenes分别与细胞生理过程和代谢有关(图1 b).前者包含在细胞组织和生物发生中起重要作用的基因产物,而后者具有主要与蛋白质代谢相关的序列。与蛋白质代谢相关的序列从与蛋白质生物合成相关的序列,如不同的核糖体亚基,到修饰和降解蛋白质的序列,包括泛素-蛋白酶体途径中涉及的各种序列。
使用pea 2k阵列检测SAM中差异表达的转录本
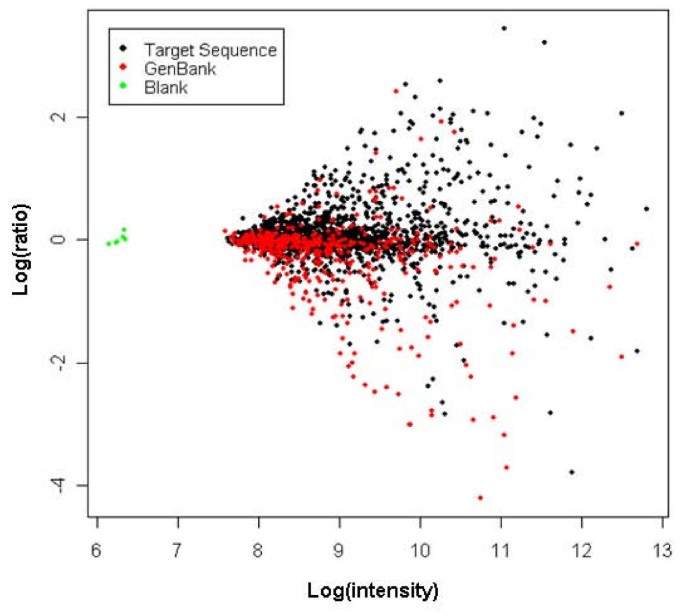
利用我们的EST资源和从GenBank豌豆蛋白数据库随机检索的大约500个豌豆序列开发了一个寡核苷酸微阵列,该数据库包含大约2000个条目(见材料和方法)。我们利用这个阵列来比较SAM和NM的转录谱。进行了四次独立的平衡块设计双标签实验的重复[材料和方法,[23]],得到的数据如图所示2.
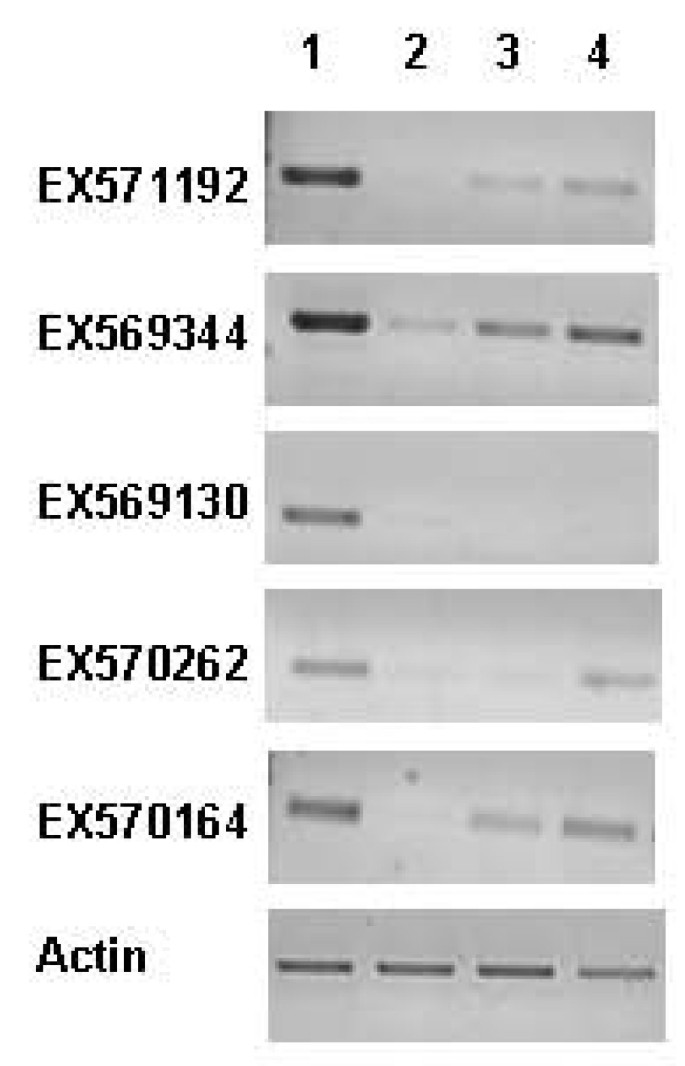
使用LimmaGUI检测的差异表达基因[24](在调整后的概率值< 0.05)根据相对变化进行进一步选择,分别使用大于1.3倍或小于0.7倍的截断值定义上调和下调转录本。基于这些标准,我们鉴定出184和175个在豌豆SAM中相对于NM显著上调或下调的转录本。这些转录本基于最好的BLASTX匹配进行了注释,并显示出相对于NM的0.1- 10.7倍的变化(参见附加文件)1&2).编码1型金属硫蛋白(AB176564)的基因发生了0.1倍的变化,注释为的序列发生了10.7倍的变化植物凝集素(AAA33691)。棉花中编码1型金属硫蛋白的类似基因的研究表明,它们在根中大量(尽管不是唯一的)表达。25].与此同时,一个编码营养凝集素的序列在豌豆顶端被观察到高表达[26].这些研究和其他研究列在表中3.提供我们微阵列数据的独立验证。我们还对选定的5个转录本进行了RT-PCR分析,如图所示3.,结果与微阵列数据基本吻合。
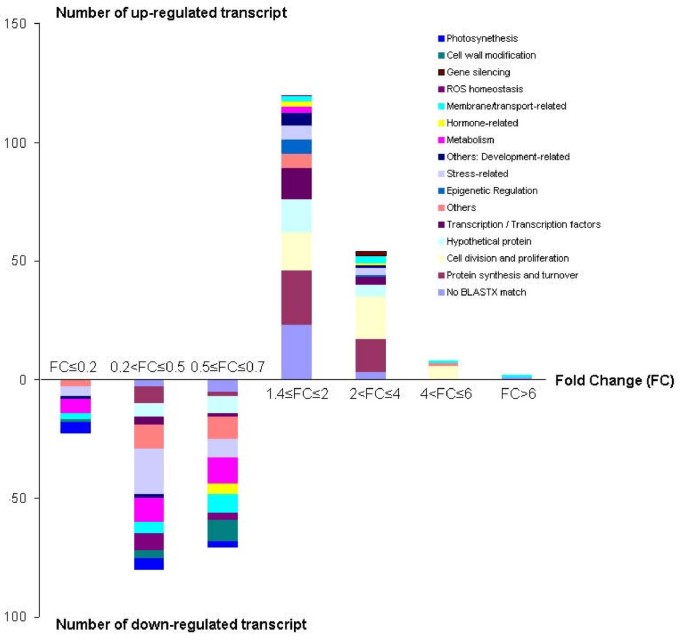
进一步比较在玉米数据中被区别调控的功能类别[25和这项研究(图4)揭示了与转录、染色质和细胞分裂类别相关的转录本在上调的基因列表中高度代表,而被归类为与代谢、应激和光合作用相关的序列在SAM中下调。然而,我们的数据也强调了单子叶植物SAM[玉米,[27]]和双字词SAM(豌豆,目前研究)。特别是,在玉米中报道的高逆转录转座子相关转录活性[27]似乎不是SAM的保守特征,因为它不存在于豌豆的SAM ESTs中。
由于我们研究的SAM由不同的功能区组成,整个SAM的信号平均可能会减弱与任何给定干细胞区域相关的信号。然而,我们的实验表明,编码PROTODERMAL FACTOR 1的序列在SAM中相对于NM上调了1.8倍(表2)3.).一个拟南芥已发现对应基因仅在SAM的最外层(L1层)表达[28].这表明有能力识别特异性表达在SAM某些区域的转录本,尽管相对变化的幅度可能已经减小,低丰度转录本可能已经被遗漏。
对差异表达转录本的进一步检查显示,约60%鉴定的下调序列来自GenBank(表2)4).相比之下,SAMs中高表达的基因中只有12%是从GenBank中检索到的,而其他表达上调的ESTs则来自我们文库的克隆。这并不奇怪,因为GenBank的序列主要来自于SAM以外的组织,而我们的EST收集来自于解剖的SAM。这表明了从特化组织构建文库的重要性,并进一步表明我们收集的EST作为研究植物分生组织功能的分子过程的宝贵资源。同时,检测到的差异表达基因中有30%未被识别,包括注释为假设或表达蛋白的基因,以及在公共数据库中没有BLASTX匹配的序列。这个未知的列表可能代表功能分析中有趣的候选基因。
SAM中的细胞分裂和增殖
根据蛋白序列相似性,116个上调转录本的功能被确定。对相应转录本的手工检查显示,预测编码与细胞分裂和增殖相关的蛋白质的ESTs具有较高的代表性(表2)4;数字4).
表格4表明编码组蛋白所有5个亚型、小染色体维持蛋白和细胞增殖核抗原的ESTs在SAM中表达高于NM。已知这些基因的表达与DNA合成和细胞增殖有关,因此它们在分生组织中大量存在[29,30.因为这个区域由活跃的分裂细胞组成。
在同一类别中,有一个转录本预测编码高迁移率组(HMG)蛋白。HMG是已知在修饰DNA构象中起结构作用以促进多蛋白-DNA复合物组装的蛋白质。它们可能只是维持物理秩序,但这些蛋白质参与调节SAM活性的网络似乎是合理的。这是考虑到最近的研究表明HMG蛋白与植物基因启动子的功能重要区域结合并刺激转录[31].
其他上调的序列包括预测编码细胞周期蛋白D (AB008188)和细胞周期蛋白B (EX570164)的转录本,它们参与细胞周期的进展。d -细胞周期蛋白是细胞增殖的主要限速因子之一,其中一些可能在细胞周期和分生组织功能之间的关联中发挥关键作用,特别是原基的形成[综述于[32]]。
SAM活性的表观遗传调控
在预测编码组蛋白修饰蛋白(EX569897)、染色质重塑因子(EX570366、EX570306和DQ026703)和DNA甲基转移酶(EX568764和AF034419;表格4).已知这些蛋白质通过参与改变染色质结构的机制,从而激活或抑制特定的基因集,在基因表达的表观遗传调控中发挥作用[综述于[33]]。
人们逐渐认识到染色质重塑过程在调节植物干细胞活性方面的重要性[综述于[34]]。例如,突变拟南芥FASCIATA1(FAS1),FASCIATA2(FAS2)编码染色质组装因子亚单位的基因导致SAM功能障碍[35].这与降低管制有关本人这两种突变体中的基因表达,表明染色质重塑因子对分生组织功能和器官发生的调节主要是通过调控同源盒转录因子的表达实现的[35].然而,染色质重塑因子与关键分生组织基因表达调控之间的直接联系仍有待建立。尽管如此,SAM中这些序列表达的上调表明表观遗传调控机制对于维持植物中干细胞的身份很重要,正如在动物中报道的那样[36].
转录因子与SAM活性的激素调节
我们还鉴定了一些在SAM中表达高于NM的基因中的假定转录因子。其中包括一个EST (EX570025),被认为是来自yabby家族蛋白的植物特异性转录因子——据报道,该家族成员参与了植物侧边器官的细胞命运规范拟南芥[37].名单上还有一个预测编码生长素反应因子9 (ARF9;EX570238)。已知生长素反应因子组蛋白质的类似成员调节生长素介导的转录激活或抑制。例如,在ARF7和ARF19双突变体中,一些编码LATERAL ORGAN BOUNDARIES domains蛋白成员和参与器官大小的生长素调控基因的表达被中断,这表明它们在生长素介导的植物发育中起着重要作用[38].
其他可能与生长素相关的基因产物包括一个假定的生长素外排载体(PIN1),生长素偶联蛋白(DWARF IN LIGHT1)和一个核糖体蛋白L24B(附加文件)1、表4).相似的基因拟南芥与生长素介导的发育调节有关[39- - - - - -41].例如,DWARF IN LIGHT1参与生长素信号转导,抑制芽和下胚轴细胞伸长[39].在我们的列表中出现了几个生长素相关转录本,反映了生长素在器官启动和分生组织定位中的既定作用[42,43].
有趣的是,内源性21-核苷酸核调节剂mirna已被证明可以靶向几种与生长素反应有关的mrna,包括DWARF in LIGHT1 [44].越来越多的证据表明,mirna介导的抑制在植物细胞命运调控基因的空间表达中起着重要作用[例如[45]]。已知一种名为ARGONAUTE的蛋白质是rna诱导沉默复合体的催化组分,它以miRNA为导向,以mRNA为目标进行降解[46].然而,在我们的数据集中,注释为编码类似ARGONAUTE的转录本的上调的确切作用(表4)有待进一步研究。
SAM中的应激反应
许多下调的转录本可能与生物和非生物应激反应有关(表5),包括预测编码脱氢酶相关蛋白(AY065655)、病原相关蛋白(AJ586324)、抗病反应蛋白(AF139018)、抗菌防御素(AF525685)和几丁质酶(AB037832)的转录本。这可能是由于茎、叶和根通常比屏蔽良好的SAM暴露在更大的生物或非生物胁迫下,因此前者需要比SAM更高水平的这些基因产物的构成,以维持成功的防御反应。然而,我们发现至少有一个其他序列(EX571142)可能与应激反应有关,其在SAM中表达更高(表2)4).虽然这一现象的分子基础尚不清楚,但相应的编码产物可能在应激反应和发育过程中发挥双重作用。最近的一项研究支持了这一观点,该研究发现水稻基因网络与胁迫反应和种子发育有关[47].
SAM中的ROS稳态
令人惊讶的是,下调的转录本包括各种编码清除或生成ROS的蛋白质的序列,如硫氧还蛋白(AJ319808)、过氧化氢酶(EX568770)、Cu-Zn超氧化物歧化酶(AB189165)、铜胺氧化酶(AB026253)和过氧化物酶(AB087838)。这意味着SAM中的ROS水平低于NM,因此在前者中编码ROS清除剂的基因表达较低。光合作用(ROS的一个来源)的缺失可能解释了SAM中ROS水平较低的原因。然而,越来越多的证据表明,植物利用ROS作为信号分子调节发育和各种生理反应,介导脱落酸诱导的气孔关闭,以及在根中的生长素信号传递和向地性[48].这是否表明ROS在SAM中的调节作用不如在NM中那么突出,有待进一步研究。
光合作用和细胞壁相关转录本
NM区比SAM区更丰富的几个基因被预测与光合作用有关,包括光系统I和II的亚基以及叶绿素-a/b结合蛋白。众所周知,分生细胞不含分化质体,这可能解释了SAM中与光合作用相关的基因表达水平较低的原因。
一些预测编码在纤维素合成中起作用的产物的序列,如纤维素合成酶(EX569643),果胶甲基酯酶(AF056493),木葡聚糖内转糖基酶(AB042531),被发现在SAM中下调。这可能反映了茎叶中的细胞壁结构比分生细胞中薄的初级细胞壁更为复杂[4].
结论
我们从pea SAM收集的EST的开发代表了对SAM功能和维护的理解的重要进步,特别是由于本研究中所展示的SAM相关转录本在公共数据库中的代表性不足。随后使用由ESTs构建的微阵列进行的转录分析实验获得了豌豆SAM的转录特征,我们已经报道了一系列具有假定或未知功能的转录本,这些转录本在SAM中受到不同的调控。在网上对预测基因产物的分析涉及了调节这一发育过程的复杂分子网络中的几个过程。未来对这些基因的研究应该试图揭示它们如何在维持和调节SAM动态的复杂分子网络中相互作用。
方法
植物材料及cDNA文库合成
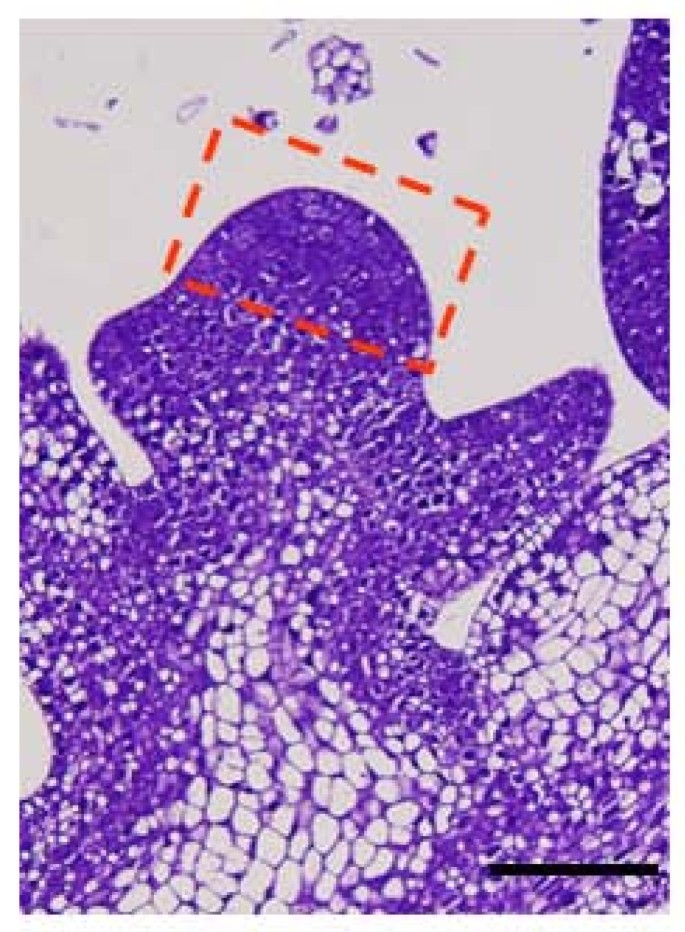
豌豆(Pisum一)栽培品种Torsdag是在位于澳大利亚墨尔本大学的温室中生长的。在40倍放大的解剖显微镜下,对10天大豌豆进行SAMs显微解剖。为了建立一个富含分生组织的组织集合,任何叶原基都被排除,组织样本的位置如图所示5.解剖样品在液氮中快速冷冻,-80°C保存,直到用于RNA提取和cDNA文库合成[49].对于减去的文库,驱动序列来自从非分生组织(NM)组织(包括初级茎(不含腋生分生组织)、成熟叶层、初级根(不含根尖分生组织和根毛)中提取的RNA的等量混合,而测试序列由从解剖SAM中获得的RNA组成。将所有cdna克隆到pBlueScriptIISK+质粒载体中。
EST测序
在澳大利亚澳大利亚基因组研究机构(AGRF)和Macrogen韩国使用T7引物分别从标准(C)、减(S)和标准化(N)文库中随机挑选约500、1000和1500个克隆进行测序。这些序列已存入GenBank,登录号为EX568682至EX571416。
序列分析与注释
序列数据使用SEQTools剔除矢量、适配器和低质量序列[50].短于100个碱基对的修剪序列被排除在进一步分析之外。然后使用SEQTools中基于Blast评分的聚类方法(得分临界值为0.6)对序列进行组装。这种自动聚类产生的所有聚类和单例被认为是我们EST文库最小基因集的最佳估计,我们将这个集称为“unigenes”。
然后将所有序列导入基于web的基因本体(GO)注释和分析工具Blast2GO [21]作后续分析。这涉及到在对NCBI (nr)蛋白质数据库进行相应的单基因序列BLASTX搜索后,与获得的命中相关的GO术语的自动检索。e值截断点设为1e-5。
用于微阵列实验的RNA提取
使用Qiagen RNeasy Mini Kit从解剖的SAM(每次提取约80个SAM)或其他植物部位(主茎、主根和成熟叶)中提取总RNA。每次微阵列杂交实验分别进行四次独立的组织收集和RNA提取(指定为A、B、C和D)。
豌豆SAM Combimatrix CustomArray™4X2K设计
Combimatrix阵列是基于半导体的寡核苷酸微阵列,并基于Combimatrix技术(超链接)生成原位合成(51].CustomArray™4x2k是一个微阵列,分为4个扇区,每个扇区可以包含多达2240个不同的寡核苷酸探针(点),可以使用提供的扇区杂交帽单独与不同的目标杂交。共有1686个豌豆序列(290个序列来自C库,利用开源的CombiMatrix探针设计系统,从GenBank豌豆蛋白数据库中随机抽取500条豌豆序列,从S文库中提取300条序列,从N文库中提取1086条ESTs)提交探针设计。探针长度在35-40个碱基之间。各种各样的控制元件也排列在幻灯片上,这些包括空白点,管家基因(肌动蛋白)以及非植物转基因。
微阵列靶的制备和杂交
目标制备和杂交在澳大利亚基因组研究设施有限公司(AGRF)进行,根据标准CombiMatrix协议详细描述在http://www.combimatrix.com/docs/PTL005_00_4x2K_%20Hyb_%20Imaging.pdf.使用Kreatech的ULS™RNA ampULSe试剂盒对来自SAM或NM的1微克总RNA进行标记,生成Cy5或Cy3标记的靶标。然后根据平衡块设计双标记实验方案将Cy5或cy3标记的cDNA杂交到芯片的不同扇区[23]:
第1区:Cy3-SAM A vs Cy5-NM A
第二部分:Cy5-SAM B vs Cy3-NM B
第三部分:Cy3-SAM C vs Cy5-NM C
第四部分:Cy5-SAM D vs Cy3-NM D
图像采集和数据分析
然后根据制造商的说明,使用Genepix 4000B微阵列扫描仪(Axon Instruments, CA, USA)扫描Cy5和cy3杂交芯片。然后将生成的tiff图像文件导入Combimatrix Microarray Imager以生成强度数据。LimmaGUI软件是实证贝叶斯线性建模方法的实现,用于对结果数据进行后续统计分析[24].在阵列归一化中选择了稳健样条方法,并使用Benjamini-Hochberg程序调整p值计算最小二乘线性模型拟合。SAM中全部差异表达转录本(p值< 0.05)列在附加文件中1及附加文件2.微阵列数据已存入基因表达综合数据库[20.],注册编号为GSE9278。
rt - pcr分析
在所有RT-PCR分析中,按照制造商的说明使用单管双酶Access RT-PCR系统(Promega, Annandale, New South Wales, Australia)。以10日龄豌豆幼苗SAM、成熟茎、成熟叶和初根中提取的10ng RNA为模板,反应体积为10 μl。豌豆肌动蛋白基因作为内对照。在含0.1 μg/μl溴化乙锭的1%琼脂糖凝胶中分离PCR反应的循环次数为25 ~ 28 ~ 80%,并在紫外光下观察。
缩写
- 山姆:
-
茎顶分生组织
- 纳米:
-
non-meristem
- 美国东部时间:
-
表达序列标记。
参考文献
- 1.
李志强,李志强,李志强,等。茎尖分生组织细胞分化与器官启动的关系。植物学报,2006,26(6):811-826。10.1007 / s11103 - 005 - 2761 - 6。
- 2.
Bhalla PL, Singh MB:茎尖分生组织中干细胞维持的分子控制。植物学报,2006,25(4):249-256。10.1007 / s00299 - 005 - 0071 - 8。
- 3.
Singh MB, Bhalla PL:植物干细胞有自己的定位。植物科学进展,2006,11(5):241-246。10.1016 / j.tplants.2006.03.004。
- 4.
刘志刚,李志刚,李志刚,李志刚。植物干细胞的多能性与全能性:依赖性与自主性。植物科学进展,2007,12(6):245-252。10.1016 / j.tplants.2007.04.002。
- 5.
鲍曼,李志刚,李志刚:植物种子芽的形态和极性。植物科学进展,2008,29(1):67-88。10.1146 / annurev.arplant.57.032905.105356。
- 6.
劳克斯·T,梅耶尔·KFX,伯杰·J,尤根斯·GWUSCHEL该基因是拟南芥芽和花分生组织完整所必需的。发展,1996,122(1):87-96。
- 7.
Carles CC, Fletcher JC:茎尖分生组织的维持:动态平衡的艺术。植物科学进展,2003,8(8):394-401。10.1016 / s1360 - 1385 (03) 00164 - x。
- 8.
布利克斯特:豌豆。遗传学手册。编辑:RC K. 1974,纽约:全会出版社,第2卷:181-221。
- 9.
Weeden NF, Muffet M:影响JI 1794 × ' Slow ' RIL群体根质量和根冠比的基因鉴定。植物遗传学报,2002,34:28-31。
- 10.
Taylor SA, Hofer JMI, Murfet IC, Sollinger JD, Singer SR, Knox MR, Ellis THN:增殖花序分生组织这是一种调控豌豆花分生组织特性的MADS-box基因。植物生理学报,2002,29(3):344 - 344。10.1104 / pp.001677。
- 11.
Foucher F, Morin J, Courtiade J, Cadioux S, Ellis N, Banfield MJ, Rameau C:定而且晚开花是两个终端FLOWER1 / CENTRORADIALIS控制豌豆开花起始和发育两个不同阶段的同源物。植物细胞学报,2003,15(11):2742-2754。10.1105 / tpc.015701。
- 12.
李文杰,李志刚,李志刚,李志刚:花大小和比例的遗传调控。中国生物医学工程学报,2005,29(5):513- 524。10.1387 / ijdb.051998jw。
- 13.
Murfet IC, Reid JB:豌豆开花和节间长度的控制。豌豆作物。编辑:Hebblethwaite PD, Heath MC, Dawkins TCK。1985年,伦敦:巴特沃斯,67-80。
- 14.
宋文杰,马基,苏林杰,Plotz J, Fitzgerald K, Fishbach J, Mullen H: AP1同源物PIM在豌豆花发育中的作用。中国生物医学工程学报,2002,27(2):518-518。
- 15.
Sollinger JD, Singer SR:用豌豆发育突变体揭示花——同源性和隐藏的潜力。中国生物医学工程学报,2002,27(2):444-445。
- 16.
Gourlay CW, Hofer JMI, Ellis THN:豌豆复叶结构受基因间相互作用的调控UNIFOLIATA,COCHLEATA,AFILA,TENDRIL-LESS.植物学报,2000,12(8):1279-1294。10.1105 / tpc.12.8.1279。
- 17.
Tattersall AD, Turner L, Knox MR, Ambrose MJ, Ellis THN, Hofer JMI:突变体crispa揭示多个角色妄想在豌豆复叶发育中。植物细胞学报,2005,17(4):1046-1060。10.1105 / tpc.104.029447。
- 18.
Yaxley JL, Jablonski W, Reid JB:豌豆叶与花的发育(Pisum一l .):突变体cochleata而且unifoliata.植物学报,2001,32(2):344 - 344。10.1006 / anbo.2001.1448。
- 19.
Wong CE, Li Y, Whitty BR, Diaz-Camino C, Akhter SR, Brandle JE, Golding GB, Weretilnyk EA, Moffatt BA, Griffith M:来自育空生态型的表达序列标签Thellungiella揭示了对寒冷、干旱和盐度反应的基因表达几乎没有重叠。植物分子生物学,2005,58(4):561-574。10.1007 / s11103 - 005 - 6163 - 6。
- 20.
国家生物技术信息中心。[http://www.ncbi.nlm.nih.gov/]
- 21.
Conesa A, Gotz S, Garcia-Gomez JM, Terol J, Talon M, Robles M: Blast2GO:功能基因组学研究中注释、可视化和分析的通用工具。生物信息学,2005,21(18):3674-3676。10.1093 /生物信息学/ bti610。
- 22.
拟南芥基因调控信息服务器。[http://arabidopsis.med.ohio-state.edu/AtTFDB/]
- 23.
Dobbin K, Simon R:类比较和类发现微阵列设计的比较。生物信息学,2002,18(11):1438-1445。10.1093 /生物信息学/ 18.11.1438。
- 24.
Wettenhall JM, Smyth GK: limmaGUI:微阵列数据线性建模的图形用户界面。生物信息学,2004,20(18):3705-3706。10.1093 /生物信息学/ bth449。
- 25.
胡斯培,王志刚,王志刚,王志刚,王志刚,王志刚:棉花金属硫蛋白类基因的鉴定与表达。植物分子生物学,1996,V31(3): 731 - 731。10.1007 / BF00042243。
- 26.
Dobres MS TWF:豌豆发育调控芽特异转录物与种子凝集素序列相似。植物生理学报,2004,27(3):344 - 344。
- 27.
Ohtsu K, Smith MB, Emrich SJ, Borsuk LA, Zhou R, Chen T, Zhang X, Timmermans MCP, Beck J, Buckner B, Janick-Buckner D, Nettleton D, Scanlon MJ, Schnable PS:玉米茎尖分生组织整体基因表达分析(玉米l .)。植物学报,2007,52(3):391-404。10.1111 / j.1365 - 313 x.2007.03244.x。
- 28.
杨春梅,高桥勇,高田勇:植物L1层特异性基因的克隆与鉴定拟南芥.植物生理学报,1999,40(6):571- 581。
- 29.
张志刚,田冈刚,张志刚:组蛋白基因在细胞周期中的表达调控。植物学报,2000,V43(5): 643-657。10.1023 /: 1006421821964。
- 30.
Kosugi S, Suzuka I, Ohashi Y, Murakami T, Arai Y:水稻增殖细胞核抗原(pcna)基因上游序列介导pcna-gus嵌合基因在转基因烟草植物分生组织中的表达。核酸研究,1991,19(7):1571-1576。10.1093 / nar / 19.7.1571。
- 31.
Webster CI, Packman LC, Gray JC: HMG-1增强了HMG-I/Y与豌豆塑青素基因中富含A/ t的增强子元件的结合。中国生物化学杂志,2001,26(4):344 - 344。10.1046 / j.1432-1327.2001.02191.x。
- 32.
黄志刚,张志刚,张志刚,等:茎尖分生组织中细胞周期基因的表达。植物学报,2006,30(6):344 - 344。10.1007 / s11103 - 006 - 0011 - 1。
- 33.
谢廷峰,费希尔RL:染色质动力学生物学。植物科学进展,2005,26(3):337 - 341。10.1146 / annurev.arplant.56.032604.144118。
- 34.
周晓东,周晓东,陈晓明,陈晓明,陈晓明:染色质重构对分生组织活性的调控。植物科学进展,2005,10(7):332-338。10.1016 / j.tplants.2005.05.003。
- 35.
Kaya H, Shibahara K, Taoka K,岩渊M, Stillman B,荒木T:FASCIATA染色质组装因子-1基因拟南芥维持顶端分生组织的细胞组织。中国生物医学工程学报,2001,40(1):344 - 344。10.1016 / s0092 - 8674(01) 00197 - 0。
- 36.
《染色质重塑与干细胞相对论》。中国生物医学工程学报,2004,31(1):1-16。10.1002 / jcp.20071。
- 37.
Siegfried KR, Eshed Y, Baum SF, Otsuga D, Drews GN, Bowman JL:成员淡水螯虾基因家族决定了细胞的命运拟南芥.《发展与发展》,1999,26(4):344 - 344。
- 38.
Okushima Y, Overvoorde PJ, Arima K, Alonso JM, Chan A, Chang C, Ecker JR, Hughes B, Lui A, Nguyen D, Onodera C, Quach H, Smith A, Yu GX, Theologis A:功能基因组分析生长素反应因子基因家族成员拟南芥:功能的独特和重叠ARF7而且ARF19.植物细胞学报,2005,17(2):444-463。10.1105 / tpc.104.028316。
- 39.
Nakazawa M, Yabe N, Ichikawa T, Yamamoto YY, Yoshizumi T, Hasunuma K, Matsui M: DFL1是一种生长素响应GH3基因同源物,负向调控茎部细胞伸长和侧根形成,正向调控下胚轴长度的光响应。植物学报,2001,25(2):213-221。10.1046 / j.1365 - 313 x.2001.00957.x。
- 40.
西村T,和田T,山本KT,冈田K:拟南芥生长素介导的雌蕊模式形成需要STV1蛋白,负责翻译再启动。植物细胞学报,2005,17(11):2940-2953。10.1105 / tpc.105.036533。
- 41.
植物生长素运输-定型。植物学报,2003,6(1):7-12。10.1016 / S1369526602000031。
- 42.
Reinhardt D, Mandel T, Kuhlemeier C:生长素调控植物侧器官的起始和径向位置。植物学报,2000,12(4):507-518。10.1105 / tpc.12.4.507。
- 43.
Reinhardt D, Pesce ER, Stieger P, Mandel T, Baltensperger K, Bennett M, Traas J, Friml J, Kuhlemeier C:生长素极性转运对叶生性的调控。自然科学学报,2003,26(6):344 - 344。10.1038 / nature02081。
- 44.
Mallory AC, Bartel DP, Bartel B: microrna对拟南芥的调控生长素反应因子17对正常发育和调节早期生长素反应基因的表达至关重要。植物细胞学报,2005,17(5):1360-1375。10.1105 / tpc.105.031716。
- 45.
Nagasaki H, Itoh J, Hayashi K, Hibara K, Satoh-Nagasawa N, Nosaka M, Mukouhata M, Ashikari M, Kitano H, Matsuoka M, Nagato Y, Sato Y:水稻芽分生组织启动需要小干扰RNA产生途径。中国科学院学报,2007,44(3):357 - 357。10.1073 / pnas.0704339104。
- 46.
Hutvagner G, Simard MJ: Argonaute蛋白:RNA沉默的关键角色。分子细胞生物学杂志,2008,9(1):22-32。10.1038 / nrm2321。
- 47.
Cooper B, Clarke JD, Budworth P, Kreps J, Hutchison D, Park S, Guimil S, Dunn M, Luginbuhl P, Ellero C, Goff SA, Glazebrook J:水稻胁迫响应和种子发育相关的基因网络。《美国国家科学院学报》上。2003, 100(8): 4945-4950。10.1073 / pnas.0737574100。
- 48.
Apel K, Hirt H:活性氧:代谢,氧化应激和信号转导。植物学报,2004,29(3):344 - 344。10.1146 / annurev.arplant.55.031903.141701。
- 49.
- 50.
Rasmussen软件:SEQtools,一个用于分析核苷酸和蛋白质序列的软件包。2006年,(http://www.seqtools.dk]
- 51.
Combimatrix公司。[http://www.combimatrix.com]
确认
我们感谢Andrea Merrell和Cathy Jensen对豌豆分生组织解剖的帮助。这项工作得到了澳大利亚研究理事会卓越中心的支持。CEO348212)授予墨尔本大学综合豆科研究卓越中心节点。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
CEW进行EST分析,参与微阵列实验和RT-PCR分析,并撰写稿件。PLB和MBS负责项目的设计,分生组织显微解剖的标准化和组织,EST文库的制作,实验和稿件编辑的整体协调。HO对EST文库的描述和EST序列分析做出了贡献。所有作者都阅读并批准了最终的手稿。
电子辅助材料
12870 _2007_281_moesm1_esm.xls
附加文件1:与非分生组织(NM)相比,豌豆芽顶端分生组织(SAM)中的转录本被鉴定为上调。(xls 42 kb)
12870 _2007_281_moesm2_esm.xls
附加文件2:与非分生组织(NM)相比,豌豆芽顶端分生组织(SAM)中的转录本被鉴定为下调。(xls 42 kb)
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
王正英,巴勒,p.l.,奥滕霍夫,H。et al。豌豆茎尖分生组织的转录分析揭示了其功能和维持的过程。BMC植物生物学8,73(2008)。https://doi.org/10.1186/1471-2229-8-73
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-8-73
关键字
- 基因本体论
- 茎尖分生组织
- 生长素反应因子
- 染色质重塑因子
- 澳大利亚基因组研究机构