摘要
背景
植物细胞器运输的细胞骨架机制与肌动蛋白功能密切相关。这一功能是由肌凝蛋白头部与f -肌动蛋白的连接以及货物与尾部的结合所介导的。肌动蛋白还能促进植物细胞的细胞质流动。肌凝蛋白头与f -肌动蛋白为基础的运动之间的联系较少被研究。拟南芥.
结果
我们在多种植物的表皮细胞中表达了MYA2的gfp融合头颈结构域,并发现它与F-actin有关。与其他标记物如fimbrin和talin相比,我们发现肌球蛋白标记的f -肌动蛋白质量较低,并且不在细胞皮层的细微丝阵列中。然而,它与细胞质(跨空泡)f -肌动蛋白共定位于与快速细胞器轨迹一致的区域。在表达GFP-MYA2-head6IQ的细胞中,细胞器流减少的事实表明,无功能的运动蛋白抑制内源性肌球蛋白。此外,GFP-MYA2-head6IQ与其他f -肌动蛋白标记的共表达破坏了其与f -肌动蛋白的连接。在细胞核中,gfp -肌球蛋白与短束的f -肌动蛋白相关。
结论
MYA2的潜在作用也可能存在于细胞核中。与其他f -肌动蛋白结合蛋白(ABPs)相比,MYA2-head6IQ的低质量f -肌动蛋白标记是否意味着肌凝蛋白与肌动蛋白丝的弱关联仍有待通过其他方法来证明在活的有机体内.迄今为止,肌凝蛋白分子与f -肌动蛋白接触方式的线索还不能从序列相关数据中得出。
背景
在真核细胞中,肌动蛋白系统对于控制不同物质的传递很重要[1- - - - - -3.].肌凝蛋白马达沿肌动蛋白丝表现出定向步进,大多数马达能同时结合细胞目标。植物肌球蛋白介导多种细胞器的靶向作用,如高尔基体[4], ER [5,6],线粒体[7,8],质体[9,10],原子核[11].肌动蛋白系统也参与植物细胞周期[12],细胞分裂[13- - - - - -15],生长素转运[13,16].
与肌球蛋白相关的运动的某些特征可能是植物细胞所特有的。例如,动物体内需要微管的过氧化物酶体靶向依赖于肌动蛋白微丝[17]和肌球蛋白[18- - - - - -20.]在植物中。21,22].拟南芥[23].它们与动物和真菌中的V类肌凝蛋白有几个共同特征。这些特征之一是极长的颈部,通常由6个IQ基基组成,可能通过与钙调蛋白或类钙调蛋白肌凝蛋白轻链结合来调节肌凝蛋白活性[22].根据杠杆臂模型,高智商会放大肌凝蛋白头的运动力[24,25].26- - - - - -28].近期运动分析拟南芥肌凝蛋白,AtMYA129],然而,显示与发现的表皮细胞的细胞质流的速度很一致拟南芥[16,30.].
植物细胞的细胞骨架运动性与特定的细胞结构密切相关[22,31,32].一般来说,质膜下的皮层f -肌动蛋白支持周围结构,包括细胞壁和微管网络。皮层处的细网向下方区域即细胞质突出,f -肌动蛋白的长索穿过空泡链。细胞皮层的f -肌动蛋白网可能在短距离运输中起作用,并与皮层微管共同作用[33- - - - - -37],而细胞质区域较长的f -肌动蛋白链可能与旺盛的细胞运动有关。这就提出了一个问题,即f -肌动蛋白的这些不同任务是否与肌凝蛋白并行。
拟南芥植物细胞中的肌动蛋白丝。我们瞬时表达了一种gfp融合蛋白,包含运动和颈部结构域AtMYA2(MYA2-head6IQ),并寻找其在各种细胞类型中的定位。GFP-MYA2-head6IQ与标准的f -肌动蛋白结合蛋白产生不同的f -肌动蛋白标记模式。此外,我们发现GFP-MYA2-head6IQ与其他f -肌动蛋白结合蛋白相似,可能通过阻断内源性肌球蛋白来干扰细胞运动。
结果
MYA2的头部与跨空泡微丝结合,但不与细胞皮层的细f -肌动蛋白网结合
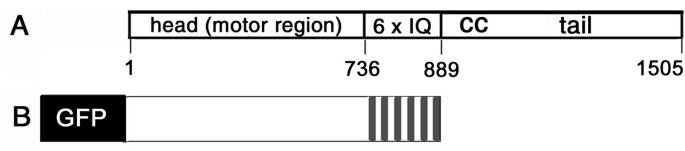
AtMYA2的电机头和6个iq(图。1)导入植物表达载体pCAT-GFP和pBIN。融合蛋白GFP-MYA2-head6IQ的表达;1 b),导致肌动蛋白丝的标记。Western blot分析证实MYA2-GFP-head6IQ基因被完全转译(图。2).的表皮细胞中洋葱(无花果。3 a, B),烟草benthamiana(无花果。3 c和无花果。4),或Sinapis阿尔巴(无花果。5 j-l),这种构造的f -肌动蛋白修饰显示了一个向细胞皮层延伸的丝状网络,电缆穿过纵向的和以核为导向的细胞质链。
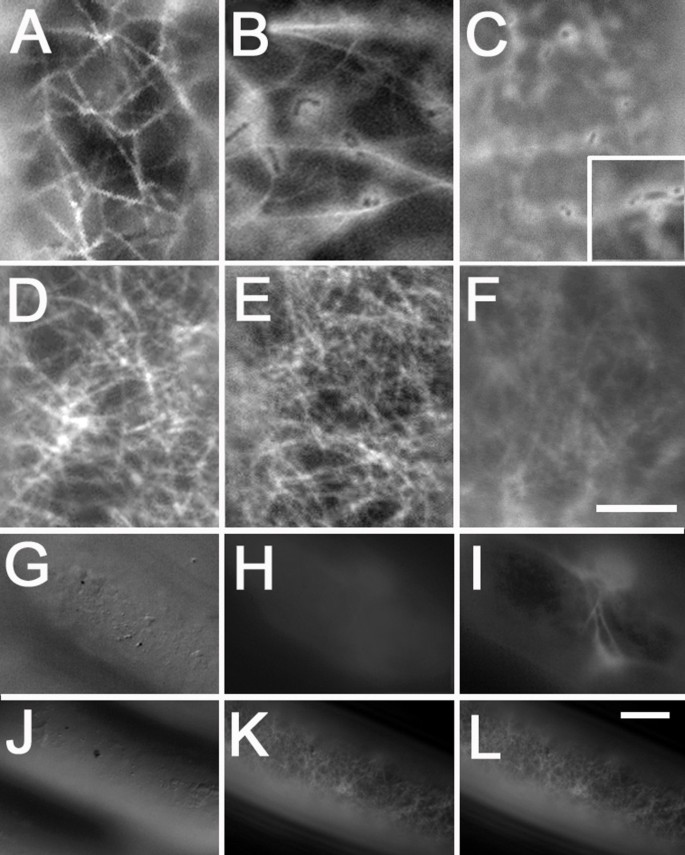
GFP荧光在不同植物细胞中定位GFP- mya2 - head6iq和F-actin.(A-C, G, I) f肌动蛋白可视化GFP-MYA2-head6IQ。为了进行比较,使用RFP-FABD2 (D, H, J)和GFP-FABD2 (E)或YFP-mTn (F)来显示F-肌动蛋白。(G)和(H)中的面板显示了F-肌动蛋白在三种不同深度的细胞中的分布。GFP-MYA2-head6IQ和RFP-FABD2信号的核定位如图(I)和(J)所示。(I*, J*)和(I**, J**)中的图像分别来自穿过细胞核中心和细胞核外围的光学切片。(A)的表达时间为6-7小时,除(C, F)的表达时间为5天外,其他图像的表达时间为15小时答:cepa除(C)和(F)代表叶表皮细胞外n benthamiana.I中的棒材,J = 5 μm。其他图像中的条形条均为15 μm。
与RFP-FABD2相比,GFP-MYA2-headIQ的亚细胞定位答:cepa.在转化后6-8小时(A)、15小时(B)和28小时(C), gfp - mya2 -head- 6iq显示f -肌动蛋白。单独表达GFP会导致细胞质信号扩散(见C)。在转化后15 h (D)、25 h (E)和2 D (F),通过RFP-FABD2显示F-肌动蛋白。f -肌动蛋白网的空间差异可用GFP-MYA2-head6IQ (G-I)或RFP-FABD2 (J-L)标记。(G)和(J)的DIC图像显示的细胞上表面的焦点平面(金颗粒可见为黑点)与对应的荧光图像(H)和(K)相比。(G, H)和(J- l)的图像来自同一平面,而(I)的图像来自5 μm以下的平面。Bar为(A-F), (F) = 5 μm, (G-L), (L) = 10 μm的图像。
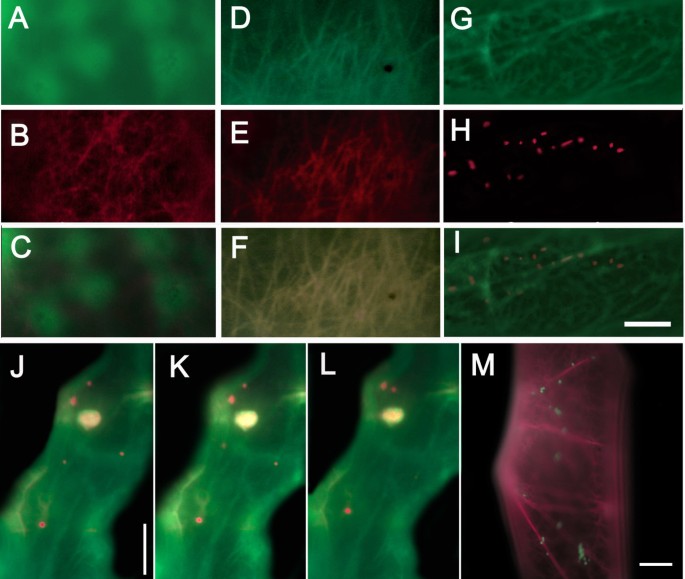
不同植物细胞中GFP-MYA2-head6IQ和RFP-FABD2在微丝亚群和过氧化物酶体通路中的f -肌动蛋白结合.(A-I)融合蛋白在cepa:GFP-MYA2-head6IQ (A)与RFP-FABD2 (B), YFP-mTn (D)与RFP-FABD2 (E)和GFP-MYA2-head6IQ (G)与mcherry (H)融合过氧化物酶体标记。合并图像分别描述在(C), (F)和(I)中。(J-L)一个表皮细胞的两秒间隔图像Sinapis子叶与GFP- mya2 - head6iq(绿色为GFP)和过氧化物酶体标记物(红色为mcherry)共同转化。(M)细胞的共转化答:cepaRFP- fabd2(红色为RFP)和过氧化物酶体标记物(绿色为CFP)。在转化后15 h (A-I)或18 h (J-M)拍摄宽视场荧光图像。上面板所有图像的Bar in (I) = 5 μm。(J-M) = 10 μm的棒材。
这种模式在所有被检查的细胞中都一致地显示出来,微丝网络的密度没有差异;它与表达水平无关。由于GFP-MYA2-head6IQ产生的网适用于典型的f -肌动蛋白组织,我们测试了与其他f -肌动蛋白结合蛋白的可能差异。我们使用了GFP-talin (mTn)和RFP-或GFP-FABD2,其中含有肌动蛋白结合域2拟南芥已知fimbrin 1在活植物细胞中产生最佳质量的f -肌动蛋白成像[38- - - - - -42].为了进行比较,我们将这些荧光耦合的ABPs引入到相同的植物组织中(图2)。3 d-f).
由于双35s启动子的强表达,在转化后不久(6-8小时)就出现了头颈融合的荧光信号,并与f -肌动蛋白明显相关(图。3).然而,f -肌动蛋白成像显示,GFP-mTn-和RFP-或gfp - fabd2标记的网络比GFP-MYA2-head6IQ显示的相对松散的网格要密集得多。3 a - c、G与3 d-f H和无花果。4 a、B与4 d, E).表达肌球蛋白头融合蛋白的细胞呈丝状模式,交联较少,细胞质背景稍高。在较长的表达时间后,GFP-MYA2-head6IQ信号在细胞质中逐渐增多,并在不同的细胞位点积累(图。3 b和无花果。4 b).此外,GFP-MYA2-head6IQ产生较少受限的信号(图。3 g)而不是RFP-FABD2信号(图;3 h),画出细丝的轮廓。因此,与其他ABPs相比,肌球蛋白修饰的微丝通常略宽。3与3 b,无花果。4 a、B与4 d, E和无花果。5克与5度而且5 f).在转染后超过一天,GFP-MYA2-head6IQ分子几乎完全定位在细胞质中(图2)。4摄氏度),而RFP-FABD2标记的f -肌动蛋白在至少25 h内保持不变。4 d, E),仅在转化后2 d时由于细胞活力的正常衰退而消失(图。4 f).
f -肌动蛋白报告基因RFP-FABD2在细胞核附近也产生不同的丝状图案。GFP-MYA2-head6IQ标记高荧光短束细胞核(图。3我)或偶见细胞核内或靠近细胞核的荧光斑块(图。3我* * * /);这些在表达RFP-FABD2的细胞中是不存在的。3 j).
通常,RFP-和gfp - fabd2标记的肌动蛋白丝出现在不同的细胞部位:微丝从细胞皮层向质膜延伸,微丝穿过细胞质链(图2)。3 e,见图。5米).GFP-MYA2-head6IQ标记的微丝仅在细胞内部区域发现。当f -肌动蛋白网的平面在显微镜下聚焦时,从细胞的最上面的表面开始(图2)。4g i k l).当比较表达GFP-MYA2-head6IQ或RFP-FABD2的细胞时,很明显,fabd2标记的f -肌动蛋白网的焦点平面几乎与细胞表面的焦点平面相同(图2)。4 k, L).相反,肌球蛋白标记微丝的主要焦点平面从未出现在这些皮质区域(图。4 g H),但分布在细胞表面以下5 μm以上的区域。4我).
GFP-MYA2-head6IQ解离迅速,不能与其他ABPs竞争
为了进一步检测F-actin标记的差异,同时将GFP-MYA2-head6IQ和RFP-FABD2引入细胞(图2)。5 a - c).肌动蛋白丝完全由纤维蛋白修饰(图。5度),而肌凝蛋白完全定位于细胞质(图。5).为了测试其他ABPs是否以类似的方式反应,由于可能的结合位点竞争或沿F-actin的有限空间,RFP-FABD2与YFP-mTn共表达。结果,一个相似的肌动蛋白网络被可视化,完全重叠的信号(图。5 d-f).所有ABPs均未表现出增强的细胞质定位。当YFP-mTn与GFP-MYA2-head6IQ共表达时,肌凝蛋白再次与丝状肌动蛋白分离(数据未显示)。然而,如果GFP-MYA2-head6IQ在类似条件下与过氧化物酶体标记物共同表达,则其标记能力被保留(图2)。5胃肠道).
GFP-MYA2-head6IQ的过表达干扰了细胞器的快速运动
然后,我们质疑mya2修饰的肌动蛋白丝是否反映了细胞质运动的主要途径。为了解决这个问题,我们将重点放在细胞器流最活跃的细胞质链上,并将其分布与GFP-MYA2-head6IQ信号分布进行比较。我们还通过联合轰击过氧化物酶体标记物和GFP-MYA2-head6IQ或RFP-FABD2融合来检测细胞中的过氧化物酶体靶向(图2)。5 j-m).最有力的细胞器运动被观察到在纵向和核导向链,与肌动蛋白索一起,占据了细胞的更多内部(细胞质)区域。因此,过氧化物酶体高速公路似乎与GFP-MYA2-head6IQ标记的更厚、更纵向的细丝一致(图2)。5 j-l)或RFP-FABD2(图;5米).过氧化物酶体的明显拉长形状,与图中心的肌球蛋白标记链共分布。5 h提示在成像过程中细胞器快速移动。
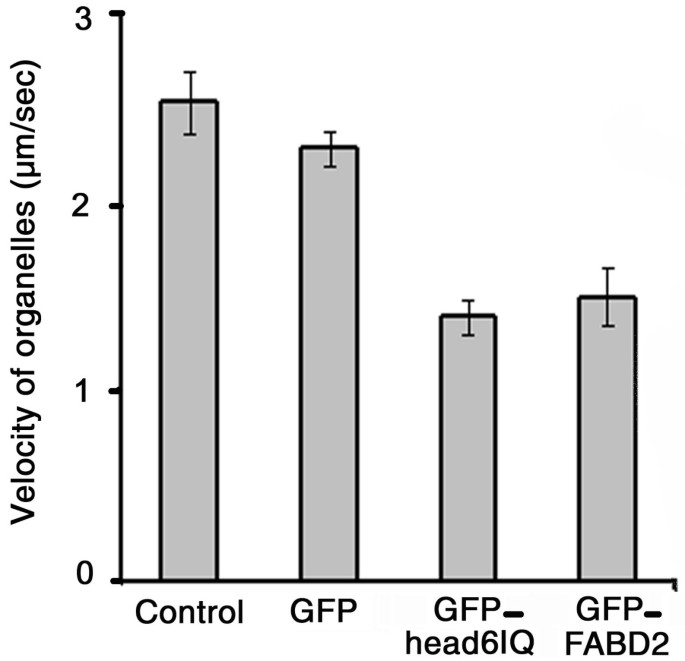
由于细胞器的转运是由肌凝蛋白介导的,其他f -肌动蛋白结合蛋白的过表达有望通过阻断肌凝蛋白与肌动蛋白丝的连接来干扰细胞质流。如前所述,过表达GFP-mTn和GFP-FABD2对细胞质流的主要负面影响是存在的[16].为了研究过量的GFP-MYA2-head6IQ是否会干扰内源性肌球蛋白与f -肌动蛋白的结合,我们改造了答:cepa并利用延时图像测量了最大流速度。仅关注快速移动的粒子以获得“平均最大速度”已被证明是评估细胞质流变化的合适方法[16].在未转化细胞中,平均最大速度为2.5 μm/sec;GFP-MYA2-head6IQ和GFP-FABD2的表达降低了约40%,而ABPs之间没有显著差异(图2)。6).在仅表达GFP的对照细胞中,平均最大速度显著降低约10%(以99%的显著性水平计算)。因此,可以合理地假设肌球蛋白或纤维蛋白蛋白过表达引起的最大流速度的净降低约为30%。
肌凝蛋白头部结构域潜在肌动蛋白结合区域的比较
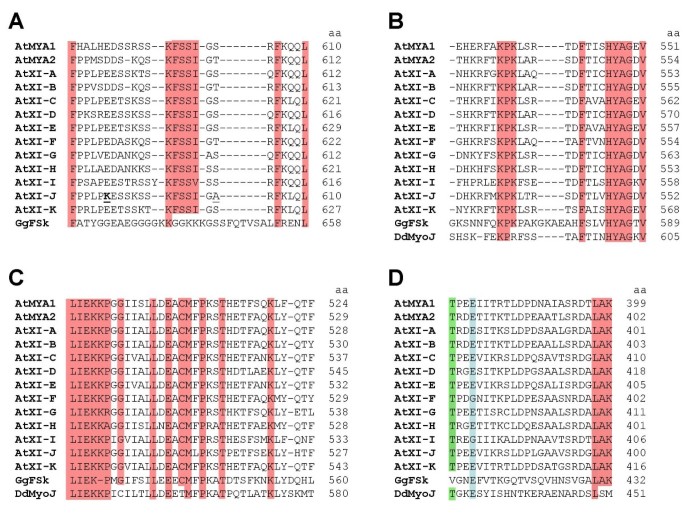
肌凝蛋白运动结构域的结构分析揭示了肌动蛋白与肌凝蛋白接触的不同区域和表面环[43- - - - - -45].为了找到MYA2-head6IQ与F-actin相互作用的可能线索,我们将几个环的氨基酸序列和TEDS规则位点[46拟南芥,从盘基网柄菌肌球蛋白(DdMyoJ)和骨骼肌肌球蛋白(GgFSk)(图。7).第一个肌动蛋白结合位点部分由环2授予(图2)。7一个).在所有序列中,它含有一个或两个带负电的氨基酸和4-6个带正电的氨基酸。因此,即使环2序列相当分散,它们具有相似的离子强度。
肌凝蛋白头部的几种潜在肌动蛋白结合位点与TEDS位点的比较.拟南芥DdMyoJ和肌球蛋白GgFSk。(A)表面环2参与第一个肌动蛋白单体的结合。(B)建议结合第二肌动蛋白的区域。(C)在主要肌动蛋白结合过程中调节主要接触的区域。(D) TEDS规则位点有谷氨酸(蓝色阴影)和苏氨酸(绿色阴影)。在拟南芥,弟弟盘基网柄菌discoideum, Gg背带吊裤带.红色阴影部分为保守氨基酸。DdMyoJ从(A)中的对齐中被排除。根据Schröder等人的表面环路。[45].在每个序列中,最后一个氨基酸残基的位置被指示(aa)。
例外的是,AtXI-J具有其他序列中不存在的电荷和极性的额外变化(下划线部分)。净正电荷也普遍存在于次级肌动蛋白结合位点(图。7 b).在所有序列中,共有15-16个疏水氨基酸残基位于一个保守区域,这有助于初级肌动蛋白结合(图2)。7 c).以这些氨基酸命名的TEDS规则位点通过某些肌凝蛋白的磷酸化调节运动活动[46],所有序列都有一个不可磷酸化的和带负电荷的谷氨酸(图。7 d).然而,DdMyoJ和所有植物肌球蛋白的TEDS位点附近都有可磷酸化的苏氨酸残基。
讨论
细胞器流动的生物学,就肌凝蛋白沿f -肌动蛋白丝运动而言,是一个谜。尽管最近关于肌凝蛋白尾巴的实验极大地促进了我们对植物肌凝蛋白靶相关功能的理解[18- - - - - -20.,47],植物肌凝蛋白与f -肌动蛋白的相互作用仍不完全清楚。
由于肌凝蛋白被确定为肌动蛋白丝为基础的生化机器,大量的在体外研究已经确定了它们的生物物理特性,包括速度、功率和f -肌动蛋白结合亲和力[48,49].植物肌球蛋白与f -肌动蛋白相互作用的研究仍然有限,可能是由于从组织或异源表达系统中获得蛋白质的困难。尽管如此,为了研究两者之间的相互作用拟南芥肌球蛋白MYA2和肌动蛋白丝在活的有机体内显微技术结合瞬时表达分析。这种方法利用了发生在活细胞中的复杂性,包括细胞骨架相互作用物的存在和可能涉及肌动蛋白功能的因素。前面介绍的使用方法mya2突变体(30.]由于检测到第二次删除而无法实现[50].尽管GFP-MYA2-head6IQ在所有植物物种中都得到了成功的表达,但我们无法识别表达GFP-MYA2-head6IQ的细胞拟南芥具有适合f -肌动蛋白成像的质量。细胞的小尺寸和蛋白质的扩散倾向,再加上植物转化的问题,阻碍了我们维持同源系统的计划。
GFP-MYA2-head6IQ信号产生与长细胞质f -肌动蛋白链一致的模式
如图所示,MYA2融合到GFP的头颈部是有功能的,可以识别丝状肌动蛋白。在表皮细胞中,它优先标记细胞质区域的微丝,即跨空泡链,而在皮质F-actin中很少发现。而其他ABPs,如GFP-FABD2或YFP-mTn,更普遍地与F-actin相关,GFP-MYA2-head6IQ在细胞皮层的精细阵列中不存在。观察到肌凝蛋白头部经常平行于快速流动的细胞器通路,这表明它与长距离运输特有的f -肌动蛋白种群有关。
问题是如何确定这种特异性。肌动蛋白的组装和重塑受到多种ABPs的调控,这些ABPs识别肌动蛋白池或控制肌动蛋白的稳定性[39,51- - - - - -53].例如,在花粉管中,不同的肌动蛋白聚合物结合域融合到GFP上,标记了不同的f -肌动蛋白群[54].也许肌凝蛋白根据肌动蛋白单体的组成或动力学来区分肌动蛋白聚合物,或者在其他f -肌动蛋白或肌凝蛋白结合蛋白的帮助下。例如,一个不太活跃的肌动蛋白网可能存在于支持长距离运输的肌凝蛋白所识别的细胞质链中。肌球蛋白重链为蛋白质-蛋白质相互作用提供了多种可能性。侧链产生的排斥力和吸引力、离子强度、磷酸化或与其他蛋白质的结合都能对肌凝蛋白马达的结合和运动产生积极或消极的影响[见参考文献中相应章节]。49]]。与丝状肌动蛋白结合的能力甚至可以由肌凝蛋白尾巴决定[2,55].以MYA2为例,尾部本身缺乏f -肌动蛋白结合能力[19,20.].
根据motif识别程序[56,57], MYA2的头部子结构域包括F-actin-和atp结合位点以及磷酸化位点。其他motif的功能尚不清楚,如Myosin N或sh3样结构域(氨基酸残基10-53),MurB(662-716)和FARP(207-217)。颈部区域(735-889),继运动核之后,包含6个IQ基序,被认为与肌凝蛋白轻链结合,可能是钙调蛋白[58].原肌凝蛋白样结构域可增强传统肌凝蛋白II中的f -肌动蛋白结合,其范围从氨基酸851-1058。基于这些数据,不可能更精确地预测MYA2与肌动蛋白丝的关联。f -肌动蛋白与其他ABPs(如FABD2)的亲和性研究显示其化学计量为1:4 [40]而在mTn存在时,adf介导的f -肌动蛋白翻转被抑制[59].由于的困难在体外蛋白质的产生,没有对MYA2进行这样的检测。此外,我们无法对ABPs的自然状况得出结论。28,60],因为这个域没有包含在我们的构造中。
MYA2在细胞核中的潜在作用
过表达ABPs后细胞核内荧光信号的增加似乎是MYA2特异性的。其他abp,如GFP-mTn [61]和GFP-或RFP-FABD2,从未产生类似的积累,不能用不同的分子量来解释,因为肌凝蛋白要大得多(130.5 kD而其他ABPs小于70 kD)。GFP-MYA2-head6IQ信号在细胞核内或细胞核内产生明显的杆状结构,使人联想到在烟草细胞核沟槽和内陷中观察到的肌动蛋白束[62].考虑到这些发现和其他观察显示肌凝蛋白i依赖RNA聚合酶II的核转运[63],我们的观察表明MYA2可能在mRNA输出中起作用。MYA2是否在细胞周期和细胞分裂中起作用还需要进一步分析。
GFP-MYA2-head6IQ的定位提示体内f -肌动蛋白结合较弱
与其他f -肌动蛋白标记物相比,GFP-MYA2-head6IQ诱导的丝状信号质量较低,不能完全由过度表达或蛋白质降解引起的人工效应解释。瞬态分析的表达时间短,蛋白在叶片中表达n benthamiana转化后5 d以上仍有功能。其次,在共表达实验中,即使GFP-MYA2-head6IQ蛋白的数量大大超过RFP-FABD2,但细胞仍表现出相对正常的RFP-FABD2-actin网络。尽管皮质f -肌动蛋白的质量略有下降,但我们既没有检测到微丝束也没有检测到解聚(图2)。5度).此外,该网络的质量与仅表达GFP的细胞相似(数据未显示)。已知GFP产生的细胞质信号不会严重影响f -肌动蛋白的功能(也可与图。6).
然而,在所有表达GFP-MYA2-head6IQ的细胞中观察到的细胞质信号斑块表明,相当数量的分子没有与肌动蛋白丝结合。这种情况不能用f -肌动蛋白上的结合位点数量少来解释,因为肌凝蛋白经常与它结合[28,49],微丝装饰丰富。即使这些斑块可能表明细胞质肌动蛋白链的一些破坏,这种长丝亚群仍然被保留下来,并且能够维持与GFP-FABD2非常相似的细胞器运输(见图2)。6).
肌凝蛋白扩散行为的另一种解释可能是头部无法与FABD2或mTn竞争。这种无能可能指向f -肌动蛋白结合的不同机制,这对肌凝蛋白头来说可能更弱。最近在体外用AtMYA1重组头进行的运动分析显示,f -肌动蛋白结合状态的比例很高[29].这表明它与f -肌动蛋白紧密接触,在活的有机体内.
然而,ABPs的模块化布局以及与其他因素的潜在共同作用在活的有机体内可能会以完全不同的方式影响f -肌动蛋白结合。在fp -融合的研究中拟南芥Fimbrin 1 [64,65], f -肌动蛋白结合从一个更明显的网络到增强的细胞质定位,这取决于用于不同结构的序列长度。因此,观察到的GFP-MYA2-head6IQ与f -肌动蛋白的弱相关性可能是这些条件的结果在活的有机体内或者与MYA2蛋白的内在特征有关。
肌凝蛋白上的多个点可以协调肌动蛋白丝的结合,包括表面环和正电荷或负电荷。关于这些接触的想法来自传统肌球蛋白的高分辨率晶体学[44,45].不同门之间的肌凝蛋白表面环存在一些相似和保守的氨基酸。我们比较了鸡肌肉肌凝蛋白中的TEDS位点和表面环,盘基网柄菌而且拟南芥还揭示了重要氨基酸残基的守恒,表明离子强度和疏水性的一致性。植物肌球蛋白中肌动蛋白结合残基与其他门的肌动蛋白结合残基之间的高度功能守恒可能表明与f -肌动蛋白有类似的接触。23而在DdMyoJ中无法预测。分析植物肌凝蛋白的动力学和力学特性可能是进一步了解f -肌动蛋白结合模式的关键。通过头部截断或氨基酸残基突变解剖肌凝蛋白的模块化组织也可能有助于解决这个问题。
GFP-MYA2-head6IQ以与其他ABPs相似的方式影响细胞质流
在以前的一项研究中表明,通过只选择一个单元中三个速度最快的粒子来确定最大流速度的方法可获得可靠的值和较小的标准偏差[16].与这些结果一致,包括abp在表皮细胞过表达后的速度降低拟南芥,我们观察到GFP-FABD2使细胞的最大速度降低了至少30%答:cepa.GFP-MYA2-head6IQ的表达具有同样的效果。根据竞争实验,MYA2的头部似乎被FABD2取代,可能预期肌凝蛋白的流更严重的减少。有趣的是,其他作者报道,肌凝蛋白AtXI-K尾部的过度表达几乎停止了细胞器运动[47].GFP-MYA2-head6IQ分子置换内源性肌球蛋白引起的负面影响相对较低,这可能是由不同的情况解释的。
首先,细胞中通常存在多种肌凝蛋白异构体。大量报告表明,拟南芥18- - - - - -20.,47].然而,它们的尾巴或RNAi的过表达所产生的负面影响在不同的异构体中表现出高度的差异[47].
其次,保存完好的流动可能是复杂结构的结果,这种结构赋予内源性肌凝蛋白更好的f -肌动蛋白结合能力。28]对于细胞器的快速运输是必不可少的[29].如果内源性肌凝蛋白的二聚化增强了f -肌动蛋白结合,而f -肌动蛋白结合本身就激活了肌凝蛋白atp酶[48,66],可能会有截然不同的肌凝蛋白结合和滑动动力学。最后,其他子域,如尾部[2,55],可以影响肌动蛋白-肌凝蛋白复合物,从而保护内源性肌凝蛋白免受GFP-MYA2-head6IQ或其他gfp -融合ABPs的干扰。
结论
MYA2的作用也可能存在于细胞核中。不同门间肌凝蛋白上潜在肌动蛋白结合位点的比较,不能假设f -肌动蛋白与肌凝蛋白异构体之间的不同接触拟南芥.到目前为止,在活细胞条件下,这种接触在MYA2头颈部的情况下似乎很弱,这要么表明一种灵活的结合模式,要么可能涉及其他因素,如肌凝蛋白尾巴或其他细胞骨架蛋白。
方法
构造
的编码区AtMYA2[TAIR: At5G43900] [66(图。1通过RT-PCR从拟南芥(Arabidopsis (Columbia))叶片中获得cDNA,扩增出该基因。使用GFP-FABD2矢量[41], pCAT-GFPm3的衍生物[68],我们准备了一个n端gfp融合,电机头为AtMYA2包括颈部结构域(MYA2-head6IQ,氨基酸残基1-889,图;1 b)用于蛋白质的瞬时表达。用于MYA2-head6IQ构建的PCR引物为5'-ATAGATCTTATGGTTGCTAACTTCAATCCAT作为正向引物和5'- ATACTAGTTTGGCTGCTTGGAGTGCTCCAGTTTCTCTA作为反向引物。PCR产物用相应的酶切割Bgl二世和SpeI(如下划线所示)并连接到pCAT-GFPm3载体Bam你好,Spe我的网站。同样含有35S启动子的载体也用于单独表达GFP。蛋白质在细胞中的表达n benthamiana,剪切含有GFP-MYA2-head6IQ的pCAT-GFPm3表达盒后III和4.6 kb片段用同样切割的二进制表达载体pBIN20连接后3重组基因经测序验证。除了单独包含GFP的pCAT结构外,我们还使用了GFP- fabd2 [41和RFP-FABD2 (P. Nick的善意礼物,未发表;根据RFP-Arp3克隆到瞬时35S-p2RGW7 Gateway载体(Invitrogen公司)和含有35S-YFP-mTn表达盒的载体[69]用于f -肌动蛋白的可视化。对于过氧化物酶体定位,我们使用RFP和CFP融合1型过氧化物酶体靶向信号[19].
植物转化
在转换的情况下洋葱,在无菌条件下从洋葱鳞茎表皮上切下切片,放在6厘米的培养皿中,培养皿中含有一半浓度的MURASHIGE和SKOOG盐和维生素(DUCHEFA)、0.1% MES、1% (w/v)蔗糖和1.5% (w/v)琼脂(ROTH)。如果Sinapis阿尔巴10 d老植株子叶向后方转化。如前所述,表皮细胞被包裹有DNA的金颗粒轰击[70].转化后,将培养皿在23℃黑暗中放置5-30 h。通常在表达6-8小时后,观察gfp标记的肌凝蛋白头。较长的表达时间用于各种目的,如蛋白质解离分析或竞争分析。
用于农杆菌对烟叶的渗透烟草benthamiana用含有pCAT-GFP或pCAT-GFP- mya2 - head6iq表达盒的二元质粒载体pBIN20的农杆菌浸润叶片。同时在pBin61中浸润35S-P19可获得更高的蛋白表达峰值[71被证明可以减少农杆菌感染后的基因沉默。在23°C下生长5 d后,从叶表皮上拍摄图像,在蛋白质表达高峰时,70%以上的表皮细胞显示荧光。
本草叶中头部蛋白表达的生化测定
将叶片在液氮中研磨,约200 mg叶粉中的蛋白质提取物在以下SDS缓冲液中以1:1.5 (w/v)的比例煮沸5分钟制备:65 mM Tris/HCl pH 7.5, 4 M尿素,3-5% SDS, 10% β -巯基乙醇,15%甘油和0.05%溴酚蓝。分别取GFP- mya2 - head6iq蛋白提取物25 μl和GFP单用蛋白提取物10 μl进行SDS-PAGE电泳和免疫印迹分析。一抗gfp抗体(来源于兔;用Acris)检测gfp融合,用抗兔碱性磷酸酶偶联抗体(Calbiochem)作为二抗。使用宽范围(6-175 kD)预染色蛋白质标记物(New England Biolabs)来估计蛋白质的分子量。用硝基蓝四氮唑/5-溴-4-氯-3-吲哚酰磷酸溶液(Roche)制备印迹。
显微镜
活细胞和荧光成像采用Zeiss (Jena, Germany) AxioImager Z1,配备Zeiss AxioCam和Axio Vision Rel. 4.5软件。GFP荧光在470 nm激发,525 nm发射,CFP为436/480 nm。通过560/645 nm的滤光片记录RFP和mcherry。为避免YFP- mtn和RFP-FABD2共表达时荧光漏过,用GFP滤波器组记录YFP。此外,在仅表达YFP-mTn的细胞中测试了暴露于RFP激发的极限(极限为1.0秒)。在共表达实验中,RFP被激发的时间较短。由于GFP-MYA2-head6IQ的扩散倾向,宽视场荧光显微镜使用300至700 msec之间的曝光时间,证明是研究其分布的快速和适当的方法。
图像用Adobe Photoshop 5.5处理。图中的图像。3 (A, D)表示用63 ×物镜以1 μm为增量,用显微镜的Apotome函数对20幅光学切片图像进行三维投影。以这种方式观察了15个细胞。图中的图像。3 (B, C, E, F)是激光扫描显微镜(蔡司LSM 510)用63 × (B, E)和40 × (C, F)物镜(n = 30个细胞)拍摄的光学切片图像的3D投影。无花果。3 (B, E),每个单元以1 μm为增量取25个光学切片。无花果。3 (C、F)大约15个光学切片以2 μm的增量拍摄。图中的图像。3 (G H, I, J)除(I*, J*)和(I**, J**)外,其余均来自宽视场荧光显微镜,它们代表了apomome函数所拍摄的穿过核区域的两个光学切片。图中的图像。4而且5由常规(宽视场)荧光显微镜制成。图中每张图像观察到的细胞数为15个。4 (f)10美元4 (G-L)图中每幅图像n = 5。5.
为了确定由不同ABPs标记的f -肌动蛋白网之间的空间差异,每个结构的10个细胞的最上表面用40 ×或63 ×物镜的DIC光学聚焦。然后,在相应的激发波长下缓慢地穿过z轴,观察μm显示,直到f -肌动蛋白网清晰可见。
为了测定细胞器的最大流动速度,用63 ×平面复色剂油浸系统,采用DIC光学系统提供的N.A 1.4物镜观察细胞。我们关注的是所有种类的粒子,而没有指定细胞器。每个结构的12-16个细胞(= n)中40-50个粒子的速度,使用30个时间序列图像以1秒间隔拍摄,并使用图像J逐帧分析(美国国立卫生研究院,贝塞斯达)。由于单个单元中粒子的速度范围很广,在每个单元中选择三个速度最快的粒子被证明是一种快速和直接的方法,产生的标准偏差低。在图像J中的滚动函数监测下,这些粒子在快速易位过程中(5-20 μm)一直被跟踪。image J的“分析-测量”函数确定第一幅图像和最后一幅图像之间被粒子覆盖的距离(μm),并除以各自的图像数,即秒。为了确定细胞器速度电位差异的统计学意义,数据通过单向方差分析(ANOVA)进行分析,然后是一个学生t-在90%和99%显著性水平上进行检验。计算误差条的标准误差(图2)。6).
序列比对
序列拟南芥肌球蛋白来源于TAIR [72],用于AtMYA1 [AT1G17580], AtMYA2 [AT5G43900], AtXI-A [AT1G04600], AtXI-B [AT1G04160], AtXI-C [AT1G08730], AtXI-D [AT2G33240], AtXI-E [AT1G54560], AtXI-F [AT2G20290], AtXI-H [AT4G28710], AtXI-I [AT4G33200], AtXI-J [AT3G58160]和AtXI-K [AT5G20490]。的序列盘基网柄菌肌球蛋白DdMyoJ从[SwissProt:。P54697],鸡肌肉肌球蛋白GgFSk的表达[SwissProt:P13538]。名字就像霍奇和柯普的树[73].使用CLUSTAL W (version 2.0.2)按输入序列对表面环的氨基酸残基进行比对[74].第三个环涉及初级肌动蛋白结合[45没有包括在内。由于相似度太低,DdMyoJ被排除在图中。7一个.
参考文献
Mermall V, Post PL, Mooseker M:细胞运动、膜运输和信号转导中的非常规肌凝蛋白。科学通报,1998,29(3):344 - 344。
肌球蛋白:一个多样化的超级家族。生物化学生物物理学报。2000, 1496: 3-22。
李志刚,李志刚,李志刚,李志刚,等。肌动蛋白对植物细胞功能的影响。多德雷赫特。荷兰:Kluwer学术出版社;2000.
Nebenführ A, Gallagher LA, Dunahay TG, Frohlick JA, Mazurkiewicz AM, Meehl JB, Staehelin LA:植物高尔基堆叠的走走停停运动是由肌动蛋白系统介导的。植物科学学报,2004,29(4):457 - 457。
李志强,李志强,李志强,李志强苦草属叶肉细胞。中国生物医学工程学报,2004,27(3):357 - 357。
Šamaj J, Peters M, Volkmann D, balujka F:肌凝蛋白atp酶抑制剂2,3-丁二酮2-单辛酯对玉米根尖肌凝蛋白、F-肌动蛋白、微管和皮层内质网分布的影响。植物生理学报,2000,41:571-582。
Romagnoli S, Cai G, Faleri C, Yokota E, Shimmen T, Cresti M:微管和肌动蛋白丝依赖的马达分布在花粉管线粒体上,对它们的运动有不同的贡献。中国生物医学工程学报,2007,29(4):344 - 344。
Van Gestel K, Köhler RH, Verbelen JP:植物线粒体在f -肌动蛋白上移动,但它们在皮层细胞质中的定位同时依赖于f -肌动蛋白和微管。应用物理学报,2002,32(3):359 - 367。
Paves H, Truve E:肌球蛋白抑制剂阻断拟南芥叶细胞中叶绿体的积累运动。中国生物工程学报,2007,29(3):344 - 344。
中国生物医学工程学报,2004,29(3):344 - 344。
Heslop-Harrison J, Heslop-Harrison Y:被子植物花粉粒和花粉管中与细胞器、营养核和生殖细胞表面相关的肌球蛋白。中国生物医学工程学报,1999,19(3):319- 324。
新月藻peracerosum-strigosum-littorale有性生殖过程中表达的复杂性与分析。植物科学学报,2006,29(3):344 - 344。
霍维格C, Honsel A, Nick P:一种肌球蛋白抑制剂破坏生长素诱导的细胞分裂。中国生物工程学报,2003,27(3):344 - 344。
Molchan TM, Valster A, Hepler PK:肌动球蛋白促进山羊草雄蕊毛细胞板排列和晚期横向扩张。植物学报,2002,29(3):344 - 344。
Reichelt S, Knight AE, Hodge TP, baluhka F, Šamaj J, Volkmann D, Kendrick-Jones J:植物细胞中非传统肌凝蛋白VIII的特征及其在细胞动力学后细胞壁的定位。植物学报,1999,19:555-567。
Holweg CL:肌动蛋白的活标记物阻断植物细胞器和生长素依赖肌球蛋白的运动。中国生物医学工程学报,2006,29(2):344 - 344。
马涛J,马涛N, Hülskamp M:植物过氧化物酶体和细胞骨架元件的同时可视化显示肌动蛋白而不是微管基础的过氧化物酶体运动。中国生物医学工程学报,2002,29(4):344 - 344。
中国生物医学工程学报,2005,29(4):344 - 344。
中国生物医学工程学报,2007,28(3):344 - 344。
Reisen D, Hanson MR: 6个yfp -肌球蛋白xi -尾部融合与移动植物细胞器的关联。中国生物医学工程学报,2007,7:6-
分子马达及其在植物中的功能。中国生物医学工程学报,2001,29(4):457 - 457。
石门T:细胞质流的滑动理论:五十年的进展。中国植物学报,2004,27(3):344 - 344。
Reddy ASN, Day IS:分析最近完成的拟南芥基因组序列中编码的肌凝蛋白。中国生物工程学报,2001,2:研究0024-
张志刚,张志刚,张志刚:步长对人体肌肉运动的影响。中国生物医学工程学报,2005,44(1):1 - 8。
Moore JR, Krementsova EB, Trybus KM, Warshaw DM:肌凝蛋白V颈区域是否起杠杆作用?JMRCM。2006, 25: 29-35。
Higashi-Fujime S, Ishikawa R, Iwasawa H, Kagami O, Kurimoto E, Kohama K, Hozumi T:绿藻中最快的肌动蛋白基马达蛋白,轮藻,以及其与肌动蛋白相互作用的独特模式。农学通报,1995,37(3):344 - 344。
Morimatsu M, Nakamura A, Sumiyoshi H, Sakaba N, Taniguchi H, Kohama K, Higashi-Fujime S:绿藻中最快肌球蛋白的分子结构。生物化学学报,2000,27(3):357 - 357。
环境科学学报,2003,26(3):344 - 344。
中国生物医学工程学报,2007,29(3):344 - 344。
《美国国家科学院学报》上。2004, 30(4): 457 - 457。
海鸥RW, Falconer MM, Weerdenburg CA:微丝:高等植物细胞的动态阵列。中国生物医学工程学报,2007,27(4):344 - 344。
向细胞内肌动蛋白骨架传递信号。植物化学学报,2000,29(3):357 - 357。
Blancaflor E:皮层肌动蛋白丝与皮层微管相互作用调节玉米初生根细胞扩张极性(玉米l .)。植物生长学报,2000,19(4):406-414。
Brown SS:微管和肌动蛋白马达蛋白之间的合作。中国生物医学工程学报,1999,30(4):344 - 344。
柯林斯,李儿,李文杰,吴志强,吴志强:对细胞骨架拮抗剂的超敏反应显示微管-微丝串音在控制植物根伸长中的作用拟南芥.植物科学学报,2006,27(3):344 - 344。
Huang JD, Brady ST, Richards BW, Stenoien D, Resau JH, Copeland NG, Jenkins NA:微管-肌动蛋白运输马达的直接相互作用。自然科学,1999,37(3):357 - 357。
Ketelaar T, de Ruijter NCA, Emons AMC:不稳定的F-Actin指定拟南芥根毛细胞扩张的面积和微管方向。植物学报,2003,29(3):344 - 344。
koval DR, Gibbon BC, McCurdy DW, Staiger CJ:荧光标记纤维蛋白修饰活植物细胞中的动态肌动蛋白丝。植物学报,2001,29(3):349 - 349。
McCurdy DW, Kovar DR, Staiger CJ:高等植物中的肌动蛋白及其结合蛋白。生物工程学报,2001,29(3):344 - 344。
Sheahan MB, Staiger CJ, Rose RJ, McCurdy DW:拟南芥纤维蛋白与肌动蛋白结合结构域2的绿色荧光蛋白融合突出了植物细胞动态肌动蛋白骨架的新特征。植物科学学报,2004,26(3):366 - 366。
Voigt B, Timmers A, Šamaj J, Müller J, balukka F, Menzel D: GFP-FABD2融合构建可在拟南芥幼苗所有细胞中动态肌动蛋白细胞骨架的体内可视化。中国生物医学工程学报,2005,34(4):595-608。
王玉生,刘cm, Blancaflor EB:转基因拟南芥中肌动蛋白丝状体的绿色荧光蛋白融合到纤维蛋白蛋白结合结构域的C端和N端。中国植物学报,2008,27(3):344 - 344。
Rayment I, Rypniewski WR, Schmidt-Bäse K, Smith R, Tomchick DR, Benning MM, Winkelmann DA, Wesenberg G, Holden HM:肌凝蛋白亚片段-1的三维结构:分子马达。科学通报,1993,26(3):344 - 344。
Holmes KC, Angert I, Kull FJ, Jahn WRR, Schröder RR:电子冷冻显微镜显示肌凝蛋白与肌动蛋白强烈结合释放核苷酸。自然科学,2003,29(4):344 - 344。
Schröder RR, Manstein DJ, Jahn W, Holden H, Rayment I, Holmes KC, Spudich JA:修饰F-actin的三维原子模型盘基网柄菌肌凝蛋白S1。自然科学学报,1993,29(3):344 - 344。
Bement WM, Mooseker MS: TEDS规则:重链头磷酸化对肌凝蛋白差异调控的分子理论基础。中国生物医学工程学报,2004,27(3):357 - 357。
Avisar D, Prokhnevsky AI, Makarova KS, Koonin EV, Dolja VV:植物叶片细胞中高尔基层、过氧化物酶体和线粒体快速转运的肌球蛋白i - k烟草benthamiana.植物物理,2008年1月4日。
Kron SJ, Spudich JA:荧光肌动蛋白丝在固定在玻璃表面的肌凝蛋白上移动。自然科学进展,2006,29(3):366 - 366。
王志强,王志强,王志强。2003,中国机械工程学报(自然科学版)
自然科学进展,2008,29 (3):349 - 349
Ayscough凯西:在活的有机体内肌动蛋白结合蛋白的功能。中国生物医学工程学报,2004,19(4):344 - 344。
胡秀玲,王志强,王志强:植物细胞生长过程中肌动蛋白骨架的调控。植物学报,2006,29(4):529 - 529。
Pollard TD, Almo S, Quirk S, Vinson V, Lattman EE:肌动蛋白结合蛋白的结构:关于原子分辨率功能的见解。中国生物医学工程学报,2004,27(4):349 - 349。
Vidali L, Hepler PK:肌动蛋白与花粉管生长。原生质体,2001,29(4):344 - 344。
李志强,李志强,李志强,等。棘阿米巴肌凝蛋白(IC)末端磷脂和肌动蛋白结合位点的定位与鉴定。中国生物医学工程学报,1997,17(6):457 - 457。
专家蛋白质分析系统。[http://www.expasy.org/]
横田E,武藤S,石门T: Ca2+离子对高等植物肌球蛋白的抑制调控。植物科学学报,2004,27(3):344 - 344。
Ketelaar T, Anthony RG, Hussey PJ:绿色荧光蛋白- mtalin引起拟南芥肌动蛋白组织和细胞扩张缺陷并抑制肌动蛋白解聚因子的体外活性。植物科学学报,2004,26(3):366 - 366。
山本K, Kikuyama M, Sutoh-Yamamoto N, Kamitsubo E, Katayama E:电子显微镜下发现的海藻肌球蛋白的独特结构。中华生物医学杂志,1995,26(3):357 - 357。
张志刚,张志刚,张志刚:哺乳动物肌动蛋白与植物细胞核微丝的结合。植物学报,2004,4:7-
Collings DA, Carter CN, Rink JC, Scott AC, Wyatt SE, Allen NS:植物核可以包含广泛的凹槽和内陷。中国生物医学工程学报,2000,29(4):344 - 344。
- dragovich L, Stojiljkovic L, Philimonenko AA, Nowak G, Ke Y, settlement RE, Shabanowitz J, Hunt DF, Hozak P, de Lanerolle P:细胞核中的肌球蛋白I亚型。科学通报,2000,29(3):337-341。
Kovar DR, Staiger CJ, Weaver E, McCurdy DW: At-Fim1是一种肌动蛋白丝交联蛋白拟南芥.植物学报,2000,24:625-636。
王玉生,Motes CM, Mohamalawari DR, Blancaflor EB:绿色荧光蛋白融合拟南芥fimbrin 1对根系f -肌动蛋白动态的时空成像。中国生物医学工程学报,2004,29(2):344 - 344。
李志刚,李志刚,李志刚,王志刚,王志刚。肌动蛋白/原肌凝蛋白对平滑肌肌球蛋白Mg2+- atp酶活性的影响。中国生物医学工程学报,1997,26(4):539 - 539。
王海燕,王晓峰,王晓峰,等。植物生长发育过程中肌球蛋白基因家族的分子分析拟南芥.植物化学学报,2004,26(4):339 - 339。
Ketelaar T, Allwood EG, Anthony R, Voigt B, Menzel D, Hussey PJ:肌动蛋白相互作用蛋白AIP1对肌动蛋白组织和植物发育至关重要。中华动物医学杂志,2004,14:145-149。
布兰迪,李晓明,李晓明,李晓明。烟草叶片内质网和高尔基体间膜蛋白转运的能量依赖与细胞骨架无关:选择性光漂白的证据。中国生物医学工程学报,2002,30(4):344 - 344。
Holweg C, Süsslin C, Nick P:捕捉在活的有机体内生长素或光刺激下肌动蛋白细胞骨架的动力学。中国生物医学工程学报,2004,45:855-863。
Voinnet O, Rivas S, Mestre P, Baulcombe D:番茄矮丛病毒p19蛋白抑制基因沉默的增强植物瞬时表达系统。植物学报,2003,33(4):344 - 344。
拟南芥信息资源。[http://www.arabidopsis.org/]
Hodge T, Cope MJ:肌凝蛋白家族树。中国生物医学工程学报,2000,29(3):344 - 344。
欧洲生物信息学研究所。[http://www.ebi.ac.uk/Tools/clustalw2/]
确认
我们感谢Boris Voigt和Diedrik Menzel (Universität Bonn,德国)提供pCAT-GFP-FABD2结构,Jan Maisch和Peter Nick (Universität Karlsruhe,德国)提供RFP-FABD2, Federica Brandizzi(密歇根州立大学,美国)提供YFP-mTn, Andreas Nebenführ(诺克斯维尔大学,田纳西州,美国)提供过氧化物酶体标记,Olivier Voinnet (CNRS, Straßbourg,法国)提供P19质粒。感谢瓦伦蒂娜·海因茨对工厂改造的帮助。这项工作得到了德国Forschungsgemeinschaft的支持,研究经费“Eigene Stelle”,项目编号:Ho 3327。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
NW进行了克隆、生物转化和部分显微工作。CLH实施了工作构想,进行了生化和微观研究,并撰写了手稿。
权利和权限
本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用属性许可协议(http://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
沃尔特,N,霍维格,c。l拟南芥BMC植物生物学8日,74(2008)。https://doi.org/10.1186/1471-2229-8-74
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-8-74
关键字
- 肌动蛋白丝
- 肌凝蛋白的头
- 胞质环流
- 表面循环
- 胞质链