摘要
背景
最新研究表明,小分子抗菌肽在植物的先天防御系统中起着重要作用。这些多肽通常通过在发芽种子周围或植物器官内不同组织层之间形成保护屏障来促进预先形成的防御。在主动防御过程中,编码基因也可能被生物和非生物刺激上调。多肽显示出广泛的抗菌活性。它们强大的抗致病特性确保了它们在医疗和农业生物技术领域是有希望的靶标。
结果
一种浆果特有的cDNA序列Vv-AMP1,V它vinifera一个ntimicrobialpeptide1,从葡萄.Vv-AMP1编码77个氨基酸肽,显示序列同源的植物防御素家族。Vv-AMP1在特定的组织中表达,发育调节的方式,仅在浆果成熟开始和以后的浆果组织中表达。用生物或非生物因子处理叶片和浆果组织,不会导致基因表达增加Vv-AMP1在测试条件下。预测的Vv-AMP1信号肽与绿色荧光蛋白(GFP)融合,表明信号肽允许其产物在外质体中积累。Vv-AMP1肽,在大肠杆菌,经质谱测定其分子质量为5.495 kDa。重组Vv-AMP1具有极高的热稳定性,对广泛的植物病原真菌表现出很强的抗真菌活性,对引起枯萎病的病原体具有非常高的活性尖孢镰刀菌而且黄萎病dahliae.Vv-AMP1肽没有引起处理真菌菌丝的形态变化,而是强烈抑制菌丝的伸长。碘化丙啶摄取实验表明Vv-AMP1的抑制活性可能与改变真菌膜的通透性有关。
结论
一个浆果特异的cDNA克隆,Vv-AMP1被分离并鉴定,并显示编码植物防御素。重组Vv-AMP1对多种真菌表现出非形态发生的抗真菌活性,可能改变了真菌病原体的膜渗透性。这种肽的表达在葡萄这暗示了浆果成熟过程中重要的防御作用。
背景
植物不断受到微生物的攻击,特别是植物病原真菌,并使用各种防御策略来保护自己免受疾病的侵袭。这些防御包括加强物理细胞壁屏障[1]以及生产化学和蛋白质抗菌化合物[2- - - - - -6].在过去的15年里,富含半胱氨酸的小肽也成为植物抵御植物病原体的整体防御的一部分,对植物的先天免疫有重要贡献[7- - - - - -10].有人认为所有的植物都具有这样的肽防御系统[8].多肽的大小在2-9 kDa之间,最典型的例子是硫蛋白和防御素[7,8,10- - - - - -15].防御素最初被分离出来时,被归类为γ-硫蛋白,但由于其结构和功能与昆虫和人类防御素相似,后来被重新命名为植物防御素[16- - - - - -18].
植物防御素是一类基本的、富含半胱氨酸的多肽,大小在45-54个氨基酸之间。在结构上,它们由一个α-螺旋和一个β-薄片组成,其中包括三条反平行的β-链,并通过在半胱氨酸残基之间形成二硫键桥而稳定[19- - - - - -22].尽管植物防御素在结构上是保守的,但它们在氨基酸水平上的整体同源性很低。然而,大多数植物防御素含有8个半胱氨酸残基,由4个二硫桥连接,一个芳香残基位于第11位,两个甘氨酸位于第13位和第34位,一个谷氨酸位于第29位(编号根据Rs-AFP1 [23])。
大多数植物防御素表现出一定的抗菌活性,抑制真菌、卵菌和革兰氏阳性菌的生长在体外.植物防御素发挥抗真菌活性的确切机制尚不清楚,但有证据表明,植物防御素与真菌膜上的一个特定受体结合,即鞘脂,而不是随机结合并整合到真菌膜的磷脂双分子层[24- - - - - -31].其他生物活性,如蛋白酶和α-淀粉酶抑制[22,32,33]、金属公差[34],以及一些分离出的植物防御素对蛋白质翻译和HIV增殖的抑制作用也有报道[35- - - - - -37].
大多数防御素是从植物种子中分离出来的[35- - - - - -43],但也从树叶中分离出防御素[23,44],花[45- - - - - -49],块茎[50],种子荚[38],以及水果[51- - - - - -53].尽管植物防御素在预先形成的防御中发挥着重要作用,但在病原体攻击或环境刺激下,一些防御素家族成员的表达也会上调,而其他成员的表达则受到严格的发育调控[34,51,52,54- - - - - -59].
在这里,我们报道了第一个植物防御素的分离和特征葡萄.该肽编码基因显示出严格的组织特异性和发育调控的表达模式。该肽具有很强的抗真菌作用,而不会引起被测真菌菌丝的形态变化,但对真菌膜有一定的影响。成熟特异性表达模式在浆果和强在体外分离肽的抗真菌特性引起了人们的兴趣在活的有机体内浆果防御系统的作用。
结果
的分离和基因组特征Vv-AMP1
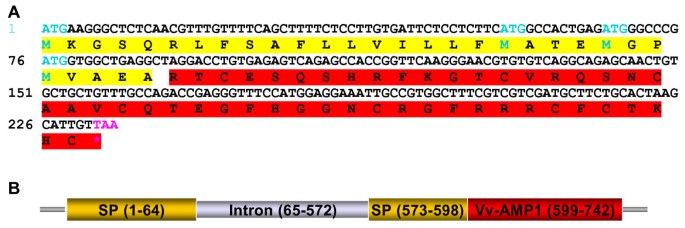
初步筛选葡萄基因组研究所(TIGR)的EST数据库使用BLAST算法只获得了一个EST命中的TC69032。在完成葡萄基因组序列之后,对可用数据库的后续分析已经产生了其他假定的防御素序列(结果未显示)。引物设计基于EST TC69032, PCR筛选葡萄根、叶和浆果材料的cDNA批,从葡萄浆果cDNA中分离出一个完整的编码序列。这个序列被命名为葡萄抗菌肽1(Vv-AMP1),因为它与植物防御素家族同源。的完整编码序列Vv-AMP1全长234 bp,编码77个氨基酸的预估肽,包括30个氨基酸的信号肽和47个氨基酸的成熟肽(图1).分离的基因组拷贝Vv-AMP1大小为742 bp,与cDNA序列的比较分析显示508 bp的内含子中断了预测的信号肽(图1 b).
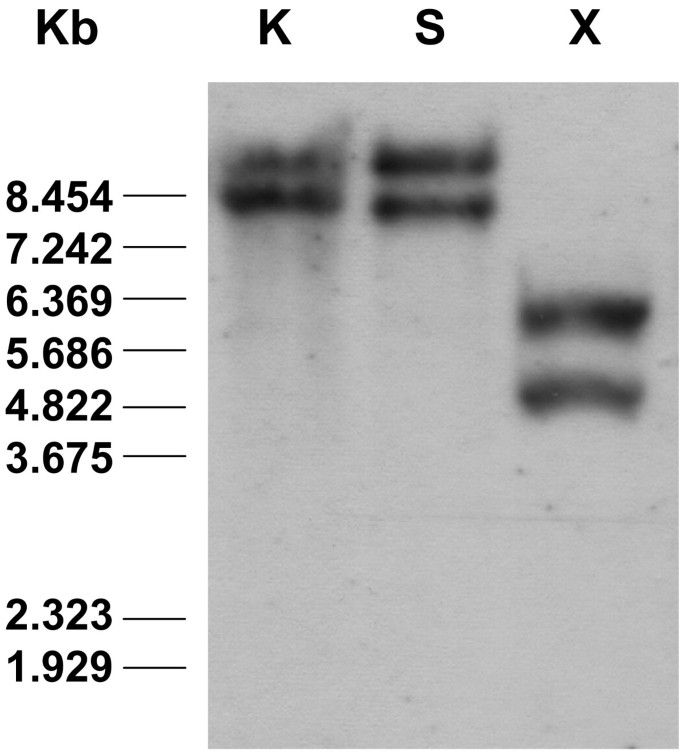
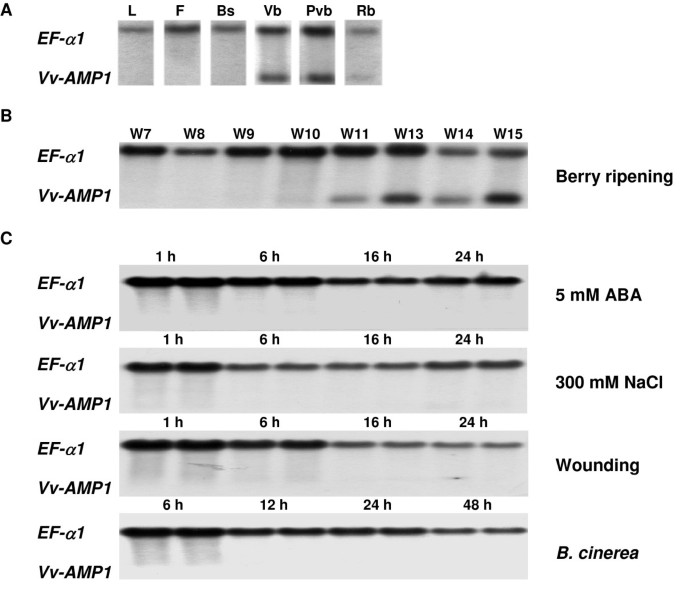
对Pinotage品种的基因组DNA进行Southern blot分析,发现存在两个杂交信号Vv-AMP1在诉酿酒用葡萄基因组(图2).美国国家生物技术信息中心(NCBI)对葡萄基因组序列的BLAST分析确定了两个可能的contig序列,VV78X055073.5和VV78X034124.3。对这两个基因组序列的比对分析表明,该基因的上游和下游核苷酸区Vv-AMP1开放式阅读相似,表明单副本Vv-AMP1存在于诉酿酒用葡萄基因组。
基因组序列的比对分析Vv-AMP1从非葡萄属植物中分离出来葡萄属种间核苷酸水平同源性较高(93%)。当推导出不同的编码序列时Vv-AMP1对基因进行比较,观察到高达95%的同源性,在推导的氨基酸水平上翻译为93%的同源性(图3.).Vv-AMP1从诉酿酒用葡萄显示出最高的同源性基因扩增自诉afganista氨基酸水平同源性为98.7%。推导出的氨基酸序列诉酿酒用葡萄而且诉afganista与其他氨基酸不同的是,在它们的信号肽区有一个额外的氨基酸,在第15位引入异亮氨酸(编号根据Vv-AMP1从诉酿酒用葡萄).
Vv-AMP1氨基酸序列的生物信息学特征
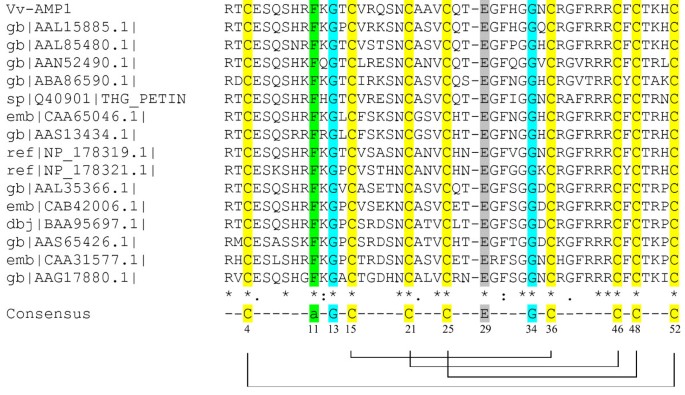
BLASTP结果和进一步的比对分析表明,推导出的氨基酸序列Vv-AMP1与γ-硫代蛋白同源性高齿栗叶的可能PPT来自牵牛花(图4).Vv-AMP1还显示了以下保守的氨基酸残基:位于所有植物防御素第11位的一个芳香族残基,位于第13位和第34位的两个甘氨酸残基,位于第29位的一个谷氨酸残基,以及位于第4位、第15位、第21位、第25位、第36位、第46位、第48位和第52位的8个半胱氨酸残基(编号根据Rs-AFP1 [23])。用DIpro进行的二硫桥分析显示Vv-AMP1的8个半胱氨酸残基由4个二硫桥连接(图4).
植物防御素B1亚家族和Vv-AMP1亚家族的氨基酸比对分析葡萄.gb|AAL15885.1|推定γ-硫蛋白[齿栗叶的可能];|防御蛋白1 [碧桃];gb|AAN52490.1| defensin EGAD1 [Elaeis guineensis];gb|ABA86590.1|推定防御素1 [耧斗菜奥运];sp|Q40901|THG_PETIN γ-硫蛋白同源物PPT前体[佩妮inflata];CAA65046.1未命名蛋白产物[甜椒];gb|AAS13434.1| defensin [烟草attenuata则];ref | NP_178319.1 | LCR69 / PDF2.2;蛋白酶抑制剂[拟南芥];ref | NP_178321.1 | LCR68 / PDF2.3;蛋白酶抑制剂[拟南芥];|AAL35366.1|防御蛋白前体[甜椒];γ-硫蛋白[Lycopersicon esculentum];dbj|BAA95697.1|硫蛋白样蛋白[烟草];| kunitz型胰蛋白酶抑制剂[番薯甘薯];CAA31577.1未命名蛋白产物[茄属植物tuberosum];库尼茨胰蛋白酶抑制蛋白[菜豆coccineus].所有防御素共有的一致序列如下所示,编号根据Rs-AFP1 [23].8个半胱氨酸用黄色表示,芳香残留物在第11位用绿色表示。保守的甘氨酸用蓝色表示,谷氨酸在29号位置用灰色表示。引入缺口与Rs-AFP1的数字一致。Vv-AMP1序列中的二硫键桥结构显示在一致序列下方。
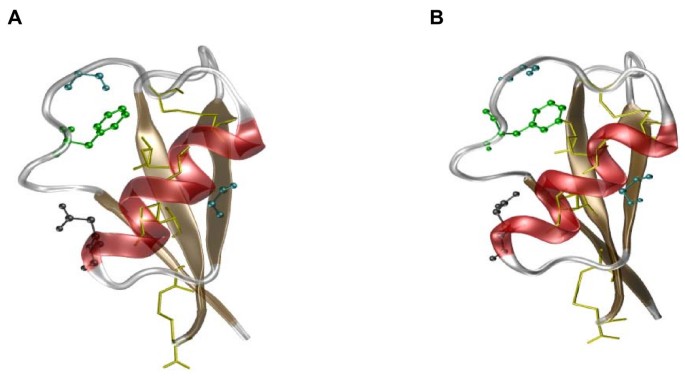
对推导出的氨基酸序列进行比较同源性建模,证实Vv-AMP1的三级结构与大麦中的hordothionin-γ (1GPT)非常相似,具有典型的防御素结构,包括一个α-螺旋和一个三股反平行β-薄片,它们以βαββ β结构组织(图α- ββ)5).该结构是由8个半胱氨酸残基之间的分子内二硫键稳定的。
推测的Vv-AMP1信号肽的靶向能力
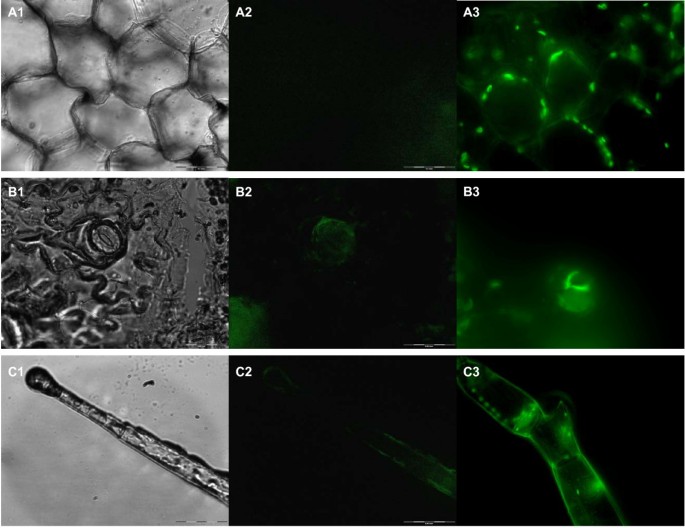
PA-SUB预测Vv-AMP1的信号肽将其产物导向植物细胞的异体区。通过将Vv-AMP1信号肽在本构表达下与GFP融合,并在烟草中过表达,证实了这一点。对烟草叶柄徒手横截面进行的倒置荧光显微镜观察显示,GFP积聚在异体区(图6).
表达谱Vv-AMP1在诉酿酒用葡萄
的表达模式的研究Vv-AMP1在葡萄藤中,揭示了该基因以一种组织特异性的方式表达,仅在浆果中表达(图7一个).通过对不同发育和成熟阶段浆果的Northern blot分析,证实该基因具有发育调控作用。Vv-AMP1开花后11周,从véraison开始,在浆果成熟时诱导表达(图7 b).的表达Vv-AMP1在浆果成熟期的其余阶段都保持高水平。对葡萄叶材料进行诱导研究,模拟渗透胁迫、损伤、病原菌感染葡萄孢菌以及ABA处理,均无法诱导Vv-AMP1表达式(图7 c).在pre-véraison浆果上也进行了同样的实验,但没有一种诱导刺激能克服发育调控(结果未显示)。在pre-véraison浆果上,添加了JA和SA处理,但未观察到任何诱导(结果未显示)。
Vv-AMP1的重组生产
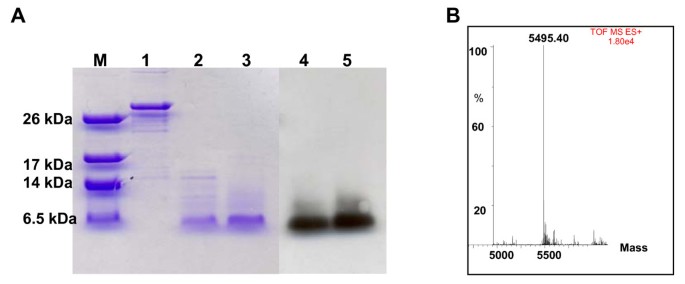
重组Vv-AMP1与gst -标签融合,成功地在大肠杆菌采用Rosetta gami pLysS表达系统。使用谷胱甘肽亲和层析系统(Sigma, St Louis, USA)纯化重组肽,得到5 mg/L纯化肽。重组融合蛋白大小为31 kDa,与预测大小一致。通过凝血酶裂解成功去除gst标记,并通过SDS-PAGE分析和western blot分析确认(图8).利用离子交换层析法成功分离重组肽,并在C8柱上脱盐。质谱分析显示重组肽的大小为5.495 kDa,与预测质量相符(图495 kDa)8 b).肽段质量指纹图谱证实重组Vv-AMP1来自成熟Vv-AMP1肽段的DNA序列编码。
Vv-AMP1的抗菌活性
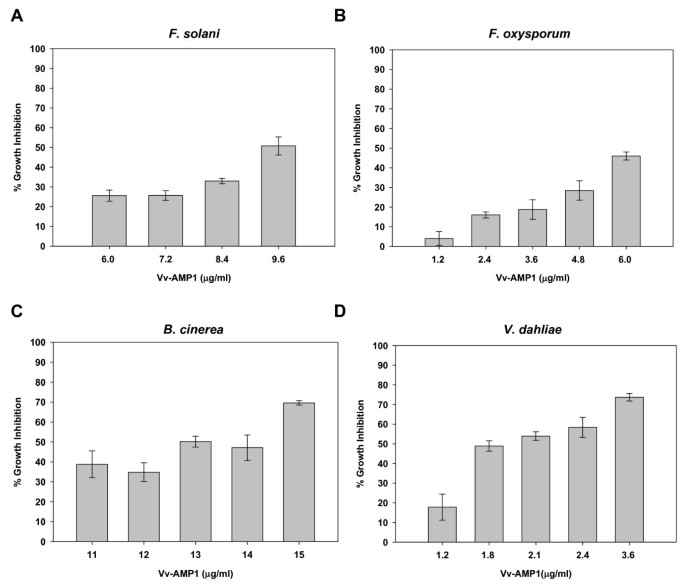
重组Vv-AMP1对几种植物病原真菌进行了剂量反应生长抑制试验。Vv-AMP1对真菌菌丝的活性是通过在不同浓度的Vv-AMP1存在的真菌孢子中孵育72小时来评估的50值在48小时孵育后确定(图9模拟).随着时间的推移,Vv-AMP1在所有测试的真菌分离株中对真菌生物量的积累有严重的影响,并且对其最有效病圃(图9 b),诉dahliae(图9 d),萎蔫病的两种致病因子,与IC50分别为6 μg/ml和1.8 μg/ml。然而,Vv-AMP1的效果较差f .以上集成电路50值为9.6 μg/ml(图9).坏死真菌b .灰质(图9 c)被IC抑制5013 μg/ml。治疗b .灰质当肽浓度高于15 μg/ml时,>孢子的生长受到95%的抑制,而当肽浓度为30 μg/ml时,孢子萌发完全被抑制(数据未显示)。该肽无抑制作用答:longipes即使肽浓度高于20 μg/ml(结果未显示)。
用Vv-AMP1处理的真菌菌丝的显微分析显示,没有与某些植物防御素相关的特征性超分支效应的迹象。然而,Vv-AMP1严重改变了真菌菌丝伸长的能力,大多数菌丝尖端都有肿胀的外观。在大多数用Vv-AMP1处理的真菌中也观察到菌丝细胞质的肉芽形成(数据未显示)。
丙啶碘处理结合荧光显微镜显示,与未处理的没有荧光的真菌相比,Vv-AMP1处理过的样品中存在高水平的荧光(图10).这表明真菌膜因Vv-AMP1肽的存在而受损。在受影响的菌丝中观察到荧光镰刀菌素菌株(图10),而荧光只出现在Vv-AMP1处理的菌丝尖端诉dahliae(图10 l).
重组Vv-AMP1在初步稳定性评估中是热稳定的,对蛋白酶活性敏感
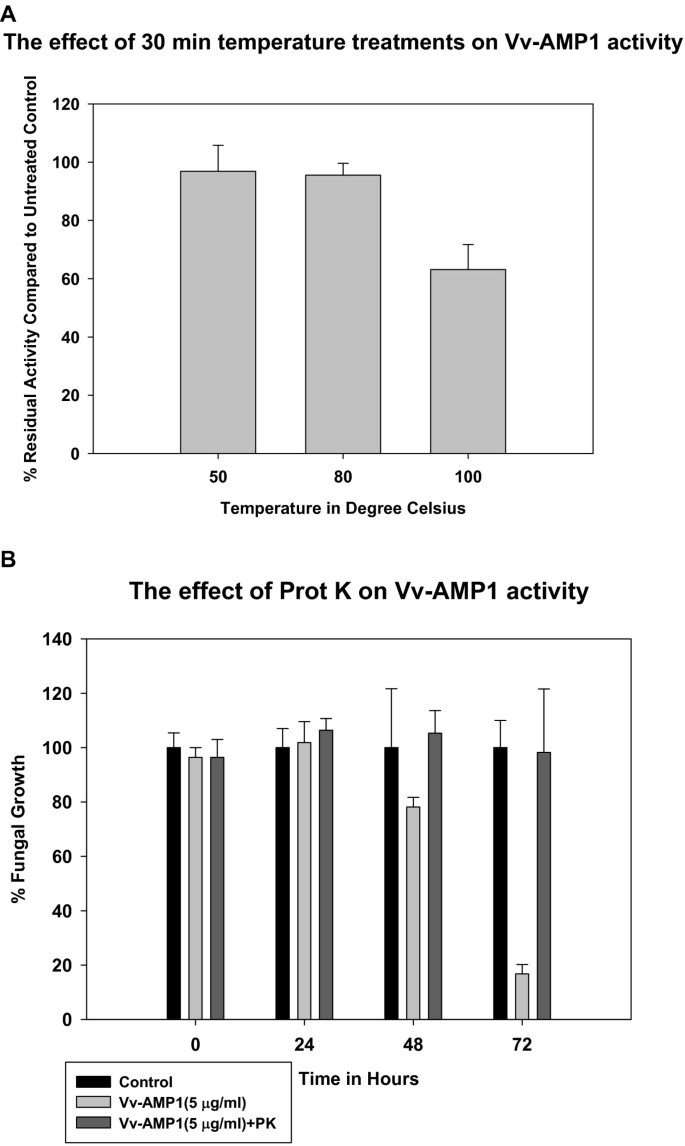
Vv-AMP1在不同温度下使用抗真菌生长试验测试其稳定性葡萄孢菌(图11个).Vv-AMP1在高达100℃的温度下表现出显著的稳定性。在80°C处理30分钟后,其抗真菌活性保留了95%,在100°C处理30分钟后保留了62%。
Vv-AMP1对蛋白酶K处理非常敏感,证实了其蛋白质性质。100 μg/ml的酶处理完全消除了Vv-AMP1的活性诉dahliae(图11 b).
讨论
葡萄植物防御素编码基因的分离与鉴定
植物防御素是一种具有基本性质的富含半胱氨酸的小肽,具有广泛的抗菌活性,并与植物的先天防御系统有关。在此我们报道了第一防御素肽及其编码基因的分离和鉴定葡萄西瓜是世界上最重要的水果作物。234bp的开放阅读框从隔离诉酿酒用葡萄浆果cDNA(图1)编码Vv-AMP1,这是一种与植物防御素肽家族具有显著一致性和结构同源性的肽。对葡萄基因组的分析显示,只有一个拷贝Vv-AMP1存在于葡萄基因组和在Southern blot分析中观察到的两个杂交信号是由于异质性Vv-AMP1轨迹。此外,分离的基因在细胞内高度保守葡萄属属(图3.).大部分非葡萄品种葡萄属产生同源序列的sp .以其对真菌病原体的高水平天然抗性而闻名。对这些序列进行了生物信息学分析诉酿酒用葡萄序列具有高度的同源性和共同的推断结构特征。最近完成的葡萄基因组序列揭示了额外的假定防御素序列葡萄(结果未显示),也可以作为隔离和表征的目标。
植物防御素表现出一系列的表达谱,并可以组织特异性模式组成性表达,也可由各种环境刺激诱导[34,52,54- - - - - -60].的表达式分析Vv-AMP1表明这个基因是高度调控的。Vv-AMP1显示出组织特异性和发育调控的表达模式,仅在葡萄浆果材料中表达(图7 a - b).在测试的条件下,没有观察到额外的诱导剂,没有克服浆果特异性和发育调控的表达模式(图7 c).对已知葡萄病原体的伤害和感染缺乏反应,b .灰质,建议监管Vv-AMP1表达独立于这些外部刺激所引导的植物防御信号通路。浆果中的激素处理包括SA、JA和ABA,但在测试条件下,这些都没有显示出任何诱导作用。的表达模式Vv-AMP1与浆果成熟相对应,进一步评估油菜素内酯的影响将是重要的,因为最近已证明这些化合物是浆果成熟的诱导剂[61].ABA同样与浆果的成熟有关,但对浆果的成熟没有任何影响Vv-AMP1表达水平。这种防御素基因的特定表达模式是有趣的,与葡萄浆果中许多与防御有关的基因相反。转录组分析和其他研究表明,许多防御相关基因在浆果成熟开始时下调。有人假设,在post-véraison阶段,浆果的防御机制没有维持,因为含有成熟胚胎的种子在浆果开始成熟时获得了坚硬的保护性种皮。因此,植物已经完成了它的繁殖周期,浆果中的防御(从植物的角度来看)不那么重要。Vv-AMP1的信号肽在转基因烟草中过表达时,可以将GFP靶向到异体区(图6).葡萄浆果中的组织定位将为这一可能性提供进一步的线索在足底这种肽的作用,特别是在浆果防御方面。
Vv-AMP1:一种高度稳定和有效的一系列真菌病原体抑制剂
Vv-AMP1的特征
将成熟的Vv-AMP1与防御素家族的其他成员进行比较分析,发现Vv-AMP1共享大多数植物防御素中存在的保守氨基酸,并且与矮牵牛中的防御素PPT关系最密切(图4).基于前体蛋白结构的分类研究,将Vv-AMP1归为防御素家族的I类[8].I类防御素肽具有保守的前体蛋白结构,由一个n端信号肽和一个成熟的防御素结构域组成[8].
Vv-AMP1基因成功过表达大肠杆菌目的:制备纯化的肽,并对肽段进行精确的尺寸测定和指纹识别。这些结果以及western blot分析证实了该肽的纯化均匀。纯化的肽被证明是高度热稳定的,但很容易被蛋白酶处理失活。初步结果(未显示)表明Vv-AMP1对二价阳离子Ca相当敏感2 +当根据b .灰质.对阳离子的敏感性是植物防御素家族许多成员的一个特征,有充分的文献记载[14,15],但高度依赖于所测试的真菌病原体。由于该肽靶向于异体区,这表明Ca2 +敏感性,以及其他阳离子,将必须进一步测试对更广泛的真菌,特别是对葡萄真菌病原体。
Vv-AMP1的抑菌作用及抗真菌特性
检测的病原体包括各种萎蔫病病原体以及葡萄孢属这是一种葡萄病原体。许多葡萄真菌病原体不能培养在体外(如白粉病和霜霉病病原体),不能纳入本次评价。Vv-AMP1对萎蔫病的致病因子特别有效,但也抑制坏死葡萄孢属.Vv-AMP1限制了测试生物的真菌生物量,但在处理培养物中没有引起典型的形态变化(在测试条件下),将Vv-AMP1分类为一种非形态发生的抗真菌防御素肽。
无论是从一般植物生物技术的角度,还是从理解和控制葡萄防御的角度,Vv-AMP1的抑制特征都是有趣和有前途的。Vv-AMP1对诉dahliae在抗病作物品种的工程方面有很大的兴趣。Vv-AMP1非常活跃诉dahliae, IC特别低50值。一种防御肽紫花苜蓿,已显示出巨大的经济潜力[62来保护土豆免受诉大丽花在现场试验条件下。该肽对葡萄病原菌的抑制活性仍需进一步评价,但对几种可培养的病原真菌进行了初步抑制分析在体外结果很有希望。几种葡萄干病病原菌对该肽有较强的敏感性在体外(M. Tredoux,葡萄酒生物技术研究所,个人交流)。大多数具有重要经济意义的葡萄真菌病原体需要在植物宿主中生长,因此需要进行转基因过表达研究和全植物感染试验来确定肽对这些病原体的影响。
观察到的Vv-AMP1活性与碘化丙啶摄取试验和荧光显微镜显示的真菌膜透性改变有关(图10).以往的研究表明,植物防御素改变了真菌细胞膜的通透性,这与钙的快速吸收和流出有关2 +和K+[63,64].Vv-AMP1是否使用相同的机制来诱导观察到的膜渗透仍有待阐明。
其他有待回答的问题是在足底过表达时肽的稳定性以及肽可能提供的抗病性的性质和程度。假定的推动者Vv-AMP1基因也已从葡萄藤中分离出来(结果未显示),并可能为这种防御素的调节提供有价值的见解。
结论
Vv-AMP1编码浆果特异性的发育调节肽,与植物防御素超家族同源。成熟的Vv-AMP1通过一个30个氨基酸的信号肽被引导到植物细胞的异体区。重组Vv-AMP1在低浓度下对引起坏死性和萎蔫性疾病的真菌显示出广泛的抗真菌活性。Vv-AMP1活性被归为非形态发生的,可能与膜渗透有关。该肽的抗真菌活性非常有前景,值得进一步研究其在生物技术方面的潜力,以提高重要作物品种的真菌抗性。
方法
植物材料和微生物菌株
大肠杆菌所有克隆实验均采用菌株DH5α大肠杆菌菌株BL21 (Rosetta-gami pLys S) DE3 (Novagen (Madison, WI, USA)用于重组蛋白的生产。葡萄孢菌,尖孢镰刀菌而且腐皮镰孢霉菌来自斯泰伦布什大学植物病理学系(DPP)。链格孢属longipes(写明ATCC 26293),尖孢镰刀菌(ATCC 10913)和黄萎病dahliae(ATCC 96522)是从美国类型文化收藏中获得的。上述真菌菌株均在25°C的马铃薯葡萄糖琼脂上培养至产孢。烟草种子来自美国Round Rock TX 78681的Lehle seeds,烟草植株在Murashige Skoog (MS)培养基上培养[65]在温度为25°C,光周期为16小时的生长室中。
引物设计与防御基因分离
EST数据库诉酿酒用葡萄在TIGR [66]使用BLAST算法进行筛选。用γ-硫蛋白序列(PPT, gb|L27173.1)筛选数据库佩妮inflata.引物设计自EST克隆TC69032,以识别EST中编码的完整编码序列。
总RNA从1 g中分离出来诉酿酒用葡萄简历。用高氯酸钠法测定皮诺奇根、叶和浆果组织[67].cDNA由总RNA合成,使用SuperscriptIII cDNA合成试剂盒(Invitrogen, Carlsbad, USA)。
从皮诺奇叶中分离出基因组DNA。收集叶片组织,在液氮中快速冷冻并研磨成细粉。按照既定方法,用10 ml提取缓冲液提取1克组织[68].
基因组和cDNA分离自诉酿酒用葡萄简历。Pinotage被用作PCR策略的模板,以分离可能的葡萄属defensin序列。所用引物为正向引物Vitisdef-5' (5'-GGCTCGAGATGGAAGGGCTCTCAACGTT-3')与反向引物Vitisdef-3' (5'-CCGGATCCTTAACAATGCTTAGTGC-3”)。将获得的PCR产物克隆到pGEM-T简易载体(Promega Corporation, Madison, USA)中并进行测序。使用BLAST算法分析得到的序列,并将显示与防御素家族同源的克隆命名Vv-AMPs.
Southern blot分析Vv-AMP1
从中分离出基因组DNA诉酿酒用葡萄简历。如上所述。Pinotage基因组DNA被消化Kpn我,Spe我或Xba在0.8% [w/v]琼脂糖TAE凝胶上分离。转印至尼龙膜后[69],用的digg标记cDNA探针检测膜Vv-AMP1.化学发光检测根据DIG过滤器杂交应用手册(Roche Diagnostics GmbH, Mannheim, Germany)进行。每个杂交信号代表Vv-AMP1的一个拷贝。
序列分析Vv-AMP1在葡萄属属
其他种质葡萄属种属来自美国农业部-农业研究所国家克隆种质资源库(Davis, CA 95616, USA)。这些包括基因组DNAV. afganista, V. x andersonii, V. aestivallis, V. cinereavar. floridana,诉出发而且蛇葡萄属aconitifoliavar. galabra。基因组副本Vv-AMP1利用相同的PCR策略从不同种质中分离Vv-AMP1从别具一格。将分离到的基因克隆到pGEM-T易表达载体上并进行测序。获得不同的基因组序列葡萄属使用VectroNTI套件(Invitrogen, Carlsbad, USA)的AlignX软件对物种进行分析,并在ClustalX中创建最终的比对[70].
表达模式Vv-AMP1
总RNA从诉酿酒用葡萄简历。皮诺奇叶、花和浆果成熟的不同发育阶段。收集组织,在液氮中研磨成细粉。用800 μl提取缓冲液在65℃(2% [w/v] CTAB, 2% [w/v] PVP-40, 100 mM Tris/HCl (pH 8.0), 25 mM EDTA, 2.0 M NaCl, 2% [v/v] β-巯基乙醇和0.5 mg/ml亚精胺)下提取100 mg叶、花和绿浆果组织5 min [71].用高氯酸钠法分离véraison到成熟浆果的总RNA [67].
总RNA在1.2% [w/v]琼脂糖甲醛凝胶(QIAGEN RNA/DNA手册)上分离,转移到带正电荷的尼龙膜上(罗氏诊断有限公司,德国曼海姆)[69].膜用digg标记探针检测Vv-AMP1cDNA探针与延伸因子1 α (EF-1α)基因来自诉酿酒用葡萄(TC65250)作为内部标准。在50℃进行预杂交和杂交。化学发光检测根据DIG过滤器杂交应用手册(Roche Diagnostics GmbH, Mannheim, Germany)进行。
用于化学诱导的分析Vv-AMP1,诉酿酒用葡萄叶片在300 mM NaCl或5 mM脱落酸中漂浮。在每次诱导实验后1、6、16、24小时收集材料,在液氮中冷冻。感应的Vv-AMP1通过伤害和b .灰质对叶片材料也进行了感染评估。为了评估伤害的效果,对叶片进行机械损伤,并在培养皿中漂浮在蒸馏水上。收集叶片材料,在损伤实验开始后1、6、16和24小时在液氮中冷冻。b .灰质通过将叶片浸泡在含有2000个孢子/ml的50%葡萄汁的孢子悬浮液中来实现感染。接种后叶片置于100%相对湿度条件下的培养皿中,室温孵育。接种后6、12、24、48小时收集材料,在液氮中冷冻。分离的pre-véraison期浆果也进行了相同的诱导,以及10 mM水杨酸和5 mM茉莉酸。所有的诱导实验都重复了三次,将材料混合并进行两次单独的RNA提取。RNA分离和Northern blot分析如上所述。
推导的氨基酸序列的生物信息学分析Vv-AMP1
推导出的Vv-AMP1的氨基酸序列在VectorNTi中生成,并使用BLASTP算法进行分析。利用ClustalX进一步对鉴定出的同源序列进行比对[70].利用DIpro对推导出的Vv-AMP1序列进行了二硫桥分析[72];二级结构分析及同源性建模采用LOOPP @ CBSU 3.0版本软件包[73].通过软件包VMD (Visual Molecular Dynamics)进一步分析得到的PDB文件,并使用POV-Ray渲染最终图像。由Vv-AMP1信号肽指导的亚细胞定位在Proteome Analyst Specialized亚细胞定位服务器(PA-SUB)上进行预测[74].肽质量预测使用Expasy工具完成,Peptide - mass [75].
确认Vv-AMP1信号肽引导的亚细胞定位
为了证实PA-SUB预测的亚细胞靶向,Vv-AMP1的信号肽被融合到绿色荧光蛋白(GFP)报告蛋白上。用引物vitisdeff -5'和Vitis SP-3' (5'- aagcttagcctcagccaccatcg -3') PCR分离Vv-AMP1信号肽,克隆到pGEM-T easy载体中,得到pGEM-VvSP。从pGEM-VvSP中分离得到信号肽Xho我和欣dIII并克隆到限制性内切酶制备的植物表达载体pART27cassette中,得到了一个pART27表达载体[76]中包含从pART7克隆到不第27部分。该结构被称为pART27-VvSP。通过PCR从ABRC克隆pLMNC92中制备了修饰的mGFP5基因。采用正向引物PIV2GFP5-5' (5'-CCAAGCTTGTAAGTTTCTGCTTCTACCTTTGA-3')和反向引物PIV2GFP5-3' (5'- gcctctagattattttgtatagttcatccatgc -3')对pLMNC92质粒的GFP序列进行PCR检测。该GFP序列缺乏n端内质网信号肽以及c端HDEL ER保留信号。PCR产物克隆到pGEM-T易表达载体中,得到pGEM-GFP5。从pGEM-GFP5中切除GFP片段欣dIII和Xba在35S花椰菜花叶病毒启动子的控制下,将Vv-AMP信号肽融合到GFP上,得到植物表达载体pARTVvSP-GFP。将pARTVvSP-GFP结构转化为根癌土壤杆菌电穿孔菌株EHA105 [77],用标准的叶盘法转化烟草[78].在MS培养基上卡那霉素选择下再生植株,在黑暗阅读器上激发GFP后,通过荧光发射识别根系中显示GFP荧光的植株(Clare Chemical Research, CO, USA)。从叶柄(未转化对照和过表达GFP的转基因株系)制备手部切片,并置于含40% [v/v]甘油的MS盐溶液中。在Olympus IX 81倒置显微镜下观察GFP定位。GFP在470 nm激发,使用CelliR的GFP过滤器立方体捕获荧光图像®相机和软件系统(Olympus Soft Imaging Solutions GmbH)。所有捕获的图像都经过CelliR处理®背景噪音降低过滤器在强度设置为7。
Vv-AMP1的重组生产
pGEX-2T系统(Amersham Biosciences, NJ, USA)用于Vv-AMP1的重组生产大肠杆菌.该系统将允许生产成熟的Vv-AMP1肽融合到gst标记。以pGEM-Vv-AMP1为模板,PCR制备成熟Vv-AMP1序列。这是通过引物Vv1-GST-5' (5'-GGCCGGATCCAGGACCTGTGAGAGTCAGAGCCACCG-3')和vitdef3 '实现的。所得产物被克隆到pGEM-T易载体中,并被命名为pGEM-GSTVv1成熟型。用酶切法从pGEM-GSTVv1中提取成熟片段Bam你好,生态并克隆成RIBam你好,生态RI制备了pGEX-2T载体。阳性克隆测序,命名为pGEX-Vv1。
将pGEX-Vv1转化为BL21 (Rosetta-gami pLysS) DE3 (Novagen Madison, WI, USA),在含50 μg/ml氨苄青霉素、12.5 μg/ml四环素、15 μg/ml硫酸卡那霉素和34 μg/ml氯霉素的LB琼脂上培养阳性菌落。将单个菌落接种到含有抗生素的5 ml LB培养基中,37℃培养过夜。将1 ml预培养物接种到4个1 l的Erlenmeyer瓶中,瓶中含有400 ml含抗生素的LB培养基,在37℃下连续摇晃培养至OD6000.7。在22°C下,用0.4 mM IPTG诱导GST-Vv1融合表达5小时。
通过离心从每个烧瓶中收集细菌球,并在5 ml GST柱结合缓冲液(10 mM Na2HPO4, 1.8 mM KH2阿宝4, 2.7 mM KCl, 140 mM NaCl2pH7.6和4 mM PefaBloc,来自Roche Diagnostics GmbH, Mannheim, Germany),并在-80°C冷冻。细胞被从液氮到37°C水浴的反复冻融循环破坏。通过10 000 rpm离心收集细胞裂解液,并调整到5 mM MgCl2.用10单位的DNase I (Roche Diagnostics GmbH, Mannheim, Germany)在室温下处理裂解液15分钟以降低粘度。Triton × 100加入最终浓度为1% (w/v),离心10 000 rpm 15 min,通过0.22 μM过滤器清除细菌细胞裂解液。
用谷胱甘肽琼脂糖树脂分批纯化重组蛋白。将2ml床量的谷胱甘肽琼脂糖糖苷4b (Sigma, St Louis, USA)添加到过滤的裂解液中,并允许重组肽在转子混合器上结合一夜。用10ml GST结合缓冲液洗涤两次去除未结合的蛋白,然后用10ml含有1% Triton × 100的GST结合缓冲液洗涤两次去除未特异性结合的蛋白。结合的重组GST-Vv-AMP1肽用10 ml洗脱缓冲液(50 mM Tris-Cl, pH 8.0, 10 mM还原型谷胱甘肽)洗脱。用20单位酶在室温下通过凝血酶消化去除n端gst标签(Amersham Biosciences, NJ, USA)。经亲和层析和凝血酶消化完全去除n端gst标签后,采用SDS-PAGE分析确认重组融合蛋白的纯度。
使用SP sepharose柱上的阳离子交换色谱法从成熟的Vv-AMP1肽中分离出gst标记(Amersham Pharmacia Biotech)。含有成熟Vv-AMP1肽的样品被混合并加载到Strata C8固相萃取柱上(Phenomenex, Torrance, CA, USA)。结合肽经5柱体积dH洗涤脱盐2O含0.1% [v/v] TFA,用5 ml含0.1% [v/v] TFA的60% [v/v]乙腈洗脱。洗脱肽冷冻干燥,终浓度100 μg/ml蒸馏水溶解,-20℃保存。
异源Vv-AMP1的大小测定和鉴定
为了确认Vv-AMP1- gst融合蛋白的纯化,并评估Vv-AMP1中gst -标签的裂解,在15% [w/v] Tris-Tricine凝胶上分离2 μg纯化蛋白[79].分离后的凝胶在染色液(考马斯氏R250在50% [v/v]乙醇,10% [v/v]乙酸中)中进行微波染色。用12.5% [v/v]异丙醇和12% [v/v]乙酸对凝胶进行染色。成熟Vv-AMP1肽样品的确切大小由Waters API Q-TOF Ultima仪器上的LC/MS分析确定。
通过肽段质量指纹图谱对肽段进行鉴定。用ProteoExtract提取45 μg重组Vv-AMP1肽tm一体化胰蛋白酶消化试剂盒(Calbiochem, La Jolla, CA, USA),并在Waters API Q-TOF Ultima仪器上进行LC/MSMS分析。用Expasy程序FindPep分析得到的峰值[75].
抗体制备及免疫印迹
用300 μg GST-Vv-AMP1融合蛋白(Freund’s完全偶联蛋白)免疫3只小鼠,制备抗Vv-AMP1的多克隆抗体。每隔2周注射2次含100 μg弗洛因德完全结合蛋白的强化注射,最后在出血结束前2周注射100 μg纯化的Vv-AMP1。
Western blot检测400 ng纯化的Vv-AMP1。肽在15% (w/v) Tris-tricine凝胶上分离[79]以及低分子量标记(Sigma, St Louis, USA)。一半凝胶用考马西R250染色,另一半电泳到PVDF膜上(BioRad, Hercules, CA, USA)。将膜在阻断缓冲液(磷酸盐缓冲盐水,0.1% [w/v]吐温20和5% [w/v]脱脂牛奶)中阻断3小时,然后在阻断缓冲液中制备的1:500稀释的一抗中孵育过夜。Vv-AMP1检测采用抗小鼠IgG二抗和ECL化学发光系统,根据Amersham Biosciences, NJ, USA。
重组Vv-AMP1的抗菌活性
采用显微分光光度法测定Vv-AMP1的定量抗真菌活性[80].在96孔微量滴度板(Bibby Sterilin Ltd, Stone, staff, UK)中,每孔分别含有100 μl含有2000个真菌孢子的半强度马铃薯葡萄糖肉汤(PDB)和纯化的Vv-AMP1肽1-20 μg/ml。对照反应不含肽。培养皿在25°C黑暗中孵育3天。每24小时测一次显微分光光度一个595.所有读数都是通过从24小时、48小时和72小时读数中减去时间零点读数来校正的。在48小时后对Vv-AMP1活性进行评分,并以生长抑制率表示。生长抑制的百分比定义为校正后的100倍一个595控制减去修正一个595对样品进行了校正一个595控制的。每个活性测定方法独立重复3次,每次测量3次技术重复。使用Olympus IX70倒置显微镜直接从抗真菌实验中收集显微镜图像。使用分析捕获图像®软件(Olympus Soft Imaging Solutions GmbH -结果未显示)。
Vv-AMP1引起真菌膜渗透的能力使用碘化丙啶(PI)摄取试验进行评估[81],在F. oxysporum, F. solani而且诉dahliae.采用200 μl含真菌孢子(2 × 104孢子/ml)和浓度为6 μg/ml的Vv-AMP1肽f .以上, 9.6 μg/ml为病圃浓度为1.8 μg/ml诉dahliae隔离。真菌菌株在Vv-AMP1存在的25℃下孵育40小时。对照样品不含Vv-AMP1。孵育后用1xPBS洗涤,PI染色液(25 μg/ml PI in PBS)染色10 min。染色样品用1× PBS冲洗2次,在Olympus IX 81倒置荧光显微镜下观察。图像是用cellr捕捉的®数码相机和软件系统(Olympus Soft Imaging Solutions GmbH)。荧光的存在表明真菌膜受损。
重组Vv-AMP1蛋白的热稳定性评价及蛋白性质
通过上述抗真菌试验评估了异源Vv-AMP1肽的稳定性。最终肽浓度为20 μg/ml时,测定了肽的热稳定性b .灰质在开始抗真菌试验之前,将肽在25°C、50°C、80°C和100°C预处理30分钟。Vv-AMP1的活性与25°C的对照反应进行对比。Vv-AMP1肽也进行了蛋白酶稳定性试验。Vv-AMP1用蛋白酶K (100 μg/ml)在37℃下处理16 h。消化后对Vv-AMP1进行抗真菌试验诉dahliae终浓度为5 μg/ml。以含蛋白酶K (100 μg/ml)但不添加Vv-AMP1肽的对照反应为对照,测定Vv-AMP1的活性。上述试验均重复3次。
参考文献
- 1.
Dixon R, Harrison M, Lamb C:植物防御反应激活的早期事件。植物学报,1994,32:479-501。10.1146 / annurev.py.32.090194.002403。
- 2.
植物中的抗真菌化合物。医药和农业植物化学资源。编辑:Nigg HN, siegler D. Plenum出版社,纽约,纽约;1992:159 - 184。
- 3.
Kuc J:植物中调控或参与抗病的化合物。来自植物的生物活性化合物Wiley,奇切斯特(汽巴基金会研讨会154)。1990年,213 - 228。
- 4.
奥斯本AE:预制抗菌化合物和植物防御真菌攻击。中国生物医学工程学报,1996,8(10):1821-1831。10.1105 / tpc.8.10.1821。
- 5.
Prost I, Dhondt S, Rothe G, Vicente J, Rodriguez MJ, Kift N, Carbonne F, Griffiths G, Esquerre-Tugaye MT, Rosahl S, Castresana C, Hamberg M, Fournier J:植物氧化脂素的抗菌活性评价支持其参与病原体防御。植物科学进展,2005,29(4):344 - 344。10.1104 / pp.105.066274。
- 6.
范龙,李建民,李建民。诱导性防御相关蛋白在植物侵染中的意义。植物学报,2006,29(4):344 - 344。10.1146 / annurev.phyto.44.070505.143425。
- 7.
Bohlmann H, Apel K:硫代蛋白。植物化学学报,2001,29(4):344 - 344。10.1146 / annurev.pp.42.060191.001303。
- 8.
雷FT,安德森MA:防御-植物先天免疫系统的组成部分。生物工程学报,2005,6(1):85-101。10.2174 / 1389203053027575。
- 9.
Stec B:植物硫蛋白-结构的观点。细胞生命科学,2006,63(12):1370-1385。10.1007 / s00018 - 005 - 5574 - 5。
- 10.
汤玛·BP,卡穆·BP, Thevissen K:植物防御素。植物学报,2002,26(2):344 - 344。10.1007 / s00425 - 002 - 0902 - 6。
- 11.
Broekaert W, Terras F, Cammue B, Osborn R:植物防御素:作为宿主防御系统组成部分的新型抗菌肽。中国生物医学工程学报,2004,27(3):344 - 344。10.1104 / pp.108.4.1353。
- 12.
Florack D, Stiekema W:硫蛋白:性质,可能的生物学作用和作用机制。植物分子生物学,1994,26:25-37。10.1007 / BF00039517。
- 13.
Garcia-Olmedo F, Molina A, Alamillo JM, Rodriguez-Palenzuela P:植物防御肽。生物高分子学报,1998,47(6):479-491。10.1002 / (SICI) 1097 - 0282 (1998) 47:6 < 479:: AID-BIP6 > 3.0.CO; 2 k。
- 14.
Osborn R, De Samblanx G, Thevissen K, Goderis I, Torrekens S, Van Leuven F, Attenborough S, Rees S, Broekaert W:从菊科、蚕豆科、海马草科和沙蒿科种子中分离和鉴定植物防御素。中国生物医学工程学报,2004,27(3):357 - 357。10.1016 / 0014 - 5793 (95) 00666 - w。
- 15.
teras FR, Torrekens S, Van Leuven F, Osborn RW, Vanderleyden J, Cammue BP, Broekaert WF:芸苔科植物抗真菌蛋白的一个新家族。中国生物医学工程学报,2003,26(3):344 - 344。10.1016 / 0014 - 5793 (93) 81299 - f。
- 16.
Aerts A, Thevissen K, Bresseleers S, Sels J, Wouters P, Cammue B, François I:表达人类β -防御素-2的拟南芥植物对真菌攻击的抗性更强:植物和人类防御素之间的功能同源性。植物细胞学报,2007,26(8):1391-1398。10.1007 / s00299 - 007 - 0329 - 4。
- 17.
Aerts A, Thevissen K, Bresseleers S, Wouters P, Cammue B, Francois I:拟南芥中人类β -防御素-2的异源产生。农业应用生物学,2005,70(2):51-55。
- 18.
Castro MS, Fontes W:植物防御和抗菌肽。蛋白质化学,2005,12(1):13-18。
- 19.
Almeida MS, Cabral KM, Kurtenbach E, Almeida FC, Valente AP: Pisum sativum defensin 1的高分辨率NMR溶液结构:植物防御素,相同的主干,不同的作用机制。中华分子生物学杂志,2002,15(4):749-757。10.1006 / jmbi.2001.5252。
- 20.
Fant F, Vranken W, Broekaert W, Borremans F: Raphanus sativus抗真菌蛋白1三维溶液结构的1H NMR测定。中华分子生物学杂志,1998,279(1):257-270。10.1006 / jmbi.1998.1767。
- 21.
杨森,李志刚,李志刚,李志刚:矮牵牛花防御素1结构的研究。生物化学,2003,42(27):8214-8222。10.1021 / bi034379o。
- 22.
刘玉娟,程春生,赖明生,徐明民,陈春生,吕昌平:绿豆植物防御素VrD1的溶液结构及其对毛蝽的杀虫活性。中国生物医学工程学报,2006,29(4):457 - 457。10.1002 / prot.20962。
- 23.
Terras FR, Eggermont K, Kovaleva V, Raikhel NV, Osborn RW, Kester A, Rees SB, Torrekens S, Van Leuven F, Vanderleyden J, Cammue B, Broekaert W:萝卜中富含半胱氨酸的抗真菌小蛋白:它们在宿主防御中的作用。中国生物医学工程学报,2004,27(5):344 - 344。10.1105 / tpc.7.5.573。
- 24.
Aerts AM, Francois IE, Bammens L, Cammue BP, Smets B, Winderickx J, Accardo S, De Vos De, Thevissen K: M(IP)2C鞘脂水平对酵母植物防御素敏感性、氧化应激抗性和年代寿命的影响。中国农业大学学报,2006,29(3):344 - 344。10.1016 / j.febslet.2006.02.061。
- 25.
林志刚,李志刚,李志刚,李志刚。紫丁香霉素E和植物防御素DmAMP1对ipt1不依赖鞘脂生物合成的影响。中国生物医学工程学报,2003,23(2):379 - 379。10.1016 / s0378 - 1097(03) 00375 - 6。
- 26.
Thevissen K, Cammue BP, Lemaire K, Winderickx J, Dickson RC, Lester RL, Ferket KK, Van Even F, Parret AH, Broekaert WF:一种编码鞘脂生物合成酶的基因决定了酿酒酵母对大丽花(dahlia merckii)抗真菌植物防御素的敏感性。美国国家科学研究院。2000, 97(17): 9531-9536。10.1073 / pnas.160077797。
- 27.
孙文杰,王志强,王志强,等。抗真菌植物防御素与真菌膜成分的相互作用。多肽,2003,24(11):1705-1712。10.1016 / j.peptides.2003.09.014。
- 28.
Thevissen K, Idkowiak-Baldys J, Im YJ, Takemoto J, Francois IE, Ferket KK, Aerts AM, Meert EM, Winderickx J, rosen J, Cammue BPA: SKN1是酵母中一个新的植物防御素敏感基因,与鞘脂生物合成有关。中国生物医学工程学报,2005,29(3):344 - 344。10.1016 / j.febslet.2005.02.043。
- 29.
Thevissen K, Osborn RW, Acland DP, Broekaert WF:大丽花(Dahlia merckii)抗真菌植物防御素在真菌细胞上的特异性结合位点是抗真菌活性所必需的。植物微生物相互作用,2000,13(1):54-61。10.1094 / MPMI.2000.13.1.54。
- 30.
Thevissen K, Osborn RW, Acland DP, Broekaert WF: crassa神经孢子菌菌丝和微粒体膜上抗真菌植物防御素的特异性高亲和力结合位点。中国生物医学工程学报,1997,32(4):379 - 379。10.1074 / jbc.272.51.32176。
- 31.
Thevissen K, Warnecke DC, Francois IE, Leipelt M, Heinz E, Ott C, Zahringer U, Thomma BP, Ferket KK, Cammue BP:昆虫和植物的防御素与真菌葡萄糖神经酰胺相互作用。中国生物医学工程学报,2004,27(6):369 - 369。10.1074 / jbc.M311165200。
- 32.
Bloch C, Richardson M:高粱种子中昆虫α-淀粉酶小蛋白抑制剂(5kd)的新家族(sorghum bicolor (L.))与小麦γ-硫肽有序列同源性。《科学通报》,2001,29(4):344 - 344。10.1016 / 0014 - 5793 (91) 80261 - z。
- 33.
Melo FR, Rigden DJ, Franco OL, Mello LV, Ary MB, Grossi de Sa MF, Bloch C:豇豆硫蛋白对胰蛋白酶的抑制:特性、分子建模和对接。中国生物工程学报,2002,48(2):311-319。10.1002 / prot.10142。
- 34.
Mirouze M, Sels J, Richard O, Czernic P, Loubet S, Jacquier A, Francois IEJA, Cammue BPA, Lebrun M, Berthomieu P, Marques L:植物防御素的一个假定的新作用:来自锌超积累植物拟南芥的一种防御素赋予锌耐受性。植物学报,2006,47(3):329-342。10.1111 / j.1365 - 313 x.2006.02788.x。
- 35.
黄俊华,Ng TB: Gymnin,一种来自云南豆(Gymnocladus chinensis Baill)的强效防御素样抗真菌肽。多肽,2003,24(7):963-968。10.1016 / s0196 - 9781 (03) 00192 - x。
- 36.
Wong JH, Ng TB: Sesquin,一种有效的防御素类抗菌肽,从豆粉中提取,对肿瘤细胞和HIV-1逆转录酶具有抑制活性。多肽,2005,26(7):1120-1126。10.1016 / j.peptides.2005.01.003。
- 37.
黄俊华,吴涛:普通豆素,一种从菜豆中提取的广谱抗真菌肽。中国生物化学杂志,2005,37 (8):1626-10.1016/ J .biocel.2005.02.022。
- 38.
Almeida MS, Cabral KM, Zingali RB, Kurtenbach E:从豌豆(Pisum sativum)种子中鉴定两种新的防御肽。中国生物工程学报,2000,27(2):388 - 388。10.1006 / abbi.2000.1824。
- 39.
陈红华,徐敏敏,谭超,宋海燕,郭春春,范俊梅,陈红梅,陈松,陈春春:红豆植物防御素VaD1的克隆与鉴定。农业食品化学,2005,53(4):982-988。10.1021 / jf0402227。
- 40.
陈凯春,林春春,郑春春,宽昌昌,宋海燕,郭春春,陈春春:绿豆种子抑菌蛋白cDNA的克隆与鉴定。中国机械工程学报,2002,29(4):344 - 344。
- 41.
Osborn RW, De Samblanx GW, Thevissen K, Goderis I, Torrekens S, Van Leuven F, Attenborough S, Rees SB, Broekaert WF:植物防御素从菊科,豆科,海马草科和沙蒿科种子中分离和鉴定。中国生物医学工程学报,2004,27(2):357 - 357。10.1016 / 0014 - 5793 (95) 00666 - w。
- 42.
宋霞,王娟,吴峰,李霞,滕敏,龚伟:肿根种子二聚体植物防御素SPE10 cDNA克隆、功能表达及抗真菌活性。植物分子生物学,2005,57(1):13-20。10.1007 / s11103 - 004 - 6637 - y。
- 43.
宋晓霞,周震,王娟,吴峰,龚伟:一种新型植物防御素的纯化、表征及晶体学初步研究。生物晶体学报,2004,60 (Pt 6): 1121-1124。10.1107 / S0907444904007395。
- 44.
Kragh KM, Nielsen JE, Nielsen KK, Dreboldt S, Mikkelsen JD:甜菜抗真菌半胱氨酸新蛋白的鉴定和定位。植物与微生物相互作用,1995,8(3):424-434。
- 45.
王志强,王志强,王志强,等。矮牵牛-硫蛋白基因的克隆与表达。植物分子生物学,1994,26(1):459-464。10.1007 / BF00039555。
- 46.
李,李志强,李志强:从观赏烟草和矮牵牛中分离出花防御素的研究进展。植物科学进展,2003,31(3):344 - 344。10.1104 / pp.102.016626。
- 47.
Park HC, Kang YH, Chun HJ, Koo JC, Cheong YH, Kim CY, Kim MC, Chung WS, Kim JC, Yoo JH, Koo YD, Koo SC, Lim CO, Lee SY, Cho MJ:编码一种新型植物防御素的花蕊特异性cDNA的鉴定。植物分子生物学,2002,50(1):59-69。10.1023 /: 1016005231852。
- 48.
Tregear JW, Morcillo F, Richaud F, Berger A, Singh R, Cheah SC, Hartmann C, Rival A, Duval Y:油棕榈花序中表达的防御素基因的特征:组织培养期间的诱导及其与表观遗传体细胞无性系变异事件的可能关联。应用物理学报,2002,29(3):344 - 344。10.1093 / jexbot / 53.373.1387。
- 49.
Urdangarin MC, Norero NS, Broekaert WF, de la Canal L:向日葵花序中表达的防御素基因。植物物理与生物化学,2000,38(3):253-258。10.1016 / s0981 - 9428(00) 00737 - 3。
- 50.
Moreno M, Segura A, Garcia-Olmedo F: Pseudothionin-St1,一种对马铃薯病原体有活性的马铃薯肽。中国生物医学工程学报,1998,23(3):326 - 326。10.1111 / j.1432-1033.1994.tb18974.x。
- 51.
Meyer B, Houlne G, Pozueta-Romero J, Schantz ML, Schantz R:防御素型基因家族在甜椒果实中的特异性表达。成熟期间和受伤时的上调。植物营养学报,2004,27(2):344 - 344。10.1104 / pp.112.2.615。
- 52.
吴宝杰,高志明,陈志明,陈志伟,金晓娟:辣椒与炭疽菌相互作用中防御素基因和硫蛋白样基因的共表达。植物分子生物学,1999,41(3):313-319。10.1023 /: 1006336203621。
- 53.
Wisniewski ME, Bassett CL, Artlip TS, Webb RP, Janisiewicz WJ, Norelli JL, Goldway M, Droby S:桃树皮和果实组织中一种防御素的鉴定及酵母毕赤酵母(Pichia pastoris)重组防御素的抗菌活性。中国生物医学工程学报,2003,29(4):344 - 344。10.1046 / j.1399-3054.2003.00204.x。
- 54.
Ahn IP, Park K, Kim CH:根杆菌诱导的抗性干扰病毒疾病的进展并触发防御相关基因的表达。分子化学,2002,13(2):302-308。
- 55.
de Zélicourt A, Letousey P, Thoiron S, Campion C, Simoneau P, Elmorjani K, Marion D, Simier P, Delavault P: Ha-DEF1,向日葵防御素,诱导Orobanche寄生植物细胞死亡。植物学报,2007,26(3):591-600。10.1007 / s00425 - 007 - 0507 - 1。
- 56.
Hanks JN, Snyder AK, Graham MA, Shah RK, Blaylock LA, Harrison MJ, Shah DM:截叶苜蓿防御素基因家族:结构、表达及信号分子诱导。植物分子生物学,2005,58(3):385-399。10.1007 / s11103 - 005 - 5567 - 7。
- 57.
Koike M, Okamoto T, Tsuda S, Imai R:冬小麦在冷驯化过程中特异诱导了一种新的植物防御素样基因。生物化学学报,2002,29(2):344 - 344。10.1016 / s0006 - 291 x(02) 02391 - 4。
- 58.
Manners JM, Penninckx IA, Vermaere K, Kazan K, Brown RL, Morgan A, Maclean DJ, Curtis MD, Cammue BP, Broekaert WF:拟南芥植物防御素基因PDF1.2的启动子被真菌病原体系统激活,对茉莉酸甲酯有反应,但对水杨酸无反应。植物分子生物学,1998,38(6):1071-1080。10.1023 /: 1006070413843。
- 59.
Heuvel van den KJ, Hulzink JM, Barendse GW, Wullems GJ:番茄防御素编码基因tgas118的表达受赤霉素调控。应用物理学报,2001,26(3):344 - 344。10.1093 / jexbot / 52.360.1427。
- 60.
Moran PJ, Thompson GA:拟南芥蚜虫摄食的分子反应与植物防御途径的关系。植物营养学报,2001,26(2):344 - 344。10.1104 / pp.125.2.1074。
- 61.
Symons GM, Davies C, Shavrukov Y, Dry IB, Reid JB, Thomas MR:类固醇葡萄。油菜素内酯参与葡萄果实的成熟。中国植物学报,2006,40(1):344 - 344。10.1104 / pp.105.070706。
- 62.
高AG, Hakimi SM, mittank CA,吴勇,Woerner BM, Stark DM, Shah DM,梁杰,Rommens CM:植物防御素肽表达对马铃薯真菌病原的保护作用。生物技术学报,2000,18(12):1307-1310。10.1038/82436。
- 63.
谢晓明,王志刚,王志刚,王志刚,王志刚。植物防御素和硫代蛋白诱导真菌膜反应的研究进展。中国生物医学工程学报,1996,27(2):379 - 379。10.1074 / jbc.271.25.15018。
- 64.
戴维森,王晓明,王晓明,等。植物防御素对真菌膜渗透的抑制作用。环境科学学报,1999,29(3):344 - 344。
- 65.
Murashige T, Skoog F:烟草组织培养快速生长和生物测定的修订培养基。中国农业科学,2004,27(4):489 -497。10.1111 / j.1399-3054.1962.tb08052.x。
- 66.
基因组研究所。[http://www.tigr.org]
- 67.
Davies C, Robinson SP:葡萄果实的糖积累(两个假定的液泡转化酶cdna的克隆及其在葡萄组织中的表达)。中国农业科学,2004,27(1):1 - 5。10.1104 / pp.111.1.275。
- 68.
杨晓明,王晓明,王晓明,等。葡萄DNA提取方法的研究进展。中国生物医学工程学报,2004,25(1):1 - 6。
- 69.
李志强,李志强,李志强。分子克隆技术的研究进展。纽约,冷泉港出版社,1989年。
- 70.
Thompson JD, Gibson TJ, Plewniak F, Jeanmougin F, Higgins DG: ClustalX窗口界面:由质量分析工具辅助的多序列比对的灵活策略。核化学学报,1997,25:476 - 482。10.1093 / nar / 25.24.4876。
- 71.
张春华,张志刚,张志刚,等:一种提取松材中核糖核酸的方法。植物分子生物学学报,2003,19(4):319 - 319。10.1007 / BF02670468。
- 72.
基因组学和生物信息学研究所。[http://www.igb.uci.edu]
- 73.
CBSU Web计算资源。[http://cbsuapps.tc.cornell.edu/loopp.aspx]
- 74.
蛋白质组分析专用亚细胞定位服务器。[http://www.cs.ualberta.ca/%7Ebioinfo/PA/Sub/index.html]
- 75.
Expasy蛋白质组学工具。[http://us.expasy.org/tools/]
- 76.
Gleave AP:一种多功能的二元载体系统,具有T-DNA组织结构,有助于将克隆DNA有效整合到植物基因组中。植物化学学报,2002,20(3):344 - 344。10.1007 / BF00028910。
- 77.
Mattanovich D, Ruker F, da Camara Machado A, Laimer M, Regner F, Steinkeliner H, Himmler G, Katinger H:电穿孔法高效转化农杆菌。原子核科学,1989,17 (16):6747-10.1093/nar/17.16.6747。
- 78.
霍希R, Fry J, Hofmann N, Eichhlotz D, Rogers S, Fraylet R:一种简单而通用的植物基因转移方法。科学通报,1985,27(3):344 - 344。10.1126 / science.227.4691.1229。
- 79.
Schagger H, von Jagow G:用于分离蛋白质的三辛-十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,范围从1到100 kDa。中国生物化学杂志,1997,27(3):366 - 366。10.1016 / 0003 - 2697(87) 90587 - 2。
- 80.
罗凯德W,特拉斯F, Cammue B, Vandereyden J:一种抑制真菌生长的自动定量检测方法。FEMS微生物莱特。1990, 29(4): 344 - 344。10.1111 / j.1574-6968.1990.tb04174.x。
- 81.
Gangwar M, Cole R, Ramani R, Sheehan D, Chaturvedi V:应用荧光探针研究两性霉素B、伊曲康唑和伏立康唑对烟曲霉结构的影响。中国生物医学工程学报,2006,26(2):344 - 344。10.1007 / s11046 - 006 - 0040 - y。
确认
我们要感谢以下个人的支持和贡献:斯坦伦博斯大学中央分析设施的M Stander博士的LC\MS结果;Dr E Pool用于抗体生产;Rob Smith博士和Ben Loos先生帮助进行荧光显微分析;M Rautenbach博士对重组Vv-AMP1的纯化提出了宝贵的建议。这项工作得到了国家研究基金会、THRIP、Winetech和落叶水果生产商信托基金的资助。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
MAV监督了这项工作,并帮助进行概念设计、手稿准备以及最终的数据分析。亚行进行了概念和实验设计,并负责所有的研究程序。
作者提交的图片原始文件
下面是作者提交的原始图片文件的链接。
权利和权限
本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用属性许可协议(http://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
de Beer, A. Vivier, M.A. Vv-AMP1,一种成熟诱导肽葡萄具有很强的抗真菌活性。BMC植物生物学8日,75(2008)。https://doi.org/10.1186/1471-2229-8-75
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-8-75
关键字
- 绿色荧光蛋白
- 葡萄浆果
- Murashige斯
- 植物Defensin
- 真菌细胞膜