摘要
背景
在传统的葡萄产区,生产应呈现出一定程度上取决于葡萄品种的典型性。因此,葡萄改良被认为是困难的,因为在其特性的范围内,品种的自然变异的选择是有限的。绕过这个问题的一种可能是利用体细胞可变性。在体外体细胞胚胎发生和器官发生可导致基因型和表型变异,称为体细胞无性系变异,这可能有助于改良葡萄基因型的选择。
结果
为了研究葡萄组织培养诱导的变异,我们利用分子标记技术分析了从两个不同品种的体细胞胚中获得的78个体细胞无性系。SSRs仅用于验证体细胞无性系和各自母无性系之间微卫星基因型的保守性。母克隆与体细胞无性系之间的AFLP多态性是无性系之间的1.3 ~ 2.8倍。然而,大多数体细胞无性系(45/78)只表现出很少的变化。将‘霞多丽96’和‘西拉174’的7个和5个体细胞无性系分别用于MSAP研究,这些无性系至少覆盖了AFLP分析中发现的所有多态性位点。所有120个多态性片段均仅在体细胞无性系中发现。体细胞无性系中CCGG识别位点的完全甲基化百分比略高,这是由于切割后产生了更多的多态性带生态RI /下丘脑-垂体-肾上腺轴的2不同的消化模式显示不同的甲基化状态,特别是不同程度的去甲基化,这是不同的结果在体外文化。
结论
MSAP突出了体细胞无性系与母无性系相比的DNA甲基化变异,因此,它是体细胞胚源葡萄基因型表征的有力工具。在许多不同品种的体细胞无性系中发现相同的多态性条带,提示DNA甲基化变异可能存在热点。“霞多丽”和“西拉”体细胞无性系的SSR图谱与各自的母无性系相同。与传统的田间无性系选择相比,体细胞无性系表现出更高的AFLP变异。因此,体细胞胚胎发生通过在体外培养技术可用于选育变化较小但保留主要性状的良种。
背景
葡萄藤是世界上经济上最重要的栽培水果作物。属葡萄属由40至60个亚洲种、25个北美种和一个欧洲种组成。葡萄L.后者种种植生产高品质的水果和葡萄酒,但显示出许多病原体(根瘤蚜,霜霉和白粉病,腐烂等)的敏感性。前者主要用于培育砧木和抗真菌接穗栽培品种。葡萄藤通过扦插繁殖,所得到的无性系在基因上彼此相同(除了体细胞突变),而且与母株(源自栽培品种的原始幼苗)相同。
克隆变异性诉酿酒用葡萄栽培品种(cépages)已被用于传统的葡萄栽培领域,在那里“真实型”是必不可少的,甚至是强制性的。但这种无性系(葡萄学和卫生学)的选择往往仍然是有限的和经验的。拓宽无性系选择的一种方法可能是诱导体细胞无性系变异,其范围从易于检测的一般形态特征偏差到细微偏差,例如活力、束和浆果大小、糖和酸浓度以及风味成分。Desperrier等.[1[分析诉酿酒用葡萄“Gamay”的体细胞无性系在十年的时间里:所有的体细胞无性系与植物性的相比,不断地降低了育性和生产力例体外传播的控制。这导致了糖含量的急剧增加和更好的成熟度。作者从观察到的体细胞无性系之间的差异得出结论,预期的可变性是存在的。然而,对葡萄体细胞无性系进行如此广泛的农艺分析的报道很少,对其中涉及的机制也知之甚少。由体细胞无性系变异引起的在体外培养也称为组织培养诱导变异[2,3.].体细胞无性系变异可能涉及染色体数目和结构、基因突变、序列拷贝数改变、转座元件激活、体细胞交叉、姐妹染色单体交换、DNA扩增和缺失以及甲基化模式的改变[4,5].基因型和在体外培养条件(外植体类型、培养基、时间)影响体细胞无性系变异的发生和频率[6].环境压力诱导遗传和表观遗传变化,从而触发DNA甲基化。DNA甲基化可产生新的可遗传的表型变异[7].植物DNA的胞嘧啶甲基化发生在CpG、CpNpG(其中N是任何核苷酸)和不对称的CpHpH位点(其中H是腺嘌呤、胞嘧啶或胸腺嘧啶)。水稻胞嘧啶甲基化多态性大于DNA多态性[8),拟南芥[9]或棉花[10].
甲基化模式据报道是不同的在体外-再生植物及其后代,如水稻[11],玉米[12,13]、油棕[14],香蕉[15),Medicago truncatula[16],玫瑰[17], hop [18],大麦[19,20.),党参生长状况[21]和马铃薯[22].
在本工作中,我们研究了来自两个不同的葡萄体细胞植物的大量体细胞无性系变异诉酿酒用葡萄品种。用6个SSRs标记来评估体细胞无性系与母无性系的一致性。我们利用甲基化敏感的AFLP,重点研究了葡萄体细胞无性系甲基化模式的可能变化。与母无性系相比,在体细胞无性系中检测到特定位点的不同甲基化状态。检测到的体细胞无性系变异表明,DNA去甲基化发生在在体外文化的过程。
结果
微卫星分析
从温室生长的嫩叶中提取DNA诉酿酒用葡萄“霞多丽”克隆96、131和548,“西拉”克隆174和“d’auvergne”,56个somaclones来自“霞多丽96”,22个somaclones来自“西拉174”,以及其他诉酿酒用葡萄栽培品种和种间杂交品种(表1).对葡萄综合遗传图谱上的6个微卫星位点VMC6C10、VMC5G7、VVMD5、VVMD7、VVMD27和VVS2进行了DNA分析,这些位点分别归属于葡萄14、2、16、7、5和11连锁群。23].参考品种的微卫星等位基因大小与文献描述一致[24对于一个特定的品种(‘霞多丽’或‘西拉’),克隆在微卫星剖面上没有显示出任何差异。在所有情况下,体细胞无性系和各自的母无性系在所有6个标记位点上共享相同的等位基因1).
总的来说,我们在调查的葡萄基因型面板中共检测到52个带有6个微卫星标记的等位基因。在各种基因中也未发现与已发表基因不同的新微卫星等位基因诉酿酒用葡萄品种和种间杂交砧木栽培品种或其他葡萄属物种。
妊娠分析
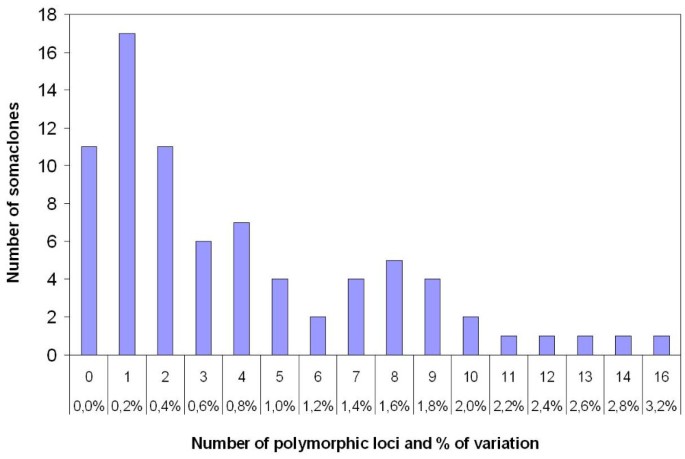
使用五生态RI /Msp引物组合,诉酿酒用葡萄对‘霞多丽96’和‘西拉174’进行了三次生物复制分析,每个引物组合平均产生101个片段,总共有505个研究位点。然后为56个“霞多丽96”和22个“西拉174”体细胞无性系生成DNA图谱,并与它们的母克隆进行比较。在这一比较中,分别发现25个和21个位点在‘霞多丽96’和‘西拉174’的体细胞无性系中表现出多态性2).这分别相当于‘霞多丽96’和‘西拉174’体细胞无性系总变异的5.0%和4.2%。10个‘霞多丽96’和1个‘西拉174’体细胞无性系在使用的5个引物组合中没有显示出任何多态性(图1).对于其余的体细胞无性系,多态性片段的数量在1个(变异率0.2%)到16个(3.2%)之间,平均每株有4.5个多态性。所有这些片段都是新的条带,因为它们只在体细胞无性系中发现,而在母无性系中没有。在母克隆中未观察到原始条带的丢失。此外,这些多态性位点中有12个同时存在于“霞多丽96”和“西拉174”体细胞无性系中。如多态性片段E46M84-358所示,显示相同可变标记的体细胞无性系的数量在2到34之间(表2 - 34)2).仅发现3个单例,即在体细胞无性系中只出现过一次的变异片段。总结,在39390个DNA片段中扩增出78诉酿酒用葡萄体细胞无性系,307个存在多态性。
对于3个不同的霞多丽无性系‘96’、‘131’和‘548’,总DNA变异的百分比为1.8(9个可变标记/505个总标记),对于‘西拉174’和‘西拉d’奥弗涅’的比较,总DNA变异的百分比为3.2(16/505),西拉是从奥弗涅地区发现的老葡萄品种开始繁殖的。在这个水平上诉酿酒用葡萄品种中,‘霞多丽96’与‘西拉174’的多态性程度占31.9%(161/505)。
MSAP分析
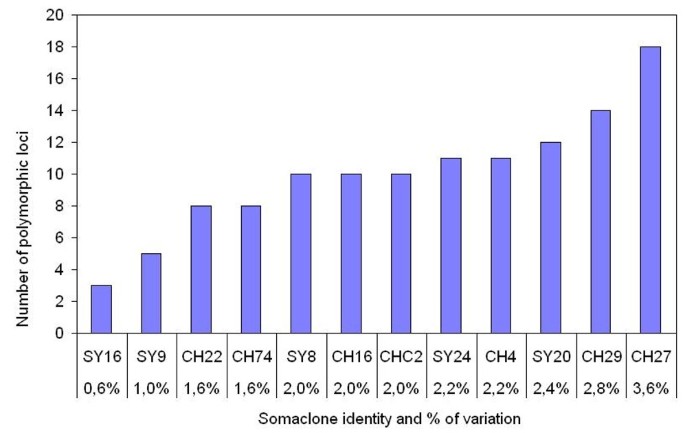
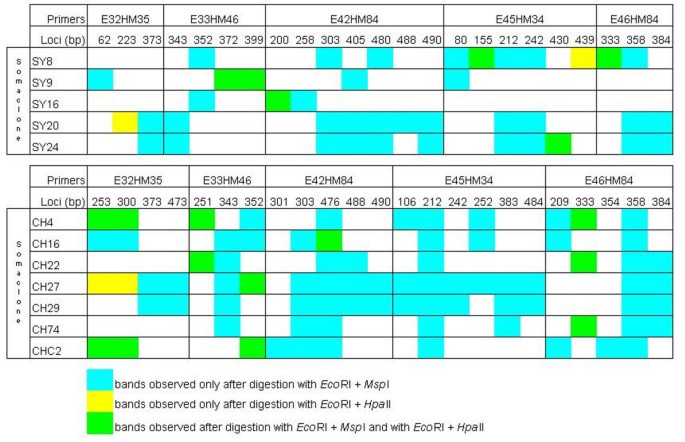
“霞多丽96”和“西拉174”的体细胞无性系分别为7个和5个,这至少涵盖了在该品种中发现的所有多态性位点生态RI /Msp选择I片段分析,用等裂体消解下丘脑-垂体-肾上腺轴的2为估计甲基化程度,从生态RI /Msp我和生态RI /下丘脑-垂体-肾上腺轴的比较了相应体细胞无性系的II酶切DNA,共观察到120个差异扩增片段。每个体细胞无性系的可变标记数在3个(Syrah somaclone no。16)和18(霞多丽体细胞无性系27号)分别对应0.6和3.6%的变异(图2).在AFLP分析中,所有多态性均以新片段的形式出现在体细胞无性系中。这些片段是在对两个同位分裂体进行鉴别识别后产生的,在12个体细胞无性系中产生了不同的MSAP模式(图3.).裂解产生98个(82%)碎屑Msp我却不是下丘脑-垂体-肾上腺轴的II表明体细胞无性系识别序列的内部胞嘧啶完全甲基化,而外部胞嘧啶没有甲基化。只有4个碎片(3%)是由切割产生的下丘脑-垂体-肾上腺轴的二而非MspI由于外胞嘧啶半甲基化,而内胞嘧啶未甲基化。与AFLP分析相比,这些MSAP位点对应于新的波段。18个片段(15%)是由两种限制性内切酶裂解产生的,表明与母克隆相比,体细胞无性系的DNA中两种胞嘧啶都完全去甲基化。有趣的是,在4个‘霞多丽96’体细胞无性系中,E32M35-253和E32M35-300这两个可变标记的出现是由于三种不同的消化模式,表明在这些标记位点上,各自体细胞无性系的甲基化状态不同。此外,在12个“霞多丽”和“西拉”体细胞无性系中,共有11个多态位点。葡萄体细胞无性系各变量带的数量见表3..
基于这些MSAP配置文件,计算了非甲基化、半甲基化和全甲基化CCGG位点的数量4).在母克隆“西拉”和“霞多丽”中,10.1%和12.3%的目标序列在内部胞嘧啶上完全甲基化,而在外部胞嘧啶上半甲基化的比例分别为2.4%和4.2%。所有12个体细胞无性系的内部c完全甲基化水平均略高(“西拉”体细胞无性系为10.4% ~ 12.0%,“霞多丽”体细胞无性系为13.2% ~ 14.7%)。然而,这些改变在统计学上不显著(Khi2检验;P(2-tailed)= 0.208 > 0.05)。
讨论
组织培养诱导的改变,包括形态学、细胞学、生化和遗传/表观遗传改变,已被频繁报道。然而,这种所谓的体细胞无性系变异背后的机制在很大程度上仍不清楚[3.,18].在许多研究中检测到胞嘧啶甲基化的修饰,表明表观遗传改变可能发挥重要作用[11- - - - - -22].最近的研究指出,植物组织培养过程诱导的遗传和表观遗传变化可能相互作用[20.,21].
本研究应用SSRs、AFLP和MSAP技术对56个‘霞多丽96’和22个‘西拉174’体细胞无性系的遗传和表观遗传稳定性进行了评价。
ssr标记对葡萄品种的区分具有重要意义。来自10个实验室的比较研究[24仅仅两个标记就足以区分46个栽培品种。4个额外的位点被用于增加多态性,从而降低错误识别的概率。使用6颗微型卫星,其中4颗来自This的工作等.[24],我们没有发现母克隆和体细胞无性系之间有任何差异。因此,在体外培养植物的基因型与栽培品种一致,表型与类型的真实性将通过最近种植的田间小区的观察进一步证实。
Imazio等.[25]表明SSRs并不是克隆区分的有力工具诉酿酒用葡萄“Traminer”。微卫星分析25诉酿酒用葡萄除3个位点外,其余8个位点的“Sangiovese”均未表现出多态性。之前的传统安培测量研究已经表明,这3种不同的血统并不是真正的“桑娇维塞血统”[26].因此,微型卫星既不能用于检测特定葡萄品种的无性系,也不能用于检测葡萄品种的体细胞无性系变异V.酿酒用葡萄.
相比之下,采用AFLP和MSAP技术的Imazio等.[25虽然平均相似度很高(97.1%),但在24个被检测的‘Traminer’克隆中,有16个可以被区分出来。此外,AFLP标记成功应用于一种“烈焰无籽”葡萄品种与其亲本基因型之间的区分,该葡萄品种具有较早的发芽时间。27].
在我们的AFLP研究中,‘霞多丽’和‘西拉’体细胞无性系中分别有25个和21个位点出现多态性,对应的遗传变异频率分别为5%和4.2%。野生大麦组培再生材料的遗传变异频率较高(9.3%),多数多态性条带是原有条带的损失[20.].在我们的研究中没有损失条带,这可能解释了观察到的较低水平的变异。少数体细胞无性系积累了大量的多态条带。只有2’西拉174’和5’霞多丽96’的体细胞无性系表现出10个或更多的变异带,而大多数(45/78)表现出不到4个多态性带。在野生大麦的组织培养中也观察到这种分布,少数再生剂积累了大量的变异带[20.].
研究体细胞无性系变异的另一种可能是评估DNA甲基化程度。对整体甲基化水平和特定位点甲基化水平的研究表明,DNA甲基化的变化在植物体内频繁发生在体外文化的过程。大多数变化是甲基化的减少,其频率是甲基化增加频率的三倍或更高[3.,19].在愈伤组织来源的啤酒花植株中,MSAP检测到的对照和再生啤酒花体细胞无性体之间83%的多态性位点变化是识别位点的去甲基化。在长时间愈伤组织培养中观察到变异增加[19].一些体胚来源的油棕显示出一种“被膜”变异表型,影响雄性和雌性花的花器官的形成。通过体细胞胚胎发生获得的再生体中检测到DNA甲基化缺陷,然而,不可能将其与异常表型的发生联系起来[28,29].相比之下,竹体胚的3个不同阶段的MSAP分析均未检测到表观遗传变化在体外培养,使用三对引物[30.].
使用5对引物,我们获得了120个多态MSAP片段,其中95%与AFLP分析中报道的片段相似。因此,多态性条带在很大程度上是由于甲基化的变化,但不应排除突变。在一项大麦组织培养诱导变异的研究中,变异的平均水平为6%,其中约1.7%归因于核苷酸突变,其余则是甲基化状态的变化[19].因此,在葡萄体细胞无性体中检测到的一些变异也可能来自核苷酸突变。组织培养还可以发现积累在葡萄藤中的体细胞突变[31,32],也可以解释一些检测到的多态性。
所有12个体细胞无性系的胞嘧啶甲基化水平略高于母体无性系的水平4).这主要是由于内部Cs的完全甲基化水平较高,因为大多数多态带是由裂解产生的Msp我却不是下丘脑-垂体-肾上腺轴的2在野生大麦组织培养的情况下,李等.报告了CCGG位点胞嘧啶甲基化水平的显著降低[20.].从10个再生剂党参生长状况, 7在胞嘧啶内完全甲基化水平上升不大,但总甲基化水平基本稳定。然而,正如我们研究中的情况一样,作者报告说,胞嘧啶甲基化水平的任何改变都没有统计学意义[21].在这两项研究中,MSAP分析揭示了不同位点上甲基化模式的改变,再生剂彼此之间以及与供体植物之间都是不同的[20.,21].在我们的研究中,所有的12个体细胞无性系都表现出不同的MSAP特征,并且与各自的母克隆不同(图3.),也表明了广泛的表观遗传多样化诉酿酒用葡萄;产生。
与母克隆相比,体细胞无性系中未观察到条带损失,这表明母克隆和体细胞无性系之间的所有单型MSAP位点均表现出相同程度的胞嘧啶甲基化。这些基因座不受在体外文化的过程。新条带仅在体细胞无性系中检测到,可能是由这些植物CCGG识别位点胞嘧啶甲基化状态的改变引起的。一个或多个胞嘧啶去甲基化可以产生一个新的MSAP片段,而在母克隆中没有检测到。这一假设的一个论点是,这3种不同的消化模式,即只由生态RI /Msp我,只靠生态RI /下丘脑-垂体-肾上腺轴的在4个不同的‘霞多丽96’体细胞无性系中发现了E32M35-253和E32M35-300。结果表明,这些标记位点表现出不同的甲基化状态。在母克隆‘Chardonnay’中,识别序列的内外胞嘧啶均被甲基化,两条链上的胞嘧啶也被甲基化(未检测到条带);在体细胞无性系中,不同胞嘧啶的去甲基化可能发生导致不同的裂解Msp我和/或HpaII,导致不同的MSAP模式。对体细胞无性系和母无性系中的这些特定片段进行测序应该有助于解决这个问题。
总之,我们的MSAP分析表明,期间胞嘧啶甲基化水平的改变和DNA甲基化模式的改变,特别是去甲基化在体外文化。
黑麦体细胞胚的RAPD分析显示,同一多态带在不同愈伤组织获得的几种植株中存在不同的DNA不稳定性热点[33].在一项关于大麦组织培养诱导变异的研究中,一些可能的甲基化模式没有被确定,而其他一些非常罕见,这支持了(epi)突变的非随机诱导。有趣的是,甲基化状态的变化受到这些非随机事件的影响,而不是序列修改[19].我们对葡萄体细胞胚的AFLP和MSAP分析也表明,在许多体细胞胚中存在一些多态性带,与栽培品种来源无关(‘霞多丽’或‘西拉’)。这些条带可能起源于葡萄基因组的高变区,并可能揭示至少在体细胞胚胎发生过程中DNA甲基化变化的热点。
结论
愈伤组织再生植株的遗传稳定,无明显的表型变异,是进行微繁和遗传转化的必要条件。对葡萄树来说,真实是必不可少的,尤其是在传统的葡萄产区,高品质是先决条件。另一方面,从愈伤组织中再生的体细胞无性系可能是一种变异来源,在植物育种中具有潜在的应用价值。
利用ssr、aflp和maps分析了来自两个不同葡萄品种的78个体细胞无性系,以确定体细胞无性系的变异水平。SSRs仅用于验证体细胞无性系的微卫星基因型与其对应的母无性系的保守性。母克隆与体细胞无性系之间的AFLP多态性是无性系之间的1.3 ~ 2.8倍。MSAP是一种非常有效的方法,可以突出体细胞无性系与母无性系的DNA甲基化差异。不同的消化模式显示不同的甲基化状态,特别是不同程度的去甲基化,这是不同的结果在体外文化。
此外,由于在许多不同品种的体细胞无性系中发现了相同的多态性条带,我们推测可能存在DNA甲基化热点。需要进一步的研究来验证这一假设,并更好地理解体细胞胚胎发生和植物发育过程中的表观遗传控制。
由于体细胞胚胎发生的变异程度高于无性系选择的变异程度,因此,体细胞胚胎发生可用于选择变异较小但保留主要性状的良种。然而,对型的真实性必须通过表型观察和葡萄酒测试来证实。
方法
植物材料
从中获得57个体细胞无性系葡萄简历。96号克隆霞多丽和22瓶somacloneV.酿酒用葡萄简历。“西拉克隆174”在其他地方有描述[34].作为分子标记分析的对照,我们使用V.酿酒用葡萄“霞多丽克隆96”和“西拉克隆174”,“霞多丽克隆131”,“霞多丽克隆548”,一种独特的西拉,从奥弗涅地区种植的老品种中获得,被命名为“西拉·奥弗涅”,“Furmint”,“苏维翁克隆530”,“苏维翁克隆159”,“桑娇维塞”和“黑皮诺克隆743”。作为不同于诉酿酒用葡萄,我们用诉锐利“蒙彼利埃克隆1030”,种间杂交:诉锐利×诉rupestris'101-14克隆1043',Seibel 9110 = Verdelet ('Seibel 5455 × Seibel 4938')和葡萄藤砧木'41B克隆194' (诉酿酒用葡萄“夏色拉”×诉? ?).植物是在温室里受控条件下种植的。收集新鲜的未膨胀的嫩叶,保存在-80°C,直到用于DNA提取。
DNA提取
使用研磨机(Retsch MM200, Haan,德国)在液氮中研磨约80 mg叶片,并按照供应商的描述使用QIAGEN DNeasy Plant Mini Kit (QIAGEN, Hilden,德国)提取总DNA。在AP1裂解缓冲液中添加2.5% PVP40。在1%琼脂糖凝胶中电泳检测DNA质量和浓度。
微卫星分析
分析了6个不同的基因组微卫星位点:VVS2, VVMD5, VVMD7, VVMD27 [24]、VMC6C10和VMC5G7(葡萄微卫星联盟,Rosa Arroyo Garcia博士和Kirsten Wolff博士)。扩增反应在25 μl的总体积中进行,其中包括10 ~ 20ng模板DNA, 10ng用6-FAM或HEX荧光基团标记的正向引物,10ng无标记反向引物,每个dNTP (MP Biomedicals, Heidelberg, Germany) 200 μM, 1× PCR Buffer和0.5单位TaqDNA聚合酶(MP Biomedicals)。PCR在MJ Research PTC 200热循环仪(Waltham, MA, USA)中进行。
循环程序包括以下步骤:在94°C下2分钟,然后在94°C下45秒,52°C下30秒,72°C下1分钟的35个循环,最后在72°C下7分钟的延伸步骤。扩增产物用ABI PRISM进行检测®377 DNA测序仪(应用生物系统公司,达姆施塔特,德国)使用5%变性聚丙烯酰胺凝胶(36厘米)和GeneScan-500 TAMRA作为内部尺寸标准。使用GeneScan™分析软件3.1版(应用生物系统公司)测定DNA片段的大小。
AFLP和MSAP分析
DNA (200 - 400 ng)用5U消化生态RI和5uMsp我或下丘脑-垂体-肾上腺轴的II (New England BioLabs, Frankfurt am Main, Germany),最终体积为30 μl,含1× NEB2缓冲液和BSA (75 ng/μl)。同时连接DNA片段Msp我- - - - - -下丘脑-垂体-肾上腺轴的II (50 pmol)和生态RI (5 pmol)适配器3小时,在37°C使用1 mM ATP和1U T4 DNA连接酶(New England BioLabs)。样品用TE稀释0.1缓冲液的最终体积为200 μl。的序列生态国际扶轮和Msp我/下丘脑-垂体-肾上腺轴的II适配器是由Vos描述的等.[35]和熊等.[36),分别。
E01和HM0引物各加2.5 pmol,预扩增量为4 μl5), 200 μM dNTPs (MP Biomedicals), 1× PCR缓冲液,0.5 UTaq最终体积为20 μl的DNA聚合酶(MP Biomedicals)。分别在65°C和94°C下2 min后,进行预扩增,进行变性(94°C下20 s)、退火(56°C下30 s)和延伸(72°C下2 min) 20个循环。在最后的延伸步骤(72°C 2 min, 60°C 30 min)后,将预扩增产物在TE中稀释1:100.1缓冲区。
选择性扩增使用选择性引物组合进行,如表所示5.在总体积为20 μl的条件下,使用预扩增混合物4 μl, 1.5 pmol生态用6-FAM或JOE荧光团标记的RI引物荧光染料,5pmolMsp我- - - - - -下丘脑-垂体-肾上腺轴的II引物,200 μM dNTPs (MP Biomedicals), 1× PCR缓冲液,0.5 UTaqDNA聚合酶(MP Biomedicals)。按Vos描述的方法进行触点PCR等.[35].
用于AFLP分析的电泳平台和条件与微卫星相同,但使用GeneScan-500 ROX作为内部尺寸标准。使用GeneScan™分析软件版本3.1确定DNA片段的大小,使用genetyper™DNA片段分析软件版本2.5.2(应用生物系统公司)对多态性进行评分。
参考文献
Desperrier JM, Berger JL, Bessis R, Fournioux JC, Labroche C: Création克隆dirigée par embryogenèse somatique。牛OIV。2003, 871-872: 751-765。[http://news.reseau-concept.net/images/oiv/client/Bull_OIV_2003_sept_oct.pdf]
拉金PJ,斯考克罗夫特WR:体细胞无性系变异:植物改良中细胞培养变异的新来源。应用理论,1981,60:197-214。10.1007 / BF02342540。
李志强,李志强,李志强:植物体细胞无性系变异的表观遗传学研究。植物化学学报,2000,43:179-188。10.1023 /: 1006423110134。
Rani V, Raina SN:有组织分生组织衍生的微繁殖植物的遗传保真度:一个关键的重新评价。体外细胞开发生物植物。2000, 36: 319-330。10.1007 / s11627 - 000 - 0059 - 6。
Jain SM:作物改良中的组织培养变异。《自然科学》,2001,29(3):344 - 344。10.1023 /: 1004124519479。
影响体细胞胚胎发生诱导和植株再生的因素拟南芥(l)Heynh。植物生长学报,2004,43:27-47。10.1023 / B: GROW.0000038275.29262.fb。
陆健,詹秀娟:植物基因组甲基化状态及其对胁迫的响应:植物改良的意义。植物学报,2007,10:317-322。10.1016 / j.pbi.2007.04.012。
Ashikawa I:水稻品种基因组中5'-CCGG的CpG甲基化研究。植物分子生物学,2001,45:31-39。10.1023 /: 1006457321781。
陈志强,陈志强,陈志强,等拟南芥基于甲基化敏感的AFLP标记。中国生物医学工程学报,2002,29(3):344 - 344。10.1007 / s00438 - 002 - 0772 - 4。
刘波,刘文德,王志强,王志强:棉花种内DNA甲基化多态性分析(陆地棉).王志强,2006,30(3):344 - 344。10.1093 / jhered / esl023。
Brown PTH, Kyozuka J, Sukekiyo Y, Kimura Y, Shimamoto K, Lörz H:水稻原生质体来源的分子变化。中国生物医学工程学报,1998,23(3):324- 324。10.1007 / BF00265070。
Brown PTH, Gobel E, Lörz H: RFLP分析玉米愈伤组织培养及其再生植株。《应用理论》,1998,32(3):377 - 377。10.1007 / BF00215727。
许晓明,李志强,李志强:组织培养诱导玉米DNA甲基化变异。美国国家科学研究院。1993, 30(4): 357 - 357。10.1073 / pnas.90.19.8773。
Jaligot E, Rival A, Beulé T, Dussert S, Verdeil JL:油棕的体细胞无性系变异(Elaeis guineensis): DNA甲基化假说。植物细胞学报,2000,19:684-690。10.1007 / s002999900177。
甲基化敏感扩增多态性(MSAP)检测香蕉幼苗DNA甲基化变化。植物科学学报,2001,26(3):359-367。10.1016 / s0168 - 9452(01) 00421 - 6。
DNA甲基化缺失对体细胞胚胎发生的影响Medicago truncatula.植物科学学报,2002,27(3):357 - 357。10.1023 /: 1016369921067。
许敏,李霞,Korban SS:玫瑰细胞分化过程中dna甲基化的改变与交换(罗莎矮牵牛l .)。应用理论与实践,2004,29(1):1 - 8。10.1007 / s00122 - 004 - 1717 - 6。
Peredo EL, Revilla MA, Arroyo-Garcia R:有机愈伤组织继代再生啤酒花植物遗传和表观遗传变异的评估。中国植物学报,2006,26(3):344 - 344。10.1016 / j.jplph.2005.09.010。
黄志刚,王志刚,王志刚,王志刚。大麦组织培养诱导变异的定量分析(大麦芽l .)。中国生物医学工程学报,2007,7:10-10.1186/1471-2229-7-10。
李霞,于旭,王宁,冯强,董志,刘玲,沈娟,刘波:野生大麦组织培养诱导的遗传和表观遗传不稳定性(大麦brevisubulatum(指标)。链接)。植物科学学报,2007,29(3):344 - 344。10.1007 / s11240 - 007 - 9224 - 5。
郭伟林,吴蓉,张艳芳,刘小明,王海燕,龚玲,张志华,刘波:组织培养诱导的DNA甲基化位点特异性改变及其与遗传变异的关系党参生长状况Benth。等困境。f.植物细胞学报,2007,26:1297-1307。10.1007 / s00299 - 007 - 0320 - 0。
Kumar Sharma S, Bryan GJ, Winfield MO, Millam S:马铃薯的稳定性(茄属植物tuberosumL.)通过体胚、腋芽增殖芽、微块茎和真马铃薯种子再生的植物:比较表型、细胞遗传学和分子评价。植物学报,2007,26(3):344 - 344。10.1007 / s00425 - 007 - 0583 - 2。
Doligez A, Adam-Blondon AF, Cipriani G, Di Gaspero G, Laucou V, Merdinoglu D, Meredith CP, Riaz S, Roux C, This P:基于5个定位群体的葡萄SSR综合图谱。应用理论与实践,2006,26(3):369-382。10.1007 / s00122 - 006 - 0295 - 1。
This P, Jung A, Boccacci P, Borrego J, Botta R, Costantini L, Crespan M, Dangl GS, Eisenheld C, Ferreira-Monteiro F, Grando S, Ibanez J, Lacombe, Laucou V, Magalhaes R, Meredith CP, Milani N, Peterlunger E, Regner F, Zulini L, Maul E:葡萄品种鉴定微卫星参考等位基因标准集的建立。应用理论与实践,2004,29(1):1 - 8。10.1007 / s00122 - 004 - 1760 - 3。
Imazio S, Labra M, Grassi F, Winfield M, Bardini M, Scienza A:克隆鉴定的分子工具:以Traminer葡萄品种为例。植物学报,2002,29(3):344 - 344。10.1046 / j.1439-0523.2002.00762.x。
李丽娟,李丽娟,李丽娟葡萄l“桑娇维塞”经微卫星和非放射性AFLP试验鉴定。电子工程学报,2002,5:1-11。[http://www.ejbiotechnology.info/content/vol5/issue1/full/2]
Scott KD, Ablett EM, Lee LS, Henry RJ:火焰无核葡萄早期突变体的AFLP标记。自然科学进展,2000,29(3):344 - 344。10.1023 /: 1003977408214。
马德华,陈志强,陈志强,陈志强:油棕品种多样性研究(Elaeis guineensis用甲基化敏感酶的aflp显示组织培养来源的再生物。应用物理学报,2001,32(3):379 - 379。10.1007 / s001220000491。
Jaligot E, Beulé T, Baurens FC, Billotte N, Rival A:油棕“被膜”变异表型的甲基化敏感扩增多态性研究(Elaeis guineensisJacq)。中国生物工程学报,2004,47:224-228。10.1139 / g03 - 085。
李志刚,李志刚,李志刚,李志刚。体细胞胚胎发育的研究进展Bambusa balcooa刺梨为基础批量生产的优良林业竹子。植物学报,2007,29(1):1 - 3。10.1007 / s11240 - 007 - 9236 - 1。
杨晓明,陈晓明,陈晓明:葡萄嵌合现象的研究进展。应用理论与实践,2002,29(3):344 - 344。10.1007 / s001220100683。
老板PK,托马斯MR:矮化和花诱导与葡萄“绿色革命”突变的关联。自然科学学报,2002,29(3):344 - 344。10.1038 / 416847。
李纳塞罗,弗雷塔斯·阿尔维斯E, Vázquez AM:黑麦体细胞无性系变异研究揭示的DNA不稳定性热点。应用物理学报,2000,30(3):366 - 366。10.1007 / s001220050066。
杨晓明,杨晓明,杨晓明,杨晓明,杨晓明葡萄简历。霞多丽96是通过器官发生而不是体细胞胚胎发生来维持的。中国生物医学工程学报,2005,26(3):344 - 344。
Vos P, Hogers R, Bleeker M, Reijans M, Lee van de T, Hornes M, Frijters A, Pot J, Peleman J, Kuiper M, Zabeau M: AFLP:一种新的DNA指纹识别技术。核酸工程,1995,23:4407-4414。10.1093 / nar / 23.21.4407。
熊丽珍,徐春春,马saghai Maroof MA,张强:利用甲基化敏感扩增多态性技术检测水稻优良杂种及其亲本胞嘧啶甲基化模式。中国生物医学工程学报,1999,26(3):344 - 344。10.1007 / s004380050986。
确认
作者感谢Flore Kieffer-Mazet博士和Sibylle Farine博士(UHA, LVBE, Colmar,法国)对葡萄体细胞无性系的生产。我们感谢Francis Minet (Pépinières Guillaume, Charcenne, France)提供的一切葡萄属作为对照,Amalie Fiedler (TUM, Freising, Germany)提供优秀的技术援助。
这项工作是在TUM (Freising, Germany)的半年假期间进行的,由UHA (Mulhouse, France)的“科学委员会”获得,并为此表示感谢。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
PS准备DNA材料进行分析,进行分子研究,对凝胶进行评分,对多态性进行量化,并参与了稿件的撰写。VM参与了研究的设计,多态性的评分和量化,并起草了手稿。GW参与了概念工作和手稿的起草。BW构思了这项研究,参与了协调工作,并帮助起草了手稿。所有作者都阅读并批准了最终的手稿。
权利和权限
本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用属性许可协议(http://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
谢伦鲍姆,P.,莫勒,V.,温泽尔,G.。et al。葡萄体细胞无性系DNA甲基化模式的变异(葡萄)。BMC植物生物学8日,78(2008)。https://doi.org/10.1186/1471-2229-8-78
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-8-78
关键字
- 体细胞胚
- 体细胞胚胎发生
- 体细胞无性系变异
- 多态带
- 胞嘧啶甲基化