摘要
背景
晚疫病是世界上最严重的马铃薯病害。控制晚疫病最有效和最环保的方法是在马铃薯品种中引入自然抗性。最近已经克隆了几个晚疫病抗性基因。然而,几乎没有关于这些基因介导的抗性途径的信息。
结果
我们之前克隆了一个晚疫病抗性基因,RB,来自二倍体野生马铃薯品种茄属植物bulbocastanum.含单的转基因马铃薯系RB基因对所有已知的5种晚疫病病原体。为了更好地理解RB-介导的抵抗使土豆沉默了Rar1而且Sgt1在对抗各种植物病原体和害虫的抗病反应中涉及的基因。的Rar1而且Sgt1a基因RB采用基于RNA干扰(RNAi)的方法对马铃薯克隆进行沉默。所有沉默马铃薯植株均表现出正常的生长表型。对晚疫病的抗性Rar1而且Sgt1采用传统的温室接种法对沉默品系进行评价,采用gfp标记进行定量p . 5压力。抵抗Rar1-沉默的植物没有受到影响。然而,沉默的Sgt1基因废除了RB介导的耐药性。
结论
我们的研究表明,沉默Sgt1马铃薯中的基因没有致死性。然而,Sgt1基因是必不可少的RB-介导的晚疫病抗性。相比之下,Rar1基因不是必需的RB介导的耐药性。这些结果为药物的普遍作用提供了额外的证据Sgt1不同的基因R基因介导的植物防御反应。
背景
马铃薯晚疫病,一种由卵菌病原体引起的疾病5种这是世界上最具破坏性的作物疾病之一。全球因晚疫病造成的损失每年超过数十亿美元[1].目前在美国种植的大多数马铃薯品种对晚疫病非常敏感,对这种疾病的控制几乎完全依赖于杀菌剂的应用。控制晚疫病最有效和最环保的方法是在马铃薯品种中引入自然抗性。目前在不同国家使用的许多马铃薯品种的系谱包括来自于茄属植物demissum,茄属植物andigena,以及其他野生物种。然而,这些野生物种的大部分抗性是由单一的显性抗性基因(R基因)。这些R基因只有在入侵时才能有效地防止晚疫病的发展p . 5人种含有相应的致病基因。这R基因介导的抗性通常是短暂的,并迅速被晚疫病病原体的新种族所克服。
茄属植物bulbocastanum(2n = 2x = 24)是一种二倍体物种,适应了与晚疫病病原体相同的环境。这种野生物种的特征是具有持久的抵抗力p . 5,即使在高疾病压力下[2,3.].两种抗性基因,RB(Rpi-blb1),Rpi-blb2,已克隆美国bulbocastanum[4- - - - - -6].这两种基因都对广泛的已知疾病具有广谱抗性p . 5比赛。含单的转基因马铃薯系RB基因在墨西哥托卢卡山谷表现出高水平的抗性,那里的马铃薯田自然密集地生长着最多样化的马铃薯p . 5人口(7].最有趣的是,转基因RB植物对晚疫病没有表现出完全的免疫力,相反,在发病症状和病变发展方面都表现出明显的延迟。这种限速阻力可以减少选择压力p . 5种群和保护这种抗性基因的持久性。的RB因此,基因为研究广谱和限速抗病性机制提供了一个很好的模型。了解这种类型抗性的潜在机制对于制定培育持久和可持续疾病抗性的战略非常重要。
有几个基因涉及调控R基因的功能。在这些基因中,Rar1而且Sgt1是研究最广泛的基因之一。的Rar1(需要Mla12抗性)基因首次被鉴定为其在一个亚群的功能中的重要作用Mla大麦白粉病抗性基因[8].RAR1蛋白含有两个高度相似但不同的富半胱氨酸和组氨酸(CHORD) Zn2 +-结合结构域,被认为在稳定R蛋白中发挥作用,这与接收病原体信号有关[9].的Sgt1的G2等位基因的抑制子skp1)是酵母中具有多种功能的必需基因。在酵母双杂交筛选中,SGT1蛋白最初被确定为rar1相互作用的伙伴[10].SGT1可能在R蛋白积累中起作用[11].Rar1而且Sgt1基因需要在各种各样的R-基因介导的对病毒、细菌、卵菌或真菌病原体的抗性[12].然而,之前的研究都没有R基因表现为非种族特异性和限速抗性表型RB基因。此外,角色的Rar1而且Sgt1基因不是万能的,这些基因对于某些人的抗性来说并不是必需的R基因(12,13].
除了两个广谱抗性基因RB而且Rpi-blb2,亦已克隆出若干种种族特有的晚疫病抗性基因[14- - - - - -16].许多晚疫病抗性基因最近在不同的马铃薯品种或群体中被发现[17- - - - - -25].然而,几乎没有关于这些基因介导的抗性途径的信息。作为最初的努力来理解RB-介导的晚疫病抗性途径,我们沉默了Rar1而且Sgt1利用基于rnai的方法,在含有RB基因。我们证明了SGT1,而不是RAR1,是关键的RB-介导马铃薯晚疫病广谱抗性。
结果
马铃薯的鉴别Rar1而且Sgt1基因
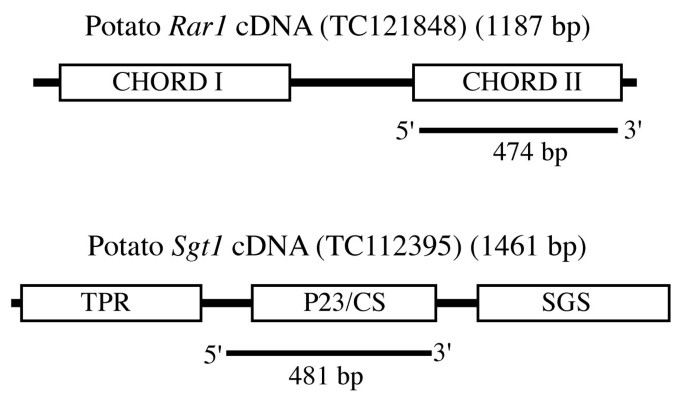
检索基因组研究所(TIGR)马铃薯数据库[26使用烟草的序列Rar1基因(AF480487)鉴定出一个马铃薯EST, TC121848 (1187 bp),与烟草和番茄的序列相似性达96%Rar1记录。类似地,使用番茄序列的搜索Sgt1基因(TC85297)鉴定出马铃薯EST基因TC112395 (1461 bp),与烟草和番茄的序列相似性达98%Sgt1基因与90%序列相似拟南芥Sgt1b基因。因为全长cdna为A. thaliana Rar1而且Sgt1b基因分别为901 bp和1290 bp [27,28],所鉴定的马铃薯ESTs几乎涵盖了马铃薯的每个完整基因。进行Southern blot杂交,以确定该基因的拷贝数Rar1而且Sgt1马铃薯基因组中的基因。从马铃薯无性系K41中分离得到基因组DNARB基因渐渗美国bulbocastanum与马铃薯杂交Rar1而且Sgt1基因探针。Southern杂交结果表明,单倍体马铃薯基因组中只含有一个拷贝Rar1基因和两份Sgt1基因(数据未显示),这与Pajerowska等人(2005)报道的相似结论一致。
基于rnai的马铃薯沉默Rar1而且Sgt1基因
我们为马铃薯开发了RNAi结构Rar1而且Sgt1基因。的Rar1沉默结构包含一个覆盖CHORD II结构域的474 bp片段。的Sgt1构造包含一个481 bp的片段,该片段针对P23/CS域(图2)1).这些结构被用于农杆菌属马铃薯株系K41的基因介导转化。我们获得了65和58个独立的转基因株系Rar1而且Sgt1基因,分别。
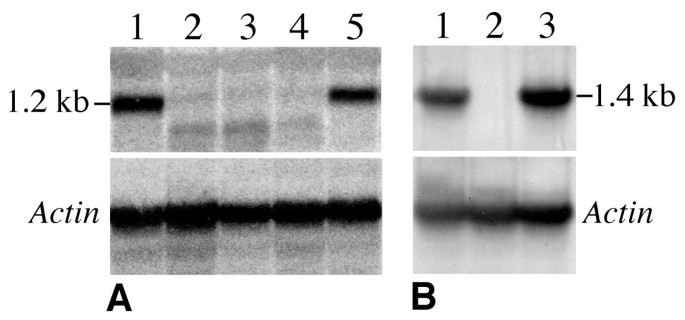
的表达式Rar1而且Sgt1用Northern blot杂交技术对转基因株系中的基因进行分析Rar1(1187 bp)和Sgt1(1461 bp)基因作为探针。的显著降低Rar165例中有47例观察到转录Rar1-RNAi转基因株系分析(表1).Sgt1在58例患者中,有35例出现转录减少Sgt1-RNAi系(表1).三个Rar1-RNAi线和一条Sgt1强化筛选暴露一个多月后-RNAi线未检测到Northern杂交信号(图2).只有这4个品系用于晚疫病抗性评价。我们没有观察到与rnai诱导的沉默相关的可区分的形态学特征Rar1而且Sgt1这些转基因系中的基因。
晚疫病抗性评价Rar1- - -Sgt1-消音土豆线
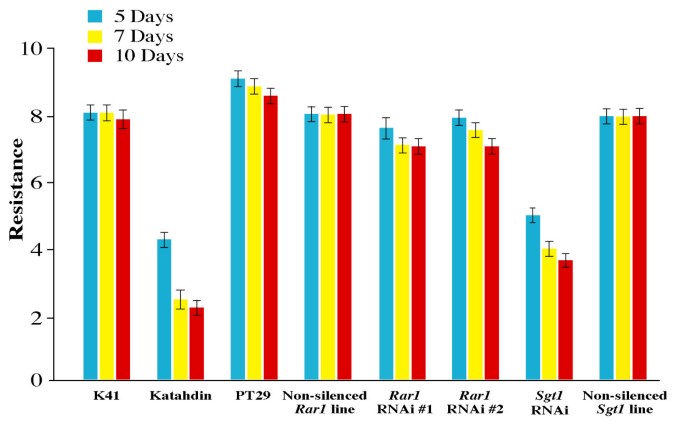
我们对该品种的晚疫病抗性进行了评价Rar1- - -Sgt1控件的多个控件(包含或不包含RB基因,包括转化,但不是沉默Rar1rnai和Sgt1-RNAi系(在这些RNAi系中未发现转录减少)。每一株系的3个重复分别用于两个独立的接种实验。在确定抗性评分时考虑了重复和实验中的所有变异。晚疫病感染的平均得分Rar1接种7 d后-沉默植株的dpi为7.3(±0.6),接种10 dpi后为6.9(±0.0),分别代表约13%和18%的叶片侵染率(图3.,4).未转化的K41植株和未沉默的Rar1-RNAi线平均得分为8.0(±0.0),感染率低于10%。所有易感对照组平均得分为2.1(±0.6)分,感染率为81%。方差分析结果表明,7 d后,受试植株的平均抗性得分差异显著(P-val = 2.2e-16)。Fisher's Least Significant Difference (LSD)检验作为抗性评分的比较手段,显示两组间无显著性差异Rar1-沉默植物和其他抗性对照,但与敏感对照Katahdin有显著差异。这些结果表明RB-介导的耐药不受影响Rar1沉默。
晚疫病抗性评价Rar1- - -Sgt1沉默行.在接种后5、7和10 d进行抗性测定(dpi)。K41:未转换控制(RB+);卡塔丁:敏感对照(RB-);PT29:美国bulbocastanum克隆作为抗性对照(RB+);Non-silencedRar1线(RB+):转基因,但非沉默Rar1-RNAi系(克隆3007);Rar1RNAi line #1 (Rar1沉默,RB+,克隆3128);Rar1RNAi line #2 (Rar1沉默,RB+,克隆2998);Sgt1RNAi线(Sgt1沉默,RB+,克隆3095);Non-silencedSgt1线(RB+):非静音Sgt1-RNAi线(克隆3061)。误差条表示与均值的标准差。
的Sgt1-沉默植株的晚疫病感染率在7 dpi后平均为4.0(±0.0),在10 dpi后平均为3.7(±0.7),分别为~70%和~73%(图)3.,4).采用P-val = 2.2e-16的方差分析,从第7天开始,被试植株的平均抗性得分存在显著差异。Fisher的LSD测试显示Sgt1与抗性对照(未转化的K41)和未沉默的植株相比,-沉默植株的抗性得分有显著差异Sgt1植物。这些结果表明,沉默的Sgt1基因损害了RB-介导的晚疫病抗性。
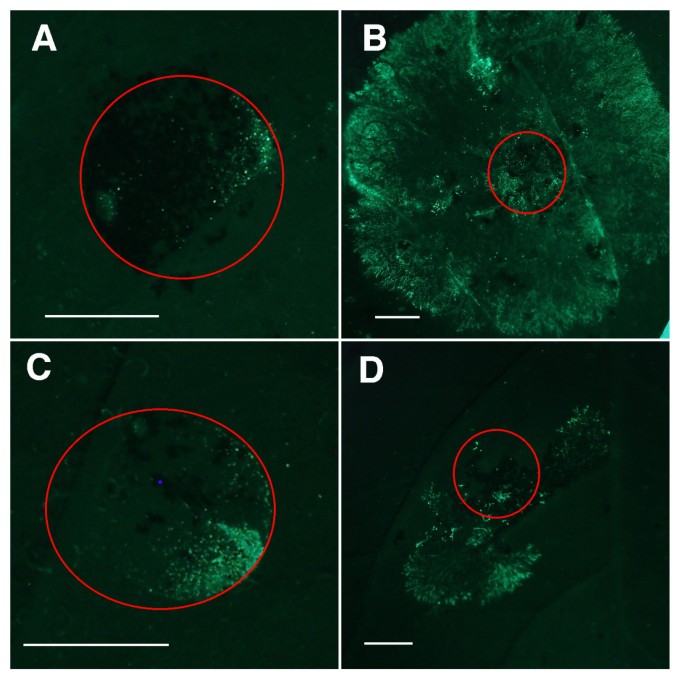
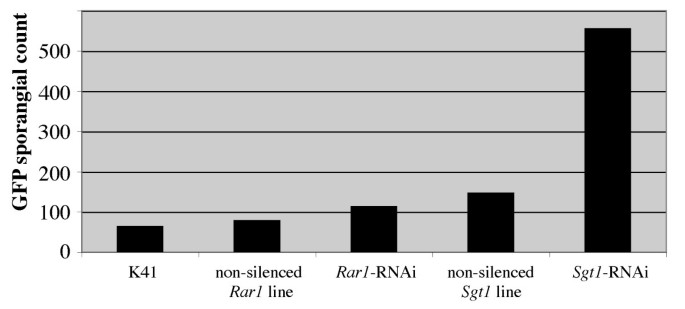
对晚疫病的抗性Rar1- - -Sgt1-沉默线也使用gfp标记进行评估p . 5隔离区208m2 [29].的疫霉通过计数每个区域内荧光孢子囊来量化生长;更多的p . 5增长由更大的数字表示。接种后1天和3天,沉默对照组和非沉默对照组孢子囊数无显著差异。然而,接种6天后,被试植株的孢子囊数量有显著差异(图2)5)基于方差不等的单因素方差分析(F = 3.627, P-val = 0.03142)。Fisher的LSD,使用的alpha值为0.01,表明Sgt1-沉默的植物有更多p . 5以孢子囊数为指标,转基因植株的生长速度明显高于对照K41,但未沉默Rar1rnai和Sgt1-RNAi线和Rar1-沉默植物(图6).这些结果与常规温室评价结果一致。
讨论
的Rar1而且Sgt1马铃薯的基因
Rar1是大麦中的单一复制基因[10),答:芥[28,30.].我们从Southern blot杂交的数据证实了之前的报道只有一个拷贝Rar1存在于单倍体马铃薯基因组中[31].植物rar1突变体没有明显的生长缺陷[32],虽然沉默的Rar1相同器官中秀丽隐杆线虫导致半不育和胚胎致死[8].的Rar1在我们的研究中,-沉默的马铃薯植株没有显示出任何明显的生长表型。
SGT1是酵母中适当的着丝点功能和单拷贝无突变的必要蛋白质Sgt1基因是致命的[33].大多数被分析的植物物种似乎含有两种Sgt1基因(11,31,34,35].的Sgt1a而且Sgt1b双突变体答:芥胚胎是否致命[11].类似地,病毒诱导的基因沉默(VIGS)Sgt1基因(NbSgt1.1而且NbSgt1.2)n benthamiana导致了一种畸形表型[34].在番茄中,消音之多Sgt1-1基因,但不是Sgt1-2是致命的。这一结果可能是由两种声音的沉默造成的Sgt1-1而且Sgt1-2使用VIGS结构设计的基因Sgt1-1[35].相比之下,沉默的小麦和大麦SGT1VIGS基因没有导致生长表型[36,37].但是,拷贝数和功能的冗余性SGT1小麦和大麦的基因尚不清楚,这可能是由于基因的部分沉默和/或由部分同源和非沉默补偿造成的SGT这些物种的基因。
我们未观察到任何异常生长表型Sgt1沉默。完全的沉默Sgt1基因经Northern blot杂交证实(图2 b).两个马铃薯的可用序列Sgt1基因(StSgt1-1: AY615272;StSgt1-2: AY615274) 100%相同。的Sgt1在我们的RNAi结构中使用的cDNA片段也与这些序列具有100%的同源性。这些结果表明,土豆的两个副本Sgt1基因可能在RNAi沉默系中被沉默。因此,似乎沉默的双方Sgt1基因在马铃薯中不是致命的。这一结果将需要多个完全沉默的人来证实Sgt1行。
RAR1和SGT1蛋白在抗病性中的需求
RAR1蛋白在抗病信号传递中的作用首次在大麦中被发现Mla12-介导的白粉病抗性[8].此后,在NB-LRR家族的几个基因授予的抗性途径中,也发现了RAR1的相同作用[12,36- - - - - -38].有趣的是,也有报道说Rar1基因似乎在抗性途径中不起作用。与rar1无关的情况包括Mla1-介导的大麦对白粉病的抗性[10,39),Bs2 / AvrBs2介导的细菌性斑点病抗性n benthamiana[40),而Mi-1-介导的番茄根结线虫抗性[35].我们证明了沉默的单一Rar1基因在马铃薯中不影响RB-介导的晚疫病抗性。
先前的独立于rar1的结论是基于通过生物传递双链RNA构建到单细胞的基因沉默技术[10,39]或由VIGS [35,40].这些技术可能不能完全抑制目标基因,也不能在整个受感染植株中均匀地沉默该基因。假阴性结果必须仔细分类,因为不完全沉默导致的低水平转录本可能足以促进RAR1的功能。的RNAi-silencedRar1根据严格的Northern blot杂交,马铃薯系没有转录本2),这表明Rar1基因。这些稳定的沉默线允许重复的电阻评估。因此,我们从多个RNAi沉默线得到的结果提供了确凿的证据RB-介导的耐药不依赖于RAR1。
RAR1蛋白被认为参与与R蛋白相关的识别复合物的形成或稳定,或协助识别复合物的构象变化[12].这些功能在R蛋白子集的复杂组装中可能不需要。Bieri等人(2004)在大麦中表明rar1对于MLA6而非MLA1抗性受损的突变体,两种MLA亚型的稳态水平都降低了。然而,在转基因系中,MLA6积累到比MLA1低4倍的水平。有趣的是,Mla1独立于Rar1只有当MLA1丰度超过阈值水平时[39].先前的大量研究表明RAR1可能控制NB-LRR型R蛋白的丰度[39].我们认为RB蛋白水平在Rar1沉默的马铃薯品系可能足以触发抗性途径。
许多先前的研究证实了在NB-LRR和SGT1蛋白介导的抗性中需要SGT1蛋白美国专利商标局-激酶型抗性基因,以及非宿主抗性[34,35,37,40,41].几种抗性基因答:芥SGT1b在sgt1b突变体背景[27,28,30.].然而,SGT1a可能弥补SGT1b的损失[11].与其他MLA变体不同,mla1在大麦中引发的抗性在很大程度上不受影响HvSgt1吉恩沉默了[10].在这个系统中使用的瞬时沉默方法可能还不完整,留下一些HvSGT1水平供MLA1发挥作用。或者,与其他MLA变体相比,MLA1需要低水平的HvSGT1才能起作用[10].Bhattarai等人(2007)最近表明,部分沉默的Sgt1-1基因在番茄中导致基因的衰减Mi-1-介导的马铃薯蚜虫抗性,但同样的植物仍然保持Mi-1介导的根结线虫抗性。这些结果支持了植物R蛋白在触发有效抗性所需的SGT1数量上存在差异的假设[11].我们证明了沉默Sgt1显然妥协了RB-介导的晚疫病抗性(图3.,4,5),这表明RNAi方法很可能使基因的两个拷贝都沉默了Sgt1吉恩和Sgt1基因在这一途径中起着关键作用。我们的结果提供了进一步的证据,普遍作用Sgt1不同的基因R基因介导的植物防御反应。
结论
我们开发了基于rnai的基因沉默系Rar1而且Sgt1在一个含有晚疫病抗性基因的马铃薯品系中RB的广谱抗性,可以对抗所有已知的p . 5.静音Rar1而且Sgt1马铃薯中的基因不引起表型变化。晚疫病抗性评价Rar1而且Sgt1沉默的线条表明Sgt1基因是必不可少的RB-介导的晚疫病抗性。相比之下,沉默的Rar1基因并没有废除RB介导的耐药性。这些结果为药物的普遍作用提供了额外的证据Sgt1不同的基因R基因介导的植物防御反应。
方法
植物材料
马铃薯系J101K6A6K41 (K41)是由马铃薯和马铃薯之间的体细胞杂交J101发展而来的四倍体无性系美国bulbocastanum(克隆PT29) [42].J101作为母本与Katahdin (BC1)、Atlantic (BC2)和Katahdin (BC3)回交。K41是一个抗晚疫病的BC3克隆。存在RB采用聚合酶链式反应(PCR)对K41基因进行了鉴定RB-特异性引物[43]该克隆系被用于转化实验,旨在沉默Rar1而且Sgt1基因。美国bulbocastanum以马铃薯品种“Katahdin”(PT29)和马铃薯品种(PT29)为对照,进行晚疫病抗性评价。
RNAi结构设计与马铃薯改造
使用RNeasy Plant Mini Kit (Qiagen, Valencia, California)从K41叶片组织中提取总RNA,并用TURBO DNA-处理免费的(德克萨斯州奥斯丁的Ambion)去除DNA污染。用1 μg总RNA、oligo d(T)引物和上标逆转录酶(Invitrogen, Carlsbad, California)合成第一链cDNA。用于沉默的cDNA片段Rar1而且Sgt1经PCR扩增。474 bp的cDNA片段Rar1该基因对应于TIGR马铃薯EST TC121848 (nt 346 ~ 820),利用铂从K41 cDNA中扩增得到TaqDNA聚合酶。用于扩增的引物包括5' CACC CAA CAC CAT CTG CTA CCA AAA A 3'(正向)和5' GAC ACT GGG TCA GCG TTG TG 3'(反向)。481 bp的cDNA片段Sgt1利用引物5' CACC GGC CTG TAT GAA GCT TGA AGA A 3'(正向)和5' TCT GCA TTT TGC AGG TGT TAT C 3'(反向)从K41 cDNA中扩增出与TIGR马铃薯EST TC112395 (nt 359 ~ 840bp)对应的基因(该EST最近被分为TC133190和TC159283)。的Rar1而且Sgt1扩增子依次用QIAquick PCR纯化试剂盒(Qiagen)纯化,经凝胶验证后,用pENTR定向TOPO克隆试剂盒(Invitrogen)克隆到pENTR/D-TOPO载体上。的Rar1而且Sgt1根据Helliwell et al.(2002),然后使用LR Clonase重组方法将DNA片段转移到pHellsGate8载体中[44].序列验证的pHellsgate8-Rar1和pHellsgate8 -Sgt1然后使用标准将结构转化为K41农杆菌属-中介转换协议[45].
Gel-blot杂交过程
根据Stupar et al.(2002)进行Southern blot杂交[46].从K41叶片组织中分离基因组DNA,用限制性内切酶进行酶切。DNA印迹用1 kb的基因组DNA片段进行检测Rar1基因和1.1 kb的基因组DNA片段Sgt1基因来评估这两个基因在马铃薯基因组中的拷贝数。采用TRIzol (Invitrogen)协议,从叶片组织中分离10-15 μg总RNA制备RNA印迹。来验证转录Rar1而且Sgt1RNA印迹与cDNA完整片段进行杂交Rar1(TC121848)和Sgt1(TC112395)从K41 cdna中扩增。如前所述进行杂交[47].强化筛选用于检测Northern印迹杂交信号,并将印迹暴露至少一个月,以揭示是否有任何转录本被检测到Rar1- - -Sgt1rnai线。
晚疫病抗性评估
Rar1而且Sgt1在威斯康星大学麦迪逊分校Biotron设施的环境控制温室中,对沉默植物和几种对照植物的晚疫病抗性进行了评估。对照包括易感马铃薯品种Katahdin(无RB基因),美国bulbocastanum(PT29)、未转换的K41系和包含其中一种结构的转换的K41系Rar1或Sgt1,但没有沉默。接种和抗性评价如前所述[43].简单地说,选择的品系在接种前8小时被随机放置在雾室中。雾室24小时相对湿度为100%,光照时间为8小时,白天温度为17-19℃,夜间温度为13-15℃。用76000 ~ 80000孢子囊/ml的孢子囊悬浮液接种p . 5分离出US930287 (US-8基因型,A-2配种型)。根据Malcolmson量表对叶枯病的测量结果进行解释和评分[48].量表以叶片侵染率为基准,评分为:9分-无明显侵染;8 - <10%感染率;7 - 11-25%;6 - 26-40%;5 - 41-60%;4 - 61-70%;3 - 71-80%;2 - 81-90%;1 - >90%; 0 – 100% infection. Blight scores were recorded 5, 7 and 10 days after inoculation. An average score for the resistance was determined using the three replicates of each clone in each inoculation experiment.
使用gfp标记的电阻评估p . 5应变
采用一种定量方法p . 5,其中含有GFP,以更好地量化病原体生长。都是静音系,以及转基因但未静音系Rar1rnai和Sgt1-RNAi系,用gfp标记接种p . 5菌株208m2,由Felix Mauch博士提供(瑞士弗里伯格大学)[29].最终平均孢子囊浓度为64259个孢子囊/mL,使用血细胞计。将孢子囊悬浮液放置于15°C 3小时后接种,释放游动孢子。取10 μl悬浮液分别置于叶片底部中脉两侧大致相同的位置。在接种后24小时和72小时分别从每株植物中取样2片叶子,在接种后144小时(6天)取样4片叶子。每一片叶子都进行了积极生长的检查疫霉使用奥林巴斯SZX12解剖镜每个区域用Olympus DP70数码相机拍摄,使用41020 Chroma窄带GFP滤波器,激发为425/75 nm,发射为500/50 nm。
的传播疫霉通过首先将GFP图像转换为黑色和白色来量化每个叶片表面。颜色转换突出了绿色荧光蛋白疫霉孢子囊和菌丝体生长在每个区域。然后使用ImageJ软件中的“analyze particle”工具对该区域进行轮廓和分析[49].该工具扫描图像选择,直到找到物体的边缘,对应于叶片表面荧光孢子囊或菌丝体。该工具勾勒出每个对象,测量它并填充它。它将这个小区域算作一个粒子,并继续扫描,直到它到达另一个粒子,在那里它重复这个过程,直到图像选择的结束。数据报告详细说明了已计数颗粒的总数,代表了叶片表面荧光孢子囊的总数。随着疫霉生长时,孢子囊和菌丝体更多,转化为更高的颗粒数。我们直接测量病原体的生长,而不仅仅是病变或叶表面死亡组织的面积,这可能与实际的病原体传播不相对应。本实验采用完全随机设计(CRD),第1天和第3天共进行56次观察,第6天共进行50次观察。进行数据质量测试和评估,如残差图和q-图。采用方差不等的单因素方差分析(one- one ANOVA)比较每条沉默线与空矢量对照的粒子数,Fisher's LSD分别测试每一组。
参考文献
- 1.
Kamoun S:非宿主抗性疫霉:经典问题的新前景。中国植物学报,2001,4:296 - 296。10.1016 / s1369 - 5266 (00) 00176 - x。
- 2.
Niederhauser JS, Millis WR:抗茄属植物物种5种在墨西哥。植物病理学杂志,2003,43:456-457。
- 3.
Vansoest LJM, Schober B, Tazelaar MF:抗5种的块茎种中茄属植物以及它的地理分布。马铃薯决议1984,27:393-411。10.1007 / BF02357427。
- 4.
宋j, Bradeen JM, Naess SK, Raasch JA, Wielgus SM, Haberlach GT, Liu J, Kuang H, Austin-Phillips S, Buell CR,等RB克隆从茄属植物bulbocastanum对马铃薯晚疫病具有广谱抗性。美国国家科学研究院。2003, 30(4): 357 - 357。10.1073 / pnas.1533501100。
- 5.
van der Vossen E, Sikkema, Hekkert BL, Gros J, Stevens P, Muskens M, Wouters D, Pereira A, Stiekema W, Allefs S:一种来自野生马铃薯的古老R基因茄属植物bulbocastanum赋予广谱抗性5种在种植马铃薯和番茄。植物学报,2003,36(3):366 - 366。10.1046 / j.1365 - 313 x.2003.01934.x。
- 6.
van der Vossen EAG, Gros J, Sikkema, Muskens M, Wouters D, Wolters P, Pereira A, Allefs S: TheRpi-blb2基因茄属植物bulbocastanum是一个Mi-1马铃薯广谱晚疫病抗性基因同源。植物学报,2005,44(4):344 - 344。10.1111 / j.1365 - 313 x.2005.02527.x。
- 7.
Lozoya-Saldana H, belmardiaz C, Bradeen JM, Helgeson JP:表征5种在墨西哥托卢卡山谷发现了一株抗该病菌的转基因和体细胞杂交马铃薯。Am J Potato res 2005, 82: 79-
- 8.
白瑞秀,周世峰,周世峰,谭文伟,杨晓明,杨晓明,杨晓明。大麦抗病信号通路中锌结合蛋白的研究进展秀丽隐杆线虫.细胞学报,1999,99:355-366。10.1016 / s0092 - 8674(00) 81522 - 6。
- 9.
胡斌,李志刚,李志刚,李志刚,李志刚。细胞内HSP90蛋白的表达与细胞内HSP90蛋白表达的关系拟南芥RPM1抗病蛋白。中国生物工程学报,2003,23(3):377 - 382。10.1093 / emboj / cdg547。
- 10.
Azevedo C, Sadanandom A, Kitagawa K, Freialdenhoven A, Shirasu K, Schulze-Lefert P: RAR1互作子SGT1, R基因引发的疾病抗性的重要组成部分。科学通报,2002,29(3):344 - 344。10.1126 / science.1067554。
- 11.
Azevedo C, Betsuyaku S, Peart J, Takahashi A, Noel L, Sadanandom A, Casais C, Parker J, Shirasu K: SGT1在植物免疫抗性蛋白积累中的作用。中国农业科学,2006,27(1):1 - 7。10.1038 / sj.emboj.7601084。
- 12.
白瑞秀,舒泽-左弗特P:复杂的形成,杂乱和多功能:蛋白质在抗病途径中的相互作用。植物科学进展,2003,8:252-258。10.1016 / s1360 - 1385(03) 00104 - 3。
- 13.
杨晓明,杨晓明,杨晓明,等。SGT1基因在植物R基因调控中的作用。微生物学杂志,2003,5:969-976。10.1016 / s1286 - 4579(03) 00183 - 7。
- 14.
巴芙拉A, Ercolano MR, Weiss J, Meksem K, Bormann CA, Oberhagemann P, Salamini F, Gebhardt C:R1马铃薯抗晚疫病基因(5种)属于亮氨酸拉链/NBS/LRR类植物抗性基因。植物学报,2002,30:361-371。10.1046 / j.1365 - 313 x.2001.01292.x。
- 15.
黄文文,Vleeshouwers VGAA, Werij JS, Hutten RCB, van Eck HJ, Visser RGF, Jacobsen E: TheR3抵抗5种在马铃薯上是由两个紧密联系在一起的R具有明显特异性的基因。MPMI。2004, 17: 428-435。
- 16.
黄文文,van der Vossen EAG, Kuang HH, Vleeshouwers V, Zhang NW, Borm TJA, van Eck HJ, Baker B, Jacobsen E, Visser RGF:比较基因组学成功分离R3a马铃薯抗晚疫病基因。植物学报,2005,29(4):344 - 344。10.1111 / j.1365 - 313 x.2005.02365.x。
- 17.
Gebhardt C, Valkonen JPT:马铃薯基因组中控制抗病基因的组织。植物学报,2001,39:79-102。10.1146 / annurev.phyto.39.1.79。
- 18.
Gebhardt C, Ballvora A, Walkemeier B, Oberhagemann P, Schuler K:基于标记-性状关联的作物种质资源遗传潜力评估——以马铃薯晚疫病抗性和成熟型数量变异为例。生物学报,2004,13:93-102。10.1023 / B: MOLB.0000012878.89855.df。
- 19.
Park TH, Gros J, Sikkema, Vleeshouwers V, Muskens M, Allefs S, Jacobsen E, Visser RGF, van der Vossen EAG:晚疫病抗性位点Rpi-blb3从茄属植物bulbocastanum属于马铃薯4号染色体上一个主要的晚疫病R基因簇。MPMI。2005, 18: 722-729。
- 20.
Park TH, Vleeshouwers V, Huigen DJ, van der Vossen EAG, van Eck HJ, Visser RGF:马铃薯中一个类似R2的晚疫病抗性位点的表征和高分辨率定位。应用物理学报,2005,29(3):531 - 531。10.1007 / s00122 - 005 - 2050 - 4。
- 21.
Villamon FG, Spooner DM, Orrillo M, Mihovilovich E, Perez W, Bonierbale M:一种新型野生马铃薯品种的晚疫病抗性关联茄属植物paucissectum(系列Piurana)。应用物理学报,2005,29(1):1- 7。10.1007 / s00122 - 005 - 0053 - 9。
- 22.
Bradshaw JE, Bryan GJ, Lees AK, McLean K, solon - blackburn RM: R10和R11基因对晚疫病抗性的定位(5种)中含有的(茄属植物tuberosum) Black的r基因差异。应用理论与实践,2006,29(3):344 - 344。10.1007 / s00122 - 005 - 0179 - 9。
- 23.
Bradshaw JE, Hackett CA, Lowe R, McLean K, Stewart HE, Tierney I, Vilaro MDR, Bryan GJ:叶片和块茎抗晚疫病的数量性状位点的检测[5种二单倍体马铃薯无性系第4染色体(茄属植物tuberosum无性系种群。tuberosum).应用物理学报,2006,29(3):344 - 344。10.1007 / s00122 - 006 - 0353 - 8。
- 24.
Rauscher GM, Smart CD, Simko I, Bonierbale M, Mayton H, Greenland A, Fry WE:表征和映射RPi-ber一种新的马铃薯晚疫病抗性基因茄属植物berthaultii.应用理论与实践,2006,29(3):344 - 344。10.1007 / s00122 - 005 - 0171 - 4。
- 25.
Simko I, Costanzo S, Ramanjulu V, Christ BJ, Haynes KG:二倍体块茎抗晚疫病的多基因定位茄属植物phureja×美国stenotomum混合人口。植物营养学报,2006,29(4):366 - 366。10.1111 / j.1439-0523.2006.01232.x。
- 26.
[http://compbio.dfci.harvard.edu/tgi/cgi-bin/tgi/gimain.pl?gudb=potato]
- 27.
Austin MJ, Muskett P, Kahn K, Feys BJ, Jones JDG, Parker JE:监管作用SGT1在早期的R基因介导的植物防御。科学通报,2002,29(4):344 - 344。10.1126 / science.1067747。
- 28.
Tornero P, Merritt P, Sadanandom A, Shirasu K, Innes RW, Dangl JL:RAR1而且NDR1拟南芥对抗病的定量贡献,其相对贡献取决于R基因化验。中国生物医学工程学报,2002,30(4):344 - 344。10.1105 / tpc.001032。
- 29.
Si-Ammour A, mach - mani B, Mauch F:诱导抗性的定量疫霉表达GFP作为重要标记的物种:β -氨基丁酸而不是BTH保护马铃薯和拟南芥从感染。中国生物医学工程学报,2003,4:357 - 357。10.1046 / j.1364-3703.2003.00168.x。
- 30.
Muskett PR, Kahn K, Austin MJ, Moisan LJ, Sadanandom A, Shirasu K, Jones JDG, Parker JE:拟南芥RAR1施加速率限制控制R基因介导的多种病原体的防御。植物科学学报,2002,22(4):379 - 379。10.1105 / tpc.001040。
- 31.
Pajerowska KM, Parker JE, Gebhardt C:马铃薯同源拟南芥基因功能在防御信号-鉴定,遗传作图,和分子克隆。MPMI。2005, 18: 1107-1119。
- 32.
Takahashi A, Casais C, Ichimura K, Shirasu K: HSP90与RAR1和SGT1相互作用,对rps2介导的疾病抗性至关重要拟南芥.美国国家科学研究院。2003, 30(4): 457 - 457。10.1073 / pnas.2033934100。
- 33.
Kitagawa K, Skowyra D, Elledge SJ, Harper JW, Hieter P: SGT1编码酵母着丝粒组装途径的一个基本成分和SCF泛素连接酶复合体的一个新亚基。生物化学学报,1999,4:21-33。10.1016 / s1097 - 2765(00) 80184 - 7。
- 34.
Peart JR, Lu R, Sadanandom A, Malcuit I, Moffett P, Brice DC, Schauser L, Jaggard DAW, Xiao SY, Coleman MJ,等:泛素连接酶相关蛋白SGT1在植物抗寄主和非寄主病害中是必需的。美国国家科学研究院。2002, 99(16): 10865-10869。10.1073 / pnas.152330599。
- 35.
Bhattarai KK, Li Q, Liu Y, Dinesh-Kumar SP, Kaloshian I心肌梗死-1-介导的害虫抗性要求一半而且Sgt1.植物科学进展,2007,29(3):344 - 344。10.1104 / pp.107.097246。
- 36.
Hein I, Pacak MB, Hrubikova K, Williamson S, Dinesen M, Soenderby IE, Sundar S, Jarmolowski A, Shirasu K, Lacomme C:基于病毒诱导的大麦抗白粉病相关基因的功能鉴定。中国生物医学工程学报,2005,29(3):344 - 344。10.1104 / pp.105.062810。
- 37.
黄丽丽,黄志强,黄志强,王志强:病毒诱导小麦基因沉默系统的建立及其在小麦功能分析中的应用Lr21-介导的叶片抗锈途径。中国生物医学工程学报,2005,38(3):344 - 344。10.1104 / pp.105.061861。
- 38.
刘玉玲,Schiff M, Marathe R, Dinesh-Kumar SP:烟草Rar1,EDS1而且NPR1 / NIM1就像基因所要求的一样N-介导的烟草花叶病毒抗性。植物学报,2002,30:415-429。10.1046 / j.1365 - 313 x.2002.01297.x。
- 39.
Bieri S, Mauch S, Shen QH, Peart J, Devoto A, Casais C, Ceron F, Schulze S, Steinbiss HH, Shirasu K,等:RAR1正调控大麦MLA抗性蛋白的稳态水平,并使MLA6积累足够的有效抗性。植物学报,2004,26(3):366 - 366。10.1105 / tpc.104.026682。
- 40.
Leister RT, Dahlbeck D, Day B, Li Y, Chesnokova O, Staskawicz BJ:分子遗传学证据的作用SGT1Bs2蛋白在分子内互补中的活性烟草benthamiana.中国生物医学工程学报,2005,27(3):344 - 344。10.1105 / tpc.104.029637。
- 41.
Tor M, Gordon P, Cuzick A, Eulgem T, Sinapidou E, Mert-Turk F, Can C, Dangl JL, Holub EB:拟南芥SGT1b是几种霜霉抗性基因传递的防御信号所必需的。中国生物医学工程学报,2002,30(4):344 - 344。10.1105 / tpc.001123。
- 42.
Helgeson JP, Pohlman JD, Austin S, Haberlach GT, Wielgus SM, Ronis D, Zambolim L, Tooley P, McGrath JM, James RV,等:间体细胞杂交茄属植物bulbocastanum马铃薯:一种抗晚疫病的新来源。应用理论,1998,96:738- 738。10.1007 / s001220050796。
- 43.
Colton LM, Groza HI, Wielgus SM, Jiang JM:马铃薯广谱晚疫病抗性基因的标记辅助选择RB源自一种野生马铃薯。作物科学,2006,46:589-594。10.2135 / cropsci2005.0112。
- 44.
Helliwell CA, Wesley SV, Wielopolska AJ, Waterhouse PM:植物高效基因沉默的高通量载体。植物学报,2002,29:1217-1225。10.1071 / FP02033。
- 45.
王晓明,王晓明,王晓明,王晓明:转基因紫花苜蓿中纤维素酶基因的表达(紫花苜蓿L.)、马铃薯(茄属植物tuberosumL.)和烟草(烟草l .)。生物化学学报,1999,5:389 - 397。10.1023 /: 1009646830403。
- 46.
宋建强,程志凯,董芳芳,姜建民:马铃薯高浓缩异染色质中含有rdna相关串联重复序列。遗传学报,2002,26(3):344 - 344。
- 47.
Stupar RM, Beaubien KA,金文文,宋建青,李明明,吴春春,张海波,韩波,姜建民:马铃薯块茎发育过程中patatin多拷贝基因家族的结构多样性和差异转录。中国生物医学工程学报,2006,27(2):344 - 344。10.1534 / genetics.105.051219。
- 48.
克鲁克山G, Stewart HE, Wastie RL:马铃薯叶枯病的鉴定关键。马铃薯决议1982,25:213-214。10.1007 / BF02359807。
- 49.
确认
我们感谢CSIRO植物工业(澳大利亚)提供pHellsGate 8沉默载体。本研究由美国国家科学基金会植物基因组研究计划(DBI-0218166)资助给S.A.P.和J.J.,哈奇基金资助给J.J.
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
PBB和JJ构思了这个项目。PBB开发了RNAi结构。JAR和SA培育了转基因株系。PBB和PN特征的转基因株系。PBB、LCK、SMW进行抗病性评价。PBB和JJ起草了手稿。所有作者都阅读并批准了最终的手稿。
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
巴斯卡尔,p.b.,拉施,j.a.,克雷默,L.C.et al。Sgt1,但不是Rar1,是必不可少的RB-介导马铃薯晚疫病广谱抗性。BMC植物生物学8,8(2008)。https://doi.org/10.1186/1471-2229-8-8
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-8-8
关键字
- 白粉病
- 晚疫病
- 马铃薯品种
- Northern Blot杂交
- 抗晚疫病