摘要
背景
葡萄果实在成熟过程中经历复杂的生化变化,其中许多取决于品种和环境。本研究采用气相色谱-质谱联用技术(GC-MS)和液相色谱-质谱联用技术(LC-MS)对赤霞珠(Cabernet Sauvignon)和设拉子(Shiraz)的浆果皮进行了代谢谱分析。使用RNAseq对生成的数据集进行转录分析。
结果
对代谢物的分析表明,两个品种间初级代谢物的发育变化规律相似。然而,随着成熟期的到来,主要有机酸和糖类(如蔗糖、海藻糖、苹果酸)以及芳香和酚类化合物的前体,如奎宁酸和shikimate的变化程度比赤霞珠更大。相比之下,当使用专门化代谢谱时,两个品种样品的PCA图在成熟期有明显的方向性投影,表明专门化代谢的调控依赖于品种。总体而言,与韦莱森之后的赤霞珠相比,西拉子表现出更强的多酚途径上调,特别是piceid和香豆蔻酰花青素形式的积累。转录谱分析显示,编码酶的基因转录丰度在苯基丙酸途径的执行步骤中协调增加。花青素代谢谱显示,F3 ' 5 ' h介导的飞燕草型花青素在两个品种成熟过程中富集,这与转录数据一致,表明在果实发育后期,F3 ' 5 ' h控制的分支步骤主导着花青素谱。相关分析证实了生长发育过程中代谢变化的紧密协调,表明中心代谢和专一代谢之间存在源-库关系,在西拉葡萄中比赤霞珠更强。RNAseq分析还表明,两个品种ABA生物合成酶相关基因的变化规律明显不同。
结论
与CS相比,Shiraz代谢产物间的显著相关性较高,且类黄酮基因表达量较高,支持该品种香豆蔻酰花青素积累增加的证据。应激相关代谢增强,如海藻糖、二苯乙烯和ABA在设拉子浆果皮中表现出较高的环境敏感性。
背景
葡萄品种从许多起源演变而来[1],分布于气候不同的地理区域[2]导致品种特定生理、形态、生长和发育的进化[3.],[4].葡萄树植物生长和冠层结构影响到达葡萄束的光量,并改变其微气密[5] - [7].此外,同化物及其他代谢产物的一堆分区也将浆果发育过程中依靠营养生长的程度并最终将决定浆果的肉和皮肤的代谢物概况[5],[8],[9].因此,基因型、宏观和微观气候以及植物活力之间复杂的相互作用将决定浆果的代谢,并最终决定葡萄酒的质量[10].
葡萄浆果,非更年期水果[11[遵循由三个主要阶段组成的双六样素生长模式[12],每一种的特点是大小、颜色、质地、代谢组成和基因表达的变化[13],[14].硬绿阶段,即第一阶段,其特征是细胞快速生长和伸长,在这一阶段结束时伴随大量有机酸、羟基肉桂酸、氨基酸和单宁的积累[15] - [19].在第二阶段,浆果停止膨胀,糖分开始积累,而酸的消耗最终导致pH值的上升[15].在复生期间,浆果进入第二个快速生长阶段,酸度逐渐下降,柔软度增加。Veraison是标志着第三阶段开始的一个阶段,它与浆果软化和基本代谢物的变化有关,如糖、芳香前体和色素的积累,[15],[16]以及其他课程的专门代谢物,将为浆果质量做出贡献[20.].浆果发育过程中生化变化的速率取决于品种[21] - [23]以及受气候因素影响[24] - [26)、土壤(27],灌溉[28] - [31]及葡萄栽培方法[32] - [34].
副代谢在浆果中的作用也没有完全理解。有肉质和鲜美水果的植物可能在动物驱动的分散期间在进化期间受到青睐[35],果皮和皮肤可能是作为种子发育的保护组织而进化而来的[36].这样,多酚类,包括许多黄酮类以及非类黄酮化合物,在植物适应中央保护作用的环境[37].黄酮醇可以保护浆果免受紫外线辐射[38],花青素在种子扩散中发挥作用,提供高温和紫外线辐射的保护,而原花青素具有抗真菌特性[39] - [41].类黄酮是一种具有生物活性的化合物,因为它们具有抗氧化活性[42],[43],并有助于水果和葡萄酒的感官特性[16],[44].
由于黑皮诺葡萄基因组的草图序列[45[浆果发育的调节和相关的代谢过程是越来越多的全基因组基因表达研究的重点[14],[15],[46] - [50].尽管如此,我们对次生新陈代谢调节以及不同品种之间的次生新陈代谢的差异存在广泛的差距。例如,近期对不同商业克隆的转录组和基因组研究发现了从黑孔NoiR参考基因组中缺失的数百个基因[51] - [53].因此,需要更多的比较研究来充分阐明葡萄代谢在浆果发育过程中的调节作用。最近开发的RNA-seq转录组分析方法,与基于微阵列的方法相比,提供了更高的分辨率和检测转录本不同亚型的能力[54].到目前为止,只有少数研究使用RNAseq进行葡萄浆果发育[55] - [57而在比较研究中则没有。此外,考虑到果实代谢的显著转录后调控[58] - [61],转录研究越来越多地被支持逐和与代谢和蛋白质组数据集成。大规模的代谢谱已应用于葡萄最近才[15],[21],[62] - [65]和大多采用一级或二级代谢的靶向分析。
在本研究中,我们使用GC-MS和基于LC-MS的基于浆果皮肤的代谢分析,研究了在半干旱环境中在该领域生长的两个红葡萄酒葡萄品种Shiraz(Sh)和赤霞珠(CS)的发育过程在以色列南部。通过RNASEQ-yragscripec谱来增强气相色谱 - 质谱(GC-MS)和液相色谱 - 质谱(LC-MS)产生的数据集。该研究旨在研究发展浆果和潜在监管机制的新陈代谢的变异差异。
据我们所知,这是第一次尝试将代谢组学和基于rnaseq的转录组数据整合到两个生理上截然不同的葡萄品种的浆果发育的比较研究中。
方法
植物材料和实验条件
对两种红葡萄品种的4年商业葡萄进行了田间试验葡萄L.(设拉子(Shiraz)和赤霞珠(Cabernet Sauvignon))是在2011年的生长季节嫁接到鲁盖里的。两个品种行距均为3米,藤距为1.5米。葡萄藤在东西方向的垂直格子上。葡萄园位于北纬30.68度,东经34.80度;平均降雨量为86毫米,平均潜在蒸发量超过2000毫米。土壤含水量每小时测量一次,并在附加文件中给出1:图S1。根据A级蒸发皿(ET)的蒸发量每4天灌一次水锅)使用0.25的灌溉系数。采用在线喷灌器进行滴灌,流量为2.2 L h−1.为了避免任何边缘效应,只使用位于每行中间的植物进行实验。试验区周围有灌水量相近的葡萄行。
浆果质量相关的特质
每次取样前,总可溶性固体(TSS)在o用手折射计(Palette PR-100, Atago, USA)对5种不同葡萄的浆果汁进行BRIX测定。从每个品种的8个植株行两侧(N和S)的代表性串中选取至少15个浆果,取平均浆果重。可滴定酸度测定(g/L酒石酸当量)根据Guymon和Ough的标准程序对同一样品进行测定[66].
采样和代谢物提取
在两个品种的四个发育阶段进行样品进行代谢分析(参考Veraison阶段给出的天数):Veraison(DTV)前30天(DTV);Veraison;在Veraison(DAV)(DAV)之后20天(Veraison),并为Shiraz收获37 DAV和53张CS。Shiraz和Cs在收获时差别取样了与oBrix测量。在所有采样日期,在给定藤厂的N和S侧收集束中间部分和类似发育阶段的五个代表的五个浆果。六个独立的生物重复,每个复制由六个单独的葡萄藤组成,在两种品种的行中间部分收集。皮肤小心地从浆果上剥离,用干净的布轻轻地从皮肤中取出剩余的肉体。之后立即,将组织在液氮中冷冻冷冻,并保持在-80℃直至进一步分析。在提取样品之前,在冻干器中冷冻干燥(Virtis Gardiner,N.Y.R525,Model 10-MR-Tr)。利用先前描述的方法的略微修饰的方法,提取冷冻干燥样品以进行平行代谢物分析(LC和GC / MS)[67].如果没有其他说明,所有的化学品都是从Sigma-Aldrich购买的。浆果皮肤组织使用retch轧机(Retsch Gmbh, 42787 Haan, Germany)与预冷钢支架和研磨珠研磨。代谢产物提取:取70 mg冷冻粉,在预冷甲醇:氯仿:水提取液(2.5:1:1 v/v)中提取。随后加入内标(水中利比醇0.2 mg/ml,水中氨苄西林1 mg/ml,甲醇中皮质酮1 mg/ml)。然后将混合物短暂旋转,14000 RPM离心2分钟(微离心机5417R),将上清倒入新管中。上清液与300 μl氯仿(LC/MS级)和300 μl超高效液相色谱级水混合,14000 RPM离心2 min, 100 μl水/甲醇相在真空浓缩器(Eppendorf concentrator Plus)中干燥后衍生化[68]用于GC-MS分析。剩余的水/甲醇相转移到UPLC小瓶中进行LC-MS分析。
气相色谱-质谱衍生化和数据处理
将上述萃取物的GC-MS样品重新溶解并进行衍生化。8微升的保留时间标准混合物(0.029% v/vn十二烷,n十五烷,n十九烷,n二十二烷,n二十八烷,n-dotracontane,n- 加入溶解在吡啶中的罕见烷。样品集还包括正宗代谢物标准的参考质量控制(1 mg ml−1每个)(附加文件2:表S1A)。Volumes of 1 μL were then injected onto 30-m VF-5 ms GC column with 0.25 mm i.d., film thickness of 0.25 μ m, and + 10 m EZ-Guard (Agilent) in splitless and split mode (32:1) allowing a more accurate comparison of highly abundant metabolites (e.g. tartarate, sugars, and inositol). The GC-MS system consisted of an AS 3000 autosampler, a TRACE GC ULTRA gas chromatograph, and a DSQII quadrupole mass spectrometer (Thermo-Fisher ltd). The parameters of the machine were exactly as described in [69].通过咨询国家标准和技术研究所(NIST,Gaithersburg,USA)算法在Xcalibur®数据软件(版本2.0.7)中,针对来自德国Golm的Max-Planck植物生理学研究所的RI库(http://www.mpimp-golm.mpg.de/mms-library/),最后用总代谢物归一化,并校正d的稀释因子。
UPLC-MS分析
对于LC-MS分析,4微升提取的样品的进样到配备有ESI接口(沃特斯QTOF的Xevo一个UPLC-QTOF-MS系统TM值: Waters MS Technologies,曼彻斯特,英国)在负离子和正离子模式下运行。采用Acquity UPLC BEH C进行色谱分离18柱(100 mm × 2.1 mm, 1.7 μm)。色谱柱和自动进样器分别保持在40℃和10℃。在每次运行样品时,流动相包括95%的水、5%乙腈、0.1%甲酸(A相)和0.1%甲酸乙腈(B相)。溶剂梯度程序的条件与前面描述的完全一致[69].所有分析均采用亮氨酸脑啡肽锁定质量校准,以确保准确性和重现性,浓度为0.4 ng L−1,用50/50乙腈/H20.1% v/v甲酸。MS条件的设置基本如前所述[69].
UPLC数据处理
使用MassLynxTM软件(Waters) 4.1版本作为控制UPLC和数据采集的系统,如前所述[69].使用marklynx应用程序管理器(Waters)处理获取的原始数据,基本如前所述[69].To verify metabolite identification, representative samples of different developmental stages from each cultivar were run using the same instruments and under the same operating conditions at the metabolomics facility of the Edmund Mach Foundation in San Michele all’Adige – Italy, where an in-house standard library described in details in [70]用于验证根据商业标准保留时间顺序标注的鉴定代谢物(附加文件2:表S1B),通过在Chemspider代谢物数据库(http://www.chemspider.com/),并与之前的代谢物注释进一步确认[23],[71] - [76].
统计分析
对归一化数据集(以组织干重和内部标准)进行Kruskal-Wallis和Wilcoxon秩和检验,以确定在浆果发育过程中显著变化的代谢物。在每个采样日期比较品种使用学生的t以及。使用皮尔逊相关算法计算所有注释代谢物的两两相关。相应的p-值使用R的cort .test函数计算,如前所述[77].为了避免假阳性,采用Q值为0.05的假发现率(FDR)。相关矩阵作为网络构建和分析的数据,使用“图形”包(http://igraph.org/r/#docs.).所有统计分析和网络属性均使用R-软件环境R 3.0.1 (http://cran.r-project.org/).
RNA-SEQ分析
为了促进与代谢物数据的平行比较,使用来自用于代谢物提取的相同样品的冷冻,接地皮肤组织。从veraison和20dav在两种品种中,从30mg Berry皮肤组织中提取总RNA,基本上如Japelaghi等人所述。[78].使用Bioanalyzer Chip RNA 7500 series II (Agilent, Santa Clara, CA)和Nanodrop 2000分光光度计(Thermo Scientific, Wilmington, DE)测定提取的RNA的质量和浓度。质量评估后,使用Illumina HiSeq 1000测序仪(Illumina Inc., San Diego, CA, USA)进行poly (A) mRNA制备和测序,如前所述[52].结果读取与引用对齐葡萄使用TopHat软件(版本2.0.6),接收作为输入葡萄gtf文件(选项“-g”),也使用以下参数:“-b2-非常敏感-r 150-mate-std-dev 50”[79].随后,Cufflinks软件[80];2.0.2版)用于将对齐的RNA-SEQ读入与参数“ - Min-Intron-Levely 10”的转录物;将这些组件加工成由绒毛设定的完整转录组[81].最后,用CuffDiff估算了它们的丰度[80].为了便于比较和可视化两个品种发育阶段之间的转录组变化,将数据归一化到CS版本阶段的转录水平。
功能分类
基于VitisNet分子网络对CS和设拉子差异表达转录本进行功能富集分析[82])。完整的网络和它们对应的基因被下载http://www.sdstate.edu/ps/research/vitis/upload/AdditionalFile2_2.xlsx.使用Expander中的超几何测试对这些网络进行富集[83),浓缩p使用Bonferroni校正进行多次测试调整值。
结果
抽样阶段和浆果质量特征
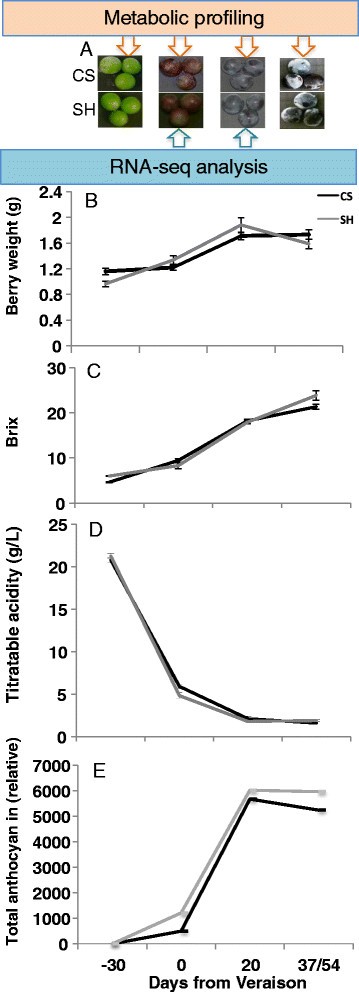
两个品种的果实在发育过程中的增重和其他果实品质相关参数(TSS和TSS)的预期变化规律相似o白利(图1).尽管如此,靠近收获的Shiraz显着更高oBRIX相比赤霞珠(图1),由于比设拉子晚两周收获了赤霞珠(Cabernet Sauvignon),因此得到了补偿。
基于GC/MS的浆果发育过程中的代谢变化
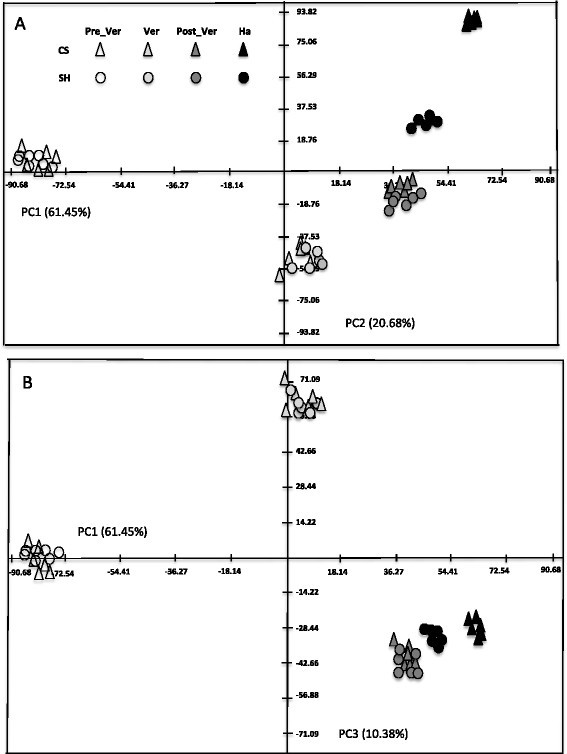
采用主成分分析(PCA)对鉴定的65个中心代谢物进行分析,以了解不同品种和发育阶段代谢变化的总体趋势。因此,两个品种的PCA投影趋势非常相似(图2)显示出类似的中枢代谢变化模式。前3个主成分占总变异的92.5%,反映了大部分发育变异和品种变异。第一主成分(PC1)贡献了61.45%的方差,并能明显区分发育阶段。半乳糖酸酯、丙酮酸酯和亮氨酸在PC1上具有较高的特征值,表明它们对沿着该组分的样品分布有很强的贡献(附加文件)2:表S2)。PC2描述了20.68%的方差,区分了两个品种的发育期、成熟期和收获期以及收获时的两个品种。分离主要是由于gulonate,脱氢抗坏血酸,丁酸,天冬氨酸,棉子糖,focuse,鼠李糖,甘氨酸和甘油的变化(附加文件2:表S2)。PC3占总方差的10.38%,主要由咖啡因、马来酸、shikimate、富马酸、脯氨酸和精氨酸描述2:表S2)。
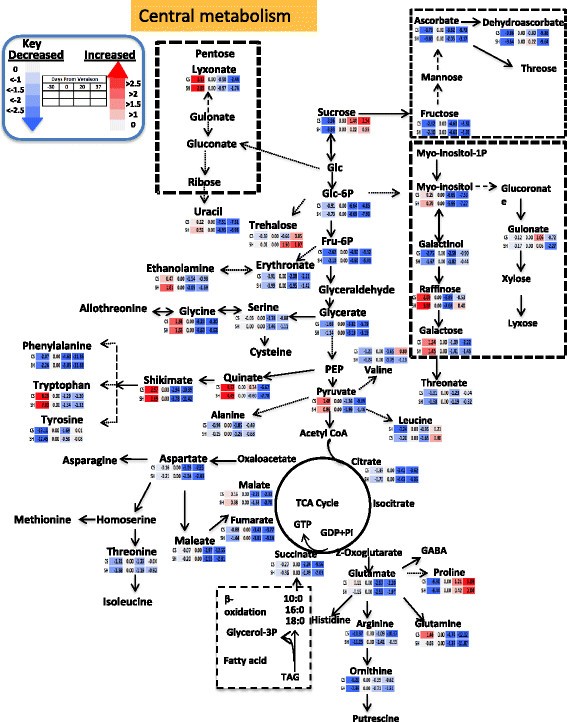
在四个发育阶段期间中央代谢物的变化被标准化为Veraison阶段,作为参考点,以便于两种品种之间的比较。因此,数据集被标准化为Veraison,日志2转换的值,以及与Veraison相关的Veraison,Veraison和收获阶段的相对变化表示为log2 [折叠变化]。然而,应该注意的是,不可能通过研究浆果发育过程中代谢物的变化模式来进行两种品种的发育阶段之间的直接比较。总体而言,中央代谢产物在两种品种中表现出类似的变化模式(图3.).与少数例外的阶段相比,浆果开发的早期阶段的特点是高度相对丰富的中枢代谢物。正如预期的那样,蔗糖丰富遵循逐步逐渐积聚的反向趋势。果糖和葡萄糖的果糖和磷酸盐伴较令人遗憾,后来朝鲜下降。包括肌醇和半乳糖的其他代谢物也在预先验证并在此后下降。奖石糖在预验证之前发挥了最高的丰富,然后在收获中的中成熟和积累时陡峭减少。具有两种品种中蔗糖积累的相似趋势,海藻糖在Shiraz中具有更高幅度的品种逐渐积累。糖酵解中间体在两种栽培品种的发育过程中逐渐下降,但与Shiraz相比,CS的发育阶段之间的变化显着更高(图3.额外的文件2:表S3)。
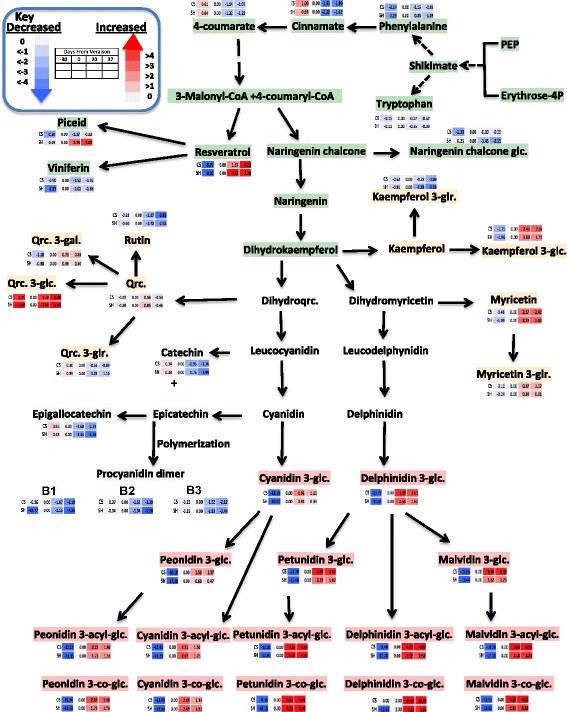
主要代谢途径的示意图,与log2转化的折叠变化归一化到每个品种的复生阶段。不同颜色表示代谢物折叠变化的增加(红色)或减少(蓝色),如颜色指数所示。n = 6。每一行(上一行CS,下一行Shiraz)代谢物的变化参照veraison阶段,其中每一列代表不同的时间点(图由路径工具程序生成[84])。
大部分氨基酸在成熟过程中逐渐减少。然而,丙酮酸衍生的氨基酸,丙氨酸和缬氨酸,在两个品种的浆果发育过程中有恒定的丰度(图)3.).此外,两种品种的甘油酸、氨基酸、丝氨酸和甘氨酸的相对丰度在收获过程中逐渐降低,但设拉子的降低程度高于CS。2-氧戊二酸衍生的氨基酸谷氨酸、精氨酸、鸟氨酸和谷氨酰胺,草酰乙酸衍生的氨基酸天门冬氨酸和苏氨酸的相对丰度在两个品种中逐渐下降。在莽草酸衍生氨基酸中,苯丙氨酸在复春时积累量最大,随后相对丰度逐渐降低。与对照相比,设拉子在收获时的减少程度略高于对照。另一种由莽草酸衍生的氨基酸,酪氨酸和色氨酸,在复变后保持相对稳定的水平。与大多数氨基酸相比,脯氨酸的相对丰度随成熟期的增加而增加(图)3.).
三羧酸循环中间体枸橼酸、琥珀酸、富马酸和苹果酸的相对丰度变化规律相似。然而,减少的程度与品种有关。例如,主要有机酸,苹果酸在设拉子中减少了6倍,而在CS中减少了4倍。设拉子枸橼酸水平的降低(~9倍)也高于CS(7倍)。少量的有机酸,琥珀酸和马来酸[85]在Shiraz中分别朝成熟度降低18倍,24倍,分别为4倍和6倍(图3.).
quininate和shikimate将初级代谢与苯基丙氨酸生物合成途径联系起来。这些代谢物在浆果发育过程中表现出高度的减少。两种品种在收获时奎宁酸和莽草酸平均分别降低了14倍和20倍。肉桂酸是苯丙酸途径的直接前体,在两个品种中,肉桂酸在春前积累量较高,在成熟期逐渐减少。
基于浆果开发的基于LC-MS的代谢变化
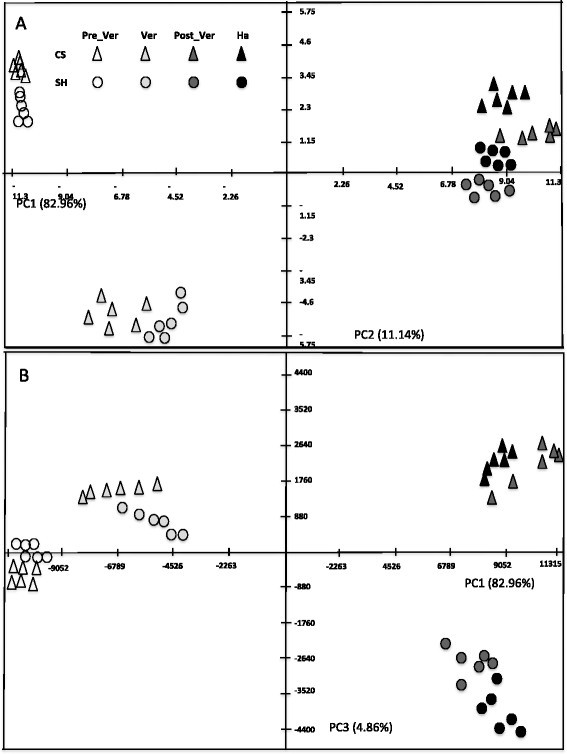
LC-MS基础代谢分析揭示了浆果皮肤特异性代谢物的开发过程中的相对丰度的重大变化。数据集的主成分分析(PCA)透露了一个方向投影时,第一主成分(PC1),由发育过程中两品种管辖代谢变化上(图4);即PC1解释了最大的差异(82.96%,图4一种)。PC2解释了对应于浆膜皮肤的代谢物变化的差异11.14%,以在两种品种(图4A).当提取代谢物的特征值相对影响样本在PC图上的分布时,malvidin 3-O-(6″-acetyl-glucoside), malvidin-3-glucoside和malvidin-3-O-(6”p-coumaroyl-葡萄糖苷)似乎是沿PC1分离的最大贡献者(附加文件2:表S2)。与酒石酸酯相同的代谢物,促成了沿PC2的数据分布。值得注意的是,沿PC3显示品种变异性,但它仅在数据集中仅解释了4.86%的变异性(图4b)。尽管如此,我们可以识别对两种品种特异性的代谢变化。分别,牡丹蛋白3-O-(6”p-coumaroyl-glucoside),矮牵牛配基3 -O-(6”p-coumaroyl-glucoside)、二甲花翠素3 -O-(6”p-香豆素-葡萄糖苷)和malvidin 3-O- (6“ - 乙酰甘油苷)导致PC3上两种品种的分布(附加档案2:表S2)。在研究品种差异的代谢数据时,主成分分析表明香豆素形式的花青素在夏拉子的春化期、春化期后和收获期具有特异性且显著的积累,而malvidin 3-的积累水平较高O-(6″-acetyl-glucoside)相对于设拉子(Shiraz)表征了这些阶段CS的浆果皮。PCA显示了两个品种间次生代谢的差异,特别是在复熟和成熟期(图)4B).重要的是,两个主要的PCA(图2)和次要(图4)的代谢产物图谱将每个品种不同发育阶段的6个生物重复组合在一起,表明与发育因子相比,每个重复之间具有较高的重现性。
代谢变化规律表明,苯丙酸的直接前体香豆酸在春前积累量最大,春后下降;它可能被纳入下游代谢(图5).糖基化的柚皮素,即柚皮素查尔酮葡萄糖苷,在设拉子中逐渐减少,而CS从veraison到收获时变化不大(图)5).羟基肉桂酸代谢物如p-coumarate,p-香豆素酒石酸酯、香豆素酸己糖酸和阿魏酸在春前达到峰值,并在成熟期逐渐下降1:图S2)。这与亚当斯之前的报告一致[41];这些代谢物可能作为合成挥发性和其他多酚代谢物的前体。
二苯乙烯是一种从苯基丙酸途径分支出来的代谢物。二苯乙烯在浆果中积累,对生物[86] - [91非生物应激[92] - [94].两种品种具有相似的斯蒂尔贝斯,白藜芦醇的积累模式,其在浆果皮肤上展现了成熟度的渐进积累。相比之下,斯蒂尔贝烯,Viniferin在两种品种的发育过程中没有变化,而白藜芦醇,葡萄糖苷的变化模式在栽培品种之间存在不同;它在Shiraz逐渐积累,同时保持在Veraison之后的CS的可比水平(图5).
黄酮醇是花青素途径前体的直接竞争对手,除槲皮苷苷在春前和春后阶段积累,在春后相对丰度短暂下降外,黄酮醇在春后阶段表现出温和的诱导作用。与其他黄酮醇不同的是,山奈酚葡醛酸和芦丁的相对丰度随着成熟而逐渐降低(图)5).在两个品种中,所有黄烷醇类(儿茶素、表儿茶素和原花青素二聚体)的丰度随着成熟期的增加而逐渐减少,但与CS相比,Shiraz的减少程度更强烈(图)5),可能是由于大量花青素积累的竞争。
如预期的那样,花青素在两个品种的发育过程中表现出逐渐积累。二氢山奈酚表示不同花青素下游途径之间的分支点(图)5, (95])。用黄酮3'-羟化物(F3'H),二氢酮蛋白转化为二氢喹啉素,并支持葡萄糖苷,乙酰基和香豆酰基的生物合成,糖蛋白酶和芍药蛋白(Cyanidin型花青素),同时用黄酮3',5'羟基化酶(F3'5'H)它可以转化为Dihydromyricetin,其产生葡萄糖苷,乙酰基,香豆酰基和咖啡酰基,丁霉素,喇叭蛋白和麦芽素(Delphinidin型花青素)。Cyanidin和PeoNidin葡萄糖苷生物合成在Veraison后的成熟阶段具有温和但重要的诱导。在两种品种中,结果表明(图5),与二氢杨梅素平行途径相比,二氢杨梅素途径获得的所有花青素均高度诱导(图)5).除malvidin 3-外,两个品种的花青素积累规律相似O-glucoside在CS中逐渐积累,而petunidin在Shiraz中逐渐积累(附文件)2:表S3)。两种初始的葡萄糖苷形式,花青素葡萄糖苷和飞燕花葡萄糖苷在成熟中期达到最大值,在收获时降低(图)5).比较花青素香豆素的形式,设拉子表现出明显更高的水平从veraison(补充文件1:图S3)。
代谢物相关和网络分析
为了了解代谢物在季节中是如何协调变化的,并确定品种特异性代谢物关系,如Hochberg等人先前所述,对所有初级和专门代谢物进行了两两相关分析。[69].同一生物合成途径的代谢物大多呈正相关(Additional file)2:表S4A和S4B)。初级代谢物和特化代谢物之间的相关性最高。花青素与黄酮醇的相关趋势基本一致,为正相关r两个类之间和在负值r有机酸的值和大多数鉴定的原发性代谢物。特别是,花青素与黄黄烷醇,黄烷酮和羟基氨基酸和其他有机酸显示出强烈的负面关系。Shiraz数据显示代谢物之间的大量相关性,而不是CS(附加文件2:表S4A和S4B,附加文件1:图S4a)。
由设拉子和CS建立的显著相关矩阵(Q < 0.05和0.7 < r <−0.7)生成的代谢网络表明,总体上边数更高(分别为1957比1771),平均节点度更高(分别为39.5比34.7)(附加文件2:表S4C)和设拉子网络中度大的节点频率与CS相比(附加文件1:图S4b)。在一起,Shiraz网络的较低直径(附加文件2:表S4C)表明,与CS相比,Shiraz开发期间代谢的更严格的协调行为。该建议也得到了Shiraz网络的较高传输评分(附加文件)支持2:表S4C),即网络与更强的互连形成群集的概率。
浆果发育过程中转录组的变化
具有类似发展阶段的采样浆果可能是难以变化的难度,即使在同一葡萄藤上的簇和簇中的浆果之间。采取预防措施从集群中间收集代表和平均(大小和外观)浆果,以减少这种发展变化。当大规模代谢物对成熟的变化开始时,Veraison是一种从绿地到成熟的过渡阶段[15],[46],[65],[96这种转变带来了整个藤蔓的基本转录组重编程[56决定了浆果的最终代谢物组成。考虑到整个浆果质量和生化参数的结果,并尽量减少两个品种之间基因表达变化的发育因素,RNA-seq数据分析样品在复种期和复种后20天(DAV)收获,即最大花青素含量(图)1).在发育和生物化学确定的阶段,两个品种表现出相似oBRIX水平,这使得转录和代谢物动态的比较调查可能[57].在鉴定明显改变的转录物后,为了促进两种品种转录组变化的比较和可视化,将数据标准化为CS Veraison阶段转录水平,以可视化阶段和品种之间的变化。
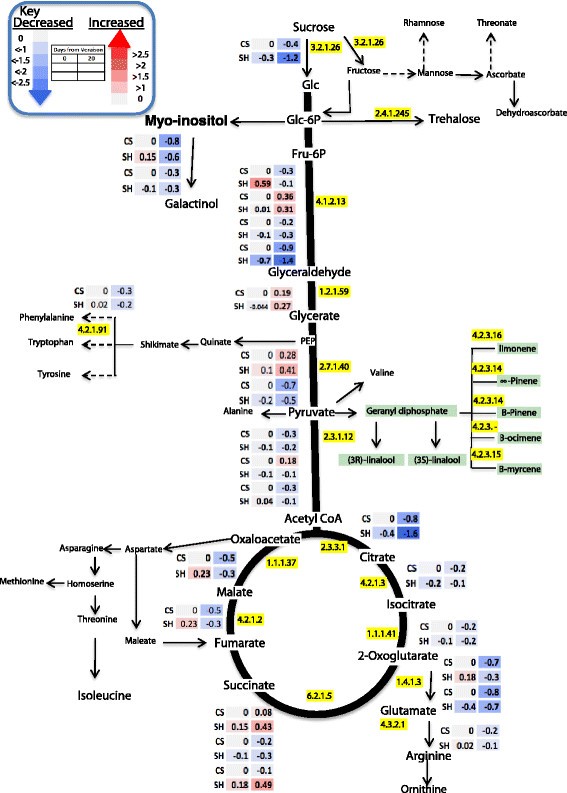
额外的文件2:表S5显示了随着浆果从veraison生长到中期成熟阶段显著变化的转录本列表。在碳水化合物代谢的转录本中,大部分蔗糖合酶基因的表达量都有适度的下调,而蔗糖转化为葡萄糖的转录本(VIT_07s0005g00690)在两个品种中从veraison到成熟期中期显著下降(图)6).在CS中,促进蔗糖降解的β -果呋喃糖苷酶(VIT_06s0061g01440)的编码基因从veraison显著降低到20 DAV。相反,设拉子在调控蔗糖降解方面表现出不同的趋势。其中,蔗糖降解基因VIT_14s0060g00770显著上调,而另一个基因VIT_06s0061g01440显著下调,表明糖代谢在早熟和晚熟阶段存在差异表达2:表S5)。在Shiraz中,一个编码海藻糖磷酸酶的基因(VIT_01s0026g00220)的表达量是CS的3.3倍(VIT_02s0012g01620)的1.7倍。而CS则下调了海藻糖合成酶海藻糖代谢编码的一个不同基因(VIT_06s0009g01580)。
在设拉子和CS中,浆果皮肤转录本参与初级代谢,并在不同版本和版本后阶段发生显著变化。将数据归一化到CS复现期各自的转录本丰度。热图表示转录本表达水平的变化2转换),由颜色图例和每个框内的值表示。EC编号为所提到的酶是:3.2.1.26(呋喃果糖苷酶),2.4.1.245(海藻糖合酶),4.1.2.13(醛缩酶),2.7.1.40(丙酮酸激酶),1.2.1.59(甘油醛-3-磷酸脱氢酶),2.7.1.40(丙酮酸激酶),2.3.1.12(酰基辅酶A:多萜醇酰基转移酶),4.2.3.16(苎烯合酶),4.2.3.14(蒎烯合酶),4.2.3.15(月桂烯合酶),2.3.3.1(柠檬酸盐(Si)的合酶),4.2.1.3(顺乌头酸酶),1.1.1.41(异柠檬酸脱氢酶),1.4.1.3(谷氨酸脱氢酶),4.3.2.1(精氨基琥珀酸裂解酶),4.2.1.5(阿糖脱水酶),6.2。1.5(琥珀酰辅酶A合成酶),4.2.1.2(延胡索酸水合酶),1.1.1.37(苹果酸脱氢酶)4.2.1.91(Arogenate脱水酶)(通过使用通路工具程序[生成的图84])。
转基因TCA循环酶如柠檬酸合酶(VIT_13S0156G00110),异柠檬酸脱氢酶(VIT_14S0066G00950),琥珀酰基-COA合成酶(VIV_10S0042G00950和VIT_01S0127G00260)和富马酸乙烯水溶酶(VIT_07S0005820)进行了umarate脱氢酶(VIT_07S0005820),在Veraison之后下调(图6),与这些TCA中间体的代谢谱相一致。
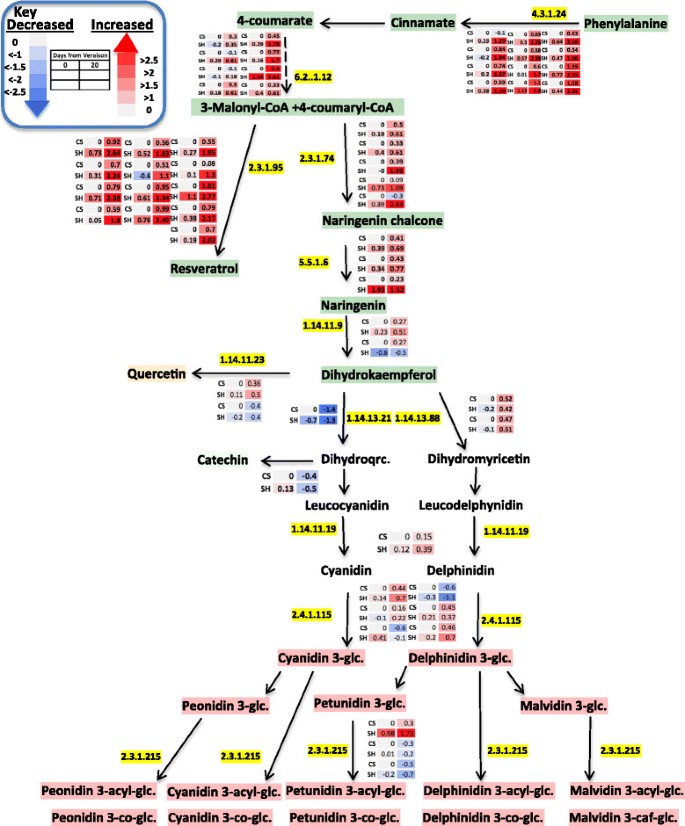
苯基丙醇型途径为斯蒂芬和黄酮类化合物提供前体。然而,在肉桂酸4-羟化酶(C4H)基因的表达水平中没有观察到显着的变化,该酶负责催化4-羟基化的酶反式-肉桂酸。尽管如此,在两个品种中,4-香豆蔻酰辅酶a连接酶(4CL)、查尔酮合成酶(CHS)、查尔酮异构酶(CHI)和类黄酮3 ',5 ' -羟化酶(F3 ' 5 ' h)这5个可能参与苯丙生物合成的基因在不同版本到20 DAV之间被共同调控和差异表达(图)7).此外,对苯丙氨酸氨裂解酶(PAL)编码的转录物的表达在Shiraz中显着上调,比Cs更大,支持在该品种的发育过程中对下游生物合成的前体代谢物强烈使用。参与后续生物合成步骤的基因,导致4-香豆素COA,在两种品种中也诱导,但在Shiraz的程度上诱导,支持Shiraz中的花青素的Coumaroyl形式的大量积累。
Shiraz和CS浆果皮中类黄酮基因转录水平的变化。将数据归一化到CS复现期各自的转录本丰度。热图表示转录本表达水平的变化2转换),由颜色图例和每个框内的值表示。上述酶的EC编号为:4.3.1.24(苯丙氨酸解氨酶)、6.2.1.12(4-香豆酸—辅酶a连接酶)、2.3.1.74(柚素查尔酮合酶)、2.3.1.95(二苯乙烯合酶)、5.5.1.6(查尔酮异构酶)、1.14.11.9(柚素3-羟化酶)、1.14.11.23(黄酮醇合酶)、1.14.13.21(黄酮3 ' -羟化酶)、1.14.13.88(黄酮3 ',5 ' -羟化酶)、1.14.11.19(花青素合成酶)、2.4.1.115(花青素3- o -葡萄糖苷转移酶)和2.3.1.215(花青素3- o -葡萄糖苷6″- o -酰基转移酶)(图由途径工具程序生成[84])。
图中描述了参与苯丙素和类黄酮途径的差异积累转录本7.有趣的是,在两个品种的浆果从veraison发育到veraison后期,二氢山酚通过类黄酮3 ',5 '羟化酶(F3 ' 5 ' h) (VIT_06s0009g02970和VIT_06s0009g02840)羟基化的基因显著增加,导致花青素前体飞飞草素。相比之下,利用相同前体二氢山奈酚通过类黄酮3 '羟化酶(F3'H)合成另一种花青素前体(cyanidin)的平行生物合成途径在设拉子中没有显示出显著的表达增加,而在CS中从veraison到成熟期中表达下调(Additional file)2:表S5)。前期研究表明,F3 ' h和F3 ' 5'H的高表达与黄酮醇、黄烷醇和部分花青素的组成有关[97],[98].因此,F3 ' h作为早期作用的类黄酮基因可以为花青素类黄烷醇和花青素提供前体,而F3 ' 5'H可能在果实发育的后期将通量转向飞燕草苷衍生物。因此,F3’5’h转录本在采后显著高表达可能与多酚成熟有关。我们对代谢物和转录本的分析表明,在多酚生物合成过程中,代谢物和相关基因转录本之间存在一致的关联(图)5和7).
葡萄果实的角质层,由一层蜡层组成,保护果实不干燥和不受伤害。三个推测的蜡合酶编码转录本(VIT_15s0046g00590、VIT_15s0046g00520和VIT_03s0063g00050)的丰度显著下降,而其他三个蜡合酶编码转录本(VIT_15s0046g00470、VIT_15s0046g00590、VIT_15s0046g00520和VIT_03s0063g00050)的丰度显著下降。VIT_19s0090g01340和VIT_19s0090g01350)在早熟至中期果实发育过程中显著诱导;但在Shiraz浆果皮中却不是这样,其中两个蜡合成相关基因(VIT_15s0046g00590和VIT_15s0046g00520)被检测到下调,只有一个基因(VIT_15s0046g00470)显著上调(附加文件)2:表S5)。我们的研究结果部分与以往芯片的转录组研究,其中最大的蜡合酶编码转录物在转色期显示对比度[47],[99].两个品种在通用胁迫蛋白(USP)的两个不同转录本上表现出差异表达。Shiraz的变化幅度(VIT_06s0004g05670和VIT_08s0007g01360分别为3.2-和2.4倍)大于CS的变化幅度(VIT_07s0005g01290和VIT_08s0007g01360分别为2.4-和1.7倍)2:表S5)。这些数据与之前的结果一致,在那里我们显示了Shiraz更明显的干旱相关的反应,与CS相比,逐步缺水[69].
意料之中的是,许多参与浆果成熟过程的植物激素相关基因在转录水平上发生了变化(Additional file)2表S6),两个品种的果实都是由变浆期发展到变浆期后的。例如,共有19个ABA代谢相关基因在发育和品种特异性方面表现出差异表达,即设拉子ABA相关基因表达上调,而CS则明显抑制了这一过程(Additional file)2:表S6)。乙烯生物合成相关基因的表达在发育过程中也发生了高度变化,但在两个品种中表现出相似的趋势2:表S6)。油菜素内酯生物合成相关基因在两个品种中也发生了显著变化,但程度不同。即CS中有2个基因表达上调,8个基因表达下调;设拉子中有3个基因表达上调,5个基因表达下调。在茉莉酸生物合成方面,两个品种上调了一个基因,而在CS(5个基因)中下调幅度大于设拉子(2个基因)2:表S6)。
基因浓缩分析
使用Expander富集分析工具对分类基因进行功能分类的结果显示在附加文件中1:图S5。富集分析结果显示,CS和Shiraz中分别有44和37个显著富集网络。明显丰富的网络的详细名单(邦菲罗尼修正p -值截止值:0.05)和基因的成员在附加文件中给出了进一步分区的进一步分区2:表S7。在分类基因中,Shiraz在碳水化合物和专门的代谢过程中表现出更高的富集,而脂质,发育和DNA / RNA过程以CS浆果(附加档案)表示1:图S5)。
讨论
不同品种的浆果代谢和其在发育过程中内源性和环境线索的调节,从而产生不同品种的葡萄酒风味[21],[22],[One hundred.] - [102].光照、温度和水分需求是影响植物生长发育的重要因素[103] - [105]。在这方面,Cabernet Sauvignon和Shiraz最近被证明具有不同的水力特性和用水[106],在本研究的实地测量中证实了土壤体积含水量(附加文件1(图S1),叶片代谢和营养生理对末端干旱的响应不同[69].此前,对赤霞珠浆果皮微阵列分析的单独研究[15]和设拉子的RNAseq [57报道了浆果发育过程中基因表达的转录谱和动态变化。通过对两个品种的代谢物和RNA转录本的比较平行分析,可以全面描述草莓发育过程中代谢过程调控的共性和差异。
在浆果发育的早期阶段,浆果皮完全是绿色的,并具有光合作用[107],[108,在当地促进糖和其他有机酸的生物合成[65],[109然后在特定的代谢过程中作为基质使用。然而,正如Dai等人最近所报道的,糖含量的逐渐下降是为了支持通过光合作用产生的碳水化合物资源的持续利用。65].大部分鉴定出的有机酸在两个品种中从变浆到果实成熟均呈递减趋势。代谢产物谱显示,随着veraison到20 DAV的发展,CS和Shiraz的TCA循环都出现了下调。我们的结果与以前的发现一致[57表明三羧酸循环活性的逐渐下降可能与碳水化合物、氨基酸和随后的类黄酮合成过程中前体供应需求的增加相匹配[65].然而,可以将较大的碳需求引导到Shiraz的专业代谢中,并且特别是在增强的花青素生产中,特别是香豆酰基(下面讨论)。例如,在Cs中表现出更大的蔗糖积累,而不是在Shiraz从Veraison成熟;在成熟的后期分阶段期间,在Shiraz中测量Quinate和Shikimate的Quals and Shikimate的较低,这在Shiraz中测量了Shiraz,这表明对下游过程(花青素产生)增加了一体化。相关分析进一步支持中央和专业代谢之间高度协调的代谢变化的证据。在Shiraz代谢物分析中发生了更多数量的显着相关性,与Cs相比,Shiraz代谢网络的较强特性以及类黄酮基因的相对较高的表达表明,Shiraz代谢具有对所研究的代谢途径相对严格地协调。
从苯基丙氨酸解氨酶(PAL)、二苯乙烯合成酶、查尔酮合成酶和查尔酮异构酶的大量转录本的表达增加是其逐渐成熟的特征;在两个品种中均有上调,但在设拉子中更明显。同时,在代谢物水平上,莽草酯含量显著降低。连接初级代谢和多酚生物合成的中间代谢物[16],[110Shikimate是芳族氨基酸的前体,苯丙氨酸,其在相对丰富的朝向成熟度与下游多酚的含量较高的相同丰富下降。Shiraz中代谢物(PHE)和相关转录物的变化大于Cs,表明中央代谢的协调变化,促进了在品种中的专用化合物的生物合成,但在Shiraz的程度上更大。通过从成熟的叶片通过Phloem成熟期间营养成果的连续供应燃料浆果代谢过程[111].尽管如此,人们还是倾向于这样一种假设,即veraison时皮肤特异性代谢的开始是由主要底物的生物合成和积累所支持的,例如糖和有机酸(包括shikimate),这些底物是通过veraison前期局部产生的光合产物而产生的。光合作用在肉质果实中的作用最近在西红柿的发育中得到了探讨[112].结果表明,至少在果实光合作用条件下,光合作用对果实能量代谢和发育不是必需的,但对种子发育是必需的。还研究了光合作用在植物自养组织向异养组织转变中的作用。这里的结果表明,光合作用有助于维持组织中的能量和氧气水平超过代谢促进阈值,随后组织将变得密集和缺氧[113].这些矛盾的结果促使更多的工作来阐明局部光合作用对组织发育的作用。浆果成熟还伴随着应激相关代谢的增强,如海藻糖、二苯乙烯和ABA,这表明设拉子对环境信号更敏感,可能与野外条件有关,反映在高辐射和温度中。在最近的一项研究中,为了支持这一假设,在渐次干旱条件下,设拉子对叶的中心代谢和应激相关化合物的积累做出了更大的改变[69].
两个品种在类黄酮途径的转录本和代谢产物上表现出相似的模式,但变化幅度不同
花青素构成浆果皮肤黄酮的重要部分[114和五类(花青素、芍药素、飞燕草素、芍药素和锦葵素)葡萄葡萄及其糖苷,乙酰糖苷,香豆蔻糖苷,牡丹苷和malvidin咖啡糖苷[95].二氢山奈酚是F3 ' h和F3 ' 5'H产生相应花青素型和飞燕花素型花青素的常用底物[21].这两种酶,F3 ' h和F3 ' 5'H,属于细胞色素p450蛋白家族[115],并分别竞争红色和蓝色花青素合成的共同前体[116].前期系统发育分析表明,F3’5’h是从被子植物和裸子植物分化之前的F3’h中征募而来[117].在目前的研究中,编码F3'5'H的转录物在来自Veraison的相对丰富于繁殖中的相对丰富程度下显着增加。F3'5'H转录物丰度的增加与F3'H转录物丰度的降低以及较高积聚该途径下游步骤中的Delphinidin型花青素。据推测,F3'5'H在驱动苯丙烷基质通量朝向Delphinidin型花青素途径的关键作用。Mattivi等人。[21]也表明较高的F3 ' 5'OH活性将引导花青素向飞飞花素型花青素型转变。Liu等[118]显示了在UV处理下,南极苔藓中F3’5’h基因的转录丰度比F3’h基因的转录丰度变化更大。也许,F3 ' 5'H基因与浆果成熟过程中应对压力增加的策略高度相关。
在本研究中,与CS相比,Shiraz中花青素香豆素形式的积累显著增加(附加文件2:表S8)对浆果发展的后期阶段,这正好与苯丙相关基因转录水平的提高。花青素生物合成的酰化步骤是通过花色素苷酰基转移酶可链接芳香成分的葡糖基的C6'位置介导的[119].生物合成的这一步提高了花色苷的颜色稳定性和强度[120] - [122].我们的结果与Mazza等人先前报道的花青素香豆素形式的重大品种变异性一致[123和Boss等人[124].
Shiraz表现出增强的斯蒂格代谢
在二苯乙烯的代谢和调控方面有显著的品种特异性。具体来说,Shiraz在成熟过程中显示了许多STS基因的显著上调,这在CS中没有观察到。转录谱与白藜芦醇和白藜芦醇的含量一致,在设拉子中积累的白藜芦醇和白藜芦醇比在CS中积累的多。这些发现表明两个品种间对二苯乙烯代谢的调节存在差异,并证实了STS转录水平与葡萄果皮中二苯乙烯化合物丰度的高度相关性[125],[126].尽管如此,二苯乙烯和类黄酮代谢之间的分支可能意味着对相同前体的竞争。然而,与CS相比,Shiraz中花青素的积累表明,该品种的多酚途径上调,可能是由于当地气候条件(通过胁迫相关基因和代谢产物表达)和主要C底物(如蔗糖)的损失。
设拉子表现出植物激素相关基因的转录增强
植物激素在浆果成熟过程中的作用及其与其他信号分子的协同作用已经被报道过[127].外源性ABA应用诱导番茄等中生水果中的成熟过程[128],[129]和香蕉[130].内源性ABA与水中的糖代谢有关[131].以前的研究表明,随着果实的成熟,ABA的含量增加[11],[132],[133],并可能参与增强酚类化合物的生物合成[134] - [137].我们的数据表明,Shiraz中ABA相关基因的上调确实与品种特异性花青素积累和特异性香豆素花青素形式的增加有关。Cramer等人[138]表明,在激素代谢相关基因中,ABA相关转录本对水和盐胁迫的响应变化最大。考虑到Shiraz和CS之间最近建立的应激反应差异[69],[106], aba相关基因增强和其他胁迫相关过程的可能解释,可能与该品种在试验田生长条件下所经历的胁迫程度有关,如高蒸散和辐射和低湿度。
结论
目前的比较研究表明,在两个品种的果实发育过程中,多酚代谢和各自的转录本之间存在紧密的协调关系。F3 ' h和F3 ' 5'H这两个具有共同底物的苯丙代谢过程的反向调节,反映在两个平行的下游花青素途径的代谢谱上。相关分析显示,中枢代谢和特化代谢之间存在“源库”样关系,转录本分析也支持这种关系。在品种水平上,设拉子的特点是更同步的发育代谢以及更大的上调整个多酚途径,应激相关过程。综上所述,葡萄品种对环境的敏感性可能受葡萄植株的水力行为和生理特性的影响,并可能决定果实收获时重要的代谢性状。
可获得的支持数据
代谢物标准清单、主成分分析、代谢物相关性分析、显著变化转录本清单、植物激素相关基因清单、富集分析、样品代谢物两两比较和香豆素花青素形式的统计分析的支持数据可在附加文件中获得2S1-S8:表。土壤体积含水量的变化、羟基肉桂酸的相对丰度、香豆蔻酰花青素形态的相对丰度、相关分析综述及功能类别分布情况见附加文件1:数字S1-S5。
附加文件
参考文献
- 1.
Arroyo-Garcia R, Ruiz‐Garcia L, Bolling L, Ocete R, Lopez M, Arnold C, Ergul A, Uzun H, Cabello F, Ibáñez J:栽培葡萄(Vitis vinifera L. ssp.)的多种来源。基于叶绿体DNA多态性。生态学报,2006,15(12):3707-3714。
- 2.
韦伯L,Whetton P,Barlow E:澳大利亚的气候变化和葡萄酒素质。气候res。2008,36(2):99-
- 3.
这P,拉孔布T,托马斯:历史渊源和酿酒葡萄的遗传多样性。趋势类型。2006年,22(9):511-519。
- 4.
Alonso-Blanco C, Aarts MG, Bentsink L, Keurentjes JJ, raymond M, Vreugdenhil D, Koornneef M:关于植物的发育、生理和适应,自然变异教会了我们什么?植物学报。2009,21(7):1877-1896。
- 5.
利用三维数字化和图像分析技术测定葡萄树冠层结构和光小气候指数及其与葡萄品质的关系。葡萄酒业,1998,4(1):2-13。
- 6.
王志强,王志强,王志强,等。葡萄果实带叶去除技术的研究进展。雷司令葡萄树。一、对冠层结构、小气候、芽存活、茎密度、藤本活力的影响。中国生物医学工程学报,1994,16(2):123-132。
- 7.
刘志刚,刘志刚,刘志刚:基于冠层三维建模的葡萄树冠层结构和冠层定位对光照截取和分布的影响。葡萄酒业,2008,14(3):143-152。
- 8.
Delgado R, Martín P, del Álamo M, González M:葡萄果实成熟过程中酚类成分的变化与葡萄园氮、钾施肥的关系。农业科学学报,2004,27(7):623-630。
- 9.
唐尼·莫,哈维·JS,罗宾逊SP:遮荫对设拉子葡萄果实发育和类黄酮积累的影响。中国葡萄酒业,2004,10(1):55-73。
- 10.
de Orduña MR:气候变化对葡萄和葡萄酒质量和生产的影响。食品科学进展,2010,43(7):1844-1855。
- 11.
Coombe BG, Hale C:葡萄果实成熟后激素含量及生长物质处理的影响。植物生理学报。2003,51(4):629-634。
- 12.
Coombe B:葡萄浆果的发育和成熟的研究。中国生物医学工程学报,1998,13 (1):101-
- 13.
【关键词】葡萄(Vitis vinifera cv.);设拉子)浆果的皮肤。功能整合基因组学。2005,5(1):40-58。
- 14.
Deluc L,Bogs J,Walker Ar,Ferrier T,Decendit A,Merillon JM,Robinson SP,Barrieu F:转录因子VVMYB5B有助于调节葡萄浆果中的花青素和原霉素生物合成。植物理性。2008,147(4):2041-
- 15.
Deluc LG, Grimplet J, Wheatley MD, Tillett RL, Quilici DR, Osborne C, Schooley DA, Schlauch KA, Cushman JC, Cramer GR:赤霞珠葡萄果实发育的转录组和代谢产物分析。中国生物医学工程学报。2007,28 (1):429-
- 16.
Conde C,Silva P,Fontes N,Dias Acp,Tavares RM,Sousa MJ,Agasse A,Delrot S,GerósH:在葡萄浆果开发和水果和葡萄酒质量的生化变化。食物(全球科学书籍)。2007,1(1):1-22。
- 17.
肯尼迪贾,马修斯马,水馆Al:果实成熟过程中葡萄种子多酚的变化。植物化学。2000,55(1):77-85。
- 18.
Kennedy Ja,Troup GJ,Pilbrow JR,Hutton Dr,Hewitt D,Hunter Cr,Ristic R,Iland Pg,Jones GP:来自葡萄葡萄的浆果中种子多酚。设拉子。Aust J葡萄酒Res。2000,6(3):244-254。
- 19.
Kennedy JA, Hayasaka Y, Vidal S, Waters EJ, Jones GP:葡萄果皮原花青素在不同浆果发育阶段的组成。农业科学学报,2001,49(11):5348-5355。
- 20.
罗宾逊SP,戴维斯C:葡萄浆果成熟的分子生物学。Aust J葡萄酒Res。2000,6(2):175-188。
- 21.
Mattivi F,Guzzon R,Vrhovsek U,Stefanini M,Velasco R:葡萄的代谢物分析:黄酮醇和花青素。JAgric Food Chem。2006,54(20):7692-7702。
- 22.
Katalinić V, Možina SS, Skroza D, Generalić I, Abramovič H, Miloš M, Ljubenkov I, Piskernik S, Pezo I, Terpinc食品化学。2010,119(2):715-723。
- 23。
梁志强,吴斌,范鹏,杨超,段伟,郑旭,刘超,李树文:< i >葡萄种质资源果皮花色苷组成及含量。食品化学。2008,111(4):837-844。
- 24。
Jones GV,White Ma,Cooper或,Storchmann K:气候变化和全球葡萄酒品质。高度变化。2005,73(3):319-343。
- 25。
环境对葡萄有机酸和碳水化合物代谢的影响。我的温度。植物生理学。1964,39 (6):869-
- 26。
White MA, Diffenbaugh N, Jones GV, Pal J, Giorgi F:极端高温降低并改变了21世纪美国优质葡萄酒的生产。中国科学(d辑:地球科学),2006,33(6):717 - 722。
- 27.
Pomar F, Novo M, Masa A:用高效液相色谱法研究50个红鲜食葡萄品种花色苷谱的差异。中国有色金属学报,2003,19(1):1 - 5。
- 28.
Bravdo B, Naor A, Zahavi T, Gal Y, Snyder R:水分胁迫对葡萄酒品质、产量和水分关系的影响。Acta horactica sinica, 2004, 664: 101-109。
- 29.
葡萄在特定发育阶段对水分亏缺胁迫的反应。中国生物医学工程学报,1996,27(2):55-61。
- 30.
马志强,王志强。中国海洋大学学报(自然科学版). 1989,40(1):52-60。
- 31.
Ojeda H, Andary C, Kraeva E, Carbonneau A, Deloire A:水分亏缺对葡萄果实生长过程中表皮酚类化合物合成及浓度的影响。设拉子。中国生物医学工程学报,2003,21(4):427 - 434。
- 32.
引用本文:Hunter J, Ruffner H, Volschenk C, Le Roux D:葡萄部分脱落。赤霞珠/99 Richter:对根系生长、冠层效率的影响;葡萄成分和葡萄酒品质。中国科学(d辑:地球科学),1995,46(3):306-314。
- 33.
olat n,gaudillere j:浆果生长阶段I阶段I阶段的叶片叶片叶片叶片的发展与组成造成的血管生长学浆..赤霞珠。Am j enol vitic。1998,49(3):251-258。
- 34.
Guidoni S, Allara P, Schubert A:簇减疏对葡萄果皮花色苷组成的影响。内比奥罗。中国生物医学工程学报,2003,21(3):427 - 434。
- 35.
Zohary D:无意识选择和驯化植物的进化。农业工程学报。2004,58(1):5-10。
- 36.
Lemaire-Chamley M,Petit J,Garcia V,Just D,Baldet P,Germain V,Fagard M,Mouassite M,Cheniclet C,Rothan C:转录型材的变化与番茄早期水果组织专业相关。植物理性。2005,139(2):750-769。
- 37.
Hichri I, Barrieu F, Bogs J, Kappel C, Delrot S, Lauvergeat V:类黄酮生物合成途径转录调控的最新进展。中国生物医学工程学报。2011,32(8):2465-2483。
- 38.
通过葡萄藤(Vitis vinifera)浆果中的酚类物质来屏蔽紫外线。植物生态学报,2003,30(12):1177-1186。
- 39.
王莉:植物防御与苯丙素途径的基因组学研究。植物营养与肥料学报。2002,3(5):371-390。
- 40.
黄酮类化合物的生物合成和应激的影响。植物营养与肥料学报。2002,5(3):218-223。
- 41.
亚当斯DO:葡萄浆果中的酚类物质和成熟过程。中国生物医学工程学报。2006,27(3):249-256。
- 42.
黄酮类化合物与酚酸的结构-抗氧化活性关系。中华结核和呼吸杂志。1996,20(7):933-956。
- 43.
酚类化合物的抗氧化性能。植物科学进展,1997,2(4):152-159。
- 44.
Broidot E,Petrussa E,Bertolini A,Peresson C,Ermacora P,Loi N,Terdoslavich M,Passamonti S,Macrìf,Vianello A:用于葡萄浆果(Vitis Vinifera L)中哺乳动物硼丙二醇酶相似的推定的黄酮类化合物的证据成熟。Planta。2008,228(1):203-213。
- 45.
Jaillon O, Aury J, Noel B, Policriti A, Clepet C, Casagrande A, Choisne N, Aubourg S, Vitulo N, Jubin C:葡萄藤基因组序列显示主要被子植物门的祖先六倍体化。自然科学学报。2007,449(7):463-467。
- 46.
陈胜,王玉英,余欧,陈胜,邱伟:Norton葡萄果实皮发育的转录调控和类黄酮生物合成的不同模式。华北农学报。2011,11 (1):7-
- 47。
Lijavetzky D, Carbonell-Bejerano P, Grimplet J, Bravo G, Flores P, Fenoll J, Hellín P, Oliveros JC, Martínez-Zapater JM:通过转录分析评估葡萄果实的果肉和皮肤成熟特征。acta photonica sinica, 2012, 37 (6): 657 - 662
- 48。
JEONG S,GOTO-YAMOMOTO N,HASHIZUME K,ESAKA M:多拷贝类黄酮途径基因的表达与花青素,黄酮醇和黄酮-3-OL的葡萄树积累。血管。2008,47(3):135-140。
- 49。
Pilati S, Perazzolli M, Malossini A, cesaro A, Demattè L, Fontana P, Dal Ri A, Viola R, Velasco R, Moser C:葡萄果实成熟的全基因组转录分析显示,一组基因在三个季节中被类似地调节,并在veraison发生氧化爆发。中国生物医学工程学报。2007,28 (1):428-
- 50。
梗N,滑溜d,GrimpletĴ,Barrieu楼Abbal P,裳C,Ageorges A,Atanassova R,列昂C,Renaudin Y:同基因特异性寡核苷酸阵列葡萄浆果中揭示了在基因表达的多方面的改变(葡萄属)发展.Planta。2005年,222(5):832-847。
- 51。
Da Silva C, Zamperin G, Ferrarini Minio,木豆Molin, Venturini L, Buson今年G, Tononi P, Avanzato C, Zago E, Boido E, Dellacassa E, Gaggero C, Pezzotti M, Carrau F, Delledonne M:葡萄多酚含量高的品种tannat浆果授予主要由基因不是与参考基因组。植物学报。2013,25(12):4777-4788。
- 52。
Venturini L,Ferrarini A,Zenoni S,Tornielli GB,Fasoli M,Dal Santo S,Minio A,Buson G,Tononi P,Zago Ed:De Novo转录组血管血管血管瘤表征。Corvina推出了品种多样性。BMC基因组学。2013,14(1):41-
- 53。
Di Genova A, Almeida AM, Mun C, Vizoso P, Travisany D, Moraga C, Pinto M, Hinrichsen P, Orellana, Maass A:餐桌葡萄和葡萄酒葡萄的全基因组比较揭示了结构变异的全面目录。华北农学报。2014,14 (1):7-
- 54.
Wang Z, Gerstein M, Snyder M: RNA-Seq:转录组学的革命性工具。中国生物医学工程学报。2009,10(1):57-63。
- 55.
Zenoni S,Ferrarini A,Giacomelli E,Xumerle L,Fasoli M,Malerba G,Bellin D,Pezzotti M,Delledonne M:使用RNA-SEQ在葡萄核苷酸中的浆果发育过程中转录复杂性的表征。植物理性。2010,152(4):1787-1795。
- 56.
Fasoli M, Dal Santo S, Zenoni S, Tornielli GB, Farina L, Zamboni A, Porceddu A, Venturini L, Bicego M, Murino V:葡萄藤表达图谱揭示了一个深层次的转录组转移,推动整个植物进入成熟程序。植物学报。2012,24(9):3489-3505。
- 57.
葡萄果实四个发育阶段的转录组分析。(设拉子)提供了关于调控和协调基因表达的见解。中国生物医学工程学报。2012,13 (1):691-
- 58.
Mattoo AK, Chung SH, Goyal RK, Fatima T, Solomos T, Srivastava A, Handa AK:高多胺在成熟番茄果实中过度积累,恢复代谢记忆,上调合成代谢相关基因,并对营养质量产生积极影响。acta physica sinica, 2010, 32(5): 593 - 598。
- 59.
番茄果实成熟和发育过程中类胡萝卜素形成的调控。中国生物医学工程学报,2002,21(4):427 - 434。
- 60.
Rosati C,Aquilani R,Dharmapuri S,Pallara P,Marusic C,Tavazza R,Bouvier F,Camara B,Giuliano G:番茄水果中β-胡萝卜素和番茄红素含量的代谢工程。工厂J.2000,24(3):413-420。
- 61.
Castellarin SD,马修斯MA,狄Gaspero G,甘贝塔GA:水赤字加速熟化并诱导基因表达的葡萄浆果调节类黄酮合成的变化。Planta。2007年,227(1):101-112。
- 62.
Castellarin SD, Di Gaspero G, Marconi R, Nonis A, Peterlunger E, Paillard S, Adam-Blondon A, Testolin R:红葡萄(Vitis vinifera L.)的颜色变化:浆果皮中红/蓝飞燕花色素的基因组组织、类黄酮3 ' -羟化酶、类黄酮3 '、5 ' -羟化酶基因表达及相关代谢物分析中国生物医学工程学报。2006,12 (1):12-
- 63.
高迪莱尔,陈志强,陈志强,陈志强:小气候对葡萄果实矿物质和代谢的影响。农业工程学报。2006,54(18):6765-6775。
- 64.
引用本文:陈志强,陈志强,陈志强,陈志强,陈志强,陈志强,陈志强,陈志强,陈志强,陈志强,陈志强,陈志强,陈志强,陈志强,陈志强:波尔多葡萄产区葡萄果实核磁共振代谢产物指纹图谱研究。Acta photonica sinica, 2006, 563(1): 346-352。
- 65.
戴志伟,Léon C, Feil R, Lunn JE, Delrot S, Gomès E:代谢谱揭示了葡萄果实(Vitis vinifera L.)主要碳水化合物代谢的协调开关。中国生物医学工程学报。2013,34(5):1345-1355。
- 66.
葡萄酒中总酸的测定方法。陈志强,陈志强,陈志强,等。
- 67.
Weckwerth W,Wenzel K,Fiehn O:用于综合提取,鉴定和定量代谢物,蛋白质和RNA的过程,以揭示其生物化学网络中的共调节。蛋白质组学。2004,4(1):78-83。
- 68.
基于气相色谱质谱的植物代谢物分析。光子学报。2006,1(1):387-396。
- 69.
Hochberg U, Degu A, Toubiana D, Gendler T, Nikoloski Z, Rachmilevitch S, Fait A:代谢谱和网络分析揭示了葡萄水分胁迫响应的协调变化。华北农学报。2013,13 (1):184-
- 70。
Arapitsas P, Scholz M, Vrhovsek U, Di Blasi S, Bartolini AB, Masuero D, Perenzoni D, Rigo A, Mattivi F:葡萄酒微氧化研究的代谢组学方法。acta photonica sinica, 2012, 37 (5): 641 - 646
- 71。
Monagas M,SuárezR,Gómez-CordovésC,BartoloméB:HPLC-DAD / ESI-MS同时测定红葡萄酒中的红葡萄酒酚类化合物。Am j enol vitic。2005,56(2):139-147。
- 72。
Monagas M,NúñezV,BartoloméB,Gómez-CordovésC:在西班牙生产的Graciano,Tempranillo和Cabroet Sauvignon葡萄酒的花青素衍生的颜料。Am j enol vitic。2003,54(3):163-169。
- 73。
Sánchez-rabaneda F,Jauregui O,Lamuela-RaventósRM,Viladomat F,Bastida J,Codina C:使用液相色谱法在串联模式下耦合到质谱法的苹果焊料中酚类化合物的定性分析。快速交流质谱。2004,18(5):553-563。
- 74。
Iijima Y,Nakamura Y,Nogata Y,Tanaka K,Sakurai N,Suda K,Suzuki T,Suzuki H,冈萨基,Kitayama M:基于质谱信息集成的代谢物注释。工厂J. 2008,54(5):949-962。
- 75。
Hanhineva K, Rogachev I, Kokko H, minz - oron S, Venger I, Kärenlampi S, Aharoni A:草莓(< I > Fragaria × < I > ananassa)花空间代谢产物组成的非目标分析。植物化学学报。2008,69(13):2463-2481。
- 76。
Moco S, Bino RJ, Vorst O, Verhoeven HA, de Groot J, van Beek TA, Vervoort J, de Vos CR:基于液相色谱-质谱的番茄代谢组数据库。植物营养与肥料学报。2006,31(4):441 - 446。
- 77。
Toubiana D,Semel Y,Tohge T,Beleggia R,Cattivelli L,荣誉L,Nikoloski Z,Zamir D,Fernie AR,FAIT A:绘图人群的代谢分析暴露了种子代谢和种子的调控中的新见解,和植物关系。Plos Genet。2012,8(3):E1002612-
- 78.
Japelaghi RH, Haddad R, Garoosi G:快速高效地从富含多酚和多糖的植物组织中分离出高质量的核酸。生物技术学报,2011,49(2):129-137。
- 79.
surgo - groba Y, Montoya-Burgos JI:从下一代测序数据中优化从头转录组组装。中国生物医学工程学报,2010,20(10):1432-1440。
- 80.
Trapnell C, Williams BA, Pertea G, Mortazavi A, Kwan G, van Baren MJ, Salzberg SL, Wold BJ, Pachter L:通过RNA-Seq转录本组装和定量揭示了细胞分化过程中未注释的转录本和亚型转换。生物技术学报,2010,28(5):511-515。
- 81.
Roberts A, Trapnell C, Donaghey J, Rinn JL, Pachter L:通过纠正片段偏倚改善RNA-Seq表达估计。中国生物医学工程学报。2011,12 (3):R22-
- 82.
GrimpletĴ,厢式赫默特Ĵ,Carbonell的-Bejerano P,迪亚兹-里克尔梅Ĵ,迪克森Ĵ,芬内尔A,Pezzotti男,马丁内斯-萨帕特尔JM:葡萄全基因组基因预测,功能注释,分类和集成的预测的比较分析基因序列。BMC RES笔记。2012年,5(1):213-
- 83.
Ulitsky I, Maron-Katz A, Shavit S, Sagir D, Linhart C, Elkon R, Tanay A, Sharan R, Shiloh Y, Shamir R:扩展器:从表达微阵列到网络和功能。光子学报。2010,40(2):363 - 368。
- 84.
Paley SM, Karp PD:通路工具细胞概览图和组学查看器。核酸学报2006,34(13):3771-3778。
- 85.
Dharmadhikari M:葡萄的构成。葡萄园复古景观莫州立大学。1994,9(7/8):3-8。
- 86.
acta opsyica (acta opsyica (acta opsyica) (acta opsyica (acta opsyica) (acta opsyica) (acta opsyica (acta opsyica) (acta opsyica (acta opsyica))); acta opsyica (acta opsyica (acta opsyica)) (acta opsyica (acta opsyica));植物营养与肥料学报。2008,32(1):1 - 8。
- 87.
Schnee S, Viret O, Gindro K:二苯乙烯在葡萄抗白粉病中的作用。acta botanica sinica(云南植物研究),2008,32(4):457 - 461。
- 88.
葡萄和其他葡萄科成员对感染或伤害的反应产生白藜芦醇。植物营养与肥料学报。1997,9(1):77-86。
- 89.
Adrian M, Jeandet P, Veneau J, Weston LA, Bessis R:葡萄中二苯乙烯化合物白藜芦醇对灰霉病病原Botrytis cinerea的生物活性。化学学报,1997,23(7):1689-1702。
- 90.
Bézier A, Lambert B, Baillieul F:感染灰葡萄孢的葡萄叶和浆果中防御相关基因表达的研究。acta botanica sinica(云南植物学报),2002,27(2):111-120。
- 91.
白藜芦醇的产生与葡萄灰霉病菌侵染的关系。葡萄。1979,18:244-253。
- 92.
Chiron H, Drouet A, Lieutier F, Payer H, Ernst D, Sandermann H:臭氧处理、创伤和真菌感染中苏格兰松二苯乙烯生物合成的基因诱导。植物营养与肥料学报。2000,12(2):865-872。
- 93。
Wang W, Tang K, Yang H ., Wen P ., Zhang P ., Wang H ., Huang W .:白藜芦醇和二苯乙烯合成酶在葡萄幼苗中的分布。赤霞珠(Cabernet Sauvignon)和UV-C对其积累的影响。植物生理学与生物化学。2010,48(2):142-152。
- 94。
Rosemann D,Heller W,Sandermann H:对臭氧II的生化植物反应。苏格兰松树(Pinus Sylvestris L.)幼苗诱导斯蒂尔贝烯生物合成。植物理性。1991,97(4):1280-1286。
- 95。
Teixeira A, Eiras-Dias J, Castellarin SD, Gerós H:挑战性环境下葡萄果实的酚类物质。中国科学(d辑),2013,27(9):1872 - 1872。
- 96。
Toffali K, Zamboni A, Anesi A, Stocchero M, Pezzotti M, Levi M, Guzzo F:通过非靶向LC-ESI-MS代谢组学分析揭示葡萄浆果成熟和收获后枯萎的新方面。代谢组学。2011,7(3):424-436。
- 97。
Castellarin SD, Pfeiffer A, Sivilotti P, Degan M, Peterlunger E, Di Gaspero G:季节性缺水条件下葡萄成熟果实花色苷生物合成的转录调控。植物学报。2007,30(11):1381-1399。
- 98。
郑志刚,后to- yamamoto N, Hashizume K, Esaka M:葡萄( Vitis vinifera)中类黄酮3 ' -羟化酶和类黄酮3 ',5 ' -羟化酶基因的表达及类黄酮组成。植物学报,2006,170(1):61-69。
- 99。
陈志强,陈志强,陈志强,等:葡萄花期后果皮的形态、结构和发育。中国葡萄学报,1996,2(2):97- 102。
- One hundred.
Vilanova M, Masa A, Tardaguila J:通过定量描述分析评估西班牙葡萄品种的香气描述符变异。acta physica sinica, 2009, 32(2): 362 - 367。
- 101.
Gatto P, Vrhovsek U, Muth J, Segala C, Romualdi C, Fontana P, prufere D, Stefanini M, Moser C, Mattivi F:健康葡萄中二苯乙烯积累的成熟和基因型控制。农业工程学报。2008,56(24):11773-11785。
- 102.
杨静,刘红华:酿酒葡萄的植物化学特征及其抗氧化活性。食品化学。2009,116(1):332-339。
- 103.
havox M:光系统II在水、热和光抑制胁迫下的抗逆性。植物营养与肥料学报,2011,30(1):1 - 8。
- 104.
王志强,王志强,王志强,等:高温和水分亏缺条件下羽扇豆光合作用的非气孔限制。光合作用。1992,27:521-528。
- 105.
Cornic G, Massacci A:干旱胁迫下叶片光合作用。光合作用与环境。编辑:Baker NR. 1996, Kluwer学术出版社,纽约,347-366。
- 106.
Hochberg U,Degu A,Fait A,Rachmilevitch S:与近氧化物葡萄葡萄栽培品种相比,在干旱胁迫下,在干旱胁迫下显示出更高的光合效率和光响应率。physiol植物。2012,147(4):443-453。
- 107.
水果光合作用。植物学报。1989,12(1):31-46。
- 108.
Sweetman C, Deluc LG, Cramer GR, Ford CM, Soole KL:葡萄浆果和其他发育果实中苹果酸代谢的调节。植物化学学报。2009,70(11):1329-1344。
- 109.
Agudelo-Romero P,Erban A,Sousa L,Pais Ms,Kopka J,Fortes Am:搜索葡萄预成熟和成熟和熟练的转录和代谢标志,并在三种葡萄牙品种中的特定香气发育。Plos一个。2013,8(4):E60422-
- 110.
Castellarin S, Bavaresco L, Falginella L, Gonçalves M, Di Gaspero G, Gerós H, Chaves M, Delrot S:葡萄浆果中的酚类物质和关键抗氧化剂。葡萄浆果的生物化学。编辑:Gerós HM, Chaves M, Delrot S. 2012,边沁科学出版社,荷兰,Bussum, 89-110。
- 111.
葡萄藤中同化物的运输——韧皮部分裂的影响。中国葡萄酒业,2001,7(3):118-126。
- 112.
Lytovchenko, Eickmeier我,脑桥C,奥索里奥,Szecowka M,莱贝格K, Arrivault年代,Tohge T, B皮内,安东MT, Hedtke B,陆Y, Fisahn J,烈性黑啤酒R,施迪M,格林B, Granell, Fernie AR:番茄光合作用是看似不重要在初级代谢和成熟但在种子发展起着相当大的作用。植物营养与肥料学报。2011,27(4):453 - 457。
- 113。
Tschiersch H, Borisjuk L, Rutten T, Rolletschek H:种子光合作用梯度及其氧平衡作用。生物工程学报,2011,33(2):362 - 368。
- 114。
Souquet J,Cheynier V,Brossaud F,Moutounet M:来自葡萄皮的聚合物花青蛋白。植物化学。1996,43(2):509-512。
- 115。
黄志强,王志强,王志强,等:葡萄果实中类黄酮羟化酶的鉴定及其调控。植物营养与肥料学报。2006,14(1):159 - 159。
- 116。
Falginella L,Castellarin SD,Testolin R,Gambetta Ga,Morgante M,Di Gaspero G:黄酮类化合物3',5'-羟基酶中的膨胀和子官能化葡萄谱系中的5'-羟基酶。BMC基因组学。2010,11:562-2164-11-562-
- 117。
Seitz C, Eder C, Deiml B, Kellner S, Martens S, Forkmann G:黄酮类化合物3 ' -羟化酶和黄酮类化合物3 ',5 ' -羟化酶cdna的克隆、功能鉴定和序列分析表明黄酮类化合物3 ',5 ' -羟化酶在菊科中独立进化。acta botanica sinica(云南植物学报),2010,31(3):457 - 461。
- 118。
刘珊珊,菊菊,夏刚:南极藓类黄酮3 ' -羟化酶和黄酮3 ',5 ' -羟化酶基因的鉴定及其在非生物胁迫中的调控。基因工程学报。2014,543(1):145-152。
- 119。
葡萄和葡萄制品中的花青素。食品科学,1995,35(4):341-371。
- 120.
安德森d,Gueffroy d,韦伯A,凯普纳R:乙酸作为花色素苷色素的葡萄酰化剂的鉴定。植物化学。1970年,9(7):1579至1583年。
- 121.
葡萄中酰基花青素色素:malvidin-3-(6-p-香豆素)糖苷的鉴定。植物化学。1971,10(4):813-819。
- 122.
利用同核哈特曼-哈恩(HOHAHA)光谱和液相色谱-质谱联用技术测定麝香葡萄中酰基化花青素的结构。植物化学学报,1994,5(4):190-196。
- 123.
Mazza G, Fukumoto L, Delaquis P, Girard B, Ewert B:不列颠哥伦比亚省品丽珠,梅洛和黑皮诺葡萄酒的花青素,酚和颜色。农业食品化学学报,1999,47(10):4009-4017。
- 124.
Boss PK, Davies C, Robinson SP:不同浆果皮肤颜色的葡萄运动中的花青素组成和花青素途径基因表达。中国葡萄酒业,1996,2(3):163-170。
- 125.
Versari A, Parpinello GP, Tornielli GB, Ferrarini R, Giulivo C:二苯乙烯化合物和二苯乙烯合成酶在葡萄成熟、萎蔫和紫外线处理中的表达。石首鱼。农业工程学报,2001,49(11):5531-5536。
- 126.
Deluc LG, Decendit A, Papastamoulis Y, Mérillon J, Cushman JC, Cramer GR:水分缺乏会增加赤霞珠浆果中的二苯乙烯代谢。农业工程学报,2010,59(1):289-297。
- 127.
Davies C, Böttcher C:荷尔蒙对葡萄浆果成熟的控制。葡萄藤分子生理学与生物技术。编辑:Roubelakis-Angelakis K. 2009,施普林格,海德堡,伦敦,纽约,229-261。2
- 128.
张敏,袁波,冷鹏:ABA在番茄果实乙烯合成和成熟中的作用。农业工程学报。2009,60(6):1579-1588。
- 129.
李志强,李志强,李志强,等。乙烯在番茄果实成熟过程中的作用。acta botanica sinica(云南植物研究),2002,33(4):457 - 461。
- 130。
姜勇,王志强,王志强:乙烯对脱落酸对香蕉果实成熟的影响。植物生长规律学报,2000,19(1):106-111。
- 131。
Deluc L, Quilici D, Decendit A, Grimplet J, Wheatley M, Schlauch K, Mérillon J, Cushman J, Cramer G:水分亏缺会改变影响赤霞珠和霞多丽葡萄果实重要风味和品质特征的不同代谢途径。中国生物医学工程学报。2009,10 (1):212-
- 132。
Inaba A, Ishida M, Sobajima Y:特拉华葡萄成熟过程中内源激素浓度的变化。中国科学(d辑:地球科学),1997,45(3):245-252。
- 133.
卡桑·DL,莫里斯·J:种子数量和成熟度与浆果发育、果实成熟、激素变化和不均匀成熟的关系。中国科学(d辑):地球科学(英文版)。
- 134.
Peppi MC,Fidelibus MW,Dokoozlian N:脱落酸应用时序和浓度影响火焰无籽葡萄的坚定,色素沉着和颜色。霍尔科。2006,41(6):1440-1445。
- 135.
Jeong S,Goto-Yamamoto N,Kobayashi S,Esaka M:植物激素和遮蔽对花青素积累的影响及葡萄浆果皮中的花青素生物合成基因的表达。植物SCI。2004,167(2):247-252。
- 136。
Ban T, Ishimaru M, Kobayashi S, Shiozaki S, Goto-Yamamoto N, Horiuchi S:脱落酸和2,4 -二氯苯氧乙酸影响‘巨穗’葡萄果实花色苷生物合成途径基因的表达。生物技术学报,2003,78(4):586-589。
- 137。
甘贝塔GA,马修斯MA,Shaghasi TH,McElrone AJ,Castellarin SD:糖和脱落酸信令直向同源物是在葡萄成熟的开始激活。Planta。2010年,232(1):219-234。
- 138。
CRAMER GR,ERGÜLA,GRIMPLET J,TILLETT RL,TATTERSALL EAR,BOHLMAN MC,VINCENT D,Sondergger J,Evans J,Osborne C:葡萄树中的水和盐度应力:转录物和代谢物轮廓的早期和晚期变化。Funct综合基因组学。2007,7(2):111-134。
确认
AF和GC感谢BARD(美国-以色列两国农业和发展基金)基金支持这项研究(批准号814512)。AD, UH和RG感谢GRCN ((NSF拨款号DBI 0741876))和Goldinger基金会的财政支持。AF和FM感谢Blaustein科学合作中心(BCSC)对他们合作的支持。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
作者的贡献
AD设计并完成了实验,分析了LCMS数据,并利用AF编写了论文正文;UH帮助进行实验,对样品进行代谢物分析,并分析气相色谱质谱数据。NS为UPLC机器样品运行提供技术支持,LV参与序列组装和随后的RNAseq计算分析,GB进行测序样品制备和测序本身,RG帮助进行RNAseq分析,AB进行网络分析,IP和VC参与RNAseq和富集分析,FM帮助使用标准进行代谢物验证,MD、MP和GRC帮助RNAseq数据分析、解读和编辑稿件,AF与sr一起构思和协调项目,所有作者评审、编辑并批准稿件的最终版本。
电子辅料
图S2。
附加文件1:图S1。:Change in volumetric water content of the soil in CS and Shiraz cultivars during the irrigation cycles. Relative abundance (log10 scale) of coumaroyl tartarate coumaric acid hexoside and ferulate at four developmental stages of the two cultivars. Values represent mean ± SE (n = 6).图S3。两个品种果实皮花青素香豆素在四个发育阶段的形态。值代表平均值±SE (n = 6)。图S4A。综上所述,CS和Shiraz与‘+’和‘-’的代谢物相关性分别为显著(p < 0.05)正(r > 0.7)和负(r <−0.7)相关性,图S4B。CS(左)和设拉子(右)网络的节点度分布。图S5。CS和Shiraz差异表达基因转录物(分类)的功能类分布。转录物分为12(CS)和10(Shiraz)更高水平的功能类别。使用扩展器浓缩分析工具产生的整个类别列表在表S5中提出。(PPTX 192 KB)
表S2。
附加文件2:表S1。:List of metabolite standards and retention time (min) run in UPLC-qTOF machine. Statistical data of the PCA (Principle Component Analysis) of GC-MS and LC-MS based metabolites including loadings and% of variance explained.表S2。表S3A。Kruskal-Wallis和Wilcoxon等级CS秩和测试值的成对比较。平均值是六个生物重复的平均值。表S3B。Kruskal-Wallis和Shiraz Wilcoxon秩和检验值的两两比较。平均值是六个生物重复的平均值。表S4A和S4B。Pairwise Pearson correlation matrix of all annotated metabolite, bolded figures represent significant correlation at p < 0.05 in CS (A) and Shiraz (B)表自己。CS和设拉子葡萄品种的相关网络特性。表S5。在赤霞珠和设拉子的浆果皮中,随着果实从Veraison发展到Veraison之后的阶段,转录本有显著变化。表S6。CS和Shiraz浆果果皮在果期至果期后的生长过程中差异表达的植物激素列表。表S7。CS (CS)和设拉子(B)浆果皮中转录本的功能类别显著改变。表S8。两个品种果实四个发育阶段香豆素花色苷形态的统计分析。(XLSX 920 KB)
作者为图像提交的原始文件
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。
除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。
要查看本许可证的副本,请访问https://creativecommons.org/licenses/by/4.0/.
创作共用及公共领域专用豁免书(https://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
德古,霍赫伯格,美国,西克朗,北。et al。在水果开发期间浆果皮肤的代谢物和成绩单剖析阐明了赤霞酚途径分支点的赤霞珠与石草品种之间的差异调节。BMC植物杂志14,188(2014)。https://doi.org/10.1186/s12870-014-0188-4
收到了:
接受:
发表:
关键字
- 代谢产物分析
- 葡萄浆果的新陈代谢
- 小道消息
- 记录分析
- 代谢组学
- 气相
- 质