摘要
背景
在被子植物中,胚乳起着至关重要的胎盘样作用,不仅是培育胚胎所必需的,而且还通过与其他种子区室复杂的遗传和表观遗传相互作用调节胚胎发生,是基因组印记发生的主要组织。
结果
我们观察到,在籽粒早期阶段,父本siRNA的表达逐渐增加,7-DAP胚乳的父本比例预计为2:1通过对玉米B73和Mo17互交的籽粒(授粉后0、3和5天)和胚乳(授粉后7、10和15天)中小干扰RNA (siRNA)转录组进行测序。此外,在胚乳中鉴定出460个siRNA印迹位点,其中大多数(456/ 460,99.1%)在10dap时由母体表达。此外,在29个印迹基因中,有13个在其2-kb的侧翼区域内存在siRNA印迹位点,模拟分析显示其频率显著高于预期。此外,“对生长素刺激的响应”、“对油菜素类固醇刺激的响应”和“基因表达的调控”等基因本体术语中富含10-DAP特异性siRNAs基因,而“营养库活性”、“蛋白质定位到液泡”和“次生代谢物生物合成过程”等基因本体术语中富含15-DAP特异性siRNAs基因。
结论
在玉米发育的胚乳中,有一部分sirna具有印迹表达模式,它们可能与某些印迹基因的表达相关。此外,siRNAs可能影响玉米胚乳发育过程中的养分吸收和分配过程。
背景
在开花植物中,两个不同的雌性配子,即中心细胞(2n)和卵细胞(1n)与两个精细胞(1n)受精,分别产生三倍体胚乳(2-母胚乳vs. 1-父胚乳,以后为2 m:1p)和二倍体胚(1 m:1p) [1].胚乳、胚胎和母体周围组织之间的遗传平衡和分子相互作用对种子的正常发育至关重要[2] - [6].胚乳虽然是末端组织,但通过提供营养物质来支持胚胎发生和种子萌发并协调种子发育发挥着至关重要的作用[2].然而,在胚乳早期发育过程中,亲本基因组的表达如何调控以及子代基因组的多大比例对这一过程的控制尚未得到充分的研究。虽然一些研究表明,在授粉后的最初几天(DAP)内,父本基因组的转录激活滞后于母本基因组的种子发育,导致亲本基因组表达不平等[7] - [9],也有研究报道亲代基因组可能在受精后同时启动,甚至在2- 4细胞阶段[10] - [12].
印记是指依赖于亲本方式的等位基因特异性基因表达,主要发生在植物胚乳中的亲本基因组的一种不平等贡献形式[13] - [16].最近的研究拟南芥而且栽培稻(水稻)揭示了产生小干扰rna (siRNAs)的非编码位点子集也受亲代基因组印记的影响[17]、[18].例如,poliv依赖的24-nt siRNAs的主要积累是在受精后从母体基因组转录的拟南芥哥伦比亚和兰德斯伯格直立树互交的种子。这些siRNAs的表达在4 ~ 6dap达到峰值,并在种子发育后期下降[17].此外,24-nt siRNAs的生物发生依赖于母体基因组剂量拟南芥24-nt sirna的比例在母系过剩的杂交中比父系过剩的杂交中高9%,这可能影响了基因的表达无性生殖的-就像与父本过剩杂交相比,母本过剩杂交产生的种子更小[19].而在杂交水稻胚乳之间Nipponbare而且Kitaake在7 ~ 8dap时,共鉴定出31个印迹siRNA位点,其中15个来自母系,16个来自父系。这一发现表明,在水稻胚乳中,父本和母本的siRNA都存在印迹,这与水稻胚乳中siRNA表达的母本倾向不同拟南芥[18],而且,这些印迹的24-nt siRNA位点富集在水稻胚乳的差异甲基化区(DMRs)中,与印迹的蛋白质编码基因相似[17].
sirna被证明参与沉默的父亲等位基因抑制drm1 drm2 drm3(署),导致其母系特异性表达拟南芥胚乳,通过检测署启动子活性pSDC::H2B-招标书野生型(WT)互交和野生型×pSDC::H2B-招标书(nrpd2a)交叉[20.].此外,siRNAs也可能参与父系等位基因的沉默MOP9.5,在WT和的胚乳中进行了等位基因特异性RT-PCR分析nrpd2a互交[20.].然而,没有令人注目的证据表明印迹siRNA和印迹基因之间有密切的联系,尽管有一部分印迹siRNA被报道与印迹基因的表达有关,例如,在水稻胚乳中,发现四个印迹siRNA位点与印迹基因近端的差异DMRs重叠,与相应的印迹基因相比,表现出相反的亲本表达模式[18此外,花粉中24-nt sirna靶向了12个围绕母系表达基因(MEGs)父系等位基因的转座因子,这可能是导致花粉中父系等位基因沉默的原因拟南芥受精后的胚乳[21].
基于在完全组装的Mo17基因组和参考B73基因组之间检测到的单核苷酸多态性(SNPs)的综合列表(release 5b.60),http://MaizeSequence.org),通过RNA-Seq分析,我们在发育0、3和5 DAP的玉米籽粒和7、10和15 DAP的胚乳中鉴定出290个印迹蛋白编码基因[22].这些阶段代表了胚乳作为吸收结构发挥核心作用的关键发育事件,包括早期细胞增殖、间室分化、淀粉和储存蛋白质的开始积累以及鲜重的迅速增加[5]、[23].印迹基因的基因本体论(GO)分析鉴定了10- dap特异性的MEGs,这些MEGs参与了由生长素信号通路介导的玉米胚乳营养吸收和分配[22].
在本研究中,为了鉴定印记siRNA并了解玉米早期胚乳中亲本siRNA表达的发育偏向性,我们使用与之前相同的材料进一步对六个发育阶段的siRNA转录组进行测序,并在3-和5-DAP杂交胚乳中观察到父本siRNA的早期转录激活,并在7-、10-和15-DAP杂交胚乳中鉴定出460个印记siRNA位点。我们的数据表明,与印迹基因相似,印迹siRNA位点的表达在胚乳发育过程中发生动态变化,大多数母系表达的siRNA位点(MESL)在10dap时唯一表达。此外,基于模拟分析,印迹siRNAs在玉米胚乳中与印迹基因表达的邻接性显著相关,sirna相关基因的GO分类显示,sinas可能在胚乳发育的关键事件中发挥作用。
结果
SiRNA转录组测序
我们对从玉米B73和Mo17互惠杂交中收获的12个siRNA样本进行了测序,包括籽粒(0、3和5dap)和胚乳(7、10和15dap)。平均而言,每个样本产生了1360万个适配器修饰的siRNA读取,长度从18到27个核苷酸(nt)不等。最丰富的三个类是24-、22-和21-nt siRNAs,分别约占总siRNAs的55.3%、13.4%和12.6%(附加文件1:图S1)。24-nt siRNAs内核样品表现出更高的比例(70.7% 0衣冠楚楚,68.1%在3 DAP和64.4%在5 DAP)与胚乳样本(7点DAP 36.6%, 50.1%在10 DAP和41.8% 15 DAP),而21 -的比例和22-nt siRNAs胚乳样本更高(37.4%在7 DAP, 26.7%在10 DAP和34.9% 15 DAP)与内核的样品(17.4% 0衣冠楚楚,18.0%在3 DAP和21.2% 5 DAP)(附加文件1:图S1)。将12个样本的siRNA测序结果定位到B73参考基因组(release 5.6b,http://MaizeSequence.org),只有完全匹配的读数被保留以作进一步分析。当一次读取最多允许10、100和1000个匹配位置时,大约37.6%的读取被唯一映射到B73基因组上,而58.8%、68.2%和74.0%的读取分别被映射到B73基因组上(附加文件)2:表S1)。
24-nt siRNAs的基因组和基因分布
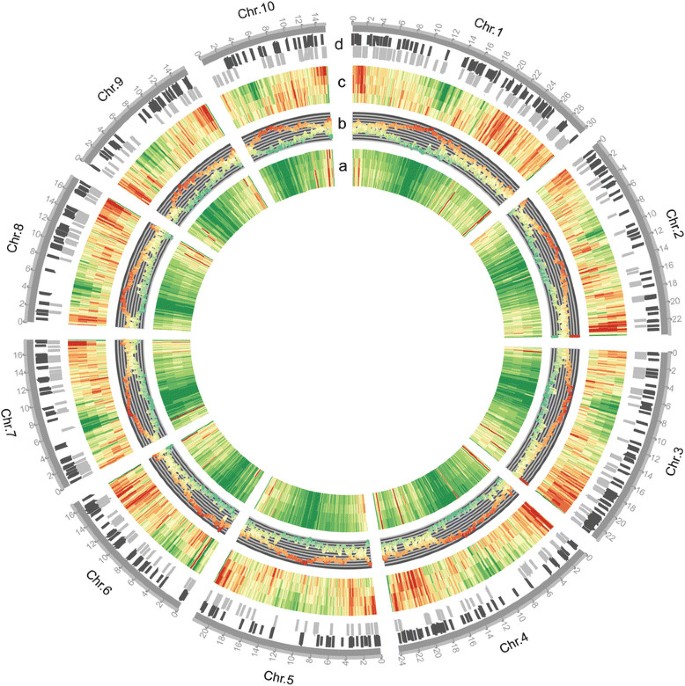
基于之前的方法,我们识别并分类了产生siRNAs的基因组位点[24]、[25](方法),这些siRNA位点被进一步定义为它们的优势siRNA种群,在一个位点上占总siRNA的50%以上。当只使用唯一映射的reads时,在所有10条染色体上鉴定出416,100个siRNA位点;当包括multi-reads时,共鉴定出644,496个、836,618个和931,924个siRNA位点,最大作图位置分别为10个、100个和1000个。染色体分布表明,siRNA位点优先富集在高密度基因区和染色体端区,而在重复丰富的中心粒周围和着丝粒区缺失(图1),这与在玉米笋中观察到的只有一小部分sirna产生于中心点周围区域和中心点区域相一致[26].为了包含更多信息并更好地反映原始siRNA情况,我们使用了931924个包含多个reads(≤1000个位点)的siRNA位点进行进一步分析,其中90%以上的siRNA位点主要产生24-nt sinas, 3%和1%的siRNA位点分别富集21-和22-nt sinas(附加文件)3.:表S2)。
玉米基因组中siRNA位点和印迹基因的染色体分布。Lane组a: siRNA染色体分布显示丰度。这四条通路通过在玉米基因组上从外到内分别≤10个、≤100个和≤1000个位置的完美映射siRNA,显示了玉米染色体上siRNA丰度的差异。它们优先富集在高密度基因区和染色体端区,而在重复丰富的中心粒周围和着丝粒区缺乏。红色:丰度高;黄色:中等丰度;绿色:低丰度。Lane b:通过repeat - mask软件识别的蛋白编码基因和重复序列的染色体分布,重复序列高度富集在着丝粒和端粒区域,与染色体上的基因密度呈负相关。红色:重复比例高;绿色:基因比例高;黄色:基因和重复序列的比例相对相等。 Lane group c: Chromosomal distributions of siRNA loci identified by using the reads uniquely mapped, mapped with ≤10, ≤100 and ≤1000 positions respectively, from outside to inside, and the trend is similar to the siRNA abundance distribution. Red: high density; Yellow: moderate density; Green: low density. Lane d: Chromosomal distributions of imprinted genes (light gray) and imprinted siRNA loci (dark gray) on maize genome, which were distributed on all 10 chromosomes.
为了统计评估21-、22-和24-nt siRNA位点与基因区、基因间区和重复区之间的相关性,我们比较了21-、22-和24-nt siRNA位点与三种基因组区域类型(Mehtods)相关的观察到的发生情况与模拟发生情况。21-nt siRNA位点与基因区高度相关(64.6%的观察位点对10.7%的模拟位点),与基因间区相关性较低(17.6%的观察位点对75.4%的模拟位点);22-nt siRNA位点与重复区域的关联程度相对较高(92%观察到的,72%模拟的),但与基因间区域的关联程度较低(3.8%观察到,17.6%模拟)。相比之下,24-nt siRNA位点在任何基因组区域内都没有明显的富集趋势(附加文件)4:表S3)。
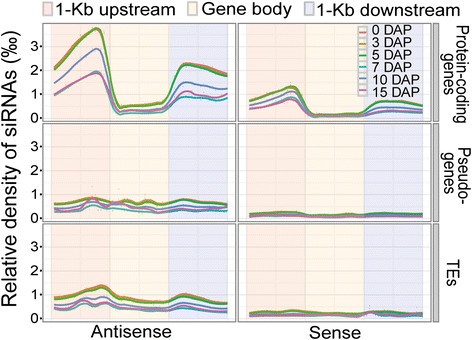
此外,我们通过沿着蛋白质编码基因、转座元件(TEs)和伪基因以及1-kb上游和1-kb下游区域绘制它们的相对密度,检查了24-nt siRNAs的详细分布。在密度计算过程中,多读对一个轨迹的贡献除以它的可映射位置数,以最小化潜在的偏差。有趣的是,24-nt siRNA的富集模式在不同的基因类别、基因区域、发育阶段和链中观察到不同(图2).首先,在1-kb的侧翼区域,蛋白编码基因的siRNA密度显著高于假基因和TEs,并且蛋白编码基因本身在1-kb侧翼区域的siRNA密度远大于基因体区域。其次,24-nt siRNAs在蛋白质编码基因的反义链上比在蛋白质编码基因的义链上更丰富。第三,籽粒中24-nt siRNAs的总体密度远大于胚乳,且10-DAP胚乳中的24-nt siRNAs的密度大于7- dap和15-DAP胚乳中的24-nt siRNAs(图)2).
24的基因分布-nt siRNAs。分别计算蛋白质编码基因、伪基因和TEs中0-、3-、5- dap核和7-、10-、15-DAP胚乳中5 ' 1-kb上游区域、基因体区域和3 ' 1-kb下游区域的24-nt siRNAs的相对密度。结果表明,24 nt-siRNAs在反义链的1 kb上游和下游区域高度富集,且在10-DAP胚乳中24 nt-siRNAs的密度远高于其他两个胚乳阶段。橙红色:5 ' 1-kb上游区域,橙色:基因体区域,蓝灰色:3 ' 1-kb下游区域。红色线:0-DAP胚乳,棕色线:3-DAP胚乳,绿色线:5-DAP胚乳,蓝色线:7-DAP胚乳,深蓝色:10-DAP胚乳,暗红色:15-DAP胚乳。
玉米籽粒和胚乳中父系sirna的激活
从精子继承的父亲基因组在双受精时以协调的方式启动。基于高通量测序结果和完整组装的Mo17和参考B73基因组比较的全面SNP信息[22],我们成功区分了超过140,000个siRNA位点的亲本来源,使我们能够研究玉米籽粒发育早期父本siRNA激活的过程。由于在组装的Mo17基因组中,由于reads不足导致的长间隙可能导致不可避免的偏倚,因此不考虑间隙大于自身长度5%的siRNA位点(剩余74,521个siRNA位点)。为了最大限度地减少模糊作图的影响,在未授粉的0-DAP粒或低表达水平(材料和方法)中去除含有父读的siRNA位点,并保留39,126个siRNA位点用于进一步分析。
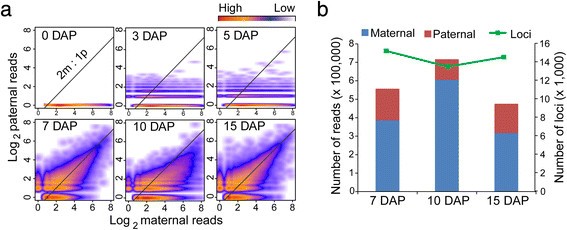
通过绘制剩余siRNA位点的父系和母系表达,我们观察到受精后3-和5-DAP粒中父系siRNA位点的表达数量和表达水平的增加,父系siRNA呈逐渐激活的模式(图3.A).从0到3个DAP和从3到5个DAP,分别有1,165个位点(3,112个父系sirna)和1,372个位点(3,956个父系sirna)被激活。siRNA激活位点比例相对较小,表达水平较低,很可能是由于母体组织比例较大所致。即便如此,我们仍然可以得出结论,父本siRNAs在玉米籽粒中启动的时间比以前报道的要早拟南芥在种子中,父端sirna保持沉默直到5dap [27].然而,与母方等位基因相比,这种在胚乳样品中鉴定出的siRNA基因座的99%以上也在籽粒样品中检测到,因此,这种以母方偏误为主的siRNA表达模式可能并不一定表明siRNA父方等位基因的激活延迟。
在7-DAP胚乳中,亲本siRNA达到了2 m:1p的正常剂量比,这意味着早期完整的父本siRNA位点激活和两个亲本基因组之间平衡的siRNA生物发生(图3.有趣的是,亲本siRNAs的比例与7-DAP胚乳中蛋白质编码基因的比例相同,与2 m:1p亲本基因组组成一致[22].与5-DAP胚乳中1372个父系激活位点(3956个父系reads)相比,7、10和15-DAP胚乳中分别发现15172个位点(171235个父系reads)、13381个位点(111678个父系reads)和14321个位点(159329个父系reads)3.b). 5-DAP胚乳和7-DAP胚乳的父本siRNA表达差异较大,这也支持了我们的推测,即父本等位基因很可能在胚乳中更早开始;而不是在2天内从父系基因组中突然爆发的siRNA,因为由于胚乳和胚胎周围的母体组织比例很高,这些等位基因几乎没有在籽粒中取样。在10-DAP胚乳中,我们观察到siRNA表达的总体母系偏倚偏离2 m:1p,与年的报告一致拟南芥在胚乳中,母体Pol iv依赖的siRNAs在4到6天内突然增加,随后在发育后期母体p4-siRNA表达水平降低甚至无法检测到[17].
siRNA印迹位点的动态表达
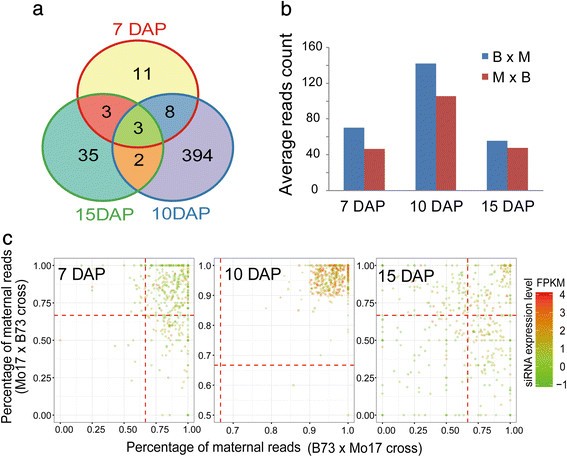
根据siRNA位点的亲本表达图,我们观察到一个siRNAs子集仅在母本表达或仅在父本表达(图2)3.A),这种siRNAs的偏性表达已经在水稻和水稻中报道过拟南芥[17]、[18].为了避免玉米籽粒中母体组织的影响,我们决定仅在7-、10-和15-DAP的纯胚乳中鉴定siRNA印迹位点。首先,使用两个标准预筛选一组约140,000个已识别的含有snp的siRNA位点:Mo17基因组上的位点不得包含长度≥5%的间隙,并且在0-DAP内核中不得映射父源性读本。然后,x2进行了测试,以检查在每个交叉中观察到的母系与父系衍生reads的比例是否显著偏离正常的2 m:1p比例。此外,我们采用了更严格的截断点来分别精确地定义MESL和父方表达的siRNA位点(PESL),即在这两个互交中,至少90%的母方读点或70%的父方读点从snp相关的总读点(至少20个读点)映射到一个位点。的显著性水平p= 0.01,在两个互反杂交中,2220个、2451个和2136个siRNA位点的亲本表达比均显著偏离2 m:1p,其中59个、1188个和110个位点分别在7、10和15 DAP表现出亲本表达模式。最后,根据reads计数截断值,在三个胚乳样本中保留了460个候选siRNA印迹位点,其中包括456个MESL和仅4个PESL。除了3个和13个位点分别在3期和2期同时印迹外,大多数MESL(456个中的444个)是分期特异性的,394个(88.7%)仅在10dap发生(图4a和附加文件5:表S5)。通过在7、10和15 DAP胚乳中使用含有snp的reads绘制所有印迹siRNA位点的母系和父系表达,我们发现10-DAP特异性MESL的表达水平在10 DAP时达到峰值,在7和15 DAP时下降,其亲本表达比也动态变化:在7-DAP时,这些MESL已经表现出母体偏倚的表达模式,其亲本表达率显著偏离预期的2 m:1p (χ2测试中,p≤0.01),但未通过比例临界值(90%)。后来,在10dap时,由于母系等位基因siRNA表达的升高,他们的母系偏向更加偏离,并满足我们的印记筛选标准;然而,这些MESL在15dap时变为双等位表达(图4因此,10-DAP特异性的MESL的瞬时印记状态可能归因于10 DAP与7和15 DAP相比动态变化的表达水平和亲本剂量比。
印迹基因可能受到相邻印迹siRNA位点的影响
10- dap特异性MESL的阶段依赖印迹模式让人联想到Xin等人报道的10- dap特异性MEGs的富集[22]使用同一组玉米胚乳样本。为了检验印迹基因的表达是否可能受到其相邻印迹siRNA位点的影响,我们专门检测了前三项研究中371个印迹基因2-kb侧翼区域内的印迹siRNA [22]、[28]、[29].在371个印迹基因中,357个与siRNA位点相关,其中298个含有snp的siRNA位点。共有166个印迹基因被进一步排除,因为它们所含的siRNA位点在Mo17基因组上的缺口大于其长度的5%,或在0 DAP时包含父本reads。在剩余的132个siRNA位点中,只有31个与29个印迹基因相邻的siRNA位点至少有20个siRNA reads,并被列入最终列表以确定其印迹状态。最后,29个印迹基因中的13个(13个父系表达基因(PEGs)和16个meg)包含严格定义的siRNA印迹位点,位于其2 kb的侧翼区域内。根据模拟分析,这部分(13/29)被认为是印迹基因和印迹siRNA位点的显著共现(图5a).具体来说,我们将相同数量的印迹基因随机放置在基因组上,并计算在其0.1、0.5-、1-、2-、5-和10-kb侧翼区域内有多少印迹siRNA位点。模拟进行了1000次,以生成成对印迹基因和印迹siRNA位点数量的一系列经验分布。分布表明,13个印迹基因和印迹siRNA位点共出现的几率显著高于模拟产生的预期数量,通过超几何分布检验检验(p= 2.122 × 10−6)(图5一个)。
在13对相关的印迹蛋白编码基因和印迹siRNA位点中,5对为MEGs和MESL, 1对为PEG和PESL,其余7对为PEG和MESL(图5b).最后7对可能很有趣,因为它们的亲本表达模式相反,因为来自母系的sirna可能参与了在基因中母系等位基因的表观遗传沉默独联体,导致其相邻印迹基因的父本等位基因特异性表达。例如,编码c2h2型锌指蛋白的PEG GRMZM2G139406在7-DAP胚乳中高表达,但在10 DAP时表达水平下降,在15 DAP时无法检测到,在三个阶段中具有相反的印迹状态的MESL(附加文件)6:图S2)。
在玉米胚乳发育过程中,SiRNAs可能参与养分的吸收和分配
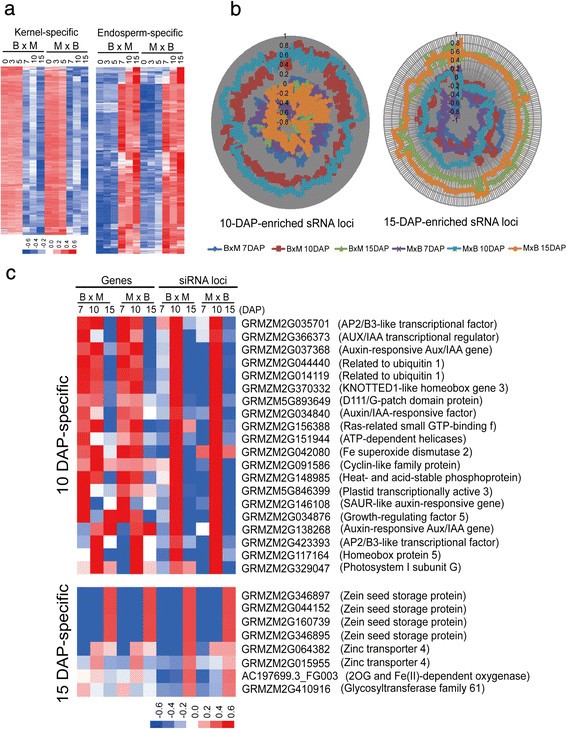
siRNA位点的基因组分布优先富集在高密度基因和染色体末端区域,与TEs和假基因相比,蛋白质编码基因侧翼的siRNA密度更高(图)1而且2).为了更好地理解siRNA在玉米籽粒和胚乳中的潜在功能,我们根据三个籽粒阶段(0,3,5dap)和三个胚乳阶段(7,10,15dap)平均siRNA丰度的5倍差异的截断值,将这些siRNA位点分为籽粒特异性和胚乳特异性。我们从12个样本的51,071个siRNA位点中鉴定出453个核特异性和729个胚乳特异性位点,这些位点包含至少1000个reads。这些siRNA位点的分级聚类显示,与内核相比,胚乳中的表达变化程度更高,这可能表明siRNA位点在发育中的胚乳中具有更动态的活性(图6a). Blast2GO分析显示,在其2-kb侧翼区域内含有胚乳特异性siRNA位点的316个基因主要富集在“通过酯交换反应进行RNA剪接”、“DNA重组”和“蛋白质-DNA复合物组装”术语(附加文件)7:表S4)。有趣的是,这些基因也富集在“端粒维持调控”类别中,与玉米染色体末端sirna的密集分布一致(图1).相比之下,含有核特异性siRNA位点的257个基因在“对细胞分裂素刺激的反应”和“对有机氮的反应”GO功能类别中显著富集(附加文件)7:表S4)。
10 .基因的功能富集-衣冠楚楚的-具体和15-衣冠楚楚的-特异性siRNA位点在2-KB侧翼区域。一个.核特异性和胚乳特异性siRNA位点的表达热图。基于3个核期(0,3,5dap)和3个胚乳期(7,10,15dap)平均siRNA丰度5倍差异的截止点,共鉴定出453个核特异性siRNA位点和729个胚乳特异性siRNA位点,12个样本中至少包含1000个reads,红色表示高表达水平,蓝色表示低表达水平。b.10- dap特异性和15- dap特异性siRNA位点在B73和Mo17互反杂交中的表达分析首先对7、10和15-DAP胚乳的siRNA丰度进行归一化,然后根据两种互交中不同胚乳发育阶段平均siRNA丰度的5倍差异进行聚类,在10- dap和15-DAP胚乳中分别鉴定出776和270个阶段富集的siRNA位点。c.在GO分析中,10-DAP和15-DAP热图特异性表达siRNA位点及其相关基因。蓝色(低)、红色(中)和红色(高)表示母系或父系等位基因的相对表达水平,“M”代表Mo17,“B”代表B73。DAP:授粉后的几天。
此外,我们使用与上述相同的标准,分别在7-、10-和15-DAP胚乳中鉴定了27、776和270个阶段富集的siRNA位点(图6b).总共有12,551和103个蛋白编码基因在其2-kb的侧翼区域分别含有这些相应的分期特异性siRNA位点。含有10- dap特异性siRNA位点的基因在“生长素刺激应答”、“油菜素类固醇刺激应答”和“基因表达调控”组中显著富集(图6C和附加文件7:表S4)。这一结果与我们之前在RNA-Seq数据中观察到的20个编码生长素反应因子(ARF)的基因在10dap时表达量升高,在15dap时表达量下降一致[22].这一结果也与10-DAP胚乳中IAA浓度突然升高的报道相吻合[30.],然后以大约15个DAP下降[31]、[32].
相比之下,含有15- dap特异性siRNA位点的基因在“营养库活性”、“蛋白质定位到液泡”和“次生代谢物生物合成过程”类别中富集,包括玉米醇溶蛋白存储蛋白家族的四个成员(附加文件)7:表S4)。有趣的是,这一结果与观察到的15dap是鲜重快速增加和玉米蛋白和淀粉生物合成的阶段相一致[23].尽管这些阶段特异性siRNA位点如何参与激素反应和养分积累的确切机制尚不清楚,但我们的数据表明,siRNA的表达可能与胚乳或胚仁发育所必需的特定细胞或生化过程相对应。
讨论
父系siRNA位点在玉米种子发育的早期阶段被激活
在被子植物中,种子受精后亲本mRNA和小RNA转录组的激活仍然不明确,尽管最近一些研究表明父本基因组的激活滞后于母本基因组[7] - [9]、[17]、[27].然而,其他研究表明,亲本基因组可能在受精卵的早期阶段发挥同样的作用[10] - [12].
在本研究中,这些数据使我们能够调查内源性siRNA的等位基因表达的动态,即在玉米种子发育过程中,亲本siRNA位点在3和5 DAP的表达时间和比例拟南芥在5 DAP之前的玉米籽粒中,siRNAs主要是母系主导的,[17]、[27].然而,我们的数据也表明,玉米籽粒中父系siRNA基因座的转录激活在受精后立即发生,这可以从3dap和5dap籽粒中父系siRNA读本的存在中得到证明(图2),表明玉米的持久胚乳和玉米的短暂胚乳对siRNA生物合成的调控可能存在差异拟南芥,其父sirna在前5dap期间基本保持沉默[17]、[18].由于在最初的几个DAP中,玉米的胚乳与胚相比发育迟缓和胚的比例较小[8],我们推测父端siRNAs的激活主要发生在胚乳5 DAP之前。此外,在这一发育阶段,基于2 m:1p的表达率,父本siRNA的激活可能至少在7个DAP后就完全实现了(图2),导致两个亲本基因组的siRNA景观平衡。5-DAP核(1372个位点,3956个reads)和7-DAP胚乳(15172个位点,171235个reads)父本siRNA表达的显著差异不太可能是由于父本siRNA等位基因在1 - 2天的短时间内被快速激活,而是由于内核中母体组织(如心皮和心心)的高比例大大降低了来自胚乳的父本siRNA的检测概率。这一激活过程可能是由父系基因组CHH甲基化的重编程所支持的,而父系基因组在受精前受到精子细胞低甲基化的影响[21]之后,在受精后的胚乳中,CHH甲基化状态与母体基因组相似[33].
此外,siRNA位点和蛋白质编码基因的父系等位基因激活模式相似,即在3- dap和5-DAP的籽粒中检测到它们的父系激活等位基因的读丰度都很低,然后在7-DAP的胚乳中达到正常的2 m:1p [22].然而,就其1-、2-和5-kb相邻区域而言,我们未能检测到父方激活的siRNA位点与蛋白编码基因之间的任何并发关系。这一结果可能是由于整个籽粒中胚乳和胚胎组织的小部分导致mRNA和siRNA转录组的覆盖不足,也可能是由于基因组位点上随机出现的父方等位基因的初始转录激活,因为B73和Mo17互反杂交中父方激活的等位基因显示了非常小的重叠部分[22].
印迹siRNAs的一个子集可能是印迹基因表达的潜在原因
由于24-nt siRNAs在rna定向DNA甲基化(RdDM)途径中起着至关重要的作用,发育中的玉米胚乳中siRNA表达的动态变化可能反映了RdDM途径在7 DAP前后在玉米胚乳中的不同活性,这与之前的报道一致拟南芥RdDM成分在胚乳发育早期表达量相当低,在胚乳发育后期则大幅增加至较高水平[34].因此,我们假设受精时立即激活的父端siRNAs [21],在胚乳中7dap前的某个时间点逐渐达到平衡的亲本表达量,然后调用新创甲基化由RdDM成分共表达辅助。这一结果可能解释了为什么在整个CHH甲基化水平之间的母本和父本等位基因几乎相同拟南芥胚乳(33].
siRNA印迹位点可能有助于亲本特异性DMRs的形成,这是导致邻近基因印迹表达的主要机制之一[14] - [16].到目前为止,已经有几行证据表明siRNAs在基因组印迹中的重要作用。首先,母性表达署而且MOP9.5涉及siRNAs,通过RdDM途径沉默父本等位基因在受精后拟南芥胚乳(20.].其次,对megg周围12个转座元件的研究表明,24-nt sirna靶向这些megg 2-kb侧翼区域内的父系等位基因,导致父系特异性CHH高甲基化和相应的父系特异性沉默[21].第三,31个siRNA印迹位点中有4个在水稻DMRs中富集,并与7 ~ 8-DAP水稻胚乳中的已知印迹基因重叠Nipponbare而且Kitaake具有相反印迹状态的互交[18].我们对玉米印记siRNA位点与印记基因之间的关联概率进行了检查,根据观察到的和模拟的共现可能性的比较,印记siRNA位点很可能与印记基因位置相关(图5).此外,13对印迹基因和印迹siRNA位点中有7对来自相反的亲本等位基因,这表明印迹siRNA可能在招募等位基因特异性方面发挥作用新创甲基化使相应的等位基因沉默。然而,我们也发现了来自同一亲本等位基因的6对印迹基因和印迹siRNA位点。一种可能的解释是,除了sirna介导外,可能还有其他机制参与这些印迹基因的调控新创甲基化。例如,父亲表达的PHE1在拟南芥是由于父系等位基因下游串联重复序列的高甲基化,这阻止了Polycomb repression Complex 2 (PRC2)与父系PHE1形成沉默的H3K27me3组蛋白修饰[35]、[36].
玉米胚乳发育过程中亲本siRNA的动态表达与关键生物学事件相关
siRNA位点的亲本表达在10-DAP胚乳中表现出母本偏向,偏离了7 DAP和15 DAP时2 m:1p的正常比例(图3.a).相应的,由于与7和15 DAP相比,母体siRNA表达水平升高,89%的印迹siRNA位点表现出强的母体表达特异性于10-DAP阶段(图4C).这个结果与之前的报告一致拟南芥某些类别的p4-siRNAs的母体等位基因表达在4-6 DAP达到峰值,然后在后期逐渐下降到降低甚至无法检测到的水平[17].然而,p4-siRNAs在胚乳中的生物学功能仍然不明确,因为即使是突变体nrpd1,含有调节大多数siRNAs生物合成的PolIV的最大亚基突变,未显示出明显的形态缺陷拟南芥.
然而,对其2-kb侧翼区域内含有siRNA位点的基因的GO分析表明,siRNA的生物发生可能与胚乳的关键发育事件密切相关。总的来说,携带相邻siRNA位点的基因的GO项表明,siRNA很可能不仅在转录水平上影响胚乳发育,而且在转录后水平上影响胚乳发育。此外,富含10-DAP胚乳的siRNA位点表现出强烈的母系偏表达,特别引起了我们的注意,因为10-DAP是一个重要的阶段,与玉米胚乳中生长素积累的快速增加以及淀粉和特定玉米蛋白生物合成的开始相吻合[23]、[30.].此外,玉米突变德* - - - - - -的energisk B18(有缺陷的胚乳-的energisk B18),生长素水平降低,种子干物质积累减少[37].有趣的是,10- da特异性sirna相关基因在“对生长素刺激的反应”类别中显著富集,其GO术语中还包括“对油菜素内酯(BRs)刺激的反应”,这让人想起它们在种子发育中的潜在功能,即BRs调节从源到库的养分同化,缺乏或不敏感的BR突变体在水稻中产生小粒种子[38] - [41].因此,尽管确切的分子机制尚不清楚,但我们的研究结果表明,siRNA位点的动态活性可能在胚乳发育过程中对养分的吸收和分配起着至关重要的作用。
结论
SRNAs可能在玉米胚乳基因组稳定性的维持中起着至关重要的作用,对siRNA相关基因的GO项分析表明,它们也参与了养分吸收和储存的调节。对亲本siRNA表达的系统分析表明,有一部分siRNA以亲本起源方式受到等位基因特异性表达的影响,这种印迹表达在玉米胚乳发育过程中表现出动态模式。此外,通过关联分析,sRNAs的印迹表达可能是基因印迹的原因之一。
方法
植物材料
以玉米B73和Mo17自交系为材料,在温室条件下进行自交系培养。进行了互交和自花授粉。首先,在蚕丝长出之前,先把耳朵装袋。然后,当丝绸长到大约2到3厘米时,穗从顶部2厘米处剪掉,并将流苏装袋。第二天用相应的花粉进行授粉。收获B73和Mo17在3、5、7、10和15 DAP未授粉的籽粒(0-DAP)和互交杂交的籽粒。人工分离7、10、15-DAP胚乳组织。从三个不同的穗上收获胚乳和籽粒,作为三个生物重复,并立即在液氮中冷冻。
小RNA文库构建及测序
根据制造商的说明,使用TRIzol试剂从36组(12个样品× 3个重复)植物材料中分离总RNA。RNA样本被送到位于深圳的北京华大基因研究所(BGI)分离出小RNA。在文库构建之前,使用安捷伦2100生物分析仪检测36个总RNA样本的RNA质量。每个样本的三个生物重复都是高质量的,因此使用华大基因的标准方案组合起来构建小RNA文库。使用Illumina Solexa对带有连接接头的小RNA样本进行测序,生成36 nt单端reads。适配器被华大基因从36 nt读取中删减。整个Solexa序列已存入GenBank,编号为GSE52726http://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE52726.
24-nt siRNAs的基因分布
首先,将基因体及其上游和下游的1-kb区域分别划分为20个大小相等的bin。然后,将完美映射到基因区域每个bin的siRNAs分别计数为正义链和反义链。最后,为了绘制24个nt-siRNA在基因体及其上游和下游区域的相对密度,它们在每个bin中的比例由沿着所有三个区域的映射reads总数归一化,然后分别用蛋白质编码基因、假基因或te的数量平均24个nt-siRNA密度。
模拟分析如下:分别使用BEDTool中的ShuffleBed程序将观察到的相同数量的21-nt、22-nt和24-nt siRNA位点随机放置到玉米基因组中,并统计这些siRNA位点在基因区、基因间区和重复区定位的次数。该模拟分析进行1000次,得到一系列的经验分布,并据此计算siRNA与基因组区域之间的统计学显著性。
siRNA位点鉴定及siRNA表达量计算
我们使用先前描述的方法来定义siRNA位点。首先,Bowtie1将来自12个小RNA样本的组合reads一起映射到B73参考基因组中,仅使用完全匹配的reads来识别siRNA位点。然后,将重叠的reads合并,形成至少包含三个reads的siRNA“岛”。最后,将100 bp内的相邻岛屿进一步合并为一个siRNA位点。为了尽量减少模糊映射的伪影,我们只保留至少两个文库中超过三个reads的siRNA位点。在计算一个位点的siRNA表达水平时,将一个多重映射的read对一个位点的贡献除以该read的映射位置数。
附加文件
缩写
- 核:
-
小干扰RNA
- 衣冠楚楚的:
-
授粉后几天
- 2 m:
-
1个孩子:2个母亲vs. 1个父亲
- dmr:
-
甲基化差异区
- 署:
-
抑制drm1 drm2 drm3
- m:
-
母系表达基因
- 挂钩:
-
父系表达基因
- 走:
-
基因本体论
- MESL:
-
母系表达的siRNA位点
- nt:
-
核苷酸
- te:
-
转座的元素
- PESL:
-
父系表达的siRNA位点
参考文献
- 1.
Yadegari R, Drews GN:雌性配子体发育。植物学报,2004,16(增刊):S133-S141。
- 2.
Berger F, Grini PE, Schnittger A:胚乳:种子生长发育的整合器。中国植物学报,2006,29(4):344 - 344。
- 3.
近距离的家庭生活:被子植物种子发育中的交流和限制。中国生物工程学报,2010,27(3):344 - 344。
- 4.
Li J, Berger F:胚乳:人类的食物和科学发现的饲料。中国生物工程学报,2012,29(3):344 - 344。
- 5.
Lopes MA, Larkins BA:胚乳的起源,发育和功能。中国生物医学工程学报,2003,23(4):457 - 457。
- 6.
Ray A: Three的公司:种子开发期间的监管对谈。植物科学学报,1997,9:665-667。
- 7.
Autran D, Baroux C, Raissig MT, Lenormand T, Wittig M, Grob S, Steimer A, Barann M, Klostermeier UC, Leblanc O, Vielle-Calzada JP, Rosenstiel P, Grimaneli D, Grossniklaus U:母本表观遗传途径控制亲本对拟南芥早期胚胎发生的贡献。电子学报,2011,34(3):344 - 344。
- 8.
王晓明,王晓明,王晓明,王晓明。玉米种子发育过程中母本向合子转化的时间研究。植物学报,2005,17:1061-1072。
- 9.
Vielle-Calzada JP, Baskar R, Grossniklaus U:种子发育过程中父本基因组的延迟激活。自然科学,2000,42(4):344 - 344。
- 10.
Meyer S, Scholten S:对等亲本对植物早期合子发育的贡献。中国生物工程学报,2007,17:1686-1691。
- 11.
nodinmd, Bartel DP:母体和父系基因组对早期植物胚胎转录组的贡献相同。自然科学进展,2012,29(4):344 - 344。
- 12.
王晓明,王晓明,王晓明,王晓明,王晓明。拟南芥种子发育的早期父本基因活性研究。自然科学,2001,414:709-710。
- 13.
池田Y:通过全基因组方法鉴定的植物印迹基因及其调控机制。中国生物医学工程学报,2012,29(3):344 - 344。
- 14.
Gehring M:基因组印记:植物亲代经验。中国农业科学,2013,29(3):344 - 344。
- 15.
黑格D:种子发展中的亲属冲突:一个相互依赖但难以控制的集体。中国生物医学工程学报,2013,29(4):379 - 379。
- 16.
姜浩,柯勒C:植物种子发育过程中基因组印记的进化、功能和调控。应用物理学报,2012,29(3):344 - 344。
- 17.
Mosher RA, Melnyk CW, Kelly KA, Dunn RM, Studholme DJ, Baulcombe DC:拟南芥发育胚乳中poliv依赖性siRNAs的单亲本表达。自然科学学报,2009,29(3):344 - 344。
- 18.
Rodrigues JA, Ruan R, Nishimura T, Sharma MK, Sharma R, Ronald PC, Fischer RL, Zilberman D:水稻胚乳中基因和小RNA的印迹表达与母端基因组局部低甲基化有关。自然科学进展,2013,29(3):344 - 344。
- 19.
陆娟,张长青,Baulcombe DC,陈志军:拟南芥种子胚乳中母源sirna对亲本基因组失衡和基因表达的调节作用。自然科学进展,2012,29(3):357 - 357。
- 20.
Vu TM, Nakamura M, Calarco JP, Susaki D, Lim PQ, Kinoshita T, Higashiyama T, Martienssen RA, Berger F: rna定向DNA甲基化调控拟南芥亲本基因组印记的几个位点。科学进展,2013,30(4):344 - 344。
- 21.
Calarco JP, Borges F, Donoghue MT, Van Ex F, Jullien PE, Lopes T, Gardner R, Berger F, Feijo JA, Becker JD, Martienssen RA:花粉DNA甲基化重编程通过小RNA引导表观遗传。生物技术学报,2012,29(3):344 - 344。
- 22.
李鑫M,杨R, G,陈H,劳里J,马C, D,姚明Y,拉金斯英航,太阳Q, Yadegari R,王X, Z倪:印迹基因的动态表达与母亲般地associates控制养分分配在玉米胚乳发育。中国生物医学工程学报,2013,26(3):344 - 344。
- 23.
Sabelli PA, Larkins BA:草类胚乳的发育。植物科学进展,2009,29(4):344 - 344。
- 24.
Groszmann M, Greaves IK, Albertyn ZI, Scofield GN, Peacock WJ, Dennis ES:拟南芥杂种24-nt siRNA水平的变化提示杂种活力的表观遗传贡献。自然科学进展,2011,29(3):344 - 344。
- 25.
Johnson C, Kasprzewska A, Tennessen K, Fernandes J, Nan GL, Walbot V, Sundaresan V, Vance V, Bowman LH:水稻发育花序中阶段性小rna的簇和超簇。中国生物医学工程学报,2009,29(4):344 - 344。
- 26.
Regulski M, Lu Z, Kendall J, Donoghue MT, Reinders J, Llaca V, Deschamps S, Smith A, Levy D, McCombie WR, Tingey S, Rafalski A, Hicks J, Ware D, Martienssen R:玉米甲基化组影响mRNA剪接位点,并揭示了由小RNA引导的广泛的参数突变样开关。中国生物工程学报,2013,29(3):344 - 344。
- 27.
Mosher RA, Melnyk CW: sirna和DNA甲基化:肮脏的表观遗传学。植物科学进展,2010,15:204-210。
- 28.
Waters AJ, Makarevitch I, Eichten SR, swson - wagner RA, Yeh CT, Xu WN, Schnable PS, Vaughn MW, Gehring M,施普林格NM:玉米胚乳基因表达和DNA甲基化的亲本效应。中国生物医学工程学报,2011,23:4221- 433。
- 29.
张明明,赵辉,谢松,陈娟,徐勇,王凯,赵辉,关辉,胡霞,焦勇,宋伟,赖俊:玉米胚乳发育过程中蛋白质编码和非编码rna的广泛聚集亲本印迹。自然科学进展,2011,29(3):344 - 344。
- 30.
Lur HS, Setter TL:生长素在玉米胚乳发育中的作用(核DNA核内复制、玉米蛋白表达和细胞分裂素的时间)。中国农业科学,2003,23(4):457 - 457。
- 31.
Torti G, Manzocchi L, Salamini F:玉米缺陷型胚乳中游离结合吲哚乙酸含量较低。应用理论与实践,2004,27(3):366 - 366。
- 32.
Shirzadi R, Andersen ED, Bjerkan KN, Gloeckle BM, Heese M, Ungru A, Winge P, Koncz C, Aalen RB, Schnittger A, Grini PE:无父系贡献的胚乳全基因组转录谱鉴定agamus - like36的亲本依赖性调控。公共科学学报,2011,7 (2):e1001303-
- 33.
Ibarra CA, Feng X, Schoft VK, Hsieh TF, Uzawa R, Rodrigues JA, Zemach A, Chumak N, Machlicova A, Nishimura T, Rojas D, Fischer R, Tamaru H, Ziberman D:植物伴生细胞中活性DNA去甲基化增强配子转座子甲基化。科学通报,2012,37(3):359 - 364。
- 34.
Belmonte MF, Kirkbride RC, Stone SL, Pelletier JM, Bui AQ, Yeung EC, Hashimoto M, Fei J, Harada CM, Munoz MD, Le B, Drews G, Brady S, Goldberg R, Harada J:拟南芥种子区域和亚区域基因活性的综合发育谱。中国科学:自然科学,2013,29(2):344 - 344。
- 35.
刘志刚,刘志刚,刘志刚,刘志刚。拟南芥PHERES1基因印迹的直接串联重复序列控制。植物学报,2009,2:654-660。
- 36.
马志刚,刘志刚,王晓明,王晓明,等。拟南芥PHERES1基因印迹的研究进展。中国生物医学工程学报,2008,29(4):457 - 457。
- 37.
Forestan C、Meda S、Varotto S: zmpin1介导的生长素转运与玉米胚胎发生和胚乳发育过程中的细胞分化有关。中国生物医学工程学报,2010,29(3):344 - 344。
- 38.
Hong Z, Ueguchi-Tanaka M, Fujioka S, Takatsuto S, Yoshida S, Hasegawa Y, Ashikari M, Kitano H, Matsuoka M:水稻油菜素类固醇缺乏的dwarf2突变体,在拟南芥的水稻同源体中缺陷,被内源性积累的替代生物活性油菜素类固醇酮拯救。植物学报,2005,27(3):344 - 344。
- 39.
Morinaka Y, Sakamoto T, Inukai Y, Agetsuma M, Kitano H, Ashikari M, Matsuoka M:油菜素类固醇不敏感引起的形态改变增加了水稻生物量和籽粒产量。植物科学学报,2006,29(4):344 - 344。
- 40.
Tanabe S, Ashikari M, Fujioka S, Takatsuto S, Yoshida S, Yano M, Yoshimura A, Kitano H, Matsuoka M, Fujisawa Y, Kato H, Iwasaki Y:通过对水稻矮秆突变体dwarf11的表征,一种新的细胞色素P450与油菜素类固醇的生物合成有关。中国生物医学工程学报,2005,17:776-790。
- 41.
Wu CY, Trieu A, Radhakrishnan P, Kwok SF, Harris S, Zhang K, Wang J, Wan J, Zhai H, Takatsuto S, Matsumoto S, Fujioka S, Feldmann K, Pennell R:油菜素内酯调控水稻籽粒灌浆。植物科学学报,2008,30(4):344 - 344。
确认
国家重点科学计划项目(2012CB910900)、国家自然科学基金项目(30925023、31230054)、中国高校科学基金项目(15054038)资助。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
ZN, XW, QS设计了这个项目。MX,收集植物材料。MX、RY、YY、HP、MC进行数据分析。MX XW和NZ。写了手稿。所有作者阅读并批准最终稿。
电子辅助材料
12870 _2014_192_moesm4_esm.xlsx
附加文件4:表S3。:Differential distribution of 21-, 22- and 24-mer clusters in gene loci, repeats and intergenic regions. (XLSX 9 KB)
12870 _2014_192_moesm6_esm.pdf
附加文件6:图S2.;:Parent-of-origin expression patterns of GRMZM2G139406 and its harboring MESL, Mega21192.9. (PDF 565 KB)
12870 _2014_192_moesm7_esm.xlsx
附加文件7:表S4。:GO category enrichments of kernel-specific siRNA-associated genes, endosperm-specific siRNA-associated genes and 10- and 15-DAP specific siRNA-associated genes. (XLSX 18 KB)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。
本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。
如欲查看本牌照的副本,请浏览https://creativecommons.org/licenses/by/4.0/.
创作共用公共领域奉献弃权书(https://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
辛,M,杨,R,姚,Y。et al。发育中的玉米胚乳中小干扰RNA表达的动态亲本效应。BMC植物生物学14,192(2014)。https://doi.org/10.1186/s12870-014-0192-8
收到了:
接受:
发表:
关键字
- 核
- 印记
- 玉米
- 胚乳
- GSE52726