摘要
背景
的萼片、花瓣和雄蕊拟南芥鲜花分离通过在其边界上形成的脱落区与底层容器。不对称的叶子1(AS1)MYB转录因子在设定新形成的叶片原基与拍摄分生之间的边界中起着关键作用。通过压制一组的表达KNOTTED1样同源盒(诺克斯)基因,AS1和它的伙伴不对称LEAVES2允许模式和分化的叶片继续进行。在这里,我们展示了AS1在建立萼片和花瓣脱落区位置中的独特作用拟南芥花。
结果
在AS1在变异花中,萼片脱落带移位成倒V形位置,在器官脱落时留下三角形的组织残根。花瓣脱落带的移动也很明显。在变异花中,内侧萼片的脱落延迟AS1花卉;Supescing Sepals中叶绿素的丧失与保持绿色的近端区域形成鲜明对比。AS1先前已被证明限制了表达式诺克斯基因,短花梗菌(BP),从萼片。我们在这里展示在BP的活性的丧失AS1鲜花足以恢复萼片和花瓣脱落区域的位置,内侧萼片的萼片 - 插座边界和它们脱落的时间。
结论
我们的结果表明,AS1活动对于适当放置花器官脱落区的适当安置至关重要,并影响器官脱落的时机。
背景
器官脱落的过程允许植物在其生命周期的特定点或对环境提示的特定点分离叶子,花器器官,水果和种子。遗传分析拟南芥揭示激活花器官脱落的细胞分离阶段的因素特别高效[1],[2].较少是关于控制外部花器器官和底层容器之间的边界处的脱落区分化的调节电路3.],[4.].
调节横向器官和/或器官间界限的几个基因也影响花器官脱落。转录激活剂叶片甲板(BOP1)和BOP2冗余地控制显影叶片和花动器官的近端区域的图案化[5.]-[7.].不能检测到脱落区分化的解剖证据bop1 bop2鲜花和萼片,花瓣和雄蕊仍然坚持[8.].贝尔型同型肿瘤转录因子,拟南芥骆驼属Homeobox Gene1(Ath1),抑制将成为花器官容器边界的地区的生长,并且是雄蕊脱落区形成所需的[9.].夏威夷裙(HWS)是F箱蛋白,可防止相邻萼片的融合,并影响其脱落的时间[10.].
五个突变等位基因不对称LEAVES1(AS1),在横向器官中极性和细胞命运的关键决定因素[11.,通过筛选花器官脱落突变体[12.](附加文件1:表S1)。AS1,一个MYB转录因子,作用于与AS2 LATERAL器官边界域(LBD)的转录因子的一组的再加压表达结合分生组织促进KNOTTED1样同源盒(诺克斯)的基因[13.]-[15.].所述BREVIPEDICELLUS(BP,也称为KNAT1)的异位活性,KNAT2和KNAT6同源结构域转录因子已被遗传连锁的尺寸减小,更短叶柄和弄绉的外观AS1突变叶[13.],[16.].AS1-AS2阻遏物复合体重新募集Polycomb-抑制复合物的组分2给启动子BP.和诀窍2,在叶细胞中建立无活性染色质状态[17.]-[19.].
AS1还限制了表达BP.和诀窍2发育中的花原基[13.].BP.在花梗,容器和野生型花的器官边界中表达,同时诀窍2主要限制在花器官的边界和插座[13.],[20.]-[22.].在AS1突变花,过早开放,由于其较小的萼片和花瓣,表达BP.和诀窍2扩展到萼片中[13.],[23.].遗传分析已经表明,BP,KNAT2和KNAT6活性的组合损耗足以拯救减小器官大小和的开放缺陷芽AS1突变花朵[16.].
BP指示容器的生长,Peedel的扩展区域[20.].英国石油公司由于容器和减少的细胞分裂的径向收缩,鲜花具有细长的缩写的花梗[20.],[23.],[24.].由于在花梗的轴向侧增加了收缩,英国石油公司花梗弯曲而不是指向[20.].BP还在花器官脱落期间起作用,以防止过早脱落并抑制脱落区细胞的膨胀[21.],[25.].脱落区域英国石油公司花明显增大,与具有结构表达的花相似脱落缺乏花序(艾达)[26.].通过HAESA (HAE)和HAESA- like2受体样激酶的IDA肽信号已经被提出通过抑制BP活性来激活器官脱落[25.],[27.],[28.].
在这里,我们表明AS1控制着植物中萼片和花瓣器官脱落区的位置拟南芥花。的内侧萼片AS1突变花受到的影响最大:延迟器官脱落发生在三角形近端结构域的边缘,具有改变的身份。我们进一步表明,BP活性的丧失足以挽救与器官脱落相关的缺陷AS1突变的花朵。
方法
植物
五AS1(原名比伯)先前通过用于器官脱落突变体的遗传筛查突变体[12.](附加文件1:表S1);所有突变体都是土地erecta.(左呃)生态型:两种植物杂交的F1后代AS1-21和AS1-20突变体显示出脱落缺陷,与突变之间的等位基因关系一致。as1-1(左呃;CS146)和BP-1(左呃;CS30)种子是从Abrc(哥伦布,OH)获得的。植物纯合AS1-20与盖子(切割扩增的多晶序列)区分[29.]基于野生型等位基因中存在的BCCI位点的标记AS1.寡核苷酸用于放大该区域AS1基因在附加文件中描述2:表S2。植物在21℃下以50%湿度和16小时的光周期生长。
显微镜和标记分析
野生型和突变型花如前所述固定[30.,并准备扫描电子显微镜使用Tousimis samdri790临界点烘干机(Tousimis, Rockville, MD)和EMS 550溅镀镀膜机配备薄膜厚度监视器(EMS, Hatfield, PA)。样品在FEI XL-30扫描电子显微镜(FEI, Hillsboro, OR)中使用10 kV加速电压进行检测。解剖幼嫩花(8-12期)并重新成像以确定其发育阶段[31.].
转基因有:格斯线 [32.]越过了AS1-20和as1-20 BP-1突变体产生携带该脱落区标记物的单一和双突变体。对于β-葡糖醛酸酶测定,如上所述固定并染色野生型和突变花朵并染色[33.]微小修改。数字图像用一个STEMI SV11解剖显微镜和Axiocam HR相机(卡尔蔡司,德国),也可以是PowerShot SX160 IS(佳能,梅尔维尔,NY)。图像亮度和对比度用Photoshop CS6(Adobe公司,山景,CA)进行了调整。离区位移使用NIH ImageJ的[测定34.].
分子生物学
基因组DNA样品由野生型(Ler)和两个独立的AS1-21突变植物使用DNeasy植物迷你试剂盒(Qiagen, Venlo,荷兰)。地区的AS1如附加文件所述,对基因进行PCR扩增2:表S2。使用Zymoclean凝胶DNA回收试剂盒(Irvine,Ca)和测序(Macrogenusa,Rockville,MD)纯化PCR产物。使用佐埃利R6.1软件(BioMatters,奥克兰,NZ)分析序列。
结果
ASMYB结构域新突变的鉴定
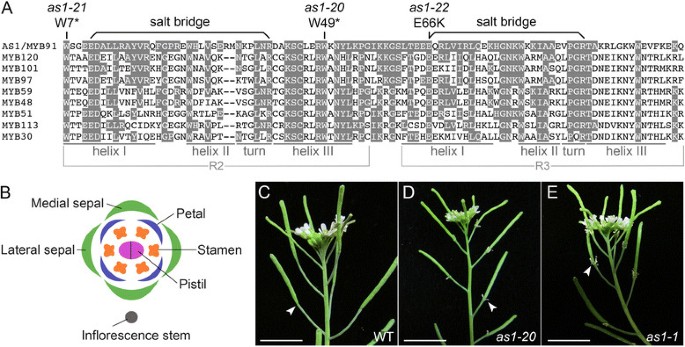
AS1是126个蛋白之一拟南芥具有由R2和R3重复序列组成的MYB域[35.],[36.].每个重复包括三个螺旋,其中,所述第二和第三形式的螺旋 - 转角 - 螺旋基序的结合DNA(图1A).描述…的作用AS1在器官脱落中,我们选择AS1-20(原名bibb-1)[12.]及as1-1[11.],[23.],[37.]作为参考等位基因(附加文件1:表S1)。对于相关的无义突变AS1-20位于AS1 R2重复序列的第三个螺旋(图1(A)[12.].这AS1-21突变体(以前称为bibb-2),发现在AS1 R2重复序列的第一个螺旋中引入无义突变(图1一种)。
突变AS1延缓萼片脱落。一种:AS1和相关基因的DNA结合域的序列比对拟南芥R2R3 MYB蛋白。保守的氨基酸残基用阴影表示。的对酸性谷氨酸(E)和碱性精氨酸(R)残基,在R 2和R 3的重复形式的盐桥是由条连结。三个位置AS1提示改变器官脱落的突变。这AS1-20(本研究的参考等位基因)和AS1-21突变引入止挡密码子代替指定色氨酸的密码子。这AS1-22突变用赖氨酸取代保守的谷氨酸;受影响的残余物是在R3重复AS1中形成的盐桥的一体部分。B.:野生型花的图,说明内侧和横向萼片相对于花序茎的取向。C:野生型花序。花脱落其外部器官(阶段16),留下发育中的果实。比例尺1°厘米。D / E:AS1-20(d)和as1-1(e)变异花序。突变花通常保留其内侧萼片,直到果实完全伸长(阶段17)。规模的酒吧、1°厘米。
AS1-22突变破坏了DNA结合结构域中的盐桥
在真核生物R2R3 MYB蛋白的每个重复序列中,第一个螺旋中的酸性氨基酸残基与第三个螺旋附近的碱性氨基酸残基形成盐桥[38.] (数字1一种)。在R2R3 MYB蛋白中形成盐桥的谷氨酸和精氨酸残基被保守超过97%拟南芥受调查的家庭成员[35.] (数字1A) 。的AS1引入点突变的等位基因[12.],[37.],AS1-22(原名bibb-5)[12.]表示确定的日期是唯一错义突变。受影响的谷氨酸与赖氨酸,碱性残基,将防止在as1-22突变蛋白的R3重复盐桥形成的替换(图1一种)。在C-MYB转录因子R3重复的相应谷氨酸内的丙氨酸取代废除了DNA结合和转录活化[38.].
asdelay脱落的内侧萼片的突变
拟南芥花有一对内侧和侧面的萼片,四个花瓣和六个雄蕊,受精后不久脱落(阶段16)(图1B, C) [31.].在每一个AS1已知的改变器官脱落的突变体(图1d,e;附加文件1:表S1;附加文件3.:图S1),内侧萼片的脱落直至水果完全伸长后(早期17级)。什么时候AS1在正常的脱落期间触摸鲜花(第16阶段),内侧萼片保持牢固连接。30.as1-1在接触后调查的花(早期到中期),80%(48/60)的内侧萼片保持依赖于10%(0/20),用于10个野生型花朵。侧向萼片的脱落也延迟了一些AS1-21那AS1-22和AS1-23鲜花(附加文件3.:图S1B,E)。
花的萼片和花瓣脱落带移位
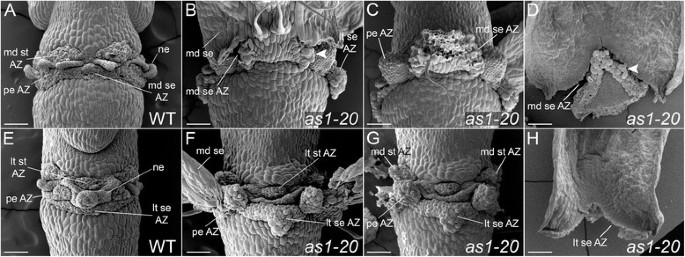
在脱落后(第17阶段),野生型花器官脱落带的位置可以很容易地看到(图2A,E;数字3.A,E)。保持植物体的脱落区细胞的离散结构域以植物和雄蕊存在,以及包围容器的萼片脱落区细胞。萼片脱落区的放置被改变AS1鲜花(17)阶段。脱落带不是在萼片基部发育,通常在近端形成倒v形AS1内侧和横向萼片(图2罪犯,F-H;数字3.B;附加文件3.:图S1)。当萼片脱落时,三角形的组织区域仍然附着在基部AS1花(图2D,F,H;数字3.C、F, G;附加文件3.:图S1F)。内侧萼片脱落区的位移(图2D;数字3.B-D)相对于外侧萼片脱落区更明显(图2F;数字3.F-H)的距离位置AS1-20内侧脱落区是从基萼片±279为15μm(N = 5),相对于133±13微米(N = 4),用于AS1-20横向脱落区域。在as1-1鲜花,内侧萼片脱落区移位268±34μm(n = 7),而侧脱落区的107±11μm(n = 6)相比。
萼片和花瓣脱落区的位置被改变AS1突变的花朵。野生型和突变型花(17期)的扫描电镜图。内侧(广告)和横向(E-H)显示视图。A / E:外器官在野生型花中脱落后,萼片(SE)脱落区(AZ)看起来作为与花梗相邻的连续环。可以区分个体花瓣(PE)和雄蕊(ST)AZ区域。剩余的Az细胞具有圆形外观。植物(Ne)组织夹在雄蕊和花瓣AZ之间。B.:内侧萼片延迟脱落AS1花。细胞分离首先发生在倒v形区域的近端边缘。在萼片AZ细胞中,细胞扩张很明显,与此区域相关(见箭头)。C:呈现花液(b)移除了内侧萼片。在花瓣附着位点处可见组织的短截线。D.:一个内心的视图AS1内侧萼片。倒V形AZ内的细胞扩张是显而易见的(参见箭头)。F:圆形细胞存在于花瓣附着部位的短节的顶端。三角形的组织区域出现在外侧(lt)萼片附着部位。G:呈现花液(F)内侧萼片被摘除。侧雄蕊AZs的定位AS1花没有明显的改变;内侧雄蕊AZs出现轻微移位。H:一个内心的视图AS1侧萼片(第16期)。存在一个倒v形的AZ。秤条,100μm。
突变AS1改变内侧萼片的近端区域。内侧(广告,I-L)和横向(E-H)野生型和AS1突变花朵(第17阶段)。A / E:野生型花。罪犯:脱离内侧萼片的脱离AS1-20(b)和as1-1(C)鲜花通常发生在倒V形脱落区(AZ)。近距离区域的三角形区域(PZ)组织仍然没有参与。在某些人AS1花(d),萼片的侧面沿着较大近端区域(PDZ)的边缘保持绿色。F-H:脱落的侧萼片和花瓣AS1-20(F / G)和as1-1(H)花的叶子后面的组织stub保持绿色。I / J.:被改变的PZSAS1-20(一世)和as1-1(J)在器官脱落之前发生的延长衰老期间,可以看到中间萼片。野生型花卉中与萼片花托边界相关的生长收缩位于改变的PZ的底部(见箭头,一世).K / L:在一些方面观察到基本更大的,沙漏形PDZsAS1-20(K)和as1-1(左)内侧萼片。比例尺,200 μm。
花瓣脱落区的位置也转移AS1花(图2C、F;数字3.F-H;附加文件3.:图S1)。脱落后,保留在花瓣附着位点的组织短项为126±18μm(n = 8)AS1-20花和92±8微米(N = 8),用于as1-1花。虽然侧向雄蕊脱落区的放置似乎不受影响AS1花(图2F),有时可在内侧雄蕊附着部位观察到小的组织突起(图)2G)。
ASMedial Sepals的近端区域显示出改变的身份
野生型花的外器官在脱落前短暂开始枯萎,并且在阶段16),但在分离时仍然是顽固的[39.].在AS1鲜花(第17阶段),由于内侧萼片脱落的延迟,在延长的衰老期后观察到两种独特的叶绿素损失模式(图3.B,D,I-L)。主要模式是叶绿素保留在三角形的近端区域并丢失在其他地方AS1内侧萼片(图3.我,j)。在一些中也观察到较大的近端间绿区AS1内侧萼片(图3.K, L)as1-1调查的内侧萼片,19(61%)有绿色近端区域,具有三角形形状(图3.一、 其他12个(39%)的近端-远端区域为绿色,呈沙漏状(图3.如果改变的近端-远端区域颈部狭窄,在离断后只有三角形的近端区域仍然附着(数据未显示)。如果较宽,内侧萼片侧面开始脱落,从近端边缘开始(见图)3.D)。
在asflowers中建立内侧萼片插座边界
在野生型花中,标记未来的萼片插座边界的折痕在阶段8的萼片基地的基础上是显而易见的(图4.A、 根据指定的阶段[31.])。随着开发的持续(第9阶段),与下面的萼片原基中发现的细胞相比,该地区的增长的增长(图中:下面的花卉容器(图4.C) 形成清晰定义的边界(图4.E,阶段12)[20.],[40].在AS1突变花(第8阶段),初始折痕的位置在内侧萼片原基的中点远端移位(图4.b)。虽然有些生长抑制很明显(图4.D,第9阶段),内侧萼片插座边界区域AS1花(图4.f,阶段12)被混乱,并且比野生型(图4.e)。作为AS1花成熟(第15阶段),仍然可以检测到中间萼片中该边界的轻微位移(附加文件4.:图S2B)相比于野生型(附加文件4.:图S2A)。横向萼片插座边界区域AS1花(第15期)与野生型花相似(附加文件4.:图S2E,f)。
突变AS1影响内侧萼片花托边界。扫描电子型突变型萼片基金的电子显微照片。内侧萼片(MD SE)原序和底层花梗(PD)之间的边界区域由箭头表示。一种:在野生型花(第8阶段)中,折痕标记未来萼片 - 插座(远端PEPICEL)边界的部位。B.:此初始边界转移AS1内侧萼片原刚度(第8阶段)。C:作为野生型花(第9阶段)开发,萼片的表面均匀圆润。D.:中央,近端地区AS1萼片原基(阶段9)从表面突出。E.:野生型花(阶段12)中存在萼片和插座之间明确的边界。在萼片的近端区域未观察到毛状物。F:内侧萼片和花梗之间的边界改变AS1鲜花(第12阶段)。毛状体(见箭头,也在(C))经常在中央,近端区域观察到AS1内侧萼片。秤条,100μm。
而野生型萼片原基是圆形的(图4.C,E),中央近端域AS1内侧萼片原始人变得越击(图4.d,f)。毛状体经常存在于这些区域中AS1萼片(图4.B,F;数字3.J L;数字2b),未在野生型萼片的相应区域观察(图4.A,C,E)。近端域的外观改变AS1中间萼片与保留叶绿素的区域相对应,作为萼片衰老的其余部分(图1)3.沿这些近端区域的远侧边缘发生脱落(图3.B;数字2d),而不是与在生长在它们的基部收缩的区域一致(图2B;数字3.一世)。
asflower的脱落带缺陷与bp有关
确定BP活动是否有助于流离失所的脱落区域AS1花,我们生成了as1-20 BP-1双突变体。BP-1由于删除了整个轨迹的删除,是一个空的等位基因[20.],[24.].如前所述AS1-1 BP-2双突变体[23.],的整体外观as1-20 BP-1对于单个突变体的那些,花序很大程度上是添加剂。像BP-1突变体(图5.A, e, i) [24.],as1-20 BP-1突变花序具有缩写的髁间和细长,短,向下指向的花梗(图5.B, F, J)AS1-20突变体(图1d),萼片的尺寸减小和花瓣as1-20 BP-1开花导致花蕾提早开放,雄蕊和心皮的发育暴露(图5.b)。
的损失BP.恢复脱落区域放置和内侧萼片插座边界的位置AS1突变的花朵。一种:英国石油公司花序。花梗是短暂的,细长的,下降。B.:AS1 BP.花序内侧萼片的脱落不延迟。光盘:扫描电子显微照片AS1 BP.花(第17期)呈中间色(C)和横向(d)意见。放置脱落区AS1 BP.花(d)类似于野生型(见图2A、 (E)车辆的离场区AS1 BP.花(C),如前所述BP-101,BP-3和BP-10花卉 [21.],[25.],表明在果实发育过程中细胞膨胀增加。E / F / I / J:内侧(E / F)和横向(I / J)意见英国石油公司和AS1 BP.鲜花(17)阶段。增大的离断带位置英国石油公司(E / i)和AS1 BP.(缩略词)鲜花类似于野生型花(见图3.A,E)。G / H / K / L:扫描电子显微照片英国石油公司和AS1 BP.内侧萼片原基。箭头表示内侧萼片原基与底层花梗之间的边界区域。G:在英国石油公司花(第9阶段),花梗是细长的,花卉器官下方的插座区域不能膨胀。H:花萼-花托边界的位移不明显AS1 BP.花(第9阶段)或英国石油公司花(G).K / L:由于花梗的径向收缩,萼片与插座之间的边界不太明显英国石油公司(K)和AS1 BP.(左)鲜花(11)阶段。规模的酒吧:1°厘米(A/B);100μm(C / d / G / H / K / L);200μm(E / F /我/ J).
然而,BP活性的丧失足以恢复植物中萼片和花瓣脱落区的位置AS1花(图5.C, D, F, J),以及内侧萼片脱落的时间(图5.在野生型花中,最初观察到明显的脱落带AS1 BP.器官脱落后的花(图5.D;数字2A,E)。作为水果成熟的进展(第17阶段),萼片脱落区域AS1 BP.鲜花变得扩大并具有杂乱的外观(图5.C)。该结果与具有特征的脱落区放大符合英国石油公司花卉 [21.],[25.].
在年轻.AS1 BP.和英国石油公司花(第9阶段),萼片-花托边界的位置没有远端移位(图5.g,h)因为他们在AS1花(图2B, D).此外,中央-近端区域AS1 BP.内侧萼片无脊状,也不含异位毛状体(图5.这些结果表明,花梗近端区身份的改变和花梗边界的偏移AS1鲜花也是BP依赖性的。
由于容器的径向收缩,底部的折痕英国石油公司和AS1 BP.萼片原基(第11期)明显不明显(图5.K,L)比野生型花朵(图2e)。通过在野生型花中促进容器的膨胀,BP活性会影响萼片平行管边界的定义。
HAE :: GUS脱落区标记的表达在asflowers中改变
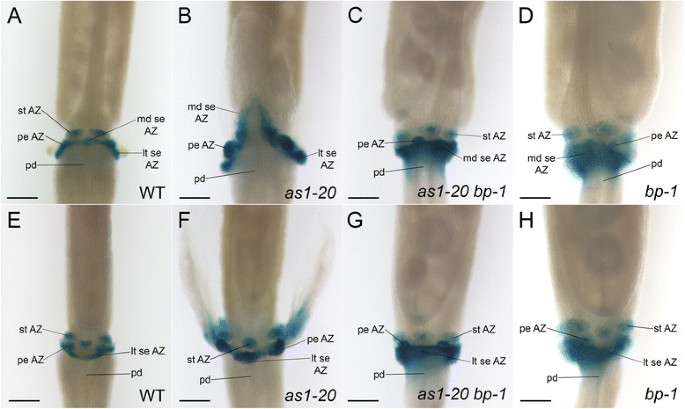
我们介绍了形态学证据表明萼片和花瓣脱落区的放置转移AS1突变花朵(图2和3.;附加文件3.:图S1)。检查已知花器官脱落区域的已知标记的概况AS1花,我们穿过了河AS1-20转基因植物的突变体携带融合豪推动者到了β-葡萄糖醛酸酶(格斯)报告基因[32.],[41.].野生型有:格斯花(17期),表达格斯在标记萼片,花瓣和雄蕊附件位点的离散域中剩余的花式器官脱落区细胞中持续存在(图6.A,E)。在AS1-20鲜花(第17阶段),豪监管区域通常是直接的格斯在内侧萼片的近端区域以倒V形表达(图6.B).类似于细胞分离的延迟进程(图2B,D;数字3.B, D),这个标记的表达起源于近端边缘AS1-20内侧萼片(附加文件5.:图S3A,B)和通常膨胀远侧直到线相交于萼片中点(附加文件5.:图S3C-F;数字6.b)。格斯在花瓣和外侧萼片附着部位残留的组织中也有表达AS1-20花(图6.B,F)。
我们已经表明,BP活动的损失足以恢复萼片和花瓣脱落区的位置在AS1-20花。确定是否表达的表达式有:格斯脱落区标记也被救出as1-20 BP-1花,携带这种标记的突变体就产生了。我们发现,在野生类型的花中(图6.A、E)格斯在剩余的萼片和花瓣脱落区细胞中表达as1-20 BP-1(数字6.C, G) as well asBP-1(数字6.D,H)花(第17阶段)。有趣的是,乐队格斯对应于萼片脱落区电池的表达显着宽,并扩散到两者的远端特性as1-20 BP-1(数字6.C,G)和BP-1花(图6.d,h)与这些突变花的扩大脱落区域对应。
综上所述,这些结果提供了分子证据,表明在植物中,萼片和花瓣脱落区向远端移位AS1而这种位移是依赖于bp的。
讨论
我们在这里报道了AS1 MYB转录因子在建立萼片和花瓣脱落区位置中的新作用。花萼脱落的改变模式的三个方面AS1花是值得注意的。首先,最大脱落区位移发生在每个中点AS1萼片(数字2和3.).第二,内侧萼片的离断带中点向远端偏移约为外侧萼片的两倍(图)2B、 (F)第三,语言的表达有:格斯脱落带标记物不仅移位,而且显示其发病较晚AS1内侧萼片(附加文件5.:图S3),在脱落中的显着延迟镜像(图1d,e)。这些结果表明,AS1活性的丧失主要影响离区细胞说明书的位置,并且位移的程度由取向相对于所述-萼片间边界区域的影响以及花的中间 - 横向轴线(数字1b)。脱离的延迟AS1内侧萼片可能代表着脱落带规范的时间或随后细胞分离的激活的改变。
我们分析AS1花朵显示内侧萼片内的近端区域具有改变的特性。随着附着器官衰老(阶段17),近端区域之间出现明显的分界,保持绿色,其余器官随着叶绿素分解而失去颜色(图17)3.毛状体经常出现在细胞的中央、脊状近端区域AS1内侧萼片(图2B;数字4.b,f)并且未发现在野生型萼片的相应圆形区域内(图4.A,C,E)。流离失所的脱落区域AS1内侧萼片勾勒出这些改变的近端区域的远侧边缘(图3.B)限定野生型花内侧萼片-花托边界的狭窄生长区域[40],[42.]是杂乱无章,并在的碱基略微偏移AS1内侧萼片(图4.;附加文件4.:图S2;数字2b)。有趣的是,与该边界相关的生长抑制可以从脱落区分化脱离AS1花。这些结果表明萼片-花托的边界被破坏AS1鲜花,但没有完全拆除。
花萼和花瓣脱落区的位移AS1鲜花依赖于BP(图5.和6.).在野生型花中,AS1-AS2阻遏物复合物限制了BP.表达域到花器器官原序的花梗,容器和器官边界区域[13.].虽然BP,KNAT2和KNAT6活动的结合损失是恢复正常的萼片和花瓣尺寸AS1花卉 [16.[单独丢失BP足以拯救萼片插座边界的移动位置,以及与位移脱落区域相关的近端区域的改变特征AS1内侧萼片(图5.).
一个有趣的平行于我们的结果是AS1介导的BP.在水果图案的表达。拟南芥果实由两个心皮瓣组成,心皮瓣附着在中间的复盖上[43.].在阀瓣边缘形成的裂带促进了种子的扩散[30.].在开发的古尼奥中,AS1限制了一个表达BP :: GUS.标记到将成为复制的地区[44.].与野生型水果相比,AS1突变果实具有较宽的韧皮部和较窄的裂片,并且韧皮部区域扩大BP.表达以及异位表达BP.在阀门[44.].BP丧失活性,发现部分恢复repla的尺寸大小和阀门AS1 BP.水果(44.].通过其对阀门 - 复制边界的调节,AS1控制水果裂开区域的位置。在AS1果,开裂区被横向移动,由于胎座框的扩张[44.].我们提出AS1同样调节花器官插座边界的放置,从而调节萼片和花瓣器官脱落区的位置。
BP在调节器官脱落双重角色。除了影响离区细胞的说明书位点,BP防止过早脱落通过抑制脱落的细胞分离相位25.].通过IDA-HAE/HSL2通路的信号通路已被提出可以缓解bp介导的器官脱落抑制[25.].英国石油公司和AS1 BP.花卉开发放大,杂乱无章萼片脱落区(图5.C, E)类似于花的组成表达IDA [21.],[25.],[26.].我们已经找到了a的表达式有:格斯标记器扩展到容器中英国石油公司和AS1 BP.花(图6.这些结果提示,BP可能通过限制萼片脱落区大小来控制萼片脱落区大小豪来自容器的表达。
我们的研究为器官边界形成与脱落带发育之间的联系提供了新的证据。与ATH1和BOP1/BOP2不同,ATH1和BOP1/BOP2是部分或全部花器官脱落带形成所必需的[8.],[9.[AS1和BP似乎通过调节其位置来在脱落区规范中发挥更加间接的作用。我们观察到萼片脱落区域的移位AS1在萼片边缘的鲜花较小而不是在萼片中点(图2D, H)表明活跃在萼片间边界的因素也影响着脱落带的分化。发生在器官间边界的生长抑制已被发现影响侧壁器官边界的建立。花中有突变杯形cotyledon1(CUC1)及CUC2基因融合萼片,但他们的萼片插座边界不会改变[45.].然而,CUC活性的降低进一步模糊了萼片-花托边界的定义ATH1花卉 [9.].预计建立横向和器官界限的复杂调节网络的进一步解剖,可以在容器边界,近端 - 远端器官图案和花器官脱落区发育之间揭示关键连接。
结论
我们已经发现AS1在建立萼片和花瓣脱落区位置中的新作用。在AS1突变花,萼片和花瓣脱落带远端移位,内侧萼片的分离明显延迟,内侧萼片的近端区域显示身份改变。BP活动的丧失挽救了离断区和近端区域的缺损AS1花。我们的研究结果表明,通过分析控制花器官边界和近端-远端模式的基因网络,可以进一步了解花器官脱落带的发育过程拟南芥树叶。
作者的贡献
SL构思和协调这项研究。CG,MC,WG和SL进行中小企业。CG拍摄植物,并进行了标记的分析。DW和工作组测序AS1-21等位基因。CG,MC,WG和DW准备的数字;SL写了稿件。所有作者阅读并认可的终稿。
附加文件
参考文献
- 1。
放手从来就不是一件容易的事:细胞脱落和受体样蛋白激酶。JIPB。2013年,55岁:1251 - 1263。
- 2。
liljgren SJ:器官切除:退出策略需要信号和移动的交通。植物营养与肥料学报。2012,29(6):657 - 662。10.1016 / j.pbi.2012.09.012。
- 3.
范诺克:剥离带的发展。丰收后,2009,1:5-
- 4.
《植物科学》2013,199-200:48-60.10.1016/J.plantsci.2012.10.008。
- 5。
Hepworth SR,张Y,McKim S,Li X,Haughn GW:锯齿依赖于叶片依赖的信号控制叶和花卉图案化拟南芥。植物细胞。2005,17:1434-1448。10.1105 / TPC.104.030536。
- 6。
Norberg M, Holmlund M, Nilsson O: The叶片叶柄上基因作用冗余控制侧生器官的生长和发育。发展。2005年,132:2203年至2213年。10.1242 / dev.01815。
- 7。
Jun JH,MA CM,Fletcher JC:刀片 - 叶片1坐标器官确定和轴向极性拟南芥通过直接激活不对称的叶子2。植物细胞。2010年,22:62-76。10.1105 / TPC.109.070763。
- 8。
McKim SM、Stenvik GE、Butenko MA、Kristiansen W、Cho SK、Hepworth SR、Aalen RB、Haughn GW:叶柄上的叶片基因对拟南芥的脱落区形成至关重要。发展。2008, 135: 1537-1546. 10.1242/dev.012807。
- 9。
Gomez-Mena C, Sablowski R:拟南芥(ARABIDOPSIS THALIANA) HOMEOBOX GENE1建立了茎器官的基底边界并控制茎的生长。acta botanica sinica, 2017, 36(5): 769 - 772。10.1105 / tpc.108.059188。
- 10。
González-Carranza ZH, Rompa U, Peters JL, Bhatt AM, Wagstaff C, Stead AD, Roberts JA:夏威夷裙子:一种调节器官融合和拟南芥生长的F型箱基因。植物理性。2007,144:1370-1382。10.1104 / pp.106.092288。
- 11.
Byrne Me,Barley R,Curtis M,Arroyo JM,Dunham M,Hudson A,Martienssen Ra:不对称leaves1介导叶子图案化和干细胞功能拟南芥.自然。2000,408:967-971。10.1038 / 35050091。
- 12.
Hazen SP,Borevitz Jo,Harmon FG,Pruneda-Paz JL,Schultz TF,Yanovsky M,Liljegren SJ,Ecker Jr,Kay SA:夏日时钟的快速阵列映射和拟南芥的发育突变。植物理性。2005,138:990-997。10.1104 / pp.105.061408。
- 13。
ori n,eShed y,chuck g,bowman jl,hake s:控制的机制诺克斯基因表达拟南芥开枪。发展。2000,127:5523-5532。
- 14。
郭M,托马斯J,柯林斯G,蒂默曼斯MCP:直接镇压诺克斯由不对称的Leve1复合物拟南芥.植物细胞。2008年,20:48-58。10.1105 / tpc.107.056127。
- 15.
徐斌,李智,朱勇,王辉,马辉,董安,黄辉:拟南芥基因AS1,AS2, 和jag.负调边界指定基因以促进萼片和花瓣发育。植物理性。2008,146:566-575。10.1104 / pp.107.113787。
- 16。
Ikezaki M, Kojima M, Sakakibara H, Kojima S, Ueno Y, Machida C, Machida Y:受调控的遗传网络不对称LEAVES1(AS1)及AS2叶片发展中拟南芥蒂利亚纳:诺克斯基因控制五种形态事件。工厂J. 2009,61:70-82。10.1111 / J.1365-313x.2009.04033.x。
- 17。
Phelps Durr TL,Thomas J,Vahab P,Timmermans MC:玉米粗鞘2及其应用拟南芥同源不对称叶1与预测的组蛋白伴侣HIRA相互作用,以维持诺克斯器官发生过程中的基因沉默和确定性。植物细胞。2005,17:2886-2898。10.1105/tpc.105.035477。
- 18。
罗米,俞c-w,陈f-f,zhao,田g,刘x,崔y,杨j-y,吴k:组蛋白脱乙酰酶hda6在镇压中与AS1相关联诺克斯基因在拟南芥.公共科学图书馆。2012,8:e100314 -10.1371/journal.pgen.1003114。
- 19。
Lodha M,Marco CF,Timmermans MCP:不对称的叶子通过直接募集Polycomb-抑制复合物来保持knox Homeobox基因的抑制。genesx dev。2013,27:596-601。10.1101 / gad.211425.112。
- 20。
道格拉斯SJ,Riggs CD:Pedicel开发拟南芥蒂利亚纳:血管定位的贡献以及BREVIPEDICELLUS和ERECTA基因的作用。王志强,王志强。10.1016 / j.ydbio.2005.06.011。
- 21。
王学强,徐文华,马立国,付志明,邓晓伟,李建勇,王永华:要求KNAT1 / BP.用于开发中的分离区拟南芥蒂利亚纳.JIPB。2006年,48:15-26。
- 22。
李志刚,李志刚,李志刚克纳特6和诀窍2和短花梗菌和便士在拟南芥花序。acta botanica sinica(云南植物研究),2008,29(5):531 - 534。10.1105 / tpc.108.058230。
- 23。
Byrne Me,Simorowski J,Martienssen Ra:不对称LEAVES1显示诺克斯基因冗余拟南芥.发展。2002,129:1957-1965。
- 24。
Venglat SP, Dumonceaux T, Rozwadowski K, Parnell L, Babic V, Keller W, Martienssen R, Selvaraj G, Datla R:同源盒基因短花梗菌是在花序架构的关键调节拟南芥.pnas。2002,99:4730-4735。10.1073 / PNAS.072626099。
- 25
Shi Cl,Stenvik Ge,Vie Ak,Bones Am,Pautot V,Proceniers M,Aalen RB,Butenko Ma:拟南芥I类KNOTTED-like同源盒蛋白作用于IDA-HAE/HSL2花脱落信号通路的下游。植物营养学报。2011,23(3):453 - 457。10.1105 / tpc.111.084608。
- 26
Stenvik Ge,Butenko Ma,Fillowicz Br,Rose JK,Aalen RB:过度表达脱落缺乏花序激活退化脱落带的细胞分离拟南芥.acta botanica sinica, 2017, 36(4): 457 - 461。10.1105 / tpc.106.042036。
- 27
Stenvik Ge,Tandstad nm,guo y,shi cl,kristiansen w,holmgren a,clark se,Aalen rb,Butenko ma:脱落的开花缺陷的Epip肽足以通过受体样激酶Haesa和α诱导拟南芥脱落Haesa-like2。植物细胞。2008,20:1805-1817。10.1105 / TPC.108.059139。
- 28
Cho Sk,Larue Ct,Chevalier D,Wang H,Jinn TL,Zhang S,Walker JC:拟南芥花器官脱落的调节。pnas。2008,105:15629-15634。10.1073 / PNAS.0805539105。
- 29
Konieczny A, Ausubel FM:映射的程序拟南芥使用共同显性生态型PCR基标记的突变。工厂J. 1993,4:403-410。10.1046 / J.1365-313x.1993.04020403.x。
- 30.
lijgren SJ, Ditta GS, Eshed Y, Savidge B, Bowman JL, Yanofsky MF:防摔疯子箱基因控制种子分散拟南芥.自然。2000,404:766-770。10.1038 / 35008089
- 31。
Smyth Dr,Bowman Jl,Meyerowitz em:早春发展拟南芥.植物细胞。1990年,2:755-767。10.1105 / tpc.2.8.755。
- 32。
Leslie Me,Lewis MW,Youn J-Y,Daniels MJ,Liljegron SJ:evershed受体样激酶调制花器官脱落拟南芥.发展。2010,137:467-476。10.1242 / dev.041335。
- 33。
Blázquezma,Soowal Ln,Lee I,Weigel D:叶子表达与花的萌生拟南芥.发展。1997,124:3835-3844。
- 34。
施耐德CA,Rasband Ws,Eliceiri Kw:NIH图像到ImageJ:25年的图像分析。NAT方法。2012,9:671-675。10.1038 / nmeth.2089。
- 35。
Stracke R,Werber M,Weisshaar B:R2R3-MYB基因家庭拟南芥蒂利亚纳.CurrOp植物BIOL。2001,4:447-456。10.1016 / s1369-5266(00)00199-0。
- 36。
Dubos C,Stracke R,Grotewold E,Weisshaar B,Martin C,Lepiniec L:MYB转录因子拟南芥《趋势植物科学》2010,15:1360-1385.10.1016/j.tplants.2010.06.005。
- 37。
孙勇,周强,张伟,付勇,黄浩:不对称LEAVES1,一个Arabidopis参与叶片细胞分化控制的基因。Planta。2002,214:694-702。10.1007 / S004250100673。
- 38。
KO ER,KO D,Chen C,Lipsick JS:MyB结构域中的保守酸性贴剂是激活内源性靶基因和染色质结合所必需的。莫癌。2008,7:77-10.1186 / 1476-4598-7-77。
- 39。
Fang S-C,Fernandez De:疯子域因子AGL15对花衰老和果实成熟的效果。植物理性。2002,130:78-89。10.1104 / pp.004721。
- 40。
Aida M,Tasaka M:芽器官边界的遗传控制。Curr Opin Plant Biol.2006,9:72-77.10.1016/j.pbi.2005.11.011。
- 41。
Jinn TL,Stone JM,Walker JC:HAESA,一个拟南芥富含浓的重复受体激酶,对照组花器官脱落。基因开发。2000,14:108-117。
- 42。
ZádníkováP,西蒙R:界限控制植物开发。CurrOp植物BIOL。2014,17:116-125。10.1016 / J.PBI.2013.11.013。
- 43。
Roeder Ahk,Yanofsky MF:水果开发拟南芥.拟南芥。2006,4:e0075-10.1199/tab.0075。
- 44。
Alonso-Cantabrana H,Ripoll JJ,Ochando I,Vera A,FerrándizC,Martínez-Laborda A:叶片和水果图案中的常见监管网络突出拟南芥不对称叶子基因。发展。2007,134:2663-2671。10.1242 / dev.02864。
- 45。
Aida M,Ishida T,Fukaki H,Fujisawa H,Tasaka M:参与器官分离的基因拟南芥:的一个分析的杯状容器子叶变种人。植物细胞。1997, 9: 841-857. 10.1105/tpc.9.6.841。
致谢
我们感谢布拉德·琼斯和Sara帕特森有益的讨论,在孟菲斯综合显微镜中心大学娄博伊金斯用扫描电子显微镜,查尔斯·麦克罗伊技术援助帮助和拟南芥生物资源中心提供种子。这项研究是由密西西比启动基金和国家科学基金会资助的大学SL(IOS-1239311)和密西西比河EPSCoR计划的支持(EPS-0903787)。MC是由密西西比EPSCoR社区学院研究计划的支持;DW是由在密西西比大学的罗纳德·E.捷学者计划的支持。
作者信息
隶属关系
通讯作者
附加信息
相互竞争的利益
提交人声明他们没有竞争利益。
电子补充材料
(A/B/E-H)
附加文件3:图S1。:部分侧萼片的脱落延迟AS1花。内侧(A/B/E-H)和横向(光盘)突变花朵的视图(第17阶段)。内侧萼片的缩小被推迟AS1-21(A/B)那AS1-101(e)那AS1-23(F), 和AS1-22(g / h)花。部分侧萼片的脱落延迟AS1-21(b / d)那AS1-23(F), 和AS1-22花。在光接触后每种基因型调查的10朵花(早期到中期),所有内侧萼片(20 of 20)仍然附有AS1-21和AS1-23鲜花,75%(共20个)和70%(十分之二)仍然存在AS1-22和AS1-101花,分别。没有横向萼片仍然附着在AS1-101(0的0)或as1-1(60 of 60)花;20%(共20分中的4个),15%(共分为20分)和15%(共分20分)AS1-21那AS1-22, 和AS1-23花,分别。比例尺,200 μm。(TIFF 2 MB)
(a,b)
附加文件4:图S2。:在横向萼片中未检测到插座边界的位移AS1-20花。内侧(a,b)和横向(c,d)野生型和AS1-20鲜花(第15阶段)。与野生型花相比(A/C),萼片 - Peecel边界的放置在内侧受到影响(B.,见箭头)但不是横向(d)萼片的AS1-20花。比例尺,200 μm。(TIFF 5 MB)
(a,b)
附加文件5:图S3。:表达式有:格斯标记物从近端边缘远端进展AS1内侧萼片。内侧的观点AS1-20突变花朵(第17阶段)组织化学染色用于β-葡糖醛酸酶(GUS)活性。表达式格斯起始于内侧萼片的近端边缘(a,b).条纹格斯表达在远端方向上从每个原点延伸(b,c)直到他们相交(d)概述反相V形近端域的边缘。在某些人AS1-20内侧萼片(E, F),GUS表达的条纹向远端扩展朝向萼片尖端,而不会在近端区域中交叉。(TIFF 6 MB)
作者的原始提交的图像文件
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。
本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。
如欲查阅本许可证副本,请浏览https://creativecommons.org/licenses/by/4.0/.
创作共用及公共领域专用豁免书(https://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
古伯特,m.m.,克里斯蒂,法医,沃德,D.L.等等。不对称叶1调节细胞中的脱落区位置拟南芥花。BMC植物BIOL.14,195(2014)。https://doi.org/10.1186/s12870-014-0195-5
已收到:
公认:
发表:
关键词
- 脱落
- 花器器官脱落
- 器官边界
- 花开发
- AS1
- BP.