摘要
背景
下穗尖峰被定义为在种子发育过程中谷物接收较少光合产物的部分。与那些所谓的高级尖峰相比,典型的劣质尖峰物理位于水稻穗中的近端次次突出的分支和传统上以后的开花时间和较慢的晶粒灌装速率。因此,在劣质尖峰上产生的颗粒的体重低于在优质尖峰上的重量较轻。MicroRNAS(MIRNA)被公认为通过转录后基因法规调节植物开发的关键参与者。我们之前介绍了MIRNA可能影响籽粒灌浆率并在确定水稻中的谷物重量和产率方面发挥作用。
结果
本研究进一步分析了籽粒发育5个不同阶段的优势小穗和劣势小穗中表达的小rna。共分析了457个已知mirna和13个新mirna,结果显示141个已知mirna在籽粒灌浆前期优势小穗和劣势小穗之间存在差异,多数优势小穗相关mirna的表达量高于劣势小穗。被差异表达mirna靶向的基因(miR156、miR164、miR167、miR397、miR1861和miR1867)在与植物激素稳态和淀粉积累相关的多种发育和信号通路中发挥作用。
结论
我们的数据建立了miRNA动态和激素在籽粒灌浆和发育中的传统作用之间的复杂联系,为广泛接受的水稻生产中所谓的优和劣小穗概念提供了新的见解。
背景
米 (栽培稻L。)是世界上最重要的粮食作物之一,为全球21%以上的人口和东南亚76%的人口提供热量[1].水稻的产量主要由两个关键因素决定,即籽粒灌浆速率和粒重[2].许多研究表明,在水稻穗中,粒重和粒饱满度(描述籽粒品质的参数)主要是位置依赖的[3.] - [5].一个水稻穗是由许多分枝组成的称为小穗,一些具有高质量的种子称为优良的小穗,一些具有低质量的种子称为劣小穗。在一般情况下,优良小穗开花早,籽粒灌浆速度快,结出优质种子。在优越的小穗上的花或种子通常位于圆锥花序的顶端的初生枝上。劣穗开花较晚,籽粒灌浆率较低,且位于近端次生枝上,导致种子品质较差[3.]、[6]、[7].
MicroRNA(miRNA),一种由茎环结构前体产生的内源性非编码小RNA,已被证明在植物发育的许多方面起着曲线作用,例如器官形态发生[8]、[9,压力反应[10.]、[11.],控制开花[12.]、[13.,植物激素稳态[14.]、[15.]和粮食/水果发展[16.]、[17.].利用小RNA高通量测序技术进行的一系列研究表明,水稻籽粒发育过程中各种mirna的表达是非常动态的[16.]、[18.] - [21.].例如,在一项研究中,大多数miRNA被显示出同样表达或表达比受精后1-5天的6-10天粒度高出高得多20.].一项类似的研究表明,在受精后5 - 7天的种子中,检测到的mirna有很高比例的上调[19.].通过对445个已知mirna和45个新mirna的分析,表明这些mirna在水稻中的表达是发育阶段依赖的。随着水稻灌浆过程的进行,大多数已知mirna的表达量逐渐增加[16.].这些观察结果也与另一项研究形成对比,该研究显示,在籼稻粒发育过程中,大约一半的已知mirna被上调,而其余mirna被下调[18.].
虽然目前尚不清楚是否所有已知的mirna都参与了粮食发育,但某些特定的mirna与粮食发育过程具有高度的相关性。MiR167就是这样一个候选miRNA,它可能通过生长素- MiR167 -在水稻灌浆过程中发挥作用ARF8.-osgh3.2.监管途径[21.].过度表达的miR167显着降低了植物高度,单个植物的分蘖数,穗长度,每根穗的小穗数量,以及通过调节其目标ARF家族转录因子的种子设定率[22.].MiR397, miR398, miR408和miR528是潜在的籽粒灌浆调节剂,通过控制其编码铜结合蛋白和/或l -抗坏血酸氧化酶的靶基因水平[21.].MiR397在水稻青少年圆锥和晶粒中高度表达,并且过度表达的miR397扩大了晶粒尺寸,促进胰穗分支,并通过下调其目标显着提高水稻产量OsLAC[17.].OsSPL14,是miR156的一个靶点,有助于形成理想的水稻植株结构,减少分蘖数,提高抗倒伏能力,提高产量[23.]、[24.].OsSPL16, miR156的另一个靶点,在调节颗粒尺寸、形状和质量方面也起着重要作用[25.].此外,与野生型的相比,在miR393过表达转基因中降低了种子大小[26.].所有这些结果表明MiRNA在水稻籽粒发育或水稻灌浆中起重要作用。
我们在开花后18天(DAF)分别发现了351个和312个已知的mirna在优势粒和劣势粒中特异表达。其中,189个mirna在优势粒和劣势粒之间差异表达,表明它们在水稻籽粒发育的多种生理或代谢过程中发挥着潜在的作用[4].为了进一步研究mirna在水稻灌浆过程中对优势和劣势小穗发育的动态影响,我们分别对10、15、21、27、35DAF 5个阶段的优势和劣势小穗的mirna进行了测序和分析。结果共发现457个已知mirna, 13个新的mirna。对已知的优势小穗和劣势小穗差异表达的mirna进行了聚类分析。我们发现一些关键mirna的靶基因构成了控制各种代谢过程的重要调控网络,包括激素稳态和淀粉积累。更重要的是,我们发现低等小穗的发生与低等小穗和低等小穗差异表达的mirna的低表达密切相关。我们的研究结果表明,miRNA网络及其表达水平在决定水稻籽粒灌浆过程中发挥了重要作用,并为优势和劣势小穗粒重的形成提供了机制。
结果
优势和劣势小穗之间的生理和表型差异
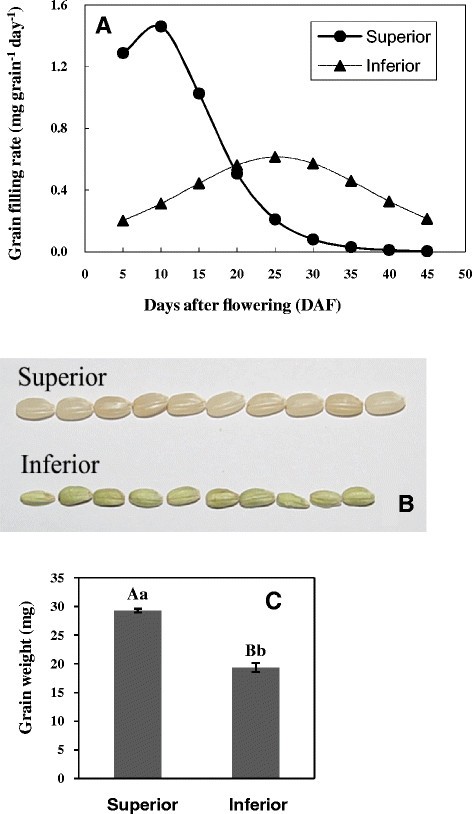
总体而言,小穗的灌浆过程是动态的,这与小穗在轴/穗分枝上的位置有关。优势小穗位于穗的顶端,开花早,籽粒灌浆快,终末粒重和饱满度高于位于穗基部的劣势小穗[3.]、[6]、[7].具体地,在初始5至10 DAF的颗粒填充速率(每粒每天1.3-1.4mg)的速度比下小穗的速度快4倍(每粒每天0.2-0.3mg)。在20 DAF中,优质小穗的大部分粒子以最高速率填充,然后填充速率降至与下粒的最高填充率相当的水平(图1一种)。相比之下,下穗穗(每粒每天〜0.6毫克)的谷物灌装速率仅在此时间点处仅小于最高尖峰的最高灌装速率的50%(每粒〜每颗粒每天〜1.5mg)。籽粒填充的整体过程大约需要30天,填充率高显示出不对称的曲线,而下穗尖峰的灌浆速率较高45天,填充率明显降低显示对称的正常曲线(图1因此,来自优势小穗的籽粒在表型上更大,饱满,而来自劣势小穗的籽粒则更小,部分充盈(图)1B和C)。
优势和劣势小穗间整体小rna表达的差异
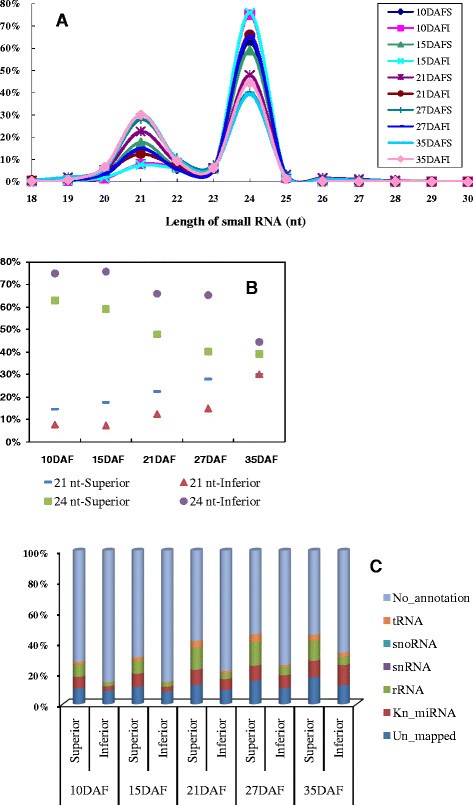
根据其长度,在植物中发现了两种主要的小rna: 21核苷酸(nt)和24核苷酸小rna。为了了解这两种小RNA在水稻灌浆过程中是如何在优势和劣势小穗中表达的,采用高通量RNA测序技术对两种小穗的小RNA库进行了分析。利用10、15、21、27和35 DAF的10个优粒和劣粒样品分离小rna进行测序。通过对适配器序列进行修剪,去除质量较低且长度小于18个核苷酸的reads后,每个文库获得了大约10,658,388至17,702,636条高质量的小RNA reads,分别代表最低的3,518,252至最高的4,917,105条不同的小RNA。其中,通过SOAP分析,超过2826852个不同的reads(77.18%)与水稻基因组完全匹配(附加文件1)[27.].
在来自个体文库的数百万高质量小rna中,24-nt和21-nt小rna在所有病例中占主导地位(图)2A和B)。具体而言,在10个文库的发育种子中,58.28%和18.30%的reads是24-nt和21-nt小rna。与此相反,21-nt小rna是水稻叶片和三细胞花粉中最丰富的群体[28.[我们的数据显示,24-NT小RNA占据了上下穗和下小穗(图)的最高百分比(图2A和B),这可能是由于在水稻器官发育过程中小rna的组织和时间特异性表达。此外,在灌浆过程中,劣穗中24nt小rna的数量要多于优穗,而21 nt小rna的数量则相反(见图)2B)。
在上述小rna中,我们分析了miRNAs以及其他类型的小rna。例如,通过比较miRBase (release 17.0)中存储的已知mirna和总小rna来识别所有已知的mirna,并分析它们的丰度。我们观察到,在水稻灌浆期,除了35 DAF时,多数已知miRNA在优势小穗上的表达率高于劣势小穗上的表达率,在35 DAF时,优势小穗和劣势小穗之间没有明显差异(图)2C,额外的文件1).其他类型的小rna主要与rrna、snrna、snoRNAs和tRNAs相关。在灌浆的所有阶段,这些小RNA群体在优势小穗中包含的小RNA比在劣势小穗中包含的小RNA更多样化,读值更高(图)2C和附加文件1).
多数mirna在优势小穗中表达量高于劣势小穗,少数mirna表达量相反
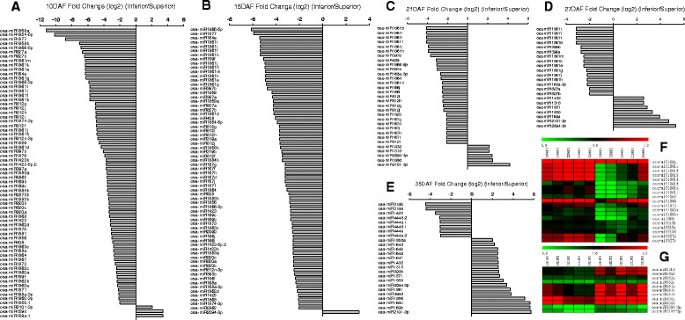
为了了解在籽粒灌浆过程中,miRNA是如何在优势和劣势小穗中表达的,我们将来自相同文库的每个miRNA的丰度归一化到转录本/百万(TPM),正如我们之前的出版物所做的[4].将小RNA的清洁读数映射到MiRNA释放的miRNA前体17.0中,并在十个库中识别出共核已知的miRNA(附加文件2).为了进一步分析提取有意义的数据,仅选择了表达式在其中一个数据集中的表达式高于10 TPM的miRNA。在此标准之后,为其表达分析选择总共160名已知的miRNA(附加文件3.).结果表明,在同一灌浆期,优穗和劣穗间有141个mirna的差异表达,且多数mirna在灌浆前期和中期(10-27 DAF)优穗中较劣穗多表达。
在109个差异表达的mirna中,有103个(~94.50%)mirna在优势小穗中表达较高(图5)3.a-e;附加文件4).此外,microrna表达的高160、19个microrna(~ 11.88%),如miR168a miR1861b, d, f, h-j, l, miR1864, miR1868, miR1873, miR1883a, b, miR408, miiR815b-d, miR827a, b,优越的表达明显高于劣质的小穗在水稻灌浆期的各个阶段(P < 0.05, n = 5,双尾配对t检验;数字3.相比之下,160个mirna中只有11个(~6.88%)在水稻灌浆期相似灌浆期的弱穗中表达量较高(P < 0.05, n = 5,双尾配对t检验;数字3.G)。
水稻灌浆过程中优势小穗和劣势小穗mirna的差异表达。(A -E).条形图反映了在10DAF时,优势和劣势小穗间所选mirna的表达倍数变化(一)15是(b)21岁是(C),27daf.(d), 35 daf)(E), 分别。在方法和材料的详细描述之后进行表达折叠变化。折叠变化的值及其范围由低于( - )在劣质和优质尖峰之间的等于( - )到超过(+)的等于( - )的MiRNA表达的比率。仅选择了十个数据库中表达式高于10 TPM的MIRNA,用于计算其迈出折叠变化,并且在图中列出了高于2的绝对值变化。(F -G).显示在优质尖峰中高度表达的所选miRNA的表达水平[log2(归一化表达式)]的热图(F)和劣质小穗(G)在不同的水稻籽粒填充阶段(P <0.05,n = 5,双尾配对T检验)。
水稻籽粒灌浆相关mirna的差异表达靶点
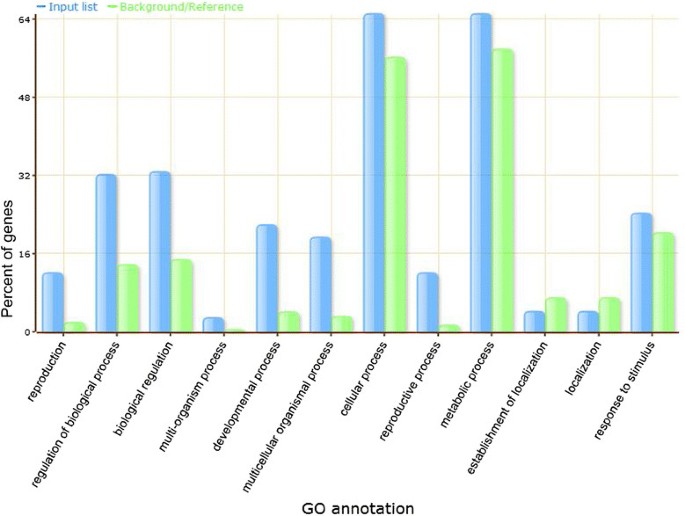
植物miRNA通过碱配对识别并不完全地与其靶mRNA结合,导致MRNA切割或在某种程度上,在转录后水平的平移抑制[29.].全基因组mirna导向的靶mRNA切割可以通过高通量测序方法识别,称为降解组分析或RNA末端平行分析。该方法在水稻中成功用于鉴定水稻miRNA的靶标[30.] - [32.].最近,利用该技术鉴定出的水稻miRNAs靶标已经通过SeqTar基于一种新的算法进行了总结和重新分析[33.]为我们提供了一种有用的平台,用于分析水稻灌浆过程中的潜在miRNA靶标。为了分析这些差异表达的miRNA在谷物填充中的功能,收集其通过SEQTAR鉴定的靶标并用于进行富集分析。结果,发现了221个目标MRNA并在已发布的网站上提交给Agrigo以进行进一步分析[34.)(附加文件5).去生物过程富集分析与其表达背景/参考文献相反,这些miRNA靶基因在功能上分类为以下特定的生物过程,或没有与各自的背景/参考的显着差异(图4):
- 1)
miRNA靶基因主要来自“细胞过程”(65.24%)、“代谢过程”(65.24%)和“对刺激的反应”(24.39%),与背景/文献差异较小;(2)小部分miRNA靶基因在“定位”(4.27%)或“定位建立”(4.27%)中发挥作用,与背景/文献无差异;(3)相当数量的重要miRNA靶基因在“生殖”(12.20%)、“生物调控”(32.93%)、“生物过程调控”(34.42%)、“发育过程”(21.95%)、“生殖过程”(12.20%)和所谓的“多细胞生物过程”(19.51%)中发挥作用。“多生物过程”(3.05%)与他们的背景/参考文献有显著差异。在这些与背景/文献存在显著表达差异的重要miRNA靶基因中,具有“生殖”、“生物调控”、“生物过程调控”、“发育过程调控”、“生殖过程”在水稻籽粒发育和灌浆过程中起着极其重要的作用。下面进一步分析优势和劣势小穗灌浆过程中具有代表性的关键调控基因及其相应的miRNA调控基因的关系。
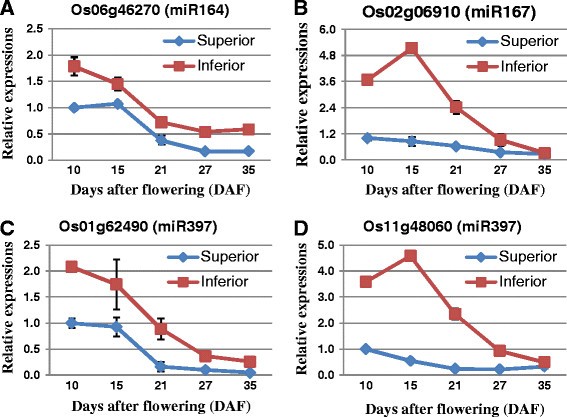
一般来说,如果mirna和它们的靶标之间存在简单的调控,它们的表达就会呈现负相关[16.]、[21.].为了鉴定与水稻灌浆相关的关键mirna及其表达模式,我们选择了3个在水稻灌浆过程中可能起关键作用的高表达mirna (miR164、miR167和miR397)的靶标,进行进一步的qRT-PCR研究。特别地,miR164和miR167是生长素相关的miRNAs(生长素- mirs),它们通过下调其靶标NAC和ARF家族转录因子来决定细胞内游离生长素的水平[21.]、[35.]、[36.].这些生长素mirs可能在水稻灌浆过程中起一定的调控作用。miR397通过靶向编码漆酶样蛋白的转录本,正向调节水稻粒大小和穗分枝[17.].确实,在水稻灌浆过程中,这些miRNA靶基因的相对表达量与优势和劣势小穗中相应的miRNA水平均存在较强但简单的负相关(图)5和6).
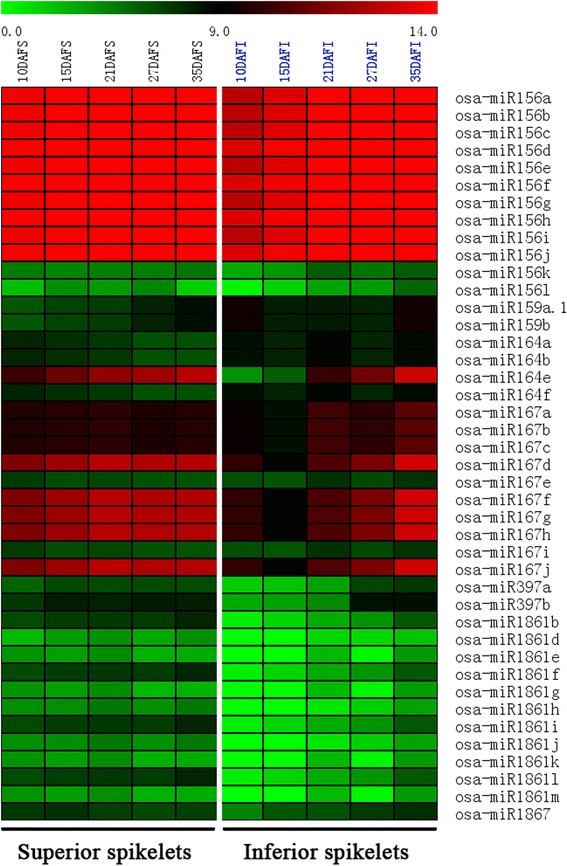
特定miRNA家族的表达分析可能导致优质和下小穗填充的差分水稻籽粒。Heatmap shows the expressional levels [log2(normalized miRNA’ expression)] of different miRNA family members including miR156, miR159, miR164, miR167, miR397, miR1861, and miR1867 families in superior (S, on left part of the map) and inferior (I, on right part of the map) spikelets at different rice grain filling stages.
在优势和劣势小穗中鉴定了新的籽粒灌浆相关mirna及其预测靶标
为了鉴定水稻籽粒灌浆过程中优势和劣势小穗中的新miRNA,我们首先从MIREAP中收集候选miRNA,然后确定它们是新miRNA,如果它们没有被报道,它们相应的miRNA也在我们的一个文库中被鉴定[37.或在超过半数的10个文库中检测到潜在的mirna [28.].在所有候选新型miRNA中,两个(miRN1和miRN2)在我们的至少一个数据集中高度表达(> 50tPM),因此包括作为新的miRNA。在这些标准之后,确定了13个新的MIRNA,以具有完美的茎环二次结构,但从未报道过(表1,附加文件6).在这些新的miRNA中,大多数显示在胰岛位置和/或发育依赖方式中的差异表达。例如,鉴定MiRN2仅在较低穗(10-21张Dafi)的早期和中谷填充阶段中仅高度表达,但在高级小穗或以后的谷物填充阶段(表1).此外,通过stem-loop qRT-PCR验证了3个新鉴定的mirna的表达,结果与我们从高通量测序中收集的数据一致(附加文件)7).最后,我们基于Dai等人提出的psRNATarget预测了这13种新mirna的靶基因[38.].除miRn2外的13种新mirna共预测了68个候选靶基因(附加文件)8).miRn6的两个靶基因通过RNA连接酶介导的5 ' -RACE进行验证,因为这两个靶基因可以在降解体数据库PsRobot中被识别[39.].这两个靶点的miRNA结合位点位于3 '或5 '非翻译区域(UTRs),但剪切位点却位于miRNA结合位点的下游或上游(附加文件)9).miRn6的另外两个靶基因也在名为starBase的降解组数据库中被观察到(附加文件10.)[40,提示这一新鉴定的miRNA可能针对它们的预测基因进行调控。然而,这些非规范的切割位点以前从未被报道过,这表明要么是靶标mRNA被加工的未知机制,要么这些假定的靶标只是随机降解,而不是miRNA善意的目标。
讨论
尽管有多达547个miRNA和一个miRNA*及其在特定发育阶段的表达已经被记录栽培稻在miRBase版本17.0中,对籽粒灌浆和籽粒发育的mirna动态,特别是在优势和劣势小穗中缺乏了解。本研究利用高通量测序技术,收集了丰富的序列信息,为研究优、劣粒灌浆过程中miRNA的动态变化提供了可能。
在植物中,大多数小RNA的长度为21-24nt。其中,大多数miRNA是20-22nt,而大多数siRNA是长度为21-nt或24-nt [41.].此外,23-nt小RNA也有报道,可能代表一种新的功能性小RNA [42.].利用高通量测序技术,从水稻灌浆过程中5个不同发育阶段的优、劣小穗中获得了1000多万条清晰序列。不像水稻叶片和三细胞花粉组织,其中21-nt小RNA是主要的小RNA种群[28.填充或开发颗粒通过测序由生长粒的不同阶段构成的十个小RNA文库排序,含有最丰富的24-NT小RNA。此外,这些24-NT siRNA的表达在水稻籽粒填充中的发育阶段依赖性方式非常动态,表明24-NT siRNA也可能在上下穗间之间形成不同的谷粒填充图案中的关键作用,因为这些24-nt siRNA与某些重要的大米Kegg途径有关,例如淀粉和蔗糖生物合成,如我们以前的出版物中所讨论的[43.].
不同的mirna表达模式可能决定了优势小穗和劣势小穗的不同灌浆模式,也可能决定了劣势小穗的不同灌浆模式
从水稻不同发育灌浆粒的十个小RNA库中,至少有一个鉴定出了260个已知的mirna和13个新mirna。mirna的表达依赖于发育阶段和/或组织特异性的方式是植物发育中发现的小rna的标志[28.]、[29.]、[42.].谷物灌装过程没有例外。通过大规模平行测序,我们检测到几乎所有表达高于10TPM的miRNA,在水稻籽粒灌装过程的不同发育阶段都具有它们独特的表达变化。这些MiRNA的大多数逐渐增加,因为谷物填充在上级进展中进行了[16.和次小穗(簇I10.,附加文件11.).这些发现扩展了以往对粮食发育相对早期阶段的许多miRNAs表达的理解,例如1-10 DAF粒在如此短的时间框架的后半段比前半段时间窗口有更多的表达[19.]、[20.或籼稻籽粒发育中miRNA动态的其他片段研究[18.[以对整个水稻籽粒发育过程中的麦克拉斯进行更系统的研究。
具体而言,我们的研究表明,多数优质小穗的mirna在初始和中期(10和27DAF)表达量较高,在15DAF达到峰值,而在劣势小穗中,多数mirna在后期(35DAF)表达量较高(图3)3.,附加文件4).由于miRNA靶基因的总体表达与谷物填充过程中miRNA的总体表达水平通常是负相关的,因此该观察结果解释了为什么先前报道的1058个基因中的1058个基因的出现在高级小穗的两倍低于下尖峰时比下尖峰水稻中的出生后9天[44.].因此,通过我们的观察,mirna的简单负调控在水稻灌浆过程中占主导地位。到目前为止,我们还不能得出优势粒和劣势粒表达模式差异决定两种水稻籽粒品质差异的结论。可能恰恰相反,它们的发育差异决定了水稻中mirna的差异表达。
单个mirna在优势和劣势小穗灌浆活动中的重要性
在动物中,个体miRNA具有多个靶标,单一蛋白质编码基因通常由多个miRNA调节。相比之下,植物miRNA具有狭窄但重要的靶基因谱。因此,当它们的表达式改变时,个体miRNA的重要性通常可见。例如,在miR156的情况下,OsSPLs它是由于圆锥形miR156主要表达的年轻圆锥中的miR156严格控制的目标。水稻中MiR156的过度表达导致严重的矮主义,显着降低了穗尺寸和开花延迟[45.].更具体地说,OsSPL14,调控营养生长期茎分枝的发育,为培育出抗倒伏能力强、产量高的理想水稻植株奠定基础[23.]、[24.].OsSPL16,另一个miR156靶点,编码一种积极调节细胞增殖的蛋白质。在表达OsSPL16促进细胞分裂和谷物填充,因此提高了粒度宽度和水稻产量[25.].在我们的研究中,MiR156在稻粒灌装过程中不仅在优越和下穗尖峰中表达,而且还表明沿谷物填充的动态变化进展。具体地,MiR156在早期谷物填充阶段(10-15个DAF)的表达较高,但在优于劣质小穗的中间和后后籽粒灌装阶段下降(图5,附加文件2和额外的文件3.).miR156的差异表达模式与籽粒灌浆速率的差异有很强的相关性(图)1A)在优势小穗和劣势小穗之间,表明miR156对优势小穗和劣势小穗灌浆差异的潜在贡献。
作为个体miRNA,MiR397在早期和中谷灌装阶段的上下尖峰中高度表达,并且沿着整个谷物灌装周期连续降低。总体而言,MiR397在低于优越的小穗下表达得多,特别是在早期和中谷灌装过程中(图5和附加文件2和额外的文件3.).据报道,MIR397通过降低其目标积极控制水稻粒度,OsLAC,一种类似漆酶的蛋白质,可控制植物对油菜素内酯的敏感性[17.].芸苔类固醇水平可以通过水稻中的C-22羟基酶调节。在水稻中过度表达的C-22羟基酶将增强分蘖和种子数量,粒度,特别是穗子碱基的种子的重量增加,在表达的转基因水稻的C-22羟基酶中增加[46.].我们发现,弱势小穗粒重较低可能是弱势小穗灌浆过程中miR397表达量较低所致(图)5,附加文件2和额外的文件3.).
MiR159是ABA诱导的另一种单独的miRNA,在拟南芥种子萌发期间控制两种MYB因子的转录水平作用[47.].虽然Spearion和Demotior Spikelets含有良好量的miR159,但这种miRNA在我们研究中的优质小尖峰中表达了更高的初穗(图5,附加文件2和额外的文件3.).前期研究表明,水稻籽粒细胞分裂、灌浆速率、淀粉积累与ABA含量呈显著正相关[48.]、[49.].ABA在早期籽粒灌装阶段的应用可以显着增强胚乳细胞分裂率,从而增加细胞数,促进粒填充率和较低穗粒重量的粒度[48.]、[50].事实上,已有报道称miR159ab双突变体具有多态形态缺陷,包括生长习性改变、叶片卷曲,以及最重要的拟南芥小角果和小种子[51].
稻种子发展实际上是淀粉沉积的方法,由于淀粉占糙米最终重量的80〜90%。作为参与淀粉合成途径的关键酶之一,显示淀粉合酶的活性与水稻粒填充率显着且正相关[5].有趣的是,已发现这种关键酶被MiR1867调节,如5'-rame和Degrainome分析所揭示的[33.].我们的数据显示,miR1867在优势和劣势小穗中高度表达,但存在差异(图)5,附加文件2和额外的文件3.).此外,miR1861已经被证明靶向编码β -淀粉酶和含淀粉结合域的蛋白质的基因,因此也可能在水稻种子发育中发挥作用[16.]、[33.].有趣的是,在灌浆过程中,弱势小穗中miR1861的表达量远低于优势小穗(图)5,附加文件2和额外的文件3.).
mirnas在养肝稳态中的角色
生长素稳态与信号转导相关mirna,包括miR160 [52其中miR164这个],[35.], miR167 [53]、[54], miR390 [55]、[56],以及miR393 [57]、[58[已在拟南芥中报道。这些miRNA属于水稻和拟南芥和不同植物种类之间的高度保守的miRNA。虽然在我们的研究中米籽粒填充期间MiR160,MiR390和MiR393在米籽粒填充期间表达,MiR167和MIR164在上下尖峰(附加档案)中非常丰富2).通过比较miR164和miR167在优势粒和劣势粒中的表达,发现除35 DAF外,在灌浆期优势粒中miR164和miR167的表达均较高。具体来说,在DAF为10和15时,miR164e在优势小穗上的表达量分别是劣势小穗上的80.3和42.4倍5,附加文件2和额外的文件3.).同样地,miR167d,f-h,j在15DAF位点上的表达量是劣穗的9.4倍(图)5,附加文件2和额外的文件3.).miR164和miR167在水稻穗部的表达量在灌浆过程中逐渐增加。而在弱穗中,虽然miR164的表达也随着籽粒灌浆过程而增加,但miR167在籽粒灌浆初期先略有下降,然后上调。这些miRNAs控制的生长素稳态的微小变化足以改变籽粒的灌浆活性,因此,这些微小的miRNAs表达差异可能对两种类型的小穗的灌浆行为差异产生很大的影响。事实上,miR167-ARF8-OsGH3.2调控节点在水稻愈伤组织发育中调控细胞游离生长素含量中起关键作用[36.].籽粒灌浆过程中生长素含量也可能存在类似的规律。
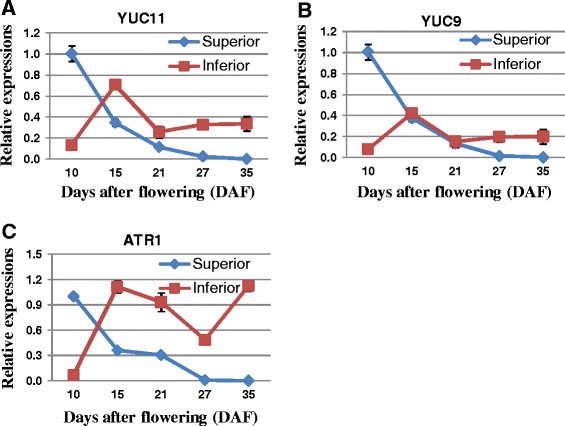
生长素内容确实可能在谷物填充中发挥关键作用。据报道,推定的IAA生物合成基因的表达,OsYUC9,osyuc11,OsTAR1与水稻籽粒发育过程中IAA含量存在较强的相关性,可能通过调节淀粉沉积而影响水稻籽粒灌浆[59].因此,通过QRT-PCR方法在我们的研究中测试了在水稻粒填充期间的尖峰期间这些基因的表达模式,结果表明这些基因在优质穗子里逐渐降低。然而,在劣质小穗粒中,它们首先上调至15个DAF,然后在谷物灌装过程中减少。尽管OsYUC9和osyuc11自21 DAF以来几乎没有变化,OsTAR1一直到27DAF,然后急剧增加,直到灌浆结束(图2)7).综上所述,我们的数据显示,在水稻灌浆过程中,这三个基因的表达量与miR167水平呈负相关,而与优势和劣势小穗IAA含量呈正相关[60].在发展水稻种子中的IAA含量与胚乳细胞分裂和籽粒填充的速率有阳性和显着相关。因此,在颗粒中差异累积,或肠蛋白相关的miRNA的差异表达,例如mir167和mir164,颗粒可能是谷粒填充差和较少的粒度较低穗粒度的原因[60] (图5,6,7和8).
优势和劣势小穗同步灌浆的机制
虽然许多研究夸大了个体mirna在发育中的作用,但对数百个mirna与其数千个靶基因的动态关系的研究,将使我们在充分理解粮食发育中同步灌浆活动的机制方面处于有利地位。例如,miR156在水稻构型和粒级的建立中起着关键作用[23.] - [25.]、[45.].miR167是水稻农艺性状和产量性状的关键决定因素[22.]、[36.].MiR393是调节旗叶和应力反应倾向的重要球员[26.]、[61].最近,miR397被确定为调节水稻穗分枝和粒级的关键因子[17.].所有这些miRNA通过靶向和调节在水稻发育过程中确定农艺重要性状的关键转录因子的表达来单独函数。我们的研究表明,这些miRNA可以在水稻籽粒填充中配合为群组。有趣的是,看到一个这样的miRNA或其目标的变化可能会改变不仅改变特定特征的变化,而且可以改变其他miRNA的变化及其在动态法规中的目标。
结论
综上所述,我们的研究结果和其他实验室发表的数据表明,差异表达的mirna,特别是那些在籽粒灌浆早期表达不同、参与激素稳态和淀粉沉积等的mirna,可能或至少部分解释了水稻籽粒灌浆过程中的非同步和非对称灌浆模式以及优子粒和劣子粒最终粒重的形成。未来的研究将集中于多种mirna,如生长素相关mirna在水稻籽粒灌浆不良机制发现过程中的作用。
方法
水稻栽培、取样、干重和灌浆速率测定
粳稻品种。新丰2号种子在河南农业大学试验场(北纬34°53′,东经113°35′,海拔94m)无胁迫条件下生长。根据以前使用的方法,从开花后5天(DAF)到45DAF,每隔5天取样一次上、下小穗[6].每个采样时间点,样品体积等于每个样品的35个晶粒。完全,获得了9套样品,用于测量上下穗和下尖峰的干重。为了确定干重,将样品首先在105℃下在105℃下干燥30分钟,然后在80℃下保持直至达到恒定重量,这表明晶粒的完全干燥。可以通过将干燥的粒度重量值填充到后平方程中来确定不同时间点的上级和下尖峰的谷物填充速率:
通过对式求导计算籽粒灌浆速率(V)1:
其中,Y为每粒重(mg), t为开花后的天数,K、a、b为回归确定的系数。
RNA采样,测序和原始深度测序数据分析
以10DAF、15DAF、21DAF、27DAF和35DAF的未成熟优、劣小穗为目标材料,按照制造商的说明,使用TRIzol试剂(Invitrogen, Carlsbad, CA, USA)进行总RNA分离。采用Agilent 2100生物分析仪对提取的总rna进行质量检测。为了去除可能的DNA残留,在37°C下应用RNase-free DNase I 30 min。北京基因组研究所(中国深圳)利用我们的RNA样本进行了下一步的文库构建和测序。
从原始数据中去除适配器序列和低质量序列,绘制干净读取的长度分布。然后,利用SOAP技术将10个文库的结果序列与水稻基因组进行比对[27.].参考NCBI核苷酸数据库和Rfam RNA家族数据库,进一步将其分为tRNA、rRNA、小核仁RNA (small nucleolar RNA, snoRNA)和小核RNA (small nuclear RNA, snRNA) [62].为了已知的miRNA鉴定,总小RNA清洁读数与来自水稻miRNA数据库的miRNA前体序列(miRBase 17.0)对齐。
为了比较谷物填充期间的同一时间点的表达模式和差异表达的miRNA在谷物填充期间的同一时间点,将10个文库中的每个miRNA的丰度标准化为如前所述的每百万(TPM)的转录物[28.].在归一化之后,我们将表达式设置为0.01 tpm,对于未表达的那些miRNA。至于在所有测序文库中表达少于10汤匙的那些miRNA,忽略它们的差异表达式。
从标准化表达式计算折叠变化和p值
我们定义了一个性状R,它表示在水稻灌浆的同一时期,弱势小穗的miRNA归一化水平与优势小穗相同miRNA归一化表达水平的比值。然后同一miRNA在同一时间点在劣势和优势小穗之间的折叠变化量等于r的二进制对数。计算p值,可以使用下式:
式中N1和N2分别代表同一灌浆时间内优、劣小穗的干净标记总数。X为调查的mirna数量,y为优势小穗中同源mirna的数量。
在p值为0.01 ~ 0.05的前提下,如果fold-change大于1或小于−1,则认为该miRNA存在差异表达,而当p值小于0.01时,则认为该miRNA存在差异表达。miRNA在上位小穗和下位小穗间显著差异表达。
新型mirna鉴定及靶基因预测
对于无法与NCBI核苷酸数据库,RFAM RNA系列数据库或MIRBASE对齐的清洁读数受到“MIREAP”(http://sourceforge.net/projects/mireap/)鉴定新的miRNA候选人。对于具有至少一个文库中存在的相应miRNA *序列的那些潜在的miRNA,或者可以从我们的图书馆的超过一半检测到其成熟序列,或者在至少一个文库中读取超过50个以上的TPM成熟序列,是终于被定义为新的mirnas。
psRNATarget程序(http://plantgrn.noble.org/psrnatarget/)的默认参数用于预测miRNAs的潜在靶标。以新鉴定的mirna序列作为输入序列。的栽培稻以TIGR基因组cDNA OSA1 Release 5 (OSA1R5)作为基因组文库进行目标搜索。
基因本体(GO)分析
GO分析使我们能够看到靶向基因在劣势和优势小穗上的功能分布或差异表达mirna的重点。GO分析工具在这个网站:http://bioinfo.cau.edu.cn/agriGO/analysis.php[34.].我们使用TIGR locus版本091211作为背景或参考。这个背景可以让我们了解与某一功能相关的基因所占的比例,相对于整个基因组。输入将是我们所鉴定的优质和劣势小穗间差异表达mirna的目标基因。在跑步后,我们可以知道这些差异表达的mirna的目标基因中涉及某一功能的基因的百分比。通过对比输入和背景输入的百分比,我们可以发现这些mirna靶向基因的功能重点。
定量实时RT-PCR (qRT-PCR)和茎环qRT-PCR
简而言之,用DNA酶I(Promega)预处理的1μg总RNA,借助于逆转录酶(Promega)来产生cDNA的逆转录。在20μLPCR系统中使用5μl的1:20稀释的cDNA作为模板,与适量的SYBR绿色反应溶液混合(SYBR®GreenQRT-PCR主混合物; Toyobo)。首先将QPCR系统在95℃下预孵育5分钟,然后进入40个循环,包括在95℃下变性15s,在60℃下退火15s,并在72℃下延伸32s。BiORAD IQ5序列检测系统是我们使用的设备(Biorad,USA)。茎环QRT-PCR用于miRNA表达模式分析,如前所述进行[4].简而言之,按照之前发表的方法,首先与水稻5.8S rRNA水平进行比较,将劣势小穗的mirna拷贝数归一化[21.[则通过在10dAF的10DAF中与其相应的表达相比,进一步归一化miRNA的表达水平,其最初设定为1.0。此实验中涉及的所有基因特异性引物列于附加文件中12..
RNA连接酶介导的5'族
To conduct the RNA ligase–mediated 5’-RACE, 1 μg total RNAs from equal mixture of superior and inferior spikelets at 10DAF, 15DAF, 21DAF, 27DAF, and 35DAF was ligated to a 5’-RACE RNA adapter without calf intestine alkaline phosphatase treatment using 5′-Full RACE Kit (Takara), followed by a reverse transcription reaction. Then 1 μl of reverse transcription product was used as template to amplify the 5’ end of the potential target by using the outer 5’ RNA adaptor primer supplied in the kit and outer 3’ gene-specific primer. Thirty more cycles of PCR were further carried out using the inner 5’ RNA adaptor primer supplied in the kit and inner 3’ gene-specific primer. The final PCR product was showed on the ethidium bromide-stained agarose gel, cloned into pGEM-T Easy vector, and at least 7 independent clones from each reaction were sequenced finally.
附加文件
参考文献
- 1。
Fitzgerald MA, McCouch SR, Hall RD:不仅仅是一粒米:对质量的追求。植物科学进展,2009,14(3):133-139。10.1016 / j.tplants.2008.12.004。
- 2。
水稻籽粒产量基因的研究。植物生态学报,2008,11(2):209-214。10.1016 / j.pbi.2008.01.009。
- 3.
杨军,张军:超级稻灌浆问题。农业工程学报,2010,61(1):1-5。10.1093 / jxb / erp348。
- 4。
PEENG T,LV Q,Zhang J,Li J,Du Y,Zhao Q:米饭中优质和下小尖峰中微小RNA的差异表达(Oryza Sativa)。J Exp Bot。2011,62(14):4943-4954。10.1093 / JXB / ERR205。
- 5.
张洪涛,李辉,袁磊,王志强,杨军,张建军:花后交替湿润和适度干燥对水稻弱穗蔗糖-淀粉转化关键酶活性的影响。生物医学工程学报。2012,32(1):115 - 115。10.1093 / jxb / err263。
- 6.
Tsutomut:从谷粒灌装早期到中间阶段的胰岛素中的水稻Caryops的形态学发育。Funct植物Biol。2003,30:1139-1149。10.1071 / FP03122。
- 7.
水稻开花时间对籽粒品质和小穗分配的影响。植物营养与肥料学报。1998,20(2):231-241。
- 8。
Khan Ga,Declerck M,Sorin C,Hartmann C,Crespi M,Lelandais-Briere C:MicroRNA作为根部开发和建筑监管机构。植物mol biol。2011,77(1-2):47-58。10.1007 / s11103-011-9793-x。
- 9。
Kidner CA:小rna在叶片发育中的许多作用。中国基因工程学报。2010,37(1):13-21。10.1016 / s1673 - 8527(09) 60021 - 7。
- 10。
Khraiwesh B,朱杰,朱家:MiRNA和SIRNA在生物和非生物应激反应中的作用。Biochim Biophys Acta。2012,1819(2):137-148。10.1016 / J.BBBAGRM.2011.05.001。
- 11.
Sunkar R,Li YF,Jagadeeswaran G:MicroRNA在植物压力反应中的功能。趋势植物SCI。2012,17(4):196-203。10.1016 / j.tplants.2012.01.010。
- 12.
Wang JW, Czech B, Weigel D: mir156调控的SPL转录因子在拟南芥开花过程中的作用。生物技术学报,2009,38(4):738-749。10.1016 / j.cell.2009.06.014。
- 13。
周春明,张天强,王旭,于松,连辉,唐辉,冯志勇,Zozomova-Lihova J,王建伟:小豆蔻春化的分子基础。中国科学:地球科学。2013,34(6):691 - 697。10.1126 / science.1234340。
- 14。
刘强,陈永强:植物发育机制的新认识:mirna途径与植物激素应答的相互作用。中国生物化学学报。2009,34(4):457 - 461。10.1016 / j.bbrc.2009.04.028。
- 15.
生长素作用的微调控因子。植物学报,2013,32(6):733-740。10.1007 / s00299 - 013 - 1425 - 2。
- 16.
彭T,Sun H,Du Y,Zhang J,Li J,Liu Y,Zhao Y,Zhao Q:MicroRNA中涉及水稻灌浆的表征和表达模式。Plos一个。2013,8(1):E54148-10.1371 / journal.pone.0054148。
- 17.
张永春,于勇,王春艳,李志勇,刘强,徐静,廖建勇,王秀娟,曲丽华,陈飞,辛鹏,闫超,楚军,李华清,陈玉强:过表达microRNA OsmiR397通过增加水稻粒级和促进穗分枝提高产量。生物技术学报,2013,31(9):848-852。10.1038 / nbt.2646。
- 18.
Lan Y,Su N,Shen Y,张R,吴F,程Z,王J,Zhang X,Guo X,Lei C:籼稻籽粒发育中新型miRNA和miRNA表达分析的鉴定。BMC基因组学。2012,13(1):264-10.1186 / 1471-2164-13-264。
- 19。
易瑞,朱智,胡军,钱强,戴军,丁颖:水稻灌浆期microrna的深度测序鉴定及表达分析。公共科学图书馆。2013,8 (3):e57863-10.1371/journal. pon.0057863。
- 20.
朱QH,Spriggs A,Matthewl,Fan L,Kennedy G,Gubler F,Helliwell C:一种多样化的MicroRNA和MicroRNA类似的小RNA在开发水稻谷物。基因组res。2008,18(9):1456-1465。10.1101 / GR.075572.107。
- 21。
薛丽娟,张建军,薛宏文:水稻种子中mirna的表达谱及特性。中国生物医学工程学报,2009,37(3):916-930。10.1093 / nar / gkn998。
- 22。
刘H,贾S,沉D,刘家,李继,赵H,韩S,王Y:微小荷兰群岛167人下调的四种助长响应因子与奥里萨苜蓿的生长发育有关。Funct植物Biol。2012,39(9):736-744。10.1071 / FP12106。
- 23。
王娇Y, Y,雪D,王J,严米,刘G, G,曾庆红D,陆Z,朱X,钱Q,李J:监管的OsSPL14 OsmiR156定义理想植物架构大米。acta photonica sinica, 2010, 42(6): 541-544。10.1038 / ng.591。
- 24。
Miura K,Ikeda M,Matsubara A,Song Xj,Ito M,Asano K,Matsuoka M,Kitano H,Ashikari M:OSSPL14促进水稻中的胰腺分支和更高的谷物生产力。NAT Genet。2010年42日(6):545-549。10.1038 / ng.592。
- 25。
王士,吴师,元q,刘x,刘z,林x,zeng r,zhu,dong g,qian q,张g,傅x,张g,富x:晶粒尺寸,形状和质量控制在米饭中的OSSPL16。NAT Genet。2012,44(8):950-954。10.1038 / ng.2327。
- 26。
关键词:miRNA393/TIR1同源基因,水稻,旗叶倾斜,冠根生长植物营养学报,2012,19(1):159 -161。10.1111 / j.1469-8137.2012.04248.x。
- 27。
Li R, Li Y, K K, Wang J: SOAP:短寡核苷酸比对程序。生物信息学(英国牛津大学)。2008,24(5): 713-714。10.1093 /生物信息学/ btn025。
- 28.
魏立强,闫立峰,王涛:全基因组深度测序揭示水稻花粉发育过程中microrna的独特组成和表达模式。中国生物医学工程学报。2011,12 (6):R53-10.1186/gb-2011-12-6-r53。
- 29.
陈曦:小rna及其在植物发育中的作用。细胞生物学杂志。2009,25:21-44。10.1146 / annurev.cellbio.042308.113417。
- 30.
吴丽,张强,周华,倪飞,吴旭,齐勇:水稻MicroRNA效应复合物与靶标。植物学报。2009,21(11):3421-3435。10.1105 / tpc.109.070938。
- 31.
李宇飞,郑勇,Addo-Quaye C,张磊,Saini A, Jagadeeswaran G, Axtell MJ,张伟,Sunkar R:水稻microRNA靶标的转录组范围鉴定。植物学报,2010,62(5):742-759。10.1111 / j.1365 - 313 x.2010.04187.x。
- 32.
周敏,顾丽,李鹏,宋旭,魏玲,陈智,曹雪梅:水稻内源小RNA靶标的降解组测序研究奥雅萨苜蓿lssp。籼稻).中国生物医学工程学报,2010,25(1):67-90。10.1007 / s11515 - 010 - 0007 - 8。
- 33。
郑益,李伊夫,孙卡尔,张W:SEQTAR:一种从植物中聚酰胺化转录物的降解鉴定MicroRNA引导裂解位点的有效方法。核酸RES。2012,40(4):E28-10.1093 / NAR / GKR1092。
- 34。
杜志华,周旭,凌云,张志华,苏智:一种面向农业社区的GO分析工具。核酸学报2010,38:64-70。10.1093 / nar / gkq310。
- 35。
Guo H-S, Xie Q, Fei J-F, Chua N-H: MicroRNA引导转录因子NAC1的mRNA切割,下调生长素信号对拟南芥侧根发育的影响。植物学报,2005,17(5):1376-1386。10.1105 / tpc.105.030841。
- 36。
Yang JH, Han SJ, Yoon EK, Lee WS:植物生长素信号通路microRNA167-ARF8-GH3及其对外源生长素的响应。中国生物医学工程学报,2006,34 (6):1892-10.1093/nar/gkl118。
- 37。
Meyers Bc,Axtell MJ,Bartel B,Bartel DP,Baulcombe D,Bowman JL,Cao X,Carchton JC,Chen X,Green PJ,GRIFFITHS-JONES S,Jacobsen SE,Maltiensen Ra,Poethig Rs,Qi Y,VAUCHERET H,Voinnet O,Watanabe Y,Weigel D,Zhu JK:植物MicroRNA的注释标准。植物细胞。2008,20(12):3186-3190。10.1105 / TPC.108.064311。
- 38。
戴旭,赵PX: psRNATarget植物小RNA靶标分析服务器。核酸学报2011,39 (Web Server issue): W155-W159。10.1093 / nar / gkr319。
- 39。
吴慧娟,马玉坤,陈涛,王敏,王学军:基于网络的植物小RNA元分析工具箱。核酸Res. 2012, 40 (Web服务器版):W22-W28。10.1093 / nar / gks554。
- 40.
Yang JH, Li JH, Shao P, Zhou H, Chen YQ, Qu LH: starBase:从Argonaute CLIP-Seq和降解ome- seq数据中探索microRNA-mRNA相互作用图谱的数据库。核酸学报2011,39(数据库版):D202-D209。10.1093 / nar / gkq1056。
- 41.
宋旭,李鹏,翟建军,周敏,马丽,刘波,郑东辉,中ano M,曹松,刘超,楚超,王新军,Green PJ, Meyers BC,曹旭:DCL4和DCL3b在水稻小RNA生物发生中的作用。植物学报,2012,69(3):462-474。10.1111 / j.1365 - 313 x.2011.04805.x。
- 42.
赵玉涛,王敏,付淑霞,杨卫文,祁昌科,王小军:利用小RNA分析鉴定两个甘蓝型油菜品种的油料生产与发育相关表达的microrna和新的小RNA类。植物营养与肥料学报。2012,29(2):429 - 434。10.1104 / pp.111.187666。
- 43.
彭涛,杜勇,张军,李军,刘艳,赵颖,孙辉,赵强:水稻优劣势粒灌浆过程中24 nt sirna动态变化的全基因组分析。acta physica sinica . 2013, 32(4): 489 - 494。
- 44.
朱国栋,叶宁,杨军,彭旭,张军:乙烯和ABA对水稻弱穗和优穗发育淀粉合成基因表达的调控。应用生物医学工程学报。2011,62(11):3907-3916。10.1093 / jxb / err088。
- 45。
谢克,吴C,熊:基因组组织,差异表达和水稻毒素启动子结合转录因子和MicroRNA156的相互作用。植物理性。2006,142(1):280-293。10.1104 / pp.106.084475。
- 46。
Wu CY, Trieu A, Radhakrishnan P, Kwok SF, Harris S, Zhang K, Wang J, Wan J, Zhai H, Takatsuto S, Matsumoto S, Fujioka S, Feldmann KA, Pennell RI:油菜素内酯对水稻籽粒灌浆的调控作用。植物学报。2008,20(8):2130-2145。10.1105 / tpc.107.055087。
- 47。
Reyes JL,Chua NH:ABA诱导MIR159在拟南芥种子萌发期间控制两种MYB因子的转录水平。工厂J. 2007,49(4):592-606。10.1111 / J.1365-313x.2006.02980.x。
- 48。
杨军,张军,王铮,刘凯,王鹏:水稻弱穗和优穗花后发育与脱落酸和乙烯的关系。植物营养与肥料学报。2006,57(1):149-160。10.1093 / jxb / erj018。
- 49。
唐涛,谢华,王艳,陆波,梁军:蔗糖和脱落酸互作对水稻蔗糖合酶的影响及其与籽粒灌浆的关系。应用生态学报。2009,60(9):2641-2652。10.1093 / jxb / erp114。
- 50.
张Z,陈继,林S,李Z,程鲁,方c,陈H,林W:蛋白质组学与磷肝蛋白酶的测定ABA对谷物填充的影响栽培稻l .劣质的小穗。植物科学学报,2012,35(6):759 - 763。10.1016 / j.plantsci.2011.11.012。
- 51.
通过对拟南芥miR159家族的遗传分析,揭示了miR159家族的功能冗余和主要靶基因。中国科学(d辑:地球科学),2007,33(4):591 - 598。10.1073 / pnas.0707653104。
- 52.
Mallory AC, Bartel DP, Bartel B: microrna定向调控拟南芥生长素反应因子17对其正常发育和调控早期生长素反应基因的表达至关重要。植物学报,2005,17(5):1360-1375。10.1105 / tpc.105.031716。
- 53.
Kinoshita N, Wang H, Kasahara H, Liu J, Macpherson C, Machida Y, Kamiya Y, Hannah MA, Chua NH: IAA-Ala resistance 3是miR167在高渗透胁迫下调控拟南芥根结构的一个进化保守靶点。植物学报。2012,24(9):3590-3602。10.1105 / tpc.112.097006。
- 54.
古铁rez L, Bussell JD, Pacurar DI, Schwambach J, Pacurar M, Bellini C:拟南芥不定根的表型可塑性受生长素反应因子转录本和microRNA丰度的复杂调控。植物学报。2009,21(10):3119-3132。10.1105 / tpc.108.064758。
- 55.
Marin E, Jouannet V, Herz A, Lokerse AS, Weijers D, Vaucheret H, Nussaume L, Crespi MD, Maizel A: miR390,拟南芥的TAS3 tasiRNAs和它们的生长素响应因子靶标定义了一个定量调控侧根生长的自动调控网络。植物学报。2010,22(4):1104-1117。10.1105 / tpc.109.072553。
- 56.
Yang JH, Yang J, Yang J, Kim SH, Kim SK, Lee WS:生长素对拟南芥侧根发育的调控。acta photonica sinica, 2010, 38 (4): 1382-10.1093/nar/gkp1128。
- 57。
miR393/AFB3调节模块调控拟南芥根系统结构中国科学(d辑:地球科学),2010,27(9):1477 - 1482。10.1073 / pnas.0909571107。
- 58。
Si-Ammour A, Windels D, Arn-Bouldoires E, Kutter C, Ailhas J, Meins F, Vazquez F: miR393和secondary sirna调控TIR1/AFB2生长素受体分支的表达和生长素相关发育。植物营养与肥料学报。2011,27(2):457 - 461。10.1104 / pp.111.180083。
- 59。
Abu-Zaitoon YM,Bennett K,Normanly J,Nonhebel HM:在水稻的开发过程中IAA的大幅增加与色氨酸氨基转移酶OSTAR1和晶粒特异性Yucca的表达相关。physiol植物。2012,146(4):487-499。10.1111 / J.1399-3054.2012.01649.x。
- 60。
张H,Tan G,Yang L,杨j,张j,Zhao B:谷物中的激素与粳稻/籼稻杂交水稻劣质和优质尖峰的后性开发。植物理性生物化学。2009,47(3):195-204。
- 61.
夏锴,王荣华,欧旭,方志平,田超,段俊,王颖,张敏:过表达OsmiR393下调OsTIR1和OsAFB2导致水稻分蘖增多、早花和耐盐性降低。acta photonica sinica, 2012, 37(6): 693 - 698。
- 62.
Gardner PP, Daub J, Tate JG, Nawrocki EP, Kolbe DL, Lindgreen S, Wilkinson AC, Finn RD, Griffiths-Jones S, Eddy SR: Rfam:更新RNA家族数据库。核酸学报2009,37(增刊1):D136-D140。10.1093 / nar / gkn766。
致谢
国家自然科学基金项目(no . 31271651, no . 31200973);河南省创新科技人才队伍建设项目(no . 94200510003);河南大学创新团队(科技)资助项目(no . 2010IRTSTHN005)。关键词:边坡,边坡稳定性,边坡稳定性
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
作者的贡献
TP和QZ设计并完成了实验,分析了数据,撰写了论文。HS进行了高通量测序和数据分析。QM和YZ进行QRT-PCR。YD、JZ、JL提供了技术建议并参与了研究设计。GT和QM编辑了手稿。所有作者阅读并批准了最终的手稿。
电子补充材料
12870 _2014_196_moesm1_esm.xlsx
附加文件1:在水稻籽粒灌装过程中优质和下小尖峰的小RNA课程摘要。(XLSX 11 KB)
12870_2014_196_moesm4_esm.xlsx.
附加文件4:在水稻灌浆期间优质和下尖峰之间的差异表达的miRNA。(XLSX 55 KB)
12870 _2014_196_moesm7_esm.docx
附加文件7:通过茎环QRT-PCR,新miRNA在上位和劣势小穗填充过程中的表达模式有效。(多克斯19 KB)
作者为图像提交的原始文件
下面是作者提交的原始图片文件的链接。
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。
除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。
如欲查阅本许可证副本,请浏览https://creativecommons.org/licenses/by/4.0/.
创作共用及公共领域专用豁免书(https://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
彭涛,孙合,乔敏。等等。水稻种子发育过程中microRNA群的表达差异可能是导致弱穗籽粒灌浆不良的原因之一。BMC植物BIOL.14,196(2014)。https://doi.org/10.1186/s12870-014-0196-4
收到了:
接受:
发表:
关键词
- 米饭(Oryza sativa)
- 微
- 差异表达
- miRNA动力学
- 劣质小穗
- 高级小穗
- 粮食灌装