摘要
背景
豆科植物具有根瘤和丛枝菌根共生的独特能力。两种类型的根内共生都受到NSP2,是microRNA171h (miR171h)的靶点。虽然,最近的数据表明,miR171h特异性地限制丛枝菌根共生的根伸长区Medicago truncatula在不同生理和共生条件下,miR171h表达的时空调控机制尚不清楚。
结果
我们发现miR171h从一个不寻常的长原始转录本中功能性表达,之前预测该转录本编码两个相同的miR171h链。miR171h和NSP2转录本表现出复杂的调控模式,涉及植物的共生状态和施肥制度。实时荧光定量PCR检测miR171h和NSP2转录水平在所有测试条件下均表现出明显的反相关,除了菌根根,其中NSP2尽管miR171h表达增加,但转录水平仍被诱导。这也得到了转录水平的明显相关性的支持NSP2而且MtPt4,一种在功能性AM共生中特异性表达的磷酸盐转运体。在充足的磷酸盐条件下生长的植物中,MiR171h被强烈诱导,我们证明这是独立的CRE1这也是转录诱导所不需要的NSP2在菌根根部。原位两种基因的杂交和启动子活性分析均证实了涉及共生状态、磷氮营养的复杂调控,且两种基因均表现为互斥的表达模式。miR171h在m . truncatula根导致减少菌根定殖和减少结节通过Sinorhizobium meliloti.
结论
miR171h和NSP2与植物的营养状况密切相关,结合过表达分析的结果,指出miR171h在整合营养稳态以保障NSP2其间,丛枝菌根与根瘤共生。
背景
植物必须不断地处理磷酸盐(P我)的限制条件和克服P我限制是一种称为丛枝菌根共生(AMS)的互惠关系的发展,这是由大多数陆地植物和真菌门形成的Glomeromycota.AMS可促进植物对磷酸盐的吸收和生长[[1]、[2]]并以细胞内树形结构(称为丛枝)的形成而命名。丛枝大多形成于菌根的内皮层细胞层,通常被植物来源的丛枝周膜(PAM)包围,这是养分交换的部位[[3.]、[4]]。AMS的形成是在寄主植物和共生体之间的化学对话之后开始的[[5]]。植物分泌独脚金内酯,这是一组已知刺激真菌孢子萌发和菌丝分枝的植物激素[[6]]。作为回报,真菌释放一种脂壳寡糖的复杂混合物,称为Myc-LCOs或myc因子,刺激AMS的形成,并诱导豆科植物侧根的形成Medicago truncatula[[7]]。
P可诱导独脚金内酯的合成和分泌我限制[[8] - [11]]。独脚金内酯的生物合成需要GRAS型转录因子Nodulation年代ignalingPathway(NSP)1而且NSP2,nsp1nsp2双突变体显示菌根真菌定植减少[[12]]。有趣的是,NSP1而且NSP2是导致根结节形成的nod因子信号通路的关键组成部分[[13]、[14]]。近期研究结果[[7[]建议NSP2也参与了AMS。作者表明nsp2突变的植物对Myc-LCOs没有反应,而且定植较少。此外,NSP2与另一种GRAS转录因子相互作用R所需的一个rbuscular米酵母根化(RAM) 1,控制甘油-3-磷酸酰基转移酶的表达RAM2.这两种基因的突变导致定植量大大减少Rhizophagus irregularis。有趣的是,致病卵菌的定植疫霉palmivora在ram1和ram2突变体中也会受损(如果不是,需要指定)[[15]、[16]]。的重要作用NSP2在独脚金内酯生物合成中,RNS和AMS暗示NSP2是常见信号通路的组成部分[[17]]。因此,可以预期的时空表达NSP2是严格控制的。
micrornas (miRNAs)是基因表达的关键调控因子,通过靶转录物裂解和/或翻译抑制发挥作用[[18]、[19]]。这些小的非编码RNA分子的大小主要为21 nt,在调节植物的发育过程、激素信号、器官极性、RNA代谢以及非生物和生物胁迫中发挥重要作用[[20.] - [24]]。一些mirna,如miR166和miR169,也被发现参与根结节共生[[25] - [27]]。mirna也参与AMS的第一个证据来自于观察到多种mirna,如miR399,在菌根的芽和根中受到不同的调控m . truncatula烟草及番茄植物[[28]、[29]]。小rna和菌根降解体的克隆和深度测序m . truncatula根鉴定出许多miRNAs及其靶mrna,其中一些在菌根根中有差异表达[[30.]]。有趣的是,miRNA171家族的一个新成员miR171h被证明是靶向的NSP2[[30.]、[31]]。鉴于上述作用NSP2, miR171h通过控制symf通路的关键成分参与根内共生的调控[[27]]。miRNA171h表达影响菌根定殖,由Myc-LCOs诱导,并在真菌营养植物中保守,这一假设得到了加强[[32]]。同时,miR171h和NSP2,在细胞分裂素处理后被诱导,该调节依赖于细胞分裂素反应1 (CRE1) [[33]]。细胞分裂素和CRE1参与结节器官发生[[34]],但细胞分裂素也被认为参与丛枝菌根共生[[35]]。此外,最近的一项研究采用了深度测序Lotus对虾结节显示非典型miR171亚型,与MedicagomiR171h,靶向LjNSP2[[36]]。这些结果表明miR171h在结节共生中具有额外的调节作用,但目前尚未证实其直接参与[[32]、[36]]。
在本研究中,我们发现miR171h通过感知寄主植物的营养状况负向调控这两种类型的根内共生,并与其目标表现出互斥的表达模式NSP2的根皮层m . truncatula植物。
结果
在体内,811 bp miR171h原始转录本的表达介导NSP2转录本裂解
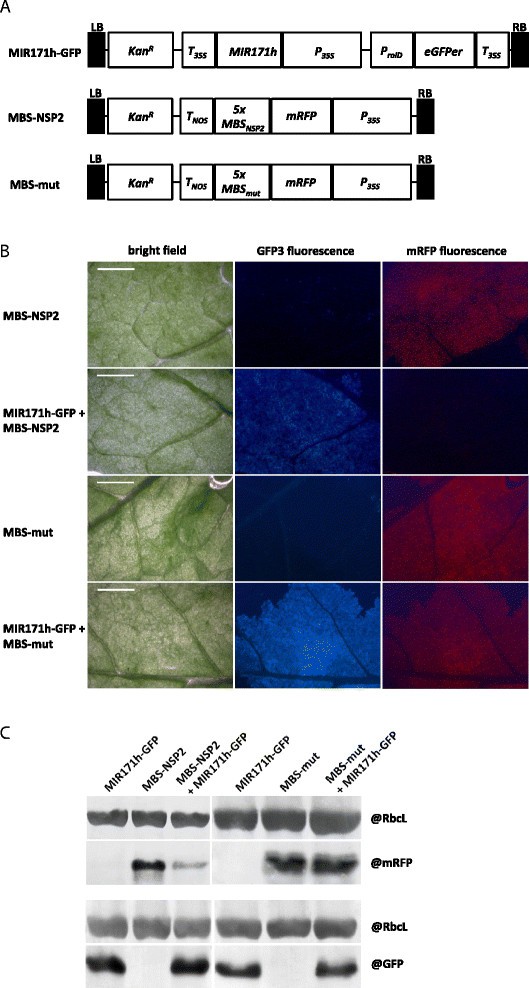
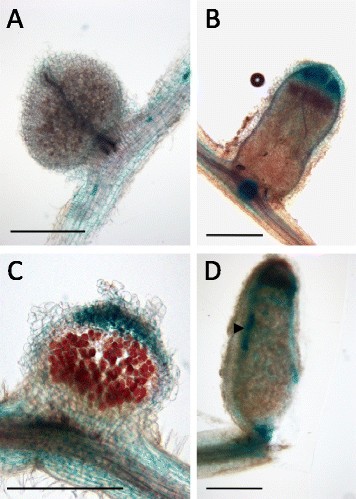
为了确认预测的miR171h 811 bp原始转录本的功能[[31]]以及沉默的可能性体内的NSP2,我们应用了miRNA传感器结构。应用了三种不同的结构(图1A).第一个构建物MIR171h- gfp包含一个811 bp的MIR171h原始转录本片段[[31]],由35s启动子构成表达。该结构包括一个独立的和构成性表达的eGFPer作为视觉转换控制。第二个构念,米iR171hb印第安纳州年代ite (MBS)-NSP2,代表实际的miRNA传感器。它由35s启动子驱动的mRFP融合到5个miR171h结合位点NSP2.作为对照,的MBSNSP2突变为打乱序列(MBS-mut),无法结合miR171h。这些构念用于根癌土壤杆菌监测-介导的烟叶浸润试验和浸润部位周围的mRFP荧光(图1B和附加文件1:图S1)。当MBS-NSP2与MIR171H-GFP共浸润时,mRFP荧光被消除。当MBS-mut和MIR171H-GFP共同浸润时,荧光恢复,这表明mRFP荧光的丢失是由于mir171h介导的传感器切割。与MBS-mut和单独浸润相比,MBS-NSP2共浸润MIR171H-GFP的烟叶中mRFP蛋白水平显著降低,导致荧光损失(图)1C和附加文件1:图S1)。这些结果证实了NSP2miR171h通过该miRNA特异性结合到其先前识别的结合位点进行调控,并且与先前的降解结果一致[[30.]]和RACE实验[[32]]。
在活的有机体内确认NSP2利用miR171h过表达和mRFP传感器构建miR171h基因沉默。(一)叶片渗透实验载体T-DNA结构。pK7WG2D中MiR171h过表达结构(MiR171h - gfp) [[37]]以及pGWB455中克隆的NSP2野生型(MBS-NSP2)或突变型miR171h (MBS-mut)结合位点的传感器结构[[38]]。左寄宿生,堪萨斯州R:卡那霉素耐药基因(nptII),诺帕林合成酶终止子,MIR171h: MIR171h初级转录本,P35个年代: 35S启动子,绿色荧光蛋白(GFP)盒(pRolD-EgfpER-t35S), 5xMBSNSP2: NSP2、5xMBS miR171h结合位点序列重复5次无足轻重的人: NSP2 miR171h结合位点序列突变5次重复。(B)miR171h过表达和mRFP传感器结构的共浸润。烟草benthamiana用MBS-NSP2或MBS-mut两种传感器结构对叶片进行渗透。对于每个传感器结构,与MIR171h-GFP结构进行共渗实验。请注意,由于mir171h介导的mRFP传感器切割,mRFP荧光下降。亮场图像,GFP3荧光和mRFP荧光显示。比例尺:5mm。(C)Western blot证实了NSP2序列中miR171h结合位点的分裂。从MIR171h-GFP、MBS-NSP2或MBS-mut以及这两种结构共浸润的叶片中提取蛋白质。图片的上半部分显示了检测到mRFP的western blot,表明传感器的存在;下图为western blot检测到GFP,间接提示miR171h的存在。在两个印迹中,RuBisCO蛋白被检测到,显示蛋白质样本的负载相等。
MiR171h和NSP2转录水平受根系共生状态和磷、氮水平的影响
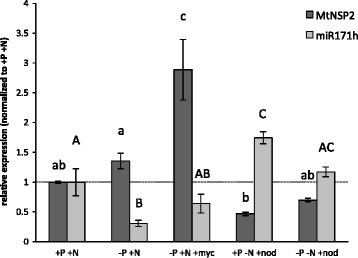
前人研究表明,miR171h是在菌根的根伸长区被诱导的NSP2在菌根中转录水平被轻微抑制[[32]]。此外,高磷酸盐营养直接诱导miR171h转录[[30.]]。研究基因的转录调控NSP2和miR171h,我们分析了两种转录水平对菌根共生和根结瘤的响应,以及在不同的磷肥和氮肥处理下。为此,我们将成熟miR171h的丰度与相对转录丰度进行了比较NSP2在正常到充分营养(+磷+氮)条件后(图2).正如预期的那样,饥饿磷酸盐抑制了miR171h的积累(P≤0.05),即受高磷酸盐条件的正向影响。在结瘤根中也增加,在这种情况下,氮饥饿进一步增强。这些结果表明NSP2和MIR171h对它们的转录有复杂的调控,这取决于根系的共生状态和营养施肥制度。
尽管miR171h表达增加,但菌根中NSP2转录水平升高
明显的反相关性(r =−0.98;p < 0.05)NSP2在除菌根条件外的所有条件下都存在积累(图2).在使用的条件下,NSP2与所有其他测试条件相比,在菌根根中显示最高的相对转录丰度。
研究miR171h和NSP2在AM共生发展的时间过程中,在菌根根中表达,进行了为期6周的实验,并分析了AM共生发展和功能的标记基因的RNA积累(附加文件1:图S2)。这清楚地表明,与施用条件(−P, +N)下的非菌根根相比,接种后2周,pri-miR171h在菌根根中的表达增加。此外,时间过程确认升高NSP2尽管miR171h积累增强,但菌根根中的转录本水平仍有所下降。因此,我们假设NSP2菌根中的转录本水平是由mir171h独立因子维持的。
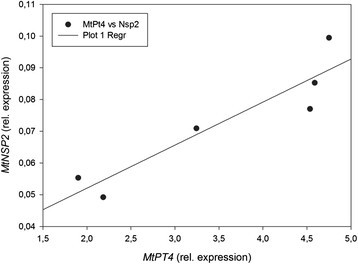
为了进一步研究NSP2我们分析了菌根根的转录水平NSP2转录水平与MtPt4单株植物的转录水平。MtPt4编码一种在含丛枝细胞中特异性表达的磷酸盐转运蛋白[[39]],可以被视为功能AM共生的标志。的正相关(r = 0.927, P < 0.01)NSP2而且MtPt4转录水平(图3.).这支持了一个假设NSP2由菌根依赖因子在菌根根中诱导。
高磷施肥对功能性共生结构的抑制与NSP2无关
在提供高磷酸盐浓度的植物中,MiR171h转录水平增加。此外,在高磷条件下,菌根定植往往比在缺磷条件下生长的植物减少,此外还导致功能较弱的共生结构,即丛枝[[28]、[40]]。因此,可以认为高磷条件下菌根共生的抑制依赖于miR171h-NSP2调节子。为了解决这个问题,我们接种了野生型和nsp2含有r . irregularis在磷酸盐饥饿(20 μM P我)或高磷酸盐(1mm P我)条件。在接种3周后,检测作为AM共生功能标志物的MtPT4转录水平。菌根野生型植物和nsp2在高磷施肥条件下,突变体MtPT4表达水平显著降低(附加文件)1:图S3),这表明两个系的功能性共生结构频率显著降低。因此,高磷施肥对菌根定植的抑制与NSP2.
高磷酸盐条件下miR171h的诱导表达不依赖于CRE1
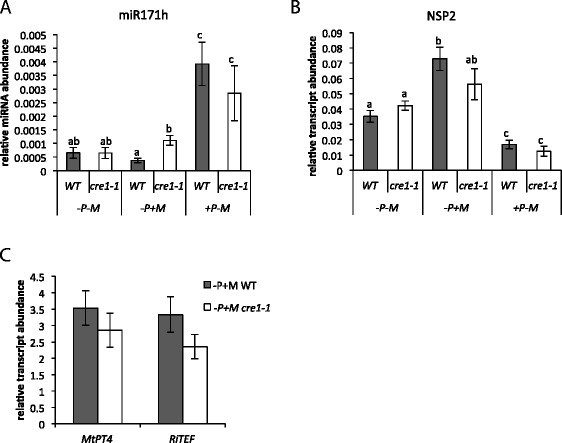
最近的一项研究独联体条例的规管要素NSP2发起人给出了证据NSP2,以及MIR171h,转录直接受细胞分裂素影响,并依赖于细胞分裂素受体CRE1[[33]]。分析高磷酸盐对miR171h的诱导作用NSP2在菌根根部的诱导依赖于CRE1我们研究了miR171h和细胞分裂素的相对表达水平NSP2在这两种情况下cre1-1突变型植物和野生型对照植物。
的cre1-1突变对肿瘤有微妙的影响NSP2与野生型植物相比,在菌根植物中表达增加(图4B).一方面,只有的增加NSP2与野生型植物相比,转录本丰度有统计学意义(P≤0.05)cre1-1植物型与野生型之间差异无统计学意义cre1-1菌根条件下的植物。这可能表明转录诱导NSP2在菌根中是不直接依赖根的CRE1,但我们不能排除这种可能性NSP2表达水平可能受到CRE1在丛枝菌根共生期间。我们还调查了cre1-1通过监测菌根标记基因的相对转录水平,研究AM共生关系MtPt4而且RiTEF[[3.]、[41]]。两种基因的表达水平在菌根间无差异cre1-1和野生型植物(图4C)接种后4周(wpi),说明cre1-1突变体在菌根发育过程中没有受损。这也得到了一个相似的相关性的支持NSP2而且MtPt4相对转录水平cre1-1与野生型植物相比(附加文件1:图S4)。相对于结节共生,其中CRE1明显参与miR171h和NSP2监管[[33]],这些结果并没有清楚地证明诱导NSP2在菌根中是由根直接介导的CRE1.
的cre1-1突变也不影响miR171h的磷酸盐依赖性调控NSP2转录丰富,对菌根诱导的表达没有影响NSP2以及丛枝菌根标记基因。成熟miR171h的相对表达(一)或NSP2(B)在不同磷肥和菌根条件下,WT植株(灰色条)和cre1-1植株(白色条)的根系中进行测定。-P: 20 μM磷酸盐,+P: 1 mM磷酸盐,- M:非菌根根,+M:菌根根。(C)菌根标记基因的相对表达MtPt4而且RiTEF在?中显示的同一植物的根物质中确定一个而且B(−p + m)。所有植株均收获4个wpi。对表达数据进行归一化,对照参考基因指数(MtPdf2而且MtEf1).所示数据为3-6个生物重复的平均值。误差条表示标准误差。不同字母表示有统计学差异(P < 0.05)。一个而且B:双向方差分析,采用Holm-Sidak多重比较。C:单向方差分析)。
这两个cre1-1而野生型植物在高磷胁迫下miR171h含量显著增加我与非菌根或菌根低磷相比(1 mM)我(20 μM)4A).在高磷条件下,两者miR171h相对丰度无显著差异cre1-1和野生型植物,说明磷酸诱导miR171h的表达不受介导CRE1.
报告融合证实了NSP2-和miR171h-启动子活性的复杂性和空间调控
NSP2和miR171h在菌根中的表达水平升高,提示这些转录本可能在根中存在空间分离。因此,我们使用启动子-报告子融合来定位MIR171h和的启动子活性NSP2在不同营养和共生条件下生长的根中。上游1248 bp的碎片NSP2编码序列和miR171h原始转录本上游900 bp的片段被融合到β-葡萄糖醛酸酶(GUS)报告基因上。两种启动子-报告子结构都转化为m . truncatula根的农杆菌属rhizogenes介导的转换。
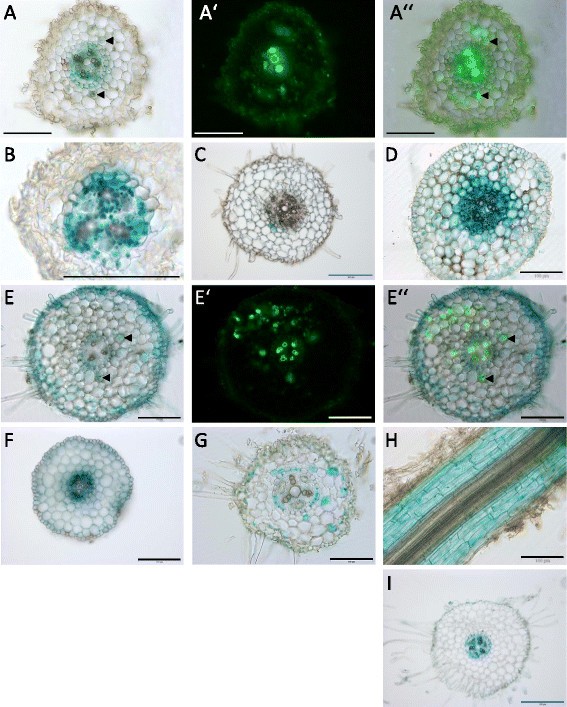
从转录本积累模式,MIR171h和启动子活性模式可以预期NSP2在不同的磷肥和硝酸盐处理下,土壤的土壤含水量发生了显著变化5).在磷酸盐饥饿时,MIR171h启动子主要活跃在中央柱体和内皮层(图5B).然而,在殖民与r . irregularis,微弱的GUS信号在不同的,但不是所有的,含有丛枝细胞(图5一个”)。的NSP2在磷酸盐饥饿过程中,启动子在中心柱体和内胚层也表现出较强的活性。此外,NSP2启动子在非菌根根的皮层细胞中表现出较弱的活性5F),而在菌根根中,在根的表皮细胞层、根毛和一些含有丛枝的细胞中观察到额外的强活性(图5E和E ")。
的NSP2miR171h启动子对营养物质和菌根定殖具有明显的调控作用。用MIR171h启动子- uida融合转化根(模拟)或者是NSP2(练习)启动子。在根转化后,将嵌合植物盆栽到基质中,在不同的营养条件下生长:磷酸盐饥饿(B及F)磷酸盐饥饿和菌根定殖(A及E),氮饥饿(C, G, H)或者完全营养(D和I).一个,一个“而且一个“还有E,E”而且E”表示相同的根节,用“/ E”显示WGA Alexafluor 488荧光来可视化r . irregularis结构和“/ E”显示亮场图像和WGA Alexafluor 488荧光叠加。比例尺表示100 μm(黑色、白色)或200 μm(蓝色)。箭头指示含有丛枝的皮质细胞GUS染色。
这一观察结果可能是上述转录丰度增加的合理解释NSP2在菌根的根部(图2和附加文件1:图S2)。在氮饥饿期间,除了一些孤立的皮层细胞外,没有观察到主要的mir171h启动子活性(图5C),这可能代表自发启动子活动或染色伪影。RNS中miR171h表达增加(图2)因此不是由于缺乏氮肥。与miR171h形成对比的是NSP2启动子在缺氮植物根系中表现出更为复杂的活性模式。部分树根露出来了NSP2启动子活性在皮层细胞和内胚层中呈明显随机模式(图5G),而在同一根的不同部位,整个皮层都观察到启动子活性(图5H).在充分营养条件下,MIR171h(图5D)和NSP2启动子(图5I)显示了相反的定位,MIR171h启动子在所有根细胞中都有活性,在中心柱中信号最强。反过来,NSP2启动子在根表皮和皮层无活性,而在中央柱体和内皮层有活性。启动子GUS在根切片中的研究结果见附加文件1:图S5。
接下来我们分析了MIR171h和的启动子活性NSP2在高磷环境下生长的植物根结节中,不含硝酸盐和接种Sinorhizobium meliloti.有代表性的年轻和成熟结节如图所示6.MIR171h启动子仅在年轻结节中表现出较弱的活性(图6A),但在成熟结节中,可以看到结节尖端的活性增加,与分生区相匹配的活性最强,在随后的侵染区和固氮区方向上逐渐减弱(图6B).值得一提的是,根瘤侧翼的根皮层细胞表现出较强的GUS活性,这与未接种对照根形成鲜明对比,对照根皮层中没有观察到启动子活性(图5C)。
的NSP2启动子在年轻结节和成熟结节中均有活性,在年轻结节尖端和成熟结节的维管束中活性最强(图6C和D)。与MIR171h启动子相似,该NSP2启动子在幼根瘤和成熟根瘤附近的根皮层也很活跃。
这些结果表明NSP2和MIR171h主要是互斥的,受磷酸盐和硝酸盐施肥以及根定殖的影响r . irregularis而且美国meliloti.
成熟的miR171h积累根结节的分生区
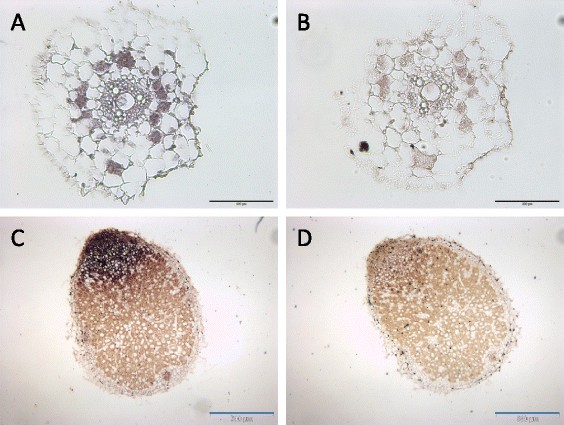
为了定位成熟miR171h在菌根和结瘤根中积累的位置,我们使用原位用mir171h特异性LNA探针杂交(图7).用打乱核苷酸序列的LNA探针作为阴性对照。与miR171h启动子活性的位置一致,我们发现成熟的miR171h在菌根根的中心柱体中积累(图7A)。我们在所有含丛枝的细胞中仅发现成熟miR171h积累的微弱信号,而miR171h启动子活性仅在不同的含丛枝的细胞中观察到(图5A).基于低信本比,无法明确判断其定位,但很可能在含有丛枝的细胞中。成熟miRNA在根结节中的定位与成熟结节中观察到的启动子活性模式一致。成熟的miR171h分子向结节分生区聚集,信号强度向感染区逐渐减弱。在固氮区未检测到miR171h的积累(图7C)。这些结果表明,miR171h的成熟积累与其转录的空间起源是一致的,并指出miR171h在根结节和可能含有丛枝的细胞中对靶标错表达具有保护作用。
miR171h过表达导致菌根定殖减少和结核数量减少
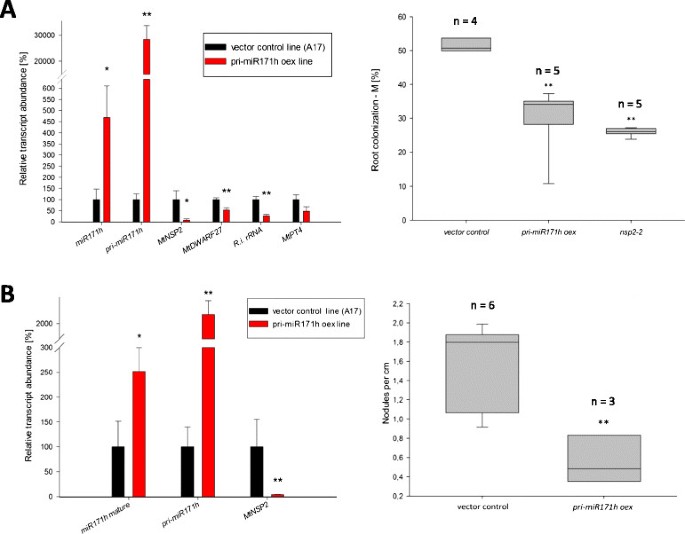
分析所观察到的空间调控的生物学功能NSP2和miR171h的转录,我们的miR171h在m . truncatula的根源。为此,m . truncatula用MIR171h-GFP构建物对根进行转化(图1),已用于叶片浸润试验,以驱动pri-miR171h的本构表达。用空矢量作为对照。根转化的植物要么接种r . irregularis或美国meliloti分析miR171h过表达对AMS和RNS的影响。接种后5周,pri-miR171h的过表达导致成熟miR171h的大量积累,从而导致miR171h的数量急剧下降NSP2转录水平(图8此外,我们还观察到MtDWARF27转录本丰度,这是的下游目标NSP2并且对于将独脚金内酯鄂罗芬酚转化为二脱氢鄂罗芬酚很重要[[12]]。有趣的是,我们发现根内rRNA水平显著降低r . irregularis但不是MtPt4转录水平,这是类似的不变MtPt4菌根的转录水平nsp2-2突变植物(附加文件1:图S4)。菌根表型的显微分析[[42]]显示菌根强度随之降低到与nsp2-2突变系(图8A),但在pri-miR171h过表达植株中未观察到灌木丛丰度的显著降低(附加文件)1:图S6)。这表明,过度积累成熟miR171h的植物根被菌根真菌定植的数量较少,而定植根区域的丛枝发育并未受到损害。此外,我们还发现过表达成熟miR171h的根与载体对照相比,结节数量显著减少8B)。
MIR171h异位过表达导致丛枝菌根和根结节共生的强烈抑制。根被转化为MIR171h-GFP(红色)或空载体(黑色)。在根转化后,嵌合植物被盆栽到基质中,并在不同的营养和共生制度下生长:(一)20 μM磷酸盐接种r . irregularis,(B)0 M硝酸盐接种美国meliloti.左窗格显示相对表达式值(归一化为MtPdf2而且MtEf1),右侧窗格显示共生参数的箱形图,即:(一)菌根定殖强度[[42]]和(B)每厘米主根长根瘤数。误差条表示标准误差。用学生t检验计算单星号(P < 0.05)或双星号(P < 0.01)表示过表达植物与对照植物之间有统计学差异。生物重复数在箱形图中表示。
综上所述,miR171h转录本在植物根中异位过表达m . truncatula导致了一种类似于nsp2-2菌根与结核共生期间的突变表型。
讨论
最近发现的一种mirna是metro - mir171h,它专门针对根内共生所必需的基因[[30.]]。
MiR171h后来被预测由一个811 bp长的原始转录本产生,编码其折叠结构单臂上的两个MiR171h位点[[31]]。在这项工作中,我们提供了miR171h从至少811 bp长的原始转录本中功能性表达的实验证明。劈理的NSP2miR171h转录本已通过基于race的方法验证[[30.]、[32]、[36]]。然而,到目前为止,miR171h的功能分析是使用主要鉴定的仅编码单个miRNA双工的部分前体进行的[[32]]。通过使用特定的mirna传感器结构n benthamiana我们可以确认叶片渗透试验已含有MIR171h的长双复合体主转录本具有生物活性。这表明Branscheid描述的长原始转录本et al。[[28]]类似于成熟miR171h的内源性来源m . truncatula.
miR171h的靶标,NSP2,是一种grass型转录因子,对根结节共生的形成至关重要[[13]、[43]、[44]],独脚金内酯生物合成[[12]]并参与myc因子信号通路[[7]]。最近的研究表明,miR171h过表达导致菌根根定殖减少[[32]]并且已被提出在丛枝菌根共生中具体起作用。miR171h的表达数据表明,该miRNA是由充分营养条件诱导的[[30.]],我们假设miR171h受植物磷酸盐状态的调控。拟南芥和油菜籽的数据并不表明miR171家族受磷和氮有效性的调控[[45]]。然而,本研究的数据有力地证明了miR171h的表达主要是由高磷酸盐利用率诱导的(图2).miR171家族成员的磷酸盐依赖性调控可能依赖于进行根内共生的能力,因为miR171h亚型仅存在于具有AMS能力的植物中[[27]、[32]]。在这些植物物种中是否有其他miR171家族成员对磷酸盐有反应尚不清楚。有趣的是,启动子GUS报告基因分析表明,miR171h的表达不仅仅受磷酸盐的调控本身而是通过磷酸盐和氮水平的结合,因为与充分营养条件相比,在高磷酸盐和低氮条件下,miR171h启动子的活性不存在(图5C和D)。
最近研究表明,miR171h的表达是由细胞分裂素诱导的,并且依赖于细胞分裂素CRE1途径[[33]、[46[]即…的损失CRE1导致细胞分裂素对miR171h的诱导缺失。因为我们知道P我氮肥增加了植物的细胞分裂素水平[[47]、[48]],并且在菌根植物的芽和根中也发现了升高的水平[文献35]。基于这些知识,我们假设miR171h在高磷酸盐条件下的表达水平可能取决于CRE1在这些植物中诱导细胞分裂素水平的直接影响。我们使用cre1-1突变植物系来解决这个问题。这些结果表明,miR171h的磷酸盐依赖性调控及其在菌根根中的适度诱导是不依赖的CRE1;后一种假设与的事实是一致的cre1-1突变对菌根标记基因表达及菌根定殖无统计学意义(图4C).综上所述,我们得出结论,miR171h的表达是由植物的磷酸盐状态以一种未知遗传因素控制的氮依赖方式调控的,此外还有先前证明的myc-LCOs的诱导作用[[32]]。
有趣的是,我们发现转录水平升高NSP2在菌根的根部(图2和附加文件1:图S2)接种后2 ~ 6周。与miR171h相似,表达NSP2细胞分裂素在aCRE1在高磷酸盐和低氮条件下的-依赖方式[[33]]。然而,的介入CRE1在归纳中NSP2低磷高氮条件下菌根根部转录物丰度不如上述细胞分裂素处理时明显(图4B).因此,我们假设这种上调是由未知因素介导的,不涉及细胞分裂素感知本身。我们不能排除潜移默化的影响CRE1在NSP2在丛枝菌根共生期间的表达,虽然菌根定殖本身显然不依赖CRE1通路。所观察到的NSP2与非菌根根相比,菌根根表皮细胞层中观察到的额外启动子活性最有可能导致转录水平升高(图5E和F)和缺乏MIR171h启动子活性(图5A).我们不能排除这种现象是由于缺乏适当装载的Argonaute蛋白(RNA诱导沉默复合体(RISC)的主要成分)与成熟的miR171h,但由于缺乏对抗的抗体m . truncatula与AGO1同源,这一假设有待检验。此外,NSP2最好是通过翻译抑制而不是转录后抑制[[19]],这将使稳态转录丰度保持不变。然而,由于miR171h-的互斥表达模式NSP2下面讨论的菌根共生过程中的目标对,我们赞成上述解释。然而,我们的观察诱发了NSP2在菌根条件下的表达与先前发表的Lauressergues的结果相反等.[[32]],他们观察到NSP2菌根根的转录水平。造成这种差异的确切原因尚不清楚,但我们可以证明,我们的结果在3个独立的实验中是一致的:(I)通过qRT-PCR检测NSP2接种3周后基于材料的转录水平如图所示2(II)通过qRT-PCR测量,基于补充文件中提出的6周以上时间过程的材料1:图S2和(III),采用qRT-PCR方法测定cre1-1突变体,携带WT基因,接种后4周见图4.此外,根据图中所示的测量,从单个植物获得的单个数据点的相关性4之间的正相关MtPt4(作为灌木丛丰度的衡量标准)和NSP2.此外,我们重新研究了公开可用的微阵列数据集,这些数据集保存在Medicago基因表达图谱v3 (MtGEA;http://mtgea.noble.org)使用探测器Mtr.44789.1。S1_at,对应于NSP2.虽然戈麦斯的数据等.[[49]]显示在菌根条件下NSP2最多略有增加,Hogekamp的数据也没有减少et al。[[50]]显示,在6周的殖民后,探针的信号强烈增加r . irregularis或血管球mosseae与20 μM处理的对照条件相比,2 mM Pi处理的响应明显下降。Hogekamp补充数据分析et al。[[50的增加更详细地揭示了NSP2表达r . irregularis经过处理的根有0.7 (p值= 0.02)的log2倍变化g . mosseae0.84 (p值= 0.008),这表示大约1.7倍的诱导NSP2这不仅与我们的数据一致,有力地支持了我们的结果,而且表明这种反应在与AM共生相互作用中是保守的g . mosseae.在戈麦斯的数据中有轻微的归纳et al。[[49]]并不重要,Lauressergueset al。[[32的减少NSP2水平在r . irregularis显然,至少还有一个未知因素参与miR171h-NSP2靶对的调控。这可能涉及到miR171h靶基因的特异性调控[[30.]、[32]]在本研究中没有进行研究,可能最好是用miR171h而不是NSP2在我们测试的条件下。未来将详细分析其从启动子到蛋白水平的空间表达模式,后者也有说明NSP2,可能会让我们对这个难题有所了解。
当比较MIR171h-和NSP2-启动子,很明显,它们主要表现为互斥的表达模式,特别是在充分营养(皮层和根表皮)和菌根条件下(根表皮)。miR395-SULTR2;1 miRNA靶对也描述了这种模式[[51]]并且最有可能的功能是阻止特定组织和细胞类型中自发启动子活动产生的转录产物的表达,这种机制称为启动子抑制[[18]]。该模型适用于miR171h-NSP2目标对与35S驱动表达miR171h的异位错误表达结果一致,导致miR171h的表达量急剧下降NSP2转录本水平和菌根定殖(本研究和[[32]]),以及35S驱动的抗mir171h NSP2版本的异位错表达导致根系和根尖的过度定殖,而野生型的异位错表达NSP2可被miR171h裂解的转录本不存在[[32]]。这种互斥的表达模式在充分营养条件下尤其明显,miR171h在所有根组织中都强烈表达NSP2除中心气缸外,启动子完全不活动。这就假设工厂需要全面保证严密NSP2在营养充足的植物的根中控制表达,以避免根结节的形成和AM共生,特别是在营养充足的情况下。尽管我们不能排除高磷施肥诱导miR171h通过限制对菌根抑制产生影响的可能性NSP2我们排除了这种效应仅仅依赖于miR171h,因为nsp2-2植物仍然响应高磷酸盐处理抑制菌根定殖(附加文件1:图S4)尽管NSP2依赖调控在基因上被敲除,这表明其他调控回路对miR171h-起上位性作用NSP2调节电路。此外,最近的一项重要发现是NSP2与另一种grass型转录因子RAM1相互作用,RAM1通过控制RAM1的表达对菌根定殖和菌丝足形成至关重要RAM2[[15]、[16]]。RAM2是一种甘油-3-磷酸酰基转移酶,它催化角质单体生成的一个重要步骤,似乎是促进菌丝附着在植物根上的重要分子,因此也可以被丝状致病真菌劫持。疫霉palmivora[[16]]。因此,可以假设miR171h的互斥表达模式已经进化为避免劫持NSP2病原体的信号通路,只创造一个狭窄的条件窗口,允许形成有益的共生相互作用,可能依赖于一个有益的共生伙伴先前的信号。因此,我们得出结论,miR171h作为启动子阻尼器,在不同的营养和共生条件下保护特定的根细胞类型NSP2错误表达为互斥表达模式,而整体转录本丰度为NSP2在野生型Medicago truncatula丛枝菌根真菌定殖的根主要由其启动子活性决定,而不是由miR171h直接切割。
除了启动子抑制外,miRNA-靶对经常看到的其他miRNA调控电路是空间限制和时间调节[[18]]。miR169在调控根结节发育方面的重要空间限制类型已被记录在案m . truncatula[[25]]。在那里,miR169限制其靶标的表达MtHAP2-1到根结节的分生区,以使根结节正确成熟。我们的研究数据表明,与上面讨论的分离表达模式相比,空间限制似乎是miR171h在根结节发育过程中的主要调控机制。在根结节中,MIR171h和NSP2启动子呈重叠的空间分布(图6),连同NSP2启动子在整个结节中都是活跃的。MIR171h的转录和积累局限于分生区现场杂交(图7).长miR171h初级转录本异位过表达导致根结节数量显著减少(图8),因此可以证明miR171h过表达抑制根结节共生,除了其所描述的限制菌根定殖的能力外[[32]]。此外,De Luis最近的一项研究et al。[[36]]在l .对虾在确定的根结节中发现了miR171h的同源物,lja-miR171c,其目标相似LjNSP2.它在结节中的表达依赖于Mesorhizobium洛蒂这表明miR171h表达的调控比之前认为的要复杂。之前尝试过表达miR171h和miR171cm . truncatula而且l .对虾失败,这可以用35S启动子的使用来解释,在包含丛枝的细胞中,35S启动子似乎减少了[[52]]和根结节[[53]、[54]]从而可能导致结果的变化。我们所展示的表型可能是miR171h过表达的剂量依赖效应所解释的,因为本研究中使用的主要转录本编码了两个miR171h双偶[[31]],因此最大丰度可能翻了一番,平衡了根结节中较低的35S活性。综上所述,我们的数据为miR171h可以直接影响根结节共生提供了深刻的证据,我们假设miR171h可以保护植物的根免受NSP2不确定结节分生区错误表达,从而防止细菌侵入该组织,类似于保护根尖不被菌根真菌定植[[32]]。
结论
我们的数据显示,miR171h和NSP2与植物的营养状况密切相关,反映了不同的生理条件下,这两种类型的内共生是有利的宿主豆科植物。结合过表达分析的结果,我们的数据指出了miR171h的重要功能,即整合营养稳态,以保障蛋白的表达NSP2其间,丛枝菌根与根瘤共生。
方法
植物材料和生长条件
的种子Medicago truncatula简历。第A17 Jemalong (),nsp2-2而且cre1-1突变株按照[[28]]。幼苗生长在石英砂(0.6 - 1.2 mm)、蛭石和膨胀粘土基质(7:1:1 [v/v])中,光照16小时(25°C),每周施肥两次,用含有20 μM Pi的半倍Hoagland溶液。在高Pi条件下,溶液中含有1mm Pi,在N限制下的实验中,Ca(NO3.)2了解3.被CaCl2和KCl。为了菌根定殖,幼苗接种r . irregularis通过将底材与底材的10% (v/v)混合而成韭葱作为寄主植物进行繁殖r . irregularis至少两个月。用于分析的植物在结果部分所示的时间点收获,根系的代表性部分用WGA-Alexa Fluor 488 (Invitrogen)染色,以估计菌根定殖。剩余的根立即冷冻在液氮中,并立即用于总RNA提取或储存在−80°C。
分子克隆
pri-miR171h的811 bp片段位于基因组位置31,405,065。3号染色体31,404,255 (Mt3.5) [[31]]被克隆到花椰菜花叶病毒35S(短35S)驱动二进制载体pK7WG2D [[37]]。由此产生的结构物被命名为MIR171h-GFP。
Eurofins®(MWG®Operon)通过基因合成获得MtNSP2的miR171h结合位点和miR171h不可切割序列(scramble),并将其克隆到35S驱动的二进制载体pGWB455 [[55]]用于n端mRFP蛋白融合,从而分别构建MBS-NSP2或MBS-mut。两个序列都包含mRFP帧中的停止密码子。
从野生型中分别扩增出起始密码子上游900 bp和1248 bp的mtr-miR171h和MtNSP2启动子区(Medicago truncatula简历。将Jemalong)基因组DNA克隆到含有GFP:GUS融合蛋白的二元载体pKGWFS7中,由插入载体驱动。
根系转化和叶片渗透试验
根转化前对种子进行表面消毒(12 min conc。H2所以4, 5 min 6% NaClO),在0.8% [w/v]水琼脂上萌发(黑暗2天,4℃,黑暗2天,25℃)。
的根Medicago用农杆菌属rhizogenes(ARqua1),由[[56]]。简而言之,用无菌刀片切根,受伤部位浸在2天的培养皿上答:rhizogenes培养后,转移到0.8% [w/v]水琼脂中,在黑暗中培养2天,然后转移到含有25 μg/ml卡那霉素的选择性法氏培养基中,在phytotron中培养3周(12 h/12 h明暗循环)。
采用4周龄烟叶浸渍试验烟草benthamiana花期前的植物。所有实验都在三个独立的工厂中进行了两次。在渗透前用水使烟草植株饱和2-4小时。根癌土壤杆菌(GV2260)接种于含有适当抗生素的20 ml YEB培养基中,在28°C和250 rpm的黑暗条件下培养2天。培养物在50ml falcon试管中,以4000转/分(Eppendorf, 5804)离心15分钟,再悬浮在含有10 mM MES, 10 mM MgCl的冰冷AS培养基中2, 150 μM乙酰丁香酮pH 5.6,稀释至OD600在室温下,在轻摇(~50转/分钟)下,进一步孵育3小时。将含有不同结构的农杆菌培养物在渗透前1:1混合,以共渗透方式进行渗透。对于单个结构物浸润事件,将含有各自结构物的农杆菌与空农杆菌1:1混合。将每片烟叶按[[]的方法向烟叶背面注入约500 μl。57]]。植物在中等光照条件下再生长3天,然后检查报告蛋白的荧光。
接种与Sinorhizobium meliloti
接种的m . truncatula根与美国meliloti菌株1021按照[[30.]]。
RNA提取
根据制造商的协议,使用miRVANA miRNA分离试剂盒(Ambion)和先前的植物隔离辅助步骤(Ambion)提取RNA。
RT-和qRT-PCR分析
定量RT-PCR分析如前所述[[30.]]。简言之,qRT-PCR分析在10 μl的反应体积下进行。将cDNA稀释1:10,用1 μl进行反应。该混合物含有4 μl 0.5 μM引物对混合物和5 μl Maxima™SYBR Green/ROX qPCR Master mix (Fermentas)。qRT-PCR机ABI Prism 7900 HT (Applied Biosystems)用于以下反应设置:第一步95°C 10分钟,40个循环95°C 15秒,60°C 60秒,交替进行。最后,采用解离阶段(95°C 15秒,60°C 15秒加热,升温速率2%至95°C 15秒)进行熔化曲线分析。使用SDS 2.4 (Applied Biosystems)和SigmaPlot v.12收集和分析数据(Systat)。ct值的阈值设置为0.2,并对所有实验进行自动基线校正。的ct值的平均值MtEF1 -α,MtPDF2而且MtGAPDH用于计算内务基因指数(HK-index),用于转录丰度的归一化。功能共生结构是通过测量MtPt4转录本丰度[[3.]],相对定殖水平通过测量RiTEF转录本丰度[[41]]。
原位用DIG标记的LNA探针杂交
的原位如前所述进行杂交[[30.]]。在将根和结节包埋石蜡前,用固定剂(4%多聚甲醛PBS, pH7)在真空下固定。针对mtr-miR171h的LNA探针由Exiqon公司定制设计。
GUS染色和根切片
β-葡萄糖醛酸酶(GUS)活性测定miR171h和NSP2启动子活性见[[58]、[59]]。如前所述,植物在不同的条件下生长,并在4个wpi后收获。去除芽,根在含有100 mM NaPO的GUS染色缓冲液中培养41mm K3.[Fe (CN)6, 1 mM K4[Fe (CN)6], 10 mM EDTA和5-溴-4-氯-3-吲哚基葡萄糖苷,pH为7,在37°C下的不同时间尺度,如所示。根在4% [w/v]琼脂糖中嵌入,用Leica VT 1000S振动仪(Bensheim, Germany)获得40 μm厚的横切面和纵切面。
显微分析
切片图像是使用奥林巴斯BX41显微镜和cellP软件(奥林巴斯,汉堡,德国)使用不同的变焦物镜生成的。
烟草叶片图像采用立体荧光显微镜MZ 16FA(徕卡),PLANATO 1×物镜(DC-DFC 300FX 1.3 MP, M.115×)。荧光蛋白用汞金属卤化物灯泡激光激发,GFP荧光用GFP3过滤系统(激发:470/40 nm,屏障:525/50 nm)过滤,mRFP荧光用DsRED过滤系统(激发:545/30 nm,屏障:620/60 nm)过滤。除了没有使用激光束或滤镜外,用相同的设置拍摄了亮场图像。荧光照片曝光时间为9秒,增益为5,变焦系数为11.4倍。过滤器在不改变设置的情况下连续移动。图像数据使用徕卡LAS-AF 2.8.1版进行处理。
菌根参数测定
菌根定殖参数Medicago使用Alexa Fluor®488染料根据[[60]]。在90°C下,用10% [w/v] KOH清除根系5分钟。根在含有137 mM NaCl, 2.7 mM KCl, 12 mM Na的Alexa Fluor染色液中室温孵育至少24小时2HPO4/ KH2阿宝40.01% [w/v] Alexa Fluor®488小麦胚芽凝集素(Invitrogen),然后在显微镜载玻片上安装前清洗5次。菌根参数由[[42]]分别为F%:菌根频率,M%:每根菌根强度,M%:每根碎片菌根强度A%:每根丛枝强度,A%每根碎片丛枝强度。
蛋白质提取和western blotting
蛋白提取和western blotting如前所述[[61]]。使用Bradford试剂盒(Biorad)测定蛋白浓度,并按照制造商的方案提供γ-球蛋白标准。
蛋白质用均质缓冲液(100 mM HEPES, 10% [v/v]甘油,5 mM二硫四醇,1片cOmplete™ULTRA片(罗氏)/ 10 ml缓冲液pH 7.5)稀释至最终浓度1.5 μg/μl。将10 μl蛋白质溶液与10 μl 2 × SDS样品缓冲液(125 mM Tris, 20% [v/v]甘油,4% [w/v] SDS, 0.01% [w/v]溴酚蓝,40 μM DTE)混合,在95℃下孵育5 min。样品在14000 g下离心1分钟(4°C),然后在1mm 12% SDS聚丙烯酰胺凝胶上分解。半干印迹按照Immobilon®-P转移膜(Millipore™)用户指南中的描述进行组装。将印迹拆解,膜进一步用于免疫染色。GFP和mRFP检测分别使用1:2500和1:1000稀释抗GFP(兔,GenScript)和抗mRFP(兔,Abcam®)。作为负载对照,在每个抗体溶液中添加1:10 000稀释的抗RubisCO抗体(兔,Agrisera™)。二抗兔碱性磷酸酶(Abcam®)抗体稀释1:5000。为了可视化,使用了现成的NBT/BCIP溶液(Roche®)。膜干燥后用爱普生perfect 4870扫描仪(爱普生扫描3.0软件)扫描。 RubisCO, mRFP and GFP were identified by comparison to a pre-stained protein size marker (Thermo Scientific).
额外的文件
参考文献
Harrison MJ:丛枝菌根共生的分子和细胞方面。植物化学学报,1999,30(3):366 - 366。10.1146 / annurev.arplant.50.1.361。
植物根和菌根界面磷素吸收的功能生物学。环境科学学报,2007,29(3):344 - 344。10.1111 / j.1469-8137.2006.01935.x。
Javot H, Penmetsa RV, Terzaghi N, Cook DR, Harrison MJ: AMedicago truncatula在丛枝菌根共生中不可缺少的磷酸盐转运体。中国科学院学报,2007,29(2):344 - 344。10.1073 / pnas.0608136104。
Pumplin N, Harrison MJ:活细胞成像显示丛丛膜周围区域和细胞器的位置Medicago truncatula丛枝菌根共生期间的根。植物科学进展,2009,29(3):344 - 344。10.1104 / pp.109.141879。
奥尔德罗伊德·GE:说,朋友,进来:促进植物有益共生关系的信号系统。中华微生物学杂志,2013,11:252-263。10.1038 / nrmicro2990。
Akiyama K, Matsuzaki K, Hayashi H:植物倍半萜烯诱导丛枝菌根真菌菌丝分枝。自然科学学报,2005,34(3):344 - 344。10.1038 / nature03608。
Maillet F, Poinsot V, Andre O, puich - pages V, Haouy A, Gueunier M, Cromer L, Giraudet D, Formey D, Niebel A, Martinez EA, Driguez H, Becard G, Denarie J:真菌脂壳寡糖共生信号的研究。自然科学学报,2011,29(3):344 - 344。10.1038 / nature09622。
林文文,林思,邱天杰:植物磷酸盐稳态的分子调控因子。应用物理学报,2009,30(2):344 - 344。10.1093 / jxb / ern303。
Lopez-Raez JA, Charnikhova T, Gomez-Roldan V, Matusova R, Kohlen W, De Vos R, Verstappen F, Puech-Pages V, Becard G, Mulder P, Bouwmeester H:番茄单脚金内酯来源于类胡萝卜素,其生物合成由磷酸盐饥饿促进。中国生物工程学报,2008,29(3):344 - 344。10.1111 / j.1469-8137.2008.02406.x。
Yoneyama K, Yoneyama K, Takeuchi Y, Sekimoto H:红三叶草缺磷促进菌根共生体信号和根寄生虫萌发促进剂orobanchol的分泌。植物学报,2007,25(3):344 - 344。10.1007 / s00425 - 006 - 0410 - 1。
Umehara M, Hanada A, Yoshida S, Akiyama K, Arite T, Takeda-Kamiya N, Magome H, Kamiya Y, Shirasu K, Yoneyama K, Kyozuka J, Yamaguchi S:新型萜类植物激素对枝条分枝的抑制作用。自然科学进展,2008,37(3):344 - 344。10.1038 / nature07272。
Liu W, Kohlen W, Lillo A, Op den Camp R, Ivanov S, Hartog M, Limpens E, Jamil M, Smaczniak C, Kaufmann K, Yang WC, Hooiveld GJ, Charnikhova T, Bouwmeester HJ, Bisseling T, Geurts R:直脚金内酯生物合成Medicago truncatula而水稻则需要共生的grass型转录因子NSP1而且NSP2.植物学报,2011,23:3853-3865。10.1105 / tpc.111.089771。
Kalo P, Gleason C, Edwards A, Marsh J, Mitra RM, Hirsch S, Jakab J, Sims S, Long SR, Rogers J, Kiss GB, Downie JA, Oldroyd GE:豆科植物的结瘤信号需要NSP2它是转录调节因子GRAS家族的一员。科学通报,2005,30(4):344 - 344。10.1126 / science.1110951。
Smit P, Raedts J, Portyanko V, Debelle F, Gough C, Bisseling T, Geurts R:NSP1对根瘤菌Nod因子诱导的转录至关重要。科学通报,2005,30(4):379 - 379。10.1126 / science.1111025。
Gobbato E, Marsh JF, Vernie T, Wang E, Maillet F, Kim J, Miller JB, Sun J, Bano SA, Ratet P, Mysore KS, Denarie J, Schultze M, Oldroyd GE:一种在菌根信号传导中具有特定功能的grass型转录因子。中国生物医学工程学报,2012,22:2236-2241。10.1016 / j.cub.2012.09.044。
王娥,Schornack S, Marsh JF, Gobbato E, Schwessinger B, Eastmond P, Schultze M, Kamoun S, Oldroyd GE:一种促进植物菌根和卵菌定植的常见信号过程。中国生物医学工程,2012,22:2242-2246。10.1016 / j.cub.2012.09.043。
Oldroyd GE, Harrison MJ, Paszkowski U:植物细胞内共生的重编程。科学通报,2009,34(3):344 - 344。10.1126 / science.1171644。
Voinnet O:植物microRNAs的起源、生物成因和活性。细胞学报,2009,36(3):369 - 387。10.1016 / j.cell.2009.01.046。
Brodersen P, Sakvarelidze-Achard L, Bruun-Rasmussen M, Dunoyer P, Yamamoto YY, Sieburth L, Voinnet O:植物mirna和sirna的广泛翻译抑制。科学通报,2008,32(3):344 - 344。10.1126 / science.1159151。
陈鑫:发育中的小rna——来自植物的见解。中国生物医学工程学报,2012,22:361-367。10.1016 / j.gde.2012.04.004。
李玉峰,李晓峰,李晓峰,王晓明,等:微rna在植物胁迫响应中的作用。植物科学进展,2012,17:196-203。10.1016 / j.tplants.2012.01.010。
杨晓燕,王晓燕,王晓燕,王晓燕。植物小分子rna在非生物胁迫中的作用及其机理研究。中华生物医学杂志,2011,9:183-199。
王志刚,王志刚,王志刚。植物microRNAs的研究进展。中国生物医学工程学报,2012,27(3):344 - 344。10.1002 / jcp.24052。
Sun G: MicroRNAs及其在植物中的多种功能。植物分子生物学杂志,2012,30(4):344 - 344。10.1007 / s11103 - 011 - 9817 - 6。
Combier JP, Frugier F, de Billy F, Boualem A, El-Yahyaoui F, Moreau S, Vernié T, Ott T, Gamas P, Crespi M, Niebel A:MtHAP2-1是由microRNA169调控的共生结节发育的关键转录调控因子Medicago truncatula.基因工程学报,2006,30(4):344 - 344。10.1101 / gad.402806。
boalem A, Laporte P, Jovanovic M, Laffont C, Plet J, Combier JP, Niebel A, Crespi M, Frugier F: MicroRNA166控制根和结节发育Medicago truncatula.植物学报,2008,29(4):344 - 344。10.1111 / j.1365 - 313 x.2008.03448.x。
杨晓明,王晓明,王晓明,王晓明,等。mirna在植物根系共生中的调控作用。中国生物医学工程学报,2012,27(3):457 - 457。10.1098 / rstb.2011.0228。
Branscheid A, Sieh D, Pant BD, May P, Devers EA, Elkrog A, Schauser L, Scheible WR, Krajinski F:表达模式表明MiR399在丛枝菌根共生过程中调控细胞对局部Pi升高的反应。植物与微生物相互作用,2010,23:915-926。10.1094 / mpmi - 23 - 7 - 0915。
顾敏,徐坤,陈安,朱勇,唐刚,徐刚:微rna在植物磷酸盐和丛枝菌根信号通路中的表达分析茄属植物lycopersicum.中国生物医学工程学报,2010,38(3):344 - 344。10.1111 / j.1399-3054.2009.01320.x。
Devers EA, Branscheid A, May P, Krajinski F:星星与共生:参与丛枝菌根共生的microRNA-和microRNA*介导的转录本裂解。中国生物医学工程学报,2011,29(3):344 - 344。10.1104 / pp.111.172627。
Branscheid A, Devers EA, May P, Krajinski F:小RNA和降解reads的分布模式提供了miRNA基因结构和调控的信息。植物学报,2011,6:1609-1611。10.4161 / psb.6.10.17305。
Lauressergues D, Delaux PM, Formey D, lelandaiss - briere C, Fort S, Cottaz S, Becard G, Niebel A, Roux C, Combier JP: microRNA miR171h调节丛枝菌根定殖Medicago truncatula通过瞄准NSP2.植物学报,2012,27(3):344 - 344。10.1111 / j.1365 - 313 x.2012.05099.x。
Ariel F, Brault- hernandez M, Laffont C, Huault E, Brault M, Plet J, Moison M, Blanchet S, Ichante JL, Chabaud M, Carrere S, Crespi M, Chan RL, Frugier F:细胞分裂素信号通路调节共生结瘤的两个直接靶点Medicago truncatula.中国生物医学工程学报,2012,29(3):344 - 344。10.1105 / tpc.112.103267。
Gonzalez-Rizzo S, Crespi M, Frugier F: The截叶苜蓿CRE1细胞分裂素受体调节侧根发育和早期共生相互作用Sinorhizobium meliloti.植物科学学报,2006,18:2680-2693。10.1105 / tpc.106.043778。
张志刚,张志刚,张志刚。植物生长素和细胞分裂素在菌根共生中的作用。植物学报,2000,19:144-154。
De Luis A, Markmann K, Cognat V, Holt DB, Charpentier M, Parniske M, Stougaard J, Voinnet O:两种与豆科植物根瘤感染和固氮能力相关的micrornaLotus对虾.中国生物医学工程学报,2012,29(4):457 - 457。10.1104 / pp.112.204883。
王志强,王志强,王志强。农杆菌介导植物转化的GATEWAY载体研究。植物科学进展,2002,7:193-195。10.1016 / s1360 - 1385(02) 02251 - 3。
Nakagawa T, Kurose T, Hino T, Tanaka K, Kawamukai M, Niwa Y, Toyooka K, Matsuoka K, Jinbo T, Kimura T:开发一系列网关二元载体pGWBs,实现植物转化融合基因的高效构建。中国生物工程学报,2007,34(4):344 - 344。10.1263 / jbb.104.34。
刘娟,刘建军,刘建军:一种磷酸转运蛋白Medicago truncatula参与获得丛枝菌根真菌释放的磷酸盐。植物科学学报,2002,26(4):344 - 344。10.1105 / tpc.004861。
Breuillin F, Schramm J, Hajirezaei M, Ahkami A, Favre P, Druege U, Hause B, Bucher M, Kretzschmar T, Bossolini E, Kuhlemeier C, Martinoia E, Franken P, Scholz U, Reinhardt D:磷酸盐系统抑制丛枝菌根发育佩妮矮牵牛并抑制与菌根功能有关的基因。植物学报,2010,44(3):344 - 344。10.1111 / j.1365 - 313 x.2010.04385.x。
Helber N, Wippel K, Sauer N, Schaarschmidt S, Hause B, Requena N:一种在丛枝菌根真菌中起作用的多功能单糖转运体血管球sp对植物的共生关系至关重要。中国生物医学工程学报,2011,29(3):344 - 344。10.1105 / tpc.111.089813。
Trouvelot A, Kough JL, Gianinazzi-Pearson V:真菌化措施VA d 'un système激进。研究méthodes估计意义函数。菌根:生理与遗传。编辑:Gianinazzi- pearson V, Gianinazzi S. 1986, INRA出版社,巴黎,217-221。
赫克曼AB,隆巴多F,米瓦H,佩里JA,邦内韦尔S,帕尼斯克M,王TL,唐尼JA:Lotus对虾结瘤需要两个GRAS结构域调控因子,其中一个在非豆科植物中功能保守。中国农业科学,2006,29(4):457 - 457。10.1104 / pp.106.089508。
Murakami Y, Miwa H, Imaizumi-Anraku H, Kouchi H, Downie JA, Kawaguchi M, Kawasaki S:位置克隆鉴定莲花NSP2,一种假定的GRAS家族转录因子,需要外祖母而且与结节起始的基因表达。DNA, 2006, 13: 255-265。10.1093 / dnares / dsl017。
Pant BD, Musialak-Lange M, Nuc P, May P, Buhtz A, Kehr J, Walther D, Scheible WR:基于实时聚合酶链反应分析和小RNA测序的拟南芥和油菜籽microrna鉴定。植物科学学报,2009,30(4):344 - 344。10.1104 / pp.109.139139。
Plet J, Wasson A, Ariel F, Le Signor C, Baker D, Mathesius U, Crespi M, Frugier F:MtCRE1依赖性细胞分裂素信号整合细菌和植物信号以协调共生结节的器官发生Medicago truncatula.植物学报,2011,29(3):344 - 344。10.1111 / j.1365 - 313 x.2010.04447.x。
Salama AMSEA, Wareing PF:矿物质营养对向日葵内源性细胞分裂素的影响(向日葵L).应用物理学报,1997,30:971-981。10.1093 / jxb / 30.5.971。
郭志刚,李志刚,李志刚:细胞分裂素浓度对紫花苜蓿根系生长及根冠比的影响大车前草多精植物在不同的营养条件下。土壤学报,1998,18(3):344 - 344。10.1007 / BF02139944。
Gomez SK, Javot H, Deewatthanawong P, Torres-Jerez I, Tang Y, Blancaflor EB, Udvardi MK, Harrison MJ:Medicago truncatula而且血管球intraradices丛枝菌根共生中丛枝皮层细胞的基因表达。中国生物医学工程学报,2009,29(3):344 - 344。
Hogekamp C, Arndt D, Pereira PA, Becker JD, Hohnjec N, Kuster H:激光显微解剖揭示了丛枝菌根中细胞类型特异性转录,包括与真菌接触和传播相关的CAAT-box转录因子基因表达。中国生物医学工程学报,2011,27(3):344 - 344。10.1104 / pp.111.186635。
Kawashima CG, Yoshimoto N, Maruyama-Nakashita A, Tsuchiya YN, Saito K, Takahashi H, Dalmay T:硫饥饿诱导microRNA-395及其一个靶基因的表达,但在不同的细胞类型中。植物学报,2009,29(3):344 - 344。10.1111 / j.1365 - 313 x.2008.03690.x。
彭普林,张晓霞,张晓霞,张晓明:一种共生特异性磷酸转运蛋白的极性定位是由短暂的分泌物重定向介导的。中国环境科学学报,2012,29(2):366 - 366。10.1073 / pnas.1110215109。
Horvath B, Yeun LH, Domonkos A, Halasz G, Gobbato E, Ayaydin F, Miro K, Hirsch S, Sun J, Tadege M, Ratet P, Mysore KS, Ane JM, Oldroyd GE, Kalo P:Medicago truncatulaIPD3是根瘤菌和菌根共生所必需的共同共生信号通路的成员。植物与微生物相互作用,2011,24:1345-1358。10.1094 / mpmi - 01 - 11 - 0015。
模型豆科植物的结瘤研究Medicago truncatula:使用本构的优点EF1alpha在结节组织中检测荧光报告蛋白的启动子和局限性。植物与微生物相互作用,2007,20:1040-1047。10.1094 / mpmi - 20 - 9 - 1040。
Nakagawa T, Suzuki T, Murata S, Nakamura S, Hino T, Maeo K, Tabata R, Kawai T, Tanaka K, Niwa Y, Watanabe Y, Nakamura K, Kimura T, Ishiguro S:改进的网关二进制载体:在植物转基因分析中创建融合结构的高性能载体。生物工程学报,2007,29(3):349 - 349。10.1271 / bbb.70216。
boison - dernier A, Chabaud M, Garcia F, Becard G, Rosenberg C, Barker DG:农杆菌属rhizogenes的-变换根Medicago truncatula用于固氮和内生菌根共生关系的研究。植物与微生物的相互作用,2001,14:695-700。10.1094 / MPMI.2001.14.6.695。
转基因烟草植物中启动子依赖的反式失活——基因沉默和基因再激活的动力学方面。第三科学学院。1994, 29(3): 344 - 344。
Jefferson RA, Bevan M, Kavanagh T:使用大肠杆菌葡醛酸酶基因作为高等植物基因表达研究的基因融合标记。生物化学学报,1998,15:17-18。
Jefferson RA, Kavanagh TA, Bevan MW: GUS融合:β -葡萄糖醛酸酶作为高等植物中敏感和多功能的基因融合标记。杨晓明,刘志刚,2007,30(6):391 - 398。
Grace C, Stribley DP:囊泡-丛枝菌根真菌常规染色的安全方法。中国农业科学,2001,30(4):344 - 344。10.1016 / s0953 - 7562(09) 80005 - 1。
Devers EA, Teply J, Reinert A, Gaude N, Krajinski F:一种内源性人工microRNA系统,用于揭示根内共生相关基因的功能Medicago truncatula.中国生物医学工程学报,2013,26(3):344 - 344。
确认
这项工作得到了马克斯-普朗克学会的支持。我们非常感谢Florian Frugier为我们提供了种子cre1-1和相应的WT控件以及有用的评论。我们要感谢乌苏拉·克劳斯提供的抗rubisco抗体。此外,我们要感谢Daniela Zöller和Derek Nedveck在样品准备方面的额外帮助,以及Jean-Phillipe Combier, Nathan Pumplin以及匿名审稿人对手稿的批判性阅读和他们的有用评论。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
VH、EAD、NG和AM进行了生物学实验。EAD和FK设计并发起了这项研究。所有作者都分析了数据。EAD和FK撰写了手稿。所有作者都阅读并批准了最终的手稿。
电子辅助材料
12870 _2014_199_moesm1_esm.pdf
附加文件1:包括下列辅助数字:图S1。在活的有机体内确认NSP2利用miR171h过表达和mRFP传感器构建miR171h基因沉默。miR171h过表达和mRFP传感器结构的共渗透2on。图S2。菌根标记基因pri-miR171hand的表达谱NSP2在丛枝菌根定殖期间m . truncatula的根源。图S3。高磷可抑制菌根定殖规划的2突变体。图S4。的cre1-1株系之间也表现出类似的相关性NSP2而且MtPt4转录丰富,像野生型植物。图S5。概括了卡通表现的本土化NSP2和MIR171h启动子。图S6。根转化野生型和miR171h过表达植物的菌根参数比较nsp2-2植物。(pdf 862 kb)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。
本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。
如欲查看本牌照的副本,请浏览https://creativecommons.org/licenses/by/4.0/.
创作共用公共领域奉献弃权书(https://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
Hofferek, V., Mendrinna, A., Gaude, N.。et al。MiR171h限制根的共生,像它的目标一样显示NSP2一个复杂的转录调节Medicago truncatula.BMC植物生物学14日,199(2014)。https://doi.org/10.1186/s12870-014-0199-1
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-014-0199-1
关键字
- 共生
- 植物microrna的
- miR171h
- NSP2
- 植物营养