摘要
背景
Taxodium以耐涝性强著称,具有巨大的生态和经济潜力。然而,属的基因组资源十分匮乏Taxodium极大地阻碍了对其潜在耐水机制的进一步探索。中山杉杉(Taxodium’Zhongshansa)是一种种间杂交种t . distichum而且t . mucronatum在中国东南部广泛种植。为了了解中杉杉(Taxodium’Zhongshansa)耐涝的遗传基础,我们分析了中杉杉(Taxodium’Zhongshansa)根和芽对短期内涝的响应转录组。
结果
RNA-seq用于分析基因的全基因组转录组变化Taxodium中山沙406无性系根系和茎部处理1 h的土壤涝渍胁迫。经de novo组装,共获得unigenes 108,692个,其中70,260个(64.64%)被注释。在根中发现了2090个差异表达基因,在笋中发现了394个差异表达基因,其中两者共有174个,表明其地上部分也受到了影响。在涝渍胁迫下,缺氧处理的根的主要反应是激活抗氧化防御系统,防止细胞遭受活性氧(ROS)中毒。当呼吸被抑制和ATP降低时,另一种快速应对机制是抑制整个植物的能量消耗生物合成过程。糖酵解和发酵途径被激活,以维持低氧根中ATP的产生。对碳水化合物的需求不断增加,碳水化合物代谢在根和茎中不断积累,这可能表明淹水组织和非淹水组织之间的系统通信促进了生存。氨基酸代谢也受到很大影响,丝氨酸降解相关基因下调,天冬氨酸降解相关基因上调。此外,一个非共生的血红蛋白1类基因被上调,这也可能有助于ATP的产生。此外,qRT-PCR检测到的糖酵解途径5个unigenes的基因表达谱证实了RNA-Seq数据。
结论
我们认为,ROS解毒和能量维持是“中山沙”在缺氧生存中的主要应对机制,这可能是其具有显著耐涝性的原因。我们的研究不仅提供了第一次大规模的基因组资源评估Taxodium同时也为探索“中山沙”耐涝分子机制提供了指导。
背景
属Taxodium历史上被认为包含三个物种:t . distichum(baldcypress),t . mucronatum(蒙特祖玛柏树)和t . ascendens(pondcypress) [1].然而,关于这三个类群的分类学仍有一些争论。1].在本研究中,我们采用郑氏的分类学观点。2他治疗了这个属Taxodium作为三个不同的物种。Taxodium是柏树科的针叶树,非常耐水,因此作为湿地物种[3.]和景观植物[1].
为了在中国东南部沿海和湿地地区培育最适宜的木本植物造林,三种植物之间进行了大量的种间杂交Taxodium自20世纪70年代以来,已进行了一批优良杂交无性系的筛选,如“中山砂302”(t . distichum×t . mucronatum)、“中山沙118”[(t . distichum×t . mucronatum)×t . mucronatum]和“中山砂406”(t . mucronatum×t . distichum) [4].杉木(Taxodium ' Zhongshansa ')是圆锥状,落叶到半常绿针叶树,具有针状叶,是种间杂交t . mucronatum和T.distichum.“中山沙”耐涝性极强[4它们的根可以在被水淹没的土壤中存活数月,而大多数树种都无法生存。目前在中国东南部,“中山杉”已被广泛用于河网地区的用材林、沿海地区的防风林和城市地区的景观树。尽管其生态和经济潜力巨大,属的基因组信息Taxodium是稀缺的,这极大地阻碍了分子标记的开发,进一步探索其潜在的耐涝机制和其他遗传研究。
高等植物是需氧生物。由于分子氧在水中的扩散速率远低于在空气中的扩散速率,土壤内涝严重阻碍植物的生长发育,可使植物缺氧或缺氧。植物对外部缺氧的反应在过去已被广泛研究。蛋白质组学研究已经确定了一组约20个厌氧诱导多肽(ANPs) [5].ANPs已被证明是许多植物物种耐受低氧的必要条件[6]、[7].进一步研究表明,大多数ANPs参与糖酵解和发酵途径[8].随后,微阵列研究已经在低氧响应拟南芥[9],玉米[10],棉花[5],杨树[11]和其他植物。所有这些大量转录本的快速变化不仅涉及众所周知的ANPs [12],也包括那些以前不知道参与缺氧或缺氧反应的基因,这表明植物对低氧有复杂的反应[5]、[13].
与微阵列相比,RNA-Seq方法具有更高的灵敏度,包括低水平和高水平的基因表达[14].这些优势使得RNA-seq的应用越来越多,以阐明植物对各种环境胁迫的反应,如寒冷[15],盐[16]、[17]和干旱[16]、[18].RNA-seq也已成功应用于作物对涝渍胁迫的反应,如玉米[19],黄瓜[20.],芝麻[21]和强奸[22].然而,关于木本植物的报道却很少。
为了更好地了解“中山沙”对土壤内涝响应的分子机制,研究了淹水根系和气生芽组织中基因的整体转录变化Taxodium使用Illumina HiSeq™2000测序平台(Illumina Inc., San Diego, CA, USA)检测“中山莎406”克隆。我们关注“中山沙”对涝渍胁迫反应的早期阶段,因为这一阶段决定了植物从正常代谢到低氧代谢的转变,并在植物生存中起着至关重要的作用[8].据我们所知,这是第一次大规模的评估Taxodium基因资源。本研究结果有助于了解耐涝木本植物对土壤内涝胁迫的响应。
方法
植物生长和水处理
剪报Taxodium2010年4月,无性系“中山沙406”在南京植物园通风温室的塑料盆中培养。2013年7月,6株植株在室温(约20°C)下移动并培养,光照/黑暗光周期为16/8小时。两周后,将植株平均分为两组:一组作为对照样品(CK),另一组用自来水处理,塑料盆浸泡作为涝渍处理样品(CT)。在施用淡水后1 h,对CT的根、芽进行取样。CK的根、芽也在同一时间点取样。从每株植物上同时采集带有部分侧根的主根和带有三片叶子的茎尖,分别在液氮中冷冻,并在−80°C下保存,然后提取RNA。根部被仔细清洗,以防止机械损伤。共获得4个RNA池,分别为CK根、CK苗、CT根和CT苗,每个RNA池由同一组3株植株的相同组织混合而成。
RNA分离、cDNA文库构建及测序
首先使用RNAprep Pure Plant Kit (Polysaccharides & Polyphenolics-rich) (Tiangen, Beijing, China)粗略提取根系总RNA,然后使用RNA清理试剂盒(Tiangen)进行纯化。对于叶片,根据制造商的说明,使用PLANTeasy植物RNA提取试剂盒(Yuanpinghao, Beijing, China)分离总RNA。RNA质量检测、cDNA文库构建及Illumina深度测序采用Lv [23],生成150 bp的配对端读。
汇编和注释
为了获得高质量的干净读取,使用内部perl脚本处理原始数据,删除了包含适配器的读取、低质量的读取和包含poly-N的读取。Q20、Q30、gc含量和序列重复水平的计算以及其他下游分析均基于clean reads。转录组组装使用Trinity [24].
基于Nr (NCBI非冗余蛋白序列)、Nt (NCBI非冗余核苷酸序列)、Pfam (protein family)、KOG/COG (Clusters of Orthologous Groups of proteins)、Swiss-Prot(手动注释和回顾的蛋白序列数据库)、KO (KEGG Ortholog数据库)和GO (Gene Ontology) 7个数据库对基因功能进行标注,使用的BLAST的截断e值为10−5.
基因表达水平定量和差异表达分析
采用RSEM方法估计基因表达量[25]为每个样本。干净的数据被映射回组装的转录组。从映射结果中获得每个基因的Readcount,归一化为每kb外显子模型的reads / million mapped reads (RPKM)。在对每个测序文库进行差异基因表达分析之前,通过edgeR程序包调整reads counts [26]通过一个缩放归一化因子。使用DEGseq (2010) R包对两个样本进行差异表达分析。p值使用q值[27];以q-value < 0.005, |log2 (foldchange)| > 1为显著差异表达的阈值。利用基于Wallenius非中心超几何分布的GO seq R包对差异表达基因(DEGs)进行GO富集分析[28],可以调节基因长度偏倚。KOBAS [29]软件用于检测KEGG通路中DEGs的统计富集。
存在分析
采用qRT-PCR方法分析糖酵解途径5个基因(基因ID: comp71558_c0、comp63755_c0、comp75584_c0、comp53892_c1、comp62913_c0)的表达谱。采用同一克隆的新植物材料进行RNA提取,进行qRT-PCR分析。生物重复3次。根据参考单基因序列,使用Primer Premier 5.0软件设计基因特异性引物。一个HiScriptTM使用Q RT SuperMix for qPCR (Vazyme,南京,中国)合成cdna,并使用ABI StepOne进行实时定量TM加上系统和AceQTMqPCR SYBR®Green Master Mix (Vazyme,南京,中国)。以95°C 5 min的程序变性PCR循环,95°C 10 s和60°C 30 s的40个循环‘中沙’肌动蛋白基因(正向:5′- TTAACATTGTGACCTGTGCGAACT - 3′,反向:5′- acaacaaggaaagtatagccagcaa−3′)为归一器,基因的相对表达量由2-△△CT因为所有测试的基因都显示出高度相似的扩增效率在0.95左右(附加文件1).
结果
转录组测序和组装
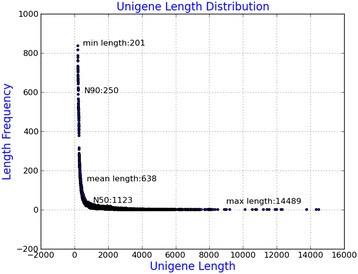
Illumina测序数据存入NCBI SRA数据库,登录号SRP043177。总共生成了174,958,744个Illumina PE原始reads(表2)1).在去除适配器序列、模糊核苷酸和低质量序列后,剩下153,993,822亿个清洁读取。在201 - 14489 bp范围内,组装干净reads得到108,692个unigenes, N50长度为1123 bp(图1).
序列注释
unigenes通过与7个公共数据库对齐进行注释(表2).在Nr数据库中有61,087个unigenes(56.2%),在Nt数据库中有21,203个(19.5%),在Swiss-Prot数据库中有44,761个(41.18%)。在Nr、Nt、Swiss-Prot、KEGG、GO、COG和Pfam数据库中,成功注释的unigenes共有70260个(64.64%),全部7个数据库中成功注释的unigenes有7622个(7.01%)。
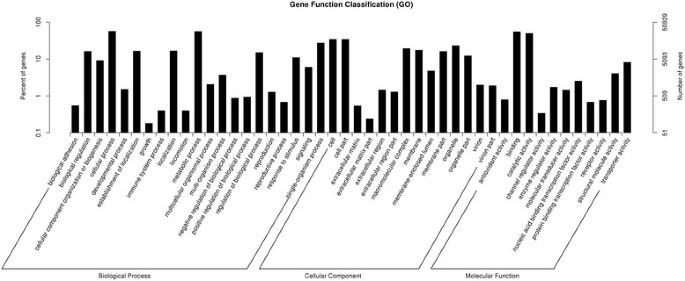
在GO分析中,有50929个unigenes被分为三个本体(图2).在生物过程(BP)类别中,参与“细胞过程”(28,970)、“代谢过程”(28,659)和“单生物过程”(13,853)的基因高度代表。细胞成分(CC)类别主要包括涉及“细胞”(17,488),“细胞部分”(17,471)和“细胞器”(11,813)的蛋白质。在分子功能(MF)类别中,“结合”(28,115)、“催化活性”(25,271)和“转运蛋白活性”(4135)被高度代表。
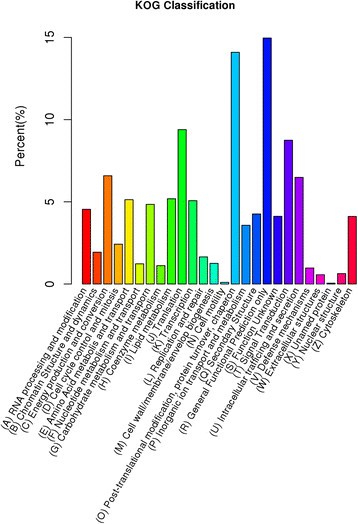
此外,所有unigenes都在COG数据库中进行了功能预测和分类的搜索。总共有31506个unigenes被分配到COG分类中,分为26个具体类别(图3.).“仅一般功能预测”(4714)是最大的一组,其次是“翻译后修饰,蛋白质转换,伴侣”(4440),“翻译”(2959),“信号转导”(2755)和“能量产生和转换”(2074)。只有少数unigenes被分配到“细胞外结构”(177个)和“细胞运动”(31个)。
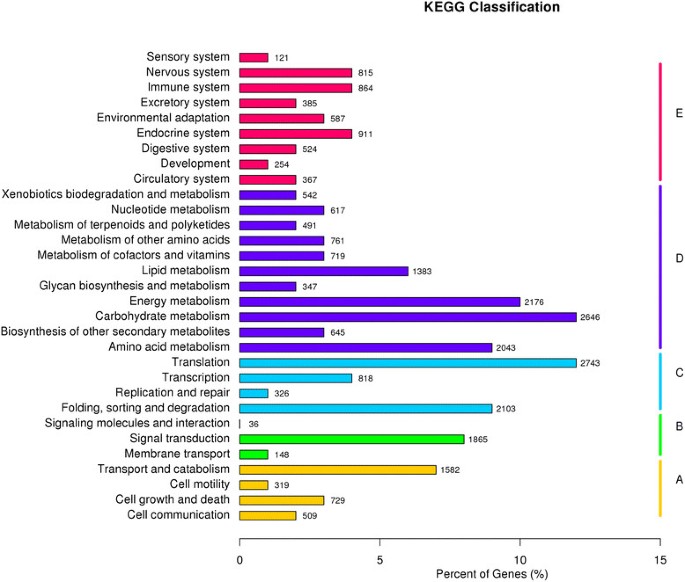
使用KEGG注释系统进行单基因代谢途径分析。这一过程共预测了258条通路,代表了22,871个unigenes(图4).涉及独特转录本数量最多的途径是“翻译”(2743),其次是“碳水化合物代谢”(2646)和“能量代谢”(2176)。
“中山沙”转录本在不同组织内涝处理下的差异表达分析
首先在两个组织间进行差异表达分析。DEGs (q-value < 0.005 and |log2 (foldchange)| >1)被定义为在一个组织中相对于另一个组织显著富集或缺失的基因。对照中,嫩枝与根系之间的差异为4730个,处理后嫩枝与根系之间的差异为4677个。
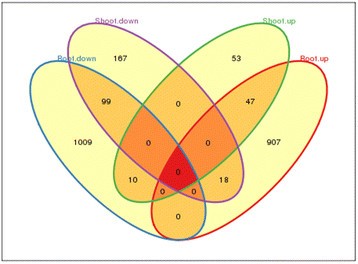
然后分析CK与CT之间的差异。在108,692个(2.1%)unigenes中,有2310个被鉴定为在CT和CK植株之间至少一个组织中的deg(图5).其中,根中检出2090个DEGs,芽中检出394个DEGs。在本研究中,与CK相比,CT中表达水平较高的DEGs被标记为“上调”,而CT中表达水平较低的DEGs被标记为“下调”。两种组织共有174个DEGs,其中28个在根与梢之间表达趋势相反,10个在根中表达上调,18个在根中表达下调。其余146个表达差异相似,其中99个表达下调,47个表达上调。
有1916个基因在根中专一差异表达,其中1009个基因下调,907个基因上调。结果表明,220个deg(167个上调,53个下调)仅在芽中发生变化。
deg的功能分类
为了进一步表征上述讨论的表达变化,我们以整个转录组为背景对DEGs进行了GO富集分析。对CK的茎根间的DEGs进行GO分析。GO富集分析表明,与根部相比,茎部表达上调的DEGs具有一定的特异性或较强的功能。幼苗中的mrna高度富集,编码参与光合作用各方面的蛋白质,其中“光合作用”、“氧化还原过程”、“光合作用,光反应”和“光合作用,光收获”被列为前四个富集的bp。拟南芥研究表明,与光合作用相关的基因在幼苗的光合细胞和保护细胞中大量表达,而在根mrna中基本缺失[30.-这正是我们的数据所表明的。以下高度富集的bp(校正p值<0.005)包括参与生物合成和代谢过程的过程——脂类、类固醇、类异戊二烯、单羧酸、脂肪酸和其他。这表明,涉及一系列脂类的过程在芽中相当活跃。本研究结果将为“中山沙”叶片脂质含量的研究提供依据。
对照笋中表达较根低的是根中表达特异或丰富的表达。与细胞增殖和发育相关的功能类别,如“生长负调节”、“生长调节”、“细胞成分组织或生物发生”、“核糖体生物发生”、“核蛋白复合体生物发生”和“植物型细胞壁组织”等,因为根系样本主要是初生根,也有一些侧根。术语“应激反应”、“过氧化物酶反应”和“氧化应激反应”也在高度丰富的术语之列。mrna的结合也得到丰富(血红素结合、四吡咯结合、铁离子结合、阳离子结合和金属离子结合),这在拟南芥根中很常见[30.].
对根中上调的DEGs进行GO分析(附加文件2).在mf类中,含量最高的前三个术语分别是过氧化物酶活性、氧化还原酶活性作用于过氧化物作为受体和血红素结合。在CC类中,“细胞壁”、“外部包覆结构”和“外质体”是三个主要的富集术语。BP中“过氧化物酶反应”、“氧化应激反应”和“碳水化合物代谢过程”富集最多。影响了天冬氨酸代谢,“天冬氨酸型内肽酶活性”和“天冬氨酸型肽酶活性”也有所增加(p值< 0.05)。与CT根相比,CK中下调的DEGs(附加文件)3.),“核糖体生物发生”和“核糖核蛋白复合物生物发生”是被下调的DEGs富集的前两个bp。核糖体是信使rna被翻译成蛋白质的地方。核糖体和核蛋白复合体的生物发生的取消可能意味着根中蛋白质生产的极大抑制。与这种“转换”相一致的是,下调的DEGs富集了前四个BP。在处理过的“中山沙”根中,“细胞成分生物发生”和“细胞成分组织或生物发生”分别是第三和第六位最富集的bp。如上所述,许多显著抑制的功能类别在对照根中高度富集。综上所述,低氧胁迫极大地限制了根系细胞的增殖,从而节省了大量能量。大多数参与线粒体电子传递的基因下调,如“线粒体电子传递,细胞色素c到氧”,其中8个DEGs下调7个,“线粒体电子传递,NADH到泛醌”,6个DEGs中4个下调。其他丰富的术语包括“丝氨酸型内肽酶活性”。
在对比CT和CK时,“植物型细胞壁组织”和“植物型细胞壁组织或生物发生”是芽中下调的DEGs中GO富集的前两个术语(附加文件)4) -他们都有4个deg,都是被抑制的。此外,100%参与“纤维素合酶活性”、“纤维素合酶(udp形成)活性”和“纤维素生物合成过程”的DEGs也被下调。转录物水平的变化表明,茎段纤维素和细胞壁生物合成过程受到了极大的抑制。对于上调的DEGs的GO富集分析,“转录,dna依赖”,“RNA生物合成过程”和“基因表达调控”是主要的(附加文件5).
对DEGs的KEGG通路富集分析也揭示了常见的和组织特异性的过度表达模式。CT根中DEGs富集的前5个途径(附加文件)6) (q≤0.05),分别为苯丙类生物合成、苯丙氨酸代谢、植物激素信号转导、核糖体、蛋白质消化吸收。还分析了芽中的DEGs(附加文件7) (q≤0.05)。与对照相比,在CT笋中,淀粉代谢和蔗糖代谢富集途径最多。共有468个基因参与了该途径,其中7个基因在胁迫下表达发生了变化。有2个标记为编码海藻糖6-磷酸合成酶(TPS)的DEGs -comp62470_c0和comp68953_c0,表达量分别增加5.81倍和2.13倍。编码蔗糖合成酶的Comp64972_c0在茎部下调了2.29倍,这可能导致了根系淀粉生成的减缓。在两种组织中均富集了四种途径:植物激素信号转导、类胡萝卜素生物合成、淀粉和蔗糖代谢以及苯丙类生物合成。
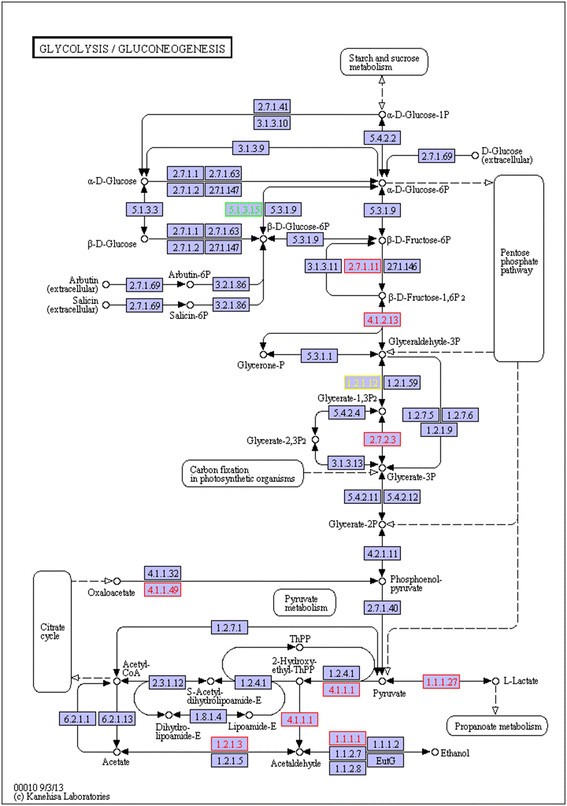
糖酵解的扰动被认为是植物适应好氧胁迫的基本特征[31].有591个unigenes被注释为编码糖酵解/糖异生途径中的酶),其中14个在处理根和对照根之间表达差异(图6).处理后的根中大部分DEGs表达上调。两个deg被注释为编码甘油醛3-磷酸脱氢酶(GAPDH)-Comp68689_c0和comp64678_c0。而comp64678_c0是唯一下调的DEG,这表明在缺氧的根中可能有另外一个GAPDH亚型被抑制。乳酸脱氢酶(LDH)活性上调。与我们的结果一致,乳酸发酵在许多植物的根缺氧的初始阶段被激活。然而,与动物相比,植物中丙酮酸的厌氧代谢并不局限于乳酸的形成。在灰杨中,LDH转录本作为O的初始反应也相当丰富2但在约5 h后,由于乳酸引起的细胞质pH值下降而下降[11].相反,乙醇是植物发酵的主要最终产物。因此,在植物中乳酸发酵之后是酒精发酵,这一过程中涉及两种关键酶:丙酮酸脱羧酶(PDC),它将丙酮酸转化为乙醛;以及酒精脱氢酶(ADH),它可以进一步将乙醛代谢为乙醇。在我们的结果中,PDC (comp75584_c0)和ADH (comp71294_c0)在CT根中均上调。通过活化酒精发酵,使浸水的“中山沙”根产生能量。这些DEGs在处理后的嫩枝中表达均无变化。这与灰杨的研究结果一致[11].
实时定量RT-PCR验证RNA-Seq数据
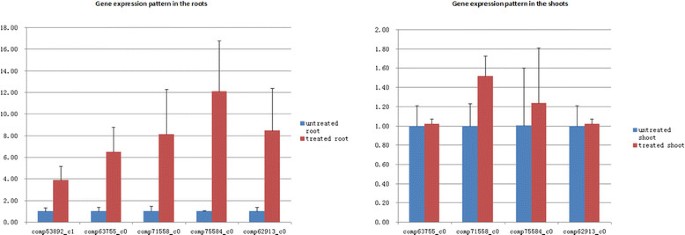
确认RNA-Seq的可靠性数据,实时定量PCR检测5个unigenes的转录水平(图7).由于使用了新的植物材料进行RNA提取,因此折叠变化与这些基因的DEG分析所揭示的数量并不完全匹配。涝渍胁迫下,5个基因>在根部的表达量均升高2倍,而在茎部的表达量均无升高2倍。Comp53892_c1注释为编码醛脱氢酶由于无表达或低表达,无法在芽中检测到,因此采用Illumina测序技术进行测序。综合来看,所有unigenes均表现出与RNA-Seq数据一致的表达模式,表明我们的实验结果是有效的。
讨论
本文利用Illumina平台对“中山沙406”无性系根、芽进行转录组测序。共获得约1.54亿个高质量reads,序列覆盖率为23.1 Gb;共组装了108,692个unigenes(≥200 bp), 64.64%的unigenes被注释。据我们所知,这是第一次大规模的评估Taxodium基因资源。我们的研究结果为分子标记的开发、基因图谱的构建和许多其他基因组学研究奠定了基础Taxodium.
根和芽间转录组的比较
我们比较了对照中根和茎的转录组差异。不出所料,与根部相比,茎部的光合相关mrna含量丰富。一系列脂类的生物合成和代谢过程也处于高度富集状态,因为裸子植物的叶片中一直含有大量的脂类。拟南芥分离细胞群的分析翻译体显示,包含“应激反应”、“过氧化物酶反应”或“氧化应激反应”的所有5个簇(簇3、19、25、45和55),尤其是簇45几乎富集在整个根中,从根的成毛细胞表皮到血管系统,从根尖到伸长和成熟区[30.],而在射击中耗尽[30.],本研究CK植物中也发现,与茎部相比,根系中抗氧化防御系统的mrna含量更高。不出所料,mrna在根中也被富集以促进增殖。综上所述,富集基因功能类别的差异可以用两种组织的功能差异来合理解释。
然后将“中山沙”根系淹水1 h后的转录组与正常条件下的转录组进行比较。共检出2310个(2.1%)DEGs。其中,根中发现了2090个DEGs,笋中发现了394个DEGs,说明土壤内涝胁迫对‘中山砂’转录本的影响主要在胁迫组织中,但对地上部分也有影响,棉花[22]和拟南芥[32].两个组织共有174个deg,而大多数是组织特异性的。与此一致的是Marc等人发现根和芽的耐缺氧能力可能在基因上是分开的[7],大多数已知ANPs的厌氧诱导在玉米和拟南芥中是根特异性的。这并不奇怪,许多组织特异性的deg是由组织特异性细胞群的存在引起的,如叶片中的光合细胞。然而,也有一些细胞群在两种组织中具有相似的功能,如沥青细胞,它们在应激下的转录本变化可能有助于共享的DEGs。
对抗氧化防御系统的影响
Mustroph等人比较了四个领域(植物、动物、真菌和细菌)的21种生物对低氧胁迫的转录组调整,发现改善ROS的酶的诱导是一种普遍的应激反应,在大多数评估物种中发现,尤其是在所有植物中[33].当植物遭受部分淹没时,根区的氧气浓度下降。随着分子氧被还原为有毒活性氧,如过氧化氢、羟基自由基、单线态氧和超氧自由基[34]时,植物体内ROS的产生和猝灭之间的平衡将被破坏,这对水淹胁迫下的细胞生存至关重要[35]、[36].为了在胁迫下防止ROS的形成,植物进化出了一个复杂的抗氧化防御系统:低分子质量的抗氧化剂(抗坏血酸、谷胱甘肽和生育酚),再生还原形式的抗氧化剂的酶,以及ROS相互作用的酶,如超氧化物歧化酶、过氧化物酶和过氧化氢酶[37].许多抗氧化酶已被证明对许多植物在不同程度的内涝条件下的生存至关重要,例如番茄[34],茄子[34],杨树[38]、冬小麦[39]、绿豆[40]和柑橘[41].中山沙的CT根抗氧化防御系统被极大地激活。许多研究表明,在不同程度的内涝条件下,改善ROS的能力与生存之间存在相关性,与此一致,在内涝条件下,“中山沙”中ROS网络蛋白的高诱导表明,强大的解毒作用对其生存至关重要。
对耗能生物合成过程的影响
涝渍导致中山沙根核糖体、细胞器等多种生物合成活性受到极大抑制。值得注意的是,与细胞增殖相关的功能类别在CK根中最为丰富,而在处理后的根系中显著减少,这表明在低氧条件下,CK根具有较大的节能作用。纤维素和细胞壁的高耗能生物合成过程也受到很大的抑制。内涝条件下,线粒体呼吸受到抑制,酒精发酵产能明显低于呼吸,造成厌氧根能量危机[11].在涝渍胁迫下广泛抑制消耗能量的生物合成过程的生物学意义可能是因为它允许同时减少ATP的消耗[13].Mustroph的研究表明,限制atp消耗过程,如核糖体、细胞器和细胞壁的生物发生,是一种进化上保守的应对机制,适用于原核生物和真核生物[42].在这两种组织中,与生物合成过程相关的mrna的大规模下降表明根系内涝诱导了atp消耗过程的系统性抑制。
对碳代谢和氨基酸代谢的影响
由于植物缺乏循环系统,无法将光合作用产生的氧气输送到异养根[33],在涝渍条件下,根系中依赖氧的线粒体呼吸受到很大限制。植物对缺氧转录应答的比较分析发现,编码线粒体电子传递链组成部分的基因在耐受种和敏感种之间存在明显的表达谱差异,基因在拟南芥中主要上调,而在杨树或水稻中主要下调[43].CT中山沙根中参与线粒体电子传递的基因大部分下调。线粒体电子传递链转录本的改变是否与植物耐涝性有关还有待进一步论证。
正如预期的那样,经qRT-PCR验证,淹水诱导了许多基因,包括众所周知的糖酵解和发酵相关的缺氧基因(ADH、PDC和LDH),表明胁迫下糖酵解和发酵途径被激活,以维持ATP的生成。结果,对碳水化合物的需求增加,且处理后根系碳水化合物代谢显著增加。碳水化合物代谢的加速在低氧条件下的植物之间进行功能转换,并已被证明对植物的生存至关重要[33]、[43].值得注意的是,在幼苗中,两个参与淀粉和蔗糖代谢的编码TPS的deg在胁迫下表达上调。通过比较杨树、拟南芥和棉花对涝渍反应的早期转录组发现,缺氧在这三个物种中都引发了TPS的过表达[44].TPS催化海藻糖合成的第一步,这在植物对非生物胁迫的反应中很重要[45].TPS已被证明可调节植物的糖代谢[46]、[47],因此TPS在茎部的上调表明“中山沙”茎部糖代谢加速。许多研究者认为,由于糖酵解过程中对碳水化合物的需求较高,嫩枝会将碳水化合物运输到根部,为缺氧组织提供更多的碳水化合物。在缺氧处理的杨树中,蔗糖从叶到根的韧皮部运输增加[11]-拟南芥研究[32]和棉花[5得出了同样的结论。因此,“中山沙”芽中淀粉和蔗糖代谢的刺激可能也参与了土壤内涝后厌氧部分与空气部分的系统通讯。
拟南芥、棉花和杨树对低氧环境早期转录组反应的对比分析发现,这三种双子叶植物的氨基酸代谢变化是常见的,尽管它们的特定反应之间几乎没有重叠[44].涝渍还导致了“中山沙”根部氨基酸含量的快速变化。CT中发现丝氨酸降解相关基因转录下调。然而,大量参与天冬氨酸降解的基因上调。结果表明,根中丝氨酸含量迅速增加,天冬氨酸含量迅速下降。在缺氧条件下,灰杨根的代谢物谱也发生了同样的动态变化[11].Kreuzwieser等人提出,缺氧会抑制TCA循环,激活糖酵解和发酵途径,导致糖酵解中间产物氨基酸(如丝氨酸)积累,TCA循环中间产物氨基酸(如天冬氨酸)减少[11].
对非共生血红蛋白的影响
Narsai等人最近对植物对缺氧的转录和代谢反应进行了比较分析,特别关注了血红蛋白表达与植物对低氧条件的耐受性之间的可能关系[43]、[48].在植物中,该蛋白家族包括共生血红蛋白和非共生血红蛋白,前者仅在豆类和其他一些物种的结节中表达,因此非共生血红蛋白在大多数植物中更常被讨论。Narsai等发现,耐氧拟南芥中1类非共生血红蛋白转录本丰度在缺氧条件下迅速升高,而在耐氧水稻和杨树中则下调或不变;编码2类血红蛋白和3类血红蛋白的基因也表现出相似但不那么极端的趋势[43]、[48].然而,对两种橡树物种对洪水压力的适应性反应的分析表明,它们之间存在相反的关系1类非共生血红蛋白基因表达与水淹耐受性[49].此外,根系转录谱分析表明,淹水胁迫使两个耐淹植物的血红蛋白上调Rorippa物种(50].涝渍胁迫下黄瓜对洪涝胁迫敏感的血红蛋白编码基因表达量降低[20.].Parent等人提出,非共生血红蛋白与一氧化氮(NO)的相互作用是缺氧条件下发酵途径的另一种选择,非共生血红蛋白作为NO双加氧酶将NO转化为硝酸盐[49]、[51].该途径不仅消除了细胞内的有毒NO,还有助于维持ATP的合成。有4个unigenes编码非共生血红蛋白:comp56074_c0、comp68739_c1、comp1346274_c0和comp13327_c0。其中,comp56074_c0被标注为编码1类非共生血红蛋白,在CT根中升高4.29倍。根据上述假设,这可能有利于‘中山沙’的耐涝性。此外,与血红素(即非共生血红蛋白)结合相关的mrna在CT根中高度上调。因此,非共生血红蛋白与“中山沙”耐涝性的关系值得进一步关注。
结论
利用RNA-seq技术对“中山沙406”在高氧和低氧条件下的转录本进行比较,有助于解释“中山沙”抗涝早期反应的分子基础。参与ROS网络和碳氮代谢的转录本发生了很大变化。在“中山沙”中,前者是通过诱导活性抗氧化防御系统介导的。为了产生ATP,糖酵解和发酵途径被刺激,结果,糖从整个植物中供应。此外,一系列消耗atp的生物合成过程在芽和根中被显著抑制。氨基酸代谢发生了很大的变化,硝酸盐产生途径也可能被诱导来帮助维持ATP。由此可见,活性氧解毒和能量维持是“中山沙”在缺氧条件下生存的主要应对机制,这可能是其具有显著耐涝性的原因。
附加文件
缩写
- 度:
-
差异表达基因
- anp:
-
厌氧诱导多肽
- RNA-Seq:
-
高通量RNA-sequencing
- Nr:
-
NCBI非冗余蛋白序列
- Nt:
-
NCBI非冗余核苷酸序列
- 包含了:
-
蛋白家族
- KOG /齿轮:
-
蛋白质的同源基团簇
- Swiss-Prot:
-
一个手动注释和审查蛋白质序列数据库
- 柯:
-
KEGG正交数据库
- 走:
-
基因本体论
- RPKM:
-
读数每公斤碱基每百万映射读数
- ALDH:
-
醛脱氢酶
- GAPDH:
-
甘油醛3-磷酸脱氢酶
- PDC:
-
丙酮酸脱羧酶
- 抗利尿激素:
-
乙醇脱氢酶
- LDH:
-
乳酸脱氢酶
- PFK3:
-
依赖于atp的6-磷酸果糖激酶
- PFK2:
-
依赖于atp的6-磷酸果糖激酶
- ROS:
-
活性氧
- TPS:
-
海藻糖6-磷酸合成酶
- MF:
-
分子功能
- 答:
-
蜂窝组件
- 英国石油公司:
-
生物过程
- 没有:
-
一氧化氮
参考文献
- 1.
Denny GC, Arnold MA:秃柏、塘柏和蒙特祖柏的分类和命名:一种、两种还是三种?机械工程,2007,17(1):125-127。
- 2.
郑文:《中国森林》第一卷。中国林业出版社,北京1983。
- 3.
李志强,李志强,李志强:海水淹水与盐渍化胁迫的相互作用。树物理学报,1996,16(1-2):307-313。
- 4.
华健,尹勇,周东,于超,徐娟:土壤水分条件对杉木“中杉木406”生长和生理的影响。生态农村环境学报。2011,6:10- 10
- 5.
王晓明,王晓明,王晓明,王晓明:棉花根系和叶片中基因表达对内涝胁迫的响应。植物生理学报,2010,29(1):61 - 61。
- 6.
Sachs MM, Subbaiah CC, Saab IN:玉米厌氧基因表达与抗洪性。实验学报,1996,47(1):1-15。
- 7.
李志刚,李志刚,李志刚:拟南芥根和芽对低氧胁迫的耐受性不同。植物营养学报,2004,27(1):457 - 457。
- 8.
李志刚,李志刚,李志刚,李志刚,李志刚,李志刚,李志刚,李志刚:植物抗涝能力的分子生物学研究进展。应用物理学报,2000,26(3):379 - 379。
- 9.
Klok EJ, Wilson IW, Wilson D, Chapman SC, Ewing RM, Somerville SC, Peacock WJ, Dolferus R, Dennis ES:拟南芥根培养物低氧响应的表达谱分析。植物学报,2002,14(10):2481-2494。
- 10.
张文文,黄玲,沈敏,韦伯斯特C, Burlingame AL, Roberts JK:低氧环境下玉米幼苗根尖蛋白质合成与耐缺氧特性的质谱分析。植物营养学报,2000,22(2):344 - 344。
- 11.
Kreuzwieser JUR, Hauberg J, Howell KA, Carroll A, Rennenberg H, Millar AH, Whelan J:低氧胁迫下灰杨叶片和根系的差异响应。植物学报,2009,29(1):461-473。
- 12.
Sachs MM, Freeling M, Okimoto R:玉米厌氧蛋白。细胞科学,1980,20(3):761-767。
- 13.
Geigenberger P:植物代谢对缺氧的反应。植物学报,2003,6(3):247-256。
- 14.
马丽妮,马森,马妮,马妮,马妮:RNA-seq:技术重现性评估和与基因表达阵列的比较。基因组学报,2008,18(9):1509-1517。
- 15.
庞涛,叶超,夏霞,尹伟:荒漠灌丛沙冬青冷驯化过程的测序和转录组分析。BMC基因组学杂志,2013,14 (1):488-
- 16.
范霞,王娟,杨楠,董燕,刘玲,王芳,王楠,陈辉,刘伟,孙勇,吴娟,李宏:大豆叶片和根系在盐、盐碱和干旱胁迫下的高通量Illumina基因表达谱分析。中国生物医学工程学报,2013,32(2):392-402。
- 17.
杨晓明,李志刚,李志刚,李志刚:盐胁迫对紫花苜蓿根系转录组的影响。中国生物医学工程学报,2013,34(7):1041-1055。
- 18.
董超,李超,闫霞,黄松,黄娟,王玲,郭锐,卢刚,张霞,方霞,魏文:干旱胁迫和复水生长条件下白荞麦叶片基因表达的Illumina深度测序。Mol生物学报,2012,39(5):5851-5857。
- 19.
翟玲,刘震,邹霞,姜艳,邱峰,郑勇,张震:玉米冠根长期内涝响应microRNA的全基因组鉴定与分析。中国生物医学工程学报,2013,47(2):379 - 379。
- 20.
齐旭,徐旭,林X,张伟,陈旭:黄瓜( Cucumis sativus .)差异表达基因的鉴定l)根系在涝渍胁迫下的数字基因表达谱分析。基因组学杂志,2012,99(3):160-168。
- 21.
王玲,张勇,齐晓霞,李东,魏伟,张欣:芝麻根系全基因表达对内涝胁迫的响应。植物物理学报,2012,34(6):2241-2249。
- 22.
李艳,金凯,张艳,黄俊,李迪,崔毅:油菜幼苗叶片内涝胁迫下基因表达的响应。植物细胞学报,2014,33(2):289-299。
- 23.
吕娟,刘萍,王艳,高斌,陈萍,李娟:三瘤梭子蟹对盐度胁迫响应的转录组分析为渗透调节的分子基础提供了新的视角。公共科学学报,2013,8 (12):e82155-
- 24.
Grabherr MG, Haas BJ, Yassour M, Levin JZ, Thompson DA, Amit I, Adiconis X, Fan L, Raychowdhury R, Zeng Q, Chen Z, Mauceli E, Hacohen N, Gnirke A, Rhinke A, Dj Palma F, Birren BW, Nusbaum C, Lindblad-Toh K, Friedman N, Regev A, Chen Z, Mauceli E, Hacohen N, Gnirke A, Rhinke A, Dj Palma F, Birren BW, nuske C, Lindblad-Toh K, Friedman N, Regev A, Chen Z, Mauceli E, Hacohen N, Gnirke A, Rhinke A, Dj Palma F, Birren BW, Nusbaum C, Lindblad-Toh K,没有参考基因组的RNA-Seq数据转录组组装。生物技术学报,2011,29(7):644-652。
- 25.
李波,杜威CN: RSEM:基于参考基因组的RNA-Seq数据的精确转录物定量。生物信息学学报,2011,12 (1):323-
- 26.
Robinson MD, McCarthy DJ, Smyth GK: edgeR:用于数字基因表达数据差异表达分析的Bioconductor包。生物信息学,2010,26(1):139-140。
- 27.
Storey JD:阳性错误发现率:贝叶斯解释和q值。生态学报,2003,31(6):2013-2035。
- 28.
Young MD, Wakefield MJ, Smyth GK, Oshlack A: RNA-seq的基因本体分析:考虑选择偏倚。基因组医学杂志2010.PubMed。,
- 29.
毛晓霞,蔡涛,李伟:基于KEGG Orthology (KO)的基因组自动注释和通路识别。生物信息学,2005,21(19):3787-3793。
- 30.
Mustroph A, Zanetti ME, Jang CJ, Holtan HE, Repetti PP, Galbraith DW, Girke T, Bailey-Serres J:分析拟南芥离散细胞群的翻译子,解决缺氧时细胞优先级的改变。自然科学进展,2009,26(3):344 - 344。
- 31.
Kennedy RA, Rumpho ME, Fox TC:植物的厌氧代谢。中国植物科学,2002,18(1):1-6。
- 32.
徐飞,周敏,彭红,周松,史敏:基于转录调控的拟南芥低氧系统反应研究。公共科学学报,2011,6 (12):e28888-
- 33.
Mustroph A, Lee SC, Oosumi T, Zanetti ME, Yang H, Ma K, Yaghoubi-Masihi A, Fukao T, Bailey-Serres J:低氧胁迫下转录组调整的跨界比较突出了保守和植物特异性反应。中国生物医学工程学报,2010,32(3):344 - 344。
- 34.
林瑞瑞,翁春,罗华,陈娟:淹水条件下番茄和茄子根系抗氧化系统的研究。中国植物科学,2004,26(2):359 - 366。
- 35.
陈晓峰,陈晓峰,陈晓峰,等:涝渍对三种地中海橡树种子萌发的影响。生态学报,2009,35(3):422-428。
- 36.
加藤C,大岛N,甘田H,佐藤S:水淹对南瓜根木质部液抑绿活性的增强。植物生理学报,2001,39(6):513-519。
- 37.
抗氧化剂、氧化损伤与缺氧应激研究进展。安Bot-London。2003, 91(2): 179-194。
- 38.
Foyer CH, Souriau NEG, Perret S, Lelandais M, Kunert K, Pruvost C, Jouanin L:过表达谷胱甘肽还原酶导致杨树抗氧化能力和抗光抑制能力增强。植物营养学报,2003,26(3):357 - 357。
- 39.
谭伟,刘娟,戴涛,景青,曹伟,姜东:花后涝渍对冬小麦光合作用和抗氧化酶活性的影响。光合作用,2008,46(1):21-27。
- 40.
胡晓明,王晓明,王晓明,王晓明,王晓明:水渍对绿豆光合作用和抗氧化酶活性的影响。中国植物科学,2002,26(1):1 - 3。
- 41.
Arbona V, Hossain Z, López-Climent MF, Pérez-Clemente RM, Gómez-Cadenas A:柑桔抗氧化酶活性与耐涝胁迫有关。植物营养学报,2008,32(4):452-466。
- 42.
李志刚,李志刚,李志刚。马铃薯块茎生长过程中代谢活性对低氧环境的适应性反应。中国生物医学工程学报,2000,32(8):723-740。
- 43.
王晓明,王晓明,王晓明,王晓明,等:植物对低氧胁迫的转录和代谢应答。环境科学学报,2011,29(2):379 - 379。
- 44.
Christianson JA, Llewellyn DJ, Dennis ES, Wilson IW:三种双子叶植物对低氧环境早期转录组反应的比较。植物信号行为学报,2010,5(8):1006-1009。
- 45.
李志强,李志强,李志强。海藻糖的生物合成及其对非生物胁迫的响应。中国植物学报,2008,30(4):339 - 339。
- 46.
李艳,李志刚,李志刚:海藻糖-6-磷酸是植物糖代谢的调节因子吗?应用物理学报,2003,29(3):344 - 344。
- 47.
Eastmond PJ, Graham IA:海藻糖代谢:海藻糖-6-磷酸的调节作用?植物学报,2003,6(3):231-235。
- 48.
Narsai R, Whelan J:低氧反应有什么独特之处?水稻和拟南芥萌发过程中的厌氧反应分析及与非生物胁迫的比较。中国植物科学,2013,4:349-
- 49.
亲本C, Vecoeur MEL CE, Capelli N, Dat JF:两种橡树树种对洪水胁迫的生长和适应反应:非共生血红蛋白的作用。植物细胞环境,2011,34(7):1113-1126。
- 50.
Sasidharan R, musstroph A, Boonman A, Akman M, Ammerlaan AM, Breit T, Schranz ME, Voesenek LA, Van Tienderen PH:两种rorippa物种的根转录谱揭示了与极端耐淹性相关的基因簇。中国生物医学工程学报,2013,29(3):379 - 379。
- 51.
李志刚,李志刚,李志刚:耐涝性:非共生血红蛋白-一氧化氮稳态与抗氧化剂。动物科学,2009,26(5):674-682。
确认
本研究由江苏省科技支撑计划(农业)重点项目(BE201343)、江苏省农业科技创新计划(CX132046)和江苏省高校学术发展重点项目(PAPD)资助。非常感谢余朝光、冯元恒和朱胜自愿协助植物样本采集和评论。作者还感谢中国北京Novogene生物信息技术公司协助进行转录组测序,以及中国南京Vazyme生物技术有限公司协助进行实验。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
BQ进行涝渍实验,制备mRNA进行测序,并参与稿件的撰写。YY分析数据,撰写稿件。YY公司提供了植物,并参与了项目的设计。MX为数据分析提供了有益的建议。HL设计了项目并修改了手稿。所有作者都阅读并批准了最终的手稿。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。
本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。
如欲查看本牌照的副本,请浏览https://creativecommons.org/licenses/by/4.0/.
创作共用公共领域奉献弃权书(https://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
气,B,阳,Y,阴,Y。et al。从头测序,组装和分析Taxodium“中山沙”根和芽的转录组对短期内涝的响应。BMC植物生物学14,201(2014)。https://doi.org/10.1186/s12870-014-0201-y
收到了:
接受:
发表:
关键字
- Taxodium
- 洪涝灾害
- 压力
- 转录组
- 中存在