摘要
背景
柳树caprea是一种在欧洲、西亚和中亚具有重要生态意义的耐寒先锋物种。然而,对其种群遗传结构和分子生态学的研究还很少。我们描述了爱尔兰自然种群的地理种群遗传结构水平美国caprea并利用叶绿体和核简单序列重复序列(SSRs)来确定基因流动和有性繁殖的程度。
结果
采集21个半自然林地183个个体,进行基因分型。叶绿体SSRs在群体间的基因多样性较高(HT= 0.21-0.58),发现79种不同的单倍型,其中48%为单一个体所独有。群体的遗传分化介于中、高水平之间G圣= 0.38)。对于核ssr,G圣低至0.07,观察到的居群杂合度很高(HO= 0.32 - -0.51);只有9.8%的基因型存在于两个或两个以上的个体中。对于这两种类型的标记,AMOVA表明大多数变异是在种群内部。通过贝叶斯聚类分析确定了小地理格局。研究发现,通过花粉传播的基因比通过种子传播的基因重要约7倍。
结论
数据是一致的离系繁殖,并表明没有明显的障碍,基因流动在爱尔兰跨越大的地理距离。花粉介导和种子介导的基因流都很高,有些居群之间的距离超过200公里。这些发现可能只是由于人类通过种子交易或种子和花粉的意外运输进行干预。这些结果对希望利用自然遗传变异的育种者和必须选择种植材料的林业人员都有价值。
背景
属柳树L.(柳树、黄柳树和柳树)属于一个产柳絮的树科,杨柳科。的基本染色体数柳树是19,大多数物种是二倍体(2x = 38),但有报道称其倍性水平可达12倍体(12x = 228) [1].大多数柳树都可以很容易地从硬木扦插中繁殖,尽管有些种类的柳树并不善于生根,例如美国capreal .,美国scoulerianaBarratt [2]、[3.].柳树花主要是虫媒传粉,但风媒传粉也会发生[4].
利用微卫星标记成功地开发了一些柳种的微卫星标记。它们已被描述为柳树burjaticaNasarow [5),美国reinii法兰治(姓氏)& l .干腊肠。[6),靠近北极的柳树,美国lanatal美国lapponuml .,美国herbaceal . (7),美国hukaoana木村(8),美国arbutifolia棺罩。[9Barker等人(2003)发现了多达31种不同种类的柳树[10].从这个后来的出版物的一个子集标记已经被测试和应用在这篇论文。使用SSR标记,因为它们是共优势的,可以在不同的研究之间进行数据比较。高水平的多态性使它们适合推断相对近期的群体遗传事件;它们还可以用来在基因上区分个体和群体[11].
柳树caprea是一种耐寒的先驱者种,原产于爱尔兰,分布于广泛的生境,是少数能在森林下层生长的柳树种之一[12].它经常被发现生长在树篱,林地边缘或岩石湖岸,因为它比许多其他柳树更能忍受干燥的环境。它也在受干扰的地方和荒地上定居[13].它有时用于短轮作灌木品种的育种计划[14].只有一项种群遗传研究检查了自然种群美国caprea[15],研究了24个欧洲人群的4个PCR-RFLP标记和3个叶绿体SSRs。在欧洲范围内,未发现种群间明显的系统地理结构。没有研究检查爱尔兰人的基因变异美国caprea.
然而,分子生态学的其他几个物种柳树全世界都在研究。Lian等人(2003)[16]利用核和叶绿体微卫星研究了植物种群的遗传结构和繁殖动态美国reinii一种匍匐灌木,是日本富士山火山基质的拓荒者。在这个多倍体物种中检测到克隆生长和幼苗招募的证据。
在英国进行了一项保护和恢复的研究美国lanata而且美国lapponum[17].他们发现了具有5个SSR标记的大多数个体的不同的多位点基因型,并能够推断出有性繁殖是研究地点的主要延续和传播方式。然而,他们也研究了一种更常见的亚北极柳树(美国herbacea),并发现了克隆生长的证据,个体之间的距离可达7米。
美国的另一项研究聚焦于一种本土柳树(美国eriocephala)和归化的(紫竹L.)比较它们种群的遗传多样性和结构[18].他们的结果显示紫竹包含具有相同多位点基因型的植物(推测为无性系),而无性系个体很少美国eriocephala人群。他们认为,营养繁殖与有性繁殖相结合,促成了植物的归化紫竹在美国,导致了更高水平的遗传分化紫竹比当地人口多美国eriocephala人口(18].
近年来对濒危物种的种群遗传结构进行了研究柳树daphnoides斯德。在捷克共和国[19].利用SSR和AFLP标记对14个居群174个个体进行了分析。SSR标记在自然居群中表现出较高的基因型变异性和杂合度。
为了研究爱尔兰天然居群的遗传多样性、基因流动程度和群体遗传结构美国caprea,我们分析了核和叶绿体微卫星标记。采用了多种统计方法,包括1)传统的群体遗传方法先天的群体指定,如多样性统计、爱尔兰等位基因频率、独特基因型、方差分析和按距离隔离的测试,以及2)将单个样本聚类到群体的贝叶斯算法先天的人口的名称。研究结果与之前对其他木本物种(特别是水杨科)的研究结果进行了比较。
具体目的是测试现有的叶绿体和核SSR标记在检测和描述群体遗传多样性和分化方面的能力美国caprea,描述了天然爱尔兰种群的核和cpDNA等位基因和单倍型多样性美国caprea,确定爱尔兰自然居群的地理居群遗传结构水平美国caprea,并确定该物种的基因流动和有性繁殖的程度。
方法
样品收集
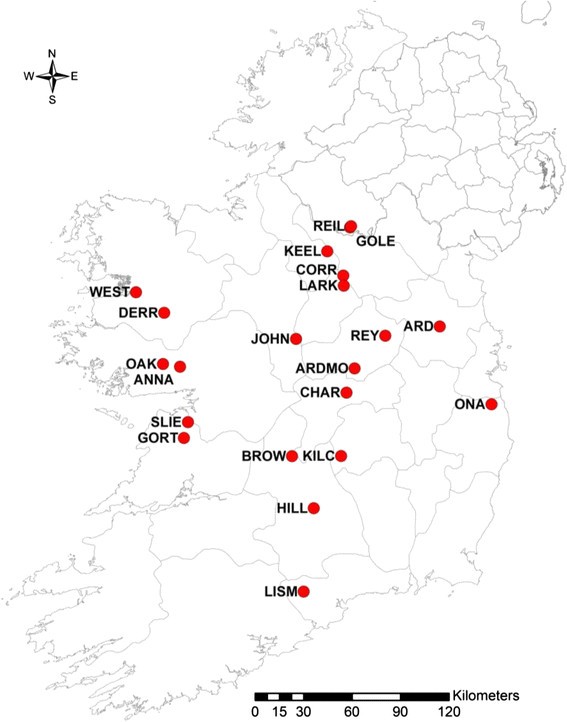
柳树caprea在半自然林地中取样,以下定义为“类似于自然林地覆盖,以原生树木为主,但受人类活动影响的林地”。以前种植过的林分,如现在自然再生,可称为半天然林分,以前被灌木覆盖的林分亦可称为半天然林分" [20.].爱尔兰是欧洲森林覆盖率最低的国家之一,约10%的土地被森林覆盖。然而,8万公顷(约占爱尔兰土地面积的1%)是原生林地,其余是非原生针叶树[21].为了找到适合研究的地点,研究人员对爱尔兰都柏林三一学院和爱尔兰都柏林国家植物园的植物标本室标本进行了研究,以获取地点的位置信息。原生林地调查资料库[22也被检查过。
植物自然居群的叶片样本柳树caprea是2010年和2011年夏天在爱尔兰各地收集的。来自卡万、克莱尔、弗马纳、戈尔韦、拉伊斯、利特里姆、朗福德、梅奥、米思、奥法利、罗斯康芒、蒂珀雷里、沃特福德、韦斯特米思和威克洛县21个地点的183个个体被取样1).每个站点收集了7到23个人(表1).从每棵树上取几片嫩叶,存放在硅胶中[23].的区别柳树caprea从其他杨柳比较明显。为了野外的正确识别,Meikle, 1984 [13和韦伯等人,1996年[24]。
放大和基因分型
用DNeasy植物提取试剂盒(Qiagen, Valencia, CA, USA)从干燥的叶片组织中提取DNA。所使用的标记包括8个叶绿体和6个核SSR位点。该叶绿体SSR标记是利用一套为双子叶被子植物通用设计的引物制备的,并在烟草(烟草l .) [25].使用CCMP2、3、4、5、6、7、8和10。它们大多位于内含子和基因间区。核标记是专门为柳树从丰富的图书馆柳树burjatica[10].使用SB24、38、85、93、194和199。用自动毛细管电泳和荧光标记引物对基因座进行分型。一对的每个前引物在5 '端用荧光染料(JOE™TAMRA或5- fam™)标记。
在PCR扩增之前,使用NanoDrop 2000分光光度计(Thermo Scientific)检测每个样品的DNA数量。CCMP引物的扩增结果如下(12.5 μL): 10ng DNA, 1×无色GoTaq®Flexi Buffer,每个dNTP 0.2 mM,每个引物0.2 μM, 1.5 mM MgCl2, 0.25单位的GoTaq®DNA聚合酶。除CCMP5的正向引物和反向引物均为0.4 μM外,其余引物均为0.2 μM。PCR参数为95°C 4 min,然后在95°C 30 s, 50°C 45 s, 72°C 1 min 15 s循环35次,最后在72°C延伸8 min。使用核SB引物(总体积12.5 μL)扩增,使用10 ng DNA, 1×无色GoTaq®Flexi Buffer,每个dNTP 0.2 mM,每个引物0.32 μM, 1.5 mM MgCl2, 0.25单位的GoTaq®DNA聚合酶。SB38和SB85正向引物和反向引物均为0.4 μM,其他引物均为0.32 μM。PCR参数为94℃2 min,然后在94℃40 s, 54℃1 min, 72℃2 min循环35次,最后在72℃延伸20 min。根据引物的不同,退火温度不同,SB38为48℃,SB85为50℃,SB194为52℃,SB24、SB93和SB199为54℃。
在检查琼脂糖凝胶上的DNA数量后,根据条带的亮度进行1:5到1:80之间的稀释。PCR产物进行多重复用,将1 μL稀释后的混合物加入8.75 μL Hi-Di甲酰胺和0.25 μL内通道尺寸标准品(Genescan™400HD-ROX standard;按照制造商的协议,在ABI 3130xl遗传分析仪(Applied Biosystems)上运行。基因分型后,使用GeneMapper v4.1 (Applied Biosystems)对片段进行大小测定。
数据分析
对于叶绿体和核标记,每个标记的频率分布在Microsoft Excel中绘制,并映射到ArcGIS 10.1 (ESRI)中。计算GenAlEx 6.5中多样性指标的总数、每群体和每个位点[26, popgene 1.31 [27或Arlequin 3.1 [28].不同等位基因数,有效等位基因数(1/(Σp我2)),香农信息指数(−1*Σ(p我* ln (p我)),基因多样性/期望杂合度[29)(1 -Σp我2), (p我I的频率是多少th等位基因和Σp我2为等位基因频率的平方和)、观察杂合子数(杂合子数/n)和Jost的分化估计[30.]、[31]在GenAlEx中计算[32].
POPGENE用于计算集合的整体多样性(总基因多样性=HT)、种群内的多样性(H年代)、遗传分化(G圣= 1 -H年代/HT),每个亚群体内个体的近交系系数(F是),个体相对于种群总数的近交系系数(F它),亚群体内的近交系系数,相对于总(群体间的遗传分化,F圣= (HT-H年代)/HT).的值G圣计算花粉介导/种子介导的基因流比值[33].
在Arlequin中计算各位点的平均基因多样性。用马尔可夫链在Arlequin对核位点进行了Hardy-Weinberg (HW)平衡的精确试验。在Arlequin中采用两种不同的距离分析、不同等位基因数量(F圣)基于无限等位基因模型和大小差平方和(R圣)基于逐步突变模型。基因流估计从F圣从amos (纳米= (1 -F圣)/F圣获取cpSSR数据或纳米= 0.25 * (1 -F圣)/F圣阅览核SSR数据)[34].使用GeneticStudio推断每个群体和所有群体的独特多位点基因型[35].
通过Mantel测试进行距离隔离(IBD)估计。采用两种测试方法:1)所有个体对照从GenAlEx中获得的单倍体遗传距离矩阵(cpSSRs)或共显性基因型距离矩阵(核标记)进行测试,2)用Slatkin线性化矩阵进行测试F圣从Arlequin [36].这两项测试都在GenAlEx中进行,排列为9999个。
遗传结构采用structure v2.3.4进行研究。[37]、[38,该算法应用了马尔可夫链蒙特卡洛(MCMC)算法。这个程序将个体聚类到群体中,并估计每个个体在每个群体中的成员比例。采用相关等位基因频率的外加剂模型KValue从1设置为10,每个值执行10次运行K.磨合期的长度被设定为5万次,而磨合后的MCMC链还要再运行10万次。的最优值K是通过检查确定的ΔK统计(39]使用结构收割机[40].
结果
检测到的等位基因的总体频率
cpSSRs
每个个体的每个位点最多检测到一个等位基因。它们是预测的长度,表明没有污染,目标区域被放大了。8个cpSSRs共发现31个等位基因。微卫星CCMP4和CCMP7是单态的(分别为113和133 bp),而其他微卫星是可变的,每个微卫星都有单核苷酸重复(差异1 bp)。每个位点发现2 - 7个等位基因2).CCMP5变异最大,CCMP10变异最小,仅有2个大小变异(102和103 bp)。当对每个群体的每个微卫星位点的等位基因比例进行测绘(数据未显示)时,未检测到明显的地理模式。
核SSRs
所有6个核标记都具有多态性,每个位点有3到16个等位基因(平均为10)(表2)3.).6个标记共检测到60个等位基因。重复序列均为二核苷酸或三核苷酸。每个位点每个个体最多检测到两个等位基因,这与所有植物都是二倍体的预期一致。SB24变异最多,有16个等位基因,SB85变异最少,只有3个等位基因3.).当对每个群体的每个微卫星位点的等位基因比例进行测绘(数据未显示)时,未检测到明显的地理模式。
遗传多样性
cpSSRs
遗传多样性指标见表2.有效等位基因数量(NE)从CCMP10的1.15到CCMP6的3.66。HT从CCMP10的0.13到CCMP6的0.73。H年代低于所有标记的整体多样性,因为不是所有的等位基因都出现在每个群体中。纳米等于2.29,纳米> 1.0,在种群间分化很小。
核SSRs
有效核等位基因的数量低于等位基因的总数,表明很少有等位基因参与了这种变异(表3.).平均杂合性(HE)在不同的位点上是可变的,反映了所发现的等位基因的不同数量和频率。三个位点,HW测试是重要的。这在SB93和SB199中尤为明显HO被观察到,这被双方证实了吗F是而且F它这些指标高的地方,表明在这两个位点上缺乏杂合子。即使在SB194位点也没有检测到过多的杂合子。纳米等于2.76,纳米>又是1.0,这表明种群间的基因流动是恒定的。
分析人口每
在叶绿体和核SSRs中,平均每个位点和每个群体分别发现2.2个和3.9个等位基因(表2)4).所有样本的平均基因多样性都很高,而且两种标记类型的基因多样性相似(0.56),这表明两个随机选择的基因在大约一半的时间内会携带不同的等位基因。对于每个群体,观察到的杂合度(HO)的杂合度低于预期(HE),但CORR和KILC的杂合子过多。
基因型
当每个个体的所有等位基因组合在一起时,cpSSRs分析发现79个单倍型。其中38个是唯一的,41个是由两个或多个个体(最多10个个体)共享的。相比之下,核标记有165个独特的多位点基因型(90.2%的个体)。个体WEST6、7、8和CORR2、4、6、7、8具有相同的基因型。当结果与cpSSRs结合时,CORR2和6、CORR4和7、WEST7和8具有相同的基因型,表明这些个体可能是克隆性的。
基因结构
G圣对于cpSSR数据是中等的(平均值G圣= 0.38,表2).F圣用核SSR数据计算,根据位点的不同,其含量介于低和中等之间(0.09 ~ 0.28)3.)和G圣约为低的两倍(0.04-0.12),表明分化程度低。根据Petit et al., 2005计算花粉介导/种子介导的基因流比率[33].的平均值G圣从表2和表3.计算了这个比率,结果是6.8。
第三种方法是在Jost的GenAlEx中计算的D(D美国东部时间) [30.].Jost认为,当使用高度多态标记来检测种群间的分化时,G圣或者它的类似物不应该被使用,因为当多样性很高时,这个度量将接近零(没有分化)。这些数据支持这一点,因为SB85是最小的变量,SB38是最大的变量,即使他们G圣相似(0.04比0.06)。D美国东部时间SB85极低(0.002),而SB38和SB194显著较高(0.33和0.27)。SB24和SB93为中度。
AMOVA
在Arlequin使用两种距离测量方法对每种标记类型进行了两个位点的AMOVA分析:F圣而且R圣(表5).从cpSSR的数据来看,两种分析都表明变异主要发生在群体内(70%是在群体内)F圣AMOVA和63%的R圣基于AMOVA),其余的变异在人群之间(表5A和B)。群体间的遗传分化是适度的F圣两种AMOVAs的相关性均显著(0.304和0.371)。用核数据计算的两个amova结果不相同。首先以AMOVA为基础F圣显示大部分的变异是在个体内部(68.9%,表5C),而对于基于的AMOVAR圣分析表明,大多数变异发生在种群内的个体之间(62.4%,表5D).表中方差分量为负5D,结果是否定的R圣这有时会发生,因为计算的是协方差。这表明基因结构的缺失。它也有生物学意义。例如,在雌雄异株的有机体中美国caprea在美国,来自不同种群的基因之间的联系可能比来自同一种群的基因之间的联系更密切。
炎症性肠病
对于cpSSR数据,所有个体之间的第一次Mantel测试显示出轻微的距离隔离模式,尽管斜率几乎等于零(y = 0.0016x + 3.2762;R2= 0.0051,p< 0.0001)。然而,2ndSlatkin线性化检验F圣无IBD (y = 5.10)−5x + 0.4624;R2= 5.10−5,p= 0.426)。对于核SSR数据,得到了与cpSSR分析相似的结果(数据未显示)。所有个体间的第一次检验显著(y = 0.0036x + 8.961;R2= 0.0046,p= 0.003),而是基于人口的Mantel检验F圣差异无统计学意义(y =−0.6.10−04x + 0.1108;R2= 0.0038,p= 0.266)。
贝叶斯聚类
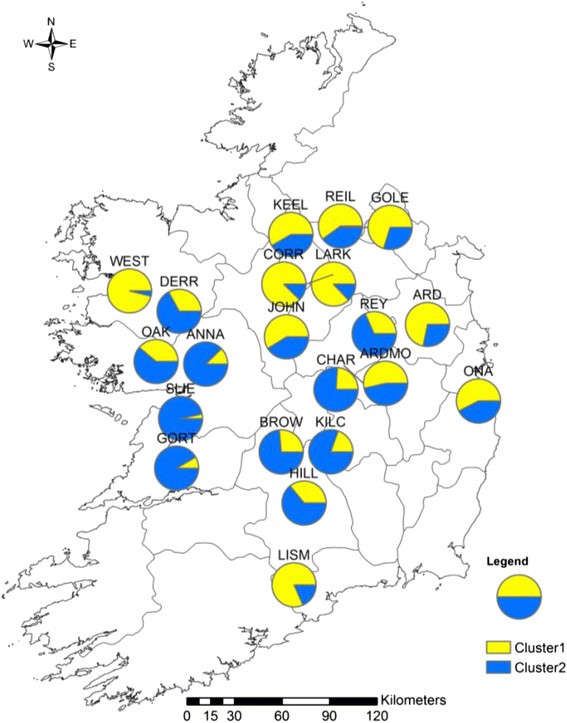
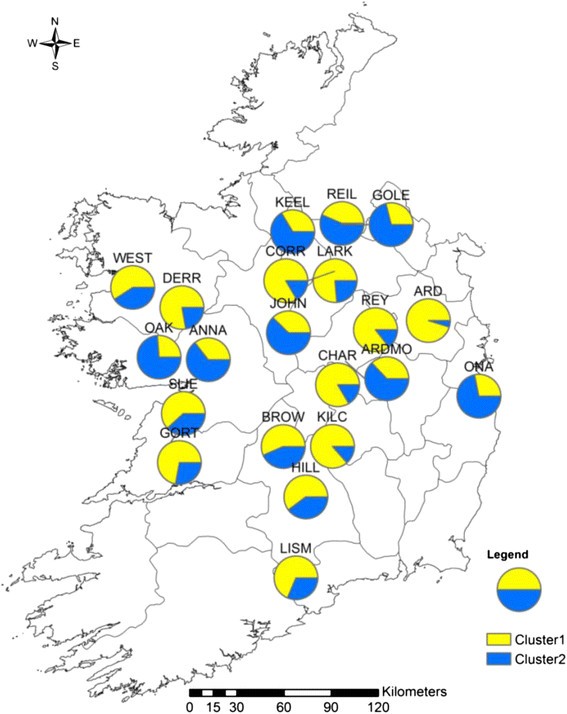
在STRUCTURE软件中实现的聚类支持的最优值为K是K对于两种类型的标记= 2。对每个居群的两个聚类进行映射(cpSSR:图2,核SSR:图3.).在cpSSR分析中发现了一种轻微的地理结构模式。例如,与群集2相关的个体在西部种群中更常见,而与群集1相关的个体在东部种群中更常见。这种结构与cpSSRs的AMOVA结果一致。WEST与其他西方人口有着不同的模式。在核SSR分析中,OAK、ANNA、KEEL、REIL、goole、JOHN、ARDMO和ONA居群具有相似的模式,而cluster 1在其他居群中更为常见。
讨论
遗传多样性和基因流动
每对SSR标记引物都成功扩增了目标DNA美国caprea.cpDNA标记被设计为烟草双子叶被子植物的通用标记[25,这项研究证明了它们在柳树caprea.本研究应用的核微卫星标记也是如此。他们发现了高度的多样性,对群体遗传结构的研究是有用的。核SSR标记被设计用于柳树burjatica[10并被证明在这里工作得很好美国caprea.本研究中发现的等位基因大小范围在Barker等人2003年发现的范围内[10],但SB85、SB93和SB199的尺寸范围略有不同3.).
一些CCMP等位基因可以与另一个微卫星研究中发现的24个种群的CCMP等位基因进行比较美国caprea在欧洲取样[15].在两项研究中,CCMP7均被发现是单型的(135 bp对133 bp,表2).CCMP10变异有限:在Palmé等,2003年发现3个等位基因(107,109,110 bp) [15我们的研究是2(102和103 bp)。在Palmé等中发现了5个CCMP2等位基因。[15(206, 208-211 bp)。在我们的研究中(210-215 bp)发现了6个大小相近的等位基因。使用的片段分析方法不一样,手动丙烯酰胺凝胶运行在Palmé等。[15这可以解释差异。
所有美国caprea研究个体表现出较高水平的cpDNA和核DNA SSR等位变异,群体内部和群体之间发现了大量的基因型。这种高等位基因变异可以用这样一个事实来解释美国caprea一种异交种,产生许多非常小的种子,长有一簇长毛,便于风传播[41].繁殖体也可能是被食草动物、鸟类或人类有意或无意地移动的。我们在中间和中间检测到了许多基因型美国caprea这表明种子在爱尔兰的传播程度很高。这与对自然种群的研究是一致的美国viminalis在捷克共和国[42该研究发现92%的个体具有独特的多位点基因型,并对38个核微卫星进行了分析。少数个体具有相同的叶绿体和核基因型(CORR2和CORR6、CORR4和CORR7、WEST7和WEST8)。本研究中的微卫星标记,特别是核标记具有高度的多态性,因此可以推断这些个体可能是克隆的。然而,随着美国caprea似乎是一种对自然的植物再生很顽固的物种[3.,这些个体很可能是基因的渐渗杂交美国caprea,可能与美国灰质ssp。oleifolia(年代。×reichardtii),因为这种混血儿在爱尔兰很常见[13],并在采集样本时对Corratober (CORR)种群进行形态学检查时注意到。
所有居群均表现出较高的杂合度(HO= 0.41为核SSRs)和基因多样性(H= 0.39, cpSSRs和H= 0.53为核SSRs),与其他水杨科类似美洲山杨,紫竹,美国viminalis或美国daphnoides[18]、[19]、[42]、[43].以Shannon信息指数为代表的研究样本的总体遗传变异性特别高,cpSSRs的平均遗传变异性为1.48,核SSRs的平均遗传变异性为1.35。Shannon指数的高值代表了微卫星位点对揭示气候变化的有效性。
纳米,估计的基因流F圣cpSSRs平均为2.29,核SSRs平均为2.76。在这两种情况下纳米优于1.0,这表明种群之间的基因流动是恒定的(即每一代至少有一个移民);因此,预计随着时间的推移,种群的基因将保持稳定[44].纳米减少与增加F圣因为群体间更大的分化对应着更低水平的基因流动[11].对于异交,雌雄异株的物种美国caprea这部分是风媒传粉,种群之间和种群内部的基因流动预计会很高[45].从我们的数据来看,基因流预计是通过花粉进行的,而很少通过种子进行。事实上,花粉介导/种子介导的基因流之比被发现大约等于7。这表明,通过花粉的基因流大约是通过种子的7倍。它没有Petit等人在2005年发现的比率中位数高[33],基于93种植物,等于17种。传播种子的美国caprea似乎占了整个基因流的很大一部分(大约13%)。
人口结构
遗传分化(G圣cpSSRs的居群显著(平均0.38),而核微卫星的居群较低(平均0.07)。这并非完全出乎意料,因为cpDNA通常在被子植物中由母系遗传[46]、[47],因此它的有效种群规模比核DNA小。因此,虽然发现花粉介导和种子介导的基因流几乎相等,但遗传漂变对叶绿体的作用比核DNA更强烈。母系遗传也意味着cpDNA只能通过种子传播。这意味着G圣cpDNA比核DNA更明显。G圣对人口的影响要低得多美国caprea在欧洲采集叶绿体DNA样本[15].他们找到了一个G圣PCR-RFLP标记为0.090G圣的−0.017。
从核SSR分析中,根据所使用的方法(F圣= 0.08 - -0.16;D美国东部时间= 0.10;G圣= 0.07)。这些数值高于自然种群的估计数值美国viminalis在捷克共和国(F圣为0.05),基于38个核SSRs [42但与保加利亚的人口相当Fraxinus精益求精的树(F圣0.09)基于6个核ssr [48].
cpSSR研究的AMOVA结果显示,大多数变异发生在群体内,但群体间变异适中(30 ~ 37%)。然而,对于核SSRs研究,群体间遗传变异估计要低得多,并且根据所使用方法的不同而不同。据估计,大部分的变异发生在个体内部F圣-AMOVA,但主要在采样点内的个体中R圣-AMOVA。这些结果与其他异交木本物种的结果一致[49]和其他水杨科植物杨树黑质或美国viminalis[42]、[50].在另一项针对16个群体的研究中p .黑质在整个欧洲,90%的遗传变异是在使用的微卫星数据的人群中发现的[51].这些研究的结果是基于F圣只有。
距离隔离试验对cpSSR和核标记都给出了相似的结果。在所有个体的测试中,在成对距离上发现轻微的IBD,但在线性化的测试中没有检测到IBDF圣在抽样站点中。这与一项研究是一致的美国viminalis在捷克共和国[42].IBD检验也符合对种群可能结构的贝叶斯分析。该分析为两种分析确定了两个假定的聚类,但没有发现明显的地理格局。从cpSSR的研究中,可以检测到轻微的东北相对于西方的结构。这在布伦人的两个人口中尤其明显,即GORT和SLIE。这些居群几乎只聚在簇2中,这可能表明在种子中与其他居群的基因流是有限的。伯伦地区的人类活动可能比其他地区要少,这可能减少了人工基因流动的数量。检测到的有限子结构也可能受到生态地理因素的影响,如降雨、温度和土壤类型。这种结构在核分析中没有显示出来,可能表明在种群之间有更强的花粉介导的基因流动。我们的研究虽然发现了一些cpSSR标记在群体间的分化,但在很大程度上与在群体上的研究一致美国caprea通过对3个cpSSRs和4个pcr - rflp的分析,发现该地区缺乏地理结构[15].
有性繁殖被推断为高美国caprea在采样区域内,这是预期的美国caprea除了少数基因型外,对自然营养再生是顽固的[3.].在我们的数据中,大量的多位点基因型是单一个体独有的(90%为核标记)和G圣/F圣/D美国东部时间特别是核SSRs的值较低,与离系繁殖一致,表明在爱尔兰境内跨大地理距离的有性繁殖和基因流动没有显著障碍。
花粉介导和种子介导的基因流动都很高,一些居群之间的距离为230公里。这一发现可能只是由于人类通过种子贸易、大量种植或意外运输种子和花粉的干预。没有人口结构可能表明整个爱尔兰存在着一个大致连续的人口。在我们的工作中还没有进行亲代研究,但结果也可能与远程授粉一致。进行了亲子关系分析杨树trichocarpa[52].在一个研究地点>300公里2在俄勒冈州西部(半径10公里),平均授粉距离为7.6公里,许多记录的交配距离超过10公里[52].他们无法估计花粉能传播的最大距离p . trichocarpa,因为林分内授粉距离的最大值只是反映了研究地点内树木之间的最大潜在距离,这在其他研究中得到了验证[53].
结论
本文利用叶绿体和核微卫星技术研究了黄豆天然居群的遗传多样性、地理居群遗传结构和基因流动程度美国caprea在爱尔兰。新的标记进行了测试,并表明适合于遗传特征美国caprea.这些标记具有高水平的等位基因和遗传多样性,群体内变异占变异的大部分,并检测到大量的独特基因型。种群结构和分化分析以及IBD测试证实了低水平的地理结构变异,但cpSSRs检测到中度分化。然而,基因在种子和花粉中的流动是很大的。这些结果对希望开发自然种群的育种者和必须选择种植材料的林业人员有价值。进一步的分析应该分析爱尔兰人口的变化与欧洲人口的关系。
参考文献
Suda Y, Argus GW:一些北美人的染色体数目柳树.中国科学(d辑),1998,20:191-197。
迪克曼(Dickmann DI, Kuzovkina J):世界杨树和杨柳,重点研究造林的重要树种。意大利罗马:粮农组织森林管理司工作文件IPC/9-2。2008年,1 - 125。
李志强,李志强,李志强,等。难根植物营养繁殖的研究进展柳树caprea.植物工程学报,2004,29(4):369 - 371。
菊科植物菊科植物(Argus GW)杂交与授粉的实验研究柳树(柳)。中国机械工程学报,1994,22(5):527 - 527。
Edwards KJ, Barker JHA, Daly A, Jones C, Karp A:植物微卫星序列富集的微卫星文库。生物技术,1996,20:758-760。
连C,奈良K,中谷H,周铮,吴斌,宫下N, Hogetsu T:多倍体微卫星标记的研究进展柳树reinii.中国生物医学工程学报,2001,1:160-161。
杨晓燕,杨晓燕,杨晓燕,杨晓燕:亚北极柳SSR多态性位点研究(英文)柳树lanata,美国lapponum而且美国herbacea).中国生物医学工程学报,2003,32(3):359 - 359。
Kikuchi S, Suzuki W, Ban N, Kanazashi A, Yoshimaru H:濒危柳树8个多态微卫星的特征分析柳树hukaoana.中国生物医学工程学报,2005,5:869-870。
Hoshikawa T,菊池S,永光T, Tomaru N: 18个微卫星位点柳树arbutifolia(水杨科)和跨种扩增柳树而且杨树物种。中国生态学报,2009,29(4):369 - 369。
Barker JHA, Pahlich A, Trybush S, Edwards KJ, Karp A:多样性的微卫星标记柳树物种。中国生物医学工程学报,2003,3:4-6。
Freeland JR, Petersen SD, Kirk H:分子生态学。威利-布莱克威尔,奇切斯特,英国,2011年。
Preston CD, Pearman D, Dines TD: Willows。英国和爱尔兰植物区系新图集:英国、爱尔兰、马恩岛和海峡群岛维管植物图集。编辑:Preston CD, Pearman D, Dines TD, Isles BSB。2002,牛津大学出版社,牛津,236-249。
英国和爱尔兰的柳树和杨树。不列颠群岛植物学会,英国伦敦,1984。
杨文华,李文华,李文华,等:国内外短轮林研究进展与展望。2010年,COFORD都柏林
Palmé AE, Semerikov V, Lascoux M:缺乏地理结构的叶绿体DNA变异,柳树caprea中国遗传学报,2003,29(4):366 - 366。
连春林,大石R,宫下N,奈良K,中谷H,吴by,周志华,虎得津T:大石竹的遗传结构与繁殖动力学柳树reinii核和叶绿体微卫星分析显示,在富士山的初级演替中。中国生物医学工程学报,2003,29(3):369 - 371。
王晓燕,王晓燕,王晓燕:三种亚北极柳的克隆多样性(白柳,白柳而且柳树herbacea).植物生态学报,2007,29(4):447 - 447。
林杰,Gibbs JP, Smart LB:本地与归化共缘灌木杨柳群体遗传结构(柳树;杨柳科)。中国生物学报,2009,32(5):771-785。
Sochor M, Vasut RJ, Bartova E, majky L, Mracek J:种群间的基因流动能否抵消极度脆弱生物群落栖息地的丧失?群体遗传结构的一个例子柳树daphnoides.中国植物学报,2013,29(5):573 - 573。
原生林地计划,2001年,林业局,海洋和自然资源部,约翰斯顿城堡庄园,爱尔兰韦克斯福德
服务F:爱尔兰共和国国家森林调查结果。政府出版物,都柏林,2007年。
Perrin P, Martin J, Barron S, O'neill F, Mcnutt K, Delaney A:全国原生林地调查-第一卷主要报告。向国家公园和野生动物管理局报告;2008年。。,http://www.npws.ie/media/npws/publications/reports/media,6688,en.pdf]
Chase MW, Hills HH:硅胶:一种用于DNA研究的树叶样品现场保存的理想材料。中国生物技术学报,1994,19(4):447 - 447。
Webb DA, Parnell J, Doogue D:水杨科。爱尔兰植物志,第七版。登达甘出版社,爱尔兰,登达克,1996:21-25。
Weising K, Gardner RC:一套用于分析双子叶被子植物叶绿体基因组简单序列重复多态性的保守PCR引物。中华医学杂志,1999,42:9-19。
Peakall R, Smouse PE: GenAlEx 6.5: Excel中的遗传分析。用于教学和科研的种群遗传软件的更新。生物信息学,2012,28:2537-2539。
叶fc,杨仁春,Boyle TB,叶振,毛建新:POPGENE,用户友好的群体遗传分析共享软件。分子生物学和生物技术中心,1997,加拿大阿尔伯塔大学,10-
Excoffier L, Laval G, Schneider S: Arlequin(3.0版本):群体遗传数据分析的集成软件包。生物信息学学报,2005,1:47-50。
细分群体的基因多样性分析。中国生物医学工程学报,2003,23(3):369 - 369。
Jost李:G圣它的近亲不衡量分化。中华分子生物学杂志,2008,17:4015-4026。
Meirmans PG, Hedrick PW:评估种群结构:FST和相关措施。植物生态学报,2011,11:5-18。
分子进化遗传学。哥伦比亚大学出版社,纽约,1987。
Petit RJ, Duminil J, Fineschi S, Hampe A, Salvini D, Vendramin GG:植物群体叶绿体、线粒体和核多样性的比较组织。中国生物医学工程学报,2005,14:689-701。
Hamilton MB, Miller JR:用种群结构的细胞核和细胞器测量方法比较岛屿模型中花粉和种子基因流动的相对速率。遗传学杂志,2002,162:1897-1909。
Dyer RJ: GeneticStudio:一套用于遗传标记数据空间分析的程序。中国生态学报,2009,29(3):447 - 447。
基于微卫星等位基因频率的种群细分测量。中国生物医学工程学报,2004,25(3):366 - 366。
Falush D, Stephens M, Pritchard JK:利用多位点基因型数据推断群体结构:连锁位点和相关等位基因频率。遗传学报,2003,34(4):369 - 369。
王晓燕,王晓燕,王晓燕。基于多位点基因型数据的群体结构推断。遗传学杂志,2000,155:945-959。
王晓燕,王晓燕,王晓燕,等:基于结构的个体簇数检测方法研究。分子生物学与分子生物学杂志,2004,14:2611-2620。
BM:结构收割机:一个用于可视化结构输出和实现伊凡诺方法的网站和程序。中国环境科学,2012,4:359-361。
柳树:柳属。英国电信巴特福德有限公司,英国伦敦,1992年。
Trybush SO, Jahodova S, Cizkova L, Karp A, Hanley SJ:高水平的遗传多样性柳树viminalis微卫星标记所显示的捷克共和国。生物能源学报,2012,5:969-977。
De Woody J, Rickman TH, Jones BE, Hipkins VD:等位酶和微卫星数据显示,在Cascade山脉南部的白杨克隆规模小,遗传多样性高。生态学报,2009,38(4):387 - 396。
罗维、哈里斯、阿什顿:生态遗传学:设计、分析和应用。美国马尔登布莱克韦尔:2004年牛津大学。
Loveless MD, Hamrick JL:植物种群遗传结构的生态决定因素。生态系统学报。1994,15:65-95。
Dumolin S, Demesure B, Petit RJ:用高效PCR方法研究有柄栎叶绿体和线粒体基因组的遗传。应用理论与实践,1995,21(4):356 - 356。
Rajora OP, Dancik BP:植物叶绿体DNA遗传杨树.《应用理论与实践》,1992,34(5):561 - 561。
Heuertz M, Hausman JF, Tsvetkov I, Frascaria-Lacoste N, Vekemans X:保加利亚普通白蜡树种群内部和种群间遗传结构的评估(Fraxinus精益求精的l .)。中国生物医学工程学报,2004,21(3):356 - 356。
杨晓峰,杨晓峰,杨晓峰:植物生活史性状对遗传多样性的影响。数学物理与工程学报,1998,15(4):391 - 398。
Imbert E, Lefevre F:扩散和基因流动杨树黑质(水杨科)沿着一个动态的河流系统。中国生物医学工程学报,2003,31(4):447-456。
Smulders MJM、Cottrell JE、Lefevre F、van der Schoot J、Arens P、Vosman B、Tabbener HE、Grassi F、Fossati T、Castiglione S、Krystufek V、fluh S、Burg K、Vornam B、Pohl A、Gebhardt K、Alba N、Agúndez D、Maestro C、Notivol E、volosychuk R、Pospíšková M、Bordács S、Bovenschen J、van Dam BC、Koelewijn HP、Halfmaerten D、Ivens B、van slecken J、Vanden Broeck A等:黑杨树遗传多样性结构(杨树黑质l)欧洲河流系统的人口:保护和恢复的后果。生态学报。2008,255:1388-1399。
Slavov GT, Leonardi S, Burczyk J, Adams WT, Strauss SH, Difazio SP:两个生态对比居群的花粉广泛流动杨树trichocarpa.分子生物学杂志,2009,18:357-373。
阿什利·MV:植物亲缘、授粉和传播:DNA微卫星如何改变了景观。植物生态学报,2010,29:148-161。
确认
我们感谢爱尔兰都柏林三一学院的Daniel Kelly博士提供的采样帮助和Philippe Cubry博士提供的技术支持。我们也感谢公共和私人业主进入采样地点。这项研究得到了来自爱尔兰农业和食品发展局Teagasc的沃尔什奖学金博士助学金的支持。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者声明他们没有竞争利益。
作者的贡献
AP对样品进行取样、实验、数据分析并撰写论文。CK对样本进行取样,并对实验设计、分析和手稿撰写做出了贡献。TH参与了论文的取样、实验设计、分析和撰写。GD参与了论文的取样、实验设计和撰写。所有作者阅读并批准了最终稿件。
权利和权限
本文由BioMed Central Ltd.授权发布。这是一篇开放获取文章,根据创作共用授权协议(http://creativecommons.org/licenses/by/4.0),它允许在任何媒体上不受限制地使用、分发和复制,只要原始作品的名称正确。创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条提供的资料。
关于这篇文章
引用这篇文章
佩德罗,ac,凯莱赫,ct,道格拉斯,cet al。高水平的基因流动和遗传多样性的爱尔兰人口柳树caprea从叶绿体和核SSR标记推断。BMC植物杂志14日,202(2014)。https://doi.org/10.1186/s12870-014-0202-x
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-014-0202-x
关键字
- 遗传多样性
- 微卫星
- 人口结构
- 柳树
- 柳树