摘要
背景
植物病毒感染在侵入组织时扰乱防御调节网络。新出现的证据表明,这些改变的很大一部分是由激素失衡介导的。尽管DELLA蛋白已被报道为激素交叉信号的中心角色,但它们在病毒感染期间调节激素信号的作用仍不清楚。
结果
这项工作揭示了TMV-Cg外套蛋白(CgCP)在不改变防御激素SA或茉莉酸(JA)水平的情况下抑制水杨酸(SA)信号通路拟南芥.此外,还观察到CgCP的表达降低了植物的生长并延迟了花的转变时间。对DELLA靶基因的定量RT-qPCR分析表明,CgCP改变了多个靶基因的相对表达,表明DELLA蛋白介导了由CgCP表达引起的转录变化。荧光共聚焦显微镜分析表明,在赤霉素(GA)存在时,CgCP稳定了DELLA蛋白的积累,并且DELLA蛋白在TMV-Cg病毒感染过程中也稳定了。此外,DELLA蛋白在TMV-Cg感染期间负向调节防御转录谱。结果表明,与野生型植物相比,四della突变拟南芥的TMV-Cg积累显著减少。
结论
综上所述,这些结果表明CgCP通过稳定DELLA蛋白,负调控水杨酸介导的防御途径拟南芥这表明CgCP改变了DELLAs的稳定性,是一种负调控抗病毒防御反应的机制。
背景
在植物和病毒病原体之间建立的共同进化过程中,植物病毒已经进化出各种改变宿主成分的方法来有效地感染植物。新出现的证据表明,病毒通过产生激素失衡扰乱植物的防御调节途径[1].激素在诱发疾病方面的作用已在以前的报告中提出;然而,这些研究并没有描述激素失衡的相关因素[2].最近,一些病毒蛋白已被证明可以改变宿主成分的定位和活性之一或两者,这可能会影响相容相互作用期间的激素平衡[3.]、[4].例如,水稻矮缩病毒(RDV) P2病毒蛋白修饰了参与赤霉素(GA)生物合成的一个因子[3.],因此GA的积累减少。双病毒的C2蛋白干扰泛素化途径的调控成分[4],它参与调节多种激素反应[5].此外,TMV复制酶蛋白被发现破坏生长素反应调节因子吲哚乙酸IAA26/PAP1的定位,从而改变生长素调控基因的表达[6]、[7].最近,人们观察到TMV-Cg改变了参与脱落酸/乙烯信号通路平衡的转录因子的功能[8].
烟草病毒有一个单链RNA基因组,编码四种特征良好的蛋白质:两种蛋白质负责RNA依赖的RNA复制;另一种参与细胞间的运动,最后是一种外衣蛋白(CP) [9]、[10].巴巴病毒CPs主要与病毒粒子组装过程中的结构功能有关。然而,CP还涉及病毒感染的其他几个方面[11].例如,烟草花叶病毒CP (TMV CP)是向远处植物组织的系统运动所必需的[12]并在病毒复制复合体中发现,这表明TMV CP可能是有效病毒复制所必需的[13]、[14].此外,TMV CP在很大程度上影响病毒感染症状的发展[15]并对其他病毒产生异源干扰[16].
积累TMV CP的转基因植物对病毒表现出明显的抗性,从而延迟症状的出现[17].这种现象被称为coat protein-mediated resistance (CP-MR)。接种TMV-RNA的CP转基因植株克服了这一抗性机制;这使得Beachy提出CP阻断了早期感染步骤[10].卡尔等人[18]研究了发病相关蛋白(PR蛋白)在CP-MR中可能的作用,但没有得到肯定的证据。与此相反,我们小组最近获得的结果表明,表达TMV CP的转基因烟草植株积累了一些水杨酸(SA)反应基因的mRNA水平降低,如pathogenesis-related (PR-1)和RDR1(RNA依赖RNA聚合酶1)与WT(非转基因野生型)植物相比[19].
在许多兼容的植物-病毒相互作用中,SA可减少病毒复制并限制细胞间移动和系统运动[20.] - [22].对RNA病毒接种的拟南芥叶片的研究表明,病毒诱导的至少三分之一的常见基因集与植物防御和胁迫反应有关[23].最重要的是,在sa信号突变体中,许多这些基因的诱导受到了损害。这一发现表明SA参与了在兼容病毒相互作用期间发生的病毒诱导信号传导[24]并表明植物病毒已经进化出了在兼容的相互作用中逃避sa诱导的防御的策略。一些研究表明病毒蛋白可以抑制SA信号通路[25]、[26,强化了逃避假说。DELLA蛋白是生长的负调控因子,在GA存在时通过泛素-蛋白酶体途径降解[27].这些蛋白质也可能在激素交叉对话中发挥整合中枢的作用[28].此外,它们还通过抑制SA防御反应来促进对生物营养性细菌病原体的敏感性拟南芥[29].最近,一些报告表明,病毒改变激素的生物合成和信号传递[1].然而,DELLA蛋白在病毒感染过程中调控信号事件的作用尚未被阐明。
为了进一步分析巴巴病毒外壳蛋白在兼容病毒相互作用中的作用,我们进行了研究,以确定来自TMV-Cg的CP是否能够调节防御反应拟南芥.TMV-Cg是一种感染拟南芥的Tobamovirus [30.].在这个实验中,我们使用了在诱导启动子下表达CgCP的转基因植物[31].转基因CgCP的表达稳定了DELLAs蛋白,抑制了一组sa反应基因的表达。在本研究中,我们确定了DELLAs蛋白在TMV-Cg感染过程中信号事件调节中的作用。我们证明了在TMV-Cg感染期间,CgCP稳定了DELLAs蛋白,这种稳定导致了sa防御信号通路的调节。
结果
ccp的表达下调了拟南芥SA反应基因的表达,但不改变SA或JA的水平
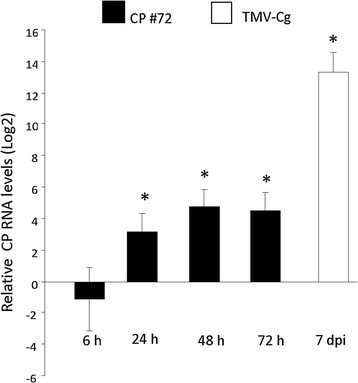
为了研究CgCP表达在病毒防御信号应答中的作用,我们使用了一个含有CgCP基因的拟南芥转基因株系(CP#72),该基因由诱导启动子调控[31].该化学诱导基因表达系统以甲氧苯肼(MOF)为诱导剂[31]、[32].转cp# 72基因的植株生长到1.08期[33](发芽后约20天)以建立CgCP的表达水平。然后用MOF处理植株,在诱导后的不同时间点采集样品。采用RT-qPCR方法,比较了cp# 72与表达TMV-Cg CP的本构转基因株系的水平花椰菜花叶病毒(CaMV) 35S启动子(cp# 71)。在WT-Col-0(非转基因)TMV-Cg感染植株中测定了CgCP的积累水平。在诱导CgCP 24小时后,诱导系(CP#72)比组成型表达系(CP#71)显示出更高水平的CP转录本(图2)1).诱导后48小时达到最大积累水平,并维持在72小时(图2)1).然而,在TMV-Cg感染的植株中,其水平低于感染后7天的水平(dpi)1).本文报道的CgCP积累的时间模式与Koo等人的报道相似。[31].
在之前的工作中,我们证明了这一点n .烟草表达TMV CP的转基因植物积累的PR-1和RDR-1成绩单(19].基于这些发现,我们选择了一组参与抗病毒防御信号的sa反应基因,以量化它们在cp# 72转基因系中的转录水平:RDR1;AOX1A和WRKY70.RDR1是RNA沉默机制的一个组成部分[34].AOX1A是植物抗氰化物替代呼吸途径的末端氧化酶,也与病毒抗性有关[21].最后,基于WRKY70在SA信号通路中的调控作用,我们选择了WRKY70 [35].
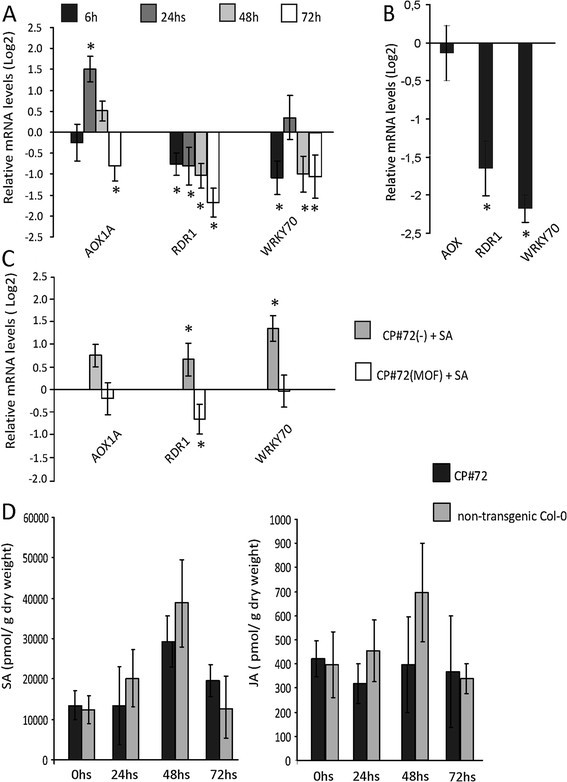
减RDR1和WRKY70在诱导后48和72 h, mof处理的CP#72植株的mRNA水平与水处理的CP#72植株相比有所下降AOX1A仅在CgCP诱导72 h后检测到mRNA水平(图2A).同时,我们在cp# 71独立转基因系中定量了同一组基因(图2B)。RDR1和WRKY70与非转基因植物相比,这一独立转基因系的表达水平也有所降低。然而,AOX1A在cp# 71转基因株系中保持不变。
ccp表达下调SA反应基因的转录水平,但不改变内源性SA或JA水平。一)相对mRNA水平AOX1A,RDR1和WRKY70在cp# 72(MOF)植物(MOF处理)中诱导CgCP后的基因超过72 h。非诱导的CP#72(−)(水处理)作为对照,表达水平被任意设置为1 (Log2(1) = 0)。B)在1.08发育阶段,组成型表达CP #71系与WT Col-0植株的相对mRNA水平WT行中的表达式级别被任意设置为1 (Log . Log . Log)2(1) = 0)。C)SA处理后CP#72的相对mRNA水平。在诱导后48小时,向经水处理的CP#72(−)或经MOF处理的CP#72(MOF)植株喷洒0.5 mM SA (+SA)或水(−)。表达水平参考非诱导的CP#72(−)植物(水处理),并任意设置为1 (Log2(1) = 0)。一),B)和C)RT-qPCR检测相对转录水平。数据与四次生物重复的平均值±标准误差相对应。星号表示差异有统计学意义(* = P值< 0.05)。D)采用高效液相色谱法测定了MOF诱导后0、24、48和72 h cp# 72和非转基因Col-0植株JA和SA的积累水平。0小时的数据对应未经处理的植物。显示了四个生物重复±SE的平均值。
另外进行了一项对照实验,以排除在cp# 72转基因株系中观察到的转录变化是由MOF处理引起的。我们测定了WT- Col-0植物经水处理或MOF处理(MOF后48小时)后这些转录本的表达水平。本实验的结果显示,两种处理之间没有统计学上的显著差异,证实所有的表达变化都是由CgCP表达引起的(附加文件1).
接下来,我们分析的表达水平WRKY70,AOX1A和RDR1在SA激素处理下对CgCP诱导的反应(图2C).为此目的,转CP#72基因的植株最初用MOF或水处理,随后(48小时后)喷洒0.5 mM SA或水。以未处理的CP#72(无MOF和SA)作为对照(CP#72对照),分析激素处理后24 h的基因表达水平。不出所料,水平WRKY70,AOX1A和RDR1在SA处理(CP#72(−)+ SA)后,对照植物(暴露于水)的含量增加。然而,与水处理的CP#72对照植物相比,SA处理并没有增加MOF诱导的CP#72植株(CP#72(MOF) + SA)的基因表达(图2)2C).因此,这些结果表明,CgCP负调控WRKY70,AOX1A和RDR1SA处理后的转录水平。
由于CgCP改变了SA信号相关基因的表达,我们接下来定量了转CP#72转基因植物和用MOF处理的WT-Col-0中SA和茉莉酸(JA)的水平。选择JA是因为JA对SA有拮抗作用。在MOF处理后,cp# 72和WT植物在整个研究过程中没有观察到SA或JA水平的统计学差异,甚至在0 h(非诱导植物)也没有观察到(图)2D)这一发现与我们之前对tmv感染的研究结果一致烟草[19].因此,这些实验证明CgCP在不改变SA或JA基础水平的情况下调节SA信号。
CgCP的表达降低了植物的生长并延迟了花的转变时间
最近的证据表明,植物病毒可以干扰激素的合成和信号传递,从而改变植物的发育[1].研究CgCP是否发生改变拟南芥在正常发育的基础上,详细分析了转CgCP转基因植株的表型。
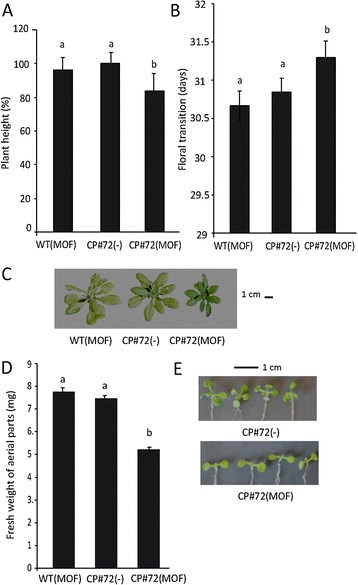
mof诱导的CP#72植株株高降低3.A)和开花时间的延迟(图3.B)与经过水处理的CP#72植物相比。另一对照是用MOF处理非Col-0转基因植株。当这些对照与经过水处理的CP#72植株进行比较时,没有发现统计学差异。由此可见,CgCP的表达是导致花转化高度和时间延迟的主要原因(图3.我们还评估了cp# 71转基因植株的表型(附加文件)2).与用MOF处理过的转基因CP#72植株观察到的结果相似,CP#71植株高度降低(附加文件)2)和开花时间的延迟(附加文件2)与非转基因Col-0植物相比。这些发育变化在Koo等人的工作(2004)中没有报道,可能是由于所使用的实验程序的差异。在Koo等人使用CP#72转基因株系进行的实验中,对CP#72株系的MOF处理是在较晚的发育阶段(5 / 6周龄)进行的,此时花序已经出现[33].因此,CP积累对花的转变时间没有影响。因此,当我们分析CP#72转基因株系的幼苗发育时,我们发现与用水处理的幼苗相比,mof诱导的CP#72转基因株系的地上部分生长显著减少(图2)3.在本分析中,我们还使用MOF处理的非转基因Col-0幼苗作为对照(野生型植物,WT)。如附加文件所示3., mof处理的WT Col-0植株与水处理的非转基因Col-0植株的生长没有差异。因此,只有在发育早期表达CgCP时,CgCP才会改变拟南芥幼苗和成体的正常发育。CgCP表达对发育和激素信号通路的影响表明,CgCP可能改变了调节生长和激素相互作用的一个基本成分。DELLA蛋白是这两个过程的核心[28]、[36]、[37];因此,这些蛋白可能在CgCP表达过程中观察到的表型中发挥作用。这些数据促使我们分析DELLA蛋白在CgCP表达过程中的作用。
CgCP的表达降低了植物的生长并延迟了花的转变时间。在mof处理的WT Col-0和mof处理的CP#72植株中进行了测量。数据与非诱导的CP#72(−)植物(水处理)进行比较。一)柱状图显示株高(6周)和B)花的转变(到第一朵花的天数)。每一列代表25株植物的平均值±SE。C)代表性的WT Col-0和CP#72转基因6周龄植株在MOF (MOF)或水(−)存在下生长。D)柱状图显示了在MOF (MOF)或水(−)存在下生长7天的Col-0 (WT)和cp# 72转基因10日龄幼苗的平均鲜重。每一列代表18种植物的平均值±SE。E)具有代表性的10日龄CP#72转基因植株在MOF (MOF)或水(−)中生长7天。所有测量在两个独立的实验中得到了相似的结果。柱状上方不同字母表示样本间差异显著,p值≤0.05。
CgCP增加DELLA靶基因的表达,稳定DELLA蛋白的积累
为了探究della是否在CgCP表达过程中观察到的变化中起作用,我们分析了一组della反应基因的mRNA转录水平(Zentella et al., 2007)。泛素结合酶17(UBC17),IQ-DOMAIN 22(IQD22),Ga不敏感侏儒1b(ATGID1b),BASIC HELIX -LOOP HELIX 137 (bHLH137)是植物幼苗中被GA下调而被DELLA蛋白稳定上调的转录本[38].为了研究这组基因在莲座叶中的转录水平,我们定量了它们在拟南芥cv Ler四DELLA突变体(缺乏四个DELLA基因的植物)中的表达。RGA,时至今日,RGL1,RGL2) [27也在勒城gai-1突变体(因gai -本构稳定而对赤霉素不敏感的植物)[39].在本实验中,我们收集了1.08发育期的莲座叶组织。UBC17和bHLH 137转录水平在统计学上增加gai-1与非突变Ler植物相比(附加文件4).另一方面,UBC17,IQD22,ATGID1b,与非突变Ler植株相比,四突变della植株的转录水平有统计学上的降低(附加文件)4).
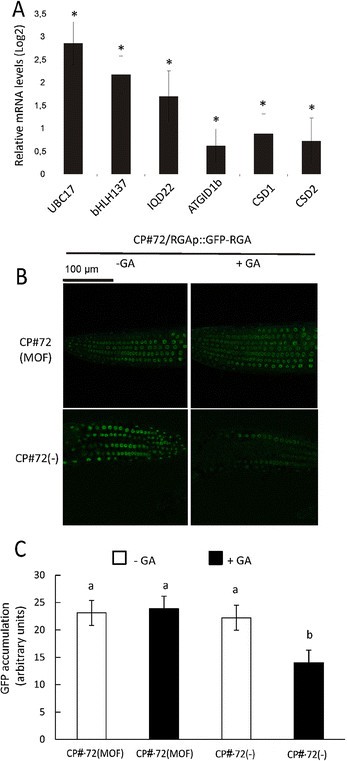
接下来,为了确定CgCP对这些基因转录水平的影响,我们量化了CgCP诱导后的转录水平。MOF诱导的CP#72 (MOF暴露72小时后)植株与未诱导的CP#72植株相比积累了更高水平的della靶基因(图2)3.A).此外,我们还评估了另外两个DELLA调控基因的转录水平。Cu/Zn超氧化物歧化酶(Cu/ Zn SOD)CSD1和CSD2,均被DELLA蛋白正调控[36].如图所示4一个,两个CSD1和CSD2CgCP可上调转录水平;这表明在ccp表达过程中观察到的基因表达的调节可能是由DELLA蛋白调控的。
ccp的表达增加DELLA靶标的表达,稳定DELLA的积累A)。DELLA靶基因相对mRNA水平UBC17,bHLH137, IQD22,ATGID1b, CSD1和CSD2通过RT-qPCR对诱导的CP#72植株(MOF处理后72 h)与水处理的CP#72(−)植株进行检测。在cp# 72(−)植物中的表达水平被任意设置为1 (Log2(1) = 0)。显示了四个生物重复的均值±SE。星号表示差异有统计学意义(* = P值< 0.05)。B)在诱导(MOF)和水处理(−)CP#72/RGAp::GFP- rga初生幼苗根中观察到GFP荧光。诱导3 d (MOF处理)后,用10 μMGA处理3.(+GA)或水(−GA) 1 h。实验重复两次,结果相似。C)该柱状图显示了拟南芥细胞核中GFP的积累水平。定量分析在方法中解释。柱状上方不同字母表示样本间差异显著,p值≤0.05。
为了确定DELLA蛋白是否通过CgCP表达而稳定,我们分析了CgCP诱导后的蛋白积累。为此,我们交叉了表达RGA的转基因系,RGA是五种DELLA蛋白之一,与GFP融合(pRGA::GFP-RGA) [40得到CP#72/pRGA::GFP-RGA。通过使用携带这两种转基因基因的纯合子,我们评估了MOF或水处理下赤霉素酸(GA)处理的幼苗中RGA-GFP的水平3.) (10 μm)。RGA-GFP在苗期很容易通过荧光共聚焦显微镜检测到[29].正如预期的那样,GA处理可以降解RGA-GFP(图4B)在非诱导的CP#72/pRGA::GFP-RGA幼苗中。然而,在拟南芥幼苗中,CgCP的表达减少了ga介导的RGA-GFP的降解(图4B)。
为了量化GFP-RGA蛋白在拟南芥细胞核中的积累量,我们使用ImageJ软件分析了5种不同植物的20个随机细胞核在不同处理下的GFP-RGA荧光强度(详见方法)。在添加GA之前,用MOF处理的CP#72/RGA::GFP-RGA植株与用水处理的CP#72/RGA::GFP-RGA植株的GFP-RGA荧光比较没有发现统计学上的显著差异3..添加GA后3.经水处理后,转基因CP#72/RGA::GFP-RGA植株细胞核的GFP-RGA荧光显著降低(图4C和附加文件5).相比之下,在cp# 72/RGA::GFP-RGA mof处理的植株中,添加GA后GFP-RGA荧光没有降低3..(10 μM4C和附加文件5).综上所述,这些实验证明CgCP稳定DELLA蛋白,从而改变基因表达谱。
CgCP抑制了一组由DELLA蛋白调控的防御基因
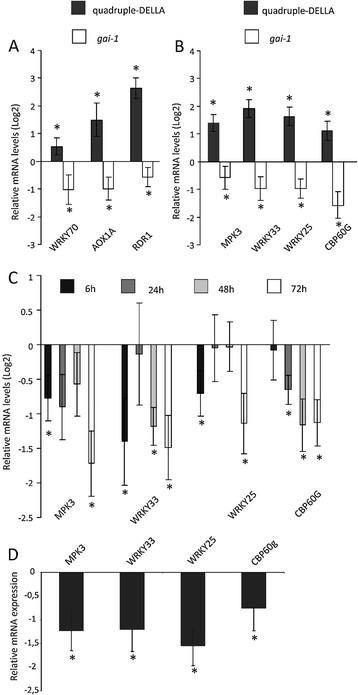
CgCP表达下调了一组sa反应基因(WRKY70,AOX1A和RDR1)也稳定了DELLA蛋白的积累。因此,我们分析了这些转录本在四重della和四重della中的表达水平gai-1和预期的一样,变种人发现WRKY70,AOX1A和RDR1在四倍della突变体中表达上调,而在gai-1突变体。野生型拟南芥Ler植物作为这些实验的参考对照(图5A).规则RDR1特别有趣的是,该基因对于维持对几种RNA病毒(包括TMV-Cg)的基础抗性至关重要[34].
ccp的表达抑制了DELLA蛋白调控的一组防御基因。一)RT-qPCR测定sa反应基因的相对mRNA水平(WRKY70,AOX1A和RDR1),B)DELLA相关防御基因(MPK3,WRKY33,WRKY25和CBP60g)gai-1以及与WT-Ler植株相比的四倍della突变体。WT-Ler植物的表达水平被任意设置为1 (Log2(1) = 0)。C)通过RT-qPCR测定诱导的CP#72植物(MOF处理)与水处理的CP#72(−)对照植物72 h内DELLA相关防御基因的相对mRNA水平。在cp# 72(−)植物中的表达水平被任意设置为1 (Log2(1) = 0)。D)的表达CBP60g,MPK3,WRKY25和WRKY33在cp# 71转基因系中。计算了cp# /71植株与WT-Col-0植株的相对mRNA水平。WT-Col-0植株的表达水平被任意设置为1 (Log2(1) = 0)。一),B),C)和D)显示了四个生物重复的均值±SE。星号表示差异有统计学意义(* = P值< 0.05)。
已知SA可诱导多种病毒抗性机制[41]、[42),RDR1只是该机制中涉及的组件之一。我们继续确定由CgCP诱导的DELLA蛋白稳定是否改变了sa诱导抗性的其他重要基因的表达。出于这个目的,我们包含了一个更大的候选集合。这一选择是基于对拟南芥之间进行的微阵列研究的分析gai-1用flg22处理的突变体和非突变体(WT)植物(GEO编号:GSE17464)。数据来自genevvestiator数据库[43](附加文件6).这组新的候选基因,涉及SA生物合成,先天免疫信号和应激反应,显示表达水平降低gai-1flg22后的突变株(gai-1+ flg22)处理与flg22处理的非突变株(WT + flg22)相比(附加文件)6).CBP60G编码钙调蛋白结合蛋白,该蛋白在SA积累和SA信号传导中起作用[44];MPK3编码病原体感染激活的MAPKs [45];WRKY25和WRKY33SA处理后应激反应及表达增加[46]、[47].通过RT-qPCR,我们定量了这些防御基因在四聚della突变体中的转录水平gai-1将这些突变体的水平与WT-Ler对照植株的水平进行比较5B).与WT-Ler植物相比,四倍della突变体中所有这些基因的表达水平都更高。相反,gai-1突变体显示这些转录本水平降低。
接下来,我们分别在CgCP诱导后6、24、48和72 h,研究了mof诱导或水处理的CP#72植株中这些基因的表达5C).同样,与用水处理的CP#72植株相比,MOF处理后CP#72植株中所有四个基因的表达水平都降低了。与非转基因Col-0植株相比,在cp# 71独立转基因株系中观察到这组基因的类似下调,该株系构成性地表达CgCP(图1)5D).综上所述,CgCP表达后观察到的表达谱与实验中观察到的相似时至今日-1突变体,与della -四重突变体相反。因此,这些发现有力地表明,ccp的表达通过稳定DELLA蛋白来减弱防御基因的表达。
TMV-Cg感染稳定DELLA蛋白积累
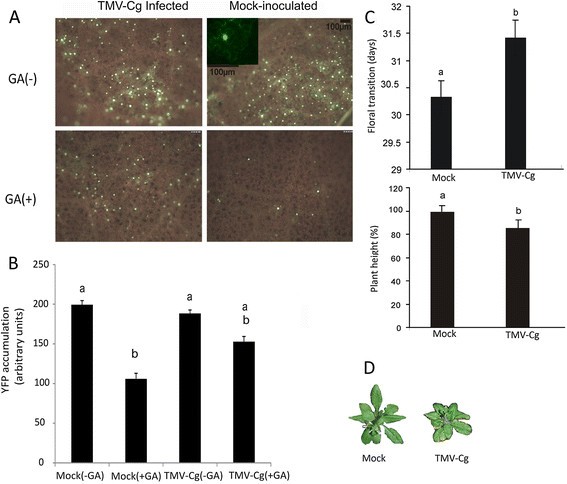
基于获得的结果,我们决定确定在TMV-Cg感染期间是否也产生了CgCP对DELLA稳定的影响。在这个实验中,烟草benthamiana植物接种TMV-Cg病毒或缓冲液(模拟接种)。随后(6天),用yfp - gai表达物对上叶植株进行浸种[48].n benthamiana之所以选择这种植物,是因为这种植物可以很好地表达YFP-GAI融合,并且易于使用荧光显微镜检测[4].农业浸润后3天,YFP-GAI主要在两种tmv - cg感染的细胞核中富集n benthamiana植物和病毒模拟接种的植物(见图6插图)。用赤霉素处理两组植株的叶片外植体3.(100 μM)溶液浸泡1小时,然后在荧光显微镜下观察。不出所料,GA处理后植株的荧光减弱。在TMV-Cg感染的植物中也观察到YFP-GAI荧光的减少,但程度较小,与模拟感染的植物相比,显示出可检测到的差异(图6A).量化YFP-GAI蛋白在细胞核内的积累量n benthamiana使用ImageJ软件分析每种处理下来自五种不同植物的20个随机核的YFP-GAI荧光强度(更多细节见方法部分)。TMV-Cg侵染植株细胞核中YFP-GAI荧光强度与模拟接种植株细胞核中YFP-GAI荧光强度无统计学差异。然而,我们观察到,与GA处理前的模拟接种植物细胞核中YFP-GAI荧光积累相比,GA处理后的模拟接种植物细胞核中YFP-GAI荧光强度有统计学意义上的降低(图6B).如附加文件所示7在GA处理的模拟接种植物中,检测到YFP-GAI蛋白的细胞核数量和YFP-GAI荧光水平均降低(附加文件)7B)。或者,当TMV-Cg感染植株用GA处理时,与GA处理前感染植株细胞核中YFP-GAI积累相比,细胞核中检测到的YFP-GAI积累并没有显著减少(图6B和附加文件7D)。因此,这些结果清楚地表明TMV-Cg病毒延缓了ga介导的DELLAs降解。
DELLA蛋白在TMV-Cg感染期间稳定,并降低植物生长和延迟花的转变时间。一)荧光显微镜观察YFP-GAI在细胞核内的积累。TMV-Cg感染n benthamiana叶片和模拟接种n benthamiana在6 dpi时,用携带YFP-GAI的结构对叶片进行农渗。农渗后72 h,喷洒100uMGA3.(GA+)或水(GA-),然后在一小时后观察。这个实验重复了两次,得到了相似的结果。B)该柱状图显示了benthamiana细胞核中YFP的积累水平。定量分析在方法中解释。C)用TMV-Cg病毒接种非转基因Col-0(生长到1.08期)植株的第三条真叶。与模拟接种的植株相比,测定了TMV-Cg感染植株的花的转变和植株的生长(6周时的株高)。D)代表性的6周龄模拟接种的非转基因Col-0植株和感染的非转基因Col-0植株。B)和C)柱状上方不同字母表示样本间差异显著,p值≤0.05。
此外,我们分析了在TMV-Cg病毒感染期间产生的症状拟南芥植物。与观察到的DELLA蛋白的稳定性一致n benthamiana在TMV-Cg感染期间,感染TMV-Cg病毒的拟南芥植株显示出高度降低和花转变延迟(图6C和D)。
DELLA蛋白在TMV-Cg感染过程中调节转录谱
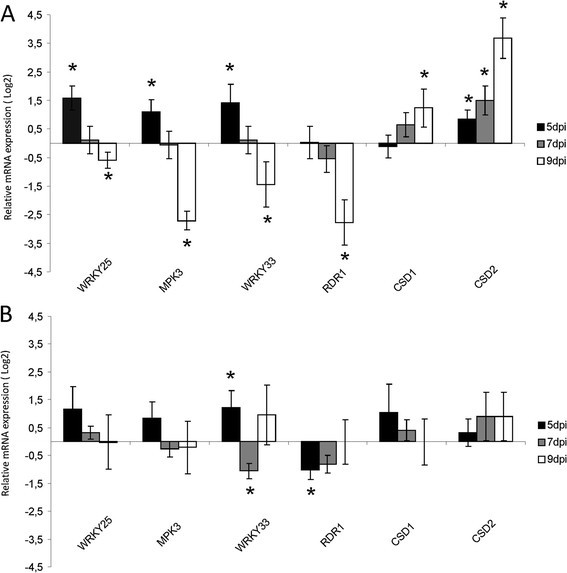
DELLA蛋白在TMV-Cg感染期间的稳定使我们假设这些蛋白可能参与了这种感染期间转录谱的调节。因此,我们鉴定了DELLA蛋白在病毒感染过程中对DELLA调控基因的调节作用。为此,利用TMV-Cg病毒侵染WT拟南芥植株,在侵染后5、7、9天分别采集样本,通过RT-qPCR检测一组della调控基因的转录水平。如图所示7一个,WRKY25,WRKY33,MPK3与模拟接种WT植株相比,TMV-Cg感染WT植株在5 dpi时转录水平提高了(几乎两倍或更多)。然而,在7 dpi时,这些转录本在感染和模拟接种植物之间没有被检测到表达差异(图7A)。在9 dpi时,与模拟接种的WT植物相比,感染WT植物中这些转录本的水平降低了(图7A).的表达水平RDR1与模拟接种WT植株相比,TMV-Cg感染WT植株在5和7 dpi时没有变化,但在9 dpi时显著下降(图7A).这些转录本水平在9 dpi时丰度的降低与之前在CgCP转基因表达过程中观察到的丰度下降一致。
DELLA蛋白在TMV-Cg感染过程中调节转录谱。一)相对mRNA水平WRKY25,WRKY33,MPK3,RDR1,CSD1和CSD2在5、7和9 dpi时,通过RT-qPCR检测了TMV-Cg感染WT-Ler植株与模拟感染WT-Ler植株的差异。在模拟接种的WT植株中,表达水平被任意设置为1 (Log2(1) = 0)。B)表达水平WRKY25,WRKY33,Mpk3 rdr1 csd1和CSD2在5、7和9 dpi时,与未感染的四della突变体植株相比,四della突变体植株在四della突变体植株中有显著的差异。在模拟接种的四倍della植株中,任意设置表达水平为1 (Log2(1) = 0)。一)和B)显示了四个生物重复的均值±SE。这个实验重复了两次,得到了相似的结果。
同时,另外两个DELLA靶标的表达,CSD1和CSD2,在WT植株感染后同一时间点测定。CSD1在5 dpi时无变化,但在7和9 dpi时其丰度明显增加。相反,CSD2从5 dpi开始略有增加,在7和9 dpi时增加较大(图7A)。同样的,CSD1和CSD2据报道,随着DELLAs的稳定,转录水平有所提高[36].因此,这些结果表明DELLA-target转录本在TMV-Cg感染过程中发生了改变,这表明DELLA蛋白可能参与了对TMV-Cg的防御反应。
为了进一步研究DELLA蛋白在转录谱调控中的作用,用TMV-Cg病毒感染四突变体植物。WRKY25和MPK3, CSD1和CSD2与模拟接种的四重DELLA突变体植株相比,TMV-Cg感染的四重DELLA突变体植株在5和7 dpi时转录本水平没有改变WRKY33和RDR1在5和7 dpi时改变了它们的转录水平(图7B)。与在WT植物中观察到的相反,与未感染的四重DELLA突变植物相比,所研究的基因在TMV-Cg感染的四重DELLA突变植物中9 dpi的表达没有变化(图7B).这些结果表明DELLA蛋白参与了TMV-Cg感染过程中转录谱的调节。
DELLA蛋白稳定减弱对TMV-Cg感染的防御反应
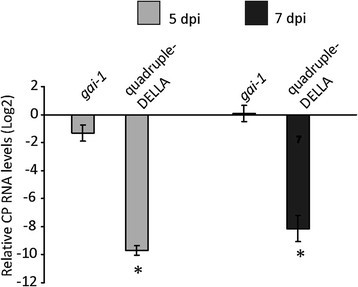
为了确定DELLA蛋白在sa介导通路上的作用是否对TMV-Cg感染水平有任何影响,我们分析了四组DELLA和四组的CP积累水平gai-1突变体与WT Ler植株CP积累量的比较。在5和7 dpi进行RT-qPCR分析。在5和7 dpi时,观察到四倍della突变体中TMV-CgCP的积累减少(减少超过100倍)(图8).然而,两组间在CP积累方面没有发现差异gai-1-突变植物和WT Ler植物(图8).此外,我们还分析了四倍della突变体与非突变体Ler植株的复制酶转录本积累情况。类似地,我们观察到与非突变的Ler植株相比,四倍della突变体中TMV-Cg复制酶的积累减少8).这些结果表明,DELLA蛋白对防御途径的调节可能是减少非突变体植物中病毒积累的原因。
讨论
CgCP下调SA防御反应
相容的宿主-病毒相互作用导致系统性感染,从而引发基因表达的广泛变化[49].为了研究CgCP对改变宿主基因表达的贡献,我们使用了在诱导启动子下表达CgCP的转基因植物。使用这个系统,我们证明了CgCP减少了一组sa反应基因的表达(图2此外,我们还研究了这些基因在一种在组成启动子下表达CgCP的转基因植物中的表达。在两个转基因系中,我们观察到所评估基因的转录物积累减少,除了AOX1A。而表达水平AOX1A在cp# 72植株中诱导后24 h,在诱导后72 h减少,在cp# 71转基因株系中保持不变,构成性表达CgCP。相比之下,所有其他基因在两个植物系中表现相似。一种可能的解释是CgCP只引起一种瞬时的调制AOX1A表达式。另一种可能是,只有当CgCP积累达到高于在cp# 71转基因系中观察到的水平时,AOX1A的表达水平才会改变。
在MOF缺失的情况下,SA诱导CP#72植株SA反应基因的表达;而在MOF存在的情况下,在表达CgCP时,SA无法诱导这组基因的表达(图2C).这些结果与我们小组先前使用组成性表达TMV CP的转基因烟草植物所作的观察结果一致[19].
之前一项分析拟南芥-多巴病毒相互作用的研究表明,TMV下调了系统感染组织中sa信号成分的表达[25].在本研究中,我们观察到在SA水平不变的情况下,CgCP降低了一组SA反应基因的表达。这些结果表明,CgCP可能通过干扰参与激素对谈的宿主成分来负性调节sa感知/信号通路。最近,一些研究表明,植物病毒蛋白抑制防御信号成分的作用[25]、[26].特别是CaMV的P6作为致病性效应因子,降低sa反应基因的表达[26].事实上,P6修饰了NONEXPRESSOR OF PATHOGENESIS-RELATED1 (NPR1),从而降低了sa反应基因的表达,但增加了ja依赖基因的表达。在本研究中,表达CP的转基因植物与非转基因植物相比,SA或JA的积累水平没有差异(图2D).因此,这些结果表明,CgCP通过改变激素交叉信号中的一个或多个成分来抑制sa感知或下游信号通路。
ccgcp的表达稳定DELLA蛋白,抑制生长拟南芥
近年来,DELLA蛋白已被证明参与调节激素和防御信号通路之间的交叉信号,包括JA和SA信号的平衡[29].在这里,我们证明了CgCP延迟ga介导的GFP-RGA (DELLA蛋白)融合蛋白的降解(图4此外,在表达CgCP的植株中,della -靶基因的表达量增加。最近;E3连接酶的损伤被认为是病毒用来保护通常不稳定的蛋白质的一种策略[50].此外,双病毒C2/L2蛋白已被证明与COP9信号体(CSN复合物)的一个成分相互作用,降低基于cul1的SCF泛素E3连接酶上的CSN活性[4].因此,基于CUL-1的泛素连接酶在这些植物中发生改变。这些连接酶参与调控许多激素信号因子,其中包括DELLA蛋白。
基于这些先前的数据,一种可能的推测可能是CgCP改变了蛋白酶体机制的某些成分,因此,这将在CgCP表达期间延迟ga介导的DELLA蛋白降解。另外,对DELLA稳定的影响可以通过TMV-Cg CP改变ga信号通路的特定成分的能力来解释。例如,RDV的P2蛋白与一种参与赤霉素生物合成的t-kaurene氧化酶样蛋白相互作用,因此,与未接种的植株相比,受感染的水稻植株表现出赤霉素GA1水平的降低[3.].由于GA水平降低,感染RDV的水稻植株与未感染的植株相比株高降低[3.].重要的是,这些发现表明GA水平的变化或GA介导信号的改变可以解释植物病毒产生的一些症状。
在这里,我们证明了当CgCP转录水平在植物发育早期积累到较高水平时,CgCP表达会降低幼苗和成体植物的生长(图2)3.A, 3b, 3d)综上所述,在目前的工作中,我们证明了CgCP稳定DELLA蛋白,因此拟南芥表现出开花时间的延迟以及植物生长的减少。
DELLA蛋白负向调节抗病毒防御信号通路
DELLAs在调节对生物营养性细菌病原体的防御反应中的作用先前已由Navarro等人描述。[29].然而,它们在病毒信号防御中的作用尚未被研究.这一特定的研究领域尤其相关,因为参与抗病毒耐药性的sa信号传导成分不同于由其他病原体触发的sa信号传导成分。例如,PR蛋白参与了对细菌或真菌的抗性,但似乎没有在抗病毒抗性中发挥作用[42].此外,SA对病毒积累的抑制似乎依赖于特定宿主成分的作用。其中一种蛋白质,RDR1,是RNA沉默通路的组成部分。RDR1是维持对包括TMV在内的几种RNA病毒的基础抗性所必需的[51].此外,感染rdr1TMV-Cg的突变植物在接种和系统感染的叶片中导致更高的病毒积累[34].除了RDR1对病毒抗性的直接作用外,该蛋白还可能间接调控其他防御相关基因的表达n .烟草[52].的表达水平AOX1A在WT植株中,PVY侵染后表达水平升高,而AOX1A并没有增加rdr1PVY感染后的突变体。AOX1A也被认为参与了sa诱导的易感烟草植物的病毒抗性[21].
在这项工作中,我们研究了两者的表达RDR1和AOX1A在四倍della突变体中gai-1突变体植物。的表达水平降低AOX1A和RDR1基因观察gai-1突变株与非突变株比较(图5A).相比之下,四重-德拉突变体表达较高AOX1A和RDR1与非突变Ler植株相比(图5A).一些报道表明活性氧(ROS)参与了信号防御事件并增强了SA信号[53]、[54].特别是,最近的研究表明,sa诱导RDR1NPR1蛋白的表达依赖于NPR1蛋白,过氧化氢可增强其表达[55]、[56].此外,SA和过氧化氢也参与其中AOX1A感应(57]、[58].DELLA蛋白增加编码ROS解毒酶的基因表达,从而降低ROS水平[36].基于这些发现,DELLA蛋白可能正在衰减RDR1和AOX1A通过改变ROS水平表达。此外,这些发现表明DELLA蛋白在病毒感染期间的稳定可能增强了植物对病毒的易感性。
TMV-Cg病毒在TMV-Cg感染期间稳定DELLA蛋白并减弱防御信号的诱导
DELLA蛋白在几种非生物和生物胁迫下稳定,[29]、[59]和病毒蛋白表达期间[4].然而,DELLA蛋白在病毒感染过程中的作用以前没有被描述过。在这里,我们观察到TMV-Cg病毒延缓了ga介导的DELLA降解n benthamiana植物(图6此外,我们发现TMV-Cg延缓了花的转变并降低了株高拟南芥(图6C).这一结果与DELLA蛋白参与胁迫下的生长抑制反应相一致。
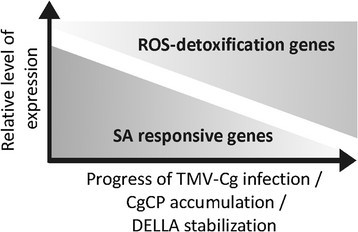
TMV-Cg稳定DELLA蛋白,反过来这些蛋白负向调节抗病毒防御基因的表达。这些结果使我们假设DELLA蛋白可以改变TMV-Cg感染期间的基因表达谱。正如预期的那样,随着TMV-Cg表达的进展,相同sa反应基因的表达减少(图7A),同时增加两个DELLA-target转录本的表达量,CSD1和CSD2的值(图7A)。与未感染的四della突变体相比,感染TMV-Cg的四della突变体在9 dpi时这些基因的表达谱保持不变(图7B);这表明DELLA在被测基因改变中有明确的作用。基于这些结果,我们提出了一个模型来描述DELLA蛋白在TMV-Cg感染过程中sa反应基因调节中的作用9).随着病毒感染的进展,CgCP稳定DELLA蛋白。这种稳定性增强了sod解毒基因的表达,并负调控了SA-反应基因的表达。
此外,基于本文的结果,可以认为CgCP通过减弱della调控的sa反应性防御基因的表达来增强宿主的易感性。与这一假设一致,我们观察到感染的四倍della突变体(其中防御基因过度表达)积累的病毒CP mRNA比感染的WT-Ler植株少约100倍。然而,病毒积累水平在感染者中保持不变gai-1突变体与感染WT-Ler植株的比较(图8).类似地,之前对其他小组的观察也表明NahG与野生型植物相比,接种多巴巴病毒(ORMV)的植物(缺乏SA的植物)对病毒的易感性没有增强[24].Huang等人认为,病毒可以在兼容的相互作用中抵消sa防御反应[24].因此,这种抵消作用可以解释为什么SA的耗尽不会增强病毒的易感性。
结论
综上所述,植物病毒蛋白调节激素信号通路似乎是对抗宿主防御的另一种机制。特别地,这项工作证明了CgCP通过稳定DELLA蛋白来减弱SA下游的信号通路。此外,本研究表明DELLA蛋白在病毒感染过程中是稳定的,从而调节SA抗病毒基因的水平。这意味着DELLA蛋白可能增强植物对TMV-Cg病毒感染的易感性。进一步研究DELLA蛋白在病毒感染过程中所起的作用,将有助于理解多巴巴病毒对SA信号的调控。
方法
植物材料
的拟南芥本研究中使用的系来自Landsberg erecta (Ler)生态型(pRGA::GFP-RGA),gai-1(TAIR株号:CS63)及四della突变系)[60]、[40]或Columbia (Col-0)生态型(cp# 72转基因系)[30.].通过交叉相应的行生成pRGA::GFP-RGA x CP#72行。通过基因组聚合酶链式反应(PCR)筛选,获得纯合子双转基因植株。
成熟植物生长实验
拟南芥种子播种到花盆中,在4°C下分层3天,以协调发芽,然后转移到AR-95 L受控环境箱(Percival, Perry, IA)。植物在标准条件下生长。相对湿度保持在60 ~ 70%。根据生长阶段的不同,通常每两到三天对植物进行次灌溉。日长设置为16小时/天。白天和夜间温度分别维持在23°C和21°C。盆栽顶部的平均光强为100 μmol m−2证券交易委员会−1.为了分析TMV-Cg CP对生长的影响,对生长到1.08期的cp# 72植株分别用61.3 μM MOF和水处理。随后,6周后测量株高。
幼苗生长实验
所有种子表面消毒后置于Murashige Skoog (MS)(半浓缩MS培养基)板上,4°C,同步发芽3天。然后将平板放置在生长室(20°C;16:8 h亮/暗光周期)。发芽完成后,用61.3 μM MOF或水处理幼苗。10 d后测定mof处理苗和模拟处理苗的鲜重。
CgCP诱导及SA处理
成熟的拟南芥在SA处理前48 h,用61.3 μM MOF或水处理土壤(1.08期)。然后,向植物喷洒0.5 ml的0.5 mM水杨酸(SA)或水。SA处理后24小时,整个莲座取样,立即在液氮中冷冻,并保存在−80°C下,直到RNA分离。
荧光显微镜检测GFP-RGA
GFP-RGA水平由荧光共聚焦显微镜测定,如前所述[40].五天的老pRGA:GFP-RGA x CP#72幼苗在一半MS培养基上生长,61.3 μM MOF处理3 d,然后用10 μM GA3处理1 h。
SA和JA测量
SA和JA含量的测定如前所述[19].拟南芥在生长1.08期,61.3 μM MOF处理Col-0和cp# 72叶片。在MOF处理后0、24、48、72 h采集样品。
烟草benthamiana瞬时表达测定
的烟草benthamiana植物接种TMV-Cg病毒。如前所述,在感染后6天(dpi)进行农业浸润[61].GA处理和YFP-GAI可视化,如Lozano-Durán所述[4].
GFP和YFP积累的定量分析
利用ImageJ软件(http://imagej.nih.gov/ij/).所有可见核都被量化,在可见核少于20的情况下。所有图像都是使用相同的显微镜设置并以相同的方式处理的。使用Infostat统计软件(Infostat 2008版),采用单向方差分析与Tukey后测进行统计比较。Grupo InfoStat。FCA,科尔多瓦国立大学)。两后验的显著性水平为α = 0.05。
病毒感染检测
每株第3个展开叶(1.08期)喷洒碳化硅。加入20 mM磷酸盐缓冲液(pH为7)稀释的半纯化TMV-Cg病毒5 μl,轻轻擦拭叶片表面。对模拟接种的植物进行缓冲摩擦。在第5、7、9 dpi取样。叶片在液氮中冷冻在单独的试管中,并在- 80°C保存,直到提取RNA。
实时定量聚合酶链反应(RT-qPCR)
总RNA是从冷冻中分离出来的拟南芥用Trizol试剂(Invitrogen)处理叶片组织,随后用DNAse I (Invitrogen)处理。对于信使rna检测,根据制造商的说明使用MMLV (Invitrogen)合成第一链cDNA。所有RT-qPCR实验均在ABI Prism 7500 Real - Time PCR System (Applied Biosystems)设备中进行,实验条件遵循MIQE (quantitative Real - Time PCR experiment for publication of quantitative Real - Time PCR Minimun information)要求(见表)1有关详情)。Ubiquitin5 (UBQ5, NM-116090)作为内参基因。用于RT- qPCR的寡核苷酸引物组列于表中2.RT-qPCR数据分析及引物效率采用LinReg PCR软件[62].用内参基因对给定靶基因的表达进行标准化;然后,使用Pfaffl等人开发的算法计算处理之间的比率。[63].使用fgStatistics软件界面(J. A. Di Rienzo,个人通讯)进行相对表达率和统计分析。统计学上显著性差异的分界点为P值< 0.05,用*表示。
统计分析
分析了不同植物组间SA和JA水平、株高、花期和鲜重。所有统计比较均采用单因素方差分析(one-way ANOVA)与Tukey后测,使用Infostat统计软件(Infostat 2008版)。Grupo InfoStat。FCA,科尔多瓦国立大学)。所有后验的显著性水平为α = 0.05。
附加文件
缩写
- CaMV:
-
花椰菜花叶病毒
- CgCP:
-
TMV-Cg外膜蛋白
- CP-MR:
-
外套蛋白介导的抗性
- 遗传算法:
-
赤霉酸
- 是:
-
茉莉酸
- MIQUE:
-
实时荧光定量PCR实验发布的最低信息
- 财政部:
-
Methoxyfenozide
- PR1:
-
Pathogenesis-related
- RDV:
-
水稻矮缩病毒
- RDR1:
-
RNA依赖的RNA聚合酶
- 山:
-
水杨酸
- 烟草花叶病毒:
-
烟草花叶病毒
- WT:
-
野生型植物
参考文献
帕拉斯V, García JA:植物病毒是如何诱发疾病的?与主机组件的交互和干扰。中华病毒学杂志,2011,29(3):344 - 344。
赫尔:马修斯的植物病毒学。伦敦,elsevier文献出版社;2004.
朱松,高峰,曹霞,陈明,叶刚,魏春,李艳:水稻矮缩病毒P2蛋白与t-kaurene氧化酶相互作用,导致赤霉素生物合成减少和水稻矮缩症状。植物科学进展,2005,29(3):344 - 344。
Lozano-Durán R, Rosas-Díaz T, Gusmaroli G, Luna AP, Taconnat L, Deng XW, Bejarano ER:双病毒通过改变csn介导的SCF E3连接酶复合物的去ruylation破坏泛素化并抑制拟南芥茉莉酸信号。植物学报,2011,23:1014-1032。
黄志刚,李志刚。植物泛素、激素与生物胁迫的关系。学报学报,2007,29(3):344 - 344。
Padmanabhan MS, Goregaoker SP, Golem S, Shiferaw H, Culver JN:烟草花叶病毒复制酶蛋白与Aux/IAA蛋白PAP1/IAA26的相互作用与疾病发展相关。中国病毒学杂志,2005,79(4):2549-2558。
杨晓明,张晓明,张晓明,等:烟草花叶病毒复制酶蛋白对Aux/IAA互作蛋白的定位和功能的影响。植物微生物学报,2006,19(8):864-873。
陈玲,张玲,于东:拟南芥损伤诱导WRKY8参与基础防御。植物学报,2010,23:558-565。
豆虫病毒与植物相互作用综述。中国病毒学杂志,1992,18(4):359-367。
涂层蛋白介导的烟草花叶病毒抗性:发现机制和开发。中国农业科学,1999,29(4):457 - 457。
Callaway A, Gillock ET, Sit TL, Lommel SA:植物RNA病毒的多功能衣壳蛋白。植物学报,2001,39:419-460。
Hilf ME, Dawson WO:多巴虫病毒衣壳蛋白在长距离运动中起宿主特异性决定因素的作用。中华病毒学杂志,1993,19(4):457 - 457。
陈志伟,陈志伟,陈志伟,等:烟草花叶病毒侵染过程中表皮蛋白调控复制复合物的形成。自然科学进展,2004,29(3):344 - 344。
王晓明,王晓明,王晓明,王晓明,等:转基因烟草幼苗中传染性TMV基因表达的抑制作用。植物生态学报,2007,30(4):489- 494。
Dawson WO, Bubrick P, Grantham GL:烟草花叶病毒外壳蛋白基因的修饰影响复制、运动和症状学。植物学报,2004,27(3):344 - 344。
Bazzini AA, Asurmendi S, Hopp HE, Beachy RN:烟草花叶病毒(TMV)和马铃薯病毒X (PVX)外壳蛋白分别对PVX和TMV感染产生异源干扰。中华病毒学杂志,2006,37(3):344 - 344。
Nelson RS, Abel PP, Beachy RN:表达烟草花叶病毒外壳蛋白基因的转基因烟草植株接种后的损伤和病毒积累。中华病毒学杂志,1997,33(4):344 - 344。
Carr JP, Beachy RN, Klessig DF:烟草的PR1蛋白是否参与了对TMV的基因工程抗性?中华病毒学杂志,1998,19(4):457 - 457。
陈志伟,陈志伟,陈志伟,陈志伟,等:烟草花叶病毒衣壳和运动蛋白的转基因表达对烟草基础防御和生物胁迫的调控作用。植物生态学报,2012,25:1370-1384。
刘志刚,刘志刚,刘志刚:dicer样蛋白2、3和4对水杨酸胁迫下黄瓜花叶病毒和烟草花叶病毒侵染的影响。中华病毒学杂志,2009,30(4):349 - 349。
杨晓明,杨晓明,杨晓明,等:水杨酸对烟草花叶病毒复制的影响。植物科学学报,1997,19(4):457 - 457。
Alamillo JM, Saénz P, García JA:水杨酸介导和rna沉默防御机制共同抑制了李痘病毒在烟草中的系统传播。植物学报,2006,38(4):344 - 344。
Whitham SA,全S, Chang H, Cooper B, Estes B,朱涛,王霞,侯勇:不同RNA病毒诱导拟南芥易感植物共同基因组的表达。植物学报,2003,33(3):344 - 344。
黄忠,黄志刚,范杰,王晓明,王晓明,王晓明,王晓明。拟南芥病毒与水杨酸相互作用中宿主基因的表达。中国生物医学工程学报,2005,27(3):344 - 344。
王欣,郭高克SP, Culver JN:烟草花叶病毒复制酶蛋白与NAC结构域转录因子的相互作用与抑制宿主系统防御有关。中国病毒学杂志,2009,43(3):344 - 344。
Love AJ, Geri C, Laird J, Carr C, Yun B-W, Loake GJ, Tada Y, Sadanandom A, Milner JJ:花椰菜花叶病毒蛋白P6抑制水杨酸信号应答并调节先天免疫。PLoS ONE。2012, 7: e47535-
孙天平,郭伯乐F:植物赤霉素信号转导的分子机制。植物学报,2004,29(3):357 - 357。
Grant MR, Jones JDG:激素(dis)和谐塑造植物健康和疾病。科学通报,2009,37(3):357 - 357。
Navarro L, Bari R, Achard P, Lisón P, Nemri A, Harberd NP, Jones JDG: DELLAs通过调节茉莉酸和水杨酸信号平衡控制植物免疫应答。动物学报,2008,18:650-655。
Yamanaka T, Komatani H, Meshi T, Naito S, Ishikawa M, Ohno T:烟草花叶病毒株Cg基因组RNA全核苷酸序列。病毒基因,1998,16:173-176。
顾建平,陈晓明,陈晓明,陈晓明,等:烟草花叶病毒外壳蛋白基因在转基因拟南芥中的表达及其对病毒抗性的影响。植物学报,2004,37:439-448。
Martínez-Andújar C, Ordiz MI, Huang Z, Nonogaki M, Beachy RN, Nonogaki H: 9-顺式环氧类胡萝卜素双加氧酶诱导拟南芥种子增强种子休眠。自然科学进展,2011,29(4):379 - 379。
杨晓东,刘志刚,刘志刚,刘志刚,刘志刚,等,Görlach J:基于拟南芥表型分析的植物功能基因组学研究。植物科学学报,2001,29(3):344 - 344。
Yu D, Fan B, MacFarlane SA, Chen Z:拟南芥RNA依赖性RNA聚合酶在抗病毒防御中的作用分析。植物生态学报,2003,26(3):366 - 366。
李娟,李建军,李志军,等:WRKY70在植物防御中的信号通路选择调控作用。植物学报,2006,46:477-491。
Achard P, Renou J-P, Berthomé R, Harberd NP, Genschik P:植物DELLAs通过降低活性氧水平抑制生长和促进逆境生存。动物学报,2008,18:656-660。
Claeys H, De Bodt S, Inzé D:赤霉素和DELLAs:生长调控网络的中心节点。植物科学进展,2014,19(4):231-239。
Zentella R, Zhang Z-L, Park M, Thomas SG, Endo A, Murase K, Fleet CM, Jikumaru Y, Nambara E, Kamiya Y, Sun T-P:拟南芥早期赤霉素信号的della直接靶点的全局分析。中国生物医学工程学报,2007,29(3):357 - 357。
彭J, Carol P, Richards DE, King KE, Cowling RJ, Murphy GP, Harberd NP:拟南芥GAI基因定义了一个负向调控赤霉素反应的信号通路。基因工程学报,1997,11:3194-3205。
彭俊,彭俊杰,陈志勇,陈志强,陈志强,陈志强,陈志强,陈志强。植物激素信号对植物生长发育的影响。科学通报,2006,31(4):344 - 344。
杨晓明,杨晓明,杨晓明,杨晓明,杨晓明。烟草花叶病毒抗性的研究进展植物科学学报,2003,27(3):344 - 344。
刘志刚,刘志刚,刘志刚。诱导抗性信号通路的研究进展。对植物病毒的天然和工程抗性。第75卷。编辑:Loebestein G, Carr JP。学术出版社,伦敦,57-121。Maramorosch K, Murphy F和Shatkin A(系列编辑):病毒研究进展;2010.
Zimmermann P, Hirsch-Hoffmann M, Hennig L, Gruissem W:基因研究者。拟南芥微阵列数据库和分析工具箱。植物科学学报,2004,26(3):344 - 344。
张颖,徐松,丁鹏,王东,程宜婷,何娟,高敏,徐峰,李颖,朱震,李晓霞,张艳:植物特异转录因子家族的两个成员对水杨酸合成和系统获得性抗性的控制。中国科学:自然科学,2010,29(3):344 - 344。
韩玲,李国军,杨克勇,毛刚,王蓉,刘勇,张松:丝裂原活化蛋白激酶3和6在拟南芥中调控灰霉病诱导的乙烯生成。植物学报,2010,29(4):344 - 344。
Lippok B, Birkenbihl RP, Rivory G, Brümmer J, Schmelzer E, Logemann E, Somssich IE:编码病原体或pamp响应WRKY转录因子的AtWRKY33的表达受含有W盒元件的复合DNA motif调控。植物微生物学报,2007,20:420-429。
郑z, Mosher SL, Fan B, Klessig DF,陈震:拟南芥WRKY25转录因子在植物防御丁香假单胞菌中的功能分析。中国生物医学工程学报,2007,7:2-
Gallego-Bartolomé J, Arana MV, Vandenbussche F, Zádníková P, Minguet EG,瓜迪奥拉V, Van Der Straeten D, Benkova E, Alabadí D, Blázquez MA:激素作用控制拟南芥根尖钩发育的层次。植物学报,2011,29(3):344 - 344。
Whitham SA, Yang C, Goodin MM:全球影响:阐明植物对病毒感染的反应。植物生态学报,2006,29(4):528 - 528。
alcade - loridan C, Jupin I:泛素和植物病毒,让我们一起玩!植物科学进展,2012,29(3):344 - 344。
谢震,范斌,陈超,陈震:诱导型RNA依赖RNA聚合酶在植物抗病毒防御中的重要作用。自然科学进展,2001,29(4):531 - 531。
Rakhshandehroo F, Takeshita M, Squires J, Palukaitis P: RNA依赖性RNA聚合酶1对马铃薯Y病毒感染及其他抗病毒反应基因的影响。植物生态学报,2009,22:1312-1318。
张志刚,张志刚,张志刚。水杨酸反应与叶绿体h2o2的关系。植物信号行为学学报,2012,7(8):944-946。
Manacorda CA, Mansilla C, Debat HJ, Zavallo D, Sánchez F, Ponz F, Asurmendi S:水杨酸决定了两者产生的差异衰老萝卜花叶病毒涉及活性氧和早期转录组变化的菌株。植物微生物学报,2013,26(12):1486-1498。
廖永伟科,孙志华,周永华,史凯,李霞,张国强,夏学军,陈志新,于建强:过氧化氢和一氧化氮在烟草花叶病毒基础防御中诱导植物编码RNA依赖RNA聚合酶1的作用。PLoS ONE。2013, 8: e76090-
Hunter LJ, Westwood JH, Heath G, Macaulay K, Smith AG, Macfarlane SA, Palukaitis P, Carr JP:拟南芥RNA依赖性RNA聚合酶1和等chorisate合成酶基因表达的调控。PLoS ONE。2013, 8 (6): e66530-
瓦格纳A:活性氧作为第二信使在诱导替代氧化酶基因表达中的作用佩妮矮牵牛细胞。中国农业科学,2004,27(3):349 - 349。
Maxwell DP, Nickels R, McIntosh L:线粒体参与诱导与病原体攻击和衰老相关的基因所需的信号转导的证据。植物学报,2002,29(4):379 - 379。
Dubois M, Skirycz A, Claeys H, Maleux K, Dhondt S, De Bodt S, Vanden Bossche R, De Milde L, Yoshizumi T, Matsui M, Inzé D:乙烯响应因子6在拟南芥限水条件下作为叶片生长的中心调节因子。中国生物医学工程学报,2013,29(3):319-332。
杨晓霞,孙春霞,陈晓明:DELLA基序在赤霉素诱导的RGA降解中起重要作用。中国科学院学报,2001,29(2):366 - 366。
Bazzini AA, Mongelli VC, Hopp HE, Del Vas M, Asurmendi S:植物RNA沉默的理解和教学的实用方法。电子生物技术2007年,doi: 10.2225 / vol10-issue2-fulltext-11。
Ramakers C, Ruijter JM, Deprez RHL, Moorman AF:实时聚合酶链反应定量数据的无假设分析。中华神经科学杂志,2003,32(3):344 - 344。
Pfaffl MW:一种新的实时RT-PCR相对定量数学模型。核酸科学,2001,29:e45-
致谢
作者要感谢Julia Sabio y Garcia博士对英文编辑的协助,以及Mariana del Vas博士对手稿的批评意见。我们要感谢Veronica Arana博士提供的pRGA::GFP-RGA转基因种子和四倍della突变体。这项工作得到了国家研究所Tecnología Agropecuaria (INTA) [PE 1131022]和ANPCyT PICT 2011-939的支持。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
构思并设计实验:MCR, SA。进行实验:MCR GC DZ。分析数据:MCR SA。贡献的试剂/材料/分析工具:MCR GC DZ CAM。写论文:MCR SA。文章修改:MCR GC DZ SA。两位作者都阅读并批准了最终的手稿。
电子辅助材料
12870 _2014_210_moesm1_esm.pdf
附加文件1:的表达WRKY70,RDR1和AOX1A在非转基因MOF处理的Col-0植株中与非转基因水处理的Col-0植株中的表达水平进行比较。数据描述:MOF处理后48 h采集样品。在未经水处理的Col-0非转基因植株中,其表达水平被任意设置为1 (Log2(1) = 0)。星号表示差异有统计学意义(* = P值< 0.05)。(pdf 26kb)
12870 _2014_210_moesm2_esm.pdf
附加文件2:在cp# 71转基因株系中,CgCP表达降低植株生长并延迟花转化时间。数据描述:代表性的WT Col-0和CP#71转基因6周龄植株。在cp# 71和WT Col-0植物中进行了测量。A)显示株高(6周龄)的柱状图和B)花的转变(到第一朵花的天数)。每一列代表25株植物的平均值±SE。(pdf 784 kb)
12870 _2014_210_moesm3_esm.pdf
附加文件3:具有代表性的10日龄Col-0幼苗在MOF (MOF)或水(−)存在下生长7天。(pdf 2mb)
12870 _2014_210_moesm4_esm.pdf
附加文件4:DELLA靶向基因在四重DELLA和四重DELLA中的表达gai-1成年植物。四倍della突变体植物个体基因的相对mRNA水平gai-1将突变株与WT-Ler株进行比较。数据描述:WT-Ler植物的表达水平被任意设置为1 (Log2(1) = 0)。给出了4个重复定量RT-qPCR±SE的平均值。星号表示差异有统计学意义(* = P值< 0.05)。(pdf 33kb)
12870 _2014_210_moesm5_esm.pdf
附加文件5:代表CP#72/RGAp::GFP-RGA初生幼苗根系荧光显微镜观察数据描述:A)在水处理的幼苗中观察到GFP荧光;B) 10 μMGA处理水处理后的幼苗观察到GFP荧光3.;C) MOF处理幼苗中观察到的GFP荧光;D) 10 μMGA处理mof处理后的幼苗观察到GFP荧光3..(pdf 1mb)
12870 _2014_210_moesm6_esm.pdf
附加文件6:使用genev调查者对防御基因子集进行表达分析。数据说明:设置用flg22 (WT + flg22)处理的WT植物的mRNA表达量为1。中各基因相对mRNA水平gai-1用flg22处理的突变株(gai-1+ flg22)与用flg22处理的WT植株进行比较。颜色刻度对应于表达低于对照的程度(WT + flg22)。(pdf 273kb)
12870 _2014_210_moesm7_esm.pdf
附加文件7:代表n benthamiana荧光显微镜下观察叶片。数据描述:A)在未感染的benthamiana叶片中观察到YFP荧光;B)经100 μ MGA处理后,未感染benthamiana的YFP荧光观察到3.;C)感染benthamiana叶片中观察到YFP荧光;D) 100 μMGA处理感染benthamiana叶片观察到YFP荧光3..(pdf 1mb)
12870 _2014_210_moesm8_esm.pdf
附加文件8:DELLA蛋白降低TMV-Cg复制酶水平。数据描述:任意设置WT-Col-0植株的表达水平为1 (Log2(1) = 0)。给出了4个重复定量RT-qPCR±SE的平均值。星号表示差异有统计学意义(* = P值< 0.05)。(pdf 26kb)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。
本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。
如欲查看本牌照的副本,请浏览https://creativecommons.org/licenses/by/4.0/.
创作共用公共领域奉献弃权书(https://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
罗德里格斯,M.C,孔蒂,G,扎瓦洛,D。et al。TMV-Cg外套蛋白稳定DELLA蛋白,反过来负向调节水杨酸介导的防御途径拟南芥病毒感染。BMC植物生物学14日,210(2014)。https://doi.org/10.1186/s12870-014-0210-x
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-014-0210-x
关键字
- TMV-Cg
- 外壳蛋白
- 德拉蛋白质
- SA信号
- 防御反应