摘要
背景
植物已经开发出各种机制来抵消蚜虫攻击。它们通过改变特定基因的表达来激活他们的防御。以前我们鉴定了一种激活标签突变体拟南芥在哪myzus persicae.人口发展减少了。激活标签突变体是函数,其中基因的表达通过插入而增加花椰菜花叶病毒35s增强剂,用于自然促进剂。通过进一步表征该先前鉴定的突变体,我们鉴定了一种降低性能的基因M. persicae.并且还提供了关于所涉及的机制的线索。
结果
我们表明,SKU5类似13.(SKS13),该基因在野生型植物中的表达仅限于花粉,对花粉无反应M. persicae.攻击,在过度表达A. Thaliana.表现出性能下降的突变体M. persicae..监测M. persicae.喂养行为SKS13过度抑制植物表明M. persicae.难以从韧皮饲喂的困难。构成表达的表达SKS13导致活性氧的积累,这可能是通过茉莉酸途径调控的。增强的抗性不是蚜虫种特异性的,也不是蚜虫种群发展的特异性的Brevicoryne Brassicae.受到了影响.
结论
我们证明了花粉特异性基因叶片中的组成型表达SKS13可以增强植物防御,导致减少M. persicae.人口发展也降低了持续病毒的传播。过度表达SKS13在A. Thaliana.也会影响B. Brassicae.还有其他韧皮喂养昆虫。鉴定可以增强植物防御昆虫的基因将对开辟昆虫抗性作物植物的新途径是重要的。
背景
蚜虫有一种复杂的进食策略,它们用茎鞘穿透植物组织,沿着细胞间途径刺穿细胞,直达韧皮部[1].为了促进探测和喂养过程,蚜虫将唾液分泌到植物组织中以降解细胞壁并克服饲养部位的闭塞[2],[3.].一旦蚜虫建立喂养部位,它可以从易感植物的韧皮芯片喂食小时数或甚至天数[1].蚜虫的侵害限制了植物的生产力,因为光同化物的消耗和过量的糖的沉积,如蜜露,鼓励霉菌的生长。此外,蚜虫是许多植物病毒的重要载体,这些病毒可在探测和取食过程中传播,对植物造成额外的损害[4.].
植物已经进化了一系列防御性状,直接影响蚜虫的饲养行为。这些防御包括物理和化学性状,可以在蚜虫攻击时组成或诱导[5.].毛发和腺毛状体等物理特征,阻碍蚜虫沉淀在植物上[6.].化学性状包括产生次级代谢物和蛋白质,其对蚜虫的驱抑或毒性有毒,从而影响它们的性能[7.].例如,芸苔属植物特有的次级代谢物硫代葡萄糖苷已被证明对通才蚜虫的性能有负面影响myzus persicae.[8.].与构成性状相反,诱导防御需要对攻击蚜虫的识别和随后的转录重编程。这也包括一般创伤反应的激活。越来越多的证据表明,活性氧(ROS),通常被认为是一种一般的创伤反应,也可以在植物对蚜虫的防御中发挥作用[9.],[10.].例如,俄罗斯小麦蚜虫侵害早期积累的ROS被认为是抗蚜小麦的一种防御反应[11.].相反,抗坏血酸的浓度增加,能够还原ROS的化合物导致增强的蚜虫繁殖力[10.],进一步支撑RO在植物防御对蚜虫的作用。此外,ROS可以用作信号分子,以及JA,以赋予蚜虫抗性[12.].植物激素途径的激活,特别是茉莉酸(JA)、水杨酸(SA)和乙烯(ET)在植物对蚜虫的防御中起着重要作用[13.],[14.].这些途径在网络中相互作用,调节特定的防御相关基因组的表达[15.].虽然所有途径都可以涉及防御,但是JA途径被认为是对蚜虫最有效的[16.],[17.].JA通路的结构性激活拟南芥突变体导致蚜虫抗性增强,而阻断JA通路则导致蚜虫易感性[14.].
已经显示出某些基因,例如某些基因IQD1(IQ-Domain1) 和MPL1.(Myzus persicae-诱导脂肪酶1)可以赋予植物对昆虫的抗性,当它们的表达水平增加或表达位置改变时[18.] - [20.].这些基因可以通过筛选昆虫抗性的激活标记突变集合来识别[18.],[21.].在这些突变体中,被标记的基因被四聚体过度表达花椰菜花叶病毒(CAMV)35S增强剂与天然促进剂相邻,导致函数显性增益表型[22.].通过筛选这种突变集合A. Thaliana.,我们已经确定了几种具有增强抗性的突变体M. persicae.[23.].在本文中,我们表征了其中一种突变体,导致识别SKU5类似13.(SKS13)作为增强抵抗力的基因M. persicae..我们分析了喂养行为M. persicae.在突变体上使用电穿透图(EPG)技术[24.]获取有关抵抗因素的位置的信息。基于推定的参与SKS13在氧化/还原反应中,我们可视化叶片中ROS的积累。最后,我们监测了几种JA - ,SA和乙烯通路标记基因的表达,以研究可能的相互作用SKS13具有这些激素途径,可以解释赋予的蚜虫抵抗力SKS13过度表达。
结果
突变体表征突变体3790
突变体3790之前被确定为一个拟南芥激活标签突变体myzus persicae.与相应的野生型Wassilewskija (Ws)相比,Wassilewskija的前生殖期更长,产生的后代数量更少[23.].与Ws相比,突变体3790的叶片更小,颜色更深(图)1),花期延迟,主茎高度降低,侧枝数增加。
鉴定SKS13作为增强抗性的基因M. persicae.
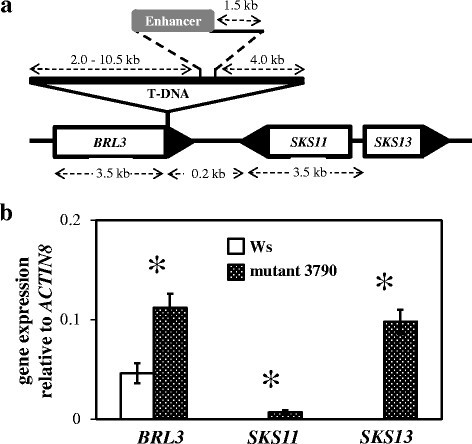
你sing inverse PCR we could determine that mutant 3790 contains a T-DNA including a 35S enhancer that is located on chromosome 3 at position 4,350,852 (according to the TAIR website; http://www.arabidopsis.org) in the 3’-UTR region of the油菜素受体样基因(BRL3At3g13380;数字2一种)。另外,另外两种基因,SKU5类似11(SKS11.,AT3G13390)和SKU5类似13(SKS13,AT3G13400)位于约8kb的增强剂的距离内(图2A)增强子能有效激活基因表达的距离[25.].为了确定这三个基因的转录水平是否受到增强子的影响,我们首先进行了定量RT-PCR (qPCR)。的转录水平BRL3突变体3790比Ws高2倍(图2b)。没有成绩单SKS11.和SKS13在WS中可检测到,但在突变体3790中可以清楚地检测它们(图2b)。
激活标签的位置和表达分析。(一)突变体3790的基因组区域显示含有CaMV35S增强子的T-DNA插入片段。T-DNA位于3 ' -UTR(黑色三角形)BRL3.相邻基因之间的确切距离SKS11.和SKS13它们的启动子和增强子是未知的。图表不是按比例画的。(b)定量RT-PCR表达分析BRL3那SKS11.和SKS13在rosette leaves of Ws and mutant 3790. Values are the means ± SD (n = 3). The star indicates a significant difference between bars within a pair (Independent-samplest-测试,P.< 0.05)。
作为A. Thaliana.许多基因敲除突变体是公开可用的,我们确定是否受损的表达BRL3影响性能M. persicae..为此,我们进行了无选择蚜虫试验并进行了比较M. persicae.人口发展BRL3敲除突变体brl3-2和brl3-3[26.在野生型Columbia-0 (Col-0)上。的数量M. persicae.(18.5±5.6)brl3-216.2±4.1开启brl3-3)与Col-0无显著性差异(19.5±7.0;Kruskal-Wallis,其次是Mann-Whitney你测试中,P.> 0.05,n = 15)。因为SKS11.和SKS13在WS植物的控制叶中没有表达(图2b),我们进行了QPCR实验以揭示这些基因是否在侵扰时诱导M. persicae..诱导表达脂氧合酶2(LOX2.;资料未显示)显示一种有效的虫害M. persicae.[27.]但是表达了SKS11.和SKS13在染病6小时和24小时后未检测到M. persicae..因此,我们没有进行评估M. persicae.性能SKS11.或SKS13敲除突变体。
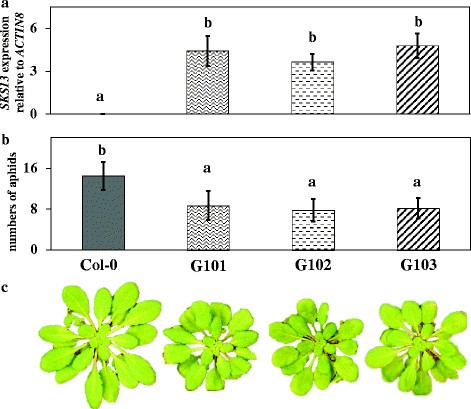
由于关于转座子位置的方向(图2a)和最强烈的过度表达影响(图2b),我们决定专注于SKS13为本研究的继续。证实…的过度表达SKS13增强抵抗力M. persicae.中,我们产生的转基因的Col-0线(G101,G102和G103),其中SKS13被CaMV 35S启动子过度表达。与Col-0相比,这些品系的表达水平显著高于Col-0SKS13(数字3.A)和更少的数量M. persicae.(数字3.b)。与突变体3790类似,这些转基因系的植物具有比它们相应的野生类型更小,圆角玫瑰花叶(图3.c)和延迟开花。主干的高度和来自这些转基因系的植物的侧枝的数量与COL-0不同。
基因表达分析,myzus persicae.蚜虫的性能和三个独立的表型SKS13overexpressing转基因线。(一)定量RT-PCR表达分析SKS13在哥伦比亚 - 0(COL-0)和三种转基因系G101,G102和G103的玫瑰花叶中。值是平均值±SD(n = 3)。(b)的表演M. persicae.对col0和转基因株系G101、G102和G103的植株进行了抗性筛选。值为平均值±标准差(n = 15)。标有不同字母的条形图彼此之间存在显著差异(Kruskal-Wallis和Mann-Whitney紧随其后你测试中,P.< 0.05)。(C)6周龄col0和转基因株系G101、G102和G103的莲座叶表型。
喂养行为M. persicae.在突变体3790
揭示蚜虫喂养行为是否受到过度表达的影响SKS13我们比较电气渗透图(EPG)[1]录音M. persicae.在突变体3790和WS植物上。与我们的研究相关的EPG参数总结在表中1.对于与表皮或木耳组织相关的EPG参数没有观察到差异。还有途径阶段的总时间在WS和突变体3790上相似(表1).myzus persicae.在突变体3790上显示出比在WS上的非探测相的持续时间显着更长(表1).韧皮部前期和韧皮部阶段相关活性也存在显著差异。Ws相比,M. persicae.突变体3790到第一个韧皮部阶段所需的时间是突变体3790的两倍,但只花大约三分之一的时间在这个阶段1).此外,少量M. persicae.在突变体3790上显示持续的Phloem Sap比在WS和那些在突变体3790上显示这项活动的抑制型SAP,这是较少的次数(表1).此外,与突变体3790相比,Ws突变体上的蚜虫进入韧皮部和摄取韧皮部汁液的时间明显更长1).
突变线3790中反应性氧的累积
SKS13具有氧化/还原反应的推定功能[28.],[29.]其共表达基因在产生反应性氧(ROS)中的作用[30.],[31.].因此,我们假设的过度表达SKS13可能导致叶子中的ROS积累。为了可视化ROS,我们使用了WS,突变体3790,COL-0和转基因线G101叶片上的3-3-二氨基苯胺(DAB)染色(图4.).每个叶子受到镊子伤害,用作DAB染色的阳性对照[32.].与WS和COL-0叶相比,分别在突变体3790和转基因线G010的叶片中观察到较暗的褐变(图4.).
Brevicoryne Brassicae.突变体现3790
有人建议,ROS积累在植物抵御蚜虫一般的作用[11.],[12.].因此,我们假设这一点SKS13过度表达的植物不仅会影响多面手M. persicae.而且其他蚜虫。这一假说是由为害突变体3790和WS与专家测试B. Brassicae..在感染后14天,平均为4天B. Brassicae.关于突变体3790和18发现B. Brassicae.在WS植物(Mann-Whitney你测试P.< 0.001, n = 15)。
效果SKS13已知的JA-,SA-和ET-DEVERD基因转录的过度表达
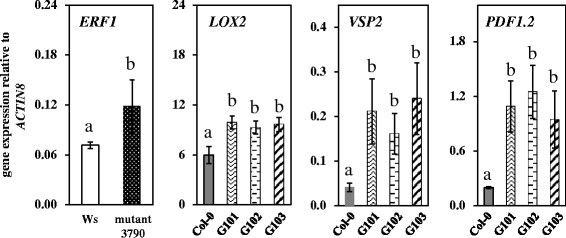
确定是否过度表达SKS13研究人员检测了突变体3790、Ws和et的JA-、SA-和et -标记基因的表达水平。SKS13过表达转基因株系和Col-0无蚜虫侵害。研究了突变体3790叶片中ja标记基因的表达水平LOX2(脂氧合酶2)那vsp2.(营养储存蛋白2) 和PDF1.2(推定植物防御素1.2)以及sa标记基因PAD4.(植保素Deficient4) 和PR1(病因相关1)与Ws叶片相似(数据未显示)。而et标记基因的表达水平ERF1.(乙烯反应因子1突变体3790显著高于WS(图5.).相反,突变3790(在WS背景中),SKS13过表达转基因株系的JA-marker基因表达量显著高于相应的野生型Col-0(图)5.).所述SA-和ET-标记基因没有在这些线受到影响(数据未显示)。
讨论
过度表达SKS13在叶中提高了抗性M. persicae.在A. Thaliana.
突变体3790之前被确定为一个A. Thaliana.人口发展的突变体M. persicae.减少了[23.]在本论文中,我们显示,这是至少部分地,由于的组成型过表达SKS13.的负面影响SKS13在接受的转基因植物中证实了蚜虫人口发展SKS13在CAMV 35s启动子的控制下。公开的微阵列数据集中表达式的分析显示SKS13在花粉特异表达(https://www.genevestigator.com/)30.].这与我们的观察是一致的SKS13Ws中或Col-0中的叶中不表达。我们还表明,表达SKS13没有在侵袭时诱导M. persicae..这与先前的微阵列研究一致,没有诱导SKS13表达A. Thaliana.后M. persicae.发现虫灾[33.] - [35.].
过度表达SKS13影响喂养行为M. persicae.可能是由于ROS积累
分析M. persicae.EPG技术的喂养行为可以为植物电阻机制提供洞察[36.].EPG结果表明,植物抗性是通过过表达SKS13是基于韧皮的。这是由验证阶段的事实支持的M. persicae.在SKS13过表达的植株在时间上延迟,在长度上减少,而通路阶段的长度与对照无显著差异。韧皮部抵抗进一步表明,持续韧皮部汁液摄入的数量减少。由于持续摄入韧皮部液是持续传播病毒传播的必要条件[37.[Phloem基电阻解释了这种病毒的变速下降,即萝卜黄色病毒,如前所述在突变体3790中观察到[23.].
揭示的角色SKS13在基于韧皮的植物抵抗力M. persicae.,我们探索了该基因可能的生物学功能.与多铜氧化酶的结构相关,抗坏血酸氧化酶和漆酶,SKS13已经提出在氧化/减少反应中起作用[28.],[29.].此外,SKS13与参与ROS生成的基因共同表达(https://www.genevestigator.com)[30.],[31.].因此,我们假设组成型过度表达SKS13导致ROS的积累在叶片和证实了这一点通过DAB染色的叶子SKS13过度抑制植物。ROS积累对蚜虫喂养行为的影响还针对具有高浓度ROS的基质品种,其中谷物蚜虫在Phloem相中呈现降低的时间和非探针阶段的延长时间[38.].这类似于我们的观察M. persicae.喂养行为SKS13过度抑制植物。ROS的积累建议在植物抵抗力对几种蚜虫物种中发挥作用[11.],[38.].这也符合我们的结果,作为蚜虫抗性SKS13过表达植物不仅影响M. persicae.但也B. Brassicae.的性能。过量的活性氧除了能增强蚜虫的抵抗力外,还能破坏蛋白质、脂质和核酸,最终对植物生长有害[39.,从而解释了规模缩小的原因SKS13过度抑制植物。
过度表达SKS13影响植物激素途径A. Thaliana.
几项研究表明,ROS积累与JA,SA和ET植物激素途径与植物防御蚜虫的作用相连[11.],[12.],[40],[41.].例如,A. Thaliana Rbohd.突变体,其中ja诱导的ROS积累不发生,促进了比其野生型col0大4倍的蚜虫种群发展[12.],[42.],表明通过激活JA途径赋予蚜虫抗性可能是由ROS积累的介导的。在我们的研究中,我们观察了JA途径的类似激活SKS13过表达COL-0植物,如三种JA标记基因的显着更高的表达水平所示。
3790年变异,SKS13过度表达A. Thaliana.加入WS和ET路线被激活而不是JA路径,这可能是由于COL-0和WS响应ROS累积的遗传差异而导致的[43.].此外,ROS可以通过改变的信号通路间接影响植物生长。Kerchev等人。[44.结论,拟南芥植物生长减少,从低抗坏血酸盐,一种缓冲RO的化合物,其触发ABA和JA依赖信号传导。作为抗坏血酸缓冲液,该化合物的低水平将导致ROS积累的增强。这与观察到的较高的ROS积累和降低突变体3790和植物生长的一致SKS13我们研究过过表达转基因素。我们观察到信号传导途径不同的影响表明其他因素也可能影响植物生长。此外SKS13的更高表达BRL3和/或SKS11.可能有助于这种差异。或者,额外的差异可能归因于BR,ET和ROS之间的未知交互。研究与之间的相互作用SKS13和JA-/ ET介导的防御反应可能会导致更好地了解JA和ET反应的激活和其抗蚜的贡献。
结论
过度表达SKS13在A. Thaliana.导致降低的韧皮喂养M. persicae.,这可能是由于叶子中的ROS积累。降低的Phloem喂养导致抑制人口发展M. persicae.并且还降低了持续病毒的传播。过度表达SKS13在A. Thaliana.也会影响B. Brassicae.还有其他韧皮喂养昆虫。对增强抵抗力M. persicae.和B. Brassicae.在SKS13过度表达A. Thaliana.植物减少了植物发展。
方法
植物
突变体3790,先前已识别出来拟南芥加入Wassilewskija(WS)激活标签库作为突变体M. persicae.显示人口发展下降[23.].该突变体的种子及其相应的背景加入Ws是从韦比植物育种的本文中获得的[22.].种子brl3-2和brl3-3突变体及其相应的背景加入哥伦比亚 - 0(COL-0)被S.C. de Vries教授,生物化学大学实验室的实验室提供了[26.].为了诱导萌发,种子在黑暗中置于4℃下在高湿度下3天。接着,将种子转移至盆栽堆肥(LentsePotgrond®)和植物在人工气候室(20℃±2℃,RH 60%-70%,6小时培养:18小时(亮:暗)植株浇水每隔day and no pest control was applied. In all experiments we used plants in their vegetative stage, i.e. before they start flowering.
昆虫
myzus persicae.(青桃蚜虫)在大白菜(Brassica Rapa.l . ssp。学报简历。Granaat)。Brevicoryne Brassicae.(白菜蚜虫)被饲养在布鲁塞尔豆芽(Brassica oleraceaL. var。gemmifera简历。赛勒斯)在韦培大学昆虫学实验室。将两种饲养的饲养室保持在20±2°C,RH 60-70%,18小时:6小时(光:暗)。对于所有实验,只使用双药蚜虫。
反向PCR
使用Dneasy植物迷你试剂盒(QIAGEN)从突变体3790的叶片中提取基因组DNA,用限制酶生态(Thermo,Product#Er0275)或BamHI(Thermo,Product#Er0051)消化,随后用T4 DNA连接酶连接(Fermentas,产品#EL0011)。根据先前描述的方法进行反相PCR [21.].PCR产物被测序,然后爆炸A. Thaliana.基因组(http://www.arabidopsis.org/)45.].
时间过程实验M. persicae.侵扰
来确定SKS11.和SKS13基因是由M. persicae.我们做了一个时间过程实验。4周大的植株中寄生了15只不同生活阶段的无翅蚜虫。分别在蚜虫侵染0、6和24 h后采集叶片材料。轻轻地把蚜虫从叶子组织上刷掉,没有感染的植物也刷掉。叶片材料立即在液氮中闪冻,在−80°C保存至使用。
定量rt - pcr
样品设计为3个生物重复,每个重复汇集17株单独植物。总RNA分离、cDNA合成及定量RT-PCR (qPCR)方法参考文献[21.].基因特异性引物设计有引物-3-Plus软件[46.]并列在表格中2.通过减去组成表达基因的CT值,用QPCR获得的阈值循环(CT)标准化以判断CDNA合成的差异ACTIN8(AT1G49240)[47.]来自感兴趣的基因的CT值。然后计算标准化的基因表达为2-Δct.分析前的对数变换。Independent-samplest-检验或方差分析,然后进行Tukey检验,以确定基因型/治疗之间的显著性(P.< 0.05)。
转基因植物的产生
产生过表达的转基因株系SKS13,编码区片段SKS13(:F-530S,100U Finnzymes公司,产品代码)在含有的Phusion酶™PCR反应使用引物AttB1_SKS13_F(GGGGACAAGTTTGTACAAAAAAGCAGGCTCGAGCGAGAGAGATTCAAAAAT)和AttB2_SKS13_R(GGGGACCACTTTGTACAAGAAAGCTGGGTTCCTCTC TGGATTGAACAATGA)从Col-0中的cDNA扩增。以下PCR程序用于:30秒,在98℃,随后的98℃的35个循环持续10秒,64℃10秒,和在72℃10分钟,72℃3分钟,最后延伸.将得到的PCR产物从1%琼脂糖使用QIAquick凝胶提取试剂盒(Qiagen)进行凝胶中提取并测序进行验证。的验证编码区片段SKS13转移到使用的Gateway®BP克隆酶™II酶混合物(Invitrogen)中,以产生进入载体pDONR207供体载体pDONR207 ::SKS13.入口载体随后被克隆到Gateway目的载体pFAST-R02 [48.]使用GatewayLR®Clonase™II酶混合物(Invitrogen)以产生表达构建体Pfast-R02-SKS13在这SKS13是CaMV 35S启动子的控制下。将构建转化大肠杆菌和转化体通过菌落PCR用引物AttB1_F(GGGGACAAGTT TGTACAAAAAAGCAGGCT)和AttB2_R(ACCACTTTGTACAAGAAAGCTG GGT)检查。验证的编码区片段的精度之后SKS13,这个结构被转换成农杆菌肿瘤术菌株GV3101 [49.]通过电穿孔。农杆菌属介导的转换(50.用来介绍Pfast-R02-SKS13质粒成Col-0花。使用荧光显微镜(Zeiss,Stereo Discovery.v8)选择含有构建体的种子[48.].
无选择蚜虫测定
若虫生产成人蚜虫(两者M. persicae.和B. Brassicae.从饲养植物中收集并放在培养皿中的分离的卷心菜叶子过夜。新生出生的一天历史少女被安置在三周大的中心A. Thaliana.用细刷种植物。每株取若虫1只,侵染14 d后统计蚜虫总数。植株随机组织,每个基因型有15个生物重复。植物之间用一道水障隔开,以防止蚜虫从一株植物转移到另一株。的Mann-Whitney你或者是Kruskal-Wallis,然后是Mann-Whitney你检验用于确定基因型之间的差异是否显著(P.< 0.05)。
电气渗透图
电气渗透图(EPG)技术[24.采用了监测喂养行为myzus persicae..使用导电水基银胶用胶水将金线(直径20μm)连接到年轻成人蚜虫的背部。将有线蚜虫放在一片半月叶的成熟叶上,该叶片通过土壤中的铜电极连接到记录系统。所有测试的蚜虫都留在叶子的下侧。EPGS在22℃下记录,恒定光线8小时。使用探针3.0软件(Wageningen University,荷兰)分析EPG数据来区分各种波形。波形C表示轨道阶段,当蚜虫探针穿过叶片组织时;波形E2代表Phloem Sap摄取;波形F与渗透困难相关;波形G表示从木耳的热量摄取水。 Both sequential and non-sequential parameters were analyzed [51.来描述个人的探究行为M. persicae..对于每个基因型,获得个别蚜虫(每株一个蚜虫)的至少15个记录。的Mann-Whitney你Fisher精确测试用于确定基因型之间的显着性差异(P.< 0.05)。
活性氧(ROS)积累的测定
为了显现反应性氧物质(ROS),树叶从四周龄的植物切并在含有HCl溶液1毫克毫升浸没过夜-13-3 ' -二氨基联苯胺(DAB), pH 3.7 [52.].叶绿素的混合物在室温下96%乙醇过夜萃取。叶子在80%甘油随后拍照。
参考
- 1。
蚜虫唾液分泌物与韧皮部创伤反应蛋白的相互作用。中国生物医学工程学报。2006,27(6):739-745。10.1093 / jxb / erj088。
- 2。
Will T,Kornemann SR,Furch AC,Tjallingii WF,van Bel Aj:蚜虫水性唾液抵消筛管闭塞:普遍存存?J EXP BIOL。2009,212:3305-3312。10.1242 / JEB.028514。
- 3.
Moreno A,Garzo E,Fernandez-Mata G,Kassem M,Aranda Ma,Fereres A:蚜虫将水唾液分泌到植物组织中,从探测器渗透开始。entomol exp appl。2011,139:145-153。10.1111 / J.1570-7458.2011.01117.X。
- 4.
Brault V,Uzest M,Monsion B,Jacquot E,Blanc S:蚜虫作为植物病毒的运输设备。Comper Biol。2010,333:524-538。10.1016 / J.CRVI.2010.04.001。
- 5。
Howe GA, Jander G:植物对昆虫食草动物的免疫。植物学报,2008,59:41-66。10.1146 / annurev.arplant.59.032607.092825。
- 6。
Alvarez Ae,Tjallingii Wf,Garzo E,Vleeshouwers V,Dicke M,Vosman B:土豆叶片和野生凝聚煤叶片的位置Solanum.蚜虫的种类myzus persicae..entomol exp appl。2006,121:145-157。10.1111 / J.1570-8703.2006.00464.x。
- 7。
Holkier Ba,Gershenzon J:葡萄糖苷的生物学和生物化学。Annu Rev植物Biol。2006,57:303-33。10.1146 / annurev.arplant.57.032905.105228。
- 8。
Kim JH,Lee BW,Schroeder FC,Jander G:吲哚葡萄糖素崩溃产品的鉴定,抗冻膜效果myzus persicae.(绿色桃蚜)。工厂J. 2008,54:1015-1026。10.1111 / J.1365-313x.2008.03476.x。
- 9。
Maffei Me,Mithöfera,博兰w:在基因表达之前:植物 - 昆虫互动的早期事件。趋势植物SCI。2007,12:310-316。10.1016 / J.Plants.2007.06.001。
- 10.
Kerchev Pi,Fenton B,Foyer Ch,Hancock Rd:植物对昆虫草食病的反应:光合作用,反应性氧物种和激素信号通路之间的相互作用。植物细胞环境。2012,35:441-453。10.1111 / J.1365-3040.2011.02399.x。
- 11.
Moloi MJ,Van der Westhuizen AJ:反应性氧气物种参与小麦对俄罗斯小麦蚜虫的抵抗力。J植物理性。2006,163:1118-1125。10.1016 / j.jplph.2005.07.014。
- 12.
Miller G,Schlauch K,Tam R,Cortes D,托雷斯D,托雷斯MA,Shulaev V,Dangl JL,Mittler R:植物NADPH氧化酶RBOHD在响应各种刺激时介导快速全身信号传导。SCI信号2009,2:ra45。,
- 13。
植物对昆虫性食草动物攻击反应的新见解。《安徽文学》,2010,44:1-24。10.1146 / annurev -麝猫- 102209 - 163500。
- 14。
植物对蚜虫摄食反应的激素信号。学报杂志(Oxf)。2011年,33:2057 - 2073。10.1007 / s11738 - 011 - 0751 - 7。
- 15.
Robert-seilaniantz A,Grant M,Jones JDG:植物疾病和防御中的激素串扰:不仅仅是茉莉酸二盐酸拮抗作用。Annu Rev植物Biol。2011,49:317-343。
- 16。
汤普森GA,高根FL:转录组和韧皮部食的昆虫植物防御诱导的功能基因组学。J Exp Bot。2006年,57:755-766。10.1093 / JXB / erj135。
- 17。
Zhu-Salzman K,Bi J-L,Liu T-X:植物防御和防虫防御的分子策略。昆虫SCI。2005,12:3-15。10.1111 / J.1672-9609.2005.00002.x。
- 18。
Levy M, Wang Q, Kaspi R, Parrella MP, Abel S:拟南芥IQD1,一种新型钙调蛋白结合核蛋白质,刺激葡糖苷堆积和植物防御。工厂J. 2005,43:79-96。10.1111 / J.1365-313x.2005.02435.x。
- 19。
张Z,Ober Ja,Kliebenstein DJ:控制定量特质基因座的基因epithiopecifier修改器1改变氨基葡萄糖水解和抗虫抗性拟南芥.植物营养与肥料学报。2006,18(4):536 - 542。10.1105 / tpc.105.039602。
- 20.
Louis J, Lorenc-Kukula K, Singh V, Reese J, Jander G, Shah J:对桃蚜的抗生作用需要Arabidopsis thaliana yuzus persicae诱导脂肪酶1基因.植物杂志2010,64:800-811。10.1111 / j.1365-313X.2010.04378.x。
- 21.
陈X,Zhang Z,Visser RGF,Broekgaarden C,Vosman B:过度表达IRM1.增强了对蚜虫的抵抗力拟南芥.普罗斯一体2013年,8:e70914。
- 22.
基于En-I转座子系统的玉米激活标记研究拟南芥.植物理性。2002,129:1544-1556。10.1104 / pp.003327。
- 23。
Chen X, Vosman B, Visser RGF, van der Vlugt RA, Broekgaarden C:大株蚜虫抗性高通量表型研究。植物学报。2012,8:33-33。10.1186 / 1746-4811-8-33。
- 24。
Tjallingii WF:连续记录蚜虫对茎突的渗透活动。Aphid-plant基因型交互。编辑:Campbell RK, Eikenbary RD. Elsevier Science publishing, Amsterdam, NL;1990:89 - 99。
- 25。
Ichikawa T, Nakazawa M, Kawashima M, Muto S, Gohda K, Suzuki K, Ishikawa A, Kobayashi H, Yoshizumi T, Tsumoto Y, Tsuhara Y, Iizumi H, Goto Y, Matsui M: 1172个T- dna插入位点的序列数据库拟南芥激活标记线在T1代中显示表型。工厂J. 2003,66:421-429。10.1046 / J.1365-313x.2003.01876.x。
- 26。
殷Cano-Delgado A, Y,于C, Vafeados D, Mora-Garcia年代,程J,南KH、李J, Chory珍:BRL1和BRL3是新型芸苔类固醇受体,其在血管分化中起作用拟南芥.发展。2004,131:5341-5351。10.1242 / dev.01403。
- 27。
莫兰PJ,汤普森GA:对蚜虫喂养的分子反应拟南芥与植物防御途径有关。植物生理学报。2001,25(4):497 - 498。10.1104 / pp.125.2.1074。
- 28。
Sedbrook JC, Carroll KL, Hung KF, Masson PH, Somerville CR: The拟南芥SKU5基因编码参与定向根生长的细胞外糖基磷脂锚定的糖蛋白。植物细胞。2002年,14:1635年至1648年。10.1105 / tpc.002360。
- 29。
Lamesch P, Berardini TZ, Li D, Swarbreck D, Wilks C, Sasidharan R, Muller R, Dreher K, Alexander DL, Garcia-Hernandez M, Karthikeyan AS, Lee CH, Nelson WD, Ploetz L, Singh S, Wensel A, Huala E:拟南芥信息资源(TAIR):改进的基因注释和新的工具。核酸学报。2012,40(4):593 - 598。10.1093 / nar / gkr1090。
- 30。
HRUZ T,Laule O,Szabo G,Wessendorp F,Bleuler S,Oertle L,Widmayer P,Gruissem W,Zimmermann P:Genevistigator V3:转录om的元分析的参考表达式数据库。阿德生物信息学2008年,物品ID 420747.,
- 31.
王C-L,吴Ĵ,许G-H,高Y-B,陈G,吴J-Y,吴H-Q,张S-L:S-RNA酶破坏尖端定位的活性氧和诱导的不相容花粉管核DNA降解Pyrus pyrifolia.J Cell SCI。2010,123:4301-4309。10.1242 / JCS.075077。
- 32.
高桥,沟口,吉田,Ichimura, Shinozaki:钙调素依赖的MAP激酶激活对ROS稳态的影响拟南芥.acta photonica sinica, 2011, 41(6): 649-660。10.1016 / j.molcel.2011.02.029。
- 33.
莫兰PJ,Cheng Y,Cassell JL,Thompson Ga:基因表达剖析拟南芥兼容植物蚜虫相互作用。拱形昆虫生物学理发学。2002,51:182-203。10.1002 / Arch.10064。
- 34.
VE VOS M,VAN OOSTEN VR,VAN POECKE RM,VAN PELT JA,POZO MJ,MUELLER MJ,BUCHALA AJ,METRAUX JP,VAN LOON LC,DICKE M,Pieterse CMJ:信号签名和转录组变化拟南芥在病原体和昆虫袭击中。Mol植物微生物相互作用。2005,18:923-937。
- 35。
Kempema LA, Cui X, Holzer FM, wallling LL:拟南芥转录组的变化响应富含植物喂养的Silverleaf粉虱若虫。对蚜虫的反应中的相似性和区别。植物理性。2007,143:849-865。10.1104 / pp.106.090662。
- 36。
蚜虫茎突细胞穿刺活性的新结构:双模式EPG研究。昆虫学报,2010,36(4):453 - 457。10.1111 / j.1570-7458.2010.00983.x。
- 37。
斯塔福德CA,Walker GP,Ullman De:搭便车:矢量喂养和病毒传输。Comment Bill。2012,5:43-49。10.4161 / cib.18640。
- 38。
ŁukasikI,Goławskas,wójcicka答:谷物蚜虫侵扰对抗坏血酸含量的影响和抗坏血液在小黑麦中的过氧化物酶活性。波兰J环境螺柱。2012,21:1937-1941。
- 39。
活性氧:代谢、氧化应激和信号转导。植物营养与肥料学报。2004,32(5):591 - 598。
- 40。
ArgandoñaVH,Chaman M,Cardemil L,MuñozO,ZúñigaGe,Corcuera LJ:蚜虫侵染大麦的乙烯生产和过氧化物酶活性。J Chem Ecol。2001,27:53-68。10.1023 /答:1005615932694。
- 41。
Mohase L,Van der Westhuizen Aj:水杨酸参与俄罗斯小麦蚜虫 - 小麦相互作用中的抗性反应。J植物理性。2002,159:585-590。10.1078 / 0176-1617-0633。
- 42。
Maruta T,Tamoi M,Yabuta Y,Yoshimura K,Ishikawa T,Shigeoka S:拟南芥NADPH氧化酶AtrbohD和AtrbohF是茉莉酸诱导的调控基因表达所必需的myc2.转录因子。植物SCI。2011,180:655-660。10.1016 / J.Plantsci.2011.01.014。
- 43.
王志强,王志强,王志强,等:拟南芥品种基础防御反应的遗传分析。植物学报。2011,34(4):491 - 498。10.1111 / j.1365-3040.2011.02317.x。
- 44.
Kerchev PI, Pellny TK, Vivancos PD, Kiddle G, Hedden P, Driscoll S:转录因子ABI4在抗坏血酸依赖的生长调控和茉莉酸依赖的防御信号通路中是必需的拟南芥.植物细胞。2011,23:3319-3334。10.1105 / tpc.111.090100。
- 45.
Altschul SF,Gish W,Miller W,Myers EW,Lipman DJ:基本的本地对齐搜索工具。J Mol Biol。1990年,215:403-410。10.1016 / S0022-2836(05)80360-2。
- 46.
Untergasser A,Nijveen H,饶X,Bisseling T,Geurts R,Leunissen JAM:Primer3Plus,增强的web界面引物3。核酸研究。2007年,35:W71-W74。10.1093 / NAR / gkm306。
- 47。
I,ven T,Königs,辛格S,Blaus-Stomeyer SA,Bischoff M,Tietze LF,Braus GH,Lipka V,Feussner I,Dröge-Laser W:转录激活和在拟南芥中的色氨酸衍生的二次代谢物的转录激活和生产有助于防御对真菌血管病原体verticillium longisporum。莫尔植物。2012,5:1389-1402。10.1093 / MP / SSS044。
- 48。
Shimada TL,Shimada T,Hara-Nishimura I:一种快速和无损的可筛选标记,快速,用于识别拟南芥的转化种子。工厂J.2010,61:519-528。10.1111 / J.1365-313x.2009.04060.x。
- 49。
海伦斯RP,Edwards的EA,Leyland的NR,Bean的S,Mullineaux PM:pGreen:一种多功能灵活双元Ti载体用于农杆菌介导的植物转化。植物mol biol。2000年,42:819-832。10.1023 / A:1006496308160。
- 50。
花浸法:农杆菌介导的拟南芥转化的简化方法。植物学报1998,16:735-743。10.1046 / j.1365 - 313 x.1998.00343.x。
- 51。
Sarria E,CID M,Garzo E,Fereres A:Excel工作簿,用于EPG数据的自动参数计算。COMP ELEC学用。2009,67:35-42。10.1016 / J.comPAG.2009.02.006。
- 52。
Orozco-Cardenas M,Ryan Ca:通过伤口和通过十八丁蛋白通路通过伤口和系统在植物叶中全身产生过氧化氢。Proc Natl Acad SCI U S A. 1999,96:6553-6557。10.1073 / pnas.96.11.6553。
致谢
作者感谢Cindy ten Broeke和Freddy Tjallingii对EPG录音的帮助;Gerrit Stunnenberg和Taede Stoker照顾植物;欢迎Steenhuis-Broers和Leon Westerd照看蚜虫;Roeland Voorrips提供统计方面的建议;刘伟协助分子分析;为有价值的祁伟聪讨论;三位匿名评论者提供了宝贵的意见和建议。
作者信息
从属关系
相应的作者
附加信息
利益争夺
提交人声明他们没有竞争利益。
作者的贡献
XC进行了分子和昆虫行为研究,进行了DAB染色研究,分析了数据并起草了稿件。ZZ产生转基因过表达线。RV帮助起草了稿件。BV和CB设想了该研究,参与了其设计和协调,并帮助起草了手稿。所有作者阅读并认可的终稿。
作者的原始提交的图像文件
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。
本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。
要查看本许可证的副本,请访问https://creativecommons.org/licenses/by/4.0/.
Creative Commons公共领域奉献豁免(https://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
陈,X.,张,Z.,visser,r.g.g。et al。花粉特异性基因的组成型过表达SKS13在叶片中降低蚜虫的表现拟南芥.BMC植物BIOL.14,217(2014)。https://doi.org/10.1186/s12870-014-0217-3
收到了:
公认:
发表:
关键字
- 激活标签突变
- Brevicoryne Brassicae.
- 电气渗透图
- 茉莉酸
- myzus persicae.
- Phloem-feeding昆虫
- 反应性氧气