摘要
背景
在Quercus木栓通过对栎木的开发,实现了等基因系的快速生产和优良基因型的无性系繁殖在体外分别由小孢子和合子胚发生胚胎。尽管其在林木育种策略上具有很高的潜力,但由于它们的顽固性,胚胎发生的效率降低在体外许多木本物种的系统仍然很低,因为负责胚胎发生、启动和发育的因素仍然很大程度上未知。在早期阶段寻找分子和细胞标记在体外胚胎发生是在诱导后区分反应细胞和非反应细胞的重要目标,并阐明胚胎发生启动的机制,以便有效地操纵它们。在这项工作中,我们对栎木小孢子和未成熟合子胚胎的两种胚胎发生途径进行了比较分析,以表征这两种途径中重编程细胞的早期标记。分析了两种植物在胚胎发生早期的细胞结构组织重排、表观遗传标记变化、细胞壁聚合物修饰和内源生长素变化在体外多学科方法的系统。
结果
结果表明,早期胚胎细胞的细胞成分发生了明确的变化,这些变化在两种胚胎发生过程中是相似的在体外系统,细胞特征在非胚胎性细胞中没有发现。胚胎细胞的DNA甲基化水平和核形态、细胞壁中酯化果胶的比例以及内源性生长素水平与胚胎起源的小孢子和未成熟合子胚细胞相比存在差异,构成了早期胚胎发生的标志。
结论
这些结果表明,DNA低甲基化、果胶酯化引起的细胞壁重塑和生长素增加在早期参与了该过程在体外木本植物的胚胎发生,为木本植物小孢子和未成熟合子胚胎两种胚胎发生途径发育模式的相似性提供了新的证据。
背景
在体外胚胎发生系统是研究胚胎形成调控机制以及生物技术应用于植物育种、繁殖和保护策略的重要工具。从小孢子和未成熟的合子胚胎两种不同的胚胎发生途径已经在许多物种中被开发出来,分别用于快速生产等基因系和优秀基因型的克隆繁殖。树木育种策略的重点是如何减少周期时间和提高选择效率;本研究采用体细胞胚胎发生和基因工程方法繁殖选定树种,并将其应用于短时间内产生的单倍体和双单倍体植株在体外小孢子胚胎发生具有很高的潜力。然而,由于他们的顽固,胚胎发生的效率在体外许多木本物种的系统仍然很低。
Quercus树木,橡树,是具有相关经济和生态价值的木本物种;其中有栎树,问:木栓在地中海地区,作为软木的天然来源,它是一种具有高度社会和经济意义的物种。不同的在体外胚胎发生系统已被开发用于Quercus许可证,效率可变[1] - [3.].尽管在过去的几十年里所做的工作,负责胚胎发生的起始和胚胎发育的因素在既定的培养中仍然大部分未知。
在早期阶段寻找分子和细胞标记在体外胚胎发生是识别参与胚胎发生发育程序的细胞,而不是那些对胚胎发生途径不敏感的细胞的一个重要目标,也是阐明潜在的细胞机制的一个重要目标在体外胚胎发展。据报道,在一些草本和木本植物中,伴随小孢子重编程过程的是各种细胞活性和亚细胞间隔结构组织的变化[4] - [11].越来越多的证据表明,一些细胞特征如表观遗传标记的相关性[12] - [15,细胞壁成分[10],[16] - [19和荷尔蒙[9在…的过程中在体外其他系统的器官发生和胚胎发生,但没有这三个细胞标记的动态报道在体外同一物种的早期胚胎发生可通过两种体细胞胚胎发生途径进行。
染色质状态之间的动态变化与小孢子发育和胚胎发生的重编程过程中的转录调控有关[6],表观遗传机制在细胞分化过程中发挥重要作用,允许细胞重新编程以产生新的分化途径[12].DNA甲基化构成染色质纤维的显著表观遗传修饰,它被锁定在转录不活跃构象中,从而导致基因沉默。胁迫诱导的植物细胞重编程涉及全球基因组组织的变化,是基因组灵活性的关键因素的表观遗传修饰[13].以往的研究表明,在小孢子胚胎发生过程中,DNA甲基化水平和分布模式发生了变化芸苔属植物显著而且大麦芽[14],[15],提示小孢子诱导到胚胎发生后存在表观遗传重编程,但没有关于过程中DNA甲基化动态的信息在体外树木的胚胎发生。
许多分子标记在体外在细胞壁中发现了胚胎发生和器官发生[10],[16] - [19].果胶是双子叶细胞壁的主要基质成分。果胶在高尔基体中被聚合和甲基酯化,并以高度甲基酯化的形式分泌到壁中。随后,它们可以被果胶甲基酯酶修饰,催化果胶中均半乳糖醛酸结构域的去甲基酯化。酯化果胶和非酯化果胶之间的关系及其在植物细胞壁中的分布是不同过程的结果[20.] - [22它们的比例和动态参与了许多植物的发育过程。果胶分布的变化已报告在小孢子产生的年轻胚胎Quercus木栓l . (8),柑橘克莱门蒂娜[23),齐墩果欧洲公司l . (10].据报道,在不同的植物系统中,如年轻的小孢子胚和草本植物的根尖分生组织细胞,增殖细胞的新形成的细胞壁中有大量的酯化果胶[17],[18],表明细胞壁中酯化果胶的高比例是增殖事件的标志,而丰富的低酯化果胶对应着较低的细胞增殖率[17],[18].
植物生长调节剂(PGR)生长素,其主要形式是吲哚-3-乙酸(IAA),是调节植物发育的主要协调信号,在包括胚胎形成在内的许多过程中起关键作用[24],[25].尽管众所周知,外源性PGRs的添加,包括2,4- d等合成生长素的刺激作用在体外胚胎发生诱导[9],[26],对于胚胎发生初始阶段这些调控因子的内源性水平知之甚少。在栎木体胚中,IAA的量化在胚胎发育早期达到最高浓度,之后下降[27].最近的研究报道了初步结果,表明内源性IAA定位于在分离的小孢子培养中发育的早期多细胞胚胎的细胞芸苔属植物显著[28].
以前的报道表明,小孢子胚胎发生在一些物种中模仿合子胚胎发生[7],[9],[14],[29].蛋白质组学分析已经接近于识别蛋白质表达模式问:木栓不同的胚胎在体外发育晚期和成熟期的系统[30.],[31].植物激素可以作为信号分子在细胞伸长过程中重塑细胞壁,以及修改染色质结构域来激活基因表达程序。从这个意义上说,胚胎发生早期表观遗传标记、细胞壁果胶酯化变化和生长素的动态信息可以揭示这些过程之间可能的相关性,为研究控制细胞重编程和胚胎发生诱导的复杂调控机制提供新的视角。
在目前的工作中,我们进行了比较分析在体外研究了栎木小孢子和未成熟合子胚胎的胚胎发生,以表征胚胎细胞在这两种途径上的早期标记物,并对这两种途径中涉及的细胞机制有新的认识在体外木本植物的小孢子和合子胚的胚胎发生途径在发育模式上的相似性,目前还缺乏相关资料。我们分析了在这两种植物的早期胚胎发生过程中,果胶在细胞壁中的DNA甲基化、酯化和内源生长素分布的变化在体外系统。
本研究结果揭示了构成早期胚胎发生标记的早期多细胞胚胎细胞的不同特征,这些早期胚胎发生标记在小孢子和合子胚胎的两种途径中都是相似的,为胚胎发生途径的发育模式类比提供了进一步的证据。
结果
小孢子和合子胚胚发生早期发育阶段的特征Quercus木栓
两种不同的胚胎起源在体外比较了栎木、小孢子胚发生(通过花药培养)和未成熟合子胚的系统,分析了各种细胞成分在早期胚胎发生阶段的存在和分布模式,并确定了在初始阶段两种胚胎发生途径中存在的共同标记。
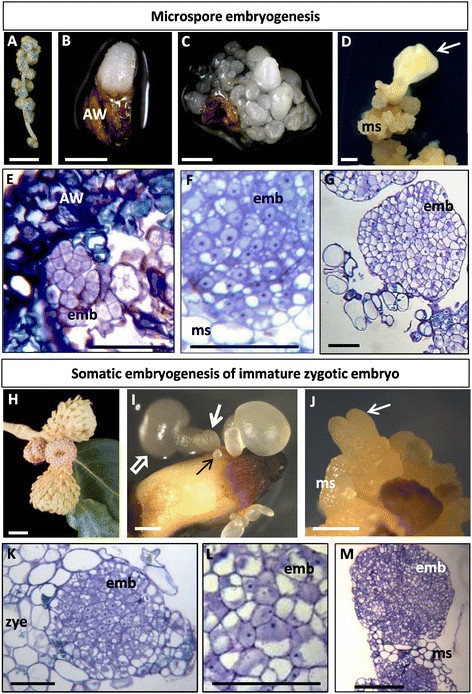
从柳絮中分离的花药经热处理诱导小孢子胚胎发生(图1A)发育阶段,其中含有液泡化小孢子反应阶段的小孢子。在20-25天的培养后,花药内出现了白色的多细胞球状小胚1B, C);这些胚胎进一步发育为心胚、鱼雷胚和子叶胚。由小孢子胚胎发生产生的成熟子叶胚在培养基上逐月传代培养,没有生长调节剂产生胚性块(图中“ms”)1D)通过次级胚胎发生产生新的胚胎(图中箭头所示)1D)。
主要发育阶段在体外栎树的胚胎发生。一个-G:小孢子胚胎发生。H-米:未成熟合子胚胎的体细胞胚胎发生。模拟,H-J:外植体和在体外胚胎发育。eg,km:胚胎发育的不同阶段,甲苯胺蓝染色的树脂切片。一个:选中的柳絮在体外小孢子胚胎发生。B,C:花药内(AW,花药壁)培养20-30天后,出现大小不同的多细胞球形胚(白色结构)。D:从胚性包块(ms)中产生的次生胚(白色箭头)。E:早期多细胞胚(emb)形成于花药内部,被花药壁组织(AW)包围。F:高倍镜下早期多细胞胚胎的细胞。G由次级胚胎发生形成的大的多细胞胚胎,附着在胚胎形成团块的一些细胞上。H:选中的橡子在体外未成熟合子胚胎的体细胞胚胎发生。我:未成熟的合子胚外植体在培养30天后出现不同发育阶段和大小的胚胎、早期多细胞胚胎(黑色细箭头)、球形、心形(白色粗箭头)和子叶(白色开箭头)胚胎。J:鱼雷期次生胚(白色箭头)来源于胚性包块(ms)。K在未成熟合子胚(zye)表面形成的早期多细胞胚(emb)。l:高倍镜下早期多细胞胚胎的细胞。米:早期多细胞胚胎(emb)由二次胚胎发生形成,并从胚胎形成团块(ms)中出现。酒吧:一个H: 100 μm;B c d i j: 1毫米;E f gk l: 50 μm;米: 200 μm。
在早期发育阶段的培养样品的显微镜分析显示小的多细胞胚胎(图中的“emb”)1E)花药内不同大小的花药和花药外的花药。通过直接或次生胚胎发生形成的早期多细胞胚胎具有典型的结构组织,由小细胞形成或多或少的圆形结构,具有活跃增殖细胞的特征。这些所谓的早期多细胞胚胎的细胞较小,细胞核中等大小,细胞质稍密,液泡化程度低(图中“emb”)1E, F, G),与花药壁组织的细胞非常不同(图中“AW”)1E)和胚性肿块(图中“ms”)1F, G),体积较大,液泡化程度高。
未成熟的授粉橡果(图1H)为受精卵来源,培养后用于体细胞胚胎发生诱导。培养开始约1个月后,未成熟的合子胚表面出现大小不一的早期多细胞胚和球状胚,随后发育成心胚、鱼雷胚和子叶胚(图)1I).将胚胎转移到增殖培养基中,观察二次胚胎发生,重复传代后,现有的胚胎可以通过产生胚性块(图中“ms”)进行增殖1J)从中产生新的胚胎(图中箭头所示)1J)。
该体细胞胚发生系统的早期多细胞胚的细胞结构与小孢子胚发生途径的细胞结构相似,早期胚细胞体积小,细胞质致密,液泡小,细胞核中等大小(图中“emb”)1K, L),与未成熟的合子胚胎显示的较大细胞明显不同,后者显示一个大液泡(图中“zye”)1K).小孢子和体细胞起源的次生胚在胚团中形成并发育为小的多细胞胚(图中“emb”)1M)由表现出类似于直接起源于小孢子或未成熟合子胚胎的早期多细胞胚胎的细胞所描述的组织的细胞所形成,与胚性团块中较大的、高度空泡化的细胞(图中“ms”)非常不同1米)。
小孢子和合子胚起源的早期胚胎发生过程中DNA甲基化的变化
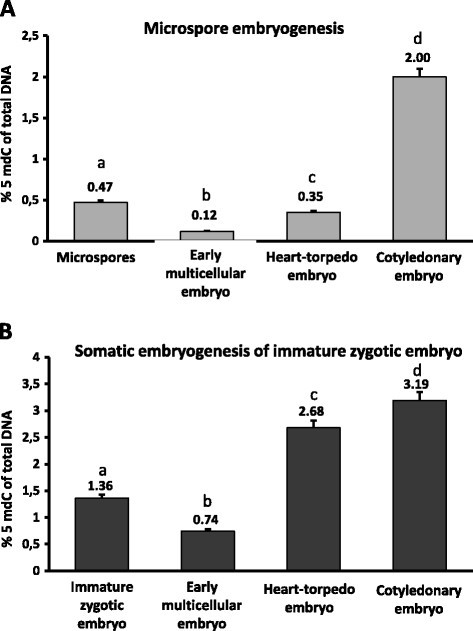
在胚胎发生的不同发育阶段以及小孢子和合子胚胎中,分析了全局DNA甲基化的百分比(图2).定量结果显示,在两种胚胎发生途径中,DNA甲基化的时间分布相似。DNA甲基化显著降低(p≤0.05),在早期多细胞胚中,与花药中的小孢子相比,在胚胎发生前的合子胚中。在胚胎发生后期,DNA甲基化水平显著增加(p≤0.05),在胚胎发育后期,两者子叶胚含量最高在体外系统(图2).从合子胚胎衍生的第二途径的心鱼雷胚胎中,整体DNA甲基化的增加高于小孢子胚胎发生途径。
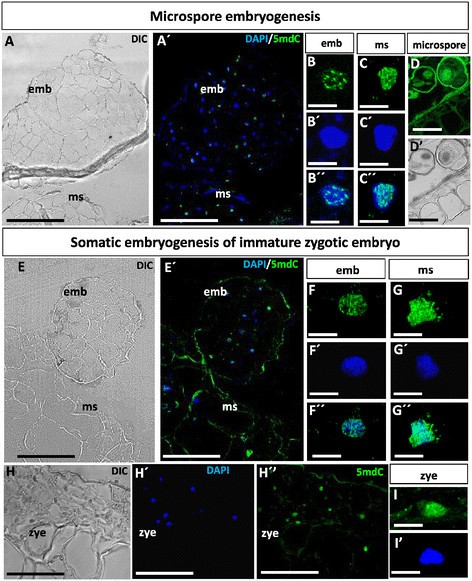
为了分析甲基化DNA在早期胚胎发生过程中核分布模式的变化,在初级和次级胚胎发生的早期,特别是在研究的两种途径的早期多细胞胚胎阶段(小孢子和未成熟合子胚胎),采用抗5mdc抗体免疫荧光和共聚焦分析。5mdC免疫荧光信号在两种胚胎发生途径的早期多细胞胚胎细胞中相似(图3.)和在初级和次级胚胎中。5mdC免疫荧光信号在早期胚胎细胞中与花药小孢子中有很大的不同(图3.D, D’),未成熟的合子胚胎(图中“zye”)3.H, H’,H”,I, I’)和胚性肿块(图中“ms”)3.A, A ', c, c ', c ", e, e ', g, g ', g ")。早期多细胞胚胎直接起源于在体外通过初代胚胎发生培养的小孢子或合子胚胎显示出与多细胞胚胎相同的5mdC定位模式(图中“emb”)3.A, A ', E, E ')由胚性块(图中“ms”)产生3.A, A ', E, E ')通过两种途径的次级胚胎发生。早期胚胎细胞在细胞核上方的小亮点中表现出5mdC免疫荧光的分布模式,DAPI染色可清晰识别(图3., B, B’,B”,,F, F’,F”),这些5mdC的荧光点可能对应小异染色质团块。相反,小孢子的核(图3.D, D’),未成熟的合子胚胎(图中“zye”)3.H, H ', H ", I, I ')和胚性肿块(图3.C, C ', C ", g, g '。G ")显示强烈的5mdC免疫荧光信号几乎覆盖整个核区。外壁,特殊的花粉壁,显示非特异性的自身荧光(图3.D)这不会干扰小孢子胚胎发生分析过程中检测到的特异性免疫荧光信号。避免第一个抗体或变性步骤(抗体识别5mdC所需的步骤)的对照实验,在任何样品和发育阶段都没有显示标记,评估抗体的特异性。
早期甲基化的DNA核模式在体外小孢子和未成熟合子胚的胚胎发生。模拟:小孢子胚胎发生。练习:未成熟合子胚胎的体细胞胚胎发生。一个,一个“,E,E”:早期多细胞胚胎(emb)和胚性包块(ms)的5mdC免疫荧光共聚焦图像。差分干涉对比度,DIC,图像(A, E)细胞核5mdC免疫荧光(绿色)和DAPI染色(蓝色)合并图像(一个“E”)同样的部分。b”,碳碳”,f”,G-G:早期多细胞胚胎代表性细胞核的高倍放大图像,emb。(b”,f”),胚性包块(ms)(碳碳”,G-G”),小孢子(D, D ')和未成熟的合子胚胎,zye(我的)绿色显示5mdC免疫荧光(b, c, d, f, g, i),细胞核DAPI染色为蓝色(B”,C ',F ',G’,我”)并合并了绿色和蓝色通道的图像(B”,C”,F”,G”).酒吧:A, A´,e, e´:50 μm;B, B´,B´´,C,C´,C´´,F,F´,F´´,G,G’,G”,我,我: 5 μm;D,D ': 10 μm。
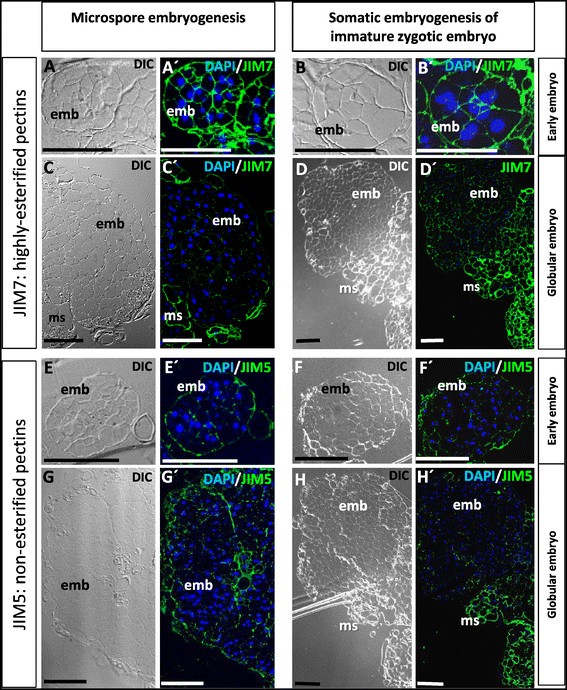
在小孢子和合子胚起源的早期胚胎发生过程中细胞壁果胶酯化的变化
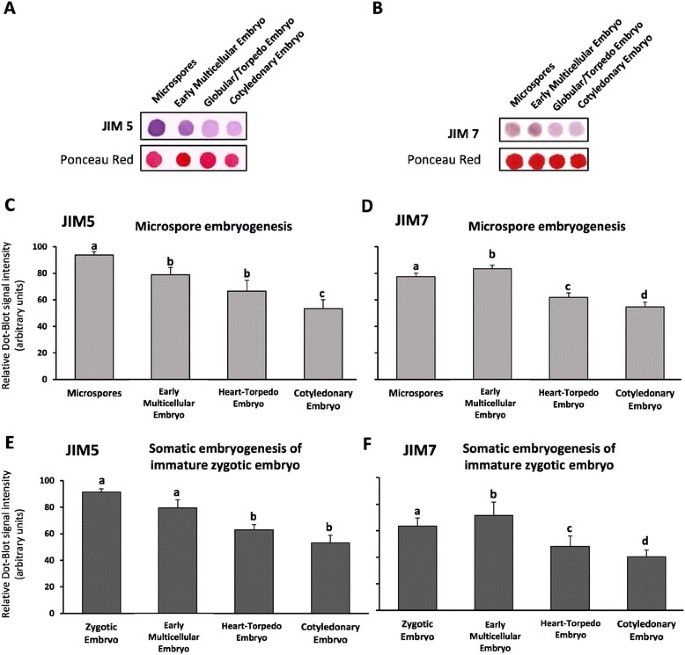
利用分别识别非酯化果胶和高度酯化果胶的JIM5和JIM7特异性抗体,用免疫斑点-印迹法和免疫荧光法分析了小孢子胚和合子胚在胚胎发育早期细胞壁中果胶酯化比例的变化。在小孢子和合子胚中进行了胚发生前的斑点杂交分析,并在两种胚发生途径的连续发育阶段进行了斑点杂交分析。在等量的蛋白质提取物上进行的点印迹信号强度的差异,如Ponceau红染色所示,揭示了胚胎发生过程中细胞壁高度酯化和非酯化果胶比例的变化(图)4A, B)。信号强度的量化显示每种抗体在两种胚胎发生途径中的时间分布相似(图4C, D, E, F)。与非酯化果胶相对应的JIM5信号在诱导前小孢子和合子胚中较高,而在心胚、鱼雷胚和子叶胚中随着胚胎发生的进展而逐渐减弱(图4C、E);在小孢子胚胎发生途径中,JIM5信号的降低在多细胞胚胎的早期阶段也显著(图1)4C, E)。相反,识别高度酯化果胶的JIM7抗体显示出显著的信号增加(p与小孢子胚和未成熟合子胚相比,早期多细胞胚的存活率为≤0.054D, F)。心脏胚胎、鱼雷胚胎和子叶胚胎中,在胚胎发生的晚期,JIM7信号的强度逐渐降低(图4D, F).避免第一个抗体的对照实验在任何情况下都没有显示标记。
免疫荧光分析显示,对于每个果胶表位,非酯化(JIM5标记)和高度酯化(JIM7标记)的果胶,小孢子和未成熟合子胚胎的胚胎发生途径都有类似的定位模式。JIM7标记在早期多细胞胚胎的外周和内细胞壁上强烈(图中“emb”)5A, A ', b, b ')。相比之下,早期多细胞胚胎的内细胞壁很少或没有JIM5抗体的标记,只有多细胞胚胎周围的外周壁层有JIM5抗体的标记(图5E, E ', f, f ')。在更高级的发育阶段,直接和次生胚胎发生形成的球形胚胎显示很少或没有标记JIM7或JIM5抗体,而胚性块的细胞壁显示标记这两种抗体(图中“ms”)5C, C ', d, d ', h, h ')。斑点杂交结果显示,在晚期胚胎阶段,JIM5和JIM7信号呈微弱阳性,这表明该方法比树脂切片上的免疫荧光法灵敏度更高,树脂切片上只能检测到表位暴露在切片表面;另一方面,不能完全排除这样一种可能性:在用于点-印迹分析的样品中,胚胎形成团块中的一些细胞仍附着在胚胎上,并对点-印迹信号有轻微贡献。
早期免疫定位非酯化(JIM5)和高酯化(JIM7)果胶在体外小孢子和未成熟合子胚的胚胎发生。A, A ', c, c ', e, e ', g, g ':小孢子胚胎发生。B, B ', d, d ', f, f ', h, h ':未成熟合子胚胎的体细胞胚胎发生。“- h”: JIM7免疫荧光信号共聚焦合并图像(绿色)“- d”)或JIM5 (E - h的’)结合细胞核DAPI染色(蓝色)。a:差分干涉对比,DIC,同切片图像。A, A ', b, b ', e, e ', f, f:早期多细胞胚胎。C, C ', d, d ', g, g ', h, h ':大的多细胞和球形胚胎(emb)通过次级胚胎发生从胚胎团块(ms)中产生。规格:100 μm。
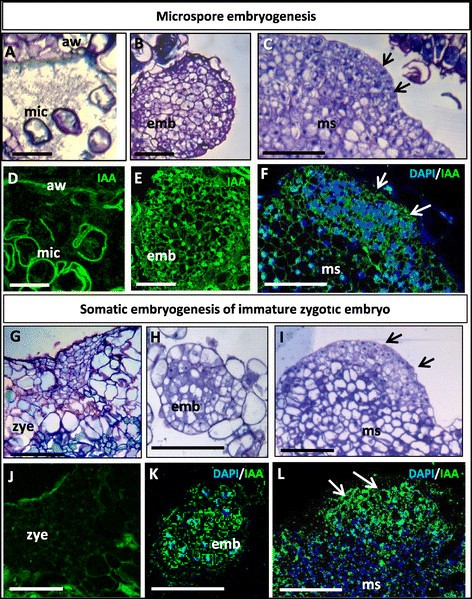
内生生长素在小孢子和合子胚起源的早期胚胎发生过程中的定位
内源性生长素吲哚乙酸(IAA)的定位采用特异性抗IAA抗体的免疫荧光法进行。结果显示,IAA在小孢子和合子胚胎两种胚胎发生途径中的定位模式相似。在胚胎发生诱导后,在小孢子中观察到很少或没有IAA标记(图6A, D)和未成熟的合子胚胎(图中“zye”)6G, J)在培养中。在小孢子中,特殊的花粉壁,即外壁,显示出非特异性的自身荧光6D)。然而,在初级胚胎发生的两种途径产生的早期多细胞胚胎的细胞质中发现了强烈的IAA标记(图中“emb”)6B, E, H, K) B, F).在早期次级胚胎发生过程中,在胚胎团块的表面(图中“ms”)6C, F, I, L)是产生新的多细胞胚胎的致密细胞,也显示出强烈的IAA标记(图中箭头)6C, F, I, L),而相邻的胚性团块细胞(图中“ms”)6C, F, I, L)没有显示任何标签。IAA抗体免疫缺失对照组在任何细胞结构和发育阶段均未显示标记,支持免疫荧光结果的特异性。
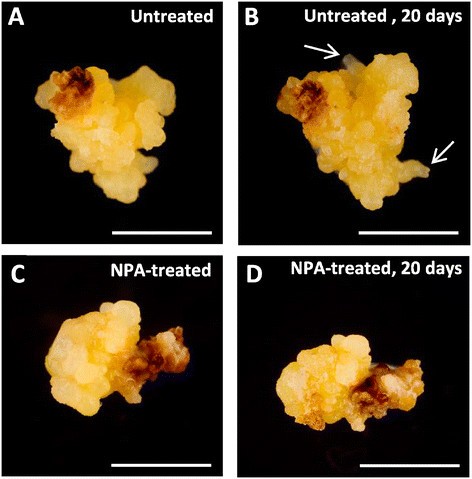
为了评估内源生长素积累在两种途径的胚胎发生早期阶段的作用,使用生长素极性转运抑制剂1- n -萘酞酸(NPA)处理在体外有胚性团块的培养物起源于这两个系统。来源小孢子和未成熟合子胚的胚胎发生培养结果相似;结果表明,与对照培养物相比,NPA处理影响了胚胎发育(图1)7).经过20天的NPA处理后,在处理过的培养物中既没有观察到新的胚胎也没有观察到胚性块的发育,而在没有NPA的平行胚性培养物中,胚胎发生正常启动和进展。在同一时期观察到从胚胎形成团块中出现的新胚胎和先前胚胎的发育(图7).
使用的细胞标记物(甲基化DNA、高度酯化和非酯化果胶和生长素)在增殖和分化细胞的其他发育系统中的分布模式
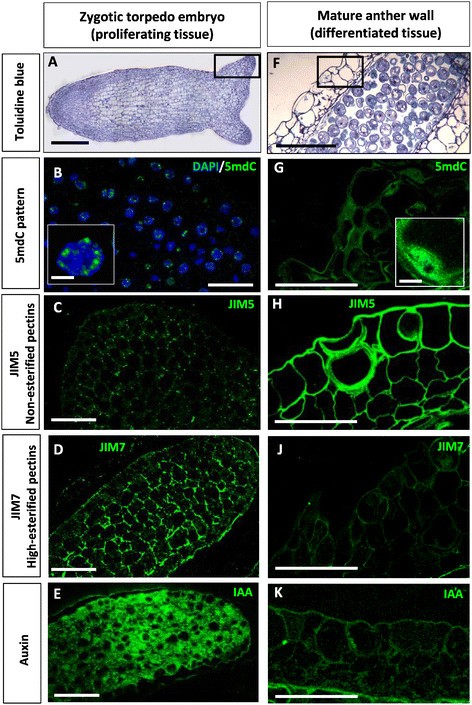
为了评价所选细胞特征(5mdC、高酯化和非酯化果胶和IAA)作为胚胎发生早期标记的模式,我们分析了它们在其他两个具有增殖和分化细胞的植物发育系统中的分布,分别作为阳性和阴性对照。其中一个系统是正在发育的合子胚胎的增殖细胞,标记物应该在其中找到,而在另一种植物中,芸苔属植物显著,以进一步评估这些特征是否也存在于其他物种。另一个系统是一个非胚性的系统,有分化的细胞,成熟花药的表皮和下层细胞层,分化的组织中不应该出现标记。
增殖胚细胞和非胚源性分化细胞两种系统的对比分析结果如图所示8.在合子鱼雷胚胎的增殖细胞中(图8A),所有抗体的免疫定位模式与早期多细胞胚胎的模式相似在体外.通过抗5mdc免疫荧光定位的甲基化DNA稀少,分布在细胞核上方的小斑点中(图8B)。JIM5和JIM7抗体分别显示非酯化果胶和高度酯化果胶,其定位模式显示增殖胚胎细胞的细胞壁被JIM7标记的比被JIM5标记的高(图)8C, D)表明这些细胞中酯化果胶的比例较高。增殖胚胎细胞的细胞质中生长素免疫荧光信号强烈(图8E)定位于发育中的鱼雷胚子叶尖端。相反,在花药壁分化组织中的定位模式(图8F)与在胚胎细胞中发现的相反。5mdC信号强烈,覆盖整个核区域(图8G),对应于丰富的高甲基化DNA。花药组织细胞壁表现出强烈的JIM5信号和极低的JIM7信号,表明非酯化果胶在这些细胞壁中所占比例较高。在花药壁层分化细胞中观察到极低或无IAA信号(图8J)。
5mdC、酯化(JIM7)和非酯化(JIM5)果胶和IAA在其他系统中的免疫定位。安妮的合子鱼雷胚胎芸苔属植物显著。f - k成熟的花药Quercus木栓。一个F:合子鱼雷胚和成熟花药全景,甲苯胺蓝染色的树脂切片;广场上一个而且F表示分析重点所在的增殖胚细胞(A)和花药壁分化细胞(B)的代表性区域。中,G-K: 5mdC (B, G)、JIM5 (C, H)、JIM7 (D, J)和IAA (E, K)抗体的免疫荧光信号放大倍数更高(绿色)。在B,细胞核DAPI染色(蓝色)与5mdC免疫荧光(绿色)合并。Insets的B而且G高倍镜下,各细胞类型的代表性细胞核。酒吧:一个F: 50 μm,中,G-K: 25 μm, insets: 5 μm。
讨论
在早期胚胎细胞的细胞核重构中,整体DNA甲基化减少
DNA甲基化在植物生长中起着至关重要的作用,它是一种表观遗传学上维持细胞增殖和分化发育命运的机制[14],[15],[32] - [34].在目前的工作中,我们分析了小孢子和合子胚胎两种途径的早期胚胎发生过程中DNA甲基化水平和分布模式与染色质变化的关系,结果表明这两种胚胎发生过程的起始都受到表观遗传学的调控。在这两种植物的早期胚胎细胞中发现了整体DNA甲基化水平的差异和5-甲基脱氧胞苷(5mdC)分布模式的变化在体外分析了胚胎发生途径,提示核活性的变化。在早期多细胞胚胎中,与小孢子、未成熟合子胚胎或两种胚胎发生的胚性团细胞相比,全局DNA甲基化显著降低在体外系统。关于树种的报告显示,形态发生能力与低水平的DNA甲基化有关[32],授粉后胚珠发生短暂的DNA去甲基化[35].在芸苔属植物显著,在小孢子胚胎发生的早期阶段也有DNA甲基化降低的报道[14].
免疫定位论文不仅显示了小孢子和合子胚胎衍生的早期胚胎细胞中5mdC标记的减少,而且5mdC在小核点的分布模式也发生了变化,与非胚细胞染色质团高度浓缩对应的大核区域的5mdC分布模式形成了对比。这种在小异染色质团块上的5mdC分布模式与在根分生组织的活跃增殖细胞中发现的模式相关[34]和油菜籽的早期小孢子胚胎,芸苔属植物显著,具有较高的转录活性和去密度染色质模式[11],[14].相反,5mdC分布在大量异染色质团块上与细胞活性阶段和细胞分化降低有关,如花粉粒的生殖/精子细胞和高级胚胎的分化细胞[14],[15]或在绒毡层细胞发育过程中程序性细胞死亡过程中发生的染色质高度凝结[36].
本文的数据揭示了一种表观遗传学变化,与转向胚胎发生发育程序和激活发生在胚胎发生的两种途径的细胞增殖有关,即通过花药培养的小孢子胚胎发生和未成熟合子胚胎的体细胞胚胎发生,这是首次在木本物种栎树中出现。
早期胚胎细胞的细胞壁显示出较高水平的酯化果胶
越来越多的证据表明,细胞壁重塑与植物生长发育的许多过程有关,包括体细胞胚胎发生[22],[37],[38].一些单克隆抗体已被用于阐明特定细胞壁表位参与控制细胞生长和形态发生;具体来说,分别识别非酯化果胶和高酯化果胶的抗体JIM5和JIM7在几种植物组织和器官中检测到的抗原分布有不同的研究[20.],[21],[39].在目前的工作中,我们已经使用JIM5和JIM7抗体来分析与之相关的细胞壁变化在体外胚胎发生起始Quercus木栓l
在草本植物非常年轻的小孢子衍生的胚胎中(甜椒而且芸苔属植物显著),在细胞壁内观察到大量的酯化果胶[17],[18],[40].使用一个原位据报道,在光镜和电镜水平的定位方法,在增殖细胞的细胞壁中,酯化果胶的水平高于分化细胞,这表明细胞壁富含非酯化果胶[17],[18].在小孢子和小孢子胚之间酯化果胶的比例有差异的树种,如Quercus木栓,柑橘克莱门蒂娜,齐墩果欧洲公司[8],[10],[23].
本研究结果显示,在栎类植物的两种途径(小孢子胚胎发生和合子胚胎发生)中,高酯化果胶在早期胚胎细胞和非胚胎发生细胞中的分布模式存在差异。高酯化果胶在早期胚细胞壁中含量高于小孢子、合子胚和胚原团块细胞,但随着胚发育和分化而减少。这一证据与一些草本植物的小孢子胚增殖细胞的新形成的细胞壁和根尖分生组织细胞中大量的酯化果胶是一致的[17],[18],从而提供了实验支持,表明细胞壁中酯化果胶的高比例不仅是增殖事件的标记,也是胚胎发生重编程途径、小孢子和未成熟合子胚胎起源的早期标记。
我们的研究结果表明,与内细胞壁相比,环绕早期多细胞胚胎的外周壁层被JIM5标记。以前的报道描述了在胚性小孢子和各种物种的年轻胚胎中,在外壁下存在一层厚壁,这是一种特殊的小孢子壁甜椒而且齐墩果欧洲公司[9],[10].在体细胞胚胎发生和器官发生以及小孢子胚胎发生的早期阶段,这些周围厚壁的发育已被报道为这些过程的一个特殊特征[9],[10],[16,虽然这堵墙的性质还没有被阐明。有人提出,这一层可以由不同的壁组分组成一个有组织的网络,这可能会创造一个渗透率和受体改变的特定细胞环境,为表达形态形成能力提供条件[16].目前的研究表明,在两个早期阶段黄栎离体研究从小孢子和未成熟的合子胚胎的胚胎发生途径来看,早期多细胞胚胎的外周壁中非酯化果胶的比例高于内细胞壁,这为进入细胞周期和启动胚胎发生程序的细胞群周围存在特殊的壁结构提供了额外的证据。
在早期胚胎细胞中存在较高的内生生长素水平
生长素在许多方面的作用取决于其在植物组织中的局部生物合成和差异分布,主要由其在细胞间的定向运输调节[41].我们分析了栎小孢子和未成熟子午形胚两种胚胎发生途径的早期内源生长素IAA的分布和水平。在体外胚胎在无外源性IAA的培养基中发育的系统[42],[43].有趣的是,IAA免疫定位分析显示,早期多细胞胚胎细胞内源IAA水平显著升高,而小孢子、未成熟合子胚胎和胚源团块细胞则表现出非常低的IAA信号。在拟南芥在早期,生长素响应启动子DR5在胚胎原体细胞中的表达定位了生长素[24],[44].IAA的生物合成与组织的快速分裂和快速生长有关,尤其是在嫩枝和根中,活植物中的游离生长素浓度分布在嫩枝的顶端分生组织、幼叶、根分生组织和侧根起始部位[45],[46].在一个新的芸苔属植物显著小孢子胚胎发生在体外我们小组报告的初步结果显示,IAA也定位于早期多细胞胚胎的细胞[28],类似于早期合子胚胎发生。
本研究结果表明,在小孢子胚和合子胚的早期多细胞胚形成过程中,内源IAA水平增加Quercus木栓.这一结果,以及NPA抑制生长素运输对胚胎发生启动和发育的负面影响表明,内源性IAA的生物合成和运输可能参与了增殖的激活和重编程的小孢子、合子胚和胚性团块细胞的胚胎发生程序的切换。
小孢子和合子胚胎的早期胚胎发生表现出相似的早期标记:DNA低甲基化的表观遗传变化,高果胶酯化的细胞壁重塑和高内源性生长素水平
在体外胚胎发生的起始和进展受到许多因素的制约,但这些因素在很大程度上仍不清楚。比较分析在胚胎发生的早期阶段,在两个不同的在体外系统,通过花药培养的小孢子胚胎发生和从未成熟合子胚胎培养的体细胞胚胎发生,在一个木本物种中,Quercus木栓,已允许鉴别的差异细胞特征,总结在表1作为早期标记,它们在栎小孢子和未成熟合子胚胎的胚胎发生途径中都是相似的。这些不同的特征是DNA甲基化的减少,通过增加酯化果胶的比例来重塑细胞壁,以及在启动胚胎形成程序的细胞中积累内源性生长素。目前的工作为两个重要问题的理解提供了新的证据在体外胚胎发生过程。一方面,报道的数据显示,在早期阶段研究的两种不同的胚胎发生途径中,一些基本的细胞特征发生了类似的变化,表明早期存在基本的细胞过程在体外胚胎发生在各种系统中是共同的,这表明一般机制可以独立于细胞类型、起源和培养条件来调节这一过程。此外,结果说明了三个细胞过程的相关性,它们专门发生在诱导后的早期胚胎细胞中,而在胚胎发生开始前和晚期发育阶段都没有观察到相同的细胞变化,这一事实允许考虑这些特征(DNA低甲基化,果胶高酯化的细胞壁重塑和内源性生长素增加)作为该过程的早期标记。打开设计策略的可能性,进行有效的操作在体外提高产量的协议。
之前的一项细胞化学和免疫细胞化学研究比较了两种起源的高级球状胚胎、小孢子和未成熟合子胚胎的结构组织,发现两者的解剖结构和细胞组织模式相似;其共同特征是高空泡化,核大小和结构小,核糖体数量多,存在淀粉粒[7].在其他物种的胁迫诱导小孢子胚胎发生和体细胞胚胎发生的研究表明,表观遗传标记参与了[14],[15,细胞壁成分[10],[16] - [19]和内源植物激素[27],[28],[47在器官发生和胚胎发生的起始和进展中起着重要作用。这里描述的一些标记物在其他植物物种中也被发现,例如,DNA低甲基化已经在小孢子胚胎中被观察到芸苔属植物显著[14),大麦芽[15],在小孢子胚细胞壁中酯化果胶的比例很高辣椒年[17],[18],在油菜小孢子胚胎发生过程中发现了早期胚胎内源生长素的产生[28].本研究首次报道了林木小孢子和体细胞胚胎发生过程,揭示了在不同的诱导下,两种不同的胚胎发生途径发生的所有这些细胞过程在体外协议。有趣的是,报告的细胞修饰不仅在直接来自小孢子和合子胚胎的早期胚胎中被观察到,而且在早期由胚胎团产生的次生胚胎中也被观察到。相比之下,在胚胎发生诱导前产生胚胎的细胞(小孢子和未成熟合子胚细胞)中没有发现这些特征。此外,它们也在其他植物合子胚胎的增殖细胞中发现,显著而成熟器官的分化细胞在DNA甲基化、果胶酯化和内源性生长素含量等方面与早期胚胎细胞表现出相反的特征。两个来源的小孢子和未成熟合子胚胎的早期胚胎细胞,由一次或二次胚胎发生产生的两个早期胚胎细胞中出现相同的差异细胞特征,这一事实表明,它们可以被认为是早期标记在体外胚胎发生。如前所述,其中一些已在其他植物的胚胎中单独报道过[14],[15],[17],[18],[28在目前的研究中,这三个特征是在另一个物种合子胚胎的增殖细胞上发现的,芸苔属植物显著这些数据支持这样一种观点,即这些早期标记反映了一种可以被其他物种利用的普遍行为。
越来越多的证据证明,不同的植物激素,包括生长素,在细胞壁重塑的信号过程中,细胞伸长和生长所必需的,以及在染色质重塑的激活特定基因表达发育程序的作用。本文报道的影响表观遗传标记和细胞壁聚合物的变化与早期胚胎细胞中生长素的积累有关,这些数据可能反映了在控制细胞重编程和胚胎发生启动的复杂调控机制中相互关联的不同过程。
结论
鉴定胚胎发生的早期标记物有助于监测诱导过程中涉及的代谢过程,从而更广泛地了解控制植物细胞重编程和胚胎发育能力获取的生理学和机制。本研究首次通过对胚胎发生早期的比较分析,发现在小孢子胚胎发生和未成熟合子胚胎发生两种胚胎发生途径的早期,DNA低甲基化、果胶酯化引起的细胞壁重塑和内源性生长素增加等多种细胞过程同时发生在体外协议,识别相似的早期胚胎发生标记Quercus木栓.这里报告的数据显示,一种木本物种,对在体外胚胎发生是特别相关的。获得的信息将有助于增加我们对监管机制和相关因素的认识在体外在生物技术、农艺和林业育种项目中,诱导胚胎发生,为识别新的策略和选择性目标,提高过程效率打开了大门。
方法
植物材料
采集柳絮和未成熟的授粉橡果Quercus木栓在花期和果实发育期,分别从蒙特大学(Universidad Politécnica de Madrid)的两棵树和西班牙马德里埃尔帕尔多(El Pardo)的三棵树中选择。
结柳絮的枝条用湿棉在4°C下阴冷处理1周。用DAPI(4,6 -二胺基-2-苯基吲哚)对不同大小的柳絮进行压扁染色,观察细胞核形态,荧光显微镜下观察小孢子发育阶段。选择的柳絮,只有那些红色的,长1.5-2.5 cm,含有液泡小孢子的,是诱导胚胎发生最敏感的阶段[48],进行表面消毒。在合适的发育阶段选择小的、1 cm、绿色的橡子进行体细胞胚发生诱导;4℃保存一周。用70%乙醇(默克)浸泡1分钟,2%次氯酸钠加吐温-20滴浸泡20分钟,然后用无菌蒸馏水冲洗三次,每次冲洗10分钟。将花药和未成熟的合子胚分别从柳絮和橡子中精心取出,分离、解剖,在无菌条件下层流箱中培养。
为了在其他植物系统中作为对照,一些成熟的花药Quercus木栓直接从柳絮中提取,不做任何预处理,固定和加工,以进一步用于免疫荧光分析。此外,还提取了鱼雷期的合子胚胎芸苔属植物显著植物,固定和处理免疫荧光。
文化传媒
小孢子和体细胞胚胎发生的基础培养基均含有充分的宏量营养素[49]、微量营养素和辅助因子[50], 3%蔗糖,用0.8%琼脂固化,调整到pH = 5.6,并蒸压。经过滤杀菌(0.22 μm)蒸压后加入氨基酸和活性化合物。小孢子胚发生诱导培养基为基础培养基中添加1%活性炭,体细胞胚发生诱导培养基中添加0.5 mg/L 2,4- d。
在体外小孢子和未成熟合子胚的胚胎发生
从柳絮中分离出含有空泡小孢子的花药,并将其置于带诱导培养基的培养皿中,每盘约100个花药用于小孢子胚胎发生,在32°C的黑暗条件下放置5天[43,然后转移到25°C。一个月后,可见的胚胎从花药内出现。将获得的胚胎分离转移到含基础培养基(不含活性炭,添加0.5 g/L谷氨酰胺)的平板上,进行二次胚胎发生繁殖。
未成熟的合子胚胎在含有体细胞胚胎发生诱导培养基的培养皿中培养,每个培养皿放置5个胚胎,在25°C、16/8 h光/暗条件下培养一个月[42],[51].然后将未成熟的合子胚胎转移到无生长调节剂的培养基中,在培养基中发现新的胚胎和胚性团块,反复发生体细胞胚胎发生过程。
每周在莱卡MZ16FA显微镜下观察胚胎发生过程,监测胚胎发生过程。两种胚胎形成系统不同发育阶段的培养样品要么固定用于显微镜分析,要么浸泡在液氮中冷冻用于生化分析。
NPA的处理
N在DMSO中加入0.1 M NPA,用无菌Ministart过滤器(Sartorius Biotech)过滤后,在相应的小孢子和体细胞胚胎发生培养基中加入40 μM浓度的-1萘酞胺酸(NPA, Duchefa),生长素运输抑制剂。用相同培养物的平行平板和保留一些缺乏NPA的平板作为对照,通过二次胚胎发生将NPA添加到繁殖胚性块的平板上。为了评估NPA对胚胎发生发育的影响,在NPA处理和对照培养物中评估了20天后的胚胎生长和每板新胚的紧急情况。
抗体
使用以下抗体和稀释剂:抗5-甲基脱氧胞苷(5mdC)小鼠单克隆稀释1:100 (Eurogentec, Cat。N: BI-MECY-0100, Liege, Belgium),抗iaa小鼠单克隆稀释1:100 (Sigma, Cat。N: A 0855)、JIM5大鼠单克隆(Plant Probes, Cat。N: JIM5)和JIM7大鼠单克隆(植物探针,Cat N: JIM7)稀释1:25用于免疫荧光,1:100用于免疫点-印迹分析。
免疫荧光的固定和处理
在不同时间收集小孢子和未成熟合子胚胎的胚胎发生培养样品,用4%的多聚甲醛磷酸盐缓冲盐水(PBS)固定在4℃下过夜。作为对照实验,成熟的花药Quercus木栓和合子鱼雷胚胎芸苔属植物显著从植物中取出,用同样的方法固定。大多数样品被嵌入树脂中,一些大的样品被用于低温冷冻器处理。
冷冻切片的加工
固定样品在PBS中洗涤,通过蔗糖溶液的逐步渗透进行冷冻保护:0.1 M, 0.5 M, 1 M, 1.5 M和2 M,每个1小时,2.3 M过夜,在4℃下,嵌入组织- tek最佳切割温度(OCT)化合物,并在干冰上冷冻,在低温恒温器(莱卡CM 1950)中切片。将20 - 30 μm厚的切片收集在载玻片上,用水清洗以去除OCT,然后转移到3-氨基丙基-三乙氧基硅烷(APTES)涂层载玻片上的水滴上,风干并保存在−20℃,直到用于免疫荧光(IF)。
树脂包埋和超微切片加工
固定样品在PBS中洗涤,通过丙酮系列(30%,50%,70%,90%和100%)脱水,并在4℃埋入Technovit 8100树脂(Kulzer,德国)。在1-2 μm厚度下将材料切片,用1%甲苯胺蓝染色进行结构分析,用Eukitt安装,并在明亮视野显微镜下观察。部分切片置于涂有APTES的载玻片上,风干,4℃保存,直到用于免疫荧光。
免疫荧光
免疫荧光(IF)基本上与我们之前描述的一样[14],[19],[28].对于低温冷冻切片,需要在IF之前进行渗透。切片在室温下解冻后,在甲醇系列(30%,50%,70%,90%,100%,90%,70%,50%,30%,各5分钟)和PBS中脱水和再水。随后,在PBS中,用酶的混合物(2.5%果胶酶,2.5%纤维素酶和2.5%果胶酶)对它们进行细胞壁的酶解,使其进一步渗透,处理时间为45分钟。半薄树脂切片不需要渗透,在PBS中孵育几分钟后直接进行免疫检测。在这一步,所有的section类型都遵循相同的IF协议。切片先用5%牛血清白蛋白(BSA)或10%胎牛血清(FCS)阻断用于iaa免疫荧光,在PBS中孵育10分钟,然后分别与JIM5、JIM7、抗5-甲基脱氧胞苷(5mdC)、抗iaa、大鼠和小鼠单克隆抗体孵育1 h。对于5mdC抗体,切片先用2 N HCl变性45分钟。PBS中冲洗三步后,切片用Alexa Fluor 488标记的抗大鼠或抗小鼠IgG抗体在1% BSA中稀释1:25孵育45分钟。在PBS中洗涤后,细胞核用DAPI染色,用PBS洗涤,安装在Mowiol中,在共聚焦显微镜(Leica TCS-SP2-AOBS,维也纳,奥地利)下检查。光学切片和最大投影图像通过与共聚焦显微镜(徕卡软件LCS 2.5版)一起运行的软件获得。
阴性对照如下:对于5mdC抗体,避免变性步骤;对IAA抗体进行免疫衰减试验;抗IAA抗体与5 mg/ml合成IAA (1:4, v/v)溶液在4℃下孵育过夜。预先阻断的抗体溶液用作免疫荧光的一抗,遵循上述相同的协议和条件。
免疫点印迹法检测JIM5和JIM7抗体
从两种胚胎发生培养物中收集不同发育阶段的样品,并在液氮中冷冻。按照我们的描述对JIM5和JIM7抗体进行点blot检测[19].每个样品0.1 g,使用冷冻臼和研锤在液氮中均质,50 ml缓冲液含有50 mM Tris-HCl pH 7.2, 50 mM反-1,2-二氨基环己烷-N,N,-四乙酸(CDTA)和25 mM二硫苏糖醇。使用牛血清白蛋白(BSA)作为校准器,根据Bradford (Bio-Rad蛋白测定试剂)测定得到的上清浓度,并将所有样品调整到0.5 mg/ml。为了进行免疫点印迹分析,5 μl等分的调整上清液应用于硝化纤维素膜(Millipore;贝德福德,MA, United Kingdom),晾干1小时。首先用Ponceau红染色条带进行总蛋白检测,然后通过扫描捕获染色点的图像。将一次抗体(JIM5和JIM7)稀释1:100,在封闭缓冲液(2%脱脂奶粉含0.05% Tween-20在PBS中)中孵育一夜,洗涤,在封闭液中以稀释1:1 000的碱性磷酸酶偶联抗大鼠抗体孵育1 h。最后,通过硝基蓝四唑、溴代氯化物-磷酸钼(NBT-BCIP)混合物的处理,揭示了抗体所识别的表位。利用图像分析软件Adobe Photoshop的颜色强度量化工具对点印迹信号的相对强度进行量化。为了进行量化,使用每种抗体、发育阶段和胚胎发生途径的三个重复图像。每种抗体的颜色强度值,以任意单位计算,并调整为Ponceau S点的强度,以估计蛋白质水平。 Mean values and standard deviations were calculated and the results showed in histograms. Differences among stages were tested by one-way ANOVA analysis of variance followed by Tukey’s multiple comparison test atP≤0.05。
5mdC elisa免疫分析法定量DNA甲基化
样品从两种胚胎发生培养系统中收集,来自不同发育阶段的小孢子和未成熟的合子胚胎,并在液氮中冷冻。DNA甲基化的量化如前所述[34].根据试剂盒的说明,使用植物基因组DNA提取试剂盒(DNeasy plant Mini, Qiagen)从0.1 g冷冻材料中提取每个样品的总DNA。纯化的DNA,每个样本100 ng基因组DNA,用于全球DNA甲基化量化,使用MethylFlash甲基化DNA量化试剂盒(比色法,Epigentek, NY)添加到ELISA板,其中DNA的甲基化部分使用5-脱氧甲基胞苷特异性抗体定量。甲基化DNA的数量与在450 nm的ELISA平板读取器中测量的光密度(OD)成正比。通过从样品和标准的读数中减去阴性对照读数,每个样品的5-甲基脱氧胞嘧啶的值被计算为样品OD相对于标准OD的比值。结果以甲基化脱氧甲基胞嘧啶(5mdC)占总DNA的百分比表示。为了定量,每个发育阶段和胚胎发生途径使用3个重复。计算均值和标准差,结果以直方图表示。采用单因素方差分析检验各阶段间的差异,然后采用Tukey多重比较检验P≤0.05。
参考文献
- 1.
杨晓燕,李文华,李文华,陈文华,陈文华,陈文华,陈文华,陈文华,陈文华,陈文华,陈文华,陈文华Quercus阿尔巴,Quercus二色的而且Quercus rubra.PCTOC2009年,98:135 - 145。
- 2.
栎树体细胞胚胎克隆繁殖技术研究。编辑:Ramawat KG, Mérillon JM, Ahuja MR. CRC出版社,博卡拉顿,美国佛罗里达州;2014:262 - 302。
- 3.
Corredoira E, San-José MC, Vietez AM:从幼体培养的芽的不同外植体诱导体细胞胚胎发生Quercus阿尔巴树。树2012年,26:881 - 891。
- 4.
testllano PS, Coronado MJ, Seguí-Simarro JM, Domenech J, González-Melendi P, Raska I, Risueño MC:定义的核变化伴随小孢子重编程到胚胎发生。中国生物医学工程学报,2000,29(3):394 - 394。10.1006 / jsbi.2000.4249。
- 5.
tesllano PS, Ramírez C, Domenech J, Coronado MJ, Vergne P, Matthys-Rochon E, Risueño MC:玉米小孢子衍生的幼胚表现出两个具有明确特征的区域,在合子胚胎发生中也存在。中国生物医学工程杂志,2002,29(4):356 - 356。
- 6.
睾丸菌PS, González-Melendi P, Coronado MJ, Seguí JM, Moreno-Risueño MA, Risueño MC:分化的植物细胞转变为增殖,重塑核结构域的功能组织。中国生物医学工程学报,2005,38(5):557 - 557。10.1159 / 000082396。
- 7.
Bueno MA, Gómez A, Sepulveda F, Segui JM, testllano PS, Manzanera JA, Risueño MC:小孢子来源的胚胎Quercus木栓花药模拟合子胚,在长期花药培养中保持单倍体。J植物物理2003年,160:953 - 960。
- 8.
Ramírez C, testllano PS, Pintos B, Moreno-Risueño MA, Bueno MA, Risueño MC:与小孢子胚胎发生早期细胞发育相关的果胶和MAPKs的变化白栎.细胞生物学2004年,83:213 - 225。
- 9.
Bárány I, González-Melendi P, Fadón B, Mityko J, Risueño MC, tesllano PS:辣椒小孢子胚发生(英文)辣椒;):发育过程中的亚细胞重排。生物细胞2005年,97:709 - 722。
- 10.
Solís MT, Pintos B, Prado MJ, Bueno MA, Raska I, Risueño MC, tesllano PS:橄榄体外小孢子重编程胚胎发生的早期标记物(油橄榄。).植物科学2008年,174:597 - 605。
- 11.
Seguí-Simarro JM, Corral-Martínez P, Corredor E, Raska I, testllano PS, Risueño MC:发育程序的改变诱导小孢子胚胎发生过程中染色质间域的重塑甘蓝型油菜.J植物物理2011年,168:746 - 757。
- 12.
科斯塔·S·肖:开放的细胞:细胞如何改变命运。细胞生物学进展,2007,17:101-106。10.1016 / j.tcb.2006.12.005。
- 13.
应激诱导细胞重编程。全球基因组调控的作用?植物生理学报,2004,25(3):369 - 369。10.1104 / pp.104.042531。
- 14.
Solís MT, Rodríguez-Serrano M, Meijón M, Cañal MJ, Cifuentes A, Risueño MC, testllano PS:胁迫诱导花粉重编程过程中DNA甲基化动态和met1a样基因表达变化。中国生物医学工程学报,2012,29(6):694 - 694。10.1093 / jxb / ers298。
- 15.
大麦小孢子重编程对胚胎发生的DNA甲基化水平和核分布模式的影响。中国生物医学工程学报,2014,38(4):559 - 564。10.1159 / 000365232。doi: 10.1159 / 000365232
- 16.
Fortes AM, tesllano PS, Risueño MC, Pais MS:植物节间生长能力表达过程中胼胝质和角质层的研究及其对有机结节形成的影响鹰嘴豆.杂志杆菌2002年,116:113 - 120。
- 17.
Bárány I, Fadón B, Risueño MC, testllano PS:在花粉发育和花粉胚胎发生过程中,细胞壁成分和果胶酯化水平作为增殖和分化事件的标记辣椒.J Exp Bot2010年,61:1159 - 1175。
- 18.
Bárány I, Fadón B, Risueño MC, testllano PS:小孢子重编程胚胎发生诱导细胞壁和淀粉积累动力学的变化与增殖和分化事件相关。植物信号学报,2010,5:341-345。10.4161 / psb.5.4.11507。
- 19.
El-Tantawy AA, Solís MT, Costa M, Coimbra S, Risueño MC, tesllano PS:小孢子胚胎发生和花粉发育过程中的阿拉伯半乳蛋白谱和分布规律芸苔属植物显著.植物繁殖2013年,26:231 - 243。
- 20.
高德伯格,莫万C,罗兰JC:绿豆下胚轴年轻和成熟细胞中果胶的组成、性质和定位。植物生理学报,1986,27:417-429。
- 21.
杜兰,林士德,张晓燕,等:拟南芥根分生组织中果胶多糖的发育调控。中国机械工程学报,1997,38(5):729 - 729。10.1093 / jxb / 48.3.713。
- 22.
Guillemin F, Guillon F, Bonnin E, Devaux MF, Chevalier T, Knox JP, Liners F, Thibault JF:甜菜根细胞壁中果胶表位的分布。植物学报,2005,32(4):355-371。10.1007 / s00425 - 005 - 1535 - 3。
- 23.
Ramírez C, Chiancone B, tesllano PS, García-Fojeda B, Germaná MA, Risueño MC:柑橘小孢子源性胚胎的第一胚胎发育阶段。克拉科夫机器人学报,2003,45:53-58。
- 24.
Möller B, Weijers D:生长素对胚胎模式的控制。中国生物医学工程学报,2009,1:a001545-
- 25.
Rademacher EH, Lokerse AS, Schlereth A, llavtta - peris CI, Bayer M, Kientz M, Freire Rios A, Borst JW, Lukowitz W, Jurgens G, Weijers D:不同的生长素反应机制控制着植物早期胚胎中不同的细胞命运。开发与开发,2012,22:211-222。10.1016 / j.devcel.2011.10.026。
- 26.
Raghavan V: 2,4-二氯苯氧乙酸(2,4- d)在拟南芥合子胚体细胞胚胎发生中的作用:胚胎连续暴露于2,4-d时的细胞膨胀、细胞周期和形态发生。中国科学(d辑:自然科学版)。10.3732 / ajb.91.11.1743。
- 27.
García-Martín G, Manzanera JA, González-Benito ME:外源ABA对胚胎成熟及内源ABA和IAA水平定量的影响Quercus木栓体细胞胚胎。PCTOC2005年,80:171 - 177。
- 28.
Prem D, Solís MT, Bárány I, Rodríguez-Sanz H, Risueño MC, tesllano PS:一种新的低温小孢子胚胎发生系统,模拟合子胚胎发生的首字母,表达生长素,高效再生双单倍体植株芸苔属植物显著.植物生物学2012年,12:127。
- 29.
Massonneau A, Coronado MJ, Audran A, Bagniewska-Zadworna A, Mol R, tesllano PS, Goralski G, Dumas C, Risueño MC, Matthys-Rochon E:玉米花粉体外胚胎发生过程中发育的多细胞结构表达胚乳和胚胎特异性基因:哪个是哪个?中国生物医学工程学报,2004,24(3):366 - 366。10.1016 / j.ejcb.2005.02.002。
- 30.
Gómez-Garay A, López JA, Camafeita E, Bueno MA, Pintos B:蛋白质组学的视角Quercus木栓体细胞胚胎发生。J蛋白质组学2013年,93:314 - 325。
- 31.
Gómez-Garay A, López JA, Pintos B, Camafeita E, Bueno MA:植物单倍体和二倍体胚胎蛋白质组学分析白栎;识别定性和定量的差异表达模式。蛋白质组学2009年,9:4355 - 4367。
- 32.
杨文华,杨文华,杨文华,杨文华,等。DNA甲基化在植物生长发育和增殖过程中的作用。PCTOC。2007, 31(4): 447 - 447。10.1007 / s11240 - 007 - 9262 - z。
- 33.
Meijón M, Valledor L, Santamaría E, tesllano PS, Risueño MC, Rodríguez R, Feito I, Cañal MJ:杜鹃花芽营养和开花阶段的表观遗传学特征:DNA甲基化和组蛋白H4乙酰化的动力学。植物生理学报,2009,26(4):369 - 369。10.1016 / j.jplph.2009.04.014。
- 34.
testllano PS, Solís MT, Risueño MC: 5-甲基脱氧胞苷(5mdC)定位原位揭示多种植物器官和组织细胞发育过程中DNA甲基化染色质模式的动态。植物学报,2013,29(4):394 - 394。10.1111 / ppl.12015。
- 35.
陈晓燕,陈晓燕,陈晓燕,等。有性胚胎发生过程中的DNA甲基化及其对体细胞胚胎发生的影响齿栗叶的可能米勒。有性植物再生2010年,23:315 - 323。
- 36.
Solís MT, Chakrabarti N, Corredor E, Cortés-Eslava J, Rodríguez-Serrano M, Biggiogera M, Risueño MC, tesllano PS:绒毡层细胞发育性程序性死亡伴随表观遗传变化。植物生理学报,2014,38(5):559 - 561。10.1093 /卡式肺囊虫肺炎/ pct152。
- 37.
Chapman A, Blervacq AS, Vasseur J, Hilbert JL:菊苣体细胞胚胎发生中的阿拉伯半乳糖蛋白:β -葡萄糖Yariv试剂和表位定位在胚胎发育中的影响。植物学报,2000,29(4):359 - 361。10.1007 / s004250000299。
- 38.
van Hengel AJ, Tadesse Z, Immerzeel P, Schols H, van Kammen A, de Vries SC: n -乙酰氨基葡萄糖和含氨基葡萄糖的阿拉伯半乳聚糖蛋白控制体细胞胚胎发生。植物生理学报,2001,25(4):381 - 381。10.1104 / pp.125.4.1880。
- 39.
长谷川勇,中村勇,中村勇,上田勇,中村勇:被子植物花粉生长和胼胝质栓形成过程中果胶的免疫定位及其可能的作用。中国科学(d辑),2000,39:46-55。10.1080 / 00173130150503803。
- 40.
Solís MT:胁迫诱导花粉重编程到胚胎发生:细胞识别,程序性细胞死亡和DNA甲基化的作用。马德里康普鲁滕斯大学遗传学系,西班牙马德里;2012.
- 41.
Petrášek J,傅立明。植物生长发育过程中生长素转运途径的研究。科学进展,2009,36(3):369 - 369。10.1242 / dev.030353。
- 42.
Manzanera JA, Astorga R, Bueno MA:体胚的诱导与萌发白栎.Silvae麝猫1993年,42:2-3。
- 43.
马bueno, Gómez A, Boscaiu M, Manzanera JA, Vicente O:胁迫诱导栎花药培养形成单倍体(Quercus木栓).杂志杆菌1997年,99:335 - 341。
- 44.
Robert HS, Grones P, Stepanova AN, Robles LM, Lokerse AS, Alonso JM, Weijers D, Friml J:拟南芥胚中局部生长素来源定位于顶端-基部轴。植物生物学杂志,2013,23:2506-2512。
- 45.
黄晓明,王晓明,王晓明,等。植物生长素介导的早期侧根起头的细胞周期激活。植物科学学报,2002,14:2339-2351。10.1105 / tpc.004960。
- 46.
P:生长素极性运输:细胞极性到成图。生长素极性转运。植物的信号与通讯。17卷。编辑:Chen R, Baluska F. Springer-Verlag,柏林,海德堡;2013:25-44。10.1007 / 978 - 3 - 642 - 35299 - 7 _2。
- 47.
Larsson E, Sitbon F, Ljung K, von Arnold S:抑制极性生长素运输导致挪威云杉胚胎发育异常。植物学报,2008,37(4):356-366。
- 48.
Pintos B, Manzanera JA, Bueno MA:小孢子分裂导致配子胚形成的细胞学分析Quercus木栓L.花药培养物。植物生理学学报2005年,27:703 - 708。
- 49.
何夏莫,Brown CL, Kormanik PP:长叶松幼苗的分化松果体palustris轧机。体外培养的组织。机器人嘎斯1975年,136:196 - 200。
- 50.
Murashige T, Skoog F:烟草组织培养快速生长和生物测定的修正培养基。植物工程学报,1996,15:493 -497。10.1111 / j.1399-3054.1962.tb08052.x。
- 51.
Bueno MA, Astorga R, Manzanera JA:植物通过体细胞胚发生再生Quercus木栓.杂志的植物1992年,85:30-34。
确认
西班牙经济和竞争力部(MINECO)项目BFU2011-23752和西班牙国家研究委员会(CSIC)项目PIE 201020E038支持的工作。HRS获得了MINECO的FPI博士前奖学金(BES-2009-014245)。我们感谢CSIC开放获取出版物支持倡议通过其信息资源研究单位(URICI)对出版费的支持。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者声明他们没有竞争利益。
作者的贡献
HRS完成了大部分的实验工作,在体外培养,免疫荧光分析,点印迹和elisa基础实验,信号的量化和统计。JAM有助于选择树木样本,在体外培养过程和监控,并参与结果的讨论。MTS对合子胚胎进行了免疫定位分析芸苔属植物显著.AGG和BP对在体外并参与了结果的讨论。MCR参与了工作的设计和结果的讨论。PST设计和协调实验工作,分析结果,阐述结论并撰写稿件。所有作者阅读并批准了最终稿件。
权利与权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。
本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。
欲查看此许可证的副本,请访问https://creativecommons.org/licenses/by/4.0/.
创作共用公共领域奉献放弃书(https://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
Rodríguez-Sanz, H., Manzanera, JA。, Solís, MT。et al。早期标记存在于栎树小孢子和未成熟合子胚胎的胚胎发生途径中,Quercus木栓l植物生物学14,224(2014)。https://doi.org/10.1186/s12870-014-0224-4
收到了:
接受:
发表:
关键字
- 体细胞胚胎发生
- 小孢子胚胎发生
- 花药培养
- DNA甲基化
- 5-methyl-deoxy-cytidine
- 果胶酯化
- 细胞壁
- 生长素
- 国际宇航科学院