摘要
背景
油菜素内酯类激素调节植物生长发育的许多方面。膜受体BRI1是油菜素内酯信号级联的核心角色。半矮秆' uzu '大麦在BRI1激酶尾部的保守区域携带突变,该突变等位基因被认为对产量和抗倒伏都有积极的贡献。
结果
在这里,我们表明Uzu Barley表现出增强的抗抵抗一系列病原体。由于预先形成,诱导和组成型防御反应的组合,通过转录组和生物化学研究的组合来确定。基因表达研究用于确定UZU衍生物在下游芸苔类固醇信号传导中衰减。减少Bri1.通过病毒诱导的基因沉默的RNA水平受损uzu疾病抗性。
结论
uzu衍生物的病原体抗性可能是由于BrioT的抗脂肪效应或其压抑的BR信号传导的级联效应。
背景
油菜素内酯(Brassinosteroids, BRs)是一类激素,参与许多细胞过程,包括细胞扩张和分裂、组织分化、开花、衰老和对非生物胁迫的反应[1]、[2].BR激素依次结合到富亮氨酸重复受体BR钝感1 (BRI1)和共受体BRI1相关激酶1 (BAK1)的胞外结构域[3.].BRI1和BAK1之间的转磷酸化激活前者,进而导致下游BR信号级联[4].Nakashita等人[5是第一个证明BR激素在烟草和水稻抗病中起作用的。油菜素内酯(Brassinolide, BL)是油菜素内酯生物合成途径的最终产物,在水稻上的应用增强了水稻对稻瘟病和白叶枯病的抗性稻瘟病菌和黄oryzae,分别。在烟草中,BL诱导对烟草花叶病毒的抗性两pv。烟和真菌粉孢子水杨酸(SA)的积累与抗性无关,系统获得性抗性(SAR)也不相关。王(6综述了br调节植物对病原菌的反应。在烟草中,病毒诱导的两个同源基因BAK1 (NbSERK3A/B)沉默增强了对马铃薯枯萎病的敏感性5种但对它的姐妹物种却不是这样疫霉君子兰[7].但Bak1 / Serk3是多官能蛋白,至少其免疫功能至少与BR信号相比[8].它与细菌鞭毛蛋白肽的受体结合,FLS2,引起PTI。如王[6[BRI1的BR活化似乎对BAK1介导的FLS2信号传导有两个相反的影响,结果似乎取决于BR,BRI1和BAK1的相对水平。BR信号传导抑制Bin2介导的BRI1-EMS-抑制剂1(BES1)的降解;然后生产并粘合到关键防御调节器,ATMYB30和它们在一起合作地致力于促进BR靶基因表达[9].BRs也可能抑制防御基因的表达。br激活的转录因子brassinazole-resistant 1 (BZR1)能够抑制基因的表达,如FLS2和SNC1直接参与防御病原体[8]、[10].但是,在植物抗病反应中BR信号级联是如何馈入的还有待确定。
Uzu大麦系在BR受体蛋白BRI1的激酶结构域的高度保守残基(His-857至Arg-857)中携带突变[11].最近Goddard等人[12和Chen等人[13结果表明,乌苏突变体渗入大麦,增强了对稻瘟病的抗性稻瘟病菌,全取根造成Gaeumannomyces茎var。tritici,由茎干引起的眼斑病Oculimacula仕达屋优先计划.和冠腐病引起的茎镰刀菌素真菌。在这里,我们调查了uzu大麦衍生物对更多疾病的抗性,并使用转录组学和生化研究的结合来确定这些uzu衍生物在防御和BR信号传递方面与它们的亲本大麦基因型的差异。
结果与讨论
Uzu增强了对真菌和病毒病原体的抵抗力
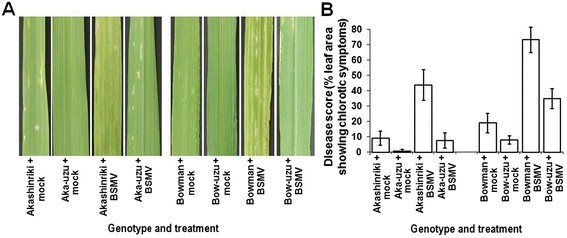
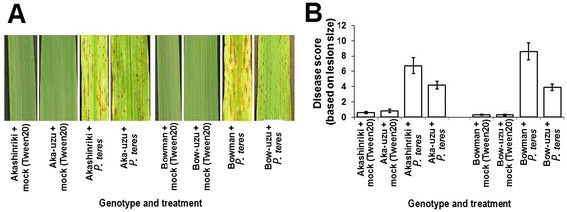
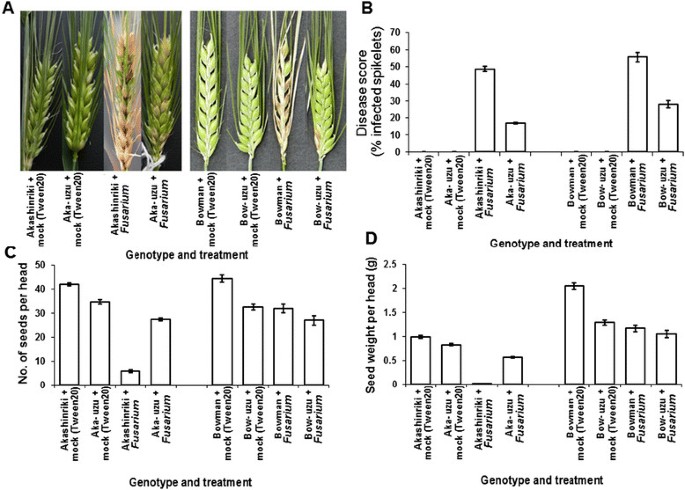
大麦的半矮秆的uzu衍生物。Akashinriki和Bowman是由一种突变体的基因渗入衍生而来的半矮化基因Bri1.来自日本老基因型Baitori 11的基因,并随后与亲本基因型回交[11].用致病性试验比较了两种半矮秆乌苏衍生物及其亲本对坏死营养网斑病病原大麦条纹花叶病毒(BSMV)的响应Pyrenophora圆柱状的和产毒半生物营养真菌镰刀菌素culmorum导致镰刀菌头枯萎病(FHB,也被称为谷物疮痂病)。与亲本相比,乌祖衍生物对所有三种病原体都具有更强的抗性。与他们的父母相比,uzu衍生物表现出明显较少的BSMV、净斑和FHB疾病症状(P≤0.01;数据1,2和3.).与其各自的母线相比,由于BSMV和Bowman的uzu衍生物,叶片面积的百分之叶含量为80%至52%,而鲍曼衍生物(图)1).赤信riki-uzu衍生物和Bowman-uzu衍生物的净斑症状严重程度分别比各自的亲本低37%和54%(图)2).赤星riki-uzu衍生物的FHB病发(小穗过早漂白百分率)比亲本少65%。在Bowman-uzu衍生的情况下,受感染的小穗比亲本少49%(图3.B).与亲本相比,FHB病使uzu衍生物的粒数和重量降低得更低(图)3.C和D)。镰刀菌素真菌也会侵害幼苗和叶子。幼苗枯萎病研究表明,在响应f . culmorum两种基因型的uzu衍生株系的茎褐变和叶坏死至少比亲本少41%和61%1:图S1及图S2) (P≤0.01)。因此,uzu衍生物在控制条件下携带广谱抗病能力,重申和扩展了Goddard等人的发现[12].这项研究表明,uzu衍生物的抗病性与环境有关,因为在最近的英国田间试验中,相同的uzu系对FHB的初始感染没有表现出抗性,尽管疾病压力相对较低[12].戈达德等[12]最近提出的证据表明,cvs的uzu衍生品。Akashinriki和Bowman对生物营养期较短或死亡营养生活方式的病原体的抗性增强,但对生物营养物质没有增强Blumeria Graminis.或者叶病原体Ramularia collo-cygni,它有一个很长的无症状期。
青稞栽培品种赤铃和Bowman赤铃衍生品对网斑病的响应Pyrenophora圆柱状的f . sp。圆柱状的.(一)接种病原菌后10天,幼苗叶片上的病状可视化。(B)基于病变大小的疾病评分[39在病原后10天的第二个和第三叶中,在病原后接种。条形图表示平均标准误差(SEM) (LSD0.05B = 2.54)。
电阻成分是构成的、诱导的和解抑制的
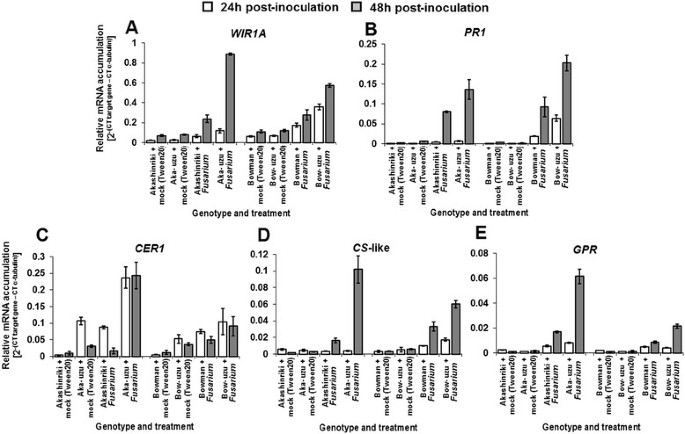
微阵列分析早期镰刀菌素-大麦幼苗间的相互作用(病原菌处理茎秆24小时后)表明,与亲本相比,赤星riki-uzu衍生物中可能的防御基因表达存在差异。比较1显示155个转录本的差异≥1.5倍f . culmorum -处理的赤shinriki-uzu的衍生物比较f . culmorum -处理的父行(附加文件2:表S1 - excel文件)。第二个微阵列比较描述了126个在uzu衍生物中具有病原体响应性的转录本(Akashinriki-uzu衍生物+/-的比较)f . culmorum)(额外的文件3.:表S2 - excel文件)。通过两种微阵列的比较,共有44个转录本在真菌处理的uzu中比真菌处理的亲本表达更高,并且在uzu衍生物中也对病原体具有响应性(见表)1).其中许多编码公认的经典微生物诱导防御和PR蛋白(见表)1).这包括公认的几丁质酶、1,3- β- d -葡萄糖苷酶和β-1,3-葡聚糖酶,所有这些都协同作用降解真菌细胞壁[14].与母线相比,三种推定的硫胺蛋白样蛋白在真菌处理的uzu中是真菌诱导和上调的(表1).一种水稻thaumatin样蛋白的表达被证明可以增强小麦对FHB的抗性[15].吲哚甘油磷酸和色氨酸合成酶A的转录表明uzu的生长素产量高于亲本和对病原菌的响应。色氨酸合成酶B能将更高的吲哚转化为色氨酸,尽管该基因对病原体没有响应,但在uzu中与亲本相比上调。生长素和油菜素内酯有多水平相互作用的报道;Sakamoto等人基于他们的研究[16提示生长素可能通过调控油菜素内酯受体基因的表达来控制油菜素内酯的感知程度。生长素已被证明能增强大麦对赤霉病的抵抗力[17,尽管其背后的机制尚未阐明。定量RT-PCR验证了这两种假设WIR1A和经典的公关基因PR-1与亲本Akashinriki和Bowman相比,在uzu衍生物中有更高的表达(图4A & B). WIR1A尚未被功能性地描述,但它被认为在基础和非宿主抗性中发挥作用[18].Wir1a赋予耐粉状霉菌真菌的小麦植物Blumeria Graminis.[19]两种变体被赋予FHB抗性的小麦基因组基因座的间隔[18].
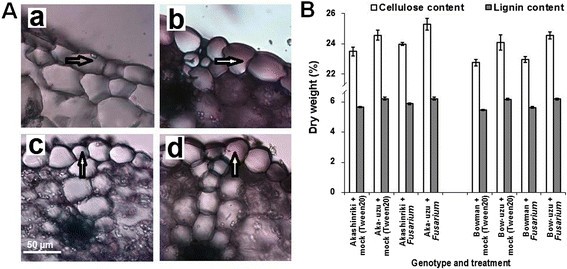
通过两种微阵列的比较,与真菌处理的亲本相比,真菌处理的uzu中总共有6个转录子被抑制,同时也有病原菌下调(见表)1).其中一个编码了推定的木葡聚糖内转糖基酶(XET;Contig21684),它催化细胞壁的重塑[20.].植物细胞壁是抵御病原体攻击的物理屏障,而纤维素和木质素是有助于防御的细胞壁成分之一[21]、[22].在病原菌感染48 h后的初步非复制微阵列分析表明,不同的基因参与蜡的产生(CRE1)和细胞壁组分(纤维素合酶和富含甘氨酸的细胞壁结构蛋白)是由病原体诱导的。Akashinriki(数据未显示)。采用转录组学、生化和显微分析等方法研究了乌祖衍生物及其亲本的细胞大小和细胞壁组成。对乌苏菌衍生物及其亲本的RT-PCR分析表明CRE1与亲本Bowman和Akashinriki相比,纤维素合酶和富含甘氨酸的细胞壁结构蛋白在uzu衍生物中得到了高表达,并且对病原体更敏感(图)4一部)。生化分析未受感染的乌祖并未发现病原体引起的纤维素和木质素绝对数量的增加(P≥0.05;数字5),但证实uzu衍生物的纤维素和木质素含量明显高于亲本(P≤0.05)。
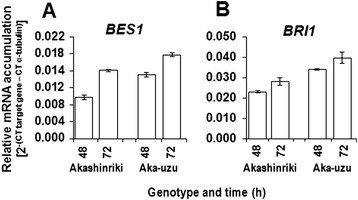
通过分析获得Uzu衍生物中增强细胞壁沉积的进一步证据BES1转录。BES1可与大多数纤维素合酶基因的上游元件结合,正向调节细胞壁合成[23].基因表达研究证实,赤星riki-uzu衍生物的幼苗叶片含有明显更多的基因BES1转录比亲本Akashinriki(图6A).上调BES1转录(图6A),四种几丁质酶上调,其中两种是病原体应答的(表1)和过程中活性氧生成的增强f . culmorum赤shinriki-uzu衍生物对亲本的感染(附加文件1:图S2B)均表明sa介导的防御反应增强[24]、[25].f . culmorum是一种半生物营养病原体,在坏死营养发生前有短暂的生物营养阶段[17].与此一致的是,在此过程中,宿主SA依赖的防御途径比茉莉酸(JA)依赖的防御途径更早被激活镰刀菌素感染(26].
最近的研究表明,BR可能通过激活其转录调节因子BZR1来拮抗植物防御信号。当被BR激活时,BZR1结合并抑制各种防御相关基因的启动子,包括鞭毛蛋白受体FLS2和主要R基因SNC1[10].有趣的是,我们发现BZR1.在48 h后,akashinriki - uzui -derivative对大麦的同源性有轻微抑制作用镰刀菌素感染与在健康父母幼苗中相似的水平(图7).这表明,uzu衍生物的防御能力可能会轻微减弱。
BR信令在Uzu被压抑
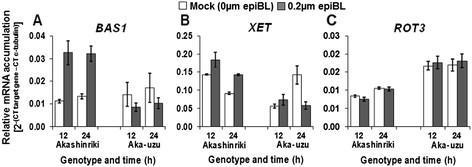
文献表明,大麦的uzu衍生物对BR反应较弱[11].我们研究了表油菜素内酯(epiBL)处理对参与BR信号转导的基因转录的影响。在mRNA水平上,BR降解酶基因BAS1和下游细胞壁酶基因XET1都被BR正调控[27]、[28,而BR生物合成基因ROT3是由于激素的使用而降低的[27].这就是epiBL处理对转录的影响BAS1和XET1在父母的简历里。Akashinriki,而ROT3显示epiBL治疗无效果(图8).epiBL应用诱导BAS1在cv处理12 h后表达增加3倍。Akashinrki (P≤0.05)。但是在uzu衍生物中,epiBL治疗没有主要效果(P≥0.05),趋势是下调表达的趋势BAS1对激素的反应(图8一种)。获得了类似的结果XET1(图8B),基因表达在野生型幼苗中显著上调,而在uzu中显著下调(P≤0.05)。我们验证了(epiBL)诱导的BR信号在Akashinriki-uzu衍生物中被抑制,从而增强Bri1.uzu的转录并不会导致BR信号的增强。在野生型Akashinriki和uzu衍生物中,没有证据表明BR生物合成的下调或上调,ROT3转录对epiBL应用无反应(图8C)。这表明uzu衍生物的增强阻力不是由于BR对抗防御响应或驾驶增强的负串扰与SA途径[29].
转录水平的Bri1.通过定量RT-PCR分析,确定表油菜素内酯(epiBL)下游基因和油菜素内酯代谢基因处理大麦品种赤星丽、Bowman及其uzu衍生物(Aka-uzu和bowu -uzu)的幼苗。用含5 μm brassinazole的Hoaglands溶液处理萌发苗4 d后,再用加或减0.2 μm epiBL的Hoaglands溶液处理。在处理后12或24小时采集的样本中进行基因表达量化。基因为代表(一)PHYB激活标记抑制因子1蛋白,BAS1(Contig3160),(B)XET(contig5258)和(C)ROT3(contig12042)。条形图表示SEM (LSD0.05A = 0.0021, b = 0.016, c = 0.0021)。
病毒诱导的uzu BRIcomprises抗病的基因沉默
病原体相关分子模式触发免疫(PTI)是最广谱耐药/耐受性的一部分,BRs通过bak1依赖和独立的机制调节PTI反应[6]、[8].植物抗病能力取决于BR、受体蛋白BRI1和BAK1的相对水平。当BRI1水平较低且BAK1水平不限速时,增加BR信号会通过提供活跃的BAK1来增强PTI信号[6].然而,在uzu衍生物中,基因表达研究证实了这一点Bri1.与亲本Akashinriki相比,转录水平较高(图6B).进行病毒诱导基因沉默(VIGS),以研究基因沉默的作用Bri1.在抗病性。为了帮助排除VIGS中的脱靶效应,进行了两种独立的沉默治疗,每一种都针对独立的片段Bri1.基因(307和277 bp)。空BSMV载体作为阴性对照。植烯去饱和酶的VIGS [30.]在VIGS实验中作为阳性对照,导致赤shinriki和uzu衍生植物过早漂白(附加文件)1:图S3)。VIGS缓冲剂FES的施用降低了叶片的抗性f . culmorum。在没有FES应用的情况下观察到的uzu/亲本型差异(附加文件)1(图S2)9C)在这两种情况下镰刀菌素唯一的区别是,在VIGS实验中,应用于第一个叶片的FES很可能在VIGS实验中诱导了系统性的伤害反应。这是可能的,正如Goddard等人提出的[12在VIGS治疗中出现的创伤可能会掩盖治疗的效果Bri1.相关防御反应,并可能触发JA信号[31].
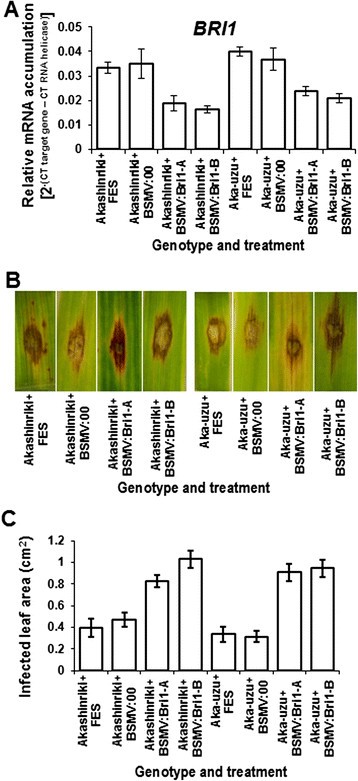
病毒诱导的基因沉默效应(VIGS)Bri1.在大麦品种赤星立及其乌祖衍生物上镰刀菌素在离体叶片试验中评估幼苗叶片的感染。用FES缓冲液、FES +空病毒(BSMV:00)或FES +病毒靶向处理植株Bri1.沉默(BSMV:BRI1&BSMV:BRI2 - 包含独立碎片的两个构造Bri1.基因)。在54天后,Pargs治疗后,3理查德·道金斯分离叶片提取RNA,用于基因表达研究和离体叶片测定。(一)Bri1.表达式是量化。(B)3天后f . culmorum与uzu的空病毒处理的空毒处理相比,接种,感染的区域对基因沉默更加明显(C)这是使用Image J软件基于像素计数进行量化的[41)(2000像素= 0.1厘米2).条形图表示SEM (LSD0.05A = 0.009, c = 0.254)。
定量RT-PCR基因表达研究证实Bri1.在赤心riki-uzu衍生品和其母产品上都取得了成功(图9A).评估vigs介导沉默后真菌接种对3理查德·道金斯vigs处理的幼苗叶片。减少Bri1.通过Vigs增强f . culmorum -诱导的uzu衍生和亲本型植株叶片坏死(图9故选BBri1.基因沉默(BSMV:00处理)后,接种叶片的病叶面积相对于基因沉默(P< 0.01)(图9C).这些结果表明,具有功能的BRI1对抗病很重要。戈达德等[12]也报道了T-DNA插入的5 '非翻译区Bri1.同源物Brachypodium distachyon结果与在大麦的uzu衍生物中观察到的抗病反应相似。要进一步了解BRI1在uzu抗病中的重要性,需要对大麦衍生物和T-DNA突变体的受体蛋白活性进行更深入的研究Brachypodium.
结论
Uzu衍生物的激酶结构域发生突变Bri1.(这是该蛋白质保守结构域的唯一突变)。Xu等[28表明拟南芥中BRI1激酶活性受损的弱突变体在植物生长发育过程中仍保留部分功能,说明BRI1激酶活性并不是该受体所有活性的关键。Uzu抗性可能是由于BRI1对另一个尚不明确的途径的多效作用,或BR信号下调的间接影响或遗传连锁Bri1.和共分离抗性基因。
虽然大多数日本和中国半矮人大麦品种携带uzu突变,但乌祖大麦的压力 - 不耐受[32]意味着它可能不适合所有气候条件。更好地理解下游防御机制可能突出其他有助于控制疾病的其他目标以较少的环境依赖的方式。为此,我们正在研究uzu中uzu上调许多基因的抗病潜力。f . culmorum。
方法
植物和微生物材料
大麦栽培品种(cvs.)Akashinriki和Bowman以及他们的uzu衍生物由日本冈山大学大麦种质中心的K. Sato博士和约翰英尼斯中心提供。uzu衍生物包含uzu突变版本的Bri1.基因(GSHO1963),该基因来源于日本一种古老的铃鹿大麦Baitori 11。的uzu通过6次回交和9次回交将基因导入到大麦品种Bowman和Akashinriki中[11].的f . culmorum本研究中使用的分离物是菌株FCF 200.真菌在-70℃下储存,在使用之前将其转移到马铃薯葡萄糖琼脂(PDA)(Difco,UK)板上并在25℃下孵育5天。如前所述,在绿豆肉汤中产生了真菌分枝膜状[33].Pyrenophora圆柱状的f . sp。圆柱状的将菌株N45储存在-70℃,并且在使用之前,将在马铃薯葡萄糖琼脂(PDA)(Difco,UK)板上转移并在25℃下孵育15天。将含有真菌培养物的平板刮擦并用0.2%Tween20溶液淹没,并通过双层奶酪通过了所得的结合悬浮液以获得分析造物。大麦条纹马赛克病毒(BSMV)的三方基因组维持在质粒和RNA中在体外翻译被用作接种物,如Holzberg等人先前所描述的[34].
赤霉病(FHB)试验
所有的枯萎病试验都是在温度为16 - 28°C的温室室中进行的。大麦cvs。Bowman和Akashinriki及其uzu衍生物生长,在花期中期,用Tween20(模拟处理)或f . culmorum分生孢子(1 × 106孢子毫升−10.2% Tween20),如前所述[35].在GS 80(面团发育开始)时记录视觉疾病症状[36],以每穗的漂白小穗百分比为基础。处理后的头在生长阶段收获。记录了单株种子数和单株种子重(g)。每个处理组合共16株(每株2头),随机布置在不同的玻璃室内进行3次试验(2010年2月- 4月、2012年2月- 4月和2012年3月- 5月)。
镰刀菌苗期枯萎病(FSB)试验
大麦的种子。Bowman和Akashinriki以及他们的uzu衍生物在一个6厘米直径的盆栽中发芽生长,盆栽中有John Innes 2号堆肥(Westland Horticulture, Dun- gannon, UK)。在光照时间为12 h (700 μmol m .−2年代−1)及恒定湿度85%。10日龄幼苗的茎基部按前面所述处理[37]加入400 μl的af . culmorum分生孢子悬浮(1 × 106孢子毫升−10.2% Tween20)在1%琼脂(Difco Laboratories, Detroit, MI)或0.2% Tween20在1%琼脂(模拟处理)。真菌处理15天后采集茎基样品(4cm)。幼苗枯萎病茎基病症状评分为病变长度(cm)与病变颜色的乘积(病变颜色分级:0,无病;1、极轻微的棕色坏死;2、轻度/中度棕色坏死;3、广泛的棕色坏死;广泛黑色坏死)[38].这个实验进行了三次,每次每个处理组合包括三个重复花盆(每个包含两株植物),以随机布局。分析基因表达对f . culmorum幼苗接种,在CV上进行类似的实验。Akashinriki及其Uzu衍生物,不同之处在于样品在液氮中闪蒸,并在RNA提取之前储存在-70℃。每次治疗组合进行三个具有六个重复罐(每种植物的含有两种植物的三个独立实验,对微阵列分析(24小时收获时间点)进行每次治疗组合的三个重复盆(每种含有两种植物)的两个独立实验进行定量Rt-PCR分析(24和48小时收获时间点)。
净污斑实验
大麦的种子。Bowman和Akashinriki及其uzu衍生物的萌发和生长是为了FSB研究。用4 × 10的分生孢子悬浮液喷洒15日龄大麦叶片4孢子毫升−10.2%的Tween20p .圆柱状的f . sp。圆柱状的菌株N45或0.2% Tween20(模拟处理)。疾病评分是根据使用1-10评分法对第2和第3叶片的平均感染表型计算的[39].结果基于3个试验,每个处理组合10个重复花盆(每个2株)。
大麦条纹花叶病毒试验
大麦的种子。Bowman和Akashinriki及其uzu衍生物的萌发和生长均按上述方法进行FSB研究,但试验是在温度恒定24°C、补充光照700 μmol m的温室中进行的−2年代−1每天16小时。按照Scofield等人描述的方法,将10日龄幼苗的第一片叶子用BSMV RNA或FES缓冲液(模拟处理)摩擦接种[30.].在接种后14天评估第三叶的疾病,基于显示氯化的百分比叶区域。结果基于两个实验,所有这些实验包括每次治疗组合的10个复制盆(每个包含2株植物)。
分离叶片试验
大麦幼苗生长旺盛。Bowman和Akashinriki及其uzu衍生物的萌发和生长是为了FSB研究。第三片叶子是从20天大的幼苗上收获的。将叶片切片(5 cm)置于用0.08%苯并咪唑溶液浸泡过的滤纸上,用无菌针打4-5个小孔表面伤透叶中央上表皮层。用0.2% Tween20(模拟处理)或5 μl处理受损叶面积f . culmorum分生孢子(1 × 106孢子毫升−1Tween20 0.2%)。接种72 h后,对叶片样品拍照,并进行3,3 ' -二氨基联苯胺(DAB)染色,检测ROS的形成[40].叶片样品置于1mg ml溶液中−1并于8 h后采集拍照。利用Image J软件根据像素计数测量染病叶面积[41在0-250的范围内,以0-100的总像素计数为基础,将其转换为叶面积(2000像素= 0.1 cm),测定活性氧的形成2).
幼苗组成和表皮细胞形态
大麦幼苗生长旺盛。Bowman和Akashinriki及其uzu衍生物的萌发和生长是为了FSB研究。用Tween20在1%琼脂中处理10日龄幼苗的茎基部f . culmorum分生孢子(1 × 106孢子毫升−10.2%吐温和1%琼脂。20天后,在茎基部以上扦插幼苗。叶片切片用无水酒精在60°C下处理过夜以去除叶绿素,并制备横切面用于显微研究。剩余的绿色植物材料在55°C烘干7-10天,并使用Ali等人的方法测定纤维素和木质素。[42].纤维素和木质素的含量测定每个品种的三个子样品,并表示为干重百分比。结果基于3个试验,每个处理组合10个重复花盆(每个2株)。
表油菜素内酯(epiBL)处理实验
大麦种子表面用2%的漂白剂消毒,放在Whatman纸上,在4°C的黑暗中保存2天,以同步种子生长。两天后,培养皿在黑暗中转移到25°C。将3日龄萌发苗移栽到含5 μm Brassinazole (BRZ)的Hoagland溶液的水培体系中,抑制内源BR的产生。将植株置于700 μmol m连续光照的培养箱中−2年代−1在25°C时。在四天之后,BRZ溶液被含有0.2μm的Hoagland的培养基取代(在70%乙醇中)和70%乙醇(模拟处理)。在RNA提取之前,在12和24小时的处理后在12和24小时的液氮中闪蒸在液氮中闪蒸中的液体中收集样品。
RNA提取
使用Chanc等人描述的方案从茎碱样品中提取总RNA。[43].RNA提取物按照制造商的说明(Invitrogen公司,Carlsbad, CA)进行dnase2处理,并重新悬浮在二乙基焦碳酸酯(DEPC)处理过的水中。根据制造商说明,使用Eppendorf生物光度计(Eppendorf AG, Hamburg, Germany)评估样本中的RNA数量。通过估算RNA完整性数(RIN)来评估样本的RNA质量[44]、[45],平均> 8,表明RNA质量高。
微阵列分析
微阵列分析用于分析早期效果f . culmorum在真菌接种24 h后,Akashinriki及其uzu衍生物的幼苗转录组的变化。微阵列的生产、杂交和数据分析是按照微阵列实验(MIAME)国际标准化和微阵列实验质量控制指南的最低信息进行的[46].每个处理使用三个复合样品进行微阵列分析;每次处理、每次实验、每次时间点,从5个重复的样品中汇集等量的总RNA (1 μg),制备复合样品。每个样品的总RNA (1 μg)用Bioarray™单轮RNA扩增和标记试剂盒(Enzo life sciences, PA, USA)转化为双链cDNA。第二链合成后,用cDNA纯化试剂盒(Enzo life sciences)纯化cDNA。然后用产生的双链DNA生成多个生物素化的cRNA副本在体外Bioarray™高产量™RNA转录标记试剂盒(Enzo life sciences)。的一个260/280使用安捷伦生物分析仪(Agilent Technologies, Palo Alto, CA, USA)测定每个crna的比例和产量,并评估这些样品的质量)并且都超过了RNA完整性数阈值8。生物素化cRNA (10 μg)biob bioc,生气和cre(杂交对照)与Affymetrix大麦基因芯片(Affymetrix, Inc.)杂交。(CA, USA)在45°C下保存16小时。杂交后,所有阵列在Affymetrix基因芯片流体站中清洗和染色。用Affymetrix genchip®scanner 3000 (Affymetrix, Inc.)扫描染色阵列。美国CA)。采用affymetrix基因芯片操作软件(gcos)和质量报告软件进行质量检查和数据分析。每个芯片和每个基因的阵列数据被归一化。每个芯片的标准化执行到中位数。对于每个基因的标准化,对三个生物重复获得的三个表达值进行比较。进行了两次比较; firstly we compared gene expression in the uzu derivative + fungus, versus Akashinriki + fungus; secondly we compared expression in uzu – fungus versus uzu + fungus. A list of significant probes were generated using a student t-test with a fold-change threshold of ≥ 1.5 and ≤ -1.5 higher transcript with ap值<0.0001.
序列分析
对于每个探针组,相关基因/基因同源物的注释直接从Affymetrix网站(https://www.affymetrix.com/analysis/netaffx/showresults.affx)或通过针对非冗余蛋白质数据库的Blastx分析[47利用国家生物技术信息中心(NCBI)的爆炸资源(http://www.ncbi.nlm.nih.gov).临界值为10−15作为期望分数(e值)的阈值,只有e值小于阈值的同源性被认为是显著的。只要两个描述不一致,就选择BLASTx描述。
定量rt - pcr分析
采用定量RT-PCR分析感兴趣的转录本的表达。按照Ansari等人的描述,对1 μg总RNA进行逆转录(RT) [48],除了所使用的引物是寡糖dT12 - 18(表达载体)。RT产物(25 μl)稀释至200 μl, pcr扩增2.5 μl, 25 μl体积反应,12.5 μl预混料Taq交货™(Perfect Real Time) (Takara,日本)和100 nM的正向和逆转录特异性引物(附加文件4:表S3)。PCR反应在Stratagene MX3000 TM定量Rt中进行-PCR机(Stratagene,USA)和该程序由1个95℃的1个循环组成,10s,40个循环为95℃,5s,60℃,30°C的1°C,60°C为60℃。使用Stratagene MX3000™软件(Stratagene,USA)进行分析数据。用于定量RT-PCR数据的正常化的内政基因是α-小管蛋白(Affymetrix Contig127_S_AT);在单独的反应中进行靶基因和家务基因的实时定量。通过定量RT-PCR获得的阈值循环(CT)值用于计算靶基因(相对mRNA积累),相对于α-微管蛋白转录物的积累^ -ΔΔCt方法,其中ΔΔCt = (Ct靶基因- Ct α-微管蛋白)[49].结果基于每个样本至少两次重复的定量RT-PCR反应的平均值。
病毒诱导的基因沉默(Vigs)
本研究使用的大麦条纹花叶病毒(BSMV)衍生的VIGS载体由野生型BSMV ND18 α、β和γ三基因组组成[30.]、[34].利用VIGS片段和定量RT-PCR方法验证VIGS的靶向性HvBri1(AB109215.1)在大麦基因组的3HL染色体上,通过对IPK大麦基因组数据库进行BLAST分析(结果未显示)。用两个独立的基因片段进行VIGSHvBri1从大麦品种基因组DNA中扩增得到。Akashinriki使用引物HvBri1f / R或HvBri1B-F / R(附加文件4:表S4)。用30 ng大麦基因组DNA,正片段特异性引物和反片段特异性引物各1 mM进行PCR反应(附加文件)4在含有0.5U Taq DNA聚合酶和1× PCR缓冲液(Invitrogen公司,英国)、1.5 mM MgCl的10 μl反应中2,每个dNTP 125毫米。PCR反应在Peltier热循环DNA引擎(MJ Research, USA)中进行,PCR程序包括94°C初始变性2 min, 94°C变性30 s, 60°C退火30 s,将扩增的沉默片段克隆到pGEM-T载体(pGEM-T Easy cloning kit;英国Promega)。携带沉默片段的pGEM-T载体用Pac1和Sma1酶切。凝胶提取纯化插入物,克隆至Pac1和Sma1酶切γ RNA载体pSL038-1 [30.].含有沉默片段的pSL038-1质粒由韩国Macrogen公司使用载体特异性引物pGamma-F/R进行测序(附加文件)4:表S4)。含185bp片段的大麦植物烯去饱和酶γ RNA构建(PDS.)基因被用作VIGS的阳性对照,此前已有报道[30.].含有BSMV基因组α和γ的质粒构建了沉默片段PDS.和HvBri1一个或HvBri1B被线性化反光镜锁定质粒与BSMV β基因组线性化Spe一。盖住在体外使用mMessage mMachine T7从线性化的质粒中制备转录本在体外制造商协议后的转录套件(Ambion,Austin,TX)。在Scofield等人描述的协议之后,用BSMV构建体接种了10天幼苗的第一叶。[30.].用1:1:1的混合物进行摩擦接种在体外BSMV α, β和γ RNA (BSMV:00)的转录本或含有大麦的γ RNA的衍生物PDS.(BSMV: PDS),HvBri1一个或HvBri1B碎片。经过14天,3理查德·道金斯叶子被切成三段,一段用液体冷冻2并在-70°C保存,然后提取RNA。利用特异性引物对基因沉默进行定量分析Bri1.相对于RNA解旋酶管家基因[50].剩下的2节用作离体叶片镰刀菌素分析如上所述(每株共使用8片叶镰刀菌素每个沉默结构的模拟Tween20处理8个)。3天后观察并记录症状。VIGS实验进行了三次。
统计分析
采用Ryan Joiner检验确定数据集的正态分布[51]在Minitab (Minitab发布13.32©, 2000 Minitab Inc.)。利用Johnson变换将非正态分布数据集转换为拟合正态分布[51]在Minitab (Minitab发布13.32©, 2000 Minitab Inc.)。通过双尾相关分析(非正态数据:Spearman Rank;正常数据:皮尔森乘积矩)在社会科学统计软件包(SPSS 11.0, SPSS Inc.)内进行(r≥0.798;P =0.01) (52].因此,从重复实验中收集的数据集用于进一步的统计分析。治疗效果的重要性分析了在社会科学统计软件包(SPSS 11.0, SPSS Inc .)通过(i)正态分布数据——单向方差分析与事后对明智的最小意义差(LSD)比较(P = 0.05),或(2)non-normally-distributed数据-克鲁斯卡尔-沃利斯H测试(52].
可获得的支持数据
支持本文结果的数据集包含在本文及其补充文件中。
作者的贡献
提供知识和编辑评论:FMD, SSA, PN和SS。构思和设计实验:SSA和FMD。进行实验:SSA, LRG, GBSK, MK。数据分析:SSA, LRG。提供试剂/材料/分析工具:FMD。写手稿:SSA和FMD。所有作者阅读并批准了最终的手稿。
附加文件
参考文献
- 1.
油菜素内酯对植物对环境胁迫反应的影响。植物生理与生物化学。2009,47:1-8。10.1016 / j.plaphy.2008.10.002。
- 2.
杨春娟,张超,陆云宁,金建强,王小龙:油菜素内酯的作用机制:从信号转导到植物发育。植物学报。2011,4:588-600。10.1093 / mp / ssr020。
- 3.
王志强,王志强,王志强:体细胞胚胎发生辅助受体激酶激活植物类固醇受体的分子机制。中国科学:地球科学。10.1126 / science.1242468。
- 4.
闫莉,马啊,刘德,魏X,孙y,陈x,赵立,周j,王z,水,lou z:磷酸化影响对植物受体样激酶的影响的结构基础.细胞res。2012,22:1304-1308。10.1038 / Cr.2012.74。
- 5.
Nakashita H, Yasuda M, Nitta T, Asami T, Fujioka S, Arai Y, Sekimata K, Takatsuto S, Yamaguchi I, Yoshida S:油菜素内酯在烟草和水稻的广泛抗病中发挥作用。植物学报,2003,33:887-898。10.1046 / j.1365 - 313 x.2003.01675.x。
- 6.
王志勇:油菜素内酯在多个水平上调节植物免疫。中国科学(d辑:地球科学),2012,32(6):514 - 514。10.1073 / pnas.1118600109。
- 7.
Chaparro-Garcia A, Wilkinson RC, Gimenez-Ibanez S, Findlay K, Coffey MD, Zipfel C, Rathjen JP, Kamoun S, Schornack S:受体样激酶SERK3/BAK1是对晚疫病病原体的基础抗性所必需的5种在烟草benthamiana.PLoS ONE。2011年,6:e16608 - 10.1371 / journal.pone.0016608。
- 8.
Albrecht C, Boutrot F, Segonzac C, Schwessinger B, Gimenez-Ibanez S, Chinchilla D, Rathjen JP, De Vries SC, Zipfel C:油菜素内酯抑制独立于受体激酶BAK1的病原体相关分子模式触发的免疫信号。中国科学(d辑:地球科学),2012,32(6):733 - 741。10.1073 / pnas.1109921108。
- 9.
Li L, Yu X, Thompson A, Guo M, Yoshida S, Asami T, Chory J, Yin Y:拟南芥MYB30是拟南芥BES1的直接靶标,并与BES1协同调控油菜素内酯诱导的基因表达。植物学报,2009,58:275-286。10.1111 / j.1365 - 313 x.2008.03778.x。
- 10.
孙颖,樊晓燕,曹冬梅,唐伟,何凯,朱建勇,何建新,白明云,朱胜,Oh E:油菜素内酯信号转导与转录网络的整合对植物生长调控的作用拟南芥.开发细胞2010,19:765-777。10.1016 / j.devcel.2010.10.010。
- 11.
Chono M, Honda I, Zeniya H, Yoneyama K, Saisho D, Takeda K, Takatsuto S, Hoshino T, Watanabe Y:一种半矮型大麦uzu是由编码油菜素内酯受体基因的核苷酸替换导致的。植物生理学报。2003,33(4):591 - 598。10.1104 / pp.103.026195。
- 12.
dr . Goddard, Peraldi A, Ridout C, Nicholson P:增强抗病能力Bri1.突变为1保守之间Brachypodium distachyon和大麦(大麦芽).植物微生物相互作用2014年
- 13.
陈刚,严伟,刘艳,魏勇,周敏,郑玉玲,刘超:非赤霉素响应型半矮化基因uzu对大麦抗冠腐病的影响。植物保护学报。2014,33(4):514 - 514。
- 14.
关键词:抗真菌水解酶;几丁质酶和β- 1,3 -葡聚糖酶联合抑制真菌生长。植物生理学报。1988,88:936-942。10.1104 / pp.88.3.936。
- 15.
Chen W, Chen P, Liu D, Kynast R, Friebe B, Velazhahan R, Muthukrishnan S, Gill B:在转基因小麦植株中表达水稻thaumatin-like蛋白基因可以延缓小麦赤霉病的发生。Theor Appl Genet. 1999, 99: 755-760。10.1007 / s001220051294。
- 16.
Sakamoto T, Morinaka Y, Inukai Y, Kitano H, Fujioka S:生长素信号转录因子调节水稻油菜素内酯受体基因的表达。植物营养学报,2013,33(6):676-688。10.1111 / tpj.12071。
- 17.
Petti C, Reiber K, Ali SS, Berney M, Doohan FM:生长素在大麦赤霉病生防中的作用及其作为病害防治剂的潜力。植物生态学报。2012,29(6):593 - 598。
- 18.
WIR1-like基因在欧洲冬小麦小花组织中的表达分析g菌.Euphytica。2012,186:103-114。10.1007 / s10681-011-0498-7。
- 19.
alpeter F, Varshney A, Abderhalden O, Douchkov D, Sautter C, Kumlehn J, Dudler R, Schweizer P:在一个新的启动子转录控制下,小麦表皮中一个防御相关基因的稳定表达可以获得抗性。植物营养与肥料学报。2005,27(6):591 - 598。10.1007 / s11103 - 004 - 7564 - 7。
- 20.
Fincher GB:我们对草类细胞壁生物合成和重塑认识的革命性时代。植物营养与肥料学报。2009,29(4):457 - 461。10.1104 / pp.108.130096。
- 21.
王志强,魏永强,王志强:木质素化在植物防御中的作用。植物学报。2009,4:158-159。10.4161 / psb.4.2.7688。
- 22.
Hernández-Blanco C,冯dx,胡静,Sánchez-Vallet A, Deslandes L, Llorente F, Berrocal-Lobo M, Keller H, Barlet X, Sánchez-Rodríguez C, Anderson LK, Somerville S, Marco Y, Molina A:纤维素合成酶的损伤拟南芥次级细胞壁的形成增强抗病能力。植物学报。2007,19:890-903。10.1105 / tpc.106.048058。
- 23.
谢磊,杨超,王欣:油菜素内酯通过调控CESA基因的表达来调控纤维素的生物合成拟南芥.中国生物医学工程学报。2011,32(4):489 - 494。10.1093 / jxb / err164。
- 24.
Harfouche AL, Rugini E, Mencarelli F, Botondi R, Muleo R:水杨酸诱导H2O2内几丁质酶基因的表达,而乙烯的生物合成板栗的体外培养模型系统。植物营养与肥料学报。2008,29(6):741 -744。10.1016 / j.jplph.2007.03.010。
- 25.
水杨酸诱导油菜中硫代葡萄糖苷的积累(英文)芸苔属植物显著L.)叶。J Exp Bot。1994年,45:1343-1346。10.1093 / JXB / 45.9.1343。
- 26.
丁玲,许慧,易辉,杨玲,孔志强,薛胜,贾辉,马志强:半生物营养的抗性f . graminearum感染与多种防御信号通路的协调有序表达有关。PLoS ONE。2011年,6:e19008 - 10.1371 / journal.pone.0019008。
- 27.
Tanaka K,Asami T,Yoshida S,Nakamura Y,Matsuo T,Okamoto S:Brassinosteroido Sopostasis拟南芥通过参与其代谢的多个基因的反馈表达来保证。植物营养与肥料学报。2005,32(4):417 - 421。10.1104 / pp.104.058040。
- 28.
徐伟,黄建军,李斌,李军,王玉英:激酶活性对BRI1的生物学功能是否重要?acta photonica sinica, 2008, 40(3): 472-478。10.1038 / cr.2008.36。
- 29.
De Vleesschauwer D,Van Buyten E,Satoh K,Bandion J,Mauleon R,Choi I-R,Vera-Cruz C,Kikuchi S,HöfteM:芸苔类药物拮抗吉布林素 - 和水稻水杨酸介导的根免疫。植物理性。2012,158:1833-1846。10.1104 / pp.112.193672。
- 30。
黄丽丽,黄丽丽,黄丽丽:小麦六倍体病毒诱导的基因沉默系统的建立及其在抗叶锈病途径功能分析中的应用。植物营养与肥料学报。2005,32(4):454 - 457。10.1104 / pp.105.061861。
- 31.
León J, Rojo E, Sánchez‐Serrano JJ:植物的伤口信号。中国生物医学工程学报,2001,22(1):1-9。10.1093 / jexbot / 52.354.1。
- 32.
Divi UK,Krishna P:Brassinosteroid:一种用于提高作物产量和应力耐受性的生物技术靶标。新的Biotechnol。2009,26:131-136。10.1016 / j.nbt.2009.07.006。
- 33.
王志强,王志强,王志强,等:温度对小麦枯萎病的影响镰刀菌素culmorum和f . graminearum.植物别墅。2005,54:156-160。10.1111 / J.1365-3059.2005.01157.x。
- 34.
大麦条纹花叶病毒诱导的单子叶植物基因沉默。植物学报,2002,30:315-327。10.1046 / j.1365 - 313 x.2002.01291.x。
- 35.
小麦和大麦枯萎病的菌媒控制及相关真菌毒素污染的研究。生物防治。2009,48:42-47。10.1016 / j.biocontrol.2008.08.015。
- 36.
Zadoks JC, Chang TT, Konzak CF:谷物生长阶段的十进制代码。植物学报,1994,14:415-421。10.1111 / j.1365-3180.1974.tb01084.x。
- 37.
王志强,王志强,王志强,等:小麦枯萎病的生物防治。植物病理学杂志。2006,32(4):489 - 494。10.1094 /发朵- 96 - 0386。
- 38.
尼科尔森,辛普森博士,Weston G, Rezanoor HN, Lees AK, Parry DW, Joyce D:检测和定量镰刀菌素culmorum和镰刀菌素graminearum在谷物中进行PCR检测。植物营养与肥料学报。1998,22(4):421 - 427。10.1006 / pmpp.1998.0170。
- 39.
Tekauz A:对大麦反应进行分类的数字尺度Pyrenophora圆柱状的.acta botanica sinica(云南植物学报),1985,7:181-183。10.1080 / 07060668509501499。
- 40.
张志强,魏亚平,张志强,等2O2在植物。H2O2大麦与白粉病互作过程中乳突的积累和超敏反应。植物学报1997,11:1187-1194。10.1046 / j.1365 - 313 x.1997.11061187.x。
- 41.
Abr moff MD, Magalhães PJ, Ram SJ:图像处理与ImageJ。生物光子学报,2004,11:36-42。
- 42.
Ali SS,Khan M,Mullins E,Doohan F:小麦基因型对秸秆乙醇生产的影响及多功能作物育种的影响。生物量生物能源。2012年,42:1-9。10.1016 / J.Biombioe.2012.03.020。
- 43.
张S,Pureyear J,Cairney J:一种简单有效的方法,用于从松树中分离RNA。植物MOL BIOL REP。1993,11:113-116。10.1007 / BF02670468。
- 44.
IMBeaud S,Graudens E,Boulanger V,Barlet X,Zaborski P,Eden E,Mueller O,Schroeder A,Auffray C:使用微量微量电泳痕迹的用户无关分类器来标准化RNA质量评估。核酸RES。2005,33:E56-E56。10.1093 / nar / gni054。
- 45.
Schroeder A, Mueller O, Stocker S, Salowsky R, Leiber M, Gassmann M, Lightfoot S, Menzel W, Granzow M, Ragg T: RIN:一个RNA完整性值,用于分配RNA测量的完整性值。中国生物医学工程学报。2006,27(4):514 - 514。
- 46.
Brazma A, Hingamp P, Quackenbush J, Sherlock G, Spellman P, Stoeckert C, Aach J, Ansorge W, Ball CA, Causton HC:关于微阵列实验(MIAME)的最小信息-微阵列数据标准。《自然》,2001,29:365-371。10.1038 / ng1201 - 365。
- 47.
Altschul SF,Gish W,Miller W,Myers EW,Lipman DJ:基本的本地对齐搜索工具。J Mol Biol。1990年,215:403-410。10.1016 / S0022-2836(05)80360-2。
- 48.
anari KI, Walter S, Brennan JM, Lemmens M, Kessans S, McGahern A, Egan D, Doohan FM:小麦反转录转座子和基因激活对真菌毒素和非真菌毒素相关镰刀菌胁迫的响应。应用电子学报。2007,14:927-937。10.1007 / s00122 - 006 - 0490 - 0。
- 49.
Livak KJ,Schmittgen Td:使用实时定量PCR和2-ΔCT方法分析相对基因表达数据。方法。2001,25:402-408。10.1006 / meth.2001.1262。
- 50。
沃尔特,布伦南JM, * *是C,安萨里KI,胡X,汗先生,Trognitz F, Trognitz B,伦纳德克,伊根D,杜汉调频:组件相关的基因网络与镰刀菌素genotype-dependent响应小麦真菌毒素deoxynivalenol。功能基因组学。2008,8:421-427。10.1007 / s10142 - 008 - 0089 - 4。
- 51。
Ryan T, Joiner BL:正态概率图和正态检验。一款统计软件统计软件。技术报告。宾夕法尼亚州立大学出版社,帕克大学,宾夕法尼亚;1983.
- 52。
(2)统计学方法。爱荷华州立大学出版社,艾姆斯;1980.
确认
这项工作得到了爱尔兰科学基金会研究基金(IN10/IN.1/B3028)和农业部研究刺激基金RSF 07 513的支持。我们感谢日本冈山大学大麦种质中心的K. Sato提供了Akashinriki及其uzu衍生物的种子。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
电子辅料
图S2。
附加文件1:图S1。:Response of uzu derivatives to Fusarium seedling blight disease. Leaf response of uzu derivatives to镰刀菌素culmorum。图S3。病毒诱导的八烯去饱和酶(PDS)基因沉默(VIGS)对大麦品种赤星立及其衍生株系叶片表型的影响多克斯(466 KB)
12870 _2014_227_moesm2_esm.xls
附加文件2:表S1。油菜素激素不敏感大麦株系uzu和野生型亲本Akashinriki对镰刀菌幼苗枯萎病的响应差异(≥1.5倍)转录本。(XLS 113 KB)
12870 _2014_227_moesm3_esm.xls
附加文件3:表S2。:Transcripts differentially regulated (≥1.5 fold) in the uzu derivative of cv. Akasinriki in response to Fusarium seedling blight. (XLS 46 KB)
12870 _2014_227_moesm4_esm.doc
附加文件4:表S3。:Primers used for real time quantitative RT-PCR analysis. Table S4. Primers used for VIGS. (DOC 44 KB)
作者为图像提交的原始文件
下面是作者提交的原始图片文件的链接。
权利和权限
本文由BioMed Central Ltd授权发表。这是一篇基于知识共享署名许可协议(http://creativecommons.org/licenses/by/4.0),允许在任何媒介上不受限制地使用、分发和复制,但须注明原作的出处。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
Ali, s.s., Gunupuru, l.r., Kumar, G.B.S.et al。用油菜素内酯受体BRI1修饰的uzu大麦株系增强了植物抗病能力。BMC植物杂志14日,227(2014)。https://doi.org/10.1186/s12870-014-0227-1
收到了:
接受:
发表:
关键字
- 抗病性
- Brassinosteroid
- Uzu
- Bri1.
- 镰刀菌素