抽象的
背景
内生菌是生活在玉米(玉米,Zea Mays.L.)没有引起疾病。通常假设大多数内体源自土壤。如果这是真的,那么随着人类从其本土墨西哥收集,驯化,繁殖和迁移玉米,他们将物种从其天然捐赠者的原生群体移动。玉米仍然存在于今天的迁移,因为育种者从墨西哥高遗传多样性的遗址收集野生和异乎寻常的种子(作为各种等位基因来源),用于在遥远的土壤中育种计划。当运送到新土地时,目前尚不清楚玉米是否只能从其共同进化的墨西哥土壤中选择聚类微生物,耐受土壤衍生的内心细胞的变化,或防止土壤类微生物的定殖者有利于种子传播的微生物。为了测试这些假设,在土着墨西哥土壤,加拿大温带土壤或灭菌沙子并排地种植了三种玉米(驯化墨西哥,古代墨西哥,古代墨西哥,古代墨西哥,现代气候)的非灭菌种子。使用16S-RDNA分析,培养和微生物性状表型测试这些土壤互动对创始体细菌内体群落的影响。
结果
多变量分析表明,当在不同的土壤上生长不同的宿主基因型时,从年轻,表面灭菌的玉米植物中的细菌16S-RDNA TRFLP型材比在同一土壤上生长不同的玉米基因型时,更相似。这结果似乎有两个原因。首先,将来自土壤种植植物的细菌16S-信号的最大分数与在灭菌砂中生长的亲本种子和/或植物共用,表明候选内心细胞的显着遗传。这体外土壤源内生菌的活性可以由从无菌沙生植物中分离出来的细菌提供。其次,生长在地理位置较远的土壤上的同胞植物的许多非遗传16s信号彼此共享,这表明玉米可以从不同土壤中选择TRFLP峰大小相似的微生物。野生、驯化前的玉米在墨西哥本土土壤上生长时并不比在加拿大土壤上生长时拥有更多独特的16s信号,这指向了长期的共同进化选择。现代杂交玉米对土壤中16s信号的排斥程度并不比祖先的玉米高,这表明这种排斥是一种有助于在不同环境下保持产量稳定的机制。一小部分16s信号与任何一种土壤都是唯一相关的。
结论
在TRFLP分析的范围内,预驯化、古代和现代玉米的候选内生菌种群部分地缓冲了地理迁移的影响——从与祖先玉米相关的墨西哥土壤,到与现代杂交农业相关的加拿大土壤。这些结果对理解驯化、迁移、前原因种子守恒与现代育种,对世界上最重要的食物作物之一的微生物组。
背景
微生物内生菌以非致病性的方式生活在寄主植物内部,可以为寄主提供许多有益的功能,包括帮助获得营养,产生刺激性植物激素和拮抗病原体[1],[2].Endophytes通过获得营养和保护与外部竞争和捕食的保护,从内部植物中受益[3.].如下所述,关于内生菌的直接来源,以及它们从周围环境(主要是土壤)中吸收或遗传(垂直传播)的程度,有相互矛盾的报道[4.].土壤微生物进入植物的关键阶段是发芽和早期发育,成为成体植物内生菌群的奠基者。
土壤被认为是植物伴生细菌的主要环境来源[5.] - [9.]因此并不令人惊讶的是,据报道,根部是最重殖民化的植物器官[10.].土壤衍生的微生物植物的教科书的例子包括血管丛枝菌根[11.]和结瘤固氮根瘤菌[12.].由于它们不是通过种子遗传的,根瘤菌必须每一代重新感染豆科植物的根[13.].因此,当豆科大豆被引入美洲,远离其亚洲本土土壤时[14.]由于新世界缺乏兼容的土壤无根瘤菌,其产量很低。为了解决这个问题,使用粗土场移植,并随后接种具有根瘤菌的纯土壤陶瓷菌株[15.] - [18.].它仍有待确定玉米等非豆科作物可以从位于他们古老的驯化地点的土壤微生物(作为内心合作伙伴)中受益。
与环境来源相反,有证据表明,在一些植物种类中,细菌内心细胞可以从一代到下一个通过种子继承[19.] - [29.].这种行为显然对Microbes显然是最有利的,这是第一个殖民殖民育苗,确保新的利基的有效殖民化。
了解幼龄植物内生菌主要是遗传的还是从当地土壤中选择的,对现代农业具有重要意义。今天,作物基因型在世界各地转移,并在新的土壤上种植,以促进育种或前原因种子堤坝的养护,种子周期性地在外国土壤上重新生长以维持活力。土壤被认为是地球上最具微生物的栖息地[30.];事实上,美洲内的地理上遥远的土壤仅在运营分类单位(OTU)水平上仅为4%相似性[31.].如果作物利用土壤作为内生菌的被动“市场”[8.[则它们相关的细菌群落显着从土壤中显着改变到具有未知影响的土壤中。
Zea Mays.SPP。梅斯(玉米/玉米)是世界上三个最重要的粮食作物之一。这是一种植物的含量,其中野生,异国情调和现代基因型在世界各地转移,以方便育种计划和前原因保护 [32.].玉米被认为是大约9000年前在墨西哥南部的瓦哈卡州由一种野生草类祖先驯化而来的,而现在最亲近的亲戚是野生大刍草,Zea Mays.SPP。Parviglumis.(parviglumis)[33.].今天仍然存在的Parviglumis唯一重要的自然群体是墨西哥的Balsas River河谷[34.].在驯化之后,哥伦比亚农民选择玉米实地,以适应当地环境和需求[35.].克里斯托弗·哥伦布注意到,到达美洲后,看到玉米地方品种在30公里长的大片土地上生长[36.].一个最古老的幸存体位,一个叫做mixteco的巨型植物(Zea Mays.ssp。梅斯,(var. Mixteco),仍由墨西哥农民种植在酸性、营养不良的土壤上,可能是野生大刍草和现代玉米之间“缺失的一环”[35.].与地理适应性的地方品种不同,现代玉米杂交品种是商业育种计划的结果,其目标是在不同的土壤类型和环境中获得稳定的产量[37.].这些繁殖中的大部分是由公司的,在高输入条件下(例如化肥)而不是当地农民,在私营部门进行的美国育种的94%的育种[38.].Pioneer 3751(Z. Mays.ssp。梅斯先锋杂交玉米(Pioneer hybrid 3751)是现代玉米杂交品种的一个例子,在包括加拿大、美国和欧洲在内的世界各地不同的温带土壤上种植。Pioneer 3751生长在美国威斯康星州(Wisconsin)的农业土壤上,已被证明在其根内包含至少74种不同的细菌系统类型[39.].
作为原产地,墨西哥拥有上述祖先,异国情调和现代玉米的最大遗传多样性[33.].这些种子被居住在墨西哥国际玉米和小麦改善中心(Cimmyt)的金库中。从这里,种子被运送到许多其他国家以促进育种,但这种种子运动对玉米内体群落组合物的影响并未得到很好的表征。有些证据表明,玉米可以从土壤中占据它适应的土壤中的内心细胞,因此将受到迁移的影响:例如,一种内生氮固定菌株洋葱只有当它与其原生农业土壤接种时,只能从墨西哥玉米地兰隔离[40].相比之下,我们进行的先前研究表明,来自不同的种子的相对细菌内心细胞组成Zea.从包括墨西哥在内的其他国家进口到加拿大的基因型,当植物随后重新种植和在加拿大土壤中收获种子[41.].这个结果表明Z. Mays.植物利用微生物的垂直传播来缓冲其内生群落对地理迁移的影响。
有几个假说可以预测地理迁移对内生菌种群的影响Zea Mays..像海绵一样,Z. Mays.植物可能被动地从土壤中获取大部分细菌内心细胞,导致植物在地理上不同的土壤上生长时对内心群体的剧烈移位。也是可能的Z. Mays.植物能够区分土壤微生物,只允许选择性进入。人们很容易推测,玉米的驯化前和其他野生亲缘物在基因上被设定为选择性吸收特定的微生物,这些微生物只存在于这些植物进化的土壤中[42.].同时,近期作物育种在各种地理位置跨越各种地理位置的产量稳定性造成了现代Z. Mays.限制来自不同土壤的微生物的进入或存活。另一种可能性是Z. Mays.通过种子而不是从土壤中继承其大多数微生物组,缓冲了植物的内生社区以防止地理迁移的影响。
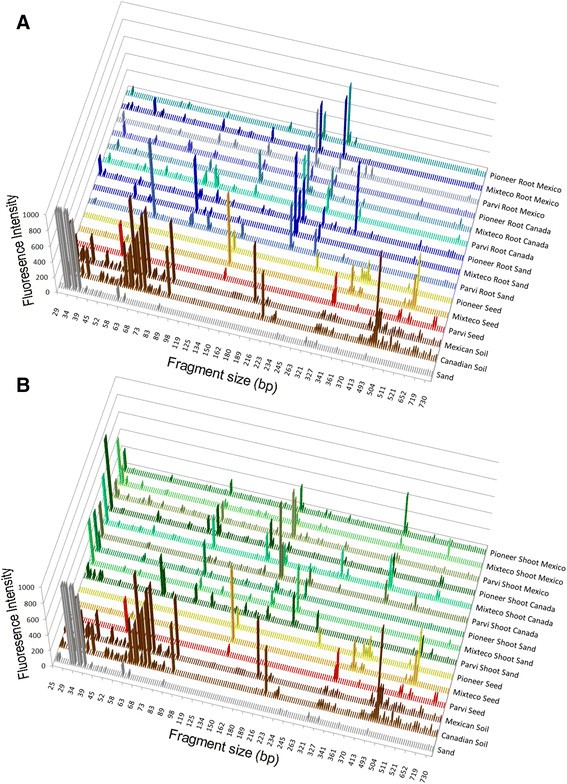
本研究的目的是表征迁移对创始人细菌内体群落的影响Z. Mays.在受控条件下。我们获得了三种遗传多样化的种子Z. Mays.上述基因型,并在三个土壤中并排在侧面(墨西哥,非农业土壤)在野外,预驯化的Parviglumis中生长;来自加拿大的现代杂交玉米的农业土壤;并被热灭菌的沙子杀死潜在的内心殖民者(图1).采用末端限制性片段长度多态性(TRFLP)指纹图谱和营养琼脂培养方法,从根和芽中提取细菌内生菌群落。土壤交换对这些植物的内生真菌群落结构的影响Z. Mays.使用多元统计进行比较基因型。兄弟姐妹种子的微生物谱配合使用在无菌砂上生长的植物,用于了解对来自遗传(垂直传输)的微生物群落的贡献,而来自墨西哥和加拿大的相关土壤的微生物谱用于澄清这些土壤的微生物贡献。
结果
土壤理化分析
加拿大土壤(灰棕色淋溶土)从10根周围挖掘Zea Mays.SSP.梅斯(现代玉米)植物在长期玉米试验领域,而墨西哥土壤(混合雷莫尔/瘦醇)在墨西哥的未开垦领域中围绕野生Parviglumis植物(祖先玉米)的根源被取样(参见方法)。土壤分析表明,加拿大样品是淤泥壤土土壤,而墨西哥样品是粘土壤土土壤,两者都有类似的pH(pH7.7与7.5,分别为7.5);对照基材与pH为8.6的砂。野生墨西哥土壤比农业加拿大土壤(分别为3.76%,2.28%)和含有更高水平的砷,铝,镉,钙,铁,铅,钼,钒和锌的有机质含量近2倍.加拿大土壤唯一比墨西哥土壤更丰富的矿物是可萃取的磷(附加档案1:表S1)。
幼体植物的16S TRFLP与它们生长的土壤中的16S TRFLP非常不同,但与种子的16S TRFLP有些相似
三种多样化Zea Mays.基因型(pre-domesticated /野生:Parviglumis;古代长白猪:Mixteco;现代温带杂交品种:先锋3751)被种植在一个生长室中,并排地放在花盆中,容器中要么是非不育的墨西哥或加拿大土壤,要么是经过高温消毒的沙子(如图)1).在发芽后20天,收获并称重并射击(附加文件2:图S1)。土壤和表面灭菌根部的细菌DNA指纹纹理,射击和种子由TRFLP进行(图2;附加文件3.:图S2)。TRFLP数据进一步与培养细菌的16S rDNA扩增序列进行匹配,以帮助确定分类身份(附加文件)4.:表S2)。将总共105个这些序列(≥200bp)提交给GenBank(登录号JF776463-JF776567)。协方差的主要成分分析(PCA)对TRFLP型材进行了,以试图解释细菌社区中任何什(6FAM和MAX550的原因)的原因;片段大小存在或在6个PCR试验中存在 - 附加文件3.:图S2)。
在根中观察到的原始TRFLP片段曲线存在明显差异(图2a)和射击(图2b)与来自土壤和种子的TRFLP信号相比。土壤型材以50至100bp的小尺寸片段为主。由于已经表明,直接附着在植物根(根际土壤)的土壤可以富集植物相关的细菌群体,不同于更远的散装土壤,因此我们在我们的研究中没有包含此样品类型的遗憾。种子有几个大峰,大小为300至500 bp;根谱由大小的200至300bp之间的峰定义(图2一个);而芽中一些更显著的峰值在100到200 bp之间(图)2b)。
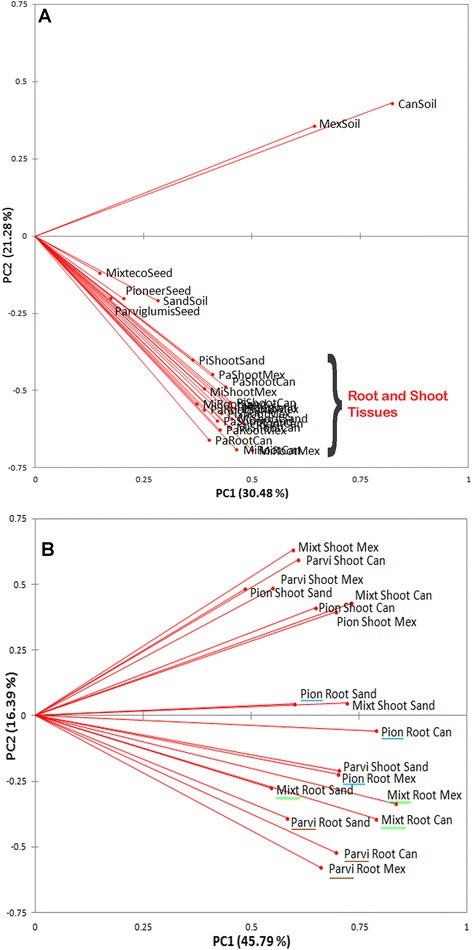
多变量主成分分析(PCA)的16S rDNA TRFLP峰显示,可检测的细菌居住在芽、根,在较小程度上,种子,聚集在一起,与居住在加拿大和墨西哥土壤样品的细菌相当远(图)3.虽然一些TRFLP峰在植物和土壤微生物谱之间共享(附加文件5.:图S3B),土壤和植物矢量的角度非常远(约90°)彼此(图3.A)表明土壤中的细菌群落与根、芽或种子中的细菌群落有很大的不同。与选择性内生菌吸收理论相反,生长在墨西哥本土土壤中的Parviglumis植物的TRFLP谱与墨西哥土壤本身的TRFLP谱并不十分相似。同样,与墨西哥土壤相比,来自温带杂交品种Pioneer 3751的TRFLP剖面与加拿大土壤的TRFLP剖面并没有更接近3.一种)。这些数据显示,土壤与植物组织的细菌群落显着截然不同。
细菌16S TRFLP谱的PCA可以区分根和茎组织
在没有土壤或种子数据的情况下重复PCA分析,这增加了PCA解释的52%至62%的变异(图3.b)。只有根和拍摄TRFLP数据的PCA显示了远离拍摄社区的根微生物社区的单独聚类(图3.b)。与此结果一致,使用Sørensen的相似性指数(QS)的TRFLP数据的β分集分析显示,在不同宿主基因型(根,QS范围= 0.63-0.78的= 0.63-0.78;拍摄,QS范围=0.70-0.81)比属于同一宿主基因型的不同组织(QS范围= 0.49-0.57)(Mann Whitney P = 0.024)。
在植物组织中观察到的细菌16S TRFLP谱组成受植物基因型的影响大于受盆栽基质的影响
在组织特异性分组中,Root 16S TRFLP谱系将更多的聚集成宿主基因型亚组,而不是最初预期的盆底亚组(图3.B),与大多数根内生菌来自土壤的假设相反。与这一结果一致的是,TRFLP峰值来自于生长在无菌沙土上的根(蒸压两次,并基于培养进行了无菌测试,数据未显示),与生长在土壤上的植物聚集在一起,但只有这些植物属于相同的基因型(图)3.B).然而,土壤在主成分分析中可以看到有影响,因为生长在加拿大和墨西哥土壤上的Parviglumis和Mixteco的根彼此靠近,比生长在蒸压砂中的相同基因型的根更靠近。在这三种基质中生长的先锋根之间的间隔似乎是相等的。在茎部组织的主成分分析中没有观察到聚类模式,表现为更随机的组织(图3.b)。
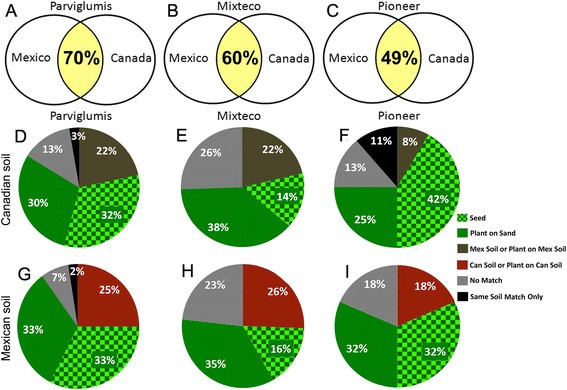
为了量化上述观察结果,当比较生长在墨西哥和加拿大土壤上的植物的TRFLP峰值(包括6FAM和Max550标记片段)时,即使结合根和茎数据,Sørensen的QS值为Parviglumis 0.70, Mixteco 0.60, Pioneer 0.494.a - c)。即使假设多种微生物可以共享相同的TRFLP峰值大小,在不同土壤上生长的植物之间的这种高度共享TRFLP峰值在统计上是非随机的,而且非常稳健Z. Mays.基因型(附加文件6.:表S3)。
年轻人存在的相关性和分类Zea.种植在不同的基材上。图中显示的是在墨西哥和加拿大土壤上种植的植物的数据:(一)Parviglumis,(b)mixteco和(C)先驱3751,基于Sørensen的细菌DNA指纹的相似性指数(16S rDNA TRFLP峰)。(d - i)6FAM和MAX500标记为TRFLP峰的共同发生:种子:与种子中存在的峰的土壤种植植物中的TRFLP峰;植物在沙地上:在土壤种植植物中的TRFLP峰与砂生长植物中存在但在种子中未发现的峰值;土壤或土壤上的植物:在土壤种植植物中存在的峰值,与在相对的土壤中生长的相对的土壤和植物共用,但不在种子中或在沙滩上生长的植物;同一土壤仅匹配:与植物生长的土壤种植植物中存在的土壤种植植物中存在的峰,但不在种子中,也不是在沙子上生长的植物,也不是在对面的土壤中生长的植物,也不是对面的土壤本身;没有匹配:土壤种植植物中存在的峰,但在种子中没有发现,砂生长植物,对面土壤种植植物或土壤。饼图D-F显示在加拿大土壤中生长的植物和墨西哥土壤的G-I的植物的碎片共同发生百分比。
当分开检查根微生物群落时,在不同土壤中生长的Parviglumis Roots的QS值为0.75,而Parviglumis Roots对同一土壤(墨西哥)生长的Mixteco Roots的QS值为0.61,而Parviglumis Roots对墨西哥种植的Pioneer Roots土壤的QS值仅为0.35(数据未显示)。在Genus水平,当同一基因型的整个植物在加拿大与墨西哥土壤中生长(QS = 0.58对于Parviglumis时,培养的内心社区也相当类似; QS = 0.47,对于Mixeer,QS = 0.47)(数据不是所示)。这些数字支持PCA中观察到的模式,这表明宿主基因型在塑造幼苗中的内心社区比是土壤类型更重要。
似乎在传统和现代Z中的细菌似乎是显着的垂直传播。梅斯基因型
考虑到宿主基因型对候选内体群体的强烈效果,通过分析来自土壤种植植物的三氟峰也存在于砂生长植物和/或兄弟种子中的可能内联垂直透射率的程度。原装种植材料。平均28%的幼苗目前存在的TRFLP峰与其表面灭菌的亲本种子(14-42%的范围)共用(图4.D-I)。Sørensen使用组合的TRFLP数据(6FAM和MAX550标有碎片)的相似性指数从根系和芽中都表明,植物内心社区平均平均〜46%相似(QS = 0.49,0.42和0.47之间Zea.基因型)。Sørensen相似性指数也表明,沙土植物和土壤植物培养的细菌群落平均相似性为47% (QS = 0.46 Parviglumis, 0.52 Mixteco, 0.44 Pioneer)。总的来说,土壤生长的植物中存在的TRFLP峰值有51-67%存在于亲本种子和/或沙生植物中(见图)4.D-I),表明在幼体中发现的细菌内生菌比例最大Zea.植物是垂直传播的,不是土壤衍生的。对于每个基因型,结果相似:土壤生长的Parviglumis植物共有62%和66%的TRFLP峰存在垂直传播的证据,而Mixteco和Pioneer分别为51%和52%,64%和67%(图)4.D-I)。发现土壤生长植物和砂生长植物和/或兄弟种子之间的TRFLP峰的共享在统计学上是非随机的,即使假设不同的微生物物种可能导致常见的TRFLP峰尺寸(附加文件)6.:表S3)。
Zea Mays植物似乎能够从地理上遥远的土壤中吸收具有相同16S RDNA TRFLP峰值尺寸的细菌
在每种基因型内,还有一类在墨西哥和加拿大土壤上生长的植物之间共享的另一类TRFLP峰,我们假设是植物选择和摄取来自不同土壤的分类学类似微生物的能力。为了表征该类,如果它们在种子或砂生长植物中存在(如这些代表的垂直传输的推定实例),首先将来自土壤生长植物的TRFLP峰被滤出。如果它们在相对的土壤中生长的植物中(或在相对的土壤本身)中,则保持其余的TRFLP信号。基于这种分类方案,对于加拿大土壤生长的植物,22%的Parviglumis峰,22%的Mixteco峰和8%的先驱峰值被归类为起源于土壤,也在地理位置跨土地分享(图4.d - i;统计分析在附加文件6.:表S3)。对于生长在墨西哥土壤上的植物,TRFLP共有峰数为:Parviglumis为25%,Mixteco为26%,Pioneer为18%(图1)4.d - i;附加文件6.:表S3)。
当生长在墨西哥本土土壤上时,祖传的、驯化前的细粒菌并不比在加拿大土壤上拥有更多独特的细菌TRFLP峰
我们的原始假设是,由于共同进化选择,玉米野生祖先的ParviglumisTeosinte可能更愿意从其天然墨西哥土壤中吸收微生物,而不是遥远的陌生土壤。与这种期望相反,多变量分析表明,当在其天然土壤上生长时,Parviglumis具有聚集在加拿大土壤上生长的兄弟植物的曲线的微生物TRFLP曲线(图3.).为了更加强大地检查这个问题,我们单独评分植物中的TRFLP峰的数量,与其天然土壤的生长单独相关(即没有与沙子或加拿大土壤种植的种子或植物共用);令人惊讶的是,只有2%的TRFLP峰值落入了这一课程,而加拿大土壤替代的唯一TRFLP峰的3%相比(图4.D、G)。然而,在土壤生长的Parviglumis植物中观察到的TRFLP峰中,还有一些峰既不能被解释为遗传的,也不能被解释为来自土壤的(见灰色切片,图)4.D-I)。由于这些可能代表稀有的土壤微生物,只有一旦它们殖民殖民地植物,它们就是可能对植物生长的土壤特异性。甚至在计算中包括这种潜在的“误差”,结果表明,在土壤上生长时,在Parviglumis中观察到在Parviglumis中观察到的9%的候选内心峰峰,而在该植物的16%相比之下在加拿大土壤中生长(灰色加黑切片,图4.d - i;附加文件6.:表S3)。相比之下,土壤中可能是独一无二的土壤衍生微生物的百分比范围为Mixteco的23-26%(图4.e,h)Pioneer 3751的18-24%(图4.F我;附加文件6.:表S3)。合并,这些数据不支持野生,预先驯化的Parviglumis优先从其天然墨西哥土壤中占用微生物。
现代玉米杂种似乎不会阻止进入土壤衍生的内心细胞
我们曾假设,现代玉米杂交品种可能是无意中培育的,以便从土壤中吸收更少的微生物,以保持在不同环境下的产量稳定。与这一预期相反,现代先锋杂交的TRFLP谱在不同的土壤环境中并不比祖先植物基因型更聚类(图)3.).为了理解这种观察,我们系统地计算了似乎源自土壤的先驱3751植物中的TRFLP峰的数量(土壤样本的独特,或者由墨西哥和加拿大土壤中生长的植物共用)。与传统Mixteco Landrace或驯化的Parviglumis植物(22-27%的驯化植物(22-27%)相比,Pioneer 3751植物仅在加拿大土壤(19%)和墨西哥土壤(19%)和墨西哥土壤(18%)上略微较小的推定土壤衍生的TRFLP片段(18%)(数字4.F,I;附加文件6.:表S3)。给定模糊起源的峰的数量(灰色切片,图4.D-I),我们还没有发现证据表明,尽管现代玉米杂种基本上拒绝了从土壤中的更多微生物,而不是祖先植物基因型。
培养预测垂直传播或土壤衍生细菌的分类
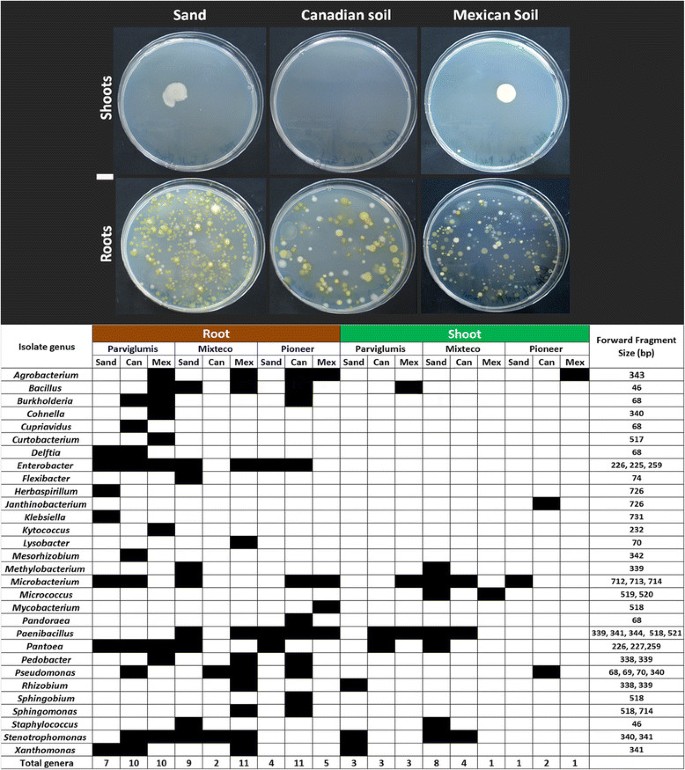
尝试从培养微生物Z. Mays.样品与16S rdNA测序组合,部分是针对土壤衍生和垂直传播的微生物的属性分类。我们培养了来自30个不同的124个细菌(图5.;附加文件5.:图S3)。数据与TRFLP分析不如TRFLP分析,但可以进行一些观察结果。微生物属的子集(肠杆菌属那微杆菌和Paenibacillus, 其次是Pantoea物种,Stenotrophomonas和芽孢杆菌)在不同的寄主基因型和盆栽组合(包括生长在无菌沙地上的植物)中似乎有些保守,这表明这些微生物属是遗传而不是土壤衍生的(图)5.;附加文件5.:图S3)。一些微生物属与特定的基因型关系更密切:9个属中的4个(肠杆菌,Klebsiella,Pantoea,和Stenotrophomonas)培养于沙土生长的细粒藻(图5.)也仅从Parviglumis种子中培养,表明这些是垂直传输的(附加文件5.:图S3)。其他的属似乎来自土壤:例如,从先锋植物的根和芽,农杆菌当植物在土壤上种植而不是沙子时,物种被培养(图5.;附加文件5.:图S3)。
Z的体外活性可以通过预测被遗传的微生物来供应微生物
植物可能无法为内生分类选择本身,而是这些微生物的功能。因此,我们询问培养的功能性质是否呈现Z. Mays.内科杂志,体外,受盆栽处理的影响。研究人员对微生物进行了17种功能特征的表征,这些功能特征可能会影响宿主的生长和/或健康,包括:矿物质营养因子[磷酸盐溶解作用(图6.a),无氮介质的生长作为生物氮固定或氮气清除的指标,铁腹部施用的铁道生产];合成含吲哚化合物,其包括根生长刺激激素,植物液[43.];acc脱氨酶的合成(分解植物胁迫激素乙烯的前体)[44.];和生产丙酮素/丁二醇[哪种改变植物激素,乙烯和细胞蛋白的合成(图6.b)] [45.],[46.].能力Z. Mays.Endophytes促进以前治愈了所有可耕的微生物的土豆外植物的生长[47.通过用不同的分离物接种后测量马铃薯生物量(图6.C)。这种基于马铃薯基的生物测定是在尚未开发出玉米的相当八噬菌生物组织培养系统。还进行了试验以检测对抗潜在的致病病毒(RNA酶分泌)和玉米病原真菌的拮抗作用,Fusarium Graminearum.和黄曲霉。最后,测试了果胶酶和纤维素酶活性,因为内心生存在由果胶和纤维素组成的地基中。
分析体外从中培养的细菌内心细胞的功能性状Z. Mays.植物。显示的是(两者)选择特征测定的示例和(d)通过宿主基因型和底物处理组织的观察性状的完整概述。测定的例子是:(一)微生物溶解磷酸三钙的能力(由清晰的晕圈表示);(b)丙酮和丁二醇生产(用红色表示);(C)与(从L-R)接种后1个月的组织培养薯类的生长促进肺炎克雷伯菌、无菌缓冲液或甲基杆菌oryzae..面板(d)在美国,分离株被分为具有活性(1)或不具有活性(0),因此这些数字表明来自该培养群体的分离株表达所注意到的性状。淡黄色遮荫表明,<25%的分离株具有该性状,深黄色为25-50%,橙色为50-75%,红色为75-100%。顶部的比例尺等于10毫米。
总体结果表明,从土壤种植植物培养的内心体积与砂厂呈现出类似的多样性体外无论宿主基因型是古老的还是现代育种的结果,活动6.d)。这种观察结果表明微生物源性益处的潜在效益Zea.植物不依赖土壤作为微生物的供体,而是可以通过垂直传播提供。关于共同进化的证据Z. Mays.植物与其本土土壤,多样性或频率没有明显差异(当标准化为隔离数量时)体外与生长在加拿大温带土壤或灭菌沙土上的Parviglumis同胞植物相比,生长在墨西哥本土土壤上的Parviglumis幼苗的候选内生菌群落所显示的特征(图)6.d)。
为了确定宿主基因型或土壤是否能够选择不同的内生状性状,也进行了PCA分析,类似于16S TRFLP分析。为了使PCA能够为每个性状分配细菌分离株(阳性活动= 1;没有活动= 0)(图6.D,额外的文件7.:图S4和附加文件4.:表S2)。忽略宿主组织类型的影响并巩固芽/根数据,因为从芽中培养了很少的细菌。内生活动的PCA显示,宿主基因型对内心群落的成员呈现的特征类型的影响而不是土壤类型(未显示数据)。例如,8种马铃薯芽的增长中的6种来自MileTeco植物中分离出Endophytes,与Parviglumis和Pioneer 3751的一个内联物(总,从Mixteco培养40/124个内心细胞)(图6.d)。来自Mixteco在沙子(3/20)或墨西哥土壤(3/15)上生长的分离物显示植物生长促进(总共只有5微生物,从加拿大土壤中生长的Mixteco)(图6.D).因为Mixteco是一种适应在低营养土壤上生长的巨型植物。35.],促进细菌内心细胞的生长可能在其生命策略中发挥作用。
讨论
在早期的研究中,检查了属属的不同基因型的内心细胞Zea.,包括野生中美洲/墨西哥大刍草,传统的北美地方品种和现代杂交品种,我们证明了种子的内生群落在加拿大一块普通土地上重新生长后保持了惊人的稳定[41.].这个结果表明Z. Mays.可以基本上缓冲其种子内科群落免于迁移到新土壤。在这项研究中,我们通过在受控温室进行土壤交换实验直接测试了这一假设。我们使用非无菌种子模仿现实世界中植物的活动。我们基于细菌16s rDNA峰的多变量分析的最重要的结果是植物基因型而不是罐基质(共享类似的pH)在整形内心群体中起最重要的作用。要了解这一结果,进行了对TRFLP峰值共享的详细分析,这表明野生/预驯化植物(Parviglumis),传统地兰(Mixteco)和现代杂交细菌(Pioneer 3751)邻近候选创始人内生细菌来源是被动土壤吸收,选择性土壤吸收和垂直传输的组合。后两种机制可能有助于宿主基因型在整形内生成的社区中的重要性,因此可能部分缓冲来自地理迁移的这种作物的细菌内生群。我们没有发现证据支持野生ParviglumisTeosinte的假设优选从其共同进化的天然土壤中占用微生物。Parviglumis种子具有艰难的额外层(水果盒),我们推测可能用于容纳并用种子传播的内心细胞接种出现的幼苗[41.[竞争土壤衍生的微生物。我们还没有发现证据支持现代先驱混合动力的内心群落比其古老的对手更加缓冲,以促进环境跨越环境的稳定性。
被动与土壤中的Endophytes的选择性摄取
墨西哥与加拿大土壤互换对内生社区的影响(图3.),我们的TRFLP峰共享分析表明,根和茎中检测到的细菌TRFLP峰中,不超过9-26%来自这些土壤微生物的被动吸收(图)4.d - i;附加文件6.:表S3)。相比之下,这项研究的令人惊讶的结论是年轻人Z. Mays.通过以宿主基因型依赖性方式从两种地理上远处的土壤中的微生物(基于TRFLP峰尺寸)的类似微生物(基于TRFLP峰尺寸)的群体显然地殖民。这些植物中的8-26%检测到的16S TRFLP信号似乎从加拿大和墨西哥土壤中获得(棕色和红色切片,图4.d - i;附加文件6.:表S3)。这种在TRFLP水平上的乱交可能部分地解释了为什么墨西哥和加拿大的土壤交换对这些植物的内生植物群落只有有限的影响(图)3., 数字4.a - c)。
已显示土壤以确定根际中的细菌群落组成[48.] - [50.],传统思想认为土壤同样是内生菌的主要来源[8.].事实上,植物被描述为微生物的“陷阱”,能够将内生菌从它们生长的土壤中引诱出来[40].支持这一观点的是,玉米地方品种生长在感染了Rhizobiumetli.从间作的豆类显示出这些微生物[51.].事实上,玉米根系二位素被证明与附近的土壤社区更有关,而不是与同一植物的芽中的那些[52.].侧根分枝连接处的裂缝是系统内生真菌从土壤定植的建议途径[53.]包括针对内心的Herbaspirillum丝氨酸[54.],肺炎克雷伯菌342 [55.] 和Burkholderia Phytofirmans.[56.].在其他植物中观察到微生物的环境进入,包括番茄(包括番茄)[57.].
然而,我们的结果与最近使用拟南芥进行的一项综合研究更加一致[9.],支持了细菌内生菌的最大比例不是由土壤微生物的被动入侵造成的观点。本研究利用16S rDNA片段的454测序法对8类内生菌进行了取样拟南芥在两种土壤中从灭菌种子生长的基因型。结果表明,根微生物组中大约60%的诊断OTU中的两种不同土壤中的两种,剩余40%的土壤特异性;本文还注意到宿主基因型在确定根内部社区中发挥了重要作用[9.].本文支持含有含有土壤中的广泛或混杂或混杂的细菌内生物细胞的想法,也是专门的土壤栖息于不同的植物能够选择性地占用的内核体。值得注意的是,与我们目前的研究不同,拟南芥植物从(非常小的)种子中生长,通过用70%乙醇和种植前漂白彻底灭菌,并在种植之前[9.这可能会使这项研究对种子传播的微生物产生偏见。
地理上不同的土壤可以提供分类上相似的细菌内生菌来源的观察有点令人惊讶,因为在整个美洲,只有4%的细菌被发现在地理上遥远的土壤中是共同的[31.].似乎可以合理地推测,虽然大多数来自大块土壤的细菌没有潜在的内生存在于内部Zea.植物,土壤衍生的内心细胞源自更多选择的微生物子集,可以在脱菱体中发现富集[58.].这种常见的内心体积可能包括植物体外菌,占先前研究中所有玉米根内体细胞的37%的植物[39.],并且通常在不同的土壤中观察到。重复我们与从未与之相关的土壤的实验会有很有趣的Zea.植物(如北极凝胶)或具有多种酸性的土壤,以确定是否仍然可以发现混杂的内心细胞。
垂直传播的内心
如上所述,只有内心TRFLP峰值为何的解释的一部分Z. Mays.植物的聚集主要取决于植物基因型,而不是盆栽基质(图)3.),以基因型依赖性方式呈现从土壤上的微生物的混杂吸收。聚类结果的主要原因似乎是与特定宿主基因型相关的垂直传播微生物的高分分数:TRFLP峰尺寸共享分析表明,在年轻人中观察到51-67%的细菌TRFLP信号Zea.植物可以通过种子遗传来解释(图4.d - i;附加文件3.:图S2和附加文件5.:图S3;附加文件6.:表S3)。与此结果一致,17个微生物衍生的潜在福利的特性Z. Mays.从灭菌沙子生长的植物中分离的微生物观察到植物,因此植物可能会在不依赖于捐赠者的土壤(图6.).
对于垂直传播的微生物,它们必须栖居在种子中,我们最近证明,这种关联受到玉米基因型的强烈影响[41.].同样,在辐射灭菌土壤上种植的水稻中,与种子相关的内生菌已被证明成为成熟植物中的主要内生菌,高达45%的内生菌在下一代种子中建立[27.].有趣的是,通过使用DGGE分析,同样的研究表明,土壤pH对根和芽内体群具有重大影响。虽然土壤pH强烈影响土壤细菌的丰富和多样性[59.[可能还改变了潜在宿主植物的生理学(例如土壤pH改变矿物吸收),导致种子衍生的微生物群的不同成员。值得注意的是,水稻研究中的土壤类型都不是无菌,因此不是观察到的微生物的主要来源[27.].
垂直传播的内生微生物的好处已经在巨型仙人掌的种子中观察到,种子细菌在发育的幼苗和精子层中定居,在那里它们溶解了对植物生长至关重要的岩石营养物质[23.].在烟草种子中,微生物被证明可以缓解成熟植物中的重金属胁迫[60.].如已经注意到,以模仿性质,Zea.在这项研究中,种子在种植前没有进行表面消毒,这使得生活在种子表面和下面的细菌能够持续存在,并有可能在发芽的幼苗上定居,而不是在土壤中定居微生物。真核宿主的早期细菌殖民者已经被证明对入侵的微生物发挥“屏障效应”[61.] - [63.]这可能有助于解释为什么土壤并不像最初假定的内心生物源。实际上,古代与在同一土壤中种植的现代小麦品种被证明具有不同的细菌社区[64.].在创建微生物的社区可能有助于移位难度的后期殖民地,植物本身也必须推测调节微生物感染其组织,或者寄生虫和病原体不堪重负。
肠和Pantoea SPP的重要性。到Z的内生微生物组
在整个植物水平观察到的70种不同的可重复的TRFLP片段(6Fam标记),在所有9个宿主基因型和盆栽治疗组合中保存,包括灭菌沙子的生长(附加档案3.:图S2)表明这些峰值代表种子传播细菌。为了预测这些微生物的身份,将它们与培养的微生物收集进行比较,其中测序16S rDNA基因(图5.;附加文件4.:表S2)。唯一培养的分离株匹配的第16ds Trflp碎片属于属于属肠杆菌属和Pantoea,具有预测的片段尺寸为225,226,258和259 bp;这些菌株也从取样的所有根基因型中培养。与这些结果一致,在先前的研究中Zea.种子,98%的克隆序列与这些片段长度也属于Pantoea和肠杆菌属[41.].根据这些独立的数据,我们有理由假设这些微生物属是紧密相连的Z. Mays.在多样化的环境。
研究的局限性和未来的实验
关于本研究中使用的方法,必须注意一些注意事项。首先,虽然我们使用16S rDNA扩增子测序来预测本研究中培养的微生物的分类身份,但这些结果并不与观察到的所有TRFLP信号一致,也不能假设一个TRFLP信号代表一个单一的微生物物种,因为不同的细菌可以产生相同的16S rDNA限制性多态性。然而,由于我们的每个组织样本从经验确定的314个峰库中通常只给出35-50个TRFLP峰,所以来自不同组织样本的这么多16S限制性多态性的共享不可能是随机发生的,这一点我们在统计学上证明了(附加文件)6.:表S3)。实际上,通过不同的微生物物种的单个TRFLP峰值的分享不会增加TRFLP峰值在不同的组织样本中通过随机机会发生的概率,因为这种贡献也线性增加可检测微生物组的尺寸。微生物群落的TRFLP分析与多变量统计方法组合,已被证明是一种用于可视化样本之间的微生物差异的鲁棒工具[65.] - [67.],并已成功用于多项微生物生态学研究[41.],[68.] - [70].我们在这里使用TRFLP作为一种廉价的方法来分析本研究所需的许多处理和重复。然而,有理由认为,在地理位置较远的土壤上生长的植物中,共享TRFLP峰值可能在最低程度上代表同一微生物种或相关物种的不同菌株。为了谨慎起见,我们试图将我们的结果称为“TRFLP峰”或“16S信号”,并将预测的物种标识放在括号中。对于读者来说,重要的是要理解我们的研究结论,只有在分类学方法论的背景下使用。理想情况下,我们的研究应该使用深度测序方法以及多基因的DNA多态性分析进行复制。
本研究还有其他技术限制。首先,对不同的细菌基团可以是可变的有效性的DNA提取,并且PCR中的引物偏压可以进一步倾斜群落的视图,并且研究表明,任何特定的引物对可能只会扩增高达50%的细菌给定示例中的多样性[71.].此外,据估计,任何特定的微生物菌株必须出现≥1%的分子指纹次数以检测其[72.,这就是为什么我们小心地注意到,研究的重点只是可检测到的内生菌。为了促进所有细菌组的扩增,本研究共进行了两次巢式PCR,共70个循环,每个重复3个生物重复(每个植物基因型-土壤组合6个重复),并对结果进行汇总,以增加重复高于背景噪声的16S信号的权重;只观察到一次的片段被丢弃。为了增加指纹的稳稳性,我们使用低信号阈值分析片段荧光强度信息,并将结果转换为二进制数据,按其他地方推荐的方法对每一组进行平等的权衡[73.].
与许多内心研究一样,这项研究的另一个警告是,我们不能排除我们还采样的可能性,以至于我们还采样了文学层或根际微生物。在DNA分离或培养之前,洗涤植物组织并表面灭菌,通过培养R2A琼脂平板上的最后表面清洗来验证方案的有效性;从植物表面培养没有微生物。我们没有测试该方案是否有效地破坏可能在植物表面上的细菌DNA;然而,我们的协议(参见方法)超过了最小浓度,并且时间发现足以用于去块DNA的骨表面[74.]以及清洁DNA提取工具[75.].此外,我们的主要结果表明,墨西哥-加拿大土壤交换对内生植物群落的影响较小(图3.),建议我们的样品具有较低的环境污染。
该研究的另一个技术限制是基于培养的分析Z. Mays.内生菌可能在特定的微生物分类群中代表性不足。众所周知,许多微生物使用传统方法是不可培养的[76.].然而,内心细胞的培养基分析对于包括在本研究中的含量是重要的,因为它似乎靶向不同的微生物子集而不是基于DNA的分析,其中6分中的63个中的仅有9个包含的TRFLP峰值匹配30属的培养微生物中的16个。(附加文件3.:图S2)。同样重要的是,细菌培养允许评估来自Endophyte社区的功能性状(图6.).
本研究的最终主要限制是,我们分析了相对幼株的内心社区(发芽后〜20天),只在交换土壤后的第一代中。幼苗的内心社区可能受到遗传的创始人微生物的影响,而土壤衍生的微生物的滴度可能会随着时间的推移而增加[5.],[48.直到它们最终能够通过种子感染后代。然而,在早期的研究中,我们证实了9种种子的细菌内生菌组成Zea.从其他国家进口到加拿大进口的基因型,当植物在加拿大土壤上恢复全球时仍然相对稳定[41.].然而,在不同土壤类型种植的时候,表征内心群落组成如何随时间变化是有趣的。
结论
通过发芽预驯化,传统和现代基因型Z. Mays.在不同地理位置的土壤和贫瘠的沙地上,我们得到的数据表明,这些植物的细菌内生菌群落部分地缓冲了地理迁移的影响。在16S-TRFLP分析范围内,本研究提示年轻Z. Mays.植物不是通过土壤微生物殖民殖民的空插座,而是似乎通过它们的种子传递大部分细菌内心生成,并进一步调节选择和广泛的土壤细菌的入口和/或建立。
方法
种子来源
Zea Mays.SPP。Parviglumis.(#11355)和Zea Mays.ssp。梅斯var。Mixteco(#24143)是从国际玉米和小麦改善中心(CIMMYT)(Texcoco,Mexico)获得的,并在括号中指出的银行登记号。用Semevin 350(杀虫剂),Tecto 60(Nematicide)和围裙XL(杀真菌剂)处理Cimmyt种子。Pioneer 3751种子(先锋Hi-Bred T3Szza11015.00)由匈牙利斯拉瓦斯的幼儿园先锋提供。用Maxim XL(杀真菌剂)和围裙XL(杀真菌剂)处理种子.
土壤来源
无菌砂:Nepheline Syenite Sand(Cas#37244-96-5,Unimin Canada Ltd,Blue Mountain,Canada)通过高压灭菌在121°C时进行两次灭菌1小时。
加拿大土壤:温带,农业淤泥LOAM Luvisol从长期玉米旋转实验中的10米玉米植物的脱耳挖掘出来[77.在2009年11月4日,加拿大安大略省埃洛拉,GPS坐标43.641044,−80.405674。
墨西哥土壤:热带,非农业粘土壤土,与百叶菌相关的Regosol,从Mazatlan,Guerrero,墨西哥附近的野外生长的10个Parviglumis植物的relizoss挖掘出来,在2009年10月23日的GPS坐标,-99.474068。这种土壤来自瓦斯拉河流域,是Parviglumis最后一个野生栖息地的一部分[78.].
在Guelph Lab Services大学分析了两种土壤的物理化学性质(附加档案1:表S1)。
植物实验设计和生长条件
为了促进萌发(对Teosinte特别重要),将种子在40℃下在干燥培养箱中热处理一周,然后在室温下浸泡在蒸馏水中。对于每次重复,将每种基因型的五种种子种植在含有土壤或砂的10cm宽×10cm深盆中。每种土壤处理每种基因型3种复制(图1)除了在砂岩上混合砂,仅由于种子有限而被复制两次。将盆随机置于生长室中并用50ml蒸馏的高压灭菌水浇水每24小时。将植物生长在生长室中的5-叶尖端(20天),其具有50%湿度,16h光周期(200μmolm-2证券交易委员会-1白炽灯和荧光灯),白天28°C,晚上23°C。为了确保不同基质处理对植物生长没有显著影响,在收获时记录了新鲜组织质量。
植物和种子表面灭菌
对于根和茎内生菌,5叶期(约20日龄)的整株植物小心地从土壤中摇离,在根/茎边界处切割,在自来水下洗净土壤,放入单独的500ml Erlenmeyer烧瓶(一个用于整个茎部,一个用于整个根部),用0.1% Triton X-100洗涤剂摇晃10分钟。水被排干,然后用3%次氯酸钠清洗样品10分钟。漂白了,再洗3%次氯酸钠额外10分钟。然后样本与热压处理过的排水和冲洗,蒸馏水,然后在95%的乙醇洗了10分钟。乙醇被移除,样品用蒸压蒸馏水冲洗三次。为检测表面无菌性,每次处理取1片组织暂时置于无菌R2A琼脂平板上,25℃孵育10天。
对于种子内心细胞,在用漂白剂和乙醇如上表面灭菌之前将每种基因型的15种种子的池浸泡48小时。为了验证表面无菌,每处理5种子瞬时放置在无菌R2A琼脂平板上,并将板在25℃下孵育10天。
植物和种子组织提取物
表面消毒过的组织(整个茎和根系)在蒸压研钵和研杵中研磨,加入1ml的50 mM钠2HPO.4.缓冲液每克新鲜根或茎组织,或每克种子重量(Parviglumis种子2ml /g)。每种混合物加1 ml到Eppendorf试管中,冷冻后提取DNA;50 μl的混合物在450 μl的50 mM Na中连续稀释3次2HPO.4.结果是10倍、100倍和1000倍的稀释。将100X和1000X的稀释倍数涂布于R2A培养基(#17209,Sigma)上培养寡养菌。培养皿在25°C孵育10天。将400 μl与250 μl 80%甘油混合,在−80℃冷冻培养。
植物组织和土壤中的DNA提取和末端限制性片段长度多态性(TRFLP)
使用DNEasy植物迷你试剂盒(Qiagen,USA)从1ml根,芽或种子提取物中提取总DNA,并在水中洗脱。使用Powersoil DNA分离试剂盒(Mobio,USA)提取来自250mg土壤或砂的总DNA,并且使用Nanodrop(Thermo Scientific,USA)量化DNA。PCR MasterMix是每25μl体积的以下组分进行:2.5μL标准Taq缓冲液(新英格兰Biolabs),0.5μl25mmDNTP混合物,0.5μl10mm 27 f degen引物,序列Agrrttygatytytyg [79.(其中R = A + G, Y = C + T, M = A + C), 0.5 μl的10 mM 1492r引物,序列为GGTTACCTTGTTACGACTT [79., 0.25 μl 50 mM氯化镁2, 0.25 μl标准Taq(新英格兰Biolabs), 50 ng总DNA,双蒸馏水总达25 μl。在PTC200 DNA热循环仪(MJ Scientific, USA)中扩增35个循环,使用以下程序:96°C for 3 min, 35 x(94°C for 30秒,48°C for 30秒,72°C for 1:30 min), 72°C for 7 min。
使用与上述相同的条件,将1.5μl上述PCR产物用作嵌套的荧光标记的PCR反应中的模板。对于嵌套的PCR,底漆799F,序列aacmggattagatackg [39.[其中M = A + C,K = G + T)用6FAM标记,1492RH与序列HGGHTACCTTGTACGACTT(其中H = A + T + C)用MAX550标记,通过集成DNA技术(美国)。选择正向引物799f,因为它被强烈地偏向于扩增叶片16s rdna [39.];更大的18S线粒体片段随后被移除在Silico.扩增和限制后,但在统计分析之前。将1.5 μl标记的PCR产物加入8.5 μl的限制性内切酶混合物中[1UDdeI(NEB),1x缓冲液3(NEB)]并在37℃下在黑暗中孵育16小时,然后通过求谷丝1200 Liz尺寸标准(Applied Biosystems,USA),测序凝胶进行测序凝胶。每个基因型/治疗组合有3个生物学重复。对于每个根或芽生物复制,重复TRFLP扩增和限制两次(两种技术复制)。每根根或芽组织,每种基因型/治疗组合如此接受了6个TRFLP重复。对于种子,每个游泳池的DNA进行三种PCR试验。
TRFLP分析
使用默认设置使用默认设置使用默认设置进行分析TRFLP结果,使用具有35个荧光单元的改进的片段峰值高度切断。向前和反向片段大小加上峰值高度将导出到Microsoft Excel。除去引物二聚体片段(峰1-26bp)。
为显示生成伪TRFLP配置文件(图2),仅使用正向碎片。通过减去水控制强度计算每个PCR试验的每个峰的TRFLP片段强度;然后平均所有PCR试验的结果。为了产生不同TRFLP片段尺寸的标识的预测,将来自培养的细菌分离株的16S rDNA序列提交给在Silico.TRFLP分析程序琐事[80].使用TRFLP分析程序aplus + [81.].
对于PCA,同时使用正向和反向片段。按照其他人的建议,减少TRFLP分析中固有的实验噪声[73.[仅在多于一个复制中观察到,仅计算片段大小类别,并且将数据被格式化为PCR试验的存在/不存在计数(0至6),其中检测每个峰值。使用XLSTAT软件(addinsoft,法国)进行协方差PCA。
TRFLP所示的微生物群落之间的相似性测量使用Sørensen相似性指数(QS)进行,QS是Beta多样性的指标,可用于微生物群落之间的比较[73.],使用公式:
在哪里S1=社区1中的物种总数,S2是社区2中的物种总数,C是两个社区共同的物种数量。
样本之间的TRFLP峰的统计学意义
为了计算通过随机机会在不同样本之间可以在不同样本之间共享TRFLP峰的概率(P),即使多种微生物物种共享相同的TRFLP峰值尺寸,使用以下等式:
在哪里:
固定的整数314表示本实验中的经验观察到的TRFLP峰的总数
a =样本a中TRFLP峰的数量
B =比较样本B中的TRFLP峰的数量b
C =与样品A共享的样本A中的TRFLP峰的数量
包含了这个方程的推导过程(附加文件6.(表S3),假设每个TRFLP峰大小可以代表10种不同的微生物菌株(尽管概率不受这个变量的影响,因为这个变量线性增加了微生物群落的大小,因此复杂性)。
使用16S RDNA测序的分类培养细菌的分类鉴定
根据菌落颜色和形态选择来自每个培养板的独特细菌。对于分类法鉴定,使用引物27F-DEGEN和1492r以上进行菌落PCR;当存在干净的1465bp扩增子时,在测序反应中直接使用1μl作为模板使用。测序反应使用引物787F(AatagatacccncngGTAG)(其中N = A + T + C + G),退火温度为49℃,以及标准的大丁基反应条件(Applied Biosystems,USA)。如果需要,在测序之前,扩增子是凝胶纯化的。读者被爆炸被寻找对Genbank [82.[JF776463 - JF776567 - JF776567 - JF776567]和分配的登录号,这些序列中的这些序列中的这些序列中的105次提交。
培养细菌的表型
利用琼脂扩散法筛选细菌内生菌对玉米病原菌生长的抑制能力。Fusarium Graminearum.和黄曲霉那体外.在这种方法中,内生菌和病原菌在培养皿上共培养:F. Graminearum.要么答:flavus真菌首先在液体PDA培养基中生长一夜(25°C, 100 rpm),然后添加到融化的、冷却的PDA培养基中(将1 ml真菌放入100 ml培养基中),混合后倒入培养皿(100 mm × 15 mm),然后允许重新凝固。用无菌玻璃管在每个平板(随后加入内生菌液)上穿刺4个孔(直径11毫米)。过夜培养的每个细菌内生菌离心5分钟,用PBS缓冲液重悬至OD6000.5。为了接种到平板上,然后将200μl的每种细菌悬浮液施加到PDA板中的孔中,该孔用每个致病真菌(如上所述)预接种,然后在30℃下孵育24小时。将实验一式三份(3琼脂平板)重复,测量抑制区的半径;仅始终引起抑制≥1.5mm的区域的内心细胞被得分为正。使用杀菌剂两性霉素B和Nystatin作为阳性对照。
其余表型测试的方案与早期研究中描述的相同[41.],并在可能的情况下使用96孔复制镀层。除了一式三份进行的植物生长促进测定外,所有测试均以重复进行。
附加文件
参考文献
- 1。
Johnston-Monje D,Raizada Mn:植物和内心关系:营养管理。综合生物技术。编辑:Moo-Young M. Elsevier,牛津;2011年:713-727。10.1016 / B978-0-08-088504-9.00264-6。2
- 2。
Rosenblueth M,Martinez-Romero E:细菌内心细胞及其与主持人的互动。Mol植物微生物相互作用。2006,19(8):827-837。10.1094 / mpmi-19-0827。
- 3.
McCully Me:作物植物中细菌内心细胞的核桃:植物生物学家的观点。澳大利亚j植物phys。2001,28(9):983-990。
- 4.
Hallmann J,Quadt A,Mahaffee Wf,Kloepper JW:农业作物的细菌内心。可以j microbiol。1997,43(10):895-914。10.1139 / m97-131。
- 5。
Van Overbeek L,Van Elsas JD:植物基因型和生长阶段对马铃薯相关的细菌社区结构的影响(Solanum Tuberosum.l .)。有限元微生物ECOL。2008,64(2):283-296。10.1111 / J.1574-6941.2008.00469.x。
- 6。
Rasche F,Velvis H,Zachow C,Berg G,Van Elsas JD,Sessitsch A:表达在细菌内生物体上表达抗菌剂对细菌的影响与植物基因型,土壤类型和病原体感染的影响相当。J Appl Ecol。2006,43(3):555-566。10.1111 / J.1365-2664.2006.01169.x。
- 7。
Mahaffee Wf,Kloepper JW:土壤,根际和尾窦的细菌社区的时间变化,与现场生长的黄瓜相关(Cucumis sativusl .)。微生物学报,1997,34(3):210-223。10.1007 / s002489900050。
- 8。
Long HH,Sonntag DG,Schmidt DD,Baldwin IT:培养根细菌内体群落的结构尼古利亚娜attenuata.由土壤成分和宿主植物乙烯生产和感知组织。新植物。2010,185(2):554-567。10.1111 / J.1469-8137.2009.03079.x。
- 9。
Lundberg D, Lebeis S, Paredes S, Yourstone S, Gehring J, Malfatti S, Tremblay J, Engelbrektson A, Kunin V,里约热内卢T, Edgar R, Eickhorst T, Ley R, Hugenholtz P, Tringe S, Dangl J:拟南芥核心根微生物群的定义。自然科学进展。2012,488(7409):86-90。10.1038 / nature11237。
- 10。
王志强,王志强。植物根系内生菌的遗传多样性。微生物根内生菌。编辑:Schulz BJE, Boyle CJC, Sieber TN.施普林格,海德堡;2006:15-31。/ 3 - 540 - 33526 - 9 - 10.1007 _2。9卷
- 11.
Brundrett MC:土地根源和菌根的菌根参与。新植物。2002,154(2):275-304。10.1046 / J.1469-8137.2002.00397.x。
- 12.
Slattery JF,Coventry Dr,Slattery WJ:受土壤环境影响的根瘤生生态。Aust J Exp Agric。2001,41(3):289-298。10.1071 / EA99159。
- 13。
Dowling DN,Broughton WJ:豆类撰写的竞争。Annu Rev Microbiol。1986,40(1):131-157。10.1146 / annurev.mi.40.100186.001023。
- 14。
Ruiz Sainz J,周J,Rodriguez-Navarro DN,Vinardell J,Thomas-Oates J:大豆种植和中国的BNF。农业、林业、生态和环境中的固氮作用。编辑:Warner D, Newton WE。多德雷赫特施普林格;2005:67-87。10.1007 / 1-4020-3544-6_5。
- 15.
大豆在北美的固氮作用。农业、林业、生态和环境中的固氮作用。编辑:Warner D, Newton WE。多德雷赫特施普林格;2005:15-23。10.1007 / 1 - 4020 - 3544 - 6 - _2。
- 16。
根际微生物生态学和土壤细菌学研究的先驱,罗伦茨·希尔特纳。植物生态学报,2008,32(1):7-14。10.1007 / s11104 - 007 - 9514 - z。
- 17。
Catroux G,Amarger N:根瘤菌作为农业土壤涂层剂。释放遗传工程和其他微生物。卷。2.编辑:Fry JC,Day MJ。剑桥剑桥大学;1992:1-9。
- 18。
Alves BJR,Boddey RM,Urquiaga S:BNF在巴西大豆的成功。植物和土壤。2003,252(1):1-9。10.1023 /答:1024191913296。
- 19。
王志强,王志强:寄主基因型对棉花内生细菌的影响。acta botanica sinica(云南植物学报). 2002,24(1):1-10。
- 20.
Christensen MJ,Voisey Cr:内心/草合作的生物学。第六次国际草丛中的真菌内心体系研讨会。卷。13,6 EDN编辑:Papay AJ,荆棘。新西兰新西兰的草原协会,基督城,新西兰;2007年:123-133。
- 21.
王志强,王志强,王志强:禾本科植物与内生真菌的共生关系。植物营养与肥料学报,2004,32(5):531 - 534。10.1146 / annurev.arplant.55.031903.141735。
- 22.
ferreira a,echecine mc,lacava pt,oada s,azevedo jl,araújowl:从桉树种子种子和幼苗的殖民化的内心细菌的多样性Pantoea agglomerans.微生物学报,2008,32(1):1 - 8。10.1111 / j.1574-6968.2008.01258.x。
- 23.
Puente Me,Li Cy,Bashan Y:仙人掌种子的内生细菌可以改善仙人掌幼苗的发展。Environ Exp Bot。2009,66(3):402-408。10.1016 / J.ENVEXPBOT.2009.04.007。
- 24.
Mundt JO, Hinkle NF:胚珠和种子中的细菌。应用环境微生物学报,1976,32(5):694-698。
- 25.
Okunishi S,Sako K,Mano H,Imamura A,Morisaki H:栽培稻的成熟种子中的细菌植物植物(栽培稻).微生物环境学报,2005,20(3):168-177。10.1264 / jsme2.20.168。
- 26.
Mano H,Tanaka F,Watanabe A,Kaga H,Okunishi S,Morisaki H:培养水稻植物成熟种子的培养表面和内生细菌植物群(栽培稻)在稻田中栽培。Microb Environ。2006,21(2):86-100。10.1264 / JSME2.21.86。
- 27.
Kaga H,Mano H,Tanaka F,Watanabe A,Kaneko S,Morisaki H:作为内生细菌来源的米种子。Microb Environ。2009,24(2):154-162。10.1264 / JSME2.ME09113。
- 28。
Cankar K,Kraigher H,Ravnikar M,Rupnik M:来自挪威云杉种子的细菌内心(Picea amiesl .岩溶)。微生物学通报。2005,44(2):341-345。10.1016 / j.femsle.2005.02.008。
- 29。
Rijavec T,Lapanje A,Dermastia M,Rupnik M:从发芽玉米核中分离细菌内心细胞。可以j microbiol。2007,53(6):802-808。10.1139 / W07-048。
- 30.
丹尼尔R:土壤的偏见。NAT Rev Microbiol。2005,3(6):470-478。10.1038 / Nrmicro1160。
- 31。
Fulthorpe RR, Roesch LFW, Riva A, Triplett EW:远采样土壤中共有的物种很少。acta Ecol J., 2008, 32(9): 941 - 946。
- 32。
Warburton ML, Frisch JC, Bohn M, Bedoya M, Xia C, Crossa XC, Franco J, Hoisington J, Pixley D, Taba K: CIMMYT非温带玉米种质资源的遗传多样性:地方品种、开放授粉品种和自交系。作物学报,2008,48(2):617-10.2135/作物科学2007.02.0103。
- 33。
威尔克斯G:玉米,奇怪和奇妙:但是一种明确的原产地名?玉米:起源,历史,技术和生产。编辑:史密斯CW,Betran J,Runge ECA。John Wiley&Sons,新泽西州;2004年。
- 34。
威尔克斯G:对所有玉米研究人员的紧急通知:失踪和灭绝最后一个野生Teosinte人口超过一半以上。在原位的Teosinte演变和保护的适度建议:Balsas,Guerrero,墨西哥。梅迪卡。2007,52(1):49-
- 35。
Matsuoka Y, Vigouroux Y, Goodman MM, Sanchez GJ, Buckler E, Doebley J:多位点微卫星基因分型显示的玉米单一驯化。中国科学(d辑:地球科学),2002,19(9):6080-6084。10.1073 / pnas.052125199。
- 36。
特洛伊AF:七十世纪玉米进化中的持续和流行的种质。玉米:起源,历史,技术和生产。编辑:史密斯CW,Betran J,Runge ECA。霍博肯约翰瓦利和儿子;2004:133-231。
- 37。
李文杰,李文忠,李文忠,等:玉米产量潜力、产量稳定性与抗逆性。农业科学学报,2002,32(3):457 - 461。10.1016 / s0378 - 4290(02) 00024 - 2。
- 38。
Frey KJ:国家植物育种研究 - 我。爱荷华州立大学,艾米斯;1996年。
- 39。
Chelius Mk,Triplett EW:与根系的古代和细菌的多样性Zea Mays.L. microb Ecol。2001,41(3):252-263。
- 40。
estrada p,mavgooi p,cournoyer b,fontaine f,Balandreau J,Caballero-Mellado J:一个n2固定内心洋葱sp。与墨西哥栽培的玉米植物相关联。可以j microbiol。2002,48(4):285-294。10.1139 / W02-023。
- 41。
Johnston-Monje D,Raizada Mn:种子相关的内心生物细胞的保护和多样性Zea.跨越进化,民族志法和生态学的界限。Plos一个。2011,6(6):20396-10.1371 / journal.pone.0020396。
- 42。
王志强,王志强,王志强,等。植物根际土壤与微生物的相互作用:一种进化的视角。土壤学报,2009,32(1):83-115。10.1007 / s11104 - 009 - 0042 - x。
- 43。
Nassar Ah,El-tarabily Ka,Sivasithamparam K:促进植物生长的酵母生长素分离物Williopsis saturnus玉米内生成(Zea Mays.L.)根。BIOL FETTIL土壤。2005,42(2):97-108。10.1007 / s00374-005-0008-y。
- 44.
细菌ACC脱氨酶对植物乙烯水平的调控。微生物学通报。2005,31(1):1-7。10.1016 / j.femsle.2005.07.030。
- 45.
Ryu C-M,Farag Ma,Hu C-H,Reddy Ms,Wei H-X,Pare PW,Kloepper JW:细菌挥发物促进生长拟南芥.Proc Natl Acad Sci U S A. 2003,100(8):4927-4932。10.1073 / PNAS.0730845100。
- 46.
李平,王志强:土壤中细菌挥发物对植物生长的促进作用拟南芥.趋势植物SCI。2004,9(6):263-266。10.1016 / J.Plants.2004.04.008。
- 47.
陈志强,陈志强,陈志强:马铃薯与植物根际促生菌相互作用研究的新方法。微生物学杂志,1997,43(9):801-808。10.1139 / m97 - 117。
- 48.
Berg G,Spalla K:植物物种和土壤类型合作地塑造了根际微生物群落的结构和功能。有限元微生物ECOL。2009,68(1):1-13。10.1111 / J.1574-6941.2009.00654.x。
- 49.
辛格BK,Munro S,Potts JM,Millard P:草地和土壤类型对草地土壤根际微生物群落结构的影响。苹果土壤Ecol。2007,36(2-3):147-155。10.1016 / J.APSoil.2007.01.004。
- 50.
Normander B,Prosser ji:大麦植物植物中的细菌来源和群落组成作为栖息地和患病的功能。申请环境微生物。2000,66(10):4372-4377。10.1128 / AEM.66.10.4372-4377.2000。
- 51.
Rosenblueth M,Martínez-Romero E:Rhizobiumetli.玉米人口及其对根殖民化的竞争力。拱微生物。2004,181(5):337-344。10.1007 / s00203-004-0661-9
- 52.
Roesch LFW,Passaglia LMP,Bento FM,Triplett Ew,Camargo Fao:与玉米植物相关的虚拟营养内生细菌的多样性。rev brasciênciasolo。2007,31:1367-1380。10.1590 / S0100-06832007000600015
- 53.
通过氮素固定细菌划分EC:植物根的内生殖殖民化。植物和土壤。2001,252:169-175。10.1023 /答:1024106605806。
- 54.
James EK, Gyaneshwar P, Mathan N, Barraquio WL, Reddy PM, Iannetta PPM, Olivares FL, Ladha JK:植物生长促进菌对水稻幼苗的侵染和定殖Herbaspirillum丝氨酸Z67。Mol植物微生物相互作用。2002,15(9):894-906。10.1094 / mpmi.2002.15.9.894。
- 55。
董玉英,王志强,王志强,等:植物内生菌定殖的寄主范围和菌株特异性的定量评价肺炎克雷伯菌342.植物生态学报,2003,27(1):49-59。10.1023 /: 1026242814060。
- 56。
Compant S,Kaplan H,Sessitsch A,Nowak J,Ait Barka E,ClémentC:内生成的殖民化vitis Viniferal .,Burkholderia Phytofirmans.菌株PSJN:从根际到花序组织。有限元微生物ECOL。2008,63(1):84-93。10.1111 / J.1574-6941.2007.00410.x。
- 57。
van Peer R,Punte HLM,De Weger La,瑞格拉,瑞格拉德B:根表面和内卓越岩伪组织的特征与他们的根系定植相关。申请环境微生物。1990,56(8):2462-
- 58。
Smalla K,Wieland G,Buchner A,Zock A,Parzy J,Kaiser S,Roskot N,Heuer H,Berg G:散装和根际土壤细菌社区通过变性梯度凝胶电泳研究:植物依赖性富集和季节性转变揭示。申请环境微生物。2001,67(10):4742-4751。10.1128 / AEM.67.10.4742-4751.2001。
- 59。
Rousk J,Baath E,Brookes PC,Lauber Cl,Lozupone C,Caporaso JG,Knight R,Fierer N:耕地中pH梯度的土壤细菌和真菌社区。ISME J.2010,4(10):1340-1351。10.1038 / ISMEJ.201010.58。
- 60。
(1)植物种子内生细菌的研究尼科尼亚塔哈瓦姆可以减少植物植物毒性。int j植物修复。2009,11(3):251-267。10.1080 / 15226510802432678
- 61。
陈志强,陈志强,陈志强,等:内生细菌对植物生长的抑制作用Botrytis cinerea及其对促进葡萄生长的影响。生物工程学报,2002,24:135-142。10.1016 / s1049 - 9644(02) 00034 - 8。
- 62。
Raibaud P, Ducluzeau R, Dubos F, Hudault S, Bewa H, Muller MC:将人类和各种动物消化道中的细菌植入无菌小鼠。中华医学会临床营养学杂志,1998,33(11):2440-2447。
- 63。
Bacilio-Jimenez M,Aguilar-Flores S,Del Valle MV,Perez A,Zepeda A,Zenteno E:水稻种子的内心细菌抑制了根的早期殖民Azospirillum brasilense.土壤生物学报,2001,33(4):453 - 457。10.1016 / s0038 - 0717(00) 00126 - 7。
- 64。
Germida J,Siciliano S:与现代,最近和古代小麦品种根源相关的细菌分类分类。BIOL FETTIL土壤。2001,33(5):410-415。10.1007 / S003740100343。
- 65。
Osborn AM, Moore ERB, Timmis KN:末端限制性片段长度多态性(T-RFLP)分析用于微生物群落结构和动态研究的评价。环境微生物学报,2000,2(1):39-50。10.1046 / j.1462-2920.2000.00081.x。
- 66。
Lukow T,Dunfield PF,Liesack W:使用T-RFLP技术评估用转基因和非转基因马铃薯植物种植的农业土壤中细菌群落结构的空间和时间变化。有限元微生物ECOL。2000,32(3):241-247。10.1111 / J.1574-6941.2000.TB00717.X。
- 67。
Schütte U, Abdo Z, Bent S, Shyu C, Williams C, Pierson J, Forney L:利用16S rRNA基因末端限制性片段长度多态性(T-RFLP)分析微生物群落特征的研究进展。应用生物技术。2008,80(3):365-380。10.1007 / s00253 - 008 - 1565 - 4。
- 68.
Wang M, Ahrne S, Antonsson M, Molin G: T-RFLP结合主成分分析和16S rRNA基因测序:比较不同年龄婴儿粪便微生物群的有效策略。微生物学杂志。2004,59(1):53-69。10.1016 / j.mimet.2004.06.002。
- 69.
徐斌,王志强,徐志强,等:土壤外生菌根菌丝垂直生态位的T-RFLP分析。植物营养学报,2002,16(3):527-535。10.1046 / j.1469-8137.2002.00535.x。
- 70。
Scala DJ,Kerkhof LJ:终端限制片段长度多态性分析船沉积物中亚硝基细菌社区的水平异质性。申请环境微生物。2000,66(5):1980-1986。10.1128 / AEM.66.5.1980-1986.2000。
- 71。
Hongs,Bunge J,Leslin C,Jeon S,Epstein SS:聚合酶链反应引物错过RRNA微生物多样性的一半。INT SoC Microb Ecol J.2009,3(12):1365-1373。
- 72。
Smalla K:纯文化的微生物。微生物生物多样性和生物保护。编辑:公牛A. Asm Press,华盛顿D.C;2004年:88-99。10.1128 / 9781555817770.ch9。
- 73。
基于方差分析和排序方法的T-RFLP数据分析:一项比较研究。中国微生物学杂志。2008,27(1):55-63。10.1016 / j.mimet.2008.04.011。
- 74.
KEMP BM,Smith DG:使用漂白剂从骨骼和牙齿表面消除污染DNA。法医SCI int。2005,154(1):53-61。10.1016 / J.forsCiint.2004.11.017。
- 75.
Bonne N, Clark P, Shearer P, Raidal:消除因打孔机携带污染而导致的假阳性聚合酶链反应结果。中国兽医学报,2008,20(1):60-63。10.1177 / 104063870802000111。
- 76.
Rondon MR, August PR, Bettermann AD, Brady SF, Grossman TH, Liles MR, Loiacono KA, Lynch BA, MacNeil IA, Minor C, Tiong CL, Gilman M, Osburne MS, Clardy J, Handelsman J, Goodman RM:克隆土壤宏基因组:获取未培养微生物遗传和功能多样性的策略。应用环境微生物学报,2000,66(6):2541-2547。10.1128 / aem.66.6.2541 - 2547.2000。
- 77.
Meyer-Aurich A,Janovicek K,Deen W,Weersink A:耕作和旋转对玉米种植系统的产量和经济性能的影响。Agron J. 2006,98(5):1204-1212。10.2134 / AGRONJ2005.0262。
- 78.
Serratos Ja,Willcox MC,Castillo F:玉米体力成分之间的基因流,所在的玉米品种和Teosinte:对转基因玉米的影响。cimmyt。1997年,1997:1997-
- 79。
Frank Ja,Reich Ci,Sharma S,Weisbaum JS,Wilson Ba,Olsen GJ:常用于扩增细菌16s rRNA基因的两个引物的关键评价。申请环境微生物。2008,74(8):2461-2470。10.1128 / aem.02272-07。
- 80。
Junier P,Junier T,Witzel K-P:Trifle:具有用户定义序列集的Silico T-RFLP分析的程序。申请环境微生物。2008,74(20):6452-6456。10.1128 / aem.01394-08。
- 81。
Shyu C,Soule T,Bent SJ,Foster Ja,Forney LJ:云母:基于末端限制性片段长度为16s和18s rRNA基因的微生物群落的基于网络的工具。Microb Ecol。2007,53(4):562-570。10.1007 / S00248-006-9106-0。
- 82。
Altschul SF,Gish W,Miller W,Myers EW,Lipman DJ:基本的本地对齐搜索工具。J Mol Biol。1990,215(3):403-410。10.1016 / S0022-2836(05)80360-2。
确认
我们要感谢本科生Jacqueline Riddle,Sarah Mcclymont,Cole Goudie和Leslie HotelWell进行实验室援助。我们感谢Garrison Wilkes(Massachussetts大学)教授(Massachussetts,Usan大学)在Teosinte Biology,Paul Goodwin博士(加拿大Guelph,Guelph,Canada大学)寻求微生物技术,John Seliga(Pioneer Hi-Bred,Canada)的帮助供应先锋3751种子,彼得·范Straaten博士(圭尔夫大学)进行基板分类,杰米拉森(圭尔夫大学)咨询PCA。DJM是Gerald R. Stephenson奖学金和Gordon Nixon领导奖的受援人员,并且由于Taffy Davison纪念研究旅游赠款和理查德和索菲亚Hungerford旅行奖,可以在墨西哥收集土壤。WKM由埃及政府,Kenneth G.Murray奖学金和Guelph International学生奖学金的慷慨奖学金得到支持。来自Ontario研究基金,Omafra和加拿大创新基金会的MNR提供资金。
作者信息
从属关系
通讯作者
附加信息
相互竞争的利益
提交人声明他们没有竞争利益。
作者的贡献
DJM设计了实验,进行了所有采样,实验室工作和数据分析,并写了稿件。WKM对细菌表型进行了抗生素实验。GL参加了研究的设计,并帮助编辑本文的草案。MNR参与了这项研究的设计和协调,资助了工作并帮助写了稿件。所有作者阅读并认可的终稿。
电子补充材料
12870_2014_233_moesm1_esm.xlsx.
附加文件1:表S1。:P.hysical and elemental characteristics of the Canadian and Mexican soils used in this study. (XLSX 10 KB)
12870 _2014_233_moesm2_esm.tiff
附加文件2:图S1:图:在生长室内的受控条件下,在无菌沙子,加拿大土壤或墨西哥土壤中,平均射击的根部和射击的新鲜重量和枝条的射击射击,Mixteco和Pioneer植物。误差条显示标准差。(TIFF 677 KB)
12870_2014_233_moesm3_esm.tiff.
附加文件3:图S2。:S.ummary of 6FAM labelled (799f) TRFLP fragments present in shoots and roots of young maize plants grown in different substrates. Numbers are summed presence/absence counts of 6FAM labelled 16S rDNA TRFLP fragments from six TRFLP replications per sample. Fragment categories were included only if at least one sample had a count of two or more. Potential fragment identities were determined by matching sequenced 16S rDNA amplified from isolates or by APLAUS+. (TIFF 4 MB)
12870 _2014_233_moesm4_esm.xlsx
附加文件4:表S2。:S.ource tissue, bacterial identities based on 16S rDNA homology, TRFLP fragment sizes, and体外培养的玉米根和芽内体的功能性状。函数被评分为0(无响应),1(小响应),11(中响应)和111(大响应)。(XLSX 30 KB)
12870 _2014_233_moesm5_esm.tiff
附加文件5:图S3。:内生细菌存在的比较Z. Mays.种子,土壤和植物。文中展示了依赖于培养和独立于培养的方法。(A)种子中存在R2A培养属的细菌Z. Mays.种植在不同的基材上。(b)在不同土壤中生长的土壤,种子和植物中标记的6Fam的存在标记的TRFLP片段。MAX550未显示标记的碎片。颜色阴影表示存在。(TIFF 2 MB)
12870 _2014_233_moesm6_esm.xlsx
附加文件6:表S3。:S.tatistical probability that TRFLP peaks could be shared between different samples by random chance, when multiple microbial species share the same TRFLP peak size. This table represents the statistical significance underlying the data shown in Figure4..(XLSX 13 KB)
12870 _2014_233_moesm7_esm.tiff
附加文件7:图S4。:S.ummary of functional traits exhibited by cultured endophytes organized by bacterial genus. Microbes were counted as having activity (1) or being inactive (0) and summed. Light yellow shading indicates that <25% of isolates from the host genotype indicated exhibited the trait, deep yellow indicates 25-50%, orange indicates 50-75%, and red indicates 75-100%. (TIFF 2 MB)
作者的原始提交的图像文件
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。
除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。
要查看本许可证的副本,请访问https://creativecommons.org/licenses/by/4.0/.
创作共用及公共领域专用豁免书(https://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
约翰斯顿-蒙耶,穆萨,w.k.,拉扎罗维茨,G。等等。交换土壤对驯化,古代和现代玉米内生细菌群落的影响。BMC植物BIOL.14,233(2014)。https://doi.org/10.1186/s12870-014-0233-3
已收到:
公认:
发表:
关键词
- 内生植物
- Zea.
- 玉米
- 细菌
- 16S.
- 驯化
- 进化
- 微生物生态学
- 根
- 射击
- 种子
- TRFLP
- 土壤
- Teosinte.
- Parviglumis
- Mixteco
- 兰德斯
- 垂直传播
- 产量稳定性
- 玉米杂交
- 玉米杂交
- 配种