摘要
背景
核黄素是黄素单核苷酸(FMN)和黄素腺嘌呤二核苷酸(FAD)的前体,是许多代谢酶催化各种生化反应的必要辅助因子。之前我们发现,表达海龟核黄素结合蛋白(RfBP)的转基因拟南芥植株叶片中的游离黄素(核黄素、FMN和FAD)浓度下降。在此,我们报道了RfBP对黄素的下调可以诱导早花表型,并提高花促光周期基因的表达。
结果
早开花是一种偶然现象,被谨慎地描述为表达rfbp的转基因拟南芥植株在长日和短日的一种恒定表型。当无叶黄素恢复到稳定水平时,表型消失RfBP基因沉默,从而使RfBP蛋白的生产无效,或通过外部核黄素喂养处理。rbp诱导的早熟开花与促花光周期基因和成花原基因的表达增强有关英国《金融时报》在叶片中,但与分配给春化、自主和赤霉素途径的基因无关,这些途径提供了可替代光周期的开花调节机制。rbp诱导的早开花进一步与增加表达FD编码花期控制所必需的bZIP转录因子FD和花分生组织识别基因的基因AP1在嫩枝顶端。相比之下,的表达英国《金融时报》和光周期基因在叶片中的表达FD而且AP1在梢尖不再增强时RfBP基因被沉默,RfBP蛋白的产生被取消,黄素浓度被提高到植物叶片内的稳定水平。
结论
综上所述,我们的研究结果提供了间接证据,表明通过RfBP下调叶片黄素含量可诱导早花,并通过光周期通路同时增强促进开花的基因。
背景
核黄素(维生素B2)是黄素单核苷酸(FMN)和黄素腺嘌呤二核苷酸(FAD)的前体,它们是参与多种细胞过程的许多代谢酶的必要辅助因子[1]-[3.].植物可以合成核黄素,但核黄素在不同器官和不同发育阶段的水平差异很大,这表明核黄素水平的变化可能引起生理效应[2]、[4]、[5].叶面应用核黄素可增加所有黄素(核黄素、FMN和FAD)的固有浓度,改变细胞氧化还原,并诱导对病原体的防御反应[6]-[10].叶黄素含量也可通过转基因龟(Trionyx sinensis对虾)编码核黄素结合蛋白的基因[11].该蛋白质包含一个与分子相互作用有关的硝基端(n端)配体结合结构域和一个羧基端(c端)磷酸化结构域,容纳核黄素分子[12]-[15].在RfBP表达(RfBP+)拟南芥rbp蛋白定位于叶绿体,与核黄素结合,降低叶片中游离黄素浓度,增强植物抗病能力[11].细胞内过氧化氢(H2O2),一种可以调节防御反应的细胞信号[7]、[10]、[11]、[16].所有这些rbp所赋予的反应都可以通过无效来消除RfBPRfBP蛋白的表达和终止产生。的RfBP沉默(RfBP+)在RfBP下生成的拟南芥系+在叶片黄素含量、抗病性和H2O2生产(11].这些发现支持了改变黄素浓度会产生生物学后果的观点[7]、[10]、[11].
RfBP是一种最先从鸡蛋蛋白中分离出来的磷酸糖蛋白。17],然后在不同的卵生动物和哺乳动物中发现,如鸸鹋[18),两栖动物(19)、鱼(20.],以及人类[21].卵生动物,RfBP基因以雌激素依赖的方式在肝脏和输卵管中表达,也在排卵后的卵母细胞中表达[12]、[18]、[22].雌性激素依赖和排卵诱导的表达模式也在哺乳动物中发现[21].RfBP蛋白主要产生于足细胞的血浆中,通过n端配体结合结构域定位于质膜[23]、[24].RfBP还利用c端磷酸化结构域以1:1摩尔比紧密结合核黄素[24]-[26].由于这些特征,RfBP在动物体内介导核黄素的细胞易位[27]、[28].动物直接从膳食来源吸收核黄素[29或通过摄入的FMN和FAD转化产生这种维生素[1]、[30.].在这两种情况下,RfBP的作用是在细胞和器官之间重新分配核黄素[13]、[27].此外,RfBP采用配体-受体结合方式[13]、[31]、[32介导核黄素转位到生长中的胚胎[25].核黄素缺乏或核黄素- rfbp复合体分解不足对胚胎发生都是致命的[33].这些结果表明,RfBP在动物发育过程中起着重要作用。在与这一作用一致的情况下,我们意外地发现了拟南芥的RfBP+花期早于WT和rbp+植物(11].这一偶然现象表明,RfBP的重新表达可能影响植物开花时间的调节。
植物开花时间主要由4种遗传途径控制,在拟南芥中具有很好的特征[34]、[35].光周期和春化途径分别根据白天的长度和长时间的寒冷来调节开花[36]、[37].赤霉素(GA)途径指的是正常开花模式对赤霉素的需求[35]、[36].该自主途径表明开花调控以光周期和GA独立的方式进行[37].这些途径可能相互作用[34]、[35]通过多个调控因子,如已知的锌指转录因子CO (CONSTANS) [38],成花蛋白FT(开花位点T) [39,以及生物钟振荡器TOC1 (TIMING OF CAB EXPRESSION1)和CCA1 (circadian clock - associated1) [40].因此,表达的花分生组织身份(FMI)基因,如AP1(APETALA1) [41],在茎尖被诱导,以促进花器官原基的生长,在随后的日子里形成花[42]、[43].本研究的主要目的是阐明四种花途径中哪一种与RfBP下调自由黄素浓度相关的早期开花表型有关。
结果
RfBP降低叶片黄素含量在长日和短日
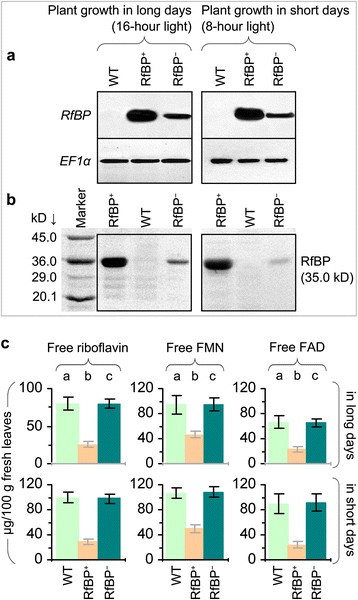
最近我们发现,在拟南芥RfBP中,叶片黄素(核黄素、FMN和FAD)浓度显著降低+(同义词REAT11)线比WT或RfBP+(同义词RfBPi11) 12小时光照/12小时暗循环下的植物[11].这种光周期不太适合研究开花调控,相反,短的白天被指定为8小时的光照/16小时的暗周期,而长的白天表示16小时的光照[34].因此,我们改种WT, RfBP+, RfBP+分别在长昼(16小时光照)和短昼(8小时光照)条件下种植。我们重新测试RfBP根据不同植物的开花时间(见下文),长日生长的10日龄植物和短日生长的25日龄植物最年轻的两片展开叶中,RfBP蛋白的表达、rbp蛋白的产生和游离黄素的浓度。
在长日照和短日照条件下对植物进行平行试验RfBP基因高表达(图1a)产生了大量的RfBP蛋白(图)1b)在rbp叶片中+相比之下,在WT植物中没有基因表达和蛋白质生产。RfBP的基因表达和蛋白产量均显著降低+植物(图1a、b)。长时间处理后,rbp叶片中游离核黄素、FMN和FAD浓度分别降低了60%、52%和69%+但在RfBP中+,提取的黄素接近WT水平(图1c).在RfBP表达式(图1a),蛋白质的产生(图1b)和黄素浓度(图1c) WT中,RfBP+, RfBP+在短暂的几天。在长时间生长的所有植物中,叶片黄素浓度比短时间生长的植物降低了约20%(图1c).这些分析表明,叶片中游离黄素浓度的下调是RfBP的恒定特征+在短日照和长日照条件下种植。
叶片黄素含量下调导致花期提前
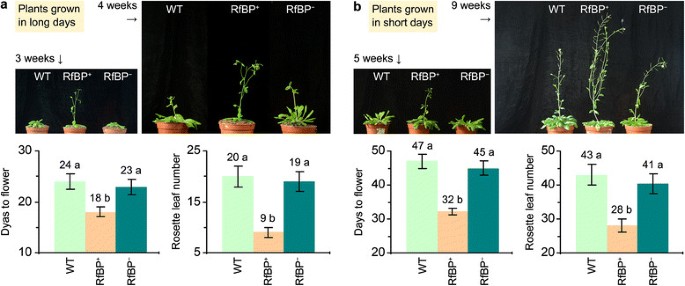
WT花了24天和47天,花了20和43个莲座叶(图2a)和短的天数(图)2分别b)。RfBP+花期和莲座叶数与WT相近,但rbp相近+花期提前6天,长时间内莲座叶减少11片(图2a)提前15天开花,短时间内缺少15片莲座叶(图)2像RfBP b)。+,其他RfBP表达行(11也获得了早开花表型(附加文件1:图S1)。因此,早开花是植物的一个恒定的特征RfBP表达植物。
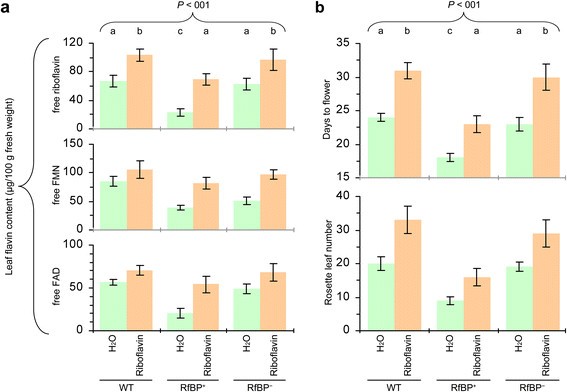
为了阐明叶黄素浓度对开花的影响,我们进行了一项药理学研究,用核黄素水溶液喂养长时间生长的植物或用超纯水处理的植物作为对照。核黄素的饲喂使rbp叶片中所有黄素的含量和黄素浓度显著增加+在水处理过的WT植株中检索到近似值(图3.a)。RfBP+核黄素摄食对叶片黄素含量的影响与WT相似(图3.a).与对照组相比,核黄素饲喂rbp后,所有植株开花时间较晚,莲座叶更多+植物失去了早期开花表型(图3.b).这些观察结果与RfBP沉默效应和这两方面的证据都将早开花表型归因于叶片黄素浓度的降低。
黄素含量下调增强了叶片促花光周期基因的表达
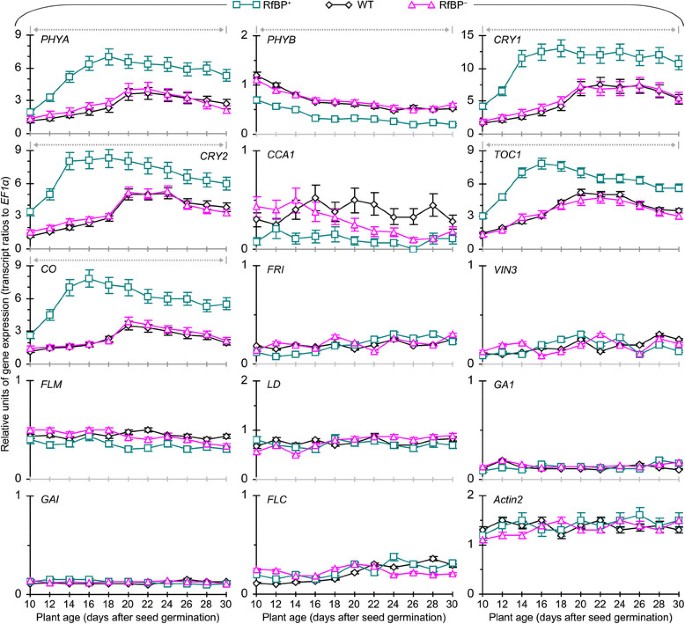
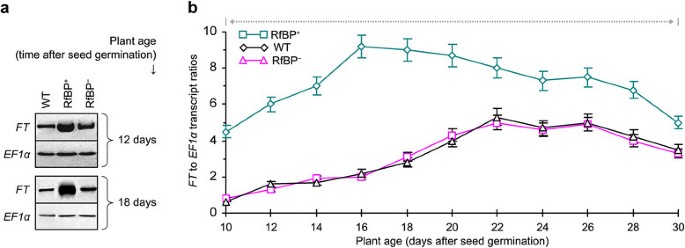
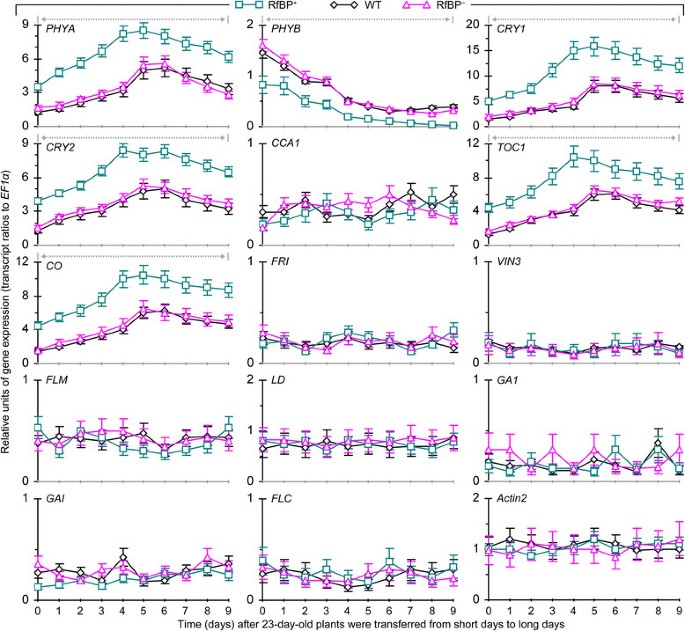
为了推断RfBP诱导早花的分子基础,我们比较了WT和RfBP+, RfBP+14个花期调控基因的表达(巴,、,CRY1,CRY2,CCA1,TOC1,有限公司),春化处理(方法,星期五,VIN3)、遗传算法(GA1而且时至今日)和自治(方法与春化处理,FLM,LD)的途径。植物在长时间内生长,并在种子发芽后10-30天内取样。采用实时逆转录-聚合酶链反应(RT-PCR)定量分析基因表达EF1α而且Actin2基因作为引用。分析中使用的rna是从光照13小时(从3小时到黑暗)下最年轻的两片展开的叶子中分离出来的,在这个时间点,在生物钟的调节下,花促进基因高度表达,而生物钟是光周期通路中的一个核心角色[34]、[35].
图中提供了植物生长10-30天内每隔一天分析一次的基因表达时间模式4.春化、GA或自主通路的7个基因在所有植株中都表达较少,而7个光周期基因表现不同。光周期方面,红/远红光受体光敏色素PHYA和PHYB [44]、[45]和蓝光受体隐色素CRY1和CRY2 [46]、[47作为时钟的入口[40,它使用了否定词CCA1而且TOC1调控光周期基因表达昼夜节律的转录反馈环[40]、[48]、[49].RfBP无明显影响CCA1因为它在所有植物中的表达水平在整个时间过程中是相似的。、在所有植物中,表达量随时间的增加而下降,但下降幅度显著(Prbp < 0.01)+与WT或RfBP相比+.其他五个光周期基因的表达量(巴,CRY1,CRY2,TOC1,有限公司),它们是开花激活剂[34]、[38]、[40]、[44]、[48]、[50,与对照组相比,血压高度升高(Actin2来EF1α转录本比率)和急剧升高在所有植物开花前约4天。然而,RfBP+比WT和RfBP更有活力+光周期基因的表达按时间顺序增加。它们在RfBP中的表达高度增强+与WT或RfBP相比+在10-30天内的每个时间点。在此期间,RfBP的表达增强倍数为1.4-3.2巴-4.4, 1.6CRY1-4.0, 1.4CRY2-2.8, 1.5TOC11.9-4.5有限公司.显然,RfBP+增强叶片中促花光周期基因的表达(图4).
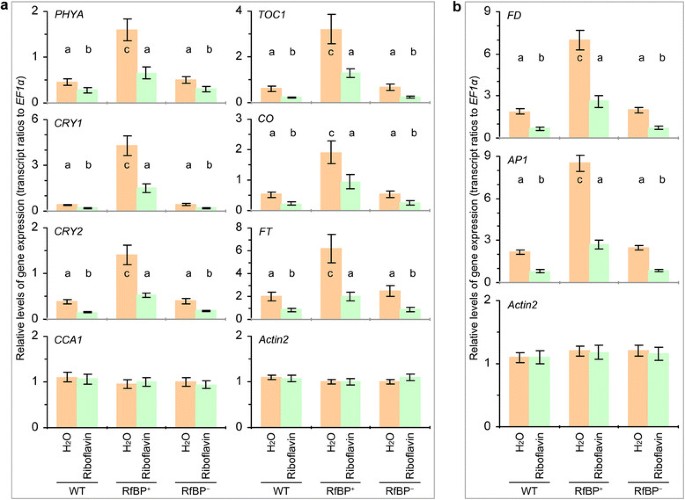
rbp对基因表达的影响被核黄素喂养处理所取消2:图S2),该方法消除了早花表型,也消除了RfBP中接近rbp降低的部分固有黄素含量+叶子(图3.b).内源性黄素浓度升高(图3.A), 5个促花光周期基因表达量显著降低(P< 0.01)+用核黄素喂养的植物与用水喂养的植物相比(附加文件2:图S2)。因此,游离黄素浓度对长日照叶片中rbp增强的促花光周期基因表达有负向影响。
RfBP增强叶片FT的表达,协调茎尖FD和AP1的表达
生物钟退出基因有限公司[48是rbp诱导的光周期基因之一(图4).作为对光周期信号的响应,CO作为生物钟的输出产生,并反过来激活成花原基因的表达英国《金融时报》在叶子48]、[50].如图所示5A,有标记的表达英国《金融时报》在12日生植株和18日生植株的叶片中检测到较多的rbp+相比于WT或rbp+在漫长的白天条件下。有趣的是,英国《金融时报》RfBP仍有大量表达+在花期(图5a与图比较2a).如图所示5B,数量英国《金融时报》日照较长的不同植物在生长10 d后转录水平显著增加,在开花前2 d达到最高值,开花后开始逐渐下降。因此,年代模式英国《金融时报》在长时间生长的10-30天内,所有植物的表达都是相似的。然而,英国《金融时报》表达水平在每个时间点都保持较高水平,并在较早的时候显著增加(P< 0.01)叶片中含量较高+与WT和RfBP相比+(图5b)。
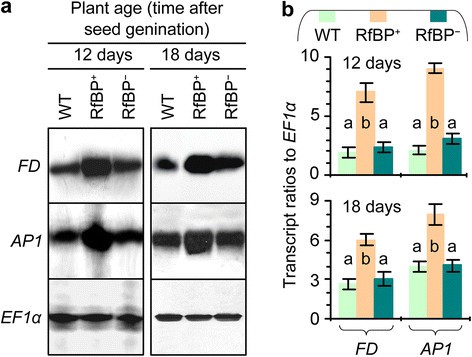
由于光周期的调节,发花原FT蛋白从叶片移动到茎尖[51]、[52],与FD一起激活AP1 [12]、[13],标志着花的器官开始形成[34].在转录水平上FD而且AP1在茎尖协调表达的基因通过促进花器官原基的生长而启动开花[42]、[43].阐明…的作用FD而且AP1在rfp诱导的开花过程中,我们分析了其在12日龄和18日龄植株茎尖中的表达。我们检测到伴随的表达FD而且AP1从所有植物(图6a)显著性(P<0.01) rbp中基因转录物含量较高+相比于WT或rbp+(图6b).显然,RfBP的从头表达影响了的同步表达FD而且AP1在芽的顶端。
RfBP增强了诱导光周期下叶片中光周期基因和FT基因的表达以及茎尖中FD和AP1基因的表达
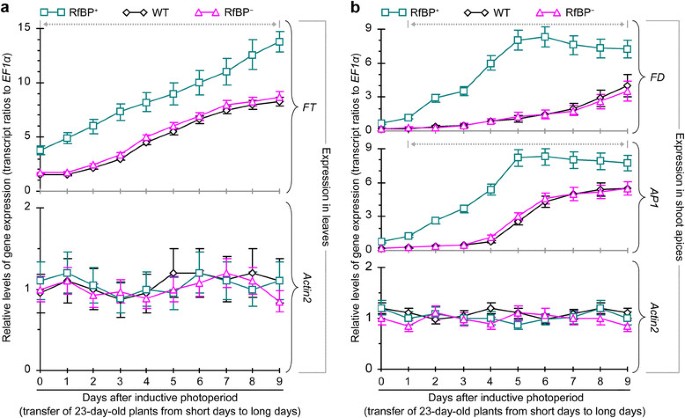
为了进一步阐明rbp诱导早花的分子基础,我们检测了rbp的表达英国《金融时报》和开花调控基因在叶片中的表达FD而且AP1在WT, rbp的梢尖+, RfBP+感应光周期下的植物。该条件的设计考虑:(i) RfBP+而WT和rbp则在32 d后开花+在短时间内生长47天和46天后开花2b);(ii)花器官原基在5天内就能很好地生长,并在随后的几天内在诱导光周期下分化为花器官[43].因此,我们采用感应光周期,在短的白天种植植物23天,并将其转移到长白天。我们分析了诱导光周期后立即(0天)和随后9天的基因表达。
如图所示7诱导光周期对不同花通路基因的叶片表达有不同的影响,在RfBP中也有不同的影响+从WT和RfBP+.在所有植物中,感应光周期对其无明显影响CCA1或分配给春化、GA和自主通路的基因,与内参基因之间的转录本比进行比较Actin2而且EF1α.诱导光周期抑制了、压抑程度显著(Prbp < 0.01)较低+叶片比WT或rbp的叶片多+.与转录本比率的比较Actin2而且EF1α,花促光周期基因表达水平巴,CRY1,CRY2,TOC1,有限公司在所有植物的叶片中,诱导光周期均增加。这些基因以类似的时间顺序表达。RfBP的表达水平在3天内略有升高+WT和rbp各5天+,在随后的两天达到最高水平,然后在所有植株中下降。在每个时间点,感应光周期作用增强的表达的程度巴,CRY1,CRY2,TOC1,有限公司明显(Prbp < 0.01)+叶片比WT或rbp的叶片多+.
在所有植物中,诱导光周期导致叶片表达增强英国《金融时报》(图8A)和表达FD而且AP1在梢尖(图8b).尽管如此,增强程度显著(Prbp < 0.01)+相比于WT或rbp+.此外,在所有植物中,表达水平英国《金融时报》在叶片和表达水平FD而且AP1枝尖在6 d内呈上升趋势英国《金融时报》持续增加(图8A)而是…的极致表达FD而且AP1维持到第九天(图8b)。
综上所述,这些分析表明,RfBP在拟南芥中的从头表达增强了英国《金融时报》而促花光周期基因也在叶片中表达增强FD而且AP1在枝尖感应光周期作用下。在RfBP中基因表达增强显著+与WT或RfBP相比+背景。
诱导光周期下,叶片黄素含量的降低是基因表达增强的主要原因
为了研究诱导光周期下rbp增强的基因表达与叶片黄素含量之间的关系,我们尝试通过饲喂核黄素来提高叶片黄素含量,并进行了分析巴,CRY1,CRY2,CCA1,TOC1,有限公司,英国《金融时报》,FD,AP1诱导光周期后第5天,在没有核黄素摄食的情况下,这些基因在叶或茎尖中高度表达(图7而且8).在诱导光周期下,饲喂核黄素的植株叶片中所有黄素的浓度和核黄素喂养的RfBP中黄素的水平均显著增加+在水处理的WT植物中检索到近似值(附加文件3.:图S3)。RfBP+核黄素饲喂对叶片黄素含量的影响与WT相似(附加文件3.:图S3)。在所有的植物,CCA1在叶片中表达不受影响,但在叶片中表达巴,CRY1,CRY2,TOC1,有限公司,英国《金融时报》在叶子(图9A)和表达FD而且AP1在梢尖(图9B)与水相比,核黄素喂养处理降低了。Riboflavin-fed RfBP+植株表现与水处理的WT或RfBP相似+植物的基因表达。在RfBP+,因此,增强英国《金融时报》光周期基因在叶片中的表达增强FD而且AP1在茎尖的表达,是由叶黄素浓度的降低引起的。
讨论
卵生RfBP在核黄素结合和再分配中的发育作用已得到充分证实[13]、[28]、[32启发了通过与海龟RfBP基因工程来操纵植物核黄素含量的想法[11].它在核黄素结合中的活性使其能够调节转基因植物中的游离黄素浓度[11].在此基础上,本研究研究了rbp蛋白在拟南芥新生表达后影响开花时间的偶然作用。我们研究了拟南芥RfBP+和RfBP+与WT植株的比较(图1),并证明了rfbp引起叶片中游离黄素含量的下调(图1)诱导早开花表型(图2).通过添加核黄素来提高植物体内游离黄素的含量,并测定其对开花时间的影响,并结合rbp的药理学数据进行分析+与RfBP+我们能够将早开花表型归因于叶片中游离黄素浓度的降低(图3.),以RfBP与叶细胞内核黄素结合为基础[11].
核黄素在大量的生物化学过程中扮演着重要的多面角色,并因其新发现的功能而经常重新受到关注[1]-[11].自从1879年发现黄素并在1933年对其进行生化表征以来,人们对黄素在植物中的各种生理作用进行了广泛的研究[3.]、[53].特别是,在最近10年里,许多以前未被重视的功能被报道出来。例如,核黄素生物合成途径的基因修饰改变了植物发育的某些方面,如由茉莉酸信号通路的重要成分COS1蛋白调节的叶片衰老[54].事实上,COS1是lumazine合成酶[54],它催化核黄素生物合成途径的倒数第二步[55].有部分缺陷的拟南芥突变体COS1核黄素含量的部分降低损害了茉莉酸在叶片衰老中的调节作用[54].此外,在植物中,外用核黄素通过启动防御反应诱导对病原体的抗性,根据病原体的类型,生物营养性或坏死营养性,以水杨酸依赖或独立的方式。6]、[10].外用核黄素也可通过激活乙烯信号通路促进植物生长[56].这些结果表明,核黄素含量的变化通过影响植物激素信号通路引起生理和病理反应。通过本文的研究,黄素的新功能从细胞信号转导扩展到与光周期和开花时间基因表达相关的花期控制。
根据一些证据,光周期和开花时间基因的表达与rfbp诱导的开花有关(图4,5,6,7,8而且9).首先,RfBP+导致五个光周期基因的表达增强(巴,CRY1,CRY2,TOC1,有限公司),它们是开花激活剂[34]、[35]、[40,在漫长的白昼下,在树叶中4)或感应光周期(图7)条件。相比之下,PHYB是开花抑制因子[44]、[57),、与早开花表型和rbp增强的促花光周期基因表达相比,RfBP抑制了其表达(图4而且7).此外,CCA1在一天的早期高度表达,在一天的晚期表达下降(46,49),解释了为什么RfBP不能影响CCA1表达式。类似地,分配给自主、赤霉素和春化途径的基因与rfbp诱导的早开花无关(图4).第二,光周期基因的表达增强与光周期基因的表达增强相关英国《金融时报》叶子(数据5而且8).FT蛋白是一种发花原,它可以从叶片移动到茎尖。51]、[52],与FD一起激活AP1,促进花器官的生长[42]、[43].第三,同时加强表达英国《金融时报》光周期基因进一步与同步表达相关FD而且AP1在茎尖(图6,8,9的同步表达式FD而且AP1在嫩枝顶端开始花器官形成[42]、[43]、[58]、[59].RfBP在基因表达中的作用可归因于叶片中游离黄素水平的降低(图9).
由于黄素在许多生物化学过程中都有作用,因此很难阐明黄素浓度下调与光周期通路之间的功能关系。一个可能的中介因子是H2O2,是一种可通过拟南芥叶片内RfBP的重新表达和自由黄素含量下调诱导的细胞信号[11].H2O2与开花调节剂的相声有关[60实际上参与了花期的调节[61]-[64].例如,当胞质H2O2拟南芥中叶绿体脂氧合酶或抗坏血酸过氧化物酶的活性可提高其水平[61]、[62].由于RfBP对叶片中游离黄素浓度的下调诱导了H2O2信号及其从胞外到细胞质的转移[11],该信号可反过来促进开花[61]、[62].另外,H2O2可能是由于线粒体电子传递链中作为氧化还原中心的FMN和FAD的缺乏,导致线粒体电子传递链的电子泄漏而产生的[65]-[68].
结论
细致的表型观察表明,在短昼和长昼生长的转基因拟南芥植株中,RfBP的重新表达赋予了早开花的恒定特性。根据RfBP的相关分析,该表型是由叶片中游离黄素浓度的下调间接引起的+与RfBP+在长昼和诱导光周期下,核黄素喂养治疗的效果以及药理学后果。在这两种条件下,叶片黄素含量的降低诱导叶片中促花光周期基因的表达,与成花原基因的表达一致英国《金融时报》在叶片中,与开花调控基因同步表达FD以及花分生组织鉴定基因AP1在嫩枝顶端。我们没有证据表明黄素浓度的变化与任何植物调节剂之间的联系。事实上,我们发现早花现象是偶然的,但我们不知道这在光周期基因表达和开花时间控制方面意味着什么。
方法
植物生长条件及开花观察
植物在盛有盆栽土壤的花盆中生长[69在22±1℃、湿度55%、白天短或白天长、光强度为200 μM量子/m的环境控制条件下2/ s。开花表型的特征有两个标准:开花天数和莲座叶数[70].
基因表达分析
从两个最年轻的膨大叶或茎尖中分离总RNA,用组成型表达进行实时RT-PCR或Northern (RNA)印迹分析EF1α和/或Actin2基因作为引用。采用特异性引物进行实时RT-PCR(附加文件4:表S1)如上文所述[71]、[72].被测基因的表达水平被量化为该基因的转录量与的比值EF1α.北面的印迹杂交到RfBP-地高辛标记的特异性探针(Novagen, EMD Biosci。,公司,WI, USA)。
蛋白质分析
在转化构建过程中,在RfBP的c端添加了一个组氨酸(His)标签,用于镍色谱法纯化植物蛋白制剂[11].将两个最年轻的膨大叶片切除,并从10 mg新鲜叶片中分离总蛋白,如前所述[73].根据制造商的说明(Amersham Biosciences Corp., Piscataway, NJ, USA)将分离的蛋白质结合到镍聚苯乙烯珠上,分别用咪唑水溶液在100、150和300 mM洗脱。用Novagen Enterokinase Cleavage Capture Kit (EMD Biosciences Inc., Darmstadt, Germany)处理200-mM咪唑洗脱液,去除His标签,并用三辛十二烷基硫酸钠聚丙烯酰胺凝胶电泳分析[71].用考马斯氏G-250凝胶染色观察蛋白质。
黄素测量
所有的操作都在昏暗的光线下进行。核黄素、FMN和FAD是使用之前描述的方法提取的[11]、[74].将叶片样品(1 g/处理)与含5 mM NaH的2ml冷提取缓冲液A (pH6.9)在冰上研磨2阿宝4.2 h2O, 5 mM Na2HPO4.12小时2O, 0.2 M NaCl, 0.5 mM苯甲基磺酰氟,1mm乙烯-四乙酸。匀浆在4℃、12000 g离心10分钟。上清分为两组。第一组在上清液200 μl中加入10%三氯乙酸制成的缓冲液B 1 ml,用0.1 M醋酸铵(pH6.1)稀释。将混合物在室温下(12000 g, 10分钟)离心,将新的上清视为总黄酮制剂[74].第二组,500 μl上清液装入Microcon YM-3 (3 kDa NMWL)超滤自旋柱(Millipore, Billerica, MA, USA)。在4℃、14000 g条件下纺丝15分钟。取200 μl滤液倒入Eppendorf管中,加入缓冲液b 1 ml,室温(12000 g, 10分钟)离心,取上清液作为游离黄素的制备。用0.22 μm共混纤维素酯过滤器分别过滤总黄素和游离黄素。每20 μl滤液用高效液相色谱法分析[75安捷伦1200 HPLC系统(安捷伦科技公司,Santa Clara, CA, USA)。制剂中核黄素、FMN和FAD的浓度参照内标准相似分析确定[75,并与植物重量进行对比量化。
核黄素喂养实验
核黄素(EMD Biosci。,Inc., Darmstadt, Germany) feeding experiments were performed on plants grown under long day and inductive photoperiod conditions, respectively. Plants were treated by spraying over tops with an aqueous solution of 0.2 mM riboflavin, made in ultrapure water produced by the EliX10/Milli-Q Synthesis A10 ultrapure water system (Merck Millipore Corporation, Billerica, MA, USA), and treated similarly with ultrapure water in the experimental control group. Flavin measurements and gene expression analyses were performed on the two youngest expanded leaves. Flowering time and the rosette leaf number were monitored.
数据处理
所有的实验至少进行了三次,结果相似。定量数据采用IBM SPSS19.0软件包进行分析(IBM公司,Armonk, NY, USA;http://www-01.ibm.com/software/analytics/spss/),该教材详细描述了使用IBM SPSS19.0的分析方法[76].采用Levene检验确定数据的方差齐性,采用Kolmogorov-Smirnov检验和P-P图确定数据的形式分布模式[76].然后对数据进行方差分析和最小显著性差异检验[77].
作者的贡献
HJ和YZ进行了实验,分析了数据,并撰写了论文。ST和MX进行了实验并撰写了论文。分别由YT、LL、HW、LH、YJ、JG、WW进行实验。HD设计了实验并撰写了论文。所有作者阅读并批准了最终稿件。
附加文件
缩写
- AP1:
-
APETALA1
- CCA1:
-
昼夜CLOCK-ASSOCIATED1
- 有限公司:
-
君士坦斯
- 口号:
-
隐花色素
- 时尚:
-
黄素腺嘌呤二核苷酸
- 方法:
-
开花轨迹C
- FMN:
-
黄素单核苷酸
- FLM:
-
开花轨迹米
- 弗莱:
-
FRIGIDA
- 英国《金融时报》:
-
开花轨迹T
- 遗传算法:
-
赤霉素
- 盖:
-
遗传算法不敏感
- GA1:
-
GA要求1
- LD:
-
LUMINIDEPENDENS
- 体育:
-
光敏色素
- RfBP:
-
riboflavin-binding蛋白质
- RfBP+:
-
表达rfbp的转基因拟南芥系
- RfBP+:
-
RfBP沉默拟南芥系+背景
- SOC1:
-
CO1过表达抑制因子
- TOC1:
-
出租车的计时表达1
- VIN3:
-
春化不敏感3
参考文献
HJ:核黄素(维生素B-2)与健康。中华医学杂志。2003,32(4):359 - 359。
黄素的物理和化学性质。编辑:Rivlin RS.核黄素:静压出版社;1975:2-36。
Jordan DB, Bacot KO, Carlson TJ, Kessel M, Viitanen PV:植物核黄素的生物合成。菠菜lumazine合成酶的克隆、叶绿体定位、表达、纯化及部分特性研究。中国生物医学工程学报,1999,29(4):369 - 369。10.1074 / jbc.274.31.22114。
C:游离和糖基化B6维生素、硫胺素和核黄素在豌豆种子萌发过程中的动力学。食品科学学报,1999,39:307-310。10.1002 / (SICI) 1097 - 0010 (199902) 79:2 < 307:: AID-JSFA195 > 3.0.CO; 2 z。
核黄素影响草莓悬浮细胞氮培养花青素合成。食品科学与技术,1998,28(4):369 - 371。10.1111 / j.1365-2621.1996.tb12184.x。
董洪生,Beer SV:核黄素通过激活一种新的信号转导途径诱导植物抗病。植物病理学杂志,2000,30(4):359 - 359。10.1094 / PHYTO.2000.90.8.801。
de Souza AC, Kodach L, Gadelha FR, Bos CL, Cavagis AD, Aoyama H, Peppelenbosch MP, Ferreira CV:核黄素作为白血病细胞死亡的一种有希望的中介作用。细胞凋亡。2006,11:1761-1771。10.1007 / s10495 - 006 - 9549 - 2。
Taheri P, Höfte M:核黄素诱导水稻抗性丝核菌通过激活信号转导途径,导致水稻阳离子过氧化物酶的上调和木质素作为结构屏障的形成。中国生物工程学报,2006,29(5):561 - 561。
Taheri P, Tarighi S:核黄素诱导水稻抗性辣椒通过茉莉酸介导的苯丙烷通路启动。植物生理学报,2010,37(4):371 - 371。10.1016 / j.jplph.2009.08.003。
张士军,杨旭,孙文伟,孙芳,邓松,董红华:核黄素诱导的病原菌防御启动拟南芥.植物生物学杂志,2009,51:167-174。10.1111 / j.1744-7909.2008.00763.x。
邓伯林,邓松,孙峰,张世杰,董红华:游离核黄素含量下调诱导过氧化氢和病原菌防御拟南芥.植物生物学杂志,2011,32(4):381 - 381。10.1007 / s11103 - 011 - 9802 - 0。
Hamajima S, Ono S:海龟核黄素结合蛋白的cDNA序列:与鸟类核黄素结合蛋白的比较。中国生物技术学报,2004,24(3):369 - 371。10.1016 / 0378 - 1119 (95) 00535 - e。
重组鸡核黄素载体蛋白的生化表征。中国生物医学工程学报,2008,38(4):371 - 371。10.1007 / s11010 - 007 - 9604 - 5。
贝homme M, Hoffmann M, McCarthy EA, Gambonnet B, Moran RG, Rébeillé F, Ravanel S:植物叶酸代谢:an拟南芥哺乳动物线粒体叶酸转运体的同源物介导叶酸进入叶绿体。中国生物医学工程学报,2005,29(3):348 -348。10.1074 / jbc.M506045200。
Sabharanjak, Mayor:叶酸受体的内吞和转运。中国生物医学工程学报2004,56:1099-1109。10.1016 / j.addr.2004.01.010。
ROS在生物相互作用中的作用。植物工程学报,2010,38(4):414-429。10.1111 / j.1399-3054.2009.01326.x。
Rhodes MB, Bennett N, Feeney RE:蛋清的黄蛋白-载脂蛋白系统。中国生物医学工程学报,2004,24(3):356 - 356。
前桥凯,马野M,内野M,山本Y,高野K,渡边T:鸸鹋核黄素结合蛋白的初步结构(Dromaius novaehollandiae).生物化学学报(英文版),2009,29(5):559 - 561。10.1016 / j.cbpb.2009.02.004。
Storey KB, Dent ME, Storey JM:黑足蟾蜍冬眠期间的基因表达,Scaphiopus couchii:肝脏核黄素结合蛋白表达上调。中国科学(d辑),1999,38(4):369 - 369。10.1002 / (SICI) 1097 - 010 x (19990801) 284:3 < 325:: AID-JEZ10 > 3.0.CO; 2 - 4。
王德生,王德生,王德生,小林T, Kajiura-Kobayashi H, Matsuda M, Yoshikuni M, Nagahama Y:尼罗罗非鱼核黄素结合蛋白的分子克隆及基因表达,Oreochromis niloticus.水生生物学报,2003,29(4):326 - 326。10.1023 / B: FISH.0000030538.85034.e0。
Natraj U, George S, Kadam PA:人类核黄素载体蛋白的分离、部分表征及在人类怀孕期间该蛋白的估计。中华免疫学杂志1988,13:1-16。10.1016 / 0165 - 0378(88) 90044 - 7。
郑东宝,林慧敏,Pene JJ, White HB:鸡核黄素结合蛋白cDNA序列及其与牛奶叶酸结合蛋白的同源性。中国生物医学工程学报,1998,29(3):356 - 356。
Pattanaik P, Sooryanarayana, Adiga PR, Visweswariah SS:天然和重组鸡核黄素载体(或结合)蛋白的再折叠:活性蛋白生成过程中形成非天然中间体的证据。中国生物医学工程学报,1998,38(4):433 - 433。10.1046 / j.1432-1327.1998.2580411.x。
摩纳哥HL:鸡核黄素结合蛋白的晶体结构。中国科学(d辑:自然科学版)。10.1093 / emboj / 16.7.1475。
蛋白核黄素结合蛋白中的二硫键:化学还原研究。中国生物医学工程学报,2004,25(3):385 - 396。10.1111 / j.1432-1033.1982.tb05800.x。
Bartosík M, Ostatná V, Palecek E:核黄素结合蛋白的电化学及其与核黄素的相互作用。生物化学学报,2009,36(4):557 - 557。10.1016 / j.bioelechem.2009.04.006。
黄思恩,斯旺PW:核黄素细胞易位中受体介导成分的参与。中国药理学杂志,2000,29(4):394 - 394。
Foraker AB, Khantwal CM, Swaan PW:核黄素细胞吸收和转运的研究进展。Adv Drug delivery, 2003,55: 1467-1483。10.1016 / j.addr.2003.07.005。
Gastaldi G, Laforenza U, Casirola D, Ferrari G, Tosco M, Rindi G:能量消耗对分离的大鼠肠细胞吸收核黄素的膜运输和细胞内代谢有不同影响。中国生物医学工程学报,1999,29(4):359 - 361。
Mohammed ZM说:水溶性维生素的肠道吸收:最新进展。中华医学会杂志。2006,22:140-146。mog.0000203870.22706.52 10.1097/01.。
Adiga PR, Visweswariah SS, Karande AA, Velu NK:核黄素载体蛋白的生化和免疫学研究。中国生物医学工程学报,1988,13:87-104。10.1007 / BF02832215。
用差示扫描量热法研究核黄素结合蛋白与核黄素及其类似物的结合。中国化学学报,2000,19:523-528。10.1023 /: 1026509717268。
Sooryanarayana Sarkar S, Adiga PR, Visweswariah SS:鸡卵母细胞中核黄素载体蛋白受体的鉴定和表征。磷酸肽在受体相互作用中的作用。生物化学学报,1998,32(3):354 - 354。10.1016 / s0167 - 4838(97) 00155 - 6。
斯里坎斯A,施密德M:花期的规定:条条大路通罗马。细胞生物学与生命科学,2011,38(4):369 - 371。10.1007 / s00018 - 011 - 0673 - y。
郑,Müller AE:开花时间控制及其在植物育种中的应用。植物科学进展,2009,14:563-573。10.1016 / j.tplants.2009.07.005。
马塔斯- g 'ttgens E, Hedden P:赤霉素在植物调控网络中的作用。中国科学(d辑:自然科学版),2009,30(4):369 - 369。10.1093 / jxb / erp040。
Simpson GG:自主途径:拟南芥开花时间的表观遗传和转录后基因调控。植物生态学报,2004,7:570-574。10.1016 / j.pbi.2004.07.002。
puterill J, Robson F, Lee K, Simon R, Coupland G:康斯坦斯基因拟南芥促进开花并编码一种与锌指转录因子相似的蛋白质。细胞学报,1995,80:847-857。10.1016 / 0092 - 8674(95) 90288 - 0。
Turck F、Fornara F、Coupland G:成花原的调控与鉴定:开花位点T转移到中心阶段。植物学报,2008,29(5):573-594。10.1146 / annurev.arplant.59.032607.092755。
Más P, Yanovsky MJ:昼夜节律的时间:植物得到同步。植物学报,2009,12:574-579。10.1016 / j.pbi.2009.07.010。
考夫曼K,威尔默F, Muiño J, Ferrier T, Wuest S, Kumar V, Serrano-Mislata, Madueño F, Krajewski P, Meyerowitz E, Angenent G, Riechmann J: APETALA1的花起始编曲。科学通报,2010,32(5):561 - 561。10.1126 / science.1185244。
Abe M, Kobayashi Y, Yamamoto S, Daimon Y, Yamaguchi A, Ikeda Y, Ichinoki H, Notaguchi M, Goto K, Araki T: FD,介导芽尖花通路整合子FT信号的bZIP蛋白。科学通报,2005,29(4):359 - 359。10.1126 / science.1115983。
Wigge PA, Kim MC, Jaeger KE, Busch W, Schmid M, Lohmann JU, Weigel D:植物诱导过程中时空信息的整合拟南芥.科学通报,2005,29(3):359 - 359。10.1126 / science.1114358。
陈明,Chory J:光敏色素信号转导机制及其对植物发育的控制。细胞生物学进展,2011,21:664-671。10.1016 / j.tcb.2011.07.002。
Kircher S, Terecskei K, Wolf I, Sipos M, Adam E:光敏色素a的特异性信号通路拟南芥.植物信号学报,2011,6:1714-1719。10.4161 / psb.6.11.17509。
托马斯B:光信号和开花。中国生物医学工程学报,2006,29(5):369 - 369。10.1093 / jxb / erl071。
范·布斯柯克,德克尔,陈M:光信号中的光体。植物生理学报,2012,29(4):561 - 561。10.1104 / pp.111.186411。
Suárez-López P, Wheatley K, Robson F, Onouchi H, Valverde F, Coupland G: CONSTANS在生理时钟和开花控制之间起中介作用拟南芥.自然学报,2001,10:1116-1120。10.1038 / 35074138。
Martinez-Garcia JF, Huq E, Quail PH:光信号直接靶向启动子元素结合的转录因子。科学通报,2000,29(5):559 - 563。10.1126 / science.288.5467.859。
刘sk, Chung KS, Kim J, Lee JH, Hong SM, Yoo SJ, Yoo SY, Lee JS, Ahn JH:康斯坦斯通过开花位点T激活康斯坦斯1过表达抑制子促进拟南芥开花。植物生理学报,2004,24(3):366 - 366。10.1104 / pp.105.066928。
Corbesier L、Vincent C、Jang S、Fornara F、Fan Q、Searle I、Giakountis A、Farrona S、Gissot L、Turnbull C、Coupland G: FT蛋白运动参与花诱导的长距离信号传递拟南芥.科学通报,2007,36(4):359 - 359。10.1126 / science.1141752。
Jäger K, Wigge P: FT蛋白在拟南芥.中华生物学报,2007,17:1050-1054。10.1016 / j.cub.2007.05.008。
A链:逆行信号与植物胁迫:质体信号启动细胞胁迫反应。植物学报,2008,11:509-513。10.1016 / j.pbi.2008.06.002。
肖松,戴琳,刘芳,王铮,彭伟,谢东:一种拟南芥的COS1coronatine insensitive1茉莉素介导的植物防御和衰老的重要抑制因子。植物学报,2004,26(4):366 - 366。10.1105 / tpc.020370。
Roje S:维生素B在植物中的生物合成。植物化学学报,2007,29(4):441 - 441。10.1016 / j.phytochem.2007.03.038。
彭建林,赵杰,潘晓明,赵建军,董海生,王建军,刘伯祥,刘光宇,程玉杰:核黄素激活植物生长信号转导通路。南京农业大学学报(自然科学版),2002,25:33-36。
Reed JW, Nagatani A, Elich TD, Fagan M, Chory J:光敏色素A和光敏色素B在拟南芥发育中具有重叠但不同的功能。植物生理学报,2007,29(4):369 - 369。
cobesier L, Coupland G:花原的探索:最近的进展。中国机械工程学报,2006,29(3):369 - 369。10.1093 / jxb / erl095。
杰克T:花控制的分子和遗传机制。植物学报,2004,16:S1-S17。10.1105 / tpc.017038。
柴亮,王静,范铮,刘铮,文刚,李旭,杨燕:山茱萸花期的调控拟南芥通过类囊体抗坏血酸过氧化物酶。中国生物工程学报,2012,11:7151-7157。
Bañuelos GR, Argumedo R, Patel K, Ng V, Zhou F, Vellanoweth RL:植物发育向开花的过渡拟南芥与叶片叶绿体脂氧合酶活性的增加有关。植物生态学报,2008,32(4):366-373。10.1016 / j.plantsci.2007.12.009。
田中芳,田中芳,田中芳,等。温度对植物抗坏血酸过氧化物酶活性和开花的影响拟南芥不同光照条件下的生态型。植物生理学报,2003,24(3):366 - 366。10.1078 / 0176-1617-00990。
Shen CH, Krishnamurthy R, Yeh KW: l -抗坏血酸含量的降低主要是通过半乳糖醛酸途径介导的金蝶兰属植物.植物生理学报,2009,30(4):369 - 369。10.1093 /卡式肺囊虫肺炎/ pcp045。
Zafra A, Rodríguez-García MI, Alché JD:花发育过程中橄榄生殖组织中ROS和NO的细胞定位。植物生物学杂志,2010,10:36-10.1186/1471-2229-10-36。
植物线粒体中的活性氧和一氧化氮:起源和冗余调节系统。植物工程学报,2009,38(4):447-462。10.1111 / j.1399-3054.2009.01340.x。
Gill SS, Tuteja N:作物植物抗非生物胁迫中的活性氧种类和抗氧化机制。植物生理与生物化学。2010,48:909-930。10.1016 / j.plaphy.2010.08.016。
Gleason C, Huang S, Thatcher LF, Foley RC, Anderson CR, Carroll AJ, Millar AH, Singh KB:线粒体复合体II在线粒体源活性氧对植物胁迫基因调控和防御的影响中发挥关键作用。中国生物医学工程学报,2011,38(2):366 - 366。10.1073 / pnas.1016060108。
Puente-Maestu L, Tejedor A, Lázaro A, de Miguel J, Alvarez-Sala L, González-Aragoneses F, Simón C, Agustí A:慢性阻塞性肺疾病骨骼肌线粒体活性氧产生部位及其与运动氧化应激的关系中华呼吸细胞与分子生物学杂志,2012,47:358-362。10.1165 / rcmb.2011 - 0382摄氏度。
董海萍,于海林,鲍志林,郭新军,彭建林,姚铮,陈光宇,曲淑萍,董海生:abab2依赖性脱落酸信号通路控制着大豆hrpn诱导的耐旱性拟南芥.植物生态学报,2005,29(4):327 -327。10.1007 / s00425 - 004 - 1444 - x。
何毅、唐荣荣、郝毅、Stevens RD、Cook CW、Ahn SM、Jing L、Yang Z、Chen L、Guo F、Fiorani F、Jackson RB、Crawford NM、Pei ZM:一氧化氮抑制拟南芥植物的过渡。科学通报,2004,31(4):368 - 371。10.1126 / science.1098837。
陈亮,钱娟,曲淑萍,龙建勇,尹强,张春林,吴晓军,孙峰,吴廷强,Hayes M, Beer SV,董洪生:水稻黄单胞菌harpin HpaGXooc特异性片段的鉴定。稻瘟病属,能诱导植物抗病并促进生长。植物病理学杂志,2008,38(4):381 - 381。10.1094 /发朵- 98 7 - 0781。
刘荣祥,陈琳,贾志华,Lü BB,史海军,邵世力,董红华:转录因子AtMYB44调控诱导表达乙烯INSENSITIVE2基因拟南芥对harpin蛋白的反应。植物学报,2011,24:377-389。10.1094 / mpmi - 07 - 10 - 0170。
桑松林,李新军,高锐,尤志忠,Lü BB,刘培强,董红霞:harpin蛋白Hpa1的胞外发育与细胞质定位Xoo语在H中扮演不同的角色2O2病原菌的产生与耐药拟南芥.植物杂志2012年,79:375 - 391。
Vorwieger A, Gryczka C, Czihal A, Douchkov D, Tiedemann J, Mock HP, Jakoby M, Weisshaar B, Saalbach I, Bäumlein H:铁同化和转录因子控制的植物核黄素合成。植物学报,2007,26(4):476 - 476。10.1007 / s00425 - 006 - 0476 - 9。
Dawson KR, Unklesbay NF, Hedrick HB:在交替热处理方法后,高效液相色谱法测定牛肉、猪肉和羊肉中的核黄素、烟酸和硫胺素。农业食品化学,1988,36:1176-1179。10.1021 / jf00084a012。
史隆伟:SPSS19.0从偶然到交谈的统计分析。北京:清华大学出版社。2012,19:109-143。
李新军,韩斌,徐爱梅,韩丽萍,赵媛媛,刘志亮,董红红,张春林:乙烯和赤霉素对harpin蛋白Hpa1的响应共同调控植物生长及相关生理反应。植物生态学报,2014,29(4):447 - 447。10.1007 / s00425 - 013 - 2013 - y。
确认
本研究得到国家自然科学基金面上项目(31171830和31272072)、国家重点基础研究计划(973计划2012CB114003)、转基因生物新品种培育计划(2013ZX08002-001)、教育部111项目和江苏省高等教育学术重点项目的资助。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者声明他们没有竞争利益。
电子辅料
12870 _2014_237_moesm1_esm.doc
附加文件1:图S1。:Flowering characteristics of different RfBP-expressing Arabidopsis lines in comparison with the WT plant in long days. (DOC 222 KB)
12870 _2014_237_moesm2_esm.doc
附加文件2:图S2。:的effects of riboflavin feeding treatment on expression of photoperiod genes in long days. (DOC 328 KB)
12870 _2014_237_moesm3_esm.doc
附加文件3:图S3。:的effects of riboflavin feeding treatment on flavin concentrations in leaves under inductive photoperiod. (DOC 256 KB)
权利和权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。
本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。
欲查看此许可证的副本,请访问https://creativecommons.org/licenses/by/4.0/.
创作共用公共领域奉献放弃书(https://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
纪华,朱玉玉,田少华,田文华,田文华。et al。拟南芥叶片黄素含量下调诱导早花和光周期基因表达。BMC植物杂志14,237(2014)。https://doi.org/10.1186/s12870-014-0237-z
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-014-0237-z
关键字
- 核黄素
- 黄素
- 苗端
- 早期开花
- 黄素腺嘌呤二核苷酸