摘要
背景
PsbS是一种22kda的光系统(PS) II蛋白,参与叶绿素荧光的非光化学猝灭(NPQ)。大米(栽培稻l .)有两个公安局的基因,PsbS1而且PsbS2.然而,只有失活PsbS1通过敲除(PsbS1-KO)或在RNAi转基因植物中,导致植物缺乏qE (NPQ的能量依赖成分)。
结果
在本研究中,在波动的强光下,缺乏PsbS的幼苗生长受到阻碍,突变体离体叶片的PSII对光抑制光照比野生型更敏感。利用组织化学和荧光探针,我们测定了叶片和类囊体中活性氧种类的水平,包括单态氧、超氧化物和过氧化氢。缺乏psbs的植株在叶绿体中产生更多的超氧化物和过氧化氢。与野生型相比,从它们分离出的PSII复合体产生了更多的超氧化物,并且在突变体中PSII驱动的超氧化物产生更高。然而,无论是在孤立的PSI复合物中,还是通过PSI驱动的电子传输,我们都无法观察到这种差异。利用分离的类囊体进行的时间过程实验表明,超氧化物的产生是初始事件,过氧化氢的产生由此开始。
结论
这些结果表明,至少部分由PsbS和qE提供的光保护是通过阻止PSII在过量激发能条件下释放超氧化物来介导的。
背景
光能在光合作用中转化为化学能。然而,由于过多的光是有害的,植物参与多种保护机制,包括叶绿素(Chl)荧光的非光化学猝灭(NPQ)。NPQ被细分为三个组成部分,分别涉及在黑暗和光照下的弛豫动力学。第一个组分qE会迅速放松(在几秒钟到几分钟内),并由反式类囊体质子梯度(ΔpH)的增加触发。第二个成分qT松弛较慢,是一种状态过渡现象。最后一个成分qI是弛豫最慢的成分,是一个定义相当不明确的成分,传统上包括一个与不可逆损伤相关的非弛豫成分,如光系统(PS) II反应中心D1蛋白失活[1]、[2].最近,第三种非常慢的组分qZ被提出,它依赖于玉米黄质[3.].玉米黄质直接或间接参与除qT外的所有NPQ机制[2].
主要的组成部分qE取决于三个因素:ΔpH [4,叶黄素循环中的色素[5,以及一种名为PsbS的22 kda PSII蛋白[6].这些以综合的方式控制qE。尽管当一个因素缺失时,信号在很大程度上消失了,但在没有PsbS的情况下,qE仍然可以被诱导,尽管要慢得多[7].qE信号具有多种活性,例如在535 nm处的光诱导吸光度变化[8,将特定的Chl荧光寿命成分从~2.0 ns缩短到~0.4 ns [9,类胡萝卜素阳离子自由基的形成[10],或捕光复合体(LHC) II中新黄质分子构型的改变[11].吸光度和Chl荧光寿命的变化通常反映了类囊体膜色素-蛋白质复合物的结构变化。
PsbS蛋白在qE中的作用首次被描述在npq4-1突变体的拟南芥缺乏公安局[6].尽管这种蛋白质显然是qE所必需的,拟南芥完全缺乏PsbS的突变体在非波动光的受控环境条件下表现出正常的光化学反应,没有任何可见表型[6]、[12].然而,当在田间或实验室中快速波动的适度光照下生长时,这些突变体产生的种子比野生型植物少[13,也表现出生长迟缓[14].PsbS在qE发育中的作用尚不明确,其谷氨酸残基质子化在Chl荧光猝灭中的作用尚存争议[15]、[16].PsbS的两个类囊体腔暴露的谷氨酸残基感知pH值的变化[17并诱发控制qE的构象变化[18].PsbS似乎不能结合色素[19]但可能与CP29相互作用[20.]或诱导其构象修饰,以调节Chl/玉米黄质电荷转移态的能量[21].最近的数据提供了关于PsbS如何控制PSII超复合物的构象和组织的信息[22] - [25].最近有研究表明,PsbS在波动光下控制光合作用,从而优化光保护过程[26].
当NPQ被抑制时,可能会在叶绿体中产生更多的活性氧(ROS)。强活性氧包括高活性单线态氧[27]、超氧阴离子自由基和过氧化氢[28].生物和非生物胁迫条件导致ROS生成和清除之间的不平衡;这些累积的活性氧会对其产生部位附近的细胞造成损伤[29].尽管活性氧被多种抗氧化防御物质清除(例如,抗氧化酶和抗氧化剂,如抗坏血酸、生育酚和谷胱甘肽;[30.]、[31]),活性氧水平可随环境变化而迅速上升[32].由于活性氧具有高度活性的性质,它能与生物有机体中的各种分子发生反应,并能破坏这些分子,其结果可能对细胞甚至植物是致命的[33].
叶绿体中ROS的主要来源是电子传递链;每个ROS的生成位置取决于施加的应力[30.]、[34]、[35].单线态氧是光合作用的副产物,主要形成于PSII [36],也在其他产生三联Chl分子的位置。一般来说,光合作用装置中有三个不同的位点与单重态产氧有关:i) PSII反应中心;ii)大型强子对撞机的天线,及iii) PSI受体部位[37].单线态氧对PSII反应中心D1蛋白的破坏作用已被充分理解[38]、[39].然而,单线态氧如何影响类囊体膜的其他成分却知之甚少。产生的单线态氧流感突变体的拟南芥强烈影响ATP合酶活性并引起NPQ的变化,尽管其产生位点与上述不同[40].水水循环被认为是PSI降低方面产生超氧化物的主要来源,通过提高电子传输速率和降低腔内pH值,帮助植物耗散多余的光能[41] - [43].也有报道在PSII中产生超氧化物[44] - [46].下一个生产超氧化物的地点是质体醌池[47].在那里,超氧化物被超氧化物歧化酶(SOD)迅速歧化为更稳定的过氧化氢[28].如果类囊体膜内产生超氧化物[48在没有SOD的地方,过氧化氢可以通过质体对苯二酚PQH还原超氧化物而产生2[47]、[49],同样的途径也发生在线粒体膜内[50].
为了阐明PsbS蛋白在NPQ光保护机制中的作用,我们研究了消除该蛋白的后果,特别是对ROS产生的影响。我们发现PSII在敲除psbs水稻叶片中产生的超氧化物高于野生型叶片。然而,PSI产生的超氧化物水平在突变体和野生型植物之间没有差异。因此,我们认为当多余的能量被PSII天线吸收时,PsbS可以防止PSII产生超氧化物。
结果
水稻PsbS敲除株的分离及PsbS RNAi转基因植株的生成
水稻基因组有两个公安局基因——OsPsbS1(LOC_Os01g64960)在染色体1和OsPsbS2(LOC_Os04g59440)在第四号染色体上[51].OsPsbS1而且OsPsbS2分别编码268和254个氨基酸的蛋白质。拟南芥PsbS (AtPsbS)与OsPsbS1的序列相似性为68%,与OsPsbS2的序列相似性为71%;这两种大米蛋白质彼此之间显示出72%的氨基酸一致性。
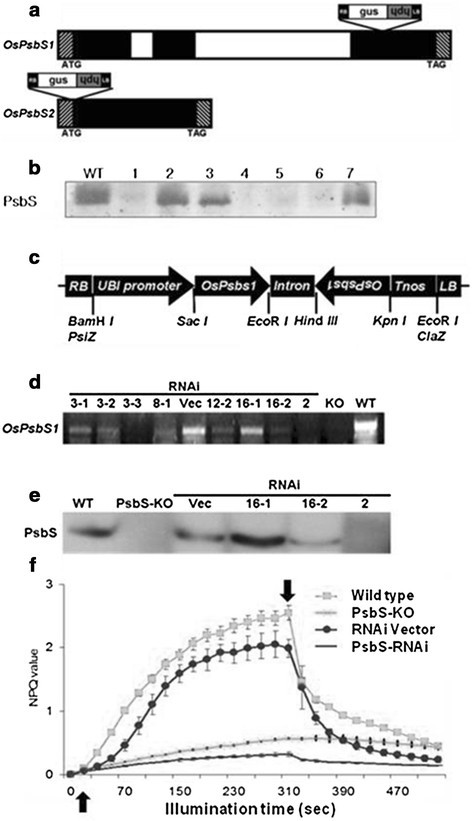
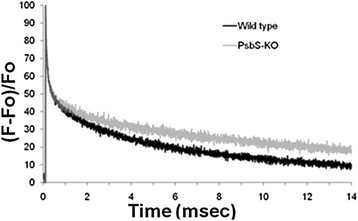
我们选择PsbS-KO,一个假定的敲除突变体OsPsbS1从一组T-DNA插入水稻系中提取。它是由含有一个无启动子的T-DNA载体(pGA2707)转化而成格斯T-DNA左缘(LB)旁的基因[52].通过反向聚合酶链反应(pcr)对该插入区侧翼区域进行测序[53的第3外显子中插入了T-DNAOsPsbS1(图1a).通过基因分型T2代,选择4个纯合子植株进行T-DNA插入。PsbS1系的基因分型结果见附加文件1:图S1。用来自AgriSera的PsbS特异性抗体进行Western blotting表明,所有四种纯合突变植物都缺乏PsbS(图1b).在这些植物中,在5分钟内形成的NPQ值约为0.4(图4)1F),这与报告的拟南芥npq4-1突变体(54].更详细的NPQ弛豫(即已发展的NPQ暗恢复)分析表明,PsbS-KO叶片完全缺乏qE。
PsbS-KO和PsbS-RNAi水稻植株的特性。(一)水稻PsbS基因和T-DNA插入位置示意图。外显子用阴影表示,内含子用开框表示。为OsPsbS1, T-DNA插入第3外显子;为OsPsbS2T-DNA被插入到外显子的起始处。(b)纯合子和杂合子植物的Western blot分析。用PsbS特异性多克隆抗体检测PsbS蛋白。的T2代,第1 ~ 7行分离OsPsbS1植物。(c)水稻PsbS-RNAi载体示意图。RB,右边界;UBI启动子,泛素I启动子;OsPsbS1, PsbS基因编码区一个独特的102 bp片段的反向重复;内含子,204 bp部分的3理查德·道金斯OsEMF1基因内含子(AF326768);Tnos,诺帕林合酶终止剂;磅,左边界。(d)野生型、PsbS- ko、PsbS- rnai和载体水稻的PsbS基因转录水平。数字表示PsbS-RNAi转化子的谱线。(e)ppsbs - rnai转化子和载体水稻的Western blot分析。以野生型(WT)和PsbS-KO植物为阳性对照和阴性对照。(f)叶片光诱导NPQ的产生(光化光强度:700μ摩尔光子米-2年代-1).向上箭头,灯打开;向下箭头,灯关闭。每个点代表至少4次实验的平均值(SD以柱表示)。NPQ的计算方法参见方法。
一株KO突变植物OsPsbS2也从T-DNA插入系中选择。它的侧翼序列显示T-DNA插入了它的起始密码子附近的唯一外显子(图1a).该水稻基因产物与AtPsbS具有非常高的序列相似性,将黄化的幼苗暴露在红蓝光下诱导其稳定水平增加数倍OsPsbS2成绩单(55].然而,该水稻突变体相对于野生型没有表现出明显的表型偏差,其NPQ水平也非常相似。没有OsPsbS2产品发现于OsPsbS1当使用两种不同的psbs抗体时,可以敲除突变植物,这表明这种产物不能被这些抗体检测到。这可能是由于OsPsbS的免疫特性和拟南芥蛋白质不同于蛋白质OsPsbS2基因产物或者编码的蛋白质OsPsbS2不会在叶绿体中积累。这些数据也与之前的基因证据一致OsPsbS1,但不是OsPsbS2,与NPQ的QTL共定位[56].因此,我们接下来的描述只关注于OsPsbS1,我们称之为OsPsbS从今以后。
证实PsbS-KO叶片的NPQ降低是由于插入OsPsbS1而不是通过插入多个t - dna或其他遗传差异,我们使用RNA干扰(RNAi)技术产生了显著降低PsbS蛋白水平的转基因水稻。植物用RNAi结构进行转化,该结构包含一个独特的102 bp的倒置重复区域OsPsbS1, pBSIIKS载体的一部分作为连接子,由泛素I启动子驱动(图1c).用RT-PCR法筛选转化子OsPsbS1成绩单(图1d)并经western blotting验证(图1e).从这些中,我们确定了3个不同的RNAi系OsPsbS1转录和PsbS蛋白水平。其中,2号线几乎不产生psb。其NPQ开发水平(图1f)及其对应的光曲线(附加文件1:图S2)与从PsbS-KO线中发现的结果相当。然而,电子传输速率在所有调查样品和野生型样品之间是相似的1:图S3)。
水稻植株缺乏PsbS蛋白导致对光抑制照明的敏感性增加
在整个工厂的水平上,一个拟南芥突变体(npq4-1)缺乏PSII蛋白的PsbS除了在振荡光下或田间生长时适应度降低外,没有可见的表型[13]、[14].我们还观察到PsbS-KO和PsbS-RNAi水稻植株在波动光下的生长速率显著降低1:图S4),且PsbS-KO植株的籽粒产量仅为野生型报告的约30% [57].在强光照(1200 μmol光子m-2- s-1白光),npq4-1变得比野生型植物更容易受到光抑制[58].当我们将叶片片段暴露在光抑制照明(2000 μmol光子m-2- s-12小时),水稻PsbS-KO突变株和RNAi植株的Fv/Fm计算值急剧下降,约为暗适应对照的40%(图2a).野生型的Fv/Fm降低到暗适应对照的55%左右。在所有的植物类型中,这种下降在处理1小时内基本完成,此后没有观察到进一步的下降(图1)2A,b -闭合符号)。最初Fv/Fm的下降可能是因为PSII的光损伤发生得比修复得快。此外,这一下降速率在1小时后的显著降低是由于PSII恢复过程的激活[59]、[60].PsbS-KO和RNAi叶片的初始光损伤率均明显高于野生型;然而,无论基因型如何,恢复似乎以类似的方式被激活(图2a、b)。
光抑制是一个复杂的过程,包括光损伤、PSII D1蛋白的修复和活性PSII的重组[61].林可霉素是叶绿体中蛋白质合成的一种抑制剂,它能使人们孤立地评估这一过程。在此,林可霉素处理下,PsbS-KO和PsbS-RNAi叶片的光损伤率均高于处理的野生型。恢复过程的阻断意味着三种植物类型的Fv/Fm持续下降,直到达到暗适应值的10%左右。这说明PsbS-KO和PsbS-RNAi叶片更容易受到PSII光损伤。
为了监测光抑制后叶片片段在没有林可霉素的情况下是如何恢复的,我们测量了在昏暗光(50 μmol光子m)下暴露2小时后的Fv/Fm的变化-2年代-1)在室温下。试验光照使PsbS-KO和野生型叶片的Fv/Fm值分别降低了40%和50%。经过2h的恢复期,PsbS-KO、PsbS-RNAi和野生型的Fv/Fm分别达到其暗适应值的82%、84%和90%(图1)2c).这说明在PsbS-KO和PsbS-RNAi叶片中,包括修复和重组在内的恢复过程是正常的。
缺乏psbs的水稻叶片产生的超氧化物和过氧化氢较多
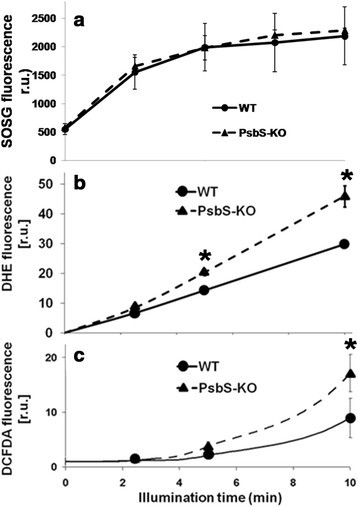
单线态氧是光合作用的副产物,主要在强光条件下PSII形成[36].由于我们的数据表明PsbS-KO和PsbS-RNAi水稻对光抑制的敏感性增加,我们使用专门检测单态氧的单态氧传感器绿色(SOSG)测量了野生型PsbS-KO和PsbS-RNAi叶片的单态氧产量[62]、[63].在这里,它的荧光发射在野生型植物中通过光抑制照明增加了近4倍,并且在PsbS-KO或PsbS-RNAi叶片中SOSG荧光发射的增加与野生型没有显著差异(图)3.a).使用丹西尔- 2,2,5,5,-四甲基- 2,5 -二氢也可以得到非常相似的结果H-pyrrole (DanePy)(数据未显示)。
水稻中ROS的产生。(一)叶片中单线态氧的检测,通过增加SOSG荧光发射在530纳米处进行监测。叶片切片用200μM SOSG溶液,然后在2000度照明μ摩尔光子米-2年代-1.(b)超氧阴离子自由基的产生。野生型(WT), PsbS-KO和PsbS-RNAi叶片在黑暗下孵育2小时(暗),在中等光照下200-摩尔光子米-2年代-1(LL),或在2000光抑制照明下μ摩尔光子米-2年代-1(HL)。(c)产生过氧化氢。用DAB对野生型(WT)、PsbS-KO和PsbS-RNAi叶片进行组织化学染色,在对照条件(黑暗)下,在中等光照下200℃μ摩尔光子米-2年代-1(LL),或在2000光抑制照明2小时后μ摩尔光子米-2年代-1(HL)。实验重复4-6次,显示代表性图像。
由于缺乏PsbS的植物在高光诱导下产生的单线态氧并不比野生型植物高,我们测量了其他ROS的水平,包括超氧化物和过氧化氢。我们用硝基蓝四唑(NBT)对水稻叶片进行组织化学染色,观察前者的生成(图)3.b).在适应深色的样品中,各基因型间无差异,但PsbS-KO和PsbS-RNAi叶片在2000 μmol光子m时均被染成深蓝色-2年代-1.即使在中等光强(200 μmol光子m-2年代-1), PsbS-KO和PsbS-RNAi叶片的超氧化物积累量均高于野生型。
超氧化物被超氧化物歧化酶迅速歧化为更稳定的过氧化氢[28].因此,我们通过3,3’-二氨基联苯胺(DAB)的组织化学染色,测量了野生型、PsbS-KO和PsbS-RNAi叶片的过氧化氢产量(图)3.c).在2000 μmol光子的光抑制照明下-2年代-1处理2 h后,PsbS-KO和PsbS-RNAi叶片中过氧化氢含量均高于野生型。
为了证实这一结果,我们分别使用DanePy、二氢乙啶(DHE)和2′、7′-二氯荧光素二乙酸(DCFDA)共聚焦激光扫描显微镜,在高分辨率下观察了单线态氧、超氧化物和过氧化氢的产生(附加文件)1:图S5-7),结果与组织化学染色观察结果基本一致。
超氧化物的产生是初始事件
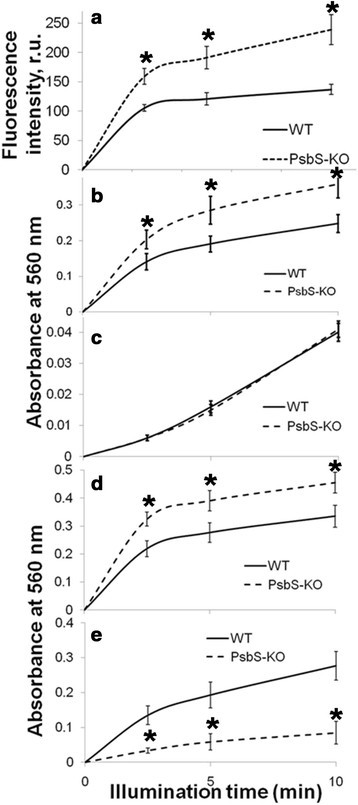
为了验证用叶片片段得到的结果,我们用700 μmol光子m测定了光照前后分离的类囊体中3种ROS的水平-2年代-1虽然SOSG荧光发射随光照而增加,但PsbS-KO与野生型植物在单线态产氧方面没有显著差异(图1)4a).为了更准确地检测超氧化物,我们监测了DHE荧光的增加,因为它已被证明可以在完整细胞和分离的亚细胞组分中检测超氧化物[64] - [66].DHE用于测定超氧化物的适用性也得到了验证,证明其荧光呈剂量依赖性增加[64].在超氧化物的情况下,在615 nm处的荧光发射持续10分钟呈线性上升,并且PsbS-KO类囊体的增加速率几乎是野生型的40%(图)4b).对于过氧化氢,类囊体中的DCFDA荧光在PsbS-KO类囊体中增加得更快(图4c).然而,过氧化氢的产生是在超氧开始产生2 - 3分钟后开始的。这说明大部分过氧化氢是由超氧化物转化而来,说明PsbS-KO植物中过量产生的ROS主要是超氧化物而不是过氧化氢。此外,通过分别测量560 nm NBT吸光度和450 nm DAB吸光度下的超氧化物和过氧化氢水平,验证了使用荧光传感器获得的结果1:图S8)。
PSII在PsbS-KO水稻叶片中产生的超氧化物多于野生型叶片
在压力下,超氧化物被认为主要在PSI中产生[41]、[43].在这种情况下,PsbS-KO水稻植株的PSI在光抑制光照下应该比野生型植株更受损伤,在光抑制光照下产生的超氧化物更多。在光抑制照明下,P700下降+PsbS-KO的形成并不大于野生型[67,尽管前者产生了更多的超氧化物。PSII粒子照射10分钟后DHE荧光的增加在PsbS-KO叶片中更高(图5一个)。
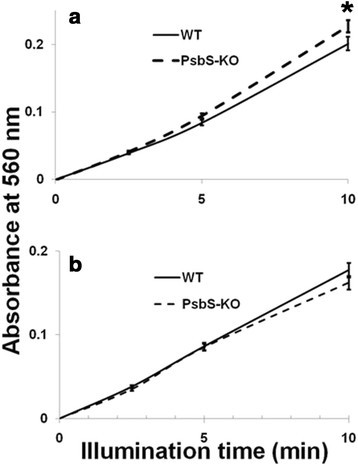
通过测量NBT在560 nm处吸光度的变化,这些结果再次得到证实,使用沿着蔗糖梯度分离的PSI和PSII颗粒[68].如图所示5b,c, PSII粒子在PsbS-KO中的超氧化物产量高于野生型植物,而在PSI复合物中的超氧化物产量在两种基因型中相似。由于PSII颗粒中产生的超氧化物更多,我们使用Western blotting比较了PSI和PSII蛋白的蛋白质组成1:图S9)。虽然BBY粒子被PSI蛋白污染,但它们的数量没有显著差异,不会影响超氧化物的产生。我们还使用相应的供体-受体对测量了PSI和psii驱动的类囊体超氧化物生成。正如预期的那样,psii驱动的产量在PsbS-KO中更高5d).令人惊讶的是,PsbS-KO类囊体的psi驱动产量较低(图5e).通过测量NBT在560 nm吸光度的变化来验证这些结果。当我们用NADP代替时+作为一种电子受体,PsbS-KO类囊体中全链驱动的超氧化物产量再次更高(图6a).然而,在这些类囊体中,psi驱动的产量较低6b).据推测,这种下降是PsbS-KO植物中围绕PSI的循环电子流激活的结果[67].
为了确保超氧化物产生的差异不是由于电子传输速率的差异,我们用克拉克型电极测量了所有样品的电子传输速率(表1).正如预期的那样,我们没有观察到野生型和PsbS-KO类囊体之间的显著差异。此外,分离的PSI和PSII样本显示出相似的比率。尽管在光抑制光照2小时后,野生型和PsbS-KO叶片的Fv/Fm有所不同(图2a),我们无法观察到两种植物在光照下的电子传输速率之间的差异1:图S3)。事实上,在700 μmol光子m的照射下,我们也无法观察到这两种植物之间的差异-2年代-1两种类囊体的Fv/Fm均比初始值下降40%。综上所述,我们的数据表明,在没有qE的情况下,多余的能量通过电子传递反应释放到分子氧中。在PsbS-KO叶片中观察到的表型可能是PSII中超氧化物生成增加的结果。
超氧化物可以在PSII的不同位点产生,如通过细胞色素b参与的循环电子流产生559[46或在Q一个网站(45].因此,我们测量了细胞色素b的氧化还原状态559以及Q的再氧化一个-野生型和PsbS-KO叶。高电位型细胞色素b的氧化还原差异谱在基因型间无显著差异559在贫锰PSII复合体(附加文件1:图S10)。然而,我们观察到Q是不同的一个-在野生型和PsbS-KO类囊体中经过一次翻转闪光后,用Chl荧光衰减测量再氧化动力学(图1)7额外的文件1:表S1)。
讨论
在本研究中,我们利用生物物理、生物化学、生理和分子生物学方法对PSII缺乏PsbS蛋白的水稻植株进行了表征。我们的目的是阐明PsbS在NPQ qE组分光保护机制中的作用。我们证实了之前的结论,缺乏psbs的植物缺乏能量依赖性猝灭[57]、[69].此外,我们证明了i)在强光胁迫下,缺乏psbs的植物产生更多的超氧化物,其次是产生更多的过氧化氢,而不是单态氧;ii)在恒定光照下,PSII(而非PSI)中心对光氧化应力更加敏感;与野生型相比,PsbS-KO植株中PSII产生了更多的超氧化物,可能发生在Q一个网站。因为在水稻和水稻中,PsbS的功能可能是相似的拟南芥,我们相信我们的数据为PsbS和qE类型的NPQ的作用提供了新的见解。
虽然qE是高等植物光合器官的主要光保护机制;它的缺失会影响PSII的光化学效率。然而,在水稻中,在恒定光照条件下,这种影响似乎可以忽略不计拟南芥[6].然而,在波动光照下,缺乏psbs的水稻植株在苗期生长迟缓1:图S4)和生殖阶段适应度降低[57],这与报告的拟南芥[13].这些减少很可能是由于缺乏PsbS的植物氧化应激增加造成的,尽管可能导致这种效应的ROS物种仍不清楚。
苔藓的三重突变体,Physcomitrella金属盘, (公安局lhcsr1 lhcsr2)缺乏NPQ的三联体叶绿素稳态水平远高于野生型[70]表明在没有NPQ的情况下单线态氧的水平也应该更高。然而,在光抑制早期,当单独降低Q一个是可逆稳定的,三重态叶绿素在与Q一个-,防止有害单线态氧的形成[71].我们假设我们的实验条件与这种情况相似。在我们的实验中,在光抑制的早期阶段,我们不期望对突变体有更多的损伤(图2a,b),因此,我们的结果是可以接受的,表明单线态氧水平在PsbS突变系中并不明显高于野生型。
单线态氧,被认为可以抑制D1蛋白的合成[72] - [74,不会在缺乏qE的植物中积累。相比之下,过氧化氢也会影响D1修复系统[72]、[75],损害光抑制照射下的细胞,并可能引起氧化爆发导致细胞死亡。在这里,过氧化氢和超氧化物在缺乏qE的水稻中产生更多。为了在体内和体外确定叶片组织中活性氧的准确水平,应采用多种方法并进行多种测量[76]、[77].在这里,我们使用了基于几种荧光染料和其他ROS传感器的检测系统。在超氧化物的情况下,所有使用NBT获得的数据都是使用DHE确认的,因为NBT作为PSII的电子受体([78], Krieger-Liszkay, Cedex,法国;(未发表的数据))。从我们的角度来看,使用NBT进行体外分析是可以接受的,因为在人工电子受体存在的情况下,电子转移到NBT将是最小的。因为即使在没有SOD酶的情况下,超氧化物也可以转化为过氧化氢,我们可以用最初超氧化物产生的增加来解释过氧化氢的增加。虽然我们不能排除在缺乏qE的水稻叶片中过氧化氢的合成也被提高的可能性,但我们的数据(最重要的是那些在孤立的类囊体上进行的时间过程实验)更好地解释了超氧化物的产生是否是最终导致过氧化氢形成的初始事件。一项平行研究报告了类似的数据拟南芥[79].在那里,荧光传感器用于类囊体,并在完整的叶子中测试了4-吡啶基-1-氧- n-叔丁基硝基自旋捕获的EPR,以检测过氧化氢/超氧化物产生的羟基自由基。此外,在20 μM的奈尼霉素存在下(消除了类囊体上的质子梯度,从而消除了qE),野生型和野生型之间的信号相似npq4这表明活性氧产生的增加是由于缺乏定量定量。
在强光条件下类囊体中产生超氧化物的主要部位被认为是PSI [43]、[80].然而,一些研究人员也证实了PSII中光诱导产生超氧化物[44] - [46].相反,我们发现,当分析PsbS-KO和野生型植物时,前者的叶子产生了更多的超氧化物。在我们对两种植物来源的比较中,我们发现只有PSII产生了更多的超氧化物,而不是PSI。此外,我们发现PSI在处理过的植物中似乎并没有引起更多的光损伤,我们还观察到PSII颗粒中产生了超氧化物。事实上,梅勒反应的证明主要参考了藻类的数据,而在高等植物中,由于梅勒反应在高等植物中的证明不足,其争议更大。獾等人。[81]回顾了一些关于高等植物、藻类和蓝藻的研究,这些研究试图量化O2不同条件下的通量及其对能量耗散的贡献。作者得出结论,梅勒反应不太可能支持C中的显著电子传输流3.和果酸代谢植物(可能少于10%)。因此,他们质疑梅勒反应是否是高等植物中ROS的重要来源[81].Driever和Baker完全证明了这种不确定性。82他没有发现任何证据表明在环境CO中存在显著的光驱动梅勒反应2两种植物的水平。此外,本研究中关于PSI中心ROS产量缺乏增加的数据将与高等植物体内梅勒反应很少发生的观点相一致。细胞色素b559也可能参与了PSII中超氧化物的生成,根据报道,超氧化物可以通过EPR光谱分析从细胞色素b559烟草突变体[46].用伏安法在孤立的类囊体中检测到超氧化物,表明当光合电子传递链过度还原时,可能在Q处产生超氧化物一个PSII的地点[45].改变问一个-re-oxidation动力学(图7额外的文件1表S1)表明,Q一个而不是涉及细胞色素b的循环电子流559,是PSII中的超氧化物产生位点。Q参与的另一个原因一个PSII在PsbS突变体中产生较高超氧化物可能是Q氧化还原电位的转移一个与A249S突变体相似的是,由于缺少PsbS,突变体变为负值Thermosynechococcus elongatus[83,这可以使Q一个-才能还原氧分子。因为在正常情况下Q的氧化还原电位一个/ Q一个-为-80 mV [84的氧化还原电位2/超氧化物为-160 mV [41].因为PsbS控制PSII超复合物的构象和组织[22] - [25],可以合理预测PsbS-KO叶片在PSII处产生的超氧化物多于野生型。PSII产生的超氧化物很可能很少受到关注,因为它很快就转化为过氧化氢,而且依赖于psbs的光耗散提供了如此高效的保护系统。在缺乏psbs的植物中,这种可能是qE在体内作用的重要组成部分的保护作用被削弱,从而促进了对超氧化物释放的检测。
结论
本研究表明,缺乏psbs的水稻植株为了弥补qE的缺乏,似乎发展了其他机制来释放多余的能量到分子氧中;这些保护系统最初可能是由PSII中的超氧化物产生触发的。研究拟南芥已经表明,这些系统也可以提供更广泛的保护,以对抗其他来源的压力。当在田间生长时,缺乏PsbS的植物诱导代谢和转录组转移,激活防御反应通路[85],从而增加对生物胁迫的抵抗力[79]、[85].这种反应是否影响缺乏PsbS的水稻突变体的易感性,就像它在拟南芥,仍有待确定。是否可以通过操纵NPQ水平来提高作物产量,这是一个悬而未决的问题[86].然而,NPQ的成本和收益之间错综复杂的相互作用显然没有导致选择NPQ水平“最高”的植物。光氧化过程的潜在积极影响[85]可能是有利于NPQ能力较弱的植物的一个因素,并可能有助于利用更少的可用资源为不断增长的人口实现粮食安全[87].我们希望未来的研究将提供一个更深入的理解,为什么光合光收集的调节已经如此优雅的组织。
方法
植物和生长条件
水稻1月龄野生型和PsbS-KO突变株幼苗(栽培稻L.)生长在pH为4.5-5.5的水稻土壤中;Nonghyup, SamhwaGreentech,首尔,韩国)在自然阳光下的温室里。生长条件包括16小时光周期和温度28/22±2°C(白天/晚上)。在一些实验中,水稻种子在固态琼脂Murashige和Skoog营养培养基(荷兰Duchefa Biochemie)上发芽和培养了一周。除非另有说明,在进行测量之前,植物应至少适应黑暗4小时。
OsPsbS-KO转基因水稻的分离
假设的psbs敲除突变株是从T-DNA插入敲除突变系中选择的。这些都是由含启动子较少的T-DNA载体(pGA2707)转化产生的格斯T-DNA LB旁的基因[52].实验采用T2代或其扩增子代分离的种子。T-DNA侧翼序列的确定如前所述[53].
用CTAB法从3周龄植物的叶片中分离基因组DNA [88].用Rtech®MM301混合磨机(Rtech GmbH and Co., Germany)提取叶片样品。基因分型时,用2 μg总DNA与基因组DNA特异性引物进行PCR反应OsPsbS1, 5 ' - ATCACCGGGAAGGGAATC -3 '(左)和5 ' - GTCGTCGCTGACGAA -3 '(右);和OsPsbS25 ' -AGCGTGAAGAGGATGAAGA-3 '(左)和5 ' -CCAAGAGAGCAAGCCAAGAT-3 '(右)。还使用了t - dna特异性引物集:5 ' -TTGGGGTTTCTACAGGAC-3 '和5 ' -AGAAGATCAAGGTGGGGACG-3 '。PCR扩增条件为95°C起始时间5min,随后95°C 1 min, 60°C 1 min, 72°C 1 min循环30次;最后在72°C下延伸10分钟。产物在含溴化乙锭的0.8% (w/v)琼脂糖凝胶上电泳分离。DNA条带用成像系统可视化(Vilber Lourmat,法国)。
OsPsbS RNAi转基因水稻的生成
为了生成OsPsbS1的RNA干扰载体,我们使用正向引物5 ' -ATAGGATCCCTCGAGCGCGCGGTGTCCGTCAAGAC-3 '和反向引物5 ' -GCGGAATTCAAGCTTGTCCTCGGTCTTGAACTTTG-3 '扩增了一个102 bp的基因片段。随后将该片段克隆到pFGL727 (pbsiks - intron)的XhoI-HindIII和BamHI-EcoRI位点。pBSIIKS-Intron-OsPsbS1的一个SacI-KpnI片段转移到pGA1611的SacI-KpnI位点上。将OsPsbS RNAi质粒转化到水稻中农杆菌属菌株LBA4404如前所述[89].
转录水平和免疫印迹分析
总RNA的分离如[90].基因特异性引物OsPsbS1用正向引物5 ' -CTGTTCGGCAGGTCCAAGAC-3 '和反向引物5 ' -TTCAGCTGCGCCAGGATTC-3 '进行扩增。PCR产物在1.2%琼脂糖凝胶上进行电泳分离。如前所述进行免疫印迹检测[91].
荧光和电子输运的测量
在经过10分钟(外加4小时)的暗适应后,用PAM2000脉冲振幅调制荧光计(Walz, Effeltrich, Germany)在室温下测量离体叶片的Chl荧光,该房间受空调系统的影响可以忽略不计。光化光由卤素灯(Schott KL1500,美因茨,德国)提供。用饱和白光脉冲(0.8 s, 5000 μmol光子m)诱导荧光参数Fm和Fm’-2年代-1).Fm和Fo分别定义为当所有PSII反应中心完全关闭或打开时,“暗适应”样品的最大和最小荧光产率。Fm'是在光化光照射下,用饱和光脉冲获得的最大荧光产量。我们用Fv/Fm[或(Fm - Fo)/Fm]来监测PSII光化学的潜在效率。光化学猝灭(qP)和NPQ参数由[92].电子输运率的计算方法如下:ETR = (ΔF/Fm ') x PAR x 0.5 × 0.84 [Δ .F= (Fm’- Ft)]假设PSI和PSII之间的激励分布相等[93].对于Q的动力学分析一个-单次翻转闪光后记录了野生型和PsbS-KO类囊体的再氧化、荧光衰变[94].数据归一化后拟合为三分量指数衰减方程。
P700的光氧化程度,P700+,通过在反射率模式下使用PAM101/102/103荧光计(德国Walz)评估吸光度(810 nm - 860 nm)的差异变化[95].经过5分钟的预光照(120 μmol m-2年代-1,光化白光),值为P700+计算为(I马克斯——我最小值) /我马克斯,在那里我马克斯为施加饱和远红光后的信号强度,I最小值是信号强度[93]、[96].这种预照明是为了克服任何可能阻止P700完全氧化的PSI受体端的限制。
Photoinhibitory治疗
为了使PSII在林可霉素和未林可霉素作用下受到光损伤,在体内用2000 μmol光子照射叶片片段,诱导光抑制-2年代-1叶片表面27°C的金属卤化物灯发出的白光。对于林可霉素处理,用2 mM林可霉素浸透叶片片段[97]孵育12 h,光抑制光照时,叶片片段漂浮在同一处理液上。样品的回收率保持在50 μmol光子m以下-2年代-1荧光灯发出的白光诱导受损PSII的修复。光抑制照射后,在荧光测量前对组织进行30分钟的暗适应,除非另有说明。
超氧化物和过氧化氢组织化学染色
如前所述,对ROS的产生进行组织化学染色[98] - [One hundred.,只是做了一些修改。为了进行超氧化物的测定,将叶片样品浸泡在含有50 mM磷酸钠(pH 7.5)的6 mM NBT溶液中12小时,在黑暗中。为了检测过氧化氢,将野生型和突变型植株的分离叶片浸泡在含有10 mM MES (pH值3.8)的5mm DAB溶液中12小时。用乳酸-甘油-乙醇(体积1:1:4)浸泡叶片并在水中煮沸5分钟,两种反应均停止。清除的叶片保存在50%乙醇中并拍照。
用荧光发射分析和活性氧传感器吸收测定孤立类囊体和光系统中的活性氧水平
用F-4500荧光分光光度计(日立,日本)获得了ROS传感器的荧光发射光谱。单线态氧在叶片和类囊体中均被检测到,如[62]、[63].为了检测超氧化物,我们根据[中描述的方法]检测了二氢乙二胺的荧光。64].采用DCFDA荧光法检测过氧化氢[101].将一个月大的幼苗的叶片片段在荧光传感器溶液中浸泡12至14小时(黑暗下25°C)进行渗透。
用UV-1650PC紫外可见分光光度计(日本岛津)测量每个ROS传感器的吸光度。为了检测超氧化物,在560 nm处测量NBT的吸光度,如[102].利用DAB在450 nm处的吸光度检测过氧化氢[103].
通过相应的给体-受体对监测PSI-和/或psii驱动的类囊体中的电子运输产生超氧化物。为了检测psii驱动的电子传递所产生的单个ROS的水平,我们使用了含有0.1 M蔗糖、10 mM NaCl、10 mM KCl和5 mM MgCl的反应缓冲液2, 10毫米Tricine, 1毫米KH2阿宝4、0.2%牛血清白蛋白(pH 8.0)。实验前立即向该缓冲液中加入以下成分:30mm抗坏血酸钠介导紫黄质去环氧化为玉米黄质;3 mM苯基对苯醌介导psii驱动的电子传递;0.3 mM ATP促进ATP水解。为了检测由psi驱动的电子传递所产生的单个ROS的水平,我们再次使用了上述缓冲液。在实验开始前立即加入以下成分:5 mM NH4Cl作为氧络合物的解耦剂;20 μM 3-(4,4-二氯苯基)-1,1-二甲基脲(DCMU)作为PSII电子传递抑制剂30mm抗坏血酸钠和0.1 mM 2,6-二氯酚-吲哚酚作为PSI的电子给体;50 μM甲基紫原或1 mM NADP+添加10 μM铁氧还蛋白介导线性电子传递;0.3 mM ATP促进ATP水解。添加了活性氧传感器:15 μM NBT用于检测超氧化物,15 μM DAB用于检测过氧化氢。所有实验中Chl浓度均为10 μg mL-1.样品被700 μmol光子m照亮-2年代-1光抑制。
类囊体和PSI、PSII复合物的分离及细胞色素b559的检测
从PsbS-KO和野生型植物中分离类囊体的方法参见[104].PSII配合物(BBY粒子)由Triton X-100纯化制备,如[105].这些颗粒储存在-80°C的再悬浮介质中,其中含有400 mM蔗糖,15 mM NaCl, 5 mM MgCl240 mM Mes (pH 6.5)。为了确认野生型和PsbS- ko植物中类囊体和BBY粒子的蛋白质组成(PsbS蛋白除外)没有太大差异,我们进行了SDS-PAGE考马斯色染色(附文件)1:图S11),结果表明野生型和PsbS-KO植物的蛋白质组成没有太大差异。高电位细胞色素b光谱的光诱导氧化还原变化559按[106].将BBY颗粒在0.8 M Tris (pH 8.0)中培养20分钟,制备出贫锰PSII配合物[46].之后,分离的PSII配合物在再悬浮介质中洗涤数次,并在-80°C保存。通过加入辛基葡萄糖苷(0.88% (w/v))和十二烷基硫酸钠(0.22% (w/v))使类囊体溶解后,用蔗糖梯度离心分离得到PSII和PSI配合物[68].通过对PSI和PSII使用相应的给体-受体对来监测这些孤立复合物中的超氧化物产生。在80%丙酮提取物中测定Chl的浓度,如[107].
作者的贡献
ISZ和CHL设计了研究并撰写了手稿;ISZ、AT、RSP、KN进行了实验和数据分析;YJE, BD, MH, MB, UCY, YHM, GA, SJ贡献了试剂/材料/分析工具。所有作者阅读并批准了最终稿件。
额外的文件
参考文献
- 1.
霍顿·P,鲁班·AV,沃尔特·RG:绿色植物光收获的调控。植物生理学报,1998,27(4):356 - 361。
- 2.
叶黄素循环和叶黄素在光系统II光保护中的作用。生物化学与生物物理学报,2004,25(3):347 - 347。
- 3.
Nilkens M, Kress E, Lambrev PH, Miloslavina Y, Müller M, Holzwarth AR, Jahns P:拟南芥叶绿素荧光非光化学猝灭的缓慢诱导玉米黄质依赖组分的鉴定。生物化学学报,2010,27(3):366 - 366。
- 4.
Müller P,李X-P, Niyogi KK:非光化学淬火。对多余光能的反应。植物生理学报,2001,29(3):359 - 359。
- 5.
Demmig-Adams B, Winter K, Krüger A, Czygan FC:日光和遮荫叶对二氧化碳同化和多余激发能耗散及玉米黄质含量的光响应。植物生理学报,2004,25(3):381 - 381。
- 6.
李雪萍,Björkman O, Shih C, Grossman AR, Rosenquist M, Jansson S, Niyogi KK:调控光合光收集必需的色素结合蛋白。自然学报,2000,403:391-395。
- 7.
Johnson MP, Ruban AV:缺乏PsbS蛋白的拟南芥植物具有光保护能量耗散。植物学报,2010,29(3):369 - 369。
- 8.
Ruban AV, Young AJ, Horton P:叶片非光化学能量耗散和吸收变化的诱导。体内光系统II的光收集系统状态变化的证据。植物工程学报,2003,24(3):381 - 381。
- 9.
Gilmore AM, Hazlett TL, Govindjee:光系统II叶绿素荧光的叶黄素循环依赖性猝灭:具有短荧光寿命的猝灭复合体的形成。中国科学:地球科学,1998,15(2):366 - 366。
- 10.
Holt NE, Zigmantas D, Valkunas L, Li X-P, Niyogi KK, Fleming GR:类胡萝卜素阳离子的形成与光合光捕获调控。科学通报,2005,37(4):433-436。
- 11.
Ruban V, Berera R, Ilioaia C, van Stokkum IHM, Kennis JTM, Pascal AA, van Amerongen H, Robert B, Horton P, van Grondelle R:高等植物光保护能量耗散机制的鉴定。自然学报,2007,45:575-578。
- 12.
Peterson RB, Havir EA:一种非光化学淬火缺陷突变体拟南芥具有正常的色素成分和叶黄素循环活性。植物学报,2000,29(4):447 - 447。
- 13.
Külheim C, Ågren J,杨松。田间收获光与植物适应性的快速调控。科学通报,2002,29(4):447 - 447。
- 14.
Krah NM, Logan BA:在温带光环境下生长的拟南芥(芸苔科)中,psbS表达的缺失会降低营养生长、繁殖产量和光限制(但不是光饱和)光合作用。中国机械工程学报,2010,38(5):644-649。
- 15.
Holt NE, Fleming GR, Niyogi KK:探讨绿色植物非光化学猝灭的机理。生物化学,2004,43:8281-8289。
- 16.
Niyogi KK, Li X-P, Rosenberg V, Jung H-S: PsbS是光合作用的非光化学猝灭位点吗?中国生物医学工程学报,2004,29(4):369 - 371。
- 17.
Li X-P, Gilmore AM, Caffarri S, Bassi R, Golan T, Kramer D, Niyogi KK: PsbS蛋白对类囊体腔内pH值的感知与光合光收集的调节有关。中国生物医学工程学报,2004,29(4):369 - 369。
- 18.
郑淑娟,黄永银,靳国娥,朴淑玉,Zulfugarov IS, Moon Y-H, Lee C-H,张树生:光系统II亚基S的表达和ph依赖性拟南芥.化学通报,2010,31:1479-1484。
- 19.
Bonente G, Howes BD, Caffarri S, Smulevich G, Bassi R:研究光系统II亚基PsbS与叶黄素的相互作用在活的有机体内而且在体外.中国生物医学工程学报,2008,29(4):434- 434。
- 20.
Teardo E, de Laureto PP, Bergantino E, Vecchia FD, Rigoni F, Szabò I, Giacometti GM:玉米类囊体中PsbS与光合复合物相互作用的证据。生物化学学报,2007,27(3):366 - 366。
- 21.
antk, Avenson TJ, Ballottari M, Cheng Y-C, Niyogi KK, Bassi R, Fleming GR:植物天线蛋白中调节光收集的电荷转移态的结构。科学通报,2008,32(4):394 - 397。
- 22.
Kiss AZ, Ruban AV, Horton P: PsbS蛋白控制高等植物类囊体膜中光系统II天线的组织。中国生物医学工程学报,2008,29(3):394 - 394。
- 23.
Kereïche S, Kiss AZ, kouielil R, Boekema EJ, Horton P: PsbS蛋白控制高等植物叶绿体颗粒膜中光系统II复合体的宏观组织。中国生物医学工程学报,2010,38(5):559 - 564。
- 24.
Lambrev PH, Nilkens M, Miloslavina Y, Jahns P, Holzwarth AR:拟南芥叶片多种非光化学猝灭成分的动力学和光谱分辨。植物生理学报,2010,32(4):371 - 371。
- 25.
Zulfugarov IS, Tovuu A, Dogsom B, Lee CY, Lee C-H:高等植物中psbs特异性玉米黄质蛋白独立的荧光发射光谱变化作为能量依赖性非光化学猝灭的标志。光化学与生物学报,2010,29(3):369 - 371。
- 26.
Hubbart S, Ajigboye OO, Horton P, Murchie EH:光保护蛋白PsbS对CO的调控作用2水稻在波动光下的同化率。植物学报,2012,29(4):366 - 366。
- 27.
单重态分子氧的物理和化学性质。化学学报,1997,21(4):395-427。
- 28.
超氧阴离子自由基(O-2)、超氧化物歧化酶及相关物质。J临床生物化学1997年,272:18515 - 18517。
- 29.
Hideg É, Barta C, Kálai T, Vass I, Hideg K, Asada K:光抑制或紫外线辐射胁迫下叶片单线态氧和超氧化物荧光传感器检测。植物生理学报,2002,32(4):354 - 354。
- 30.
门厅CH,夜行者G:叶子在黑暗中看到光明。科学通报,1999,34(4):359 - 361。
- 31.
Mittler R:氧化应激,抗氧化剂和抗应激能力。植物生态学报,2002,27(4):489 - 489。
- 32.
王晓燕,王晓燕,王晓燕。抗氧化剂、氧化损伤与缺氧应激的研究进展。科学通报,2003,29(4):394 - 394。
- 33.
活性氧是植物和动物细胞程序性死亡的中介。中国生物医学工程学报,1999,29(5):561 - 561。
- 34.
Laloi C, Apel K, Danon A:活性氧信号:最新消息。植物生态学报,2004,7:323-328。
- 35.
Mittler R, Vanderauwera S, Gollery M, Breusegem V:植物活性氧基因网络。植物生态学报,2004,29(4):489 -498。
- 36.
特费尔,Bishop SM, Phillips D, Barber J:光系统ii的孤立光合反应中心作为单线态氧检测和用化学捕获技术测定量子产率的敏化剂。中国生物医学工程学报,1994,29(4):394 - 394。
- 37.
Niyogi KK:重新审视光保护:基因和分子方法。植物生理学报,1999,30(5):359 -359。
- 38.
Keren N, Berg A, van Kann PJM, Levanon H, Ohad I:微光下光系统II失活和D1蛋白降解的机制:回电子流的作用。中国科学:地球科学,1998,19(3):369 - 369。
- 39.
Trebst A:功能β-光系统II中的胡萝卜素和生育酚。中国生物工程学报,2004,25(3):359 - 361。
- 40.
Mahler H, Wuennenberg P, Linder M, Przybyla D, Zoerb C, Langraf F, Forreiter C:单重态氧影响类囊体ATP合酶的活性,并对其有很强的影响γ亚基。植物生态学报,2007,29(4):473 - 476。
- 41.
浅田K:叶绿体中的水循环:清除活性氧和耗散多余的光子。植物生理学报,1999,30(5):369 - 369。
- 42.
浅田K:叶绿体中活性氧的产生和清除及其功能。植物生理学报,2006,31(4):391-396。
- 43.
Sonoike K:光系统I的光抑制和保护光系统I:光合作用中的质体青素:铁氧还蛋白氧化还原酶。编辑:Golbeck GH。多德雷赫特施普林格;2006:657 - 668。
- 44.
Ananyev GM, Renger G, Wacker U, Klimov VV:光系统II中超氧化物自由基的光还原和超氧化物歧化酶活性。细胞色素b559的可能参与。中国科学d辑,1994,31(3):327- 333。
- 45.
cleeland RE, Grace SC:用光系统II对超氧化物产生的伏安检测。中国生物医学工程学报,1999,38(4):388 - 388。
- 46.
Pospíšil P, Šnyrychova I, Kruk J, strzazka K K, nauic J:细胞色素b559参与光系统II中超氧化物的产生:合成短链质体醌在细胞色素b559烟草突变。物化学J2006年,397:321 - 327。
- 47.
Mubarakshina MM, Ivanov BN:叶绿体类囊体膜质体醌池中活性氧的产生和清除。植物工程学报,2010,30(4):359 - 361。
- 48.
Kozuleva M, Klenina I, Proskuryakov I, Kirilyuk I, Ivanov B:叶绿体类囊体膜中超氧化物的产生。不同亲脂性环羟胺的ESR研究。中国生物医学工程学报,2011,38(5):567 - 571。
- 49.
Kruk J, Jemiola-Rzeminska M, Burda K, Schmid G, Strzalka K:类囊体膜中质体喹啉和其他丙烯脂清除光系统I中产生的超氧化物。生物化学学报,2003,42:8501-8505。
- 50.
Maroz A, Anderson RF, Smith RAJ, Murphy MP:泛素酮和泛素醇与超氧化物和氢过氧自由基的反应:体内抗氧化活性的意义。中国生物医学杂志,2009,46:105-109。
- 51.
Umate P:拟南芥和水稻中捕光叶绿素a/b结合蛋白家族的全基因组分析。植物信号学报,2010,5:1537-1542。
- 52.
郑德华,安生,姜鸿贵,文硕,韩建军,朴硕,李红华,安凯,安高:利用T-DNA插入突变技术进行水稻激活标记。植物生理学报,2004,24(3):366 - 366。
- 53.
安硕、朴硕、郑D-H、李D-Y、康H-G、余J- h、Hur J、Kim S- r、Kim Y-H、Lee M、Han S- h、Kim S-J、Yang J、Kim E、Wi SJ、Chung HS、Hong J- p、Choe V、Lee H-K、Choi J- h、Nam J、Kim S- r、Park P-B、Park KY、Kim WT、Choe S、Lee C-B、An G:水稻T-DNA标记系末端序列数据库的生成与分析。植物生理学报,2004,24(3):366 - 366。
- 54.
李兴平,李志强,李志强,李志强,李志强:一种植物的分子和全局时间分辨分析公安局基因剂量对光系统中pH-和叶黄素循环依赖的非光化学猝灭的影响。中国生物医学工程学报,2002,27(4):359 - 359。
- 55.
Iwasaki T, Saito Y, Harada E, Kasai M, Shoji K, Miyao M, Yamamoto N:水稻光系统II (PSII-S) 22 kDa蛋白cDNA的克隆及光诱导表达分析。中国生物技术学报,1997,38(5):561 - 561。
- 56.
Kasajima I, Ebana K, Yamamoto T, Takahara K, Yaho M, Kawai-Yamada M, Uchimiya H:水稻非光化学猝灭遗传调控中的分子差异。中国生物医学工程学报,2011,38(2):359 - 359。
- 57.
顾海燕,Zulfugarov IS, Oh M-H, Moon Y-H, Jansson S, An G, Lee C-H:水稻PsbS蛋白在非光化学能量依赖性猝灭中的作用。光合作用:全球视角的基本方面:2004年8月30日- 9月3日。编辑:Est A, Bruce D. Allen出版社,蒙特利尔;2005:527 - 530。
- 58.
李雪萍,Müller-Moulé P,张晓燕,李晓燕:反馈去激励的psbs依赖性增强对光抑制的保护作用。中国生物技术学报,2004,22(3):366 - 366。
- 59.
Tyystjärvi A, Kettunen R, Aro E-M:体外光抑制速率常数与光系统II的天线尺寸无关,但与温度有关。生物化学学报,1994,32(4):347 - 347。
- 60.
Tyystjärvi E:光系统II的光抑制和出氧锰簇的光损伤。化学学报,2007,52:361-376。
- 61.
高春华,高世明,裴洪杰,金永杰:植物光合作用与环境的光抑制与修复机制。植物生物学杂志,2012,55:93-101。
- 62.
Dall 'Osto L, Cazzaniga S, Havaux M, Bassi R:通过蛋白结合与自由叶黄素池增强光保护:叶绿素b和叶黄素生物合成突变体的比较分析。植物学报,2010,3:576-593。
- 63.
德比安奇S,贝特勒N,库里尔R,卡扎尼加S,博克马E,巴西R,达尔奥斯托亚L:拟南芥光捕获蛋白Lhcb4中缺失的突变体光系统II的宏观结构被破坏,光保护功能有缺陷。植物学报,2011,23:2659-2679。
- 64.
Georgiou AD, Papapostolou I, Patsoukis N, Tsegenidis T, Sideris T:一种用于生物体内超氧自由基定量的超灵敏荧光测定方法。生物化学学报,2005,32(4):354 - 354。
- 65.
Robinson KM, Janes MS, Pehaf M, Monette JS, Ross MF, Hagen TM, Murphy MP, Beckman JS:使用基于乙胺的探针对体内超氧化物进行选择性荧光成像。中国生物工程学报,2006,29(3):447 - 447。
- 66.
白沙瓦属HM, Dusting GG, Selemidis S:二氢乙二胺荧光检测NADPH氧化酶产生的胞内和胞外超氧化物的分析。《放射学报》2007,41:699-712。
- 67.
李志强,李志强,李志强,李志强:循环电子流在水稻植株中的加速作用(栽培稻L.)缺乏光系统II的PsbS蛋白。植物生理学报,2014,34(4):369 - 369。
- 68.
Dunahay TG, Staehelin LA:从辛基葡萄糖苷/十二烷基硫酸钠溶解的菠菜类囊体中分离光系统I配合物。脂质体的表征和重组。植物生理学报,2004,25(3):366 - 366。
- 69.
石田S,森田K,岸井M,高林A,村上R,武田S,岛本K,佐藤F,远藤T: PSII吸收光能在水稻PsbS亚基存在或不存在时的热耗散分配。植物生理学报,2011,32(5):522 - 531。
- 70.
Carbonera D, Gerotto C, Posocco B, Giacometti GM, Morosinotto T: NPQ激活减少苔藓中叶绿素三胞态的形成Physcomitrella金属盘.生物化学与生物物理学报,2004,25(3):366 - 366。
- 71.
Noguchi T:三联体定位对光系统II反应中心副叶绿素的双重作用:D1蛋白的光保护和光损伤。植物生理学报,2002,32(4):369 - 369。
- 72.
Nishiyama Y, Yamamoto H, Allakhverdiev SI, Inaba M, Yokota A, Murata N:氧化应激抑制光损伤对光合机制的修复。中国生物医学工程学报,2004,19(5):557 - 557。
- 73.
Nishiyama Y, Allakhverdiev SI, Yamamoto H, Hayashi H, Murata N:单重态氧通过抑制Synechocystis sp PCC 6803 D1蛋白的翻译伸长抑制光系统II的修复。生物化学,2004,43:11321-11330。
- 74.
Nishiyama Y, Allakhverdiev SI, Murata N:活性氧在光系统光抑制作用中的新范式II。生物化学学报,2006,27(4):742-749。
- 75.
高桥,村田。环境压力是如何加速光抑制的?植物科学进展,2008,13:178-182。
- 76.
Tarpey MM, Fridovich I:血管反应种的检测方法。一氧化氮,超氧化物,过氧化氢,丙亚硝酸盐。中国证监会第2001,89:224-236号决议。
- 77.
Zulfugarov IS, Tovuu A, Kim J-H, Lee C-H:高等植物活性氧的检测。植物生物学杂志,2011,54:351-357。
- 78.
JMC:生物学和医学中的自由基。克拉伦登,牛津大学;1989.
- 79.
Johansson JH, Frenkel M, Zulfugarov I, Reichelt M, Krieger-Liszkay A, Gershenzon J, Moen J, Lee C-H, Jansson S:拟南芥非光化学猝灭能力影响草食动物行为。科学通报,2013,8(1):艺术。不。e53232 -
- 80.
王晓东,王晓东,王晓东,等。光系统的光抑制效应。植物学报,2005,29(5):561 - 561。
- 81.
Badger MR, von Caemmerer S, Ruuska S, Nakano H:高等植物和藻类的电子向氧的流动:直接光还原(梅勒反应)和rubisco加氧酶的速率和控制。中国生物医学工程学报,2000,29(3):369 - 369。
- 82.
Driever SM, Baker NR:当CO2同化受到限制时,叶片中的水循环并不是耗散多余激发能量的主要替代电子汇。植物细胞环境学报,2011,34:837-846。
- 83.
傅菲zan C, Gross CM, Sjödin M, Rutherford AW, kriger - liszkay A, Kirilovsky D:光系统II中醌类电子受体氧化还原电位对光抑制的影响。中国生物医学工程学报,2007,29(3):369 - 369。
- 84.
Krieger A, Rutherford AW, Johnson GN:初级醌电子受体Q氧化还原中点电位的测定一个,在光电系统II。Biochim Biophys学报1995年,1229:202 - 207。
- 85.
弗伦克尔M, Külheim C, Jänkänpää HJ, Skogström O, Dall’osto L, Ågren J, Bassi R, Moritz T, Moen J, Jansson S:不适当的过量光能量耗散拟南芥结果导致代谢重编程。植物生物学杂志,2009,9:12-
- 86.
Murchie EH, Niyogi KK:利用光保护技术提高植物光合作用。植物生理学报,2011,31(5):561 - 561。
- 87.
Gruissem W, Lee C-H, Oliver M, Pogson B:全球植物理事会:增加植物研究的影响以应对全球挑战。中国植物学报,2012,55:343-348。
- 88.
陈德华,陈永平:一种适用于AFLP和其他PCR应用的快速DNA微制备方法。植物学报,1999,17:53-57。
- 89.
戴胜,郑鹏,Marmey P,张胜,田伟,陈松,Beachy RN, faquet C:农杆菌介导的转基因水稻植株与颗粒轰击的比较分析。动物学报,2001,7:25-33。
- 90.
李硕,金金华,刘es,李智华,弘奇卡,安庚:不同的监管叶绿素a加氧酶基因在水稻。植物生物学杂志,2004,25(3):366 - 366。
- 91.
Zulfugarov IS, Ham O-K, Mishra SR, Kim J-Y, Nath K, Koo H-Y, Moon Y-H, Kim H-S, An G, Lee C-H:反应中心型能量依赖猝灭对光系统II天线尺寸的依赖。生物化学学报,2007,27(3):369 - 371。
- 92.
叶绿素荧光命名法在植物胁迫生理学中的应用。中国科学d辑,1990,25:457 - 457。
- 93.
Kim J-H, Kim S-J, Cho SH, Chow WS, Lee C-H:光系统I受体侧限制是四种不同冷敏性植物P700在光照下短期冷却后最大氧化程度可逆降低的前提条件。植物工程学报,2005,29(4):381 - 381。
- 94.
Kim EH, Razeghifard R, Anderson JM, Chow WS:磷脂酰甘油水解后光系统II中电子转移的多个迟滞位点。中国科学d辑,2007,29(3):359 - 359。
- 95.
Klughammer C, Schreiber U:用双波长脉冲调制系统测量近红外光谱区P700吸光度的变化。光合作用:机理和效应:1998年8月17-22日;布达佩斯。编辑:Dordrecht GG. Kluwer学术出版社,布达佩斯;1998:4357 - 4360。
- 96.
Harbinson J, Woodward FI:利用820 nm处的光诱导吸收变化监测叶片的氧化阶段。植物细胞环境学报,1987,12:357-369。
- 97.
Bachmann KM, Ebbert V, Adams WW, Verhoeven AS, Logan BA, Demmig-Adams B:林可霉素对光抑制和恢复过程中PSII效率、非光化学猝灭、D1蛋白和叶黄素循环的影响。植物功能学报,2004,31:803-813。
- 98.
Fryer MJ, Oxborough K, Mullineaux PM, Baker NR:叶片光氧化应激反应的成像。中国生物医学工程学报,2002,32(5):559 - 561。
- 99.
李军,李建军,李建军等:叶绿素酶1对植物防御途径平衡的影响。植物学报,2004,25(3):366 - 366。
- One hundred.
Mahalingam R, Jambunathan N, Gunjan SK, Faustin E,翁红,Ayoubi P:臭氧诱导的氧化信号通路分析拟南芥.植物细胞环境学报,2006,29:1357-1371。
- 101.
Hempel SL, Buettner GR, O ' malley YQ, Wessels DA, Flaherty DM:二氢荧光素二乙酸在检测细胞内氧化剂方面优于2 ' 7 ' -二氯二氢荧光素二乙酸,5(和6)-羧基-2 ' 7 ' -二氯二氢荧光素二乙酸和二氢丹明123的比较。放射医学杂志1999,270:146-159。
- 102.
Auclair C, Voisin E:硝基蓝四唑还原。CRC氧自由基研究方法手册。编辑:Greenwald RA。CRC出版社,博卡拉顿;1985:123 - 132。
- 103.
Geerts A, Roels F:二氨基联苯胺染色后过氧化氢酶活性的显微分光光度法测定。组织化学细胞生物学杂志,1981,72:357-367。
- 104.
Gilmore AM, Shinkarev VP, Hazlett TL, Govindjee:类囊体内pH值和叶黄素循环色素对叶绿素影响的定量分析一个类囊体的荧光寿命分布和强度。生物化学,1998,37:13582-13593。
- 105.
福特RC,埃文斯MCW:从具有高度富氧活性的高等植物中分离光系统2制剂。中国科学(d辑:自然科学版)。
- 106.
Tiwari A, Pospíšil P:细胞色素b的超氧化物氧化酶和还原酶活性559光系统II。Biochim Biophys学报2009年,1787:985 - 994。
- 107.
Porra RJ, Thompson WA, Kriedemann PE:用四种不同溶剂测定叶绿素a和b的精确消光系数的确定和联立方程:用原子吸收光谱法验证叶绿素浓度。生物化学学报,1998,25(3):394 -394。
致谢
我们非常感谢Jong-Seong Jeon教授、Ki-Hong Jung教授和Jung-il Cho博士(庆熙大学,龙仁,韩国)和Anja Krieger-Liszkay教授(CEA, iBiTecS, Cedex,法国)对手稿的批判性阅读和深刻的评论。本研究得到教育科学技术部(批准号:2009-0071776,2010-0015946,2011-0003040)和科学信息通信技术部(批准号:2011-0003040)国家研究基金基础科学研究项目(批准号:2009-0071776,2010-0015946,2011-0003040)的资助。nrf - 2014 r1a2a2a01005741)。该研究也得到了2012年博士后资助。釜山国立大学发展计划”授予Ismayil S. Zulfugarov。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者声明他们没有竞争利益。
电子辅料
图S1。
附加文件1:PsbS-KO突变系的基因分型。图S2。NPQ的光响应曲线。图S3。电子传输速率的光响应曲线。图S4。1周龄幼苗的相对生长率。图S5。单线态氧的产生。图S6。超氧阴离子自由基产生的检测。图S7。过氧化氢产生的检测。图S8。类囊体中ROS产生的时间过程。图S9。类囊体和BBY颗粒的免疫印迹。图S10。高电位cyt b的光诱导氧化还原变化559.图S11。类囊体和BBY颗粒的蛋白质组成。表S1。衰减时间常数(τ我, μs)和振幅(A我,任意单位)的Q一个-单周转闪光后的再氧化动力学。(PDF 752 KB)
权利和权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。
本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。
欲查看此许可证的副本,请访问https://creativecommons.org/licenses/by/4.0/.
创作共用公共领域奉献放弃书(https://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
Zulfugarov, I.S, Tovuu, A., Eu, YJ。et al。水稻光系统II产生超氧化物(栽培稻L.)缺乏PsbS的突变体。BMC植物杂志14日,242(2014)。https://doi.org/10.1186/s12870-014-0242-2
收到了:
接受:
发表:
关键字
- 包括光
- 公安局
- ROS
- 过氧化物
- 光合作用
- NPQ
- 大米