摘要
背景
抗微生物肽的生产是针对各种病原体的活细胞的常见防御策略。植物Snakin肽在极低浓度下抑制细菌和真菌生长。然而,众所周知它们的分子和生态特征,包括原始,进化的等价,特定功能和对抗有益微生物的活性。本研究的目的是识别和表征来自苜蓿的Snakin-1(小姐SN1)。
结果
系统发育分析表明,snatin -1与植物树完全一致。抗微生物活性小姐SN1对紫花苜蓿细菌性和真菌性病原菌均有抑制作用体外和体内。转基因苜蓿过表达MsSN1型对强致病真菌菌株的抗菌活性增强.然而,小姐SN1不影响固氮细菌株只有当这些有苜蓿起源。
结论
本研究结果表明蛇肽在陆地植物先天免疫中具有重要的祖先作用。我们的数据表明了一个共同进化的过程,其中苜蓿施加了一个选择压力的抗性小姐在根瘤菌细菌上的SN1。对毒性真菌菌株的抗微生物活性增加而不改变观察到的氮固定共生MsSN1型-Trfalfa转基因植物为生物胁迫抗性的有效豆类转基因品种的生产开辟了途径。
背景
紫花苜蓿(苜蓿被称为“牧草女王”,是一种多年生豆科植物。本种原产于亚洲,被认为是最早的已知作物之一,至少有3500年的栽培历史。苜蓿具有生命力强、营养品质高、产量高、适应性强、用途广等特点,是世界温带地区的主要饲用作物。优良苜蓿品种不仅要有较高的饲草产量,而且要保持其生产力和林分数年,以提供可观的经济效益。关于这个复杂的话题,提高真菌抗病性已被明确确定为苜蓿持久性的关键性状[1].在这种情况下,建议使用Snakin-1肽(SN1),强大但尚未研究的抗菌化合物,以改善苜蓿耐受性对毒性真菌病原体的耐受性。
抗微生物肽几乎存在于所有生物中,是先天免疫的古老和关键的组分。SN1是待表征的Snakin家族的第一个成员,从马铃薯的粗细胞壁制备中分离出来(Solanum Tuberosum.)块茎(圣SN1)[2]. 这种富含半胱氨酸的马铃薯肽在极低浓度(EC)下对细菌和真菌病原体具有活性50<10μm)[3.]. 表达模式StSN1基因表明,植物SN1可以是组成型防御障碍的组成部分,尤其是储存和生殖植物器官的组成部分[3.].第二种蛇形肽(圣SN2),其具有高氨基酸同一性(30%)圣SN1也从马铃薯块茎的粗细胞壁制剂中分离得到。与这种高氨基酸特性一致,圣SN2也以非常低的浓度为活性,针对各种病原体[4.].与此相反StSN1,表达StSN2通过伤口和病原体感染局部诱导,表明Snakin-2在植物的构成和诱导型防御障碍中的关键作用。使用细菌和真核异源表达系统验证了Snakin肽的这些强抗微生物活性[5.]-[7.].基于赤霉酸刺激的拟南芥(GASA)结构域的存在和没有生物信息(例如RGD残基)和功能性(例如有毒活性)数据,其支持其与蛇毒液的半胱氨酸富含肽的关系,圣SN1和圣SN2最近分别更名为GSL1和GSL2[8.],[9.].
SN1在马铃薯和小麦中的高表达(Triticum aestivum.),马铃薯和番茄中的sn2(番茄茄),烟草中的鼻腔防御杂交蛋白(烟草)和马铃薯在不改变这些作物农艺表型的情况下,限制了病原体的侵袭,提高了对细菌和真菌病害的耐受性[6.],[9.]-[12].此外,通过在野生烟草中沉默SN2来增强疾病敏感性(尼古利亚娜·宾夕法尼亚州)支持蛇皮肽在植物防御中的中心作用[13].此外,最近的研究表明圣SN1位于植物细胞壁[14],证实蛇皮肽是物理屏障的组成部分,也是植物细胞用来防止细菌和真菌进入的第一道防线[3.]. 此外,与作为GASA蛋白家族成员的蛇皮肽的功能分类一致[4.],[15],[16],StSN1沉默影响细胞分裂、初级代谢和细胞壁组成[14].Snakin Peptides可能在植物生长和发展中具有额外的功能,超出其在生物应激反应中的证明功能。尽管他们假设的功能性相似,但几乎没有关于关系之间的关系报告圣SN1和gasa相关蛋白。
本研究的目的是鉴定和表征snakin-1(MsSN1型)的基因。系统发育和功能分析表明MsSN1型是一个与生物胁迫抗性有关的祖先植物基因,表明紫花苜蓿是一个共同进化的过程,在这个过程中,紫花苜蓿对生物胁迫抗性施加选择压力小姐在根瘤菌细菌上的SN1。
方法
细菌和真菌菌株
本研究采用的菌株(均为革兰氏阴性菌)为:荧光假单胞菌PF-5 [17],草木樨中华根瘤菌BL225C型[18],草木樨中华根瘤菌SM11型[19],药用中华根瘤菌WSM419型[20],费氏中华根瘤菌美国农业部257[21],根瘤菌sp.或191[22],菜豆根瘤菌CFN 42 [23],Mesorhizobium洛蒂Maff303099 [24],Bradyrhizobium日本血吸虫USDA110 [25]以及根癌农杆菌LBA4404 [26]. 本研究中使用的真菌菌株为:茎点霉应变CT1和Collettrichum Trifolii.菌株CT2,与Inta苜蓿品种分离,并由Ricardo Comerio博士(InstitutoMicrobiologíayzoologíaGrícola,Instituto Nacional de Tecnologia Agropecuaria,阿根廷)提供。
真菌材料
两个真菌病原体,茎点霉应变CT1和Collettrichum Trifolii.菌株CT2,在PDA (Cat。# B0216605, Britania)在生物测定开始前,在室温下放置约7天。为了收集孢子,在培养皿中注入无菌蒸馏水,并用金属丝环刮拭。孢子浓度调整为1 × 106.孢子/mlC三叶草CT2和至1×105.孢子/mlP. Medicaginis.CT1加无菌蒸馏水。真菌菌株在植物中通过连续传代维持。
植物材料
这苜蓿使用的植物是再生克隆C2-3,由DRS提供。B. McKersie和S. Bowley(植物生物技术司,植物农业大学,加拿大大学)和再生克隆432-19-17,以前在我们的实验室中孤立。
细菌和植物RNA的分离和cDNA合成
细菌总数(E大肠杆菌)和植物组织(根、蒸汽、小叶)的RNA提取,使用RNeasy Mini Kit (Cat。# 74106, Qiagen)遵循制造商的说明。从细菌细胞或植物组织中分离出2 μg总RNA,用MMLV-RT (Cat。# M1701 Promega)。对细菌和植物进行PCR扩增,RT反应为1 μl。PCR反应25 μl,每个引物0.5 μM [27],使用Taq聚合酶(猫#.11615010,Invitrogen)后制造商的说明。
MsSN1质粒构建
这MsSN1型用引物p1-FW和p2-RV(附加文件)分离cDNA(GenBank登录号JQ809686)1)针对假定基因的5′和3′非翻译区(UTR)设计SN1基因(GenBank登录号码XM_003589066,MTR_1G018640)来自Medicago Truncatula..通过PCR扩增全长cDNA,将该片段克隆到PCR2.1TOPO载体(猫。#K4500-01,Invitrogen)中。用Klenow治疗,并用klenow治疗,并致以克诺,并宗教以消化ptopo-mssn1质粒。得到的质粒被命名为ptopo-noti-mssn1。PTOPO-NOTI-MSSN1的测序反应在Inta-Argentina进行(www.inta.gov.ar).对其cDNA序列进行命名MsSN1型(苜蓿Snakin-1)。产生表达重组细菌MsSN1型,质粒pSJ33-MsSN1携带MsSN1型通过亚克隆0.5 kb的EcoRI (Cat。# R6011, Promega) fragment from pCR2.1TOPO-MsSN1 into pSJ33 [28],然后在大肠杆菌用于异源表达MsSN1型. 获得高表达的转基因苜蓿品系MsSN1型, pCR2.1TOPO-NotI-MsSN1用KpnI (Cat。# R6341, Promega)和XbaI(猫。msn1限制性片段被克隆到pKANNIBAL载体(GenBank登录号AJ311873)中。用NotI酶切得到的质粒35SMsSN1型将限制性片段克隆到第27部分二元载体中[29]. 得到的含有MsSN1型CAMV 35S启动子下的信号肽的cDNA命名为第35孔:: MSSN1。
MsSN1的生物信息学分析
小姐SN1序列苜蓿以91个氨基酸组成的多肽(AFE82743)为查询对象,利用GenBank中的蛋白质注释,对NCBI中所有可用的完整真核生物基因组数据库进行检索。获得候选同源序列的截止值为氨基酸同一性的20%(附加文件)2). 使用BLASTP工具在NCBI和PLAZA数据库中搜索序列(http://www.ncbi.nlm.nih.gov/blast.;http://bioinformatics.psb.ugent.be/plaza).使用MATGAT v2.02进行蛋白质标识计算[30]. 使用MEGA版本5.0进行进化分析[31].使用ClustalW程序对蛋白质序列进行对齐。系统发育树的构建采用邻域连接法,遗传距离的计算采用成对删除模型和500值bootstrap分析和中点根(即两个序列簇之间最长路径的中点)。在Silico.通过使用PFAM和信号-3L具有默认参数的PFAM和Signal-3 L预测PFAM结构蛋白,PFAM结构域和信号肽的保守基序分析。32],[33].
真菌菌株的DNA提取及序列分析
按照Moller先前的描述提取了真菌DNA [34]博士建议的修改.Boehm(http://www.eboehm.com/). 简言之,从10天龄的PDA培养物中刮取100 mg真菌菌丝体,通过添加500μl裂解缓冲液(100 mM Tris-pH 8,10 mM EDTA,2%SDS,1%β-巯基乙醇,100μg/ml蛋白酶K)在1.5 ml管中用微杵研磨。裂解物在60℃下培养60分钟。随后,添加5 M NaCl至最终浓度1.4 M,并在添加0.1体积的CTAB 10%(w/v)之前混合。混合物在65℃下培养10分钟。通过添加等量的氯仿:异戊醇(24:1)提取DNA,在0℃下培养30分钟,并在14000×g下在4℃下离心10分钟。将水相与0.5体积的5 M醋酸铵混合,在0℃下培养60 min,并在14000×g下离心1 min。通过添加0.55体积的异丙醇从上清液中沉淀DNA,在14000×g下离心10 min,并用70%乙醇洗涤两次。将DNA颗粒风干并在50μl TE(10 mM Tris pH 8.0;1 mM EDTA(pH 8.0)。内部转录间隔区1、2和5.8S nrDNA(ITS)以及TUB基因的部分序列由Macrogen公司(韩国)进行扩增和测序(http://www.macrogen.com/),分别使用引物对ITS-1FW和ITS-4RV,以及Btub2FW和Btub4RV(附加文件1). 此处获得的核苷酸序列保存在EMBL核苷酸序列数据库中,检索号:KF846005C三叶草浴缸,KF846006P. Medicaginis.浴缸,KF846009C三叶草它和kf846010为P. Medicaginis.它的
体外抗菌活性测定
大肠杆菌含有PSJ33空载体或PSJ33-MSSN1的重组菌株在30℃下在补充有1mM异丙基-β-的LB培养基中振荡(250rpm)生长过夜。D.-硫代半乳糖吡喃苷250毫升锥形烧瓶,包含50毫升介质。取培养液25 ml (od值:0.8),4℃,5000 × g离心10 min,用生理溶液(0.9% NaCl)洗涤3次。粗细胞裂解物通过连续4次在液氮中冻结,然后在37°C下解冻得到。4℃,14000 × g离心20 min后,在400 μl生理溶液中重悬上清。用于分析MsSN1型表达E大肠杆菌,用RNeasy Mini试剂盒提取细菌总RNA,用DNaseI (Cat。# M6101 Promega)。用随机六聚体(Cat。# B070-40, Promega)和AMV逆转录酶(Cat。# M9004 Promega)。PCR扩增,RT反应1 μl。PCR反应25 μl,每个引物0.5 μM,参照Setten [27]. PCR条件包括:94℃1个循环3min,94℃34个循环45s,56℃1min,72℃1minMsSN1型使用引物p3 FW和p4 RV来放大完整的开放阅读框架(附加文件1).
按照Ayub的描述对圆盘抑制试验进行评估[35],有很小的修改。在含有25ml TY培养基的125ml Erlenmeyer烧瓶中进行培养物[36根根亚或根瘤菌或培养基假单胞菌和农杆菌分别是。细菌在28°C下振荡(250 rpm)培养过夜。无菌Whatman 1号过滤盘(5 mm),浸渍5μl小姐SN1-free (E大肠杆菌pSJ33)或小姐SN1型(E大肠杆菌将pSJ33-MsSN1)提取物放置在细菌接种的平板上。在28℃培养24小时后测量抑制区。抗真菌活性小姐根据Kovalskaya测定SN1提取物[12通过计数萌发和非萌发的真菌孢子。真菌孢子茎点霉CBS-KNAW真菌生物多样性中心的变种medicaginis CBS 316.90(www.cbs.knaw.nl/collections.)在PDB中制备。对于抑制试验,孢子悬浮液为1×105.使用孢子/ mL。每个抗真菌测定一式三份进行。
植物转化
将重组二元载体部分 - 35s :: MSSN1引入根癌农杆菌采用Shen&Forde所述的程序,通过电穿孔法获得lba4404[37]. 以苜蓿克隆C2-3为材料,用pART-35S::MsSN1通过基因工程技术转化其叶柄A. Tumefaciens.有教养的体外正如D'Halluin所描述的[38,稍加修改(附加文件3.).通过将叶柄组织浸入70%乙醇1分钟,然后在2%次氯酸钠中浸渍20分钟。在无菌蒸馏水中洗涤叶柄3次。以前用手术胶损伤的外植体接种细菌培养2分钟(OD600毫米= 0.5-0.8),然后在Whatman滤纸中干燥并转移到固体共培养SHK培养基中[3%蔗糖,0.435%KSO4., 2 mg/l 2.4-D, 0.2 mg/l动力学,6.5 g/l琼脂,20% SHK原液(w/v) pH:5.8 (300 mg/l NH4.H2阿宝4.,2.5%硝酸钾3.,200 mg / l cacl20.2小时2O、 400毫克/升硫酸镁4.0.7小时2o,4.3%k2所以4.,1 mg / l ki,5 mg / l h3.博3.,10毫克/升硫酸锰4..H2O, 1 mg/l ZnSO4..H2O, 1 mg/l Na2哞4.0.2小时2O、 1毫克/升硫酸铜4.0.5小时2O、 0.1毫克/升氯化钴20.6小时2O、 26.29毫克/升NaFeEDTA.H2O、 288 mg/l脯氨酸、53 mg/l硫代脯氨酸、200 mg/l肌醇、5 mg/l烟酸、0.5 mg/l吡哆醇、5 mg/l硫胺素),含100μM乙酰丁香酮,在25°C黑暗中放置2天。然后用0.5 g/l头孢噻肟加蒸馏水洗涤外植体,转移到含有25 mg/l卡那霉素和400 mg/l头孢噻肟的选择/诱导培养基SHK中,每2周常规转移到新鲜培养基中,温度25℃,光照16 h(100μmol/l)-2S.-1). 3个月后获得体细胞胚,转入MS生根培养基,由Murashige和Skoog基本培养基(Cat.)组成M5519,Sigma)用水稀释1:2。愈伤组织诱导6个月后获得转基因植株。再生植株一旦生根,就被转移到温室里。所有植物都在25-20°C昼夜温度的温室中生长,每天浇水。通过与克隆432-19-17杂交和扦插繁殖苜蓿转基因事件(命名为S1、S2和S3),以增加可用于生化、生理和遗传分析的植株数量。
转基因植物的鉴定
用DNeasy植物小试剂盒(Cat.)从叶片组织中分离DNA69104,恰根)。首先用引物p5-FW和p6-RV对转基因植株进行PCR鉴定(另附文件)1),设计针对35s启动子和SN1重组二进制向量的区域。利用p7 FW和p4 RV引物,针对pcr2 -1- topo - mcs衍生的5 ' UTR区和5 ' UTR区设计引物,通过RT-PCR验证该基因的表达MsSN1型基因(附加文件1).所有PCR反应均采用Taq (Cat。# 11615010,英杰公司)。
在Southern杂交分析中,利用DNeasy-Plant-Maxi试剂盒(Cat.#68161,Qiagen)。DNA被KpnI限制性内切酶消化,该酶仅切割构建体一次。然后,将每个样品的20μg DNA消化过夜,并在1%(w/v)琼脂糖凝胶1×TAE上分离后印迹。将凝胶中的DNA片段转移到带正电荷的尼龙膜(Cat.#11209272001,罗氏)。尼龙膜交联,然后用DIG标记探针杂交。根据制造商的说明进行预杂交和杂交。用PCR-DIG探针合成试剂盒(Cat.#)通过PCR产生杂交探针mssn1地高辛标记DNA11573152910,罗氏),使用底漆p8 FW和p9 RV,然后用作探针(附加文件1).在标准条件下进行PCR扩增(使用0.8μm的每个引物,1x PCR缓冲液,0.2mm,每个DNTP,2mM MgCl2以及20 ng模板),程序为34次循环94°C 1 min,50°C 30 s和72°C 2.5 min,最后循环72°C 10 min。
实时定量RT-PCR(RT-QPCR)
RT- qpcr采用1u iQ SYBR green Supermix (Cat。# 170-8880, Bio-Rad)和0.2 mM引物,与iCycler iQ系统。real-time qPCR引物为p10 FW和p11 RV(附加文件1).qPCR条件包括:1个94℃5 min循环,34个94℃45 s循环,59.1℃30 s循环,72℃30 s循环。在每个周期检测PCR产物的积累。扩增片段测序,发现与MsSN1基因相同(100%核苷酸同源性)。以门冬氨酸转氨酶(ATT) (AAB46610)作为管家基因,引物p12 FW和p13 RV对MsSN1的表达水平进行归一化处理1).引物结合的效率是通过绘制周期阈值与cDNA稀释对数的线性回归来确定的[39]. RT-qPCR实验用独立的RNA样本(生物复制品)进行两到三次。对于每个生物复制,qPCR反应分两次进行。
生物测定。体外挑战
在健康的15天历史的非熏蒸的小叶中进行测定。传单被净化在用无菌水中的烧瓶中洗涤它们,吐温-20(0.01%)10分钟。三次用无菌水洗涤后,将叶片转移至5%次氯酸盐溶液5分钟。最后,用无菌水洗涤传单三次,并转移到琼脂 - 水培养皿中。将平板维持在在23℃和8小时在20℃下为23℃和8小时编程的生长室中。通过放5μl接种传单P. Medicaginis.CT1或C三叶草每个传单的CT2孢子溶液。通过照片观察和记录感染演变,并得出以下损伤评分以量化损伤:1.健康传单,2.可计数损伤,3.不可计数损伤,4.黄化,5.完全损伤。
生物测定。体内挑战
通过用432-19-17基因型植物交叉转基因植物S1,S2和S3获得苜蓿转基因种子。将转基因和野生型种子用硫酸处理10分钟,用无菌水洗涤三次,并在培养皿中置于16小时的1%琼脂水(100μmols/ m2和25°C。将萌发后的植株转移到MS 0.5X瓶中,25℃下,16 h光周期培养1个月,然后转移到蛭石:珍珠岩的1:1中,置于洋红容器(SIGMA)中保持湿度。两个月大的植株接种P. Medicaginis.通过将孢子悬浮液喷洒到所有空中组织的CT1。分析了患病传单的百分比,分析了30天的接种后,并重新开始的植物数量和高度落叶植物的百分比进行了60天接种后60天。作为植物病的额外严重程度参数,估计了受活力影响的植物的百分比(即与未接种植物相比的脾脏损失的视觉迹象)。所有实验均用至少10株自治疗进行,至少5种非接种的野生型植物用作对照。
细菌根定植的评价
在共生试验中,野生型和转基因苜蓿幼苗在100%蛭石中生长,每天用最小的培养基“INTA13无氮”进行灌溉[27].10天龄植物接种了暴发悬浮液的早期静止相培养物(草木樨中华根瘤菌BL225C)。一个月后,收获植株并分析粉红色结节的数量。以未接种的植株为对照。每种治疗方法分析三个重复。这个P荧光Pf-5定殖实验根据Sanchez [40]对苜蓿进行了两次轻微的改良:在INTA13中添加钙(NO3.)2[27]和0.5 ne2培养基加辛酸钠(0.25%w / v)估计菌落形成单位[28].
统计分析
将生物测量重复至少三次,至少10种不同的植物。使用学生的T检验计算治疗之间的显着差异。QPCR实验独立地进行三次,结果是可比的。三种PCR反应一式两份进行。使用ANOVA随后进行了显着差异,然后进行Tukey测试。
结果和讨论
MsSN1的鉴定与进化分析
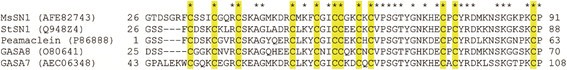
分析生物进化与功能MsSN1型通过RT-PCR方法,从根中分离出276bp的cDNA片段,并设计特异性引物,从豆科模式植物基因组中预测snakin-1肽Medicago Truncatula.(公吨SN1,MTR\ U 1g018640)。将PCR产物克隆到pCR2.1TOPO载体中并测序(JQ517286)。该cDNA片段与推测的snakin-1肽有98%的同源性Medicago Truncatula.(xp_003589114),因此它被命名MsSN1型(苜蓿蛇皮-1)。马铃薯蛇皮-1肽(圣SN1),小姐SN1具有25个氨基酸的推定信号肽,并具有含有12个半胱氨酸残基的Snakin / Gasa结构域(PFAM02704),在保守的C末端区域内的保守位置(图1).
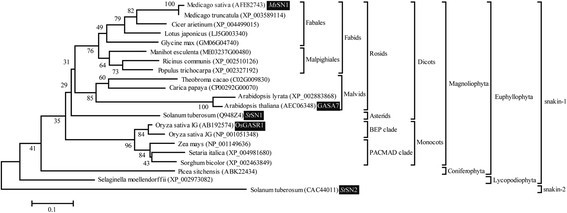
为了对SN1进行系统发育分析,进化研究仅限于使用具有高氨基酸同源性的蛋白质(>20%)的特征明确的植物物种。利用这一严格准则,可以观察到SN1与维管植物树之间的完全同等(即拓扑相同)(图5)2),表明植物SN1是通过垂直转移获得的[41]. 由于我们对SN1的系统发育分析与rRNA数据一致,因此在任何维管植物中同源SN1的分配都是可能的。因此,我们的进化研究表明小姐SN1从苜蓿(JQ517286)所呈现的正射影像确实是圣SN1从Solanum Tuberosum.(Q948Z4),赤霉素刺激转录本1 (OsGASR1)来自水稻(AB192574)和GASA7来自拟南芥(AEC06348)先前所述[3.],[42],[43]从而为深入了解植物中SN1的功能提供了实验数据整合的起点。值得注意的是,通过比较snakin/GASA相关蛋白(如拟南芥GASAs)的氨基酸同源性,无法预测snakin样肽的同源性(附加文件)4.).因此,评估Snakin / Gasa基因的正确陈列学需要严格的系统发育分析。
为了支持高等植物SN1的垂直起源SN1基因存在于原始维管植物中Selaginella Moellendorffii(数字2).此外,基因组数据库内的蛋白质的详尽系统发育分析未能在祖传中找到SN1的正交基因Physcomitrella金属盘,以及属于门藻的绿藻种类Chorophyta如Ostreococcus lucimarinus那micromonas.sp。rcc299,团藻和Chlamydomonas Reinhardtii..在此发现的情况下,含有Snakin / Gasa结构域的蛋白质在土地植物中广泛分布,但在苔藓和绿藻中完全没有缺席(数据未显示),表明这一点SN1是在维管植物/苔藓植物分离后出现在维管谱系中的一个祖先基因。考虑到主导陆地环境的陆地植物的先祖必须面对巨大的压力,包括极端多样的微生物土壤群落产生的感染,选择一些基因创新,这并不奇怪[44].因此,SN1的出现可能是祖先植物对陆地的适应。
MsSN1体外抗菌活性分析
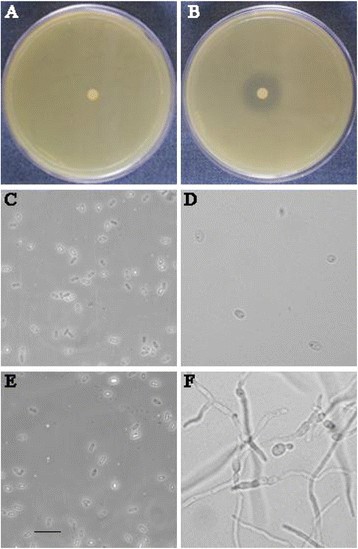
关于这一点体外特征化小姐SN1抗菌活性MsSN1型基因表达E大肠杆菌. 表达MsSN1型在转型期E大肠杆菌细胞经RT-PCR分析确认(附加文件5.).抗微生物活性小姐SN1自由或小姐针对细菌和真菌苜蓿病原体测试SN1提取物根癌农杆菌LBA4404和茎点霉var. medicaginis分别为CBS 316.90。抗菌活性小姐无sn1的提取物检测不到,而小姐SN1提取物对细菌生长有很高的抑制活性(图1)3.(A-B)和真菌孢子萌发(图3.C-F)。如前所述,其他成员的蛇皮/GASA肽[3.],[4.],抗微生物活性小姐针对属于不同域的生物,至少细菌和真核的生物体是一致的,其功能是植物非特异性免疫系统的组成部分。
MsSN1表达分析
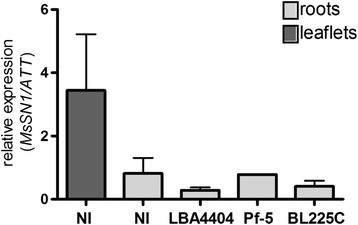
表达模式MsSN1型通过RT-PCR分析基因,以探索功能小姐野生型苜蓿植株中的SN1。MsSN1型在所分析的所有组织中检测到表达,包括根、茎、叶和幼花芽(附加文件)6.).采用RT-qPCR检测MsSN1型通过暴露于微生物而改变。MsSN1型当在控制条件下生长时,转录水平比根状况高于根,在根中较高(图4.).有趣的是,MsSN1型水平并没有改变,对生物刺激,如病原菌A. Tumefaciens.共生菌LBA4404草木樨中华根瘤菌BL225C和自由生活的菌株荧光假单胞菌Pf-5(图4.). 符合StSN1马铃薯的表达[3.的表达模式MsSN1型表明,SN1是构成性防御屏障的一个组成部分。
过表达MsSN1转基因苜蓿植株的分子生物学特性
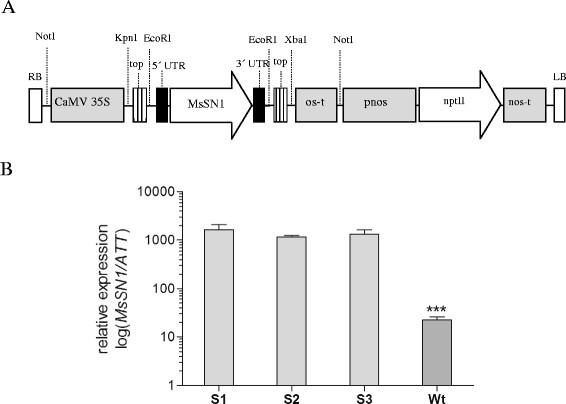
为了研究其抗菌活性MsSN1型针对苜蓿真菌病原体,产生转基因苜蓿植物。这MsSN1型在CAMV 35S启动子的控制下将基因置于组成型表达盒中(图5.A) 将再生无性系C2-3导入苜蓿植株根癌农杆菌- 导明的转换(附加文件3.). PCR分析(附加文件7.A)和Southern Blot分析(附加文件7.B) 对三个含有CaMV35S:MsSN1结构的转基因苜蓿品系S1、S2和S3进行了鉴定。进化分析表明Medicago Truncatula.和莲藕每个基因组只有一个SN1基因位点MTR_1g018640和LJ5G003340。与此一致的是,豆科植物的基因组结构也非常保守[45]苜蓿的四体遗传和异交特性[46],未转化的苜蓿植株显示出三种拷贝的存在,可能是等位基因MsSN1型基因(附加文件7.B) 是的。正如预期的那样,转基因植物在Southern杂交中显示出额外的和差异的条带,这表明转基因在苜蓿基因组的不同区域被整合(附加文件)7.B) 是的。这三个事件显示了转基因的稳定遗传(数据未显示)。利用为嵌合5′UTR设计的特异性引物,通过RT-PCR分析确认转基因的表达(附加文件)7.C)。还通过RT-QPCR测定分析各种线MsSN1型表情。转基因株系的表达水平表明MsSN1型比野生型内源性表达高100倍(图5.B),表明这三个转基因株系是评价过表达效应的良好候选品种MsSN1型.
转基因苜蓿过表达系的特性分析MsSN1型.(一种)二元载体第35S::MsSN1部分的T-DNA区域的示意图,包含MsSN1型CAMV 35S启动子下的基因。显示了质粒结构和南口印迹分析中使用的相关限制酶。RB:右边边缘;Camv 35s:启动子;Topo:来自PCR2.1-Topo Vector的地区;UTRS:来自本土的未经翻译区域MsSN1型基因;Os-t:章鱼碱合酶终止子;pnos- npti -nos-t:卡那霉素盒(其中,pnos和nos-t分别为诺帕林合成酶启动子和终止子);磅:左边界。(二)苜蓿转基因株系(S1-S3)和对照未转化植株(wt)的实时RT-PCR检测。所有值均为log means±SEM (n = 3)。星号表示差异有统计学意义(Tukey: ***p < 0.001)。
类似于马铃薯、小麦和番茄的转基因系[6.],[10],[11],过表达MsSN1型没有似乎对转基因苜蓿植物中的一般表型产生负面,例如,与野生型植物相比,转基因植物中的植物活力没有减少(附加文件8.).因此,转基因苜蓿植物似乎是研究角色和生物技术潜力的合适平台MsSN1型. 不幸的是,没有MsSN1型获得表达减少或沉默的苜蓿植株(数据未显示)。梅亚拉汉也报告了类似的结果[8.),作者没有发现使用反义载体表达GSL1的再生植物(StSN1)及GSL2 (SN2)在其内源性启动子调控下。这些结果可能表明MsSN1型沉默对转化或再生效率进行了不利影响。在这种观察中,SN1沉默极大地影响了马铃薯植株的细胞分裂和初级代谢[14].
两种高毒性的苜蓿真菌菌株的分子表征
炭疽病和春叶斑病,由真菌致病菌引起Collettrichum Trifolii.和茎点霉,分别是世界上最具破坏性的苜蓿感染。在分析紫花苜蓿对这些真菌疾病的抗性时,通常需要权衡这些致病菌株的毒力和特性。一般来说,是典型菌株的长期连续传代体外减轻这些病原体的毒性体内,虽然新分离的病原体表现出高毒力表型,但通常根据疾病症状或显微镜观察推测其分类位置。为了绕过这一限制,我们使用了来自苜蓿育种项目的两个高毒力苜蓿真菌菌株,通过连续的植物感染维持,并通过对保守基因和基因间区域的扩增、测序和系统发育分析进行表征。对ITS区和TUB基因的进化分析表明,这些分离株属于炭疽菌和Phoma.(附加文件9.). 事实上,这些来自强毒株(KF846005、KF846006、KF846009和KF846010)的DNA片段和ITS区域和来自其他毒株的TUB基因具有100%的核苷酸同源性C三叶草CBS 158.83(KF178478和KF178599)和P. Medicaginis.CBS 316.90(分别为GU237828和GU237630)。根据这些数据,这些菌株被命名为Collettrichum Trifolii.应变CT2和茎点霉菌株CT1。不像那些特征很好的真菌菌株C三叶草CBS 158.83和P. Medicaginis.CBS 316.90,应变C三叶草CT2和P. Medicaginis.CT1对紫花苜蓿具有很强的毒力,可侵染大量的商业品种以及本研究所用的苜蓿克隆C2-3和432-19-17。这证实了真菌病原菌的保存形式对维持其苜蓿毒力至关重要,因此,研究苜蓿抗真菌的遗传基础是必要的。
MSSN1过表达转基因植物的抗真菌体外活性
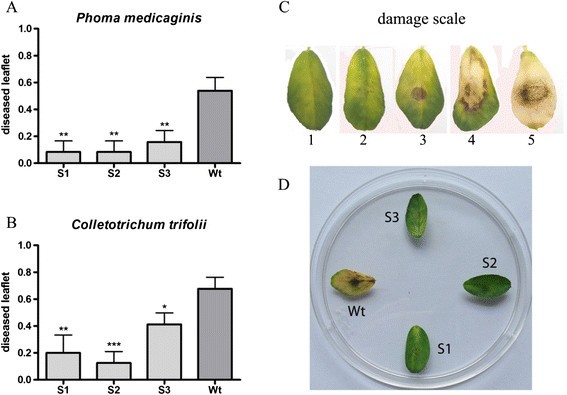
作为研究转基因紫花苜蓿线的抗真菌活性的第一步,体外进行挑战测定。用两种毒力和分子特征的苜蓿真菌菌株的孢子悬浮液接种分离的小叶P. Medicaginis.CT1和C三叶草CT2将叶片置于培养皿中孵育7天(图6.a - b)。通过视觉评分被感染小叶的疾病症状为显示疾病病变的小叶的百分比来评估疾病的严重程度(图)6.C). 3个转基因株系(S1- S3)在两种攻毒条件下,患病小叶的比例均显著低于野生型P. Medicaginis.CT1(图6.a)和C三叶草CT2毒性菌株(图6.b),表明抗微生物功能MsSN1型在生物胁迫条件下。此外,这种小规模的研究有助于对大量转基因事件进行快速目测筛选(图)6.D) 节省时间,降低成本,加快抗菌转基因在商业品种中的导入,特别是在苜蓿等异交种中[47].
抗真菌体外的活动MsSN1型overexpressing转基因植物。(一种)与小叶接种有关的患病小叶Phoma.(#患病的传单/ #总传单).(二)与小叶接种有关的患病小叶炭疽菌(#患病的传单/ #总传单)。(三)伤害评分:1。健康传单,2.可数伤害,3.不可数损伤,4.氯化,5。完全损坏。(四)代表Phoma测定.Wt:野生型。S1-S3:小姐SN1转基因植物。所有值都是数值±SEM(n = 10-30)。星号表示统计上显着差异(土耳其:* P <0.5; ** P <0.01 *** P <0.001)。当伤害评分中显示出症状3,4或5时,传单被视为患病。估计疾病严重程度从三个单独的植物得分30到60个分离的传单。
过表达mssn1转基因植物的体内抗真菌活性
选择三个转基因苜蓿品系(S1-S3)进行后代分析,探讨其潜在的生物抗性增强。以克隆432-19-17为花粉供体,与转基因苜蓿进行有性杂交,以避免自交后代的近交衰退。转基因在后代植株叶片中的存在和表达分别通过PCR和RT-qPCR分析进行测定(数据未显示)。体内抗真菌活性测定P. Medicaginis.CT1用孢子液喷施转基因植物和野生型植物。通过评估两个月的农艺参数来估计植物病害的严重程度。野生型植物表现出了疾病的所有症状[48],[49],包括茎部深褐色病变,小叶部深褐色病变,开始是特定的暗色损伤,叶子枯萎,褪绿和落叶。转基因株系表现出罕见的症状,通常看起来像对照植物(数据未显示)。
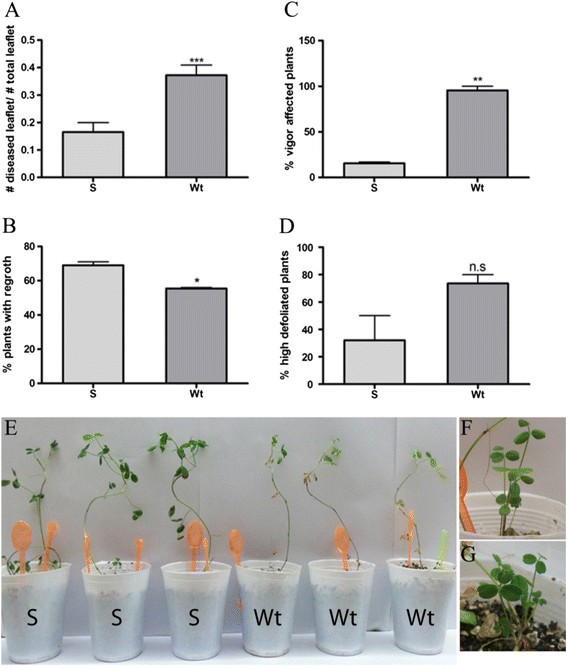
首先,通过在感染植物中的视力评分疾病症状估算小叶病。在感染后一个月,转基因患者患者患者的百分比显着低于野生型植物(图7.A).接种2个月后,通过评价植株的活力、再生植株数和高度落叶植株的百分比来分析病害的严重程度。转基因植物的再生水平显著高于野生型植物(图7.事实上,疾病症状在野生型再生中存在,而在转基因植物中没有(图)7.G) 是的。过表达MsSN1型紫花苜蓿在真菌胁迫条件下提高植物活力(图7.C).此外,野生型植物比转基因植物落叶更多,但差异没有统计学意义(图7.D) 是的。总之,转基因植物表现出更好的抗肿瘤能力Phoma.感染而不是野生型植物,表明抗真菌活性小姐SN1体内.
MSSN1和根根亚洲的共同划分证据
对先天免疫的其他效应分子的类似观察[50],本构关系式MsSN1型可使苜蓿在微生物侵染早期相对于病原菌具有选择性优势。然而,它也可能对固氮共生菌等有益微生物产生不利影响。为了调查这一明显的悖论体外抗微生物活性小姐分析了含有不同豆科植物和土壤中分离的九种根瘤菌菌株的SN1。所有从苜蓿结节中分离的根瘤菌(草木樨中华根瘤菌BL225C,草木樨中华根瘤菌SM11和根瘤菌sp.或191)对该菌无抑制作用小姐SN1提取物(表1). 相反,从其他豆科植物中分离出的共生固氮菌株,如麦迪克(药用中华根瘤菌WSM419),大豆(费氏中华根瘤菌USDA 257和Bradyrhizobium日本血吸虫USDA110) bean (菜豆根瘤菌CFN 42)和莲花SPP。(Mesorhizobium洛蒂Maff303099),易于影响小姐SN1Extract(表1). 这些结果表明,苜蓿与其共生菌可能是共生的。
细菌共生和慢性感染之间存在细微的细节。虽然一个人有益,但另一个是有害的。最近的调查结果表明,索引主机防御的共享机制[50].豆科植物在它们的起源之后迅速地进化,而结瘤很可能在它们的分化过程中进化了几次[51].这些植物具有共生氮素固定细菌,其含有抗微生物化合物的根结节隔室。为了避免植物致病细菌感染,氮气固定的根瘤菌细菌和豆科植物已经开发出复杂的信号交换机制,使特定的细菌菌株诱导其特定的宿主植物物种以形成侵入结构,细菌可以进入植物根部[52]. 共同进化的证据表明小姐SN1肽可能是一组化合物的一部分,参与区分共生体和其他微生物,从而允许有益的感染和抑制潜在致病微生物的定植。
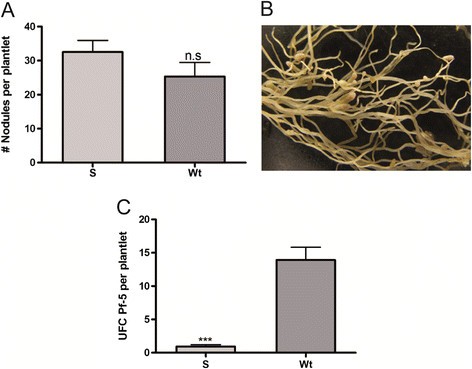
与植物-微生物共同进化的假说一致,MsSN1型-过表达的转基因植株表现出结瘤生产美国melilotiBL225C与野生型植物比较(图8.A-B),表明小姐当氮固定的细菌菌株具有苜蓿来源时,SN1不会影响植物感染。然后,探索效果小姐自由生活型根际细菌SN1的研究假单胞菌,其抗菌活性小姐SN1开启P荧光对从土壤样品中分离得到的Pf-5进行了研究。有趣的是,P荧光PF-5表现出超敏反应小姐sn1提取物(抑制区= 1.76±0.06 mm)。与体外的活动小姐SN1型,P荧光PF-5在接种后30天在苜蓿的野生型和转基因系中的根际显示差异增殖,表明抗菌活性增加MsSN1型-过度表达的植物(图8.C).这些结果显示了额外的体外和体内的证据小姐SN1作为先天免疫应答的一部分,具有广泛的免疫活性小姐第1条。
结论
以往的研究和报道的结果表明,蛇皮肽在陆生植物天然免疫中具有重要的遗传作用。有趣的是,MsSN1型在不改变固氮共生关系的情况下,过表达苜蓿转基因植株对强毒真菌的抑菌活性增强,为生产有效的苜蓿转基因品种开辟了道路。在这项工作中,数据也表明了一个共同进化的过程,在苜蓿施加选择压力的抗性小姐在根瘤菌细菌上的SN1。
其他文件
参考文献
- 1.
Wilnec JJ、Cunningham SM、Haagenson DM、Berg WK、Joern BC、Wiersma DW:苜蓿改良的生理遗传学:过去的失败,未来的展望。《大田作物研究》,2002年,75:97-110.10.1016/S0378-4290(02)00020-5。
- 2.
Lopez-Solanilla E,Garcia-Olmedo F,Rodriguez-Palenzuela P:Sapa灭活Erwinia Chrysanthemi的Sapf Locus揭示了植物和动物细菌发病机制的共同特征。植物细胞。1998,10(6):917-924。
- 3.
Segura A,Moreno M,Madueno F,Molina A,Garcia-Olmedo F:Snakin-1,来自土豆的肽,对植物病原体有效。Mol植物微生物相互作用。1999年,12(1):16-23。10.1094 / mpmi.1999.12.1.16。
- 4.
Berrocal Lobo M,Segura A,Moreno M,Lopez G,Garcia Olmedo F,Molina A:Snakin-2,一种来自马铃薯的抗菌肽,其基因通过创伤局部诱导并对病原体感染作出反应。植物生理学。2002,128(3):951-961。10.1104/pp.010685。
- 5.
植物抗菌素蛇毒蛋白1和防御素重组蛋白的表达和功能鉴定。蛋白质研究进展。2009,63(1):12-17。10.1016 / j.pep.2008.08.013。
- 6.
关键词:马铃薯,抗微生物肽SN1,小麦,小麦全蚀性病菌,抗菌素功能集成基因组学。2013,13(3):403-409。10.1007 / s10142 - 013 - 0332 - 5。
- 7.
Guzman-Rodriguez JJ、Ibarra-Laclette E、Herrera-Estrella L、Ochoa-Zarzosa A、Suarez-Rodriguez LM、Rodriguez-Zapata LC、Salgado-Garciglia R、Jimenez-Moraila B、Lopez-Meza JE、Lopez-Gomez R:对鳄梨种子(Persea americana var. drymifolia)的表达序列标签(est)进行分析,发现编码抗菌肽snakin的基因表达丰富。植物营养与肥料学报,2013,30(3):431 - 434。10.1016 / j.plaphy.2013.05.045。
- 8.
Meiyalaghan S,Thomson SJ,Fiers MW,Barrell PJ,Latimer JM,Mohan S,Jones EE,Conner AJ,Jacobs JM:编码赤霉素刺激样蛋白的GSL1和GSL2基因在二倍体和高度杂合四倍体马铃薯中的结构和表达揭示了它们的高度保守性和必要性。BMC基因组学2014,15:2。,
- 9
Mohan S, Meiyalaghan S, Latimer JM, Gatehouse ML, Monaghan KS, Vanga BR, Pitman AR, Jones EE, Conner AJ, Jacobs JM: GSL2过表达使马铃薯对Pectobacterium atrosepticum产生抗性。中国生物医学工程学报,2014,33(3):457 - 461。10.1007 / s00122 - 013 - 2250 - 2。
- 10
在转基因马铃薯中,snakin-1基因的过表达增强了对茄根丝核菌和胡萝卜素的抗性。植物病理学杂志。2008,9(3):329-338。10.1111 / j.1364-3703.2008.00469.x。
- 11
Balaji V,Smart CD:snakin-2和伸展蛋白样蛋白基因的过度表达限制病原体的侵袭性并增强对米氏棒杆菌亚种的耐受性。转基因番茄(茄属番茄)中的米奇甘草。转基因研究,2012,21(1):23-37.10.1007/s11248-011-9506-x。
- 12
Kovalskaya N,Zhao Y,Hammond Rw:在烟草和马铃薯植物中表达的鼻腔防御素杂交蛋白的抗菌和抗真菌活性。开放植物SCI J.111,5:29-42。10.2174 / 1874294701105010029
- 13
Balaji V, Sessa G, Smart CD:沉默宿主基础防御反应相关基因表达增加了本氏烟草(Nicotiana benthamiana)对Clavibacter michigan subsp的敏感性。michiganensis。植物病理学报。2011,31(3):349-357。10.1094 /发朵- 05 - 10 - 0132。
- 14
Nahireñakv,almasia ni,fernandez pv,hopp he,Estevez JM,Carrari F,Vazquez-Rovere C:马铃薯Snakin-1基因沉默影响细胞分裂,初级新陈代谢和细胞壁组合物。植物理性。2012,158(1):252-263。10.1104 / pp.111.186544。
- 15
Nahirñak V,Almasia NI,Hopp HE,Vazquez Rovere C:蛇皮蛋白/GASA蛋白:参与激素串扰和氧化还原稳态。电厂信号行为。2012,7(8):1004-1008.10.4161/psb.20813。
- 16
波尔图WF,佛朗哥OL:斯纳金/加斯家族的理论结构洞察。肽。2013,44:163-167.10.1016/j.peptides.2013.03.014。
- 17
Howell CR,Stipanovic RD:用荧光假单胞菌产生的抗生素控制棉花幼苗上的立枯丝核菌。植物病理学。1979,69:480-482.10.1094/Phyto-69-480。
- 18
Carelli M,Gnocchi S,Fancelli S,Mengoni A,Paffetti D,Scotti C,Bazzicalupo M:意大利土壤中不同苜蓿品种结瘤的苜蓿中华根瘤菌种群的遗传多样性和动态。应用环境微生物学。2000年,66(11):4785-4789.10.1128/AEM.66.11.4785-4789.2000。
- 19
Selbitschka W, Keller M, Miethling-Graff R, Dresing U, Schwieger F, Krahn I, Homann I, Dammann-Kalinowski T, Puhler A, Tebbe CC:长期野外释放生物发光的中华根瘤菌,评估recA突变对菌株生存的影响。微生物学报,2006,52(3):583-595。10.1007 / s00248 - 006 - 9056 - 6。
- 20。
Reeve W、Chain P、O'Hara G、Ardley J、Nandesena K、Brau L、Tiwari R、Malfatti S、Kiss H、Lapidus A、Copeland A、Nolan M、Land M、Hauser L、Chang YJ、Ivanova N、Mavromatis K、Markowitz V、Kyrpides N、Gollagher M、Yates R、Dilworth M、Howieson J:苜蓿微共生青贮(中华根瘤菌)药用菌株WSM419的完整基因组序列。标准基因组科学。2010年,2(1):77-86.10.4056/sigs.43526。
- 21。
关键词:大豆,根瘤菌,快速生长,根瘤菌abstract:科学出版社,2002。10.1126 / science.215.4540.1631。
- 22.
早期BD, Hannaway DB, Bottomley PJ:无效苜蓿根瘤菌的特性:结瘤豆科植物的能力[Phaseolus vulgaris (L.)]萨维。]。应用环境微生物学,1985,50(6):1422-1427。
- 23.
李建平,李建平,李建平,等。美国根瘤菌根瘤菌I型菌株的重新分类[J] .中国生物防治学报,2001,21(3):349 - 352。10.1099 / 00207713-43-2-374。
- 24.
Kaneko T、Nakamura Y、Sato S、Asamizu E、Kato T、Sasamoto S、Watanabe A、Idesawa K、Ishikawa A、Kawashima K、Kimura T、Kishida Y、Kiyokawa C、Kohara M、Matsumoto M、Matsuno A、Mochizuki Y、Nakayama S、Nakazaki N、Shimpo S、Sugimoto M、Takeuchi C、Yamada M、,Tabata S:固氮共生菌中根瘤菌loti的全基因组结构(补充)。《DNA Res.2000》,7(6):381-406.10.1093/dnares/7.6.381。
- 25.
Mathis JN,Israel DW,Barbour WM,Jarvis BD,Elkan GH:日本慢生根瘤菌USDA 110及其衍生物I-110的共生性能分析和利用甘露醇的固氮USDA 110新衍生物的发现。应用环境微生物学。1986, 52 (1): 75-80.
- 26.
农杆菌(Agrobacterium tumefaciens)质粒的vir-和t -区分离研究自然科学学报,2001,21(5):529 - 533。10.1038 / 303179 a0。
- 27
Setten L,Soto G,Mozzicafreddo M,Fox Ar,Lisi C,Cuccioloni M,Angeletti M,Pagano E,Diaz-Paleo A,Ayub Nd:工程假单胞菌致氮固定剂PF-5及其在提高氮气下提高植物生长的应用- 条件。公共科学图书馆一号2013、8 (5):e63666。
- 28
Ayub Nd,Julia Pettinari M,Mendez BS,Lopez Ni:Pseudomonass Sp中葡萄糖的多羟基丁酸酯生物合成受损。14-3是由于β-酮溶酶基因有缺陷。有限元微生物吧。2006,264(1):125-131。10.1111 / J.1574-6968.2006.00446.x。
- 29
Gleave AP:一种多功能的双载体系统,具有T-DNA组织结构,有助于克隆DNA高效整合到植物基因组中。中国生物医学工程学报,2000,20(6):1123 - 1128。10.1007 / BF00028910。
- 30
Campanella JJ,Bitincka L,Smalley J:MatGAT:利用蛋白质或DNA序列生成相似性/同一性矩阵的应用程序。BMC生物信息学2003, 4:29.,
- 31
Tamura K,Peterson D,Peterson N,Stecher G,Nei M,Kumar S:Mega5:使用最大可能性,进化距离和最大判定方法的分子进化遗传学分析。mol Biol Evol。2011,28(10):2731-2739。10.1093 / Molbev / MSR121。
- 32
Finn Rd,Mistry J,Tate J,Coggill P,Heger A,Pollington Je,Gavin OL,Gunasekaran P,Cercer G,Forslund K,Holm L,Sonnhammer EL,EDDY SR:PFAM蛋白质数据库。核酸RES。2010,38(数据库问题):D211-D222。10.1093 / nar / gkp985。
- 33
Shen HB, Chou KC: signal - 3l:一种预测信号肽的三层方法。生物化学与生物物理学报,2007,36(2):457 - 461。10.1016 / j.bbrc.2007.08.140。
- 34
Moller Em,Bahnweg G,Sandermann H,Geiger HH:一种简单有效的协议,用于从丝状真菌,果实和感染的植物组织中分离高分子量DNA。核酸RES。1992,20(22):6115-6116。10.1093 / NAR / 20.222.6115。
- 35
Ayub ND, Pettinari MJ, Ruiz JA, Lopez NI:一种从南极环境中分离的具有高抗逆性的多羟基丁酸生产假单胞菌。微生物学杂志。2004,49(3):170-174。10.1007 / s00284 - 004 - 4254 - 2。
- 36
豆科根瘤菌中贝林格JE: R因子转移。中华结核和呼吸杂志。1997,16(1):1 - 6。10.1099 / 00221287-84-1-188。
- 37
沈文俊,Forde BG:高压电穿孔法高效转化农杆菌。核酸研究1989, 17(20):8385.,
- 38
D'Halluin K,Botterman J,De Greef W:在现场条件下,除草剂抗苜蓿的工程和评估。农作物科学。1990,30:866-871。10.2135 / Cropousci1990.0011183x003000040020x。
- 39
Soto G、Fox R、Ayub N、Alleva K、Guaimas F、Erijman EJ、Mazzella A、Amodeo G、Muschietti J:TIP5;1是一种专门针对花粉线粒体的水通道蛋白,可能参与拟南芥中氮的再活化。植物J。2010年,64(6):1038-1047.10.1111/j.1365-313X.2010.04395.x。
- 40。
研究表明,荧光假单胞菌(Pseudomonas fluorescens)和苔藓球孢(Glomus mosseae)在苜蓿根中激活了dmi3依赖的信号转导通路相关基因。植物生理学报,2005,42(2):457 - 461。10.1104 / pp.105.067603。
- 41。
基于进化和功能分析的水通道蛋白功能预测。中国生物医学工程学报。2014,247(2):107-125。10.1007 / s00232 - 013 - 9618 - 8。
- 42。
Furukawa T,Sakaguchi N,Shimada H:两种OsgasR基因,在增殖组织中丰富的水稻种同源物基因,在显影胶质中显示出不同的表达模式。基因类型系统。2006,81:171-180。10.1266 / ggs.81.171。
- 43。
RoxrudⅠ,Lid SE,Fletcher JC,Schmidt ED,Opsahl-Sorteberg HG:GASA4,拟南芥GASA小多肽家族的14个成员之一,调节开花和种子发育。植物细胞生理学。2007,48(3):471-483。10.1093/pcp/pcm016。
- 44。
陆地植物的起源和早期演化:问题和考虑。社区整合生物。2008年,1(2):212-218.10.4161/cib.1.2.6987。
- 45。
Choi HK、Kim D、Uhm T、Limpens E、Lim H、Mun JH、Kalo P、Penmetsa RV、Seres A、Kulikova O、Roe BA、Bisseling T、Kiss GB、Cook DR:截短苜蓿的基于序列的遗传图谱以及与M的标记共线性比较。萨蒂瓦。遗传学。2004,166(3):1463-1502.10.1534/genetics.166.3.1463。
- 46.
库克博士:截短苜蓿-一个正在制作的模型!。植物生物学。1999年,2(4):301-304.10.1016/S1369-5266(99)80053-3。
- 47.
McCann MC, Rogan GJ, Fitzpatrick S, Trujillo WA, Sorbet R, Hartnell GF, Riodan SG, Nemeth MA:耐草甘膦紫花苜蓿的成分等同于传统紫花苜蓿(Medicago sativa L.)。农业化学学报,2006,54(19):7187-7192。10.1021 / jf061482m。
- 48.
masoud sa,朱q,羊肉c,dixon ra:苜蓿中诱导葡聚糖酶的组成型表达减少了oomycete病原体植物植物植物麦克海植物F的疾病严重程度。SP Medicaginis,但不会降低含丁蛋白的真菌的疾病严重程度。转基因Res。1996年,5:313-323。10.1007 / BF01968941。
- 49.
Hipskind JD,Paiva NL:白藜芦醇葡萄糖苷在转基因苜蓿中的结构性积累增加了对紫花苜蓿的抗性。植物与微生物相互作用。2000年,13(5):551-562.10.1094/MPMI.2000.13.5.551。
- 50。
Grunheid S,Le Moual H:革兰阴性菌对抗菌肽的耐药性。女性微生物学。2012年,330(2):81-89.10.1111/j.1574-6968.2012.02528.x。
- 51。
对结瘤起源的系统发育观点。植物微生物学杂志。2011,24(11):1289-1295。10.1094 / mpmi - 05 - 11 - 0114。
- 52。
Jones Km,Kobayashi H,Davies BW,Taga Me,Walker GC:Rhizobial Symbionts如何入侵植物:Sinorhizobium-Medicago模型。NAT Rev Microbiol。2007,5(8):619-633。10.1038 / Nrmicro1705。
致谢
为了纪念他。农业部。劳尔·里奥斯。
我们感谢卡门·索里亚(Carmen Soria)、胡安·里克尔梅(Juan Riquelme)和吉列尔莫·皮帕罗拉(Guillermo Piparola)的技术支持。
这项工作得到了国家科学和技术促进署(grant PICT 2011-1325)的支持。保密协议;驾驶室;JPM和GCS是国家科学技术研究委员会(CONICET)的研究人员。
作者信息
隶属关系
通讯作者
附加信息
相互竞争的利益
作者声明他们没有相互竞争的利益。
作者的贡献
构思和设计了实验:GCS;NDA;嗯;MEP。执行实验:Ang;NDA;GCS;ARF;MCG;MJD。 Analyzed the data: GS; NDA. Wrote the paper: GS; NDA; CAB. All authors read and approved the final manuscript.
电子辅助材料
产品的相似性
附加文件2:MsSN1型从植物中提取的其他蛇皮蛋白/GASA基因。(DOC 38 KB)
产品的身份
附加文件4:MsSN1型基因到拟南芥中其他蛇形/GASA蛋白。(Doc 1 MB)
大肠杆菌的RT-PCR研究
附加文件5:MsSN1型基因表达在E大肠杆菌pSJ33 (1)E大肠杆菌PSJ33-MSSN(2)菌株。(医生737 KB)
rt - pcr分析显示
附加文件6:MsSN1型在幼芽(A-B)、叶片(C-D)、茎(E-F)和根(G-H)中表达。(文档620 KB)
转基因苜蓿过表达系的分子特性研究
附加文件7:MsSN1。(文档610 KB)
权利和权限
开放存取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。
除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。
要查看本许可证的副本,请访问https://creativecommons.org/licenses/by/4.0/.
“创作共用公共领域”豁免书(https://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
加西亚,a.N.,阿尤布,N.D.,福克斯,a.R。等等。Alfalfa Snakin-1防止真菌殖民化,并且可能与根扎恐惧症共同。BMC植物生物学14,248 (2014). https://doi.org/10.1186/s12870-014-0248-9
收到:
公认:
发表:
关键词
- 抗菌肽
- 苜蓿
- 进化
- 陆地植物
- 先天免疫
- 斯诺林