摘要
背景
的R2R3-MYB基因是植物中最大的转录因子基因家族之一,在植物特有的发育过程、代谢产物积累和防御反应中起着调节作用。虽然已经在一些物种中进行了该基因家族的全基因组分析,但研究人员没有发现R2R3-MYB基因在甜菜属ssp。寻常的(甜菜)作为石炭叶目第一个序列成员,迄今为止尚未进行分析。
结果
我们提出了一个全面的,全基因组的分析MYB基因甜菜属ssp。寻常的(甜菜),它是石炭叶目第一个具有测序基因组的物种。总共70个R2R3-MYB基因以及编码含有多个MYB重复序列的其他三类MYB蛋白的基因被鉴定出来,并在结构和染色体组织方面进行了描述。此外,从RNA-seq数据确定了器官特异性表达模式。的R2R3-MYB基因进行了功能分类,这导致了在R3结构域具有非典型氨基酸组成的甜菜特异性分支的鉴定,假定编码甜菜素调节因子。通过实验验证了功能分类的正确性R2R3-MYB基因Bv_iogq编码黄酮醇调节器。
结论
这项研究为克隆和功能解剖的作用提供了第一步MYB转录因子基因在营养和进化有趣的物种b .寻常的.此外,它还描述了黄酮醇调节剂BvMYB12,是第一个具有实验证明功能的甜菜R2R3-MYB。
背景
基因表达的转录控制几乎影响真核细胞或生物的所有生物过程。转录因子通过激活或抑制(或两者兼有)RNA聚合酶对特定基因的募集来单独或与其他蛋白质复合发挥这一功能。转录因子的数量之多、多样性之大与其调控的复杂性有关[1].
MYB蛋白广泛分布于所有真核生物中,是植物王国中最大的转录因子家族之一。MYB蛋白由高度保守的MYB dna结合结构域定义,主要位于n端,通常由多达4个约52个氨基酸的不完美氨基酸序列重复序列(R)组成,每个重复序列形成3个α -螺旋[2].每个重复的第二和第三个螺旋构造了一个螺旋-螺旋-螺旋(HTH)结构,具有三个规则间隔的色氨酸(或疏水)残基,形成疏水核心[3.].每个重复序列的第三个螺旋是与DNA直接接触的DNA识别螺旋[4].在DNA接触过程中,两个MYB重复序列紧密地排列在主槽中,使两个识别螺旋协同结合到特定的DNA识别序列基序上。
MYB蛋白可以根据相邻重复序列的数量(1、2、3或4)分为不同的类别。原型MYB蛋白c-Myb的三次重复[5]被称为R1, R2和R3,来自其他MYB蛋白的重复序列根据它们的相似性命名。植物r1r2r3型MYB (MYB3R)蛋白被认为在细胞周期控制中发挥不同的作用[6]、[7],类似于它们的动物同源体的功能。
大多数植物MYB基因编码R2R3-MYB类蛋白,包含两个重复序列[2]、[8],被认为是从R1R2R3-MYB基因祖先进化而来的,其原因是R1重复编码序列的丢失和随后基因家族的扩展[9] - [11].R2R3-MYB转录因子具有模块化结构,n端MYB结构域为dna结合结构域,激活或抑制结构域通常位于高度可变的c端。在n端模块中发现了用于与真核生物转录机制的其他组件建立蛋白-蛋白相互作用的组件[12] - [14].
基于MYB结构域和c端结构域常见氨基酸基序的保守性,R2R3-MYB蛋白被分为几个亚群,这些亚群通常将蛋白质按功能关系分组。在系统发育分析的基础上定义的亚群的可靠性也得到了其他标准的支持,如基因结构和内含子的存在和位置[15].这些亚群中的大多数,首先定义为蛋白质答:芥[2]、[16]、[17],在其他高等植物中也存在,有时还扩大。比较系统发育研究已经在其他植物物种中发现了新的R2R3-MYB亚群,这些亚群在其他植物物种中没有代表答:芥(例如在水稻、杨树和葡萄藤中),这表明这些蛋白质可能具有特定的功能,它们要么在水稻中丢失了答:芥或者是在与最后的共同祖先分化后获得的[18] - [20.].
正如第一个工厂最初描述的那样MYB基因家族回顾[21],植物特异性的扩张R2R3-MYB基因家族被认为与植物复杂性的增加有关,尤其是被子植物。因此,的功能R2R3-MYB基因可能与调节植物特异性过程有关,包括初级和次级代谢、发育过程、细胞命运和特性以及对生物和非生物胁迫的反应[2]、[17]、[21].
随着植物基因组全测序数量的不断增加,植物基因组的鉴定R2R3-MYB近年来基因数量有所增加。基于它们良好保守的MYB结构域,R2R3-MYB基因家族已在基因组范围内进行了注释答:芥(126名委员)[17),玉米(157名委员)[22),栽培稻(102名委员)[23),葡萄(117名委员)[19),杨树trichocarpa(192名委员)[20.),大豆(244名委员)[15),Cucumis巨大成功(55名委员)[24),家棠(222名委员)[25].鉴于R2R3-MYB蛋白在基因表达调控、次生代谢和环境应激反应中的潜在作用,以及甜菜属ssp。寻常的(石龙目)是第一个基因组已被测序的非蔷薇属、非小行星属的真叶藻[26],对其进行完整的鉴别和分类是很有意义的MYB本物种中有关数量、染色体位置、系统发育关系、保守基序以及表达模式的基因。特别是,由于甜菜是温带气候的重要作物,既是生物乙醇的来源,也是动物饲料,提供了世界每年近30%的糖产量[26].
在本研究中,我们描述了R2R3-MYB基因家族通过在网上分析b .寻常的基因组序列,以预测蛋白质结构域的结构,并评估之间的保守和分歧程度b .寻常的而且答:芥基因家族,从而导致了甜菜的功能分类MYB基于系统发育分析的基因。此外,RNA-seq数据用于分析不同的表达b .寻常的器官和比较紧密分组的共orthortho的表达模式。为了验证功能分类,选择了一个候选基因进行cDNA分离,并通过瞬态转激活试验和同源互补进行后续功能分析答:芥突变体。我们确定了R2R3-MYB基因Bv_iogq激活两种黄酮醇生物合成酶启动子,补充黄酮醇缺乏Myb11 myb12 myb111突变体,从而编码了一个功能性黄酮醇生物合成调控因子。我们的发现为进一步研究MYB转录因子在经济和进化上有趣的物种中的生物学和分子功能提供了第一步b .寻常的.
结果与讨论
注释的基因组序列b .寻常的已成为最近可用。从双单倍体育种系KWS2320 [26].该序列已被分配到9条染色体和b .寻常的预测在567 Mb中包含27,421个蛋白质编码基因(RefBeet),其中85%为染色体分配。
普通柏R2R3-MYB基因的鉴定及基因组分布
MYB蛋白编码基因b .寻常的在RefBeet基因组序列的TBLASTN搜索中,使用一致的R2R3-MYB DNA结合域序列作为蛋白质查询进行了鉴定。人工分析假定的MYB序列是否存在完整的MYB结构域,以确保基因模型包含两个或多个(多个)MYB重复序列,并且它们映射到基因组中的唯一位点。我们确定了6个B. vulgaris(BvMYB)自动注释中遗漏的基因[26还有两本是用不完整的开放阅读框标注的。我们创建了70个R2R3-MYB蛋白和三种与典型R2R3-MYB蛋白远相关的非典型多重重复MYB蛋白的主要数据集:三种R1R2R3-MYB (MYB3R)蛋白,一种MYB4R蛋白和一种cdc5样蛋白b .寻常的基因组(表1).非典型性多重重复次数MYB基因鉴定b .寻常的与报道的其他植物物种的范围相同吗,例如多达六种MYB3R最多两个MYB4R而且CDC5-like基因。然而,数量R2R3-MYB基因是已经研究过的物种中最小的一个(从55英寸c .巨大成功到244年g·马克斯).正如下面讨论的,这可能是由于最近的基因组复制事件的缺席b .寻常的.
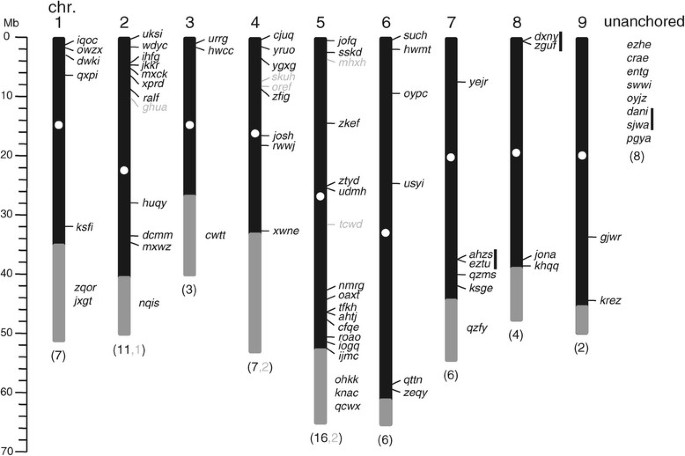
NCBI数据库中的关键字搜索(http://www.ncbi.nlm.nih.gov/)揭示了三个先前注释的b .寻常的来自不同甜菜品种的MYB蛋白:AET43456和AET43457,分别对应于本工作中的BvR2R3-MYB Bv_jkkr和本工作中的Bv_nqis对应的AEL12216。被识别的75人BvMYB基因,约占27,421个预测蛋白质编码的0.27%b .寻常的基因和5.9%的1271假定b .寻常的转录因子基因[26],以作进一步分析。与注释中所有其他基因相似b .寻常的基因组(RefBeet),一个唯一的,不可变的四字母标识符(ID)被分配给每个BvMYB基因(表1).这个不可变的ID是基因指示符的一部分b .寻常的命名系统和应该是稳定的,与描述染色体分配和假染色体上的位置的指示元件相反,当当前未分配或未锚定的支架被集成到假染色体中时,这些位置可能会发生变化。以后用四个字母的id来命名个人BvMYB基因和推导出的蛋白质。根据RefBeet, 75个中的67个BvMYB基因可以被分配到9条染色体上。平均来说,一个R2R3-MYB基因每10.5 Mb出现一次BvMYB假染色体上的基因如图所示1并揭示了B. vulgaris基因分布在所有染色体上。虽然九个都是b .寻常的染色体包含MYB基因,分布似乎是不均匀的(图1).的BvMYB每条染色体的基因密度是不完整的,只有两条BvR2R3-MYB9号染色体上有16个基因,5号染色体上有16个基因。一般来说,染色体的中心部分,包括着丝粒和着丝粒周围区域,缺乏MYB基因。相对高密度的BvMYB在染色体两端观察到基因,在染色体2的顶部和染色体5的底部观察到密度最高(图1).这种不均匀的分布是以前观察到的Z. may, G. max而且家蝇R2R3-MYB基因(15]、[22]、[25].
识别的总数MYB与其他植物种类相比,基因含量较低b .寻常的.即使一些MYB基因可能由于参考序列的间隙而被遗漏,这也不足以解释这个小数目。大量的MYB一个物种的基因主要归因于祖先的全基因组复制事件A. thaliana, O. sativa, P. trichocarpa,g·马克斯而且家蝇[27] - [31].在最近的谱系特异性全基因组复制事件的缺席b .寻常的[32]被发现的只有70个,进一步证实了这一点R2R3-MYB基因由于缺乏这种复制事件,很容易解释数量少MYB这种物种的基因。这一解释与在黄瓜中的研究结果一致,其中的数量R2R3-MYB据报道,基因是55 [24].
我们进一步确定了妹妹的身体联系BvMYB基因对沿着9条染色体(图1(用垂直黑条标记),形成集群,可能是从局部染色体内重复事件进化而来,导致重复基因的串联排列。目前已鉴定出三对基因:一对在7号染色体上,由密切相关的基因组成Bv_ahzu而且Bv_eztu在第8号染色体的顶部有第二个Bv_dxny而且Bv_zguf和第三个在未连接的脚手架(0254.scaffold00675)上,由Bv_dani而且Bv_sjwa.的BvMYB后两对的基因在物理上彼此靠近,没有干扰注释基因之间。总共约5%(75个中的6个)BvMYBs参与串联复制,这与大豆MYB基因的报道值相同[15].此外,在2号染色体上观察到一个不完整的基因对,其中一个单独的典型R2R3-MYB“第三外显子”,包含编码R3重复序列的一部分和c端区域,在其下游约18.7 kb处发现Bv_jkkr在cDNA上显示88%的同源性,在第三外显子的推导蛋白水平上显示82%的同源性Bv_jkkr.
基因结构分析显示BvR2R3-MYB基因(53,70,76%)遵循先前报道的具有两个内含子和三个外显子的规则,并显示高度保守的剪接排列,这在其他植物物种中也有报道[15]、[22]、[24].11BvR2R3-MYB有1个内含子和2个外显子的基因占16%,有4个(6%)为1个外显子基因。只有两个BvR2R3-MYB基因有三个以上的外显子:Bv_mxck有四个外显子Bv_zeqy12个外显子(表1).的复杂外显子-内含子结构Bv_zeqy从它的答:芥直接同源AtMYB88而且AtMYB124/FOUR LIPS (FLP)它们分别包含10个和11个外显子,并且在MYB结构域编码序列中多于通常的0到2个内含子[18]、[19].这支持了它们之间密切的进化关系,但也表明了自石蕊植物从rosids和asterids的前体分裂以来,这种内含子模式在进化中的保守性。
MYB结构域的序列特征
研究R2R3-MYB结构域序列特征,以及每个重复序列中每个位置上最常见氨基酸的频率b .寻常的分别用推导出的70个R2和R3重复序列通过多重比对分析(ClustalW)得到R2R3-MYB结构域和序列标识。总的来说,这两个MYB重复序列覆盖了大约104个氨基酸残基(包括连接子区),很少有缺失或插入(附加文件)1).如图所示2中保守氨基酸的分布b .寻常的MYB结构域与拟南芥、拟南芥、拟南芥、拟南芥、拟南芥、拟南芥、拟南芥而且巨大成功。R2和R3的MYB重复b .寻常的R2R3-MYB家族含有特征氨基酸,包括最突出的一系列规则间隔和高度保守的色氨酸(W)残基,已知它们在序列特异性DNA结合中发挥关键作用,作为植物MYB蛋白的标志。正如从其他植物物种的同源物中所知道的,R3重复序列中第一个保守的色氨酸残基(位置60,W60)可以被F取代,或者很少被异亮氨酸(I)、亮氨酸(L)或酪氨酸(Y)取代。有趣的是,MYB重复序列的第98位包含最后一个保守的色氨酸残基(W98),并不是完全守恒的b .寻常的R2R3-MYBs(图2,附加文件1).在Bv_ralf和Bv_zeqy中发现的苯丙氨酸(F)残基在这个位置(例如在ZmMYB29中)很少有报道[22],但在Bv_jkkr中发现的这个重要位置上的非典型半胱氨酸(C)尚未被描述。这使得R2R3-MYB蛋白Bv_jkkr在dna结合和目标序列特异性方面的进一步分析变得有趣。
除了高度保守的色氨酸残基外,我们还观察到所有氨基酸残基都是保守的b .寻常的R2R3-MYBs: D11C43, R46R2重复和E64G76, R89和T90在R3中重复。的进一步高度保守残基b .寻常的R2R3-MYB结构域为:G4E10,我14G35, R38K41, R44N49,我51和P53R2重复,我82,一个83N92K95和N96在R3中重复(图2).这些高度保守的氨基酸残基主要位于第三螺旋和螺旋-螺旋-螺旋-螺旋(HTH)基序的转角,这与其他植物的研究结果一致。
普通B. MYB家族的系统发育分析
探讨预测值的假定函数b .寻常的myb,我们把它们分配到已知的功能支答:芥之所以选择它,是因为我们对植物的大部分知识MYB基因已从这一主要植物模型的研究中获得。从类似的研究中可知,大多数具有相似功能的MYB蛋白聚集在相同的系统发育支中,这表明大多数密切相关的MYB可以识别相似的靶基因,并具有冗余、重叠和/或合作功能。
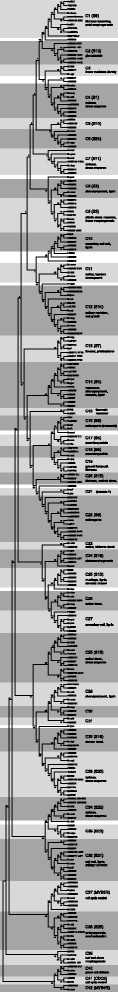
我们对75个bvmyb进行了系统发育重建答:芥MYB家族(133个成员,包括126个R2R3-MYB, 5个MYB3R, 1个MYB4R和1个CDC5-MYB)和51个来自其他植物物种的具有良好特征的标志性R2R3-MYB(图3.)和最大简约(MP)方法(附加文件2)在MEGA5 [33].除了一些内部节点具有较低的自举支持值外,每种方法得到的系统发育树显示出非常相似的拓扑结构。我们将此作为我们分支和子组命名的可靠性的指示。系统发育树拓扑结构允许我们将分析的MYB蛋白分为42个分支(C1到C42)(图3.).在我们的分类中MYB基因,我们还考虑了亚组(S)类别答:芥[2]、[17].我们的分类结果与之前对葡萄和大豆的研究结果相同[15]、[19].如图所示3., 42个演化支中有34个同时存在于b .寻常的而且答:芥.因此,很可能出现的情况最多MYB这两个物种的基因早于石蕊亚目(caryophylales)在小行星目(asterids)和蔷薇目(rosids)分离之前的分枝[26].
我们还观察到种特异性支和支含有b .寻常的或答:芥MYB蛋白和其他物种的MYB标记蛋白。值得注意的是,我们使用术语“物种特异性”是在当前具有测序基因组的物种集的背景下。要在属或科水平上确定基因或分支的存在和不存在,需要大量的基因组序列。正如其他研究所表明的那样,对种特异性演化支的观察可以作为一种暗示MYB在一个物种从最近的共同祖先分化的过程中,基因可能已经获得或丢失。例如,分支C2的成员(亚组S12,具有高脂肪型GLUCOSINOLATE1 (AtHAG1),高吲哚型GLUCOSINOLATE1 (AtHIG1), ALTERED TRYPTOPHAN REGULATION1 (AtATR1))已被确定为硫代葡萄糖苷生物合成调节剂[34] - [37].该支系中未发现bvmyb,其成员主要存在于芥菜科累积硫代葡萄糖苷化合物的植物中。先前的研究表明,该分支源于拟南芥与芸苔属(Brassica)分化之前的重复事件[23].另一个MYB支没有b .寻常的直系位点为C20 (S15),包括具有里程碑意义的r2r3 - myb AtMYB0/GLABRA1和AtMYB66/狼人(图3.),它们参与表皮细胞的发育,导致毛状体和根毛的形成[38] - [40].在非蔷薇属玉米和大豆中也有类似的观察结果[15]、[22],均不含C20 (S15)直系物,而蔷薇葡萄和杨树则含有[19]、[20.].作为GLABRA1例如MYB据推测,基因是在rosid-asterids分裂后获得的[41]、[42的缺失BvMYBs在这支支系中,石蕊类在小行星和蔷薇类分离之前就开始分叉,这与这一假设是一致的。毛状体形成b .寻常的因此可能受到进化较早的MIXTA分支C1 (S9)的基因调控[41]其成员也在多细胞毛状体的形成中发挥作用[43].因此,Bv_dcmm作为该分支中唯一的甜菜基因,是编码毛状体发育调控因子的候选基因。不含bvmyb的C5 (S10)答:芥蛋白质AtMYB9, AtMYB107功能分配未知,C16 (S5)含有单子叶植物中的R2R3-MYB地标性花青素调节因子,C22 (S6)包括地标性R2R3-MYB因子生产花青素色素1 (AtPAP1),花青素2 (PhAN2)和ROSEA1 (AmROSEA1),已知它们调节许多物种的花青素生物合成[44] - [47].后两个分枝中缺乏bvmyb符合观察,即属植物β不产生花青素色素[48].石蕊植物是植物王国中唯一的一个目,其中包含了用化学性质不同但功能相同的红色和黄色色素取代花青素的类群——吲哚衍生的甜菜素,命名于甜菜属,从中首次提取甜菜碱[49].虽然甜菜素作为色素的功能与花青素类似,但花青素和甜菜素在植物中是相互排斥的色素[50].
三个演化支不含任何物质答:芥MYB(图3.).其中两个含有标志性myb和b .寻常的myb: C18 (S5)和C15,分别参与原花青素调控和抑制类黄酮生物合成。一个分支只包含bvmyb。进化枝C21由两个bvmyb (Bv_ralf和Bv_jkkr)组成,在系统进化树中被发现靠近代表进化枝C22 (S6)的“花青素”调控因子(图3.,附加文件3.).这支演化支可以被描述为在b .寻常的这反映了物种特有的适应。两个经典的甜菜色素位点,红色(R)和黄色(Y) [51]、[52],会影响甜菜中甜菜素的产生。最近,R位点被证明编码细胞色素P450 (CYP76AD1,Bv_ucyh载于KWS2320) [53].据推测,甜菜素途径可能已经选择了花青素调节因子,因为这两种色素类型的产生都以相似的时间和空间模式[53].因此,r2r3 - myb型转录激活子,与花青素色素调节剂同源,被认为通过调控生物合成酶R (CYP76AD1)和DODA (4,5- dopa -双加氧酶)控制β -蛋白酶的生物合成[53]、[54].两个C21BvMYB基因Bv_jkkr而且Bv_ralf均位于第2染色体上靠近R位点的位置,这可由基于染色体的基因命名(Bv2g027795_jkkr, Bv2g029890_ucyh, Bv2g030925_ralf).由于已知R和Y位点的遗传距离约为7.5厘米[51]、[52],这使得R2R3-MYB基因Bv_ralf而且Bv_jkkr用于编码Y调节器的候选。仔细检查Bv_ralf和Bv_jkkr的MYB结构域,并与花青素调节MYB进行比较,揭示了C21支MYB的一些有趣特征,这些特征可能导致C21和C22 MYB的分离(图3.).C21 myb不包含bhlh结合一致基序[D/E]Lx2(R / K) x3.Lx6Lx3.R (13],表明Bv_ralf和Bv_jkkr与C22花青素调节myb不同,不与bHLH蛋白相互作用。R3重复序列中的一个关键氨基酸残基,由Heppel鉴定et al。[55在分离花青素调节剂(A89)来自原花青素调节剂(G89),用异亮氨酸(I89)在C21 myb中。此外,已知R2重复序列第三螺旋中的一个氨基酸残基直接参与DNA结合(位置44),与花青素调节剂中在该位置发现的氨基酸残基不同(附加文件)1),可能表明不同的目标启动子特异性。在这个方向上,Bv_jkkr MYB结构域高度保守的98位的非典型半胱氨酸也可能是重要的,如下文所述。
在BvMYB蛋白中寻找上述bhlh相互作用基序[13]鉴定了7个含有该motif的bvmyb,因此推测与bHLH蛋白相互作用。Bv_crae、Bv_swwi和Bv_dwki被分配到原花青素调节支C17 (S5), Bv_ihfg被分配到含有负类黄酮调节因子FaMYB1的C15 [56], Bv_cjuq到含有一般苯丙烷通路调节剂VvMYB5a的分枝C19 [57]和Bv_gjwr和Bv_iquc到“阻遏”枝C14 (S4)。
六个b .寻常的MYB蛋白,Bv_uksi, Bv_josh, Bv_cfqe Bv_ijmc, Bv_swwi和Bv_pgya没有聚集在任何已识别的分支或亚群中,或在不同的系统发育树之间显示出模糊的位置,这意味着这些BvMYB蛋白可能具有获得或扩展的特殊作用b .寻常的在基因组进化的过程中。
基本上,在大多数分支中发现atmyb的数量高于其BvMYB同源物,这表明它们是在两个谱系分化后复制的。例如,C28 (S18)和C36 (S21)的系统发育仅包含3个BvMYB和8个atmyb,或C25 (S13)包含1个BvMYB和4个atmyb。C26分支中有3个bvmyb和2个AtMYB。如上所述,数值越高MYB基因在答:芥可能主要是由于整个基因组的祖先复制和随后的重排,随后在拟南芥的进化中发生了基因丢失和广泛的局部基因复制[27].
草MYB基因在不同发育阶段的表达谱
在大型转录因子家族中,功能冗余并不罕见。因此,一个特定的转录因子经常需要在整个家族的背景下进行研究和鉴定。在这种情况下,基因表达模式可以为基因功能提供重要线索。我们使用了基因组测序的全球rna序列Illumina公司从b .寻常的参考基因型KWS2320 [26]来分析75BvMYB不同器官和发育阶段的基因:幼苗、主根(圆锥形白色肉质根)、幼叶和老叶、花序和种子。过滤后的RNA-seq reads与基因组参考序列进行比对,每个注释转录本的映射reads数量被量化,并在分析样本中进行统计比较,给出了附加文件中给出的规范化RNA-seq read值3..与其他转录因子基因一样,许多转录因子基因BvMYBs通过RNA-seq分析,显示出低转录丰度水平。
我们的表情分析显示b .寻常的myb在不同器官中有不同的表达模式。我们对这些配置文件进行了分层聚类,以识别相似的转录丰度模式,并生成了一个表达热图,以便可视化不同的表达配置文件BvMYBs(图4).最高的数量BvMYB基因(66;对应88%)在花序中表达,其次是幼苗(62;83%),主根(58;77%),种子(55;73%)和幼叶(51;68%)。最少的BvMYB基因在老叶中表达(35;47%)。70BvMYBs(93%)至少在一个分析样本中表达,尽管一些基因的转录丰度非常低。33BvMYB基因(44%)在所有分析样本中表达,这表明这些BvMYBs在多个发展阶段发挥调节作用。5个基因在任何分析样本中都缺乏表达信息,这可能表明这些基因在其他器官(如根、茎)、特定发育阶段、特殊条件下或假基因中表达。一些BvMYB基因在所有分析样本中的表达水平相似(如R2R3-MYBBv_ohkk和MYB3R-typeBv_tcwd),而另一些则表现出转录丰度的差异,在一个或几个器官中表达高水平,而在其他器官中表达低水平(无)。例如,Bv_hwcc, Bv_owzx而且Bv_jxgt在幼苗、主根、花序和种子中均有表达,但在叶片中不表达(无论是幼叶还是老叶)。只有四个BvMYB的基因,Bv_oaxt, Bv_ahtj,Bv_zkef和Bv_ijmc其中三个人的职责是发展,表现出器官特异性表达,仅在花序或幼苗中检测到。这一结果表明,相应的BvMYB调控因子仅限于离散的器官、组织、细胞或条件。
一些集群BvMYB基因(图1),它们通常被认为是平行序列(由基因组内的复制事件产生),显示出相似的表达谱,而其他的则聚集在一起BvMYB基因则不然。Bv_ahzs而且Bv_eztu(两者均在发展相关分支26),主要在花序和种子中表达,在其他分析器官中低表达(或不表达)。两个聚集基因Bv_dxny而且Bv_zguf(两者均在国防7)表达谱与Bv_zguf主要在幼苗和种子中表达Bv_dxny在叶中进一步表达。这些结果表明Bv_ahzs而且Bv_eztu可能是功能冗余基因,而Bv_dxny而且Bv_zguf可能(部分)参与防御过程的各个方面。
R2R3-MYB基因Bv_iogq功能分析
在我们选择的泛函分析的背景下Bv_iogq首先。Bv_iogq是分枝C13 (S7)中唯一一个与标志性myb聚集在一起的BvMYB,被认为是植物发育过程中黄酮醇和苯甲酚特异性的类黄酮生物合成激活剂。这尤其包括z梅斯因子ZmP,控制果皮中红色邻苯酞色素的积累[58),诉酿酒用葡萄黄酮醇调节剂VvMYBF1 [59]和答:芥由AtMYB12/AtPFG1、AtMYB11/AtPFG2和AtMYB111/AtPFG3组成的黄酮醇苷(PFG)家族的产生[60].AtMYB12通过结合myb识别元件MRE调节查尔酮合成酶(CHALCONE SYNTHASE, CHS)的表达CHS[61].这三个答:芥进一步发现pfg家族因子在黄酮醇通路特异性基因调控中具有重叠功能,但发挥器官特异性作用。认识提高,答:芥树苗pfg三突变体(myb11 myb12 myb111)在标准生长条件下不形成黄酮醇,而其他类黄酮的积累不受影响[60].
我们测试了Bv_iogq功能性黄酮醇调节器代码。的Bv_iogq开放阅读框(ORF)编码了一个含有387个氨基酸残基的预测蛋白,计算分子质量为43.6 kD。对推导出的氨基酸序列的分析表明,Bv_iogq包含黄酮醇调节剂的两个特征基序。亚群S7 motif (GRTxRSxMK) [17发现Bv_iogq的c端存在一个氨基酸取代基(GRTSRWAMQ), SG7-2基序([W/x][L/x]LS;[59])在Bv_iogq的c端被发现。
因为黄酮醇苷是已知的积累在b .寻常的叶子(62]、[63],我们的表达数据表明Bv_iogq在嫩叶中表达(图4),以该器官为来源克隆黄酮醇生物合成调控因子Bv_iogq的cDNA。
Bv_iogq激活类黄酮通路结构基因的启动子
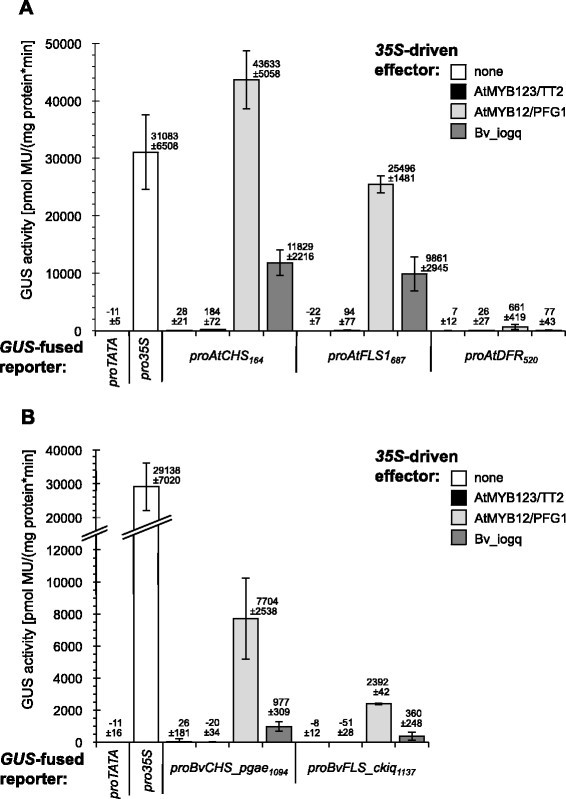
一个短暂的答:芥采用At7原生质体报告基因检测系统,分析Bv_iogq对基因启动子的激活电位答:芥类黄酮生物合成酶。数字5A总结了结果,表明Bv_iogq能够激活的启动子青岛,类黄酮途径中的初始酶,以及黄酮醇合成酶1 (AtFLS1),酶催化最后一步导致黄酮醇的形成。花青素分支基因的启动子二氢黄酮醇还原酶其产物直接与FLS竞争同一底物(二氢黄酮醇),不被Bv_iogq激活。在进一步的实验中,我们测试了Bv_iogq激活B. vulgaris CHS_phae而且FLS_ckiqAt7原生质体中的启动子。转染检测结果(图5B)表明AtMYB12激活了两种测试的类黄酮b .寻常的促进者,尽管程度比答:芥同源染色体。Bv_iogq能够激活的启动子BvCHS_phae而且BvFLS_ckiq在某种程度上。因此,我们认为Bv_iogq是一种功能性类黄酮调节剂,这也是考虑到异源检测系统。这些结果揭示了R2R3-MYB转录因子AtMYB12和Bv_iogq之间的大量功能相似性,正如结构相似性所预测的那样(图2).AtMYB12先前被证明在不需要bHLH辅助因子的情况下激活一个类黄酮通路基因子集[61].Bv_iogq在R2R3结构域中也缺乏bHLH相互作用基序,因此在不需要辅助因子的情况下激活一个类黄酮通路基因子集(图5),证实黄酮醇的合成不依赖于bHLH辅助因子答:芥而且b .寻常的.转活化实验的结果表明,Bv_iogq是黄酮醇生物合成的特异性调控因子,可能调控黄酮醇前体在黄酮醇形成过程中的早期生物合成基因b .寻常的.
拟南芥多重pfg突变体黄酮醇缺乏表型的互补
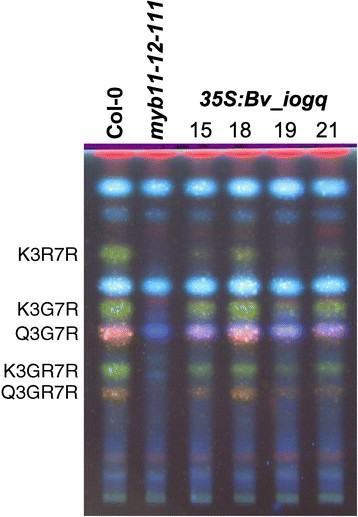
为了证实Bv_iogq作为黄酮醇合成的调节因子的作用Bv_iogqORF在花椰菜花叶病毒35S启动子(2 x35s: Bv_iogq)在A. thaliana myb11 myb12 myb111三突变体。而突变体幼苗表现为黄酮醇缺乏表型,几个独立稳定的转基因Myb11 myb12 myb111:2×35S:Bv_iogq线显示黄酮醇积累,通过高效薄层色谱(HPTLC)的二苯硼酸-2-氨基乙基lester (DPBA)染色可见黄酮醇分离(图6).这个结果清楚地表明Bv_iogq能够补充A. thaliana myb11 myb12 myb111缺乏黄酮醇合成的突变体。因此,Bv_iogq fromb .寻常的是一种功能性R2R3-MYB转录因子,参与调控黄酮醇生物合成。为了表示这个函数,我们命名为Bv_iogq根据答:芥直接同源:BvMYB12 (BvPFG1).
35 s: Bv_iogq补充黄酮醇缺乏A. thaliana myb11-12-111突变体。独立转基因T2苗甲醇提取物的HPTLC答:芥行(15,18,19,21)包含T-DNA插入与a35 s: Bv_iogq在黄酮醇缺乏的情况下构建myb11 - 12 - 111背景。DPBA染色和紫外光照下可见黄酮醇苷,显示山奈酚衍生物(绿色)和槲皮素衍生物(橙色)。K3R7R kaempferol-3 -O-rhamnoside-7 -O-rhamnoside;K3G7R kaempferol-3 -O-glucoside-7 -O-rhamnoside;Q3G7R quercetin-3 -O-glucoside-7 -O-rhamnoside;K3GR7R kaempferol-3 -O- glucorhamnosid-7O-rhamnoside;Q3GR7R quercetin-3 -O- glucorhamnosid-7O-rhamnoside。
结论
的全基因组鉴定,染色体组织,功能分类和表达分析B. vulgaris基因提供了对这种转录因子编码基因家族及其在生长和发育过程中的潜在参与的全面了解。这项研究为克隆和功能解剖提供了第一步MYB这个在经济上和进化上有趣的物种的基因,作为石龙目的代表。通过实验验证了功能分类的正确性R2R3-MYB基因Bv_iogq编码黄酮醇调节器,从而使BvMYB12成为第一个具有实验证明功能的甜菜R2R3-MYB。
方法
在数据库中搜索寻常草基因组中MYB蛋白编码基因
MYB蛋白编码基因的初步研究b .寻常的使用一致的R2R3-MYB DNA结合域序列[19]作为TBLASTN中的蛋白质查询[64]对甜菜基因组序列(RefBeet,http://www.genomforschung.uni-bielefeld.de/en/projects/annobeet).为了确认获得的氨基酸序列,人工分析假定的MYB序列是否存在完整的MYB结构域。所有b .寻常的检查MYB蛋白,以确保假定的基因模型包含两个或多个(多个)MYB重复序列,并且基因模型映射到基因组中的唯一位点。将冗余序列从数据集中丢弃,以获得唯一序列BvMYB基因。所确定的BvMYB与自动标注的基因进行匹配MYB从多姆的研究基因等.([26])。打开阅读框的标识BvMYB已经通过映射、可视化和人工检查组合RNA-seq数据进行了验证。此外,手动识别BvMYB基因得到一个唯一的不可改变的四字母id和一个描述假染色体或未锚定支架位置的基因代码。本工作中使用的蛋白质序列的多个FASTA文件,CDS和CDSi (CDS加内含子)序列BvMYBs被发现为附加文件4,5而且6.
序列守恒分析
分析基因MYB结构域的序列特征b .寻常的70个BvR2R3-MYB蛋白的R2和R3 MYB重复序列与ClustalOmega (1.2.0) (http://www.ebi.ac.uk/Tools/msa/clustalo/),使用默认参数。R2和R3 MYB重复序列的标识是由基于web的应用程序从多个对齐文件生成的WebLogo(http://weblogo.berkeley.edu/logo.cgi) [65]使用默认设置。
系统发育分析
133答:芥MYB蛋白序列来自TAIR (http://www.arabidopsis.org/).51条著名标志性植物R2R3-MYB蛋白序列从美国国家生物技术信息中心(NCBI)的GenBank (http://www.ncbi.nlm.nih.gov/).我们还考虑了非典型多myb重复蛋白答:芥在系统发育分析中确定了直系同源b .寻常的基因组:AtCDC5, AtMYB4R1和5个AtMYB3R。利用MEGA5.2,利用ClustalW标记的全长MYB蛋白(75个bvmyb, 133个atmyb和51个植物标志性MYB)构建系统发育树[33]使用全长蛋白质和默认设置。树的生成采用两种统计方法:(i)邻接法(NJ)毒性校正和自举分析,1000个重复;(ii)最大简约法(MP), 1000个自举重复。分类b .寻常的根据myb与其对应的系统发育关系进行鉴定答:芥和标志性MYB蛋白。
rna测序数据表达分析
RNA-seq的原始数据来自花序,主根,老叶,种子和幼苗b .寻常的双单倍体参考系KWS2320已在Dohm的工作中得到et al。[26]并存入NCBI短读档案馆(SRA),登录号为SRX287608-SRX287615。RNA-seq原始数据是从嫩叶(第三和第四叶,没有中裂口)中分离出来的RNA,通过对端测序(2× 101碱基)在一个Illumina公司HiSeq1500文书,并与详细文件一起存放在SRA,登记号为SRX647324。原始RNA-seq读取使用trimmommatic -0.22进行修剪[66]和选项ILLUMINACLIP,领先:3,落后:3,滑动窗口:4:15以及MINLEN:36。Tophat [67]映射与RefBeet序列相比,只使用Trimmomatic-0.22生成的修剪成对读取(附加文件7).对于长读集(>55碱基读长)和短读集(≤55碱基读长)的映射,配对内距分别设置为175和150,选项solexa1.3-quals被打开了。映射结果显示在“附加文件”中7.生成的BAM文件根据最小映射质量5进行质量过滤,并使用SAMtools进行转换[68].SAM文件随后排序(Unix命令sort -s -k 1,1)。每个基因的读取量是基于人工校正的基因结构(以gff3格式存储)和排序的SAM文件(HTSeq -count(选项t = CDS), HTSeq版本0.5.4 (http://www-huber.embl.de/users/anders/HTSeq/doc/overview.html).HTSeq为每个器官创建的单计数表使用定制的Perl脚本连接,随后通过DESeq包导入R中[69].数据设计、样本分配和归一化如前所述[69].不同数据集对幼苗、主根、幼叶、老叶、花序和种子的校正因子分别为4.02、1.25、3.53、0.11、1.47、0.41。
RNA-seq数据的层次聚类和热图可视化
使用Cluster 3.0软件对log2转换的归一化RNA-seq数据进行中心-连锁层次聚类[70) (http://bonsai.hgc.jp/~mdehoon/software/cluster/software.htm).分层聚类结果使用Java TreeView可视化[71) (http://jtreeview.sourceforge.net).
植物材料和生长条件
b .寻常的KWS2320种子用70%乙醇表面消毒,然后在有盖的塑料烧杯中播种在无菌的湿棉絮上。幼苗在22°C下生长一周,每天光照16小时。所有其他植物材料从温室/土壤中收获b .寻常的植物。
RNA分离和cDNA合成
RNA从50毫克植物材料中分离使用NucleoSpin®RNA的植物工具包(Macherey-Nagel)根据制造商的说明。如前所述,由1 μg总RNA生成cDNA [60].
cDNA克隆
cDNA片段对应于的全长ORF的cDNA片段Bv_iogq(1164 bp)通过PCR得到含有RS1050 (5'-attB1-ccATGGGGAGAGCACCGTGTTGCGAAAAG-3')和反义RS1051 (5'-attB2-gTTATGAAAGTAGCCAATCAAGCATAGC-3')引物的attB重组位点Phusion®聚合酶(新英格兰生物实验室)在从中制备的cdna上b .寻常的KWS2320嫩叶为模板。PCR产物通过BP克隆酶(pDONRzeo)导入GATEWAY®载体pDONRzeo。表达载体),给予Bv_iogq入口克隆(RSt810)。的Bv_iogqcDNA序列提交EMBL/GenBank;注册编号KJ707238。
与Bv_iogq互补实验
的Bv_iogq进入克隆经lr反应重组(表达载体)转换为二进制目标向量pLEELA [72给,给2×35 s: Bv_iogq构造(RSt815)。所得到的质粒用于转化黄酮醇缺乏的互补实验答:芥三突变体Myb11 myb12 myb111(NASC N9815)通过根癌土壤杆菌(GV3101:: pM90RK) [73]根据浸花程序。采用高效薄层色谱法(HPTLC)和二苯硼酸2-氨基乙酯(DPBA)染色法分析不同转基因株系T2幼苗含黄酮醇的甲醇提取物[60].
瞬态原生质体测定
的增长答:芥按照Mehrtens的描述,进行At7细胞培养、原生质体分离和瞬时表达检测的转染实验et al。[61].共转染实验中,共转染25 μg预混合质粒DNA,包括10 μg报告质粒(转录GUS融合)、10 μg效应质粒和5 μg荧光素酶(LUC)转染对照(4 xproubi:卢克) [74].原生质体在26℃黑暗条件下孵育20 h后,测定LUC和GUS酶活性。特异GUS活性以每毫克蛋白质每分钟pmol 4-甲基伞形酮(MU)表示。误差条表示分别报告物/效应物组合确定的四个GUS值的标准偏差。的35 s: Bv_iogq通过lr反应得到效应质粒(RSt816)(表达载体)的Bv_iogq入口克隆(RSt810)与目标向量pBTdest [75].一个1064 bp的启动子片段proBvCHS_phae是通过PCR在基因组b .寻常的使用含有引物BP60 (5'-attB1-CCACAAGAACATCTTGTAAGAGC-3')和BP55 (5'-attB2-CAACTCGTGAGTATGAAGAAATATG-3')的attB重组位点的KWS2320 DNA。1137 bp的启动子片段proBvFLS_ckiq分别用attB引物RS1128 (5'- attb1 - tataccttgtaatatatcacttaaatct -3')和RS1129 (5'-attB2-CCATTGAATATCAACTCAGGATTTTC-3')获得。所得到的PCR产物通过BP和LR反应导入GATEWAY®目的载体pDISCO [76给…proBvCHS_phae-GUS(DH33)和proBvFLS_ckiq-GUS(RSt830)报告器构造。其他效应器和报告器结构已在其他地方描述[13]、[61]、[77].
支持数据的可用性
系统发育数据(树和用于生成它们的数据)已保存在TreeBASE存储库中,并可在URL下获得http://purl.org/phylo/treebase/phylows/study/TB2:S16360.
植物的花序、主根、幼叶、老叶、种子和幼苗的RNA-seq数据b .寻常的行KWS2320保存在NCBI Short Read Archive (SRA;http://www.ncbi.nlm.nih.gov/sra/),编号为SRX287608-SRX287615和SRX647324。
附加文件
参考文献
- 1.
Riechmann JL, Heard J, Martin G, Reuber L, Jiang CZ, Keddie J, Adam L, Pineda O, Ratcliffe OJ, Samaha RR, Creelman R, Pilgrim M, Broun P, Zhang JZ, Ghandehari D, Sherman BK, Yu CL:拟南芥转录因子:真核生物全基因组比较分析。科学通报,2000,29(4):344 - 344。10.1126 / science.290.5499.2105。
- 2.
Dubos C, Stracke R, Grotewold E, Weisshaar B, Martin C, Lepiniec L:拟南芥MYB转录因子。植物科学进展,2010,15:573-581。10.1016 / j.tplants.2010.06.005。
- 3.
Ogata K, Kanei-Ishii C, Sasaki M, Hatanaka H, Nagadoi A, Enari M, Nakamura H, Nishimura Y, Ishii S, Sarai A: Myb DNA结合域疏水核心的空腔用于DNA识别和反式激活。中国生物工程学报,1996,3(2):178-187。10.1038 / nsb0296 - 178。
- 4.
贾磊,蒋涛:dna结合域的进化动力学研究R2R3-MYB水稻亚种籼稻和粳稻基因组的基因鉴定。植物科学进展,2004,34(2):344 - 344。10.1104 / pp.103.027201。
- 5.
克伦普纳尔,龚达,毕晓明。逆转录病毒白血病基因的核苷酸序列研究v-myb以及它的细胞祖细胞c-myb:转导癌基因的结构。细胞,1982,31:453-463。10.1016 / 0092 - 8674(82) 90138 - 6。
- 6.
Ito M:植物中三重复Myb转录因子的保护和多样化。植物保护学报,2005,29(1):1-6。10.1007 / s10265 - 005 - 0192 - 8。
- 7.
Haga N, Kato K, Murase M, Araki S, Kubo M, Demura T, Suzuki K, Muller I, Voss U, Jurgens G, Ito M: R1R2R3-Myb蛋白通过激活胞质分裂正向调控KNOLLE转录的拟南芥.中国农业科学,2007,34(6):344 - 344。10.1242 / dev.02801。
- 8.
Jin H, Martin C:植物内部的多功能性和多样性MYB基因家族。植物分子生物学,1999,41(5):577-585。10.1023 /: 1006319732410。
- 9.
Rosinski JA, Atchley WR: Myb转录因子家族的分子进化:多系起源的证据。中华药理学杂志,1998,46(1):74-83。10.1007 / PL00006285。
- 10.
Braun EL, Grotewold E:新发现的植物c-myb类基因改写了植物的进化过程myb基因家族。植物科学学报,2004,27(3):344 - 344。10.1104 / pp.121.1.21。
- 11.
Kranz H, Scholz K, Weisshaar B:c-MYB编码三个MYB重复序列的癌基因样基因在所有主要的植物谱系中都存在。植物学报,2000,21(2):231-235。10.1046 / j.1365 - 313 x.2000.00666.x。
- 12.
Dias AP, Braun EL, McMullen MD, Grotewold E:最近复制的玉米R2R3 Myb基因为重复后进化分化的不同机制提供了证据。植物营养学报,2003,31(2):339 - 339。10.1104 / pp.012047。
- 13.
Zimmermann IM, Heim MA, Weisshaar B, Uhrig JF:综合识别拟南芥MYB转录因子与R/ b样BHLH蛋白相互作用。植物学报,2004,30(4):344 - 344。10.1111 / j.1365 - 313 x.2004.02183.x。
- 14.
宋松,齐涛,黄红,任强,吴东,常春,彭伟,刘艳,彭娟,谢东:拟南芥茉莉酸- zim结构域蛋白与R2R3-MYB转录因子MYB21和MYB24相互作用影响茉莉酸调控的雄蕊发育。植物细胞学报,2011,23(3):1000-1013。10.1105 / tpc.111.083089。
- 15.
杜华,杨世升,梁震,冯斌斌,刘玲,黄一斌,唐玉玉:大豆MYB转录因子超家族的全基因组分析。中国生物医学工程学报,2012,29(6):528 - 528。
- 16.
Kranz HD, Denekamp M, Greco R, Jin H, Leyva A, Meissner RC, Petroni K, Urzainqui A, Bevan M, Martin C, Smeekens S, Tonelli C, Paz-Ares J, Weisshaar B:朝着成员的功能特征R2R3-MYB基因家族拟南芥.植物学报,1998,16(3):366 - 366。10.1046 / j.1365 - 313 x.1998.00278.x。
- 17.
Stracke R, Werber M, Weisshaar B: TheR2R3-MYB基因家族拟南芥.植物学报,2001,4:447-456。10.1016 / s1369 - 5266(00) 00199 - 0。
- 18.
蒋超,顾晓霞,Peterson T:基因保守结构和羧基末端基序的鉴定Myb拟南芥和栽培稻l . ssp。籼稻。中国生物医学工程学报,2004,5 (7):R46-10.1186/gb-2004-5-7-r46。
- 19.
Matus JT, aquaa F, Arce-Johnson P:葡萄MYB R2R3亚家族的分析揭示了葡萄和拟南芥基因组中与葡萄酒品质相关的扩展分支和保守的基因结构组织。BMC植物生物学2008年,8(83)。
- 20.
杨晓明,杨晓明,杨晓明,杨晓明,杨晓明:杨树R2R3-MYB转录因子家族的扩增和多样性研究。植物学报,2009,29(2):379 - 379。10.1104 / pp.108.132795。
- 21.
杨晓明,王晓明,杨晓明,等。植物MYB转录因子的研究进展。植物学报,1997,13(2):67-73。10.1016 / s0168 - 9525(96) 10049 - 4。
- 22.
杜华,冯斌斌,杨世升,黄亚波,唐玉玉:玉米R2R3-MYB转录因子基因家族。公共科学学报,2012,7 (6):e37463-10.1371/journal.pone.0037463。
- 23.
闫辉C,晓远Y, H坤,美华L,吉刚L,赵峰G,志强L,云飞Z,晓晓W,晓明Q,云平S,李Z,晓辉D,静初L,邢旺D,张良C,洪亚G,李嘉Q:拟南芥MYB转录因子超家族:与水稻MYB家族的表达分析及系统发育比较。植物分子生物学,2006,60(1):107-124。10.1007 / s11103 - 005 - 2910 - y。
- 24.
李强,张超,李娟,王玲,任志:水稻R2R3MYB家族的全基因组鉴定与鉴定Cucumis巨大成功.公共科学学报,2012,7 (10):e47576-10.1371/journal.pone.0047576。
- 25.
曹志华,张淑珍,王荣康,张文峰,郝玉娟:苹果MYB转录因子家族全基因组分析可鉴定MdoMYB121植物抗非生物胁迫基因。公共科学学报,2013,8 (7):e69955-10.1371/journal.pone.0069955。
- 26.
Dohm JC, Minoche AE, Holtgrawe D, Capella-Gutierrez S, Zakrzewski F, Tafer H, Rupp O, Sorensen TR, Stracke R, Reinhardt R, Goesmann A, Kraft T, Schulz B, Stadler PF, Schmidt T, Gabaldon T, Lehrach H, Weisshaar B, Himmelbauer H:新近驯化作物甜菜的基因组(甜菜属).自然科学进展,2014,38(4):344 - 344。10.1038 / nature12817。
- 27.
拟南芥基因组计划:分析开花植物的基因组序列拟南芥.自然科学学报,2000,27(2):344 - 344。10.1038 / 35048692。
- 28.
栽培稻l . ssp。粳稻)。科学通报,2002,29(5):528 - 528。10.1126 / science.1068275。
- 29.
Tuskan GA, Difazio S, Jansson S, Bohlmann J, grigoriiev I, Hellsten U, Putnam N, Ralph S, Rombauts S, Salamov A, Schein J, Sterck L, Aerts A, Bhalerao RR, Bhalerao RP, Blaudez D, Boerjan W, Brun A, Brunner A, Busov V, Campbell M, Carlson J, Chalot M, Chapman J, Chen GL, Cooper D, Coutinho PM, Couturier J, Covert S, Cronk Q,等:杨树trichocarpa(托。&灰色)。科学通报,2006,29(3):344 - 344。10.1126 / science.1128691。
- 30.
Schmutz J, Cannon SB, Schlueter J, Ma J, Mitros T, Nelson W, Hyten DL, Song Q, Thelen JJ, Cheng J, Xu D, Hellsten U, May GD, Yu Y, Sakurai T, Umezawa T, Bhattacharyya MK, Sandhu D, Valliyodan B, Lindquist E, Peto M, Grant D, Shu S, Goodstein D, Barry K, Futrell-Griggs M, Abernathy B, Du J, Tian Z, Zhu L,等:古多倍体大豆基因组序列分析。自然科学学报,2010,38(4):344 - 344。10.1038 / nature08670。
- 31.
Velasco R, Zharkikh A, Affourtit J, Dhingra A, Cestaro A, Kalyanaraman A, Fontana P, Bhatnagar SK, Troggio M, Pruss D, Salvi S, Pindo M, Baldi P, Castelletti S, Cavaiuolo M, Coppola G, Costa F, Cova V, Dal Ri A, Goremykin V, Komjanc M, Longhi S, Magnago P, Malacarne G, Malnoy M, Micheletti D, Moretto M, Perazzolli M, Si-Ammour A, Vezzulli S等:驯化苹果(Malus x domestica Borkh.)的基因组。自然遗传学,2010,42(10):833-839。10.1038 / ng.654。
- 32.
Dohm JC, Lange C, Holtgräwe D, Sörensen TR, Borchardt D, Schulz B, Lehrach H, Weisshaar B, Himmelbauer H:从广泛的基于基因的物理和遗传图谱推断出Caryophyllales的古六倍体祖先(甜菜属).植物学报,2012,30(3):344 - 344。10.1111 / j.1365 - 313 x.2011.04898.x。
- 33.
Tamura K, Peterson D, Peterson N, Stecher G, Nei M, Kumar S: MEGA5:利用最大似然,进化距离和最大简约方法进行分子进化遗传学分析。分子生物学杂志,2011,28(10):2731-2739。10.1093 / molbev / msr121。
- 34.
Celenza JL, Quiel JA, Smolen GA, Merrikh H, Silvestro AR, Normanly J, Bender J:拟南芥ATR1 Myb转录因子控制吲哚硫代葡萄糖苷稳态。中国生物医学工程学报,2005,37(1):344 - 344。10.1104 / pp.104.054395。
- 35.
Sonderby IE, Hansen BG, Bjarnholt N, Ticconi C, Halkier BA, Kliebenstein DJ:系统生物学方法识别R2R3 MYB在脂肪族硫代葡萄糖苷调控中具有不同和重叠功能的基因亚家族。公共科学图书馆,2007,2 (12):e1322-10.1371/journal.pone.0001322。
- 36.
Gigolashvili T, Berger B, Mock HP, Muller C, Weisshaar B, Flugge UI:转录因子HIG1/MYB51调节吲哚硫代葡萄糖苷生物合成拟南芥.植物学报,2007,30(5):366 - 366。10.1111 / j.1365 - 313 x.2007.03099.x。
- 37.
Gigolashvili T, Engqvist M, Yatusevich R, Muller C, Flugge UI: HAG2/MYB76和HAG3/MYB29对脂肪族硫代葡萄糖苷生物合成的调控具有特异性和协调性拟南芥.植物保护学报,2008,37(3):344 - 344。10.1111 / j.1469-8137.2007.02295.x。
- 38.
Oppenheimer DG, Herman PL, Sivakumaran S, Esch J, Marks MD: Amyb拟南芥叶片毛状体分化所需基因在托叶中表达。细胞,1991,67:483-493。10.1016 / 0092 - 8674(91) 90523 - 2。
- 39.
Lee MM, Schiefelbein J:狼人(WEREWOLF)是拟南芥中myb相关蛋白,是一种位置依赖的表皮细胞模式调节蛋白。细胞科学学报,1999,24(5):473-483。10.1016 / s0092 - 8674(00) 81536 - 6。
- 40.
Kirik V, Lee MM, Wester K, Herrmann U, Zheng Z, Oppenheimer D, Schiefelbein J, Hulskamp M:功能多样化MYB23而且GL1毛状体形态发生和启动的基因。中国科学进展。2005,32(7):379 - 379。10.1242 / dev.01708。
- 41.
Serna L, Martin C:毛状体:不同的调控网络导致聚合结构。植物科学进展,2006,11(6):274-280。10.1016 / j.tplants.2006.04.008。
- 42.
Brockington SF, Alvarez-Fernandez R, Landis JB, Alcorn K, Walker RH, Thomas MM, Hileman LC, Glover BJ:演化分析MIXTA基因家族突出了细胞分化研究的潜在靶点。分子生物学杂志,2013,30(3):526-540。10.1093 / molbev / mss260。
- 43.
Perez-Rodriguez M, Jaffe FW, Butelli E, Glover BJ, Martin C:三种不同细胞类型的发育与一种特定MYB转录因子的活性有关金鱼草majus花。发展,2005,132(2):359-370。10.1242 / dev.01584。
- 44.
黄志强,王志强,范德武德K,苏尔E,德维特恩N,摩尔J,科埃斯R:分子分析anthocyanin2矮牵牛的基因及其在花色进化中的作用。植物学报,1999,29(4):344 - 344。10.1105 / tpc.11.8.1433。
- 45.
赵丽娟,夏玉娟,杨晓明,杨晓明,兰姆C:活化标记法鉴定了一种苯丙类生物合成的MYB保守调控因子。植物学报,2000,12(12):2383-2393。10.1105 / tpc.12.12.2383。
- 46.
Schwinn K, Venail J, Shang Y, Mackay S, Alm V, Butelli E, Oyama R, Bailey P, Davies K, Martin C:一个小家族的myb调节基因控制着反rrhinum属的花色素强度和图案。植物细胞学报,2006,18(4):831-851。10.1105 / tpc.105.039255。
- 47.
赵敏,李志刚,李志刚,李志刚:拟南芥TTG1/bHLH/Myb转录复合体对花青素合成途径的调控。植物学报,2008,32(5):344 - 344。10.1111 / j.1365 - 313 x.2007.03373.x。
- 48.
Kimler L, Mears J, Mabry TJ, Rösler H:关于batalains和花青素互斥性的问题。生物分类学报,1997,19(6):875-878。10.2307 / 1218301。
- 49.
施密特OT, Schönleben W: Zur Kenntnis der Farbstoffe der Roten Rübe, II。科学发展观für自然科学杂志。1957,12b: 262-263。
- 50.
Stafford HA:花青素和甜菜素:相互排斥途径的进化。中国植物科学,1994,19(4):344 - 344。10.1016 / 0168 - 9452(94) 90244 - 5。
- 51.
凯勒W:甜菜中一些主要颜色类型的遗传。农业学报,2003,52:27-38。
- 52.
Goldman IL, Austin D:甜菜R、Y和BI位点的连锁分析。应用理论,2000,20(3):337-343。10.1007 / s001220050044。
- 53.
Hatlestad GJ, Sunnadeniya RM, Akhavan NA, Gonzalez A, Goldman IL, McGrath JM, Lloyd AM:甜菜R基因座编码红色甜菜素生产所需的一种新的细胞色素P450。植物学报,2012,44(7):816-820。10.1038 / ng.2297。
- 54.
李志强,李志强,李志强,Zrÿd JP:一种新型植物4,5-异二醇双加氧酶在甜菜素合成中的功能鉴定马齿苋属的植物大花蔷薇.中国农业科学,2004,34(1):1 - 4。10.1104 / pp.103.031914。
- 55.
Heppel SC, Jaffé FW, Takos AM, Schellmann S, Rausch T, Walker AR, Bogs J:花青素和原花青素调控MYB因子启动子靶特异性进化的关键氨基酸鉴定。中国生物医学工程学报,2013,32(4):457-471。10.1007 / s11103 - 013 - 0074 - 8。
- 56.
Aharoni A, De Vos CHR, Wein M, Sun Z, Greco R, Kroon A, Mol JNM, O'Connell AP:草莓FaMYB1转录因子抑制转基因烟草花青素和黄酮醇积累。植物学报,2001,28(3):319-332。10.1046 / j.1365 - 313 x.2001.01154.x。
- 57.
Deluc L, Barrieu F, Marchive C, Lauvergeat V, Decendit A, Richard T, Carde JP, Merillon JM, Hamdi S:调控苯丙类途径的葡萄R2R3-MYB转录因子的鉴定。植物营养学报,2006,40(2):379 - 379。10.1104 / pp.105.067231。
- 58.
格罗特沃德E,德拉蒙德BJ,鲍文B,彼得森T:myb同源P基因通过直接激活一个类黄酮生物合成基因亚群来控制玉米花器官中的酞酚色素沉着。细胞科学学报,1994,36(3):543-553。10.1016 / 0092 - 8674(94) 90117 - 1。
- 59.
Czemmel S, strke R, Weisshaar B, Cordon N, Harris NN, Walker AR, Robinson SP, Bogs J:葡萄R2R3-MYB转录因子VvMYBF1在葡萄果实发育过程中调控黄酮醇合成。植物学报,2009,29(3):344 - 344。10.1104 / pp.109.142059。
- 60.
strike R, Ishihara H, Huep G, Barsch A, Mehrtens F, Niehaus K, Weisshaar B:密切相关的r2p3 - myb转录因子的差异调控控制黄酮醇在不同部位的积累拟南芥幼苗。植物学报,2007,30(4):366 - 366。10.1111 / j.1365 - 313 x.2007.03078.x。
- 61.
Mehrtens F, Kranz H, Bednarek P, Weisshaar B:拟南芥转录因子MYB12是苯丙醇生物合成的黄酮醇特异性调节因子。中国生物医学工程学报,2005,29(2):344 - 344。10.1104 / pp.104.058032。
- 62.
Gardner RL, Kerst AF, Wilson DM, Payne MG: β vulgaris L.:从叶片中分离出的三种多酚的性质。植物化学学报,1997,6:417-422。10.1016 / s0031 - 9422(00) 86299 - 8。
- 63.
石竹类黄酮醇和c -糖基黄酮。生物化学学报,1998,26(3):344 - 344。10.1016 / 0305 - 1978(78) 90046 - 7。
- 64.
Altschul SF, Gish W, Miller W, Myers EW, Lipman DJ:基本的局部对齐搜索工具。中华分子生物学杂志,2000,26(3):344 - 344。10.1016 / s0022 - 2836(05) 80360 - 2。
- 65.
克鲁克斯GE, Hon G, Chandonia J-M, Brenner SE: WebLogo:一个序列Logo生成器。基因组学报,2004,14:1188-1190。10.1101 / gr.849004。
- 66.
Lohse M, Bolger AM, Nagel A, Fernie AR, Lunn JE, Stitt M, Usadel B: RobiNA:一个用户友好的,基于rna - seq转录组学的集成软件解决方案。核酸决议2012,40 (Web服务器issue): W622-W627。10.1093 / nar / gks540。
- 67.
Kim D, Pertea G, Trapnell C, Pimentel H, Kelley R, Salzberg SL: TopHat2:存在插入、缺失和基因融合时转录组的精确对齐。中国生物医学工程学报,2013,14 (4):R36-10.1186/gb-2013-14-4-r36。
- 68.
Li H, Handsaker B, Wysoker A, Fennell T, ruj, Homer N, Marth G, Abecasis G, Durbin R:序列比对/映射格式与SAMtools。生物信息学,2009,25(16):2078-2079。10.1093 /生物信息学/ btp352。
- 69.
杨晓明,王晓明,王晓明,等。序列计数数据的差分表达式分析。中国生物工程学报,2010,11 (10):R106-10.1186/gb-2010-11-10-r106。
- 70.
De Hoon MJ, Imoto S, Nolan J, Miyano S:开源集群软件。生物信息学,2004,20(9):1453-1454。10.1093 /生物信息学/ bth078。
- 71.
Saldanha AJ: Java treeview可扩展的微阵列数据可视化。生物信息学,2004,20(17):3246-3248。10.1093 /生物信息学/ bth349。
- 72.
Jakoby M, Wang HY, Reidt W, Weisshaar B, Bauer P: FRU (BHLH029)诱导铁动员基因拟南芥.中国生物医学工程学报,2004,29(3):528-534。10.1016 / j.febslet.2004.10.062。
- 73.
Koncz C, Schell J: TL-DNA基因的启动子5控制一种新型农杆菌二元载体携带的嵌合基因的组织特异性表达。中国生物医学工程学报,2004,27(3):366 - 366。10.1007 / BF00331014。
- 74.
Sprenger-Haussels M, Weisshaar B:欧芹富脯氨酸bZIP转录因子的转激活特性。植物学报,2000,22(1):1-8。10.1046 / j.1365 - 313 x.2000.00687.x。
- 75.
Baudry A, Heim MA, Dubreucq B, Caboche M, Weisshaar B, Lepiniec L: TT2, TT8, TTG1协同指定的表达也有而原花青素在生物合成中拟南芥.植物学报,2004,39(3):366-380。10.1111 / j.1365 - 313 x.2004.02138.x。
- 76.
strake R, Jahns O, Keck M, Tohge T, Niehaus K, Fernie AR, Weisshaar B:黄酮醇苷积累对黄酮醇苷产生的影响拟南芥植物显示MYB11-, MYB12-和myb111不依赖的黄酮醇苷积累。中国生态学报,2010,38(4):379 - 379。10.1111 / j.1469-8137.2010.03421.x。
- 77.
哈特曼U, Valentine WJ, Christie JM, Hays J, Jenkins GI, Weisshaar B:紫外/蓝光响应元素的识别拟南芥查尔酮合成酶启动子使用同源原生质体瞬时表达系统。植物分子生物学杂志,1998,36:741-754。10.1023 /: 1005921914384。
确认
我们感谢梅兰妮·库尔曼提供的出色技术援助。我们感谢Sebastian Packheiser,他为克隆和植物转化做出了贡献。这项工作得到了教育和科学部(BMBF)资助“AnnoBeet:注释des Genoms der Zuckerrübe unter Berücksichtigung von Genfunktionen und struktureller Variabilität für Nutzung von genome daten in der Pflanzenbiotechnologie”(FKZ 0315962 A)的支持。进一步“感谢”我们的工业合作伙伴KWS Saat AG和先正达种子有限公司。我们感谢德国研究基金会和比勒费尔德大学图书馆开放获取出版基金对文章处理费的支持。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
RS和BW构思并设计了研究。RS和BP进行了实验。RS、DH、JS和TRS对数据进行了分析和解释。RS和BW撰写了手稿。所有作者都阅读并批准了最终的手稿。
电子辅助材料
MYB结构域的多次对齐为70
附加文件1:b .寻常的R2R3-MYB蛋白质。ClustalW氨基酸序列比对。顶部的黑色箭头表示保守的、规则间隔的色氨酸(W)或苯丙氨酸(F)残基。顶部的位置编号与图中给出的位置编号相对应2.(doc 42 kb)
系统发育最大简约(MP)树(1000自举)与MYB蛋白来自
附加文件2:B. vulgaris (Bv), A. thaliana (At)以及使用MEGA5.2建造的其他工厂的标志性myb。引导措施是在分支机构给出的。分支(和子组)由不同深浅的灰色标记和指示。(pdf 821 kb)
的表达
附加文件3:BvMYB器官中的基因b .寻常的参考线KWS2320,由Dohm研究的RNA-seq数据推断et al。([[26]])。计算每个基因的ReadsBvMYB基因结构。根据Anders和Huber(2010)的方法,将每个器官的单计数表转换为归一化数据,使用不同数据集的校正因子,分别计算为幼苗、主根、幼叶、老叶、花序、种子的4.02、1.25、3.53、0.11、1.47、0.41。(docx145kb)
多个FASTA文件的CDS序列
附加文件5:BvMYBs.(txt 82kb)
多个带有CDSi (CDS加内含子)序列的FASTA文件
附加文件6:BvMYBs.(txt 231kb)
修剪和映射RNA-seq读取。(一)
附加文件7:修剪RNA-seq原始读取使用Trimmomatic.SRA:序列读存档。(B)应用后,RNA-seq读取到RefBeet的映射大礼帽.(doc 44 kb)
权利和权限
本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用属性许可协议(http://creativecommons.org/licenses/by/4.0),允许在任何媒介上不受限制地使用、传播和复制,前提是原创作品的名称要注明出处。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
斯特莱克,R., Holtgräwe, D.,施耐德,J.。et al。的全基因组鉴定和特征R2R3-MYB甜菜的基因(甜菜属).BMC植物生物学14,249(2014)。https://doi.org/10.1186/s12870-014-0249-8
收到了:
接受:
发表:
关键字
- 甜菜属
- 石竹目
- R2R3-MYB
- 转录因子
- 基因家族
- 黄酮醇调节器