摘要
背景
小的Rab gtpase是植物水疱运输的重要调节因子。AtRabA1d是小gtpase RabA1亚家族的成员之一,此前在生长的根毛中富含囊泡的根尖顶部发现,这表明它在根尖生长过程中起作用;然而,其在植物细胞内的具体定位和作用尚未被很好地描述。
结果
的瞬时表达35个年代::绿色荧光蛋白:RabA1d构建在韭葱而且烟草benthamiana揭示了囊泡结构,进一步证实了稳定转化拟南芥植物。与GFP-RabA1d共域反式-高尔基网络标记mCherry-VTI12和早期fm4 -64标记的内体室隔。分别用FYVE-DsRed和ER-DsRed标记的晚期内小体和内质网均不含GFP-RabA1d。GFP-RabA1d在brefeldin A (BFA)诱导区隔核心的积累和BFA处理后RabA1d蛋白水平的定量上调证实了RabA1d与早期核内体/TGN的关联及其在囊泡运输中的作用。光镜观察显示RabA1d参与了根的发育。在根细胞中,GFP-RabA1d跟随细胞板扩张,与细胞动力学相关的囊泡运输和膜循环一致。GFP-RabA1d在新生细胞板的盘状结构中积累,逐渐演化为生长细胞板的边缘环状结构。在根毛生长发育过程中,GFP-RabA1d在根毛突起处和根毛大力伸长的根顶处富集。重要的是,GFP-RabA1d信号强度表现出与尖端生长相一致的振荡行为。逐渐地,这种根尖定位在成熟的根毛中消失,这表明RabA1d的根尖定位与根毛伸长之间存在联系。我们的结果支持RabA1d在需要强有力的膜贩运的事件中发挥作用。
结论
RabA1d位于早期核内体/TGN中,参与囊泡运输。RabA1d参与细胞板的形成和根毛振荡尖的生长。GFP-RabA1d亚细胞定位证实了其特定的时空积累与细胞板和根毛形成过程中局部囊泡运输需求之间的相关性。
背景
细胞的扩张和分裂是所有生物的基本过程。它们需要源源不断的蛋白质和脂质来生成新的质膜和细胞壁,并通过内吞作用来回收多余的膜和回收蛋白质组分,以维持细胞内膜的稳态[1] - [3.].这些高度动态的事件是由几个水疱贩运监管机构精心策划的。在这些因素中,Rab家族的小GTPases在植物细胞中起着核心作用[4] - [6].Rab GTPase是Ras小GTPase超家族的成员。Rab GTPases在活性gtp结合和膜相关形式和非活性gtp结合和主要的细胞质形式之间循环,并参与囊泡运输、栓系和融合过程中囊泡靶向的膜特性和特异性[7].机械上,Rab GTPases通过其与膜的可逆和GTP/ gdp依赖的结合/解离来执行特定膜表面的动力学校对。在它们的活性,gtp结合形式,Rab gtp酶参与到间接相互作用的外壳成分,马达蛋白和SNAREs。因此,在真核细胞的膜运输过程中,Rab GTPases作为多层面的组织者出现了[8] - [10].Rab gtpase家族的扩增尤其明显拟南芥有57个个体成员,分为8个亚科(RabA到RabH)。植物中最广泛的亚科(对应于拟南芥RabA (Rab11)包含已鉴定的57个基因组中的26个拟南芥rab [4]、[7]、[11].
请记住,与拟南芥,哺乳动物(只有三个成员;Rab11a, Rab11b及Rab25/Rab11c [12)和酵母(只有两个成员;Ypt31/32 [13]、[7RabA同系物的代表性要少得多[14],这是一个了解植物中每个raba的具体功能的问题。因此,从蛋白质-蛋白质相互作用、细胞内定位模式的特异性以及在组织和器官水平上可能的差异发育调控等方面研究植物RabA多样性具有重要意义。
之前的研究已经阐明了一些raba的极定位(RabA4d [15], RabA4b [16], RabA2 [17], RabA1d [18[])及其在花粉管和根毛伸长过程中对顶端靶细胞壁沉积的意义。RabA4b在细胞壁物质极化囊泡分泌中的作用与效应蛋白PI-4Kβ1的活性有关,并可受肌动蛋白微丝断裂的影响[16]、[19].
植物raba的作用不仅限于极性生长,还与细胞质分裂有关。在植物中,子细胞在有丝分裂后通过细胞动力学沉积进行空间和时间控制的分裂,是一个严重依赖膜转运和内吞作用的过程[20.] - [23].从细胞分裂平面的前期定义开始,微管前期带标记了密集网格蛋白介导的膜检索的位置[22]、[23],细胞板沉积的细胞动力学过程与通过Rab5识别的小泡的细胞板靶向壁材料的内吞相关沉积密切相关拟南芥orthologue Ara7 [20.].Cytokinetic进展在拟南芥招募到RabA2、RabA3和RabA1c,它们与FM4-64和部分液泡H共定位+- atp酶亚基a1 (VHA-a1)在早期核内体和TGN中的表达[24]、[25].在细胞板形成过程中,内吞作用的相对作用还不完全清楚,然而,一些观察表明它的重要作用。细胞表面材料和外源应用的内吞示踪剂被迅速运送到形成的细胞板[20.]、[26],而在细胞板起始前定位于核内体并定位于细胞分裂平面的KNOLLE syntaxin涉及到内吞相关蛋白[20.]、[27]、[28].其中一些蛋白质使用网格蛋白介导机制[29]、[30.,它们的突变也证实了这一点在活的有机体内细胞分裂的作用[24]、[30.].类似地,其他的rabp - gtpase也参与了胞吞过程,如RabF2a, RabF2b和RabF1,它们被VPS9a激活[31],可定位于早期,但优先定位于晚期/多泡核内体[32] - [34].
Rab GTPases的作用不仅限于内吞作用,也被认为在分泌性转运中起作用(例如,RabD1和RabD2;[35])。分泌作用可能也归因于RabA亚家族成员,因为有报道称,其中一些成员定位于与内吞和分泌相关的特定TGN区[26].用空泡H的抑制剂螺霉素A治疗后,它们的聚集进一步证实了TGN的分隔+−atp酶(36]以及它们对wortmannin(一种有效的特异性磷脂肌苷-3激酶抑制剂和液泡运输抑制剂;[24])。此外,RabA2a和VHA-a1在针鼹鼠(决定自突变体的拟南芥,使内吞作用不受影响,但分泌转运受损[36].最后,RabA1b与VAMP721、R-可溶性n -乙基马来酰亚胺敏感因子附着蛋白受体(R- snare)的显著共定位,但与TGN、高尔基体和核内体标记的部分和不稳定关联表明,它在TGN和质膜之间的运输中起着特殊的作用[37].
我们的研究报道了RabA1d的亚细胞定位及其在囊泡运输中的作用。在成像过程中,使用确保细胞活力和无应力的根发育的光学显微镜,我们发现RabA1d参与了两个重要的细胞过程,细胞质分裂期间的细胞板扩张和根毛中振荡尖端的生长,代表了高度活跃的囊泡运输事件。
结果
GFP-RabA1d定位于跨高尔基网室的囊泡样结构
为了遵循RabA1d的定位模式,我们设计了一个在花菜花叶病毒下表达的GFP-RabA1d35个年代启动子。通过瞬时表达GFP-RabA1d检测其定位特异性35个年代::绿色荧光蛋白:RabA1d构建在韭葱而且烟草benthamiana(图1A、D、G J;额外的文件1:图S1A,B)和在的幼苗中得到证实拟南芥使用相同的构造稳定地转换(附加文件1:图就是S1C)。用抗GFP的单克隆抗体western blotting验证融合蛋白的表达,显示一个约46 kDa的单条带,与GFP- raba1d融合的分子量相对应(附加文件)1:图S1D)。
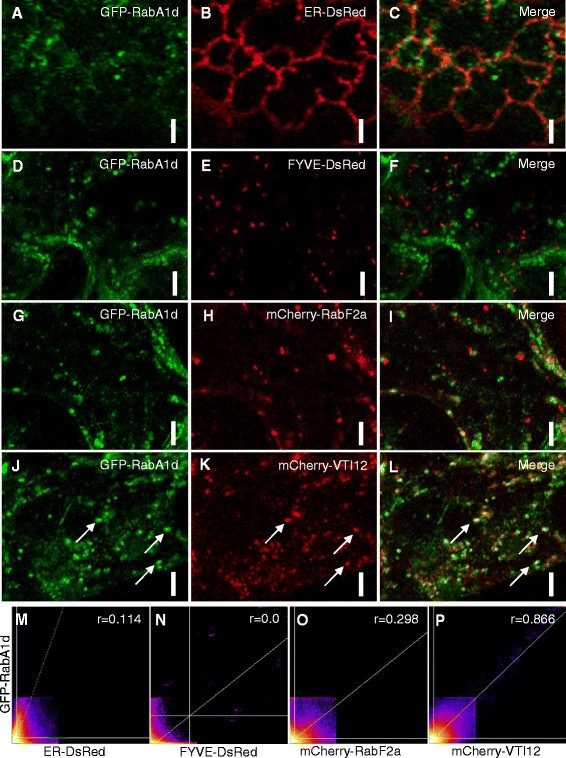
GFP的亚细胞定位-RabA1d标记。GFP-RabA1d在细胞中的亚细胞定位n benthamiana.与ER记者ER- dsred共同可视化(一个-C)显示GFP-RabA1d与皮质ER小管部分相关。GFP-RabA1d与两个2xFYVE-DsRed共域(D-F)也与mCherry-RabF2a(G-我),晚期核内体/多泡小体标记物。GFP-RabA1d与代表TGN标记的mCherry-VTI12共定位(J-L).GFP-Rab1Ad和ER-DsRed的强度相关散点图(M), FYVE-DsRed(N), mCherry-RabF2a(O), mCherry-VTI12(P).在Costes自动阈值后确定Pearson系数(r)。bar表示A-C为3 μm, D-L为5 μm。
在两种瞬态转化的情况下,GFP-RabA1d定位于斑点状结构,这些结构快速地穿过细胞质(附加文件1:图S1A, B)。此外,GFP-RabA1d的定位与已知特异性的内膜标志物包括内质网(融合到DsRed的HDEL信号肽[38];命名为ER-DsRed),晚期核内体和前泡隔室(小鼠Hrs蛋白与DsRed融合的双FYVE结构域;指定FYVE-DsRed [39]、[40]及mCherry-RabF2a [4])和反式-高尔基网络(TGN)/早期核内体(VTI12 SNARE蛋白融合到mCherry;指定mCherry-VTI12 [34]、[41]、[42])。GFP-RabA1d没有与ER- dsred共域,然而,含有GFP-RabA1d的运动点样结构出现在靠近ER小管的位置(图1得了,M)。通过观察FYVE-DsRed和mCherry-RabF2a与GFP-RabA1d的共表达,发现与晚期内小体标记物没有明显的共定位(图1d - i, N, O)。有趣的是,GFP-RabA1d与TGN标记mCherry-VTI12存在明显的共定位。这种共域化表现出良好的定量相关性;因此,RabA1d局限在TGN区(图1J-L, P)。
GFP-RabA1d在BFA隔室中积累,并被BFA处理上调
上述结果表明,GFP-RabA1d定位于TGN/早期核内体,这与RabA类许多其他成员的预期一致。为了更好地证实这种定位模式,拟南芥稳定表达GFP-RabA1d融合的幼苗与膜/内吞噬示踪剂FM4-64共同染色[43],这取决于显微镜观察的直接性,它完全或部分地定位于早期核内体,如那些用荧光蛋白标记的VTI12标记的核内体(例如[34])。
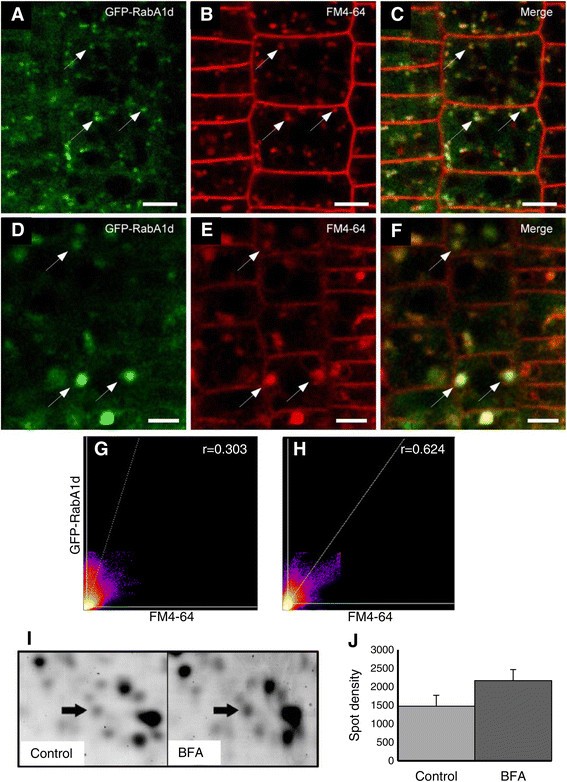
在这种情况下,在染色后6-15分钟内,GFP-RabA1d小泡与内吞途径的早期FM4-64腔室共定位(图2a - c)。与YFP-RabF2a晚期内体标记物的比较进一步证实,仅在15分钟后显示与FM4-64隔室部分共定位(附加文件1:图S2A, B)。接下来,用BFA处理FM4-64染色的根,BFA是一种抑制胞外和胞内循环的真菌毒素,不影响胞内作用的第一步[44]、[45].重要的是,在BFA处理后,GFP-RabA1d与FM4-64一起重新定位并聚集在BFA的核心区(图4-64)2D-F)。这些bfa隔室由核心的TGN和质膜来源的内吞小泡组成,周围是高尔基堆的残留物[44].GFP-RabA1d与FM4-64的共定位表现出良好的定量相关性,在bfa处理后共定位增加(图4-64)2G H)。BFA冲洗后,GFP-RabA1d和FM4-64隔室在5min内开始从BFA隔室中分离,并逐渐在根细胞中重新分布。重要的是,GFP-RabA1d和FM4-64隔区在从BFA隔区释放期间仍然保持共定位(附加文件)1:图S3A-E)。
绿色荧光蛋白-RabA1d在BFA隔室中积累,并被BFA处理上调。根细胞的拟南芥稳定了,35个年代::绿色荧光蛋白:RabA1d构建进行分析。GFP-RabA1d与FM4-64标记的早期内吞噬区共定位(一个-C).BFA处理后,GFP-RabA1d和FM4-64共同积累在BFA室芯中(D-F).根细胞中GFP-Rab1Ad和FM4-64早期内吞室的2d直方图强度及其相关性(G)经BFA处理后(H).Pearson系数(r)采用Costes自动阈值法确定。BFA处理诱导RabA1d蛋白水平上调(我), RabA1d的上调是通过对比2-DE凝胶(箭头)确定的,并随着斑点密度的增加而测量(J).bar表示A-C为4 μm, D-F为5 μm。
bfa处理的蛋白质组学分析拟南芥RabA1d蛋白水平定量上调。诱导率达到1.35倍2I,J),但略超过显著水平(P = 0.061)。MOWSE得分为60分,序列覆盖率为25%,有7个肽段与RabA1d同源1:图S4A, B)。因此RabA1d参与囊泡运输,其在TGN/早期核内体中的表达和定位受BFA的影响。
在细胞分裂过程中,GFP-RabA1d在生长的细胞板中积累
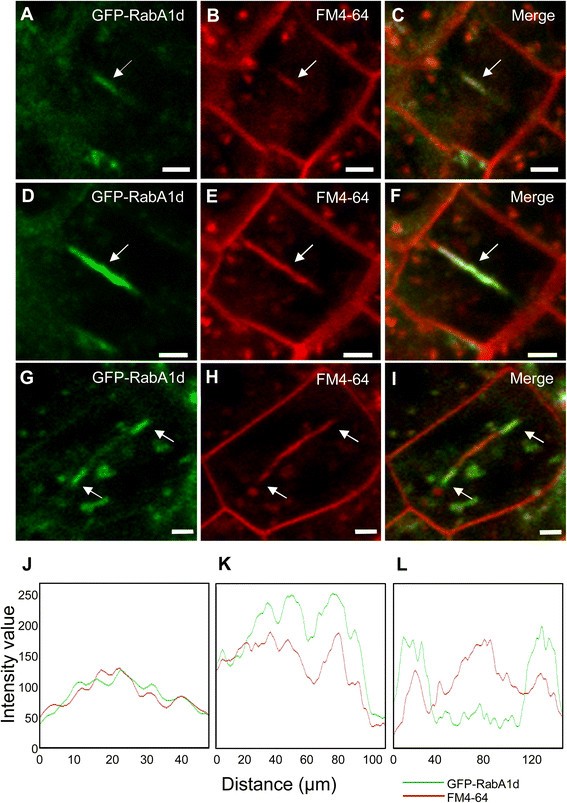
在根分生组织细胞的分裂过程中,GFP-RabA1d在细胞板沉积平面上特异积累,与微管成膜体的离心膨胀相似。因此,在细胞质分裂开始和细胞板形成早期,GFP-RabA1d在可视化横切面上与FM4-64标记物完全共定位时,均匀标记整个细胞板,形成一条细而连续的线(图4-64)3.f J K)。在更晚期,GFP-RabA1d信号被限制在生长中的细胞板边缘,与细胞板中部的FM4-64标记分离(图4-64)3.胃肠道,L)。
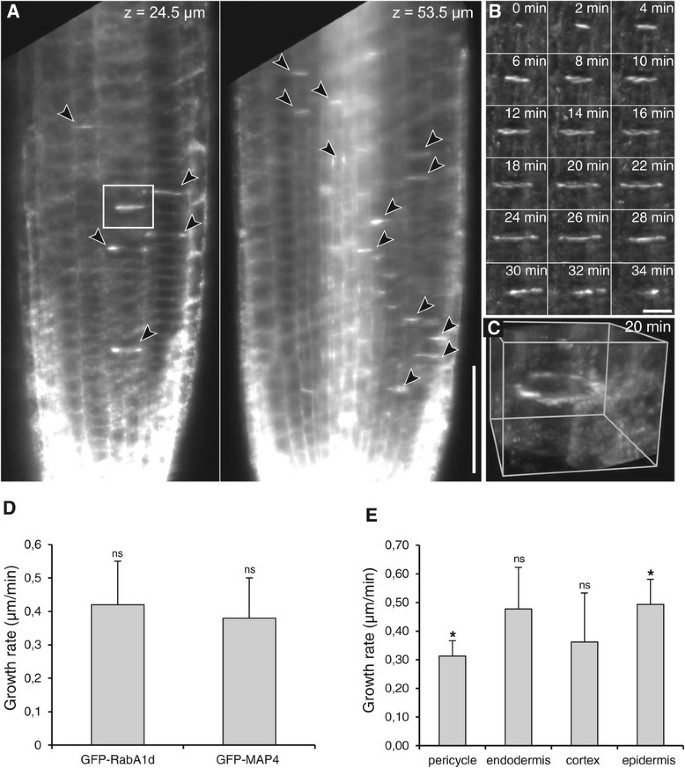
GFP-RabA1d的细胞动力学相关定位模式被进一步用光镜观察,这允许观察生理性的、无应力的根生长[46].在分生组织中进行胞质分裂的细胞显示了GFP-RabA1d积累的几个位置(图4A). GFP-RabA1d的积累模式与细胞板形成和生长过程中活跃的囊泡融合区域相吻合。在初始化的幼龄细胞板中,观察到盘状结构,可能从囊泡堆积时的弥漫性表达开始,在囊泡融合时强度增加(图4B,额外的文件1:图S5A, B)。在细胞板扩张过程中,在生长的细胞板边缘形成环状结构(图4B, C,附加的文件1:图S5A,B,附加文件2:视频S1)。在细胞分裂过程中,GFP-RabA1d在生长的细胞板上的定位表明,它在细胞板形成和边缘区域膜回收的膜/货物运输中发挥了作用1:图S5C)。用GFP-Rab1Ad标记的细胞板的生长速度与用GFP-MAP4标记的细胞板的生长速度相当4D,额外的文件3.:视频S2)。然而,表达GFP-Rab1Ad的表皮细胞和中柱鞘细胞之间存在显著差异4E)。
光-GFP薄片实时成像-根分生组织中细胞板形成过程中RabA1d的积累。正在进行胞质分裂的分生细胞在主根内指定深度的一个时间点的单个切片中发现了GFP-RabA1d的多个积累位置(一)GFP-RabA1d在细胞动力学细胞板上的积累(箭头)。盒子里的区域一个放大显示在B.在单个细胞板形成过程中,GFP-RabA1d积累的详细延时成像,从细胞中部的斑点状结构开始,随后在囊泡融合期间强度增加,随后在生长细胞板边缘形成环状结构(B).所示细胞板的三维重建(B)时间点20分钟(C).细胞板生长速度的比较拟南芥植物稳定地转化与内35个年代::绿色荧光蛋白:RabA1d而且35个年代::绿色荧光蛋白:MAP4构念(ns:无显著差异)(D).不同组织细胞中细胞板的生长速率(E).*与Wilcoxon秩和检验有显著性差异(p<0.05), ns:无显著性差异。条形图A表示50 μm, B表示10 μm。
值得注意的是,过表达GFP-RabA1d的转基因植物与未转化的野生型植物相比,对植物生长和向地性响应没有严重的影响(附加文件)1:图S6A-E)。
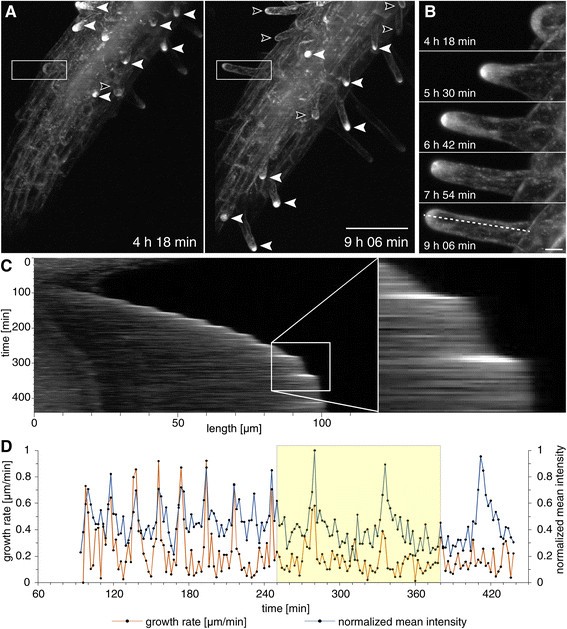
生长根毛尖端GFP-RabA1d的振荡积累与生长速率相关
根毛生长是植物细胞尖端生长的一个强有力的例子,伴随着极化膜运输(例如[47]、[48]、[18])。之前有研究证实RabA1d在生长根毛的顶状突起中定位[18,但是,没有在时间上遵循这种本地化模式。出于这个原因,我们通过光学薄片显微镜扩展了GFP-RabA1d与根毛生长动力学的关系,这允许在相当长的时间内跟踪GFP-RabA1d的分布,包括根毛生长的整个过程,从出现到停止伸长。如前所示[18], GFP-RabA1d标记主要在代表新生根毛的毛胚生长(突起)中观察到(图5A,B),随后很大程度上限制在蓬勃生长的根毛的顶端圆顶(图5a - c)。但在未生长成熟的根毛顶端,不可见含有小泡的GFP-RabA1d的积累。在突起和生长的根毛中,GFP-RabA1d与内吞标记物FM4-64共定位于根尖区域(附加文件1图S7A-F),但在成熟的根毛中,GFP-RabA1d和FM4-64在发管中的分布大致相同(附加文件)1:图S7G-I)。
在根毛突起中观察到GFP-RabA1d的尖端积累,随着根毛生长速度的下降,生长中的根毛逐渐减少(图1)5A).延时成像显示隆起阶段的GFP-RabA1d堆积,呈时间依赖性增加(图5B).从横过根毛顶顶的荧光强度谱可以看出,GFP-RabA1d信号强度在低强度和高强度之间振荡,与根毛生长的暂停期和生长期分别显著相关5C, D,附加的文件1:图S8A, B)。根毛生长与GFP-RabA1d强度在特定时间段(如150-250 min)的交叉相关系数计算表明,R2(线性相关系数)值为0.72,反映出根尖RabA1d积累与根尖生长之间存在较强的时间相关性5D).在转基因中也证实了根毛振荡生长的模式拟南芥以YFP为标记的应激诱导丝裂原活化蛋白激酶(SIMKK-YFP)。SIMKK-YFP在根细胞的细胞核和细胞质中积累。光镜观察和荧光强度沿生长的根毛横向剖面的测定显示了根毛生长的振荡模式1:图S8C,D,附加文件4:视频S3)。这一发现证实了RabA1d参与了与密集和时空控制的根毛囊泡运输相关的振荡细胞扩张的假设。
含有GFP-RabA1d的囊室的运动依赖于肌动蛋白细胞骨架
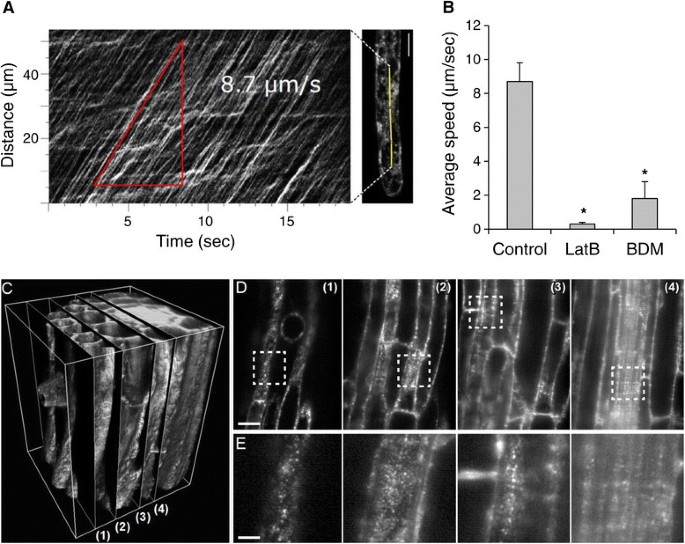
利用根毛延时图像序列测得raba1阳性TGN囊泡的最大速度。结果表明,GFP-RabA1d小泡在根毛中的平均移动速度约为8.7 μm/s6A、B)。
接下来,拟南芥用细胞骨架抑制剂oryzalin (Oryz)、latrunculin B (LatB)和丁烷二酮肟(BDM)处理表达GFP-RabA1d的幼苗。之前,我们观察到在毛胚细胞中,GFP-RabA1d隔室的运动不受Oryz诱导的微管破坏的影响(补充文件1:图S9A, B)。因此,我们在根毛中使用肌球蛋白药物来更好地表征GFP-RabA1d细胞沿肌动蛋白骨架的运动。Latrunculin B通过与单体G-actin亚基结合破坏肌动蛋白的细胞骨架,而BDM通过抑制肌动蛋白的atp酶功能影响肌动蛋白。经latrunculin B处理后,含有TGN小泡的GFP-RabA1d在15分钟内显著减慢和/或停止其通过细胞质的运动。使用BDM抑制小泡运动后也发现了类似的效果(图6B).这些数据表明GFP-RabA1d区室的运动是依赖于肌球蛋白的。
由于光镜成像深度的扩大,在不同的根组织如表皮、皮层、内皮层、中柱鞘和中柱细胞中可以观察到高迁移率的raba1阳性的TGN小泡。所有这些组织的细胞都清楚地显示了囊泡的存在,这证实了RabA1d在不同细胞的膜运输中的作用,以及薄片状显微镜在厚生物探针中进行深度成像的适用性(图6一部,附加的文件5:视频S4)。
讨论
在本研究中,我们报道了gfp标记的RabA1d在短暂和稳定转化的植物细胞中的亚细胞定位,详细描述了RabA1d参与活跃和高度调控的囊泡运输事件,这些事件对根分生细胞的细胞质分裂和根毛的极化扩张至关重要。
RabA1d定位于早期核内体/TGN,并参与囊泡运输
在瞬时转化的叶细胞和稳定转化的根细胞中均发现了GFP-RabA1d的细胞分布和定位模式,证明GFP-RabA1d定位于可移动的囊泡样结构,这与小gtpase在囊泡运输中的作用一致。gfp - raba1阳性的囊泡结构被认为是TGN的隔室,因为它们与mCherry-VTI12共同标记,mCherry-VTI12是一种积累在TGN上的snare蛋白标记[41]、[42].此外,GFP-RabA1d小泡在进入细胞后不久就与fm4 -64阳性的室区共定位,fm4 -64阳性室区由小泡/内吞噬标记物标记。RabA类的其他成员RabA2、RabA3和RabA1c也显示了TGN室的合并和联合,它们也与VHA-a1亚基部分重叠[24]、[25].在TGN隔室中,Qa-SNARE组成员定位于一个复合物(SYP41, VTI12, VPS45和SYP61) [26],所有这些隔室在染料到达RabF2或含GNOM的隔室之前都被FM4-64染色[25]、[26].因此,GFP-RabA1d的定位模式表明其在内吞噬和快速囊泡运输的第一阶段发挥特定作用,而不是在核内体成熟过程中,因为没有发现与晚期核内体标记物FYVE-DsRed或mCherry-RabF2a共定位。在这方面,fyve结构域特异性结合到磷酸肌醇-3-磷酸(PI-3P),后者主要聚集在晚期内体室隔膜中[39].FYVE结构域标记也与RabF2a和RabF1共定位,如今被认为是多泡或晚期内小体rabgtpase标记[32]、[33]、[40].
显微镜分析证实GFP-RabA1d与早期FM4-64房室共定位。与RabF2a相比,另一种优先定位于晚/多泡核内体的rabp - gtpase [32] - [34], GFP-RabA1d在FM染色后几分钟内与FM4-64腔室共定位。YFP-RabF2a与FM4-64部分共定位的记录较晚。将表达GFP-RabA1d并与FM4-64共染色的转基因植株经BFA处理后,在根细胞BFA核心区出现了共同的迁移和积累。由于已知bfa诱导的隔室由TGN和质膜来源的内吞小泡组成,被高尔基堆的残体包围[44],这一定位模式证实了RabA1d在早期核内体/TGN间室的驻留。此外,这提示RabA1d在囊泡循环调节中的作用,因为BFA处理有效地抑制了这一过程[44]、[45].蛋白质组学分析发现BFA处理后RabA1d的定量上调进一步支持了上述观点。
RabA1d在TGN小室的定位和活性[26]及其对BFA的响应表明其在囊泡贩运中起作用。参与内吞作用和水疱回收也报道了其他成员的RabA类。位于TGN室的RabA1c对endosidin1敏感,但对wortmannin不敏感[24].Endosidin1是一种内吞作用和囊泡循环的抑制剂[49],而wortmannin通过影响液泡前隔室、TGN小泡和MVBs抑制向液泡的运输[50].例如,endosidin1对BRI1, PIN2和AUX1循环的影响也涉及到由SYP61/VHA-a1定义的早期核内体/ tgn -隔室的错误定位[49].通过抑制液泡H+-ATPases with concanamycin A (ConcA)。ConA阻断核内体的成熟,导致tgn衍生的小泡聚集物的产生,因此,它干扰bfa -室间隔的形成[26].TGN蛋白VHA-a1、RabA2a和SYP61也存在定位错误决定自突变体,缺乏TGN定位的对TGN功能至关重要的ECHIDNA蛋白。然而,该突变体在分泌方面受到影响,而内吞作用或多或少保持完整[36].这就提出了RabA1d可能也在分泌通路中发挥作用的问题,这与RabA1b在从TGN到质膜的分泌通路中的作用是平行的[51].RabA1b与VAMP721/722共定位,在分泌通路中起作用的R-SNARE蛋白,仅部分且不稳定地与TGN、高尔基体和核内体关联[37].然而,wortmannin处理后RabA1b重新定位到质膜[37]不同于通过荧光标记RabA1d、RabA4b、RabA1e、VTI12、FYVE和RabF2a观察到的TGN和MVB隔室的聚集、聚集、融合或肿胀[52].在wortmannin处理下,RabA1d被重新定位到wortmannin诱导的多囊腔中并下调[52].因此,当植物通过上调RabA1d来抵消对内消化循环的抑制时,wortmannin对泡前转运的抑制会导致RabA1d下调[52].因此,RabA1d在囊泡运输(内吞循环,可能在分泌途径)中发挥重要作用,这与它在早期核内体/TGN室的位置一致。
在细胞分裂和根毛尖生长期间,RabA1d在高度活跃的囊泡运输区聚集
细胞板是由细胞板组装矩阵(CPAM)中心定位复合物(central - located complex of Cell plate assembly matrix, CPAM)所引导的囊泡聚集、融合和拉伸而形成的。这些小泡通过成膜微管被输送到生长中的细胞板[53],而细胞板的扩张在很大程度上受到分泌和内吞机制的支持[54]、[20.].在生长的细胞板中,形成了一个环状结构,代表着囊泡运输的高度活跃区[53].在细胞板形成的初始阶段,GFP-RabA1d在赤道面以圆盘状结构积累,表现出荧光强度的稳定增加,可能是由于持续的囊泡融合。与细胞板扩张过程中泡转运活性区空间再分配一致[53], GFP-RabA1d重新标记生长细胞板的边缘。
在细胞质分裂过程中,GFP-RabA1d的定位表明,在细胞板形成过程中,它在运送货物和细胞膜方面发挥了作用。这也与RabA1d在细胞板边缘区域活性膜回收中的支撑作用一致,与RabA2和RabA3亚类在细胞板形成过程中的积累一致。有趣的是,它们与细胞运动特异性syntaxin KNOLLE (AtSYP111)共定位于细胞板[25].另外3个raba,即RabA1a, RabA1b和RabA1c,在细胞动力学上也有重复的作用。这些在endosidin1治疗后定位错误,而三敲除突变体(rab-a1a/b/c)对内切素1诱导的细胞动力学破坏高度敏感[24].同样,细胞动力学缺陷突变体pas2(微粒体延长酶基因PASTICCINO2突变体),由于RabA2a和KNOLLE的异质性聚集,导致细胞板形成延迟和缺陷,而RabF2a没有任何缺陷。因此,早期核内体/TGN隔室在细胞板形成过程中起着特殊的作用[55].RabA1b与VAMP721相互作用对TGN和质膜的转运[37]参与胞质分裂,ConA对TGN转运的抑制通过对早期核内体/TGN隔室的错定位影响细胞板的形成[56].此外,RabA1d与SNARE复合体成员VTI12的共定位表明,RabA1d在转运到质膜中也起作用[57].因此,RabA1d在细胞板形成过程中的作用与提出的早期核内体/TGN区隔在分泌、内吞和循环途径协调中的活性是一致的。
与细胞质分裂类似,RabA1d参与需要增加囊泡运输的局部细胞扩张。RabA1d在根毛和生长中的尖端积累证实了一些raba在极性生长过程中的作用。RabA4d在花粉管中的破坏减少了细胞极性、扩张,显示细胞壁成分的沉积改变[15].与RabA1d类似,在成熟的根毛或经latrunculin B处理后,根毛尖端的积累消失[16].RabA2沉默导致了根毛数量和长度的减少,这表明它不仅在根毛的扩张中起着重要作用,而且在根毛形成过程中也起着重要作用[17].
凸起阶段的RabA1d堆积在顶端生长过程中逐渐增加。在根毛生长过程中,GFP-RabA1d信号强度呈振荡波动。GFP-RabA1d在根毛尖低标记和高标记强度之间的振荡时间分别与根毛尖生长的停顿期和生长期相吻合。类似于花粉管[58],根毛表现出振荡生长,以及伴随根尖生长的其他事件,如细胞壁改变、细胞骨架重排和靶向囊泡运输[59].一些因素,如Ca2 +梯度(60],细胞外pH值和ROS浓度[61和肌动蛋白组织[62]、[63]已被发现与针尖生长的振荡特征有关,并与囊泡运输密切相关。根毛膨大期的GFP-RabA1d积累量低于根毛生长期,这与根毛萌发和生长过程中水疱转运的频率一致。在局部结构改变后,需要确定凸起位置,如细胞骨架重排[64],细胞壁组成[65]、[66]以及结构固醇在质膜中积聚[18],在根毛伸长过程中需要增加囊泡运输,以在扩张区提供新的质膜。这个区域充满分泌和内吞小泡[2],清晰区域的高动态早期核内体和亚根尖区较大的核内体隔室[67].因此,如之前报道的,RabA1d被定位在生长根毛的尖端区[18],其积累与根毛尖扩张和小泡运输具有时空相关性。
含有GFP-RabA1d的TGN小泡的高运动依赖于肌动蛋白细胞骨架
核内体表现出不同的运动模式,包括静止阶段、缓慢或快速运动[40].米唑林破坏的微管不影响raba1阳性小泡的运动,但肌球蛋白抑制剂对其运动影响极大。同样,RabA4b的尖端定位受latrunculin B处理的影响,而不受oryzalin的影响[16].这表明肌动蛋白细胞骨架在RabA1d运动中发挥重要作用,然而,一些内体结构的组织和动力学同时受到肌动蛋白和微管细胞骨架的影响[40]、[68]、[69和它们的马达蛋白,即肌球蛋白[70].通过蛋白质组学研究,BFA处理后,肌动蛋白细胞骨架在囊泡运输中的作用得到加强,发现肌动蛋白结合蛋白profilin 2(一种肌动蛋白结合蛋白)显著上调,并在BFA-隔室中积累[71].最后,在不同的根组织,如表皮、皮层、内皮层、中柱鞘和中心圆柱体细胞中也观察到RabA1d含有TGN小泡的旺盛运动,证实了RabA1d在不同细胞的小泡运输中发挥的作用,而且不仅与根尖生长有关。
结论
我们发现RabA1d与早期FM4-64细胞内吞噬区以及TGN标记物VTI12共定位。BFA处理不仅诱导RabA1d上调,而且GFP-RabA1d重新定位到BFA核心区。最重要的是,RabA1d的特定时空积累与细胞板形成和根毛振荡尖生长过程中的囊泡运输需求相关。
方法
35S::GFP:RabA1d结构的克隆
的编码序列RabA1d采用以下引物从Columbia-0 cDNA中pcr扩增出(At4g18800)基因:正向引物:5 ' -GCG GAT CCG TGT TAA TGG CGG GTT-3 ',反向引物:5 ' -GCG GAT CCT TTA GGA CAT AAG ACC AT-3 '。利用BamHI酶切位点将编码序列连接到pCATgfp向量。由此产生的35个年代::绿色荧光蛋白:RabA1d用HindIII切除表达盒,连接到二元载体中pCB302[72].该构造用于转换胜任GV3101 (pMP90)根癌土壤杆菌细胞。
植物转化
表皮细胞韭葱被瞬间转化为35个年代::绿色荧光蛋白:RabA1d用粒子轰击构造[73]使用Biolistic PDS-1000/He系统(Bio-Rad Laboratories GmbH, München,德国)。的叶子烟草benthamiana被渗入根癌土壤杆菌[74].细菌光密度(OD600)均为0.2。共表达时,在浸润前将菌悬液结合。35个年代::绿色荧光蛋白:RabA1dConstruct与35个年代::呃:安全域使ER皮层网络形象化[38];pUBQ10::mCherry:VTI12,一种snare蛋白,已知在TGN上积累[41]、[42];35个年代::2 xfyve:安全域[39]、[40),pUBQ10::RabF2a:mCherry[4],用于叶细胞的晚期核内体烟草benthamiana。拟南芥生态型哥伦比亚-0的植株经根癌土壤杆菌-介导花浸法[75].通过卡那霉素抗性筛选得到稳定的转化植株。SIMKK-YFP在稳定转化的拟南芥植株中表达[76].
免疫印迹
蛋白质提取物样品按照Wessel和Fluegge描述的方法进行沉淀[77].蛋白质在SDS - PAGE凝胶上分离,并在湿槽中使用转移缓冲液转移到聚偏二氟乙烯膜上1.5 h [78].为了免疫检测蛋白,用6% (w/v) BSA在tri -buffered saline (TBS)缓冲液中封闭膜1小时,然后用1:300稀释的抗gfp抗体(Roche)在含1% (w/v) BSA的TBS- t缓冲液(TBS 0.1%, Tween 20)中孵育1.5小时,室温或4℃过夜。TBS-T洗涤后,将膜与二抗、山羊抗小鼠IgG、AP偶联物(分子探针)在含1% (w/v) BSA的TBS-T中1:500稀释,室温孵育1.5小时。经过几个洗涤步骤,在新制备的ECL试剂(GE Healthcare)中孵育2分钟检测蛋白。在暗室(GE Healthcare)使用Hyperfilm ECL检测发光。
FM4-64染色及BFA处理
将幼苗置于浓度为5 μg/ml的FM4-64培养基中,培养10- 15min,观察早期核内体。为了进行共定位研究,将幼苗置于显微镜载玻片上,置于FM4-64液滴中,盖上盖片,立即转移到显微镜下。每5 min记录一次根细胞。BFA处理时,幼苗置于含有50 μm brefeldin A (BFA)的培养基中孵育。洗脱实验:幼苗在50 μm BFA和5 μm FM4-64中孵育30 min,用培养液在载玻片上彻底洗涤5 min,再在显微镜下观察60 min。
蛋白质组学分析
蛋白质组学分析遵循先前描述的方法[71].拟南芥L.幼苗(生态型哥伦比亚)在10天内培养。幼苗经液体表面处理2小时1/2ms介质含有50 μm BFA或含有相同最终浓度DMSO的模拟溶液。利用液氮中的研钵和研杵,将根迅速解剖和均质化为细粉末。用酚法提取总蛋白,如前所述[79].
二维电泳
从颗粒中提取蛋白质样品并进行双向电泳的方法如下所述[71].凝胶用Bio-Safe考马斯亮蓝染色液(Bio-Rad)染色,使用密度计(GS-800, Bio-Rad)扫描,并使用软件包PD-Quest 8.0 (Bio-Rad)进行分析,如Takáč等人所述[71].
在凝胶胰蛋白酶消化和质谱
胰酶消化过程和肽混合物提取过程如前所述[71],用干液滴法将其标记在锚定芯片靶(布鲁克道尔顿)上[80].α-氰基-4-羟基肉桂酸(2mg /ml, 50% (v/v) ACN含0.2% (v/v)三氟乙酸(TFA))作为吸能分子(基质)。质谱分析使用MALDI-TOF-TOF (Ultraflex II, Bruker Daltonics),使用Takáč等描述的采集设置进行。[71],与Bruker软件包Flex分析2.4和BioTools 3.1的数据处理、吉祥物搜索(吉祥物服务器2.2.03)、Swissprot数据库版本54.6中的数据匹配类似,包含29315条条目。在蛋白质/肽鉴定中,选择标准评分和P < 0.05的显著性阈值作为吉祥物结果参数。
显微分析
显微分析使用奥林巴斯FV1000直立共聚焦激光扫描显微镜(具有63x/NA 1.3油浸物镜)和蔡斯LSM 710(具有63x/NA 1.4油浸物镜)。在共表达研究中,图像的获取采用顺序行扫描模式,以避免出血通过。共域分析使用ImageJ工具箱JACoP进行,在Costes自动阈值[后确定Pearson系数(r)]81].
对于时移观测,我们使用Andor Revolution xD共聚焦旋转盘系统(Andor Technology, Belfast, Ireland)结合奥林巴斯IX71倒置显微镜和奥林巴斯UPLANSAPO 60xW/1.2物镜,蔡司共聚焦旋转盘系统结合横河c苏- x1扫描头,配备63x/NA 1.4油浸物镜。以每秒20帧的速度记录单个焦平面。
使用multikymograph插件ImageJ软件(http://rsbweb.nih.gov/ij/).记忆器是三维(x, y,时间)图像序列的二维(2-D)图形表示。粒子沿着定义的1-D线的运动显示时间(y,时间)。在视频序列的每一帧中截取1-D像素线,并排显示。一个沿着这条线移动的粒子将在记音器中显示为一条对角线,它的斜率等于粒子的速度。
如前所述,在定制的系统中进行光片显微镜检查[46]或蔡司z1光片荧光显微镜。在海关系统里,七天了拟南芥在检测路径上使用卡尔蔡司N-Achroplan 40x/0.75物镜,在照明路径上使用卡尔蔡司Plan-Neofluar 5x/0.16物镜,每两分钟对幼苗进行一次成像,时间长达10小时。每一叠图像包含388个沿z轴间距为0.645 μm的平面,并由Andor NEO相机(Andor Technology, Belfast, Ireland)记录。z1光片荧光显微镜系统由卡尔蔡司W Plan-apochromat 20x/1.0检测物镜和卡尔蔡司LSFM 10x/0.2照度物镜组成。用PCO记录图像。Edge sCMOS相机(PCO AG, Kelheim,德国)。
以表达GFP-Rab1Ad和GFP-MAP4的幼苗为对照,在根分生区,按照细胞板完全扩张所需的总时间(即直到细胞板边缘到达母细胞壁)划分细胞板直径得到细胞板生长速率。在这两种情况下,测量了超过10个细胞,并计算了平均生长速度。只考虑完整的细胞板形成。
对于根毛生长和荧光强度测量图像被裁剪到更小的区域。小堆栈被旋转为根头发的侧视图。经过一个背景减法步骤后,使用求和投影将图像叠平。这些图像序列用于跟踪根毛尖的生长速率,并使用Adobe After Effects估计荧光强度。
作者的贡献
TB制备了该结构,转化了植物,并进行了部分生物成像。DW在进行数据评估的同时进行了光片生物成像。TT进行了蛋白质组学研究。OŠ进行了细胞骨架药物实验,并制备了用于显微镜工作的下一代转基因系。MO进行了BFA实验和一些光片生物成像。JŠ设计和协调本研究。TB、DW、AR、JŠ进行数据分析。TB、GK、MO、AR、ES、JŠ撰写稿件。所有作者阅读并批准最终稿。
附加文件
参考文献
根毛和花粉管的膜运输和极性生长。中国生物医学工程学报,2007,30(5):532 - 532。10.1093 / jxb / erl059。
Cole RA, Fowler JE:极化生长:保持对尖端的关注。植物学报,2006,29(4):579-588。10.1016 / j.pbi.2006.09.014。
Zárský V, Cvrčková F, Potocký M, Hála M:植物的胞吐作用和细胞极性-胞囊和循环域。中国生物医学工程学报,2009,29(3):393 - 393。10.1111 / j.1469-8137.2009.02880.x。
研究报告:调控性RAB和ARF GTPases对水疱转运的作用。植物生理学报,2008,27(3):322 - 322。10.1104 / pp.108.121798。
罗网和罗网蛋白在植物生命中的作用。中国生物医学工程学报,2009,29(3):393 - 393。10.1016 / s1937 - 6448(08) 02004 - 2。
王志强,王志强,王志强,王志强,王志强,王志强,王志强:诱捕与诱捕相互作用的发光检测拟南芥原生质体。植物化学学报,2010,34(3):393 - 393。10.1007 / s11103 - 009 - 9581 - z。
卢瑟福S,摩尔I: The拟南芥Rab GTPase家族:另一个谜样变异。植物学报,2002,5:518-528。10.1016 / s1369 - 5266(02) 00307 - 2。
Rab GTPases作为小泡交通的协调者。中国生物医学工程学报,2009,10:513-525。10.1038 / nrm2728。
Barr FA:回顾系列:Rab GTPases和膜认同:因果关系还是无关紧要?中国生物医学工程学报,2013,29(3):319 - 319。10.1083 / jcb.201306010。
rabb家族小g蛋白膜转运的结构基础。中国生物医学工程学报,2013,29(3):393 - 393。10.3390 / ijms14058912。
Rab GTPases在植物膜运输中的作用。植物学报,2008,34(3):393 - 393。10.1016 / j.pbi.2008.09.010。
作者:王晓明,王晓明。生物化学,2012,40:1360-1367。10.1042 / BST20120157。
Neto H, Balmer G, Gould G:胞质分裂中的外囊蛋白:Rab11的调控。通信学报,2013,6:e27635-10.4161/cib.27635。
拉伯蛋白作为膜组织者。中国生物医学工程学报,2001,22(3):357 - 361。10.1038 / 35052055。
Szumlanski AL, Nielsen E: rabb GTPase RabA4d调节花粉管顶端的生长拟南芥.植物细胞。2009,21:526-544。10.1105 / tpc.108.060277。
Preuss ML, Serna J, Falbel TG, Bednarek SY, Nielsen E: The拟南芥rabb GTPase RabA4b定位于生长中的根毛细胞尖端。植物细胞。2004,16:1589-1603。10.1105 / tpc.021634。
Blanco FA, Meschini EP, Zanetti ME, Aguilar OM: rabb家族的一个小GTPase在常见的大豆-根瘤菌共生关系的根毛形成和感染前阶段是必需的。植物细胞。2009,21:2797-2810。10.1105 / tpc.108.063420。
Ovečka M, Berson T, Beck M, Derksen J, Šamaj J, Baluška F, Lichtscheidl IK:结构固醇参与了根毛的起始和根尖的生长拟南芥.植物细胞。2010,22:2999-3019。10.1105 / tpc.109.069880。
Preuss ML, Schmitz AJ, Thole JM, Bonner HK, Otegui MS, Nielsen E: RabA4b效应蛋白PI-4Kbeta1在根毛细胞极化扩张中的作用拟南芥.中国生物医学工程学报,2006,22(3):393 - 397。10.1083 / jcb.200508116。
杜宏慧P, Baluška F, Schlicht M, Hlavačka A, Šamaj J, Friml J, Gadella TW:细胞胞质分裂过程中细胞表面物质的内吞作用介导细胞板的形成。中国地质大学学报(自然科学版),2006,10:137-150。10.1016 / j.devcel.2005.11.015。
张晓东,李文华,李文华,等:植物细胞分裂的细胞质分裂新模式。《生物学报》,2007,29:371-381。10.1002 / bies.20559。
Karahara I, Suda J, Tahara H, Yokota E, Shimmen T, Misaki K, Yonemura S, Staehelin LA, Mineyuki Y:前期带是洋葱子叶表皮前期晚期细胞网格蛋白介导的内吞作用的一个定位中心。植物学报,2009,35(3):329 - 331。10.1111 / j.1365 - 313 x.2008.03725.x。
Karahara I, Staehelin LA, minyuki Y:内吞作用在植物细胞质分裂中的作用。中国生物医学工程学报,2010,3:36-38。10.4161 / cib.3.1.9720。
Qi X, Zheng H: rabb - a1c GTPase定义了一个跨高尔基网络群体,该群体在细胞分裂过程中对内切素1敏感拟南芥.植物学报,2013,6:847-859。10.1093 / mp / sss116。
Chow CM, Neto H, Foucart C, Moore I: raba - a2和raba - a3 GTPases定义了一个跨高尔基体内体膜结构域拟南芥这对电池板有很大的贡献。植物细胞。2008,20:101-123。10.1105 / tpc.107.052001。
Dettmer J, Hong-Hermesdorf A, Stierhof YD, Schumacher K:液泡H+- atp酶活性是内吞和分泌转运所必需的拟南芥.植物细胞。2006,18:715-730。10.1105 / tpc.105.037978。
Boutté Y, Frescatada-Rosa M, Men S, Chow CM, Ebine K, Gustavsson A, Johansson L, Ueda T, Moore I, JŠrgens G, Grebe M:内吞作用限制拟南芥在细胞分裂后期KNOLLE合成蛋白进入细胞分裂平面。中国科学:地球科学,2010。10.1038 / emboj.2009.363。
Teh OK, Shimono Y, Shirakawa M, Fukao Y, Tamura K, Shimada T, Hara-Nishimura I: AP-1 μ适应蛋白是KNOLLE在细胞板上定位所必需的,以介导细胞分裂拟南芥.植物生理学报,2013,54:838-847。10.1093 /卡式肺囊虫肺炎/ pct048。
Van Damme D, Gadeyne A, Vanstraelen M, Inzé D, Van Montagu MC, De Jaeger G, Russinova E, Geelen D:植物体细胞质过程中,adaptin样蛋白TPLATE和网格蛋白募集通过两种不同的途径发生。中国科学:地球科学,2011。10.1073 / pnas.1017890108。
王春梅,王春梅,王春梅,张志强,张志强,张志强,张志强,张志强。网格蛋白转运在细胞分裂中的作用及其与细胞增殖的关系拟南芥气孔胞质分裂缺陷蛋白。植物学报,2013,25:3910-3925。10.1105 / tpc.113.115162。
Goh T, Uchida W, Arakawa S, Ito E, Dainobu T, Ebine K, Takeuchi M, Sato K, Ueda T, Nakano A: VPS9a,两种不同类型的Rab5 gtpase的共同激活剂,对Rab5 gtpase的发展至关重要拟南芥.植物细胞。2007,19:3504-3515。10.1105 / tpc.107.053876。
张建平,张建平,张建平,张建平。细胞内核小体的功能分化拟南芥细胞。植物学报,2004,30(4):393 - 393。10.1111 / j.1365 - 313 x.2004.02249.x。
Haas TJ, Sliwinski MK, Martínez DE, Preuss M, Ebine K, Ueda T, Nielsen E, Odorizzi G, Otegui MS: The拟南芥AAA atp酶SKD1参与多泡核内体功能,并与其正调控因子LYST-INTERACTING PROTEIN5相互作用。植物细胞。2007,19:1295-1312。10.1105 / tpc.106.049346。
张建平,张志强,张志强,张志强。基于多色标记集的植物膜室快速组合分析。植物学报,2009,29(3):349 - 356。10.1111 / j.1365 - 313 x.2009.03851.x。
Pinheiro H, Samalova M, Geldner N, Chory J, Martinez A, Moore I:基因证据表明,rabd1和rabd2 gtpase在早期分泌通路中表现出不同但重叠的相互作用。中国生物医学工程学报,2009,29(3):349 - 356。10.1242 / jcs.050625。
Gendre D, Oh J, Boutté Y, Best JG, Samuels L, Nilsson R, Uemura T, Marchant A, Bennett MJ, Grebe M, Bhalerao RP: reserved拟南芥ECHIDNA蛋白介导跨高尔基网络运输和细胞伸长。中国科学:地球科学,2011,29(3):349 - 356。10.1073 / pnas.1018371108。
Asaoka R, Uemura T, Ito J, Fujimoto M, Ito E, Ueda T, Nakano A:拟南芥RABA1 gtpase参与跨高尔基网络和质膜之间的转运,是耐盐胁迫所必需的。植物学报,2013,33(3):349 - 356。10.1111 / tpj.12023。
张志强,张志强,张志强,张志强,张志强,张志强,张志强:一种内质网诱导的内质网衍生结构拟南芥.植物生理学报,2002,30(3):397 - 397。10.1104 / pp.009464。
Gillooly DJ, Simonsen A, Stenmark H:磷脂酰肌醇3-磷酸和FYVE结构域蛋白的细胞功能。中国生物医学工程学报,2001,34(3):349 - 356。10.1042 / 0264 - 6021:3550249。
Voigt B, Timmers AC, Šamaj J, Hlavačka A, Ueda T, Preuss M, Nielsen E, Mathur J, Emans N, Stenmark H, Nakano A, Baluška F, Menzel D:基于肌动蛋白的核内体运动与根毛极尖生长有关。中国生物医学工程学报,2004,24(3):322 - 329。10.1016 / j.ejcb.2004.12.029。
Sanderfoot AA, Kovaleva V, Bassham DC, Raikhel NV:合成taxins之间的相互作用确定了高尔基/泡前系统中至少5个SNARE复合物拟南芥细胞。中国生物医学工程学报,2001,12(3):393 - 393。10.1091 / mbc.12.12.3733。
张志勇,张志勇,张志勇,张志勇,张志勇,张志勇,张志勇,张志勇,张志勇,张志勇,张志勇,张志勇:纳米材料中SNARE分子的系统分析拟南芥:解剖植物细胞中的后高尔基网络。细胞结构功能。2004,29:49-65。10.1247 / csf.29.49。
(1): fm -染料作为活体植物细胞解剖囊泡运输的实验探针。中国生物医学工程学报,2004,24(4):449 - 456。10.1111 / j.0022-2720.2004.01348.x。
李志强,李志强,李志强,李志强。破译一种神秘的分泌抑制剂。植物生理学报,2002,30(3):393 - 398。10.1104 / pp.011569。
Geldner N, Anders N, Wolters H, Keicher J, Kornberger W, Muller P, Delbarre A, Ueda T, Nakano A, JŠrgens G: The拟南芥gnome ARF-GEF介导内体循环、生长素运输和依赖生长素的植物生长。Cell. 2003, 112: 219-230。10.1016 / s0092 - 8674(03) 00003 - 5。
王文海姆,王文海姆,王文海姆,王文海姆,王文海姆,王文海:利用光片荧光显微镜对近生理明亮条件下植物生长的高分辨率实时成像。植物学报,2011,34(4):377- 379。10.1111 / j.1365 - 313 x.2011.04692.x。
Larson ER, Domozych DS, Tierney ML: SNARE VTI13在与液泡相关的内小体运输途径中起着独特的作用,对细胞壁组织和根毛生长至关重要拟南芥.安机器人2014年,doi: 10.1093 / aob / mcu041。,
Ichikawa M, Hirano T, Enami K, Fuselier T, Kato N, Kwon C, Voigt B, Schulze-Lefert P, Baluška F, Sato MH:植物蛋白SYP123和SYP132的合成蛋白介导根毛尖的生长拟南芥.植物生理学报,2014,55:790-800。10.1093 /卡式肺囊虫肺炎/ pcu048。
Robert S, Chary SN, Drakakaki G, Li S, Yang Z, Raikhel NV, Hicks GR: Endosidin1定义了一个参与油菜素内固醇受体BRI1和生长素转运体PIN2和AUX1的内吞噬的小室。中国科学:地球科学,2008,29(3):344 - 344。10.1073 / pnas.0711650105。
谢永昌,莫波,赵敏,罗西文,鲁宾孙DG,蒋玲:多泡体在脑内的识别烟草2细胞。植物细胞。2004,16:672-693。10.1105 / tpc.019703。
Feraru E, Feraru MI, Asaoka R, Paciorek T, De Rycke R, Tanaka H, Nakano A, Friml J: BEX5/RabA1b调控跨高尔基网络-质膜蛋白转运拟南芥.植物学报。2012,24:3074-3086。10.1105 / tpc.112.098152。
Takáč T, Pechan T, Šamajová O, Ovečka M, Richter H, Eck C, Niehaus K, Šamaj J: Wortmannin治疗诱导变化拟南芥根蛋白质组和后高尔基区隔。中国生物医学工程学报,2012,31(3):397 - 397。10.1021 / pr201111n。
Seguí-Simarro JM, Austin JR, White EA, Staehelin LA:细胞分生组织中体细胞板形成的电子层析分析拟南芥高压冷冻保存。植物细胞。2004,16:836-856。10.1105 / tpc.017749。
Fendrych M, Synek L, Pecenková T, Toupalová H, Cole R, Drdová E, Nebesářová J, Sedinová M, Hála M, Fowler JE, Žárský V: The拟南芥外囊复合体参与细胞质分裂和细胞板成熟。植物细胞。2010,22:3053-3065。10.1105 / tpc.110.074351。
Bach L, Gissot L, Marion J, Tellier F, Moreau P, Satiat-Jeunemaître B, Palauqui JC, Napier JA, Faure JD:在细胞分裂过程中,极长链脂肪酸对细胞板形成是必需的拟南芥.中国生物医学工程学报,2011,24(3):393 - 397。10.1242 / jcs.074575。
张磊,张浩,刘鹏,郝浩,金建斌,林杰:拟南芥R-SNARE蛋白VAMP721和VAMP722是细胞板形成所必需的。科学通报,2011,6:e26129-10.1371/journal.pone.0026129。
王军,王晓明,王晓明,王晓明,王晓明,王晓明,王晓明,王晓明,王晓明,王晓明,王晓明,王晓明,王晓明,王晓明,王晓明,王晓明,王晓明。SYP61细胞胞外运输的蛋白质组学分析及其与细胞外运输的关系拟南芥.细胞研究,2012,22:413-424。10.1038 / cr.2011.129。
作者:Holdaway-Clarke TL, Feijo JA, Hackett GR, Kunkel JG, Hepler PK:花粉管生长和细胞内钙梯度振荡相同时,细胞外钙内流延迟。植物细胞。1997,9:1999-2010。10.1105 / tpc.9.11.1999。
Cárdenas L:关于根毛细胞极性生长调节机制的新发现。植物信号行为。2009,4:4-8。10.4161 / psb.4.1.7341。
Monshausen GB, Messerli MA, Gilroy S:黄色Cameleon 3.6指示剂的成像显示细胞质Ca2的升高+随根毛的生长振荡增加拟南芥.植物生理学报,2008,29(3):393 - 393。10.1104 / pp.108.123638。
李志强,李志强,李志强,李志强。细胞外pH值和活性氧对植物针尖生长的影响拟南芥根头发。中国科学:地球科学,2007,29(3):393 - 398。10.1073 / pnas.0708586104。
Cárdenas L, Lovy-Wheeler A, Kunkel JG, Hepler PK:花粉管生长振荡和细胞内钙水平被肌动蛋白聚合可逆地调节。植物生理学报,2008,29(3):322 - 322。10.1104 / pp.107.113035。
Zepeda I, Sánchez-López R, Kunkel JG, Bañuelos LA, Hernández-Barrera A, Sánchez F, Quinto C, Cárdenas L:高度动态的F-肌动蛋白加末端生长的可视化菜豆根毛细胞及其对根瘤菌etli点头的因素。植物生理学报,2014,55:580-592。10.1093 /卡式肺囊虫肺炎/ pct202。
Ringli C, Baumberger N, Diet A, Frey B, Keller B: ACTIN2在根毛发育过程中膨大部位选择和根尖生长中起着重要作用拟南芥.植物生理学报,2002,29(3):349 - 356。10.1104 / pp.005777。
刘海燕,刘志强,刘志强,刘志强:CSLD3在根尖生长根毛细胞细胞壁合成中的作用。中国生物医学工程学报,2011,13:973-980。10.1038 / ncb2294。
Vissenberg K, Fry SC, Verbelen JP:根毛起始与木葡聚糖内转糖基酶作用的高度局部增加有关拟南芥的根源。植物生理学报,2001,27(3):393 - 393。10.1104 / pp.010295。
Ovečka M, Lang I, Baluška F, Ismail A, Illéš P, Lichtscheidl IK:根毛尖生长过程中的内吞和囊泡运输。原生质体。2005,226:39-54。10.1007 / s00709 - 005 - 0103 - 9。
Idilli AI, Morandini P, Onelli E, Rodighiero S, Caccianiga M, Moscatelli A:微管解聚影响烟草花粉管顶端的内吞和外吞作用,并影响花粉管内小体的运动。植物学报。2013,6:1109-1130。10.1093 / mp / sst099。
Moscatelli A, Idilli AI, Rodighiero S, Caccianiga M:低浓度Latrunculin B抑制肌动蛋白聚合影响烟草花粉管柄和顶端的胞吞和胞吐作用。植物医学杂志》2012。
Peremyslov, Klocko AL, Fowler JE, Dolja VV:拟南芥前沿植物科学。2012,3:184-10.3389/fpls.2012.00184。
Takáč T, Pechan T, Richter H, Müller J, Eck C, B hm N, Obert B, Ren H, Niehaus K, Šamaj J: brefeldin a处理的蛋白质组学拟南芥根揭示了profilin 2作为一个新的蛋白参与了之间的交叉对话囊泡运输和肌动蛋白细胞骨架。中国生物医学工程学报,2011,30(4):489 - 497。10.1021 / pr100690f。
向晨,韩鹏,王凯,王凯,王志刚:一种用于植物转化的小型二元向量序列。植物化学学报,1999,19(3):322 - 327。10.1023 /: 1006201910593。
刘志刚,刘志刚,刘志刚:利用瞬态转化技术分离玉米花粉特异性启动子的研究。植物学报,1997,18:211-218。10.1007 / BF00034950。
Batoko H, Zheng HQ, Hawes C, Moore I: rab1 GTPase在植物内质网和高尔基体之间的运输以及正常的高尔基体运动中是必需的。植物学报,2000,12:221 -2218。10.1105 / tpc.12.11.2201。
弯曲AF:花浸渍:农杆菌介导转化的一种简化方法拟南芥.植物学报,1998,16(3):357 - 361。10.1046 / j.1365 - 313 x.1998.00343.x。
林里čka M,魏čT,科米克,VadovičP, Bekeš卵子年代,Doskočilova, Smekalova V, Luptovčiak我Samajova O, Schweighofer, Meskiene我Jonak C Křenek P, Lichtscheidl我Škultety L,赫特H,Šamaj J: Salt-induced亚细胞激酶搬迁和幼苗在拟南芥易感性Medicago SIMKK过度引起的。中国生物医学工程学报,2014,35(3):335- 350。10.1093 / jxb / eru115。
Wessel D, Flügge UI:在洗涤剂和脂类存在的稀释溶液中定量回收蛋白质的方法。生物化学。1984,138:141-143。10.1016 / 0003 - 2697(84) 90782 - 6。
汤斌H, Staehelin T, Gordon J:蛋白质从聚丙烯酰胺凝胶到硝化纤维素薄片的电泳转移:程序和一些应用。中国科学:地球科学,1997,16(3):438 - 438。10.1073 / pnas.76.9.4350。
植物膜蛋白增溶作用的二维凝胶电泳分析。植物生理学报,1996,16(3):322 - 327。10.1104 / pp.81.3.802。
分子质量超过10,000道尔顿的蛋白质的激光解吸电离。化学。1998,15:2299-22301。10.1021 / ac00171a028。
Bolte S, Cordelières FP:在光学显微镜下进入亚细胞共定位分析的导览。中国生物医学工程学报,2006,24(3):313 - 319。10.1111 / j.1365-2818.2006.01706.x。
确认
这项工作是由国家支持项目可持续性我(批准号LO1204)由捷克教育部和操作性项目教育竞争力-欧洲社会527基金(项目cz.1.07 / 2.2.3.00 /20.0165)和法兰克福歌德大学卓越集群“大分子复合物”(DFG项目EXC 115)提供(给DW和ES)。感谢S. Pfeiffer和Th。Schenker (da-cons GmbH)在3d数据分析方面的帮助。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者声明他们之间没有利益冲突。
电子辅料
12870 _2014_252_moesm1_esm.pdf
附加文件1:图S1。:GFP的亚细胞定位-RabA1din diverse plants.图S2。FM4-64的摄取和与早期和晚期核内体的共定位。图S3。BFA冲洗后fm4 -64阳性和gfp - raba1阳性区隔在BFA处理的根表皮细胞中的再分布图S4。蛋白质组学分析中的RabA1d鉴定。图S5。细胞板形成过程中GFP-RabA1d的积累和再分配。图S6。的影响35个年代::绿色荧光蛋白:RabA1d转基因对植物生长的过度表达拟南芥植物。图S7。GFP-RabA1d和FM4-64的共定位拟南芥根头发。图S8。表达GFP-RabA1d和SIMKK-YFP的幼苗根毛振荡尖生长。图S9。Oryzalin (Oryz)对GFP-RabA1d细胞运动的影响。(PDF 6 MB)
12870 _2014_252_moesm2_esm.zip
附加文件2:视频S1。:GFP的本地化-RabA1d在细胞动力学细胞板形成过程中起重要作用。(邮政编码348 KB)
12870 _2014_252_moesm3_esm.zip
附加文件3:视频S2。:细胞板formation in Arabidopsis primary root expressing GFP-MAP4. Maximum intensity projections of Z-stacks collected every 1 min for a time period of 60 minutes. Scale bar: 20 μm. (ZIP 3 MB)
12870 _2014_252_moesm4_esm.zip
附加文件4:视频S3。:根头发tip growth in Arabidopsis plants expressing SIMKK-YFP observed by light sheet microscopy. Video sequence of a root hair growing over a time period of 1 h, 15 min and 1 s. (ZIP 6 MB)
12870 _2014_252_moesm5_esm.zip
附加文件5:视频S4。:Deep imaging and mobility of small RabA1d-positive TGN vesicles in diverse root tissues observed by light sheet microscopy. (ZIP 17 MB)
权利和权限
开放获取本文根据知识共享署名4.0国际许可协议授权,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和源代码,提供知识共享许可协议的链接,并说明是否进行了修改。
本文中的图像或其他第三方材料均包含在本文的知识共享许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的知识共享许可中,并且您的预期使用不被法定法规允许或超过允许的使用,您将需要直接从版权所有者获得许可。
如欲查阅本牌照副本,请浏览https://creativecommons.org/licenses/by/4.0/.
知识共享公共领域转让豁免书(https://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在对数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
Berson, T., von Wangenheim, D., Takáč, T.。et al。反式-高尔基网络定位的小GTPase RabA1d参与细胞板形成和振荡根毛生长。BMC植物杂志14日,252(2014)。https://doi.org/10.1186/s12870-014-0252-0
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-014-0252-0
关键字
- 拟南芥
- 细胞板
- 胞质分裂
- Rab GTPase
- 本地化
- RabA1d
- 根头发
- Trans-Golgi网络
- 囊泡