摘要
背景
内质网伴侣结合蛋白(BiP)是一种重要的功能蛋白,参与蛋白质的合成、折叠组装和分泌。为了研究BiP在小麦种子发育过程中的作用,我们从面包小麦(小麦),通过快速扩增cDNA末端(RACE)完成,并使用HMW-GS沉默的近等基因系(NILs)和非生物胁迫下检测了小麦组织中BiP的表达,特别是BiP表达与HMW-GS亚基类型之间的关系。
结果
序列分析表明,所有BiPs都包含三个高度保守的结构域,存在于植物、动物和微生物中,表明它们在不同生物物种中的进化保守性。定量逆转录聚合酶链反应(qRT-PCR)显示TaBiP(小麦BiP)的表达不具有器官特异性,而主要局限于种子胚乳。此外,免疫定位证实,TaBiP主要位于小麦胚乳的蛋白体(PBs)内。三个TaBiP高分子量谷蛋白亚基(HMW-GS)沉默后,基因的表达显著下调。干旱胁迫诱导TaBiPs在小麦的根、叶和发育中的谷粒中。
结论
BiP序列的高度保守性表明,BiP在不同物种的新生多肽的折叠和组装以及蛋白质合成中起着相同的作用或具有共同的机制。的表达式TaBiPs在不同的小麦组织和非生物胁迫下表明TaBiP在高分泌活性和高分裂细胞比例的组织中最丰富,并且BiP的表达水平与HMW-GS和合成的亚基类型有关。的表达式TaBiPs在种子发育和幼苗早期生长以及各种非生物胁迫下受到发育调控。
背景
内质网(ER)参与蛋白质合成和新生蛋白质的折叠、组装、运输和分泌[1].内质网最重要的功能之一涉及新生蛋白的质量控制,这是由内质网伴侣蛋白如蛋白二硫异构酶(PDI)和结合蛋白(BiP)完成的。作为主要的ER伴侣蛋白之一,BiP在蛋白质合成、折叠和组装中起着重要的作用[2].
BiP属于伴侣蛋白HSP70家族。它在N端有一个ATP酶结构域,在C端有一个蛋白质结合结构域,这使得BiP能够在三磷酸腺苷(ATP)水解和二磷酸腺苷(ADP)交换之间循环,并结合和释放其未折叠的蛋白质[3.]、[4].BiP蛋白在C端包括一个KDEL或HDEL ER保留信号,其功能是将蛋白质保留在内质网管中。一般来说,BiP伴侣蛋白在内质网中有两个主要功能。首先是结合进入内质网腔的未折叠蛋白质,从而防止新生多肽链折叠错误或聚合。BiP的第二个功能是与内质网中由膜结合多体合成的新生未成熟分泌蛋白相互作用。这可以防止未成熟的蛋白质变性或降解,并确保适当的折叠。因此,BiP不仅参与协助蛋白质折叠,还参与被称为er相关降解(ERAD)的蛋白质降解过程。当未折叠或错误折叠的蛋白质在内质网内大量积累时,BiP诱导ERAD将这些异常蛋白质从折叠途径中移除[5].
编码BiP的基因从玉米、水稻、拟南芥南瓜和其他植物似乎高度保守,特别是在更接近的物种中[6].据报道,BiPs参与高水平储存蛋白的合成和应激反应[7]-[9].BiP与聚核糖体中的新生脯胺链和游离脯胺形成复合物,并通过促进脯胺折叠和组装成蛋白体(PBs)而将脯胺保留在管腔中[10].严重抑制(BiP1KD)或显著过表达(BiP1OEmax)BiP1不仅改变水稻种子表型和胚乳细胞胞内结构,而且降低种子贮藏蛋白含量、淀粉积累和籽粒重[j]。6].这表明,BiPs的表达水平影响着与籽粒品质和产量相关的种子贮藏蛋白和淀粉的合成和积累。
各种环境因素可引起内质网应激反应,包括温度、光、干旱和盐。有研究表明,BiP的表达与内质网应激反应密切相关。例如,光强度的变化可以引起特定组织中BiP表达水平的变化拟南芥,并调节分泌蛋白质的积聚水平[11].有趣的是,与野生型相比,过表达BiP的转基因植株表现出更好的耐旱性和更低的干旱敏感性。此外,在相同的干旱条件下,与野生型相比,过表达BiP的转基因植株表现出更高的叶片含水量、更少的枯萎和更少的气孔关闭。而与野生型相比,这些转基因植株中与干旱有关的某些生物学参数,如脯氨酸和葡萄糖的含量没有显著变化[12].这些发现表明毕普可能关闭其他干旱诱导基因的表达,并可能导致转基因植物比野生型更具耐受性。
作为一种同种六倍体,面包小麦(小麦L., 2n = 6x = 42, AABBDD)是世界上最重要和广泛种植的作物之一。小麦贮藏蛋白,主要是聚合谷蛋白和单体麦胶蛋白,主要决定小麦面粉的加工质量,使其具有独特的粘弹性,用于生产面包和其他食品[13].特别是高分子量谷蛋白亚基(HMW-GS),作为谷蛋白的重要组成部分,通过二硫键形成大的聚合物结构,在控制面包制作能力中起着关键作用。14].研究表明,BiP参与小麦储存蛋白的合成,包括HMW-GS,并且在胚乳发育的中期,即细胞快速扩增和HMW-GS积累的时期,BiP积累达到最高水平[15].尽管在HMW-GS积累的后期形成下降趋势,但BiP积累的模式与提出的作为储存蛋白折叠和内质网积累的催化剂的作用相一致,并且在胚乳发育的后期被检测到[16].
虽然BiPs已经在一些植物物种中被研究过,但它们在小麦中的结构、系统进化和功能特性仍然不确定。在本研究中,三个同源的cDNA序列头猪首次克隆了面包小麦,对其结构特征、进化保守性、不同器官表达谱及干旱胁迫下的表达进行了研究。结果表明,BiPs在动物、微生物和植物中具有高度保守性,其表达水平与HMW-GS合成和抗旱性密切相关。这些发现为了解BiP家族的结构、进化和功能提供了新的见解。
结果
面包小麦BiP基因的分子特征分析
的完整cDNA序列TaBiPs利用特异性引物扩增了面包小麦品种“中国春”(Chinese Spring, CS)的基因片段,RACE扩增了约1670 bp的预期产物(见附加文件)1).经过克隆和测序,一个1665 bp的序列包含了该基因的保守部分长度毕普互补脱氧核糖核酸序列。DNA序列分析确定了开放阅读框(ORF)的存在,但未发现N端和c端编码序列。因此,采用基于pcr的方法分离剩余的5 '和3 '端毕普互补脱氧核糖核酸。最后得到三个完整的cDNA序列TaBiP基因,名叫TaBiP1,TaBiP2,和TaBiP3,分别存入GenBank,登记号为KC894715、KC894716和KC894717。
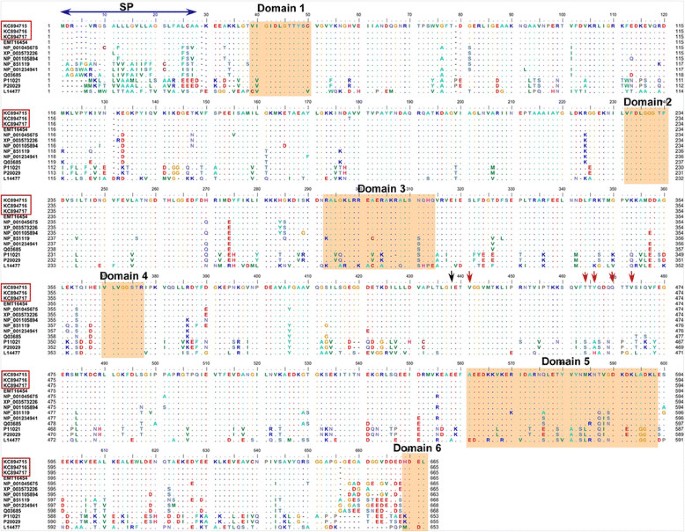
cDNA序列分析表明TaBiP1,TaBiP2,TaBiP3大小分别为2163、2155和2158 bp,但所有基因的编码区均由一个编码665个氨基酸残基的1998 bp序列组成(图1).此外,还获得了三个对应的基因组全长DNA序列;的完整序列长度TaBiP1,TaBiP2,TaBiP3基因分别为3725、3701和3691 bp。此外,染色体定位研究表明TaBiP1位于6DS染色体上,TaBiP2位于6BS染色体上,而TaBiP3位于6AS染色体上。通过wheat URGI检索和分析最近完成的小麦基因组序列,我们发现每个小麦基因组只有一个毕普表明普通小麦可能有三个BiP基因拷贝。这三个基因都包含高度保守的8个外显子和7个内含子(见附加文件)2).三个克隆体的分子特性毕普小麦的同源基因见表1.
将推断的TaBiP氨基酸序列与其他物种的BiP同源物进行比对,显示出区域之间的高度保守性,尽管存在一些差异。特别是,tabip与玉米、水稻和大豆的BiPs具有更高的相似性Brachypodium distachyon,包括相似的编码区和orf以及功能域(图2)1).一般来说,BiP蛋白在N端有一个atp酶结构域(约45 kda),该结构域包含高度保守序列的延伸、一个atp酶活性区域和C端一个蛋白质结合结构域[17].c端区域包括一个16 kda的片段,该片段具有肽结合位点,以及一个更可变的10 kda序列,包括蛋白质的末端部分[17]、[18].这种结构允许BiP在ATP和ADP交换之间循环,并结合和释放未折叠的蛋白质[3.].C末端的两个结构域都有一个截断点GI,这是将atp酶结构域与肽结合结构域分开的切割位点(图2)1).
所有BiPs在N端起始处都有一个信号肽序列(图2)1),其主要功能是引导不同BiP蛋白菌株的膜转运。信号肽序列的长度因物种而异。例如,水稻、玉米、小麦中的信号肽,Brachypodium,高粱有24个氨基酸残基(aa)而在拟南芥菠菜、烟草和大豆分别含有27、28、29和30个氨基酸。值得注意的是,花旗松的信号肽只有17aa [9].
在BiPs的atp酶结构域中,一些具有不同功能的重要基序是高度保守的。如图所示1β(结构域1)、γ(结构域2)和腺苷结合(结构域4)基序位于ATP酶结构域,它们的功能是结合ATP或释放ADP。一个假定的钙调素结合基序(结构域3)也位于atp酶结构域[19]、[20.].
BiPs的c端蛋白结合域具有5个高度保守的氨基酸残基(图2)1),形成一个五残基底物核心,并促进与肽-底物骨架的氢键。位于c端蛋白结合域的αβ基序(结构域5)主要阻止新生肽底物从蛋白结合口袋中释放出来[21].此外,BiP的C端具有高度保守的HDEL序列(结构域6),作为内质网保留信号。然而,保留信号有一些变化。HDEL存在于大多数植物BiPs中,而KDEL存在于哺乳动物中,MDDL存在于某些细菌物种中(图2)1) [9].
小麦BiP基因的单碱基替换和插入/缺失(InDels)
三个克隆体的完整编码序列TaBiP11个基因对齐毕普其他谷类作物的基因(o .漂白亚麻纤维卷BiP1/2来自大米;z梅斯来自玉米的BiP1/2;b . distachyonBiP1/2从b . distachyon,美国二色的BiP1/2从高粱,美国italicaBiP1/2/3从Setaria italica)来检测单碱基替换和indel。在不同位置共鉴定出14个单碱基取代,取代的数量在TaBiP1,TaBiP2,TaBiP3分别为8、5、4(表1)2).然而,没有找到indel。在检测到的14个单碱基取代中,11个(70%)是过渡(A-G或C-T)的结果,只有3个取代归因于转化(A-T, A-C, C-G或G-T)。在位置72、96、228、252、834和1404的6个取代涉及可能导致氨基酸取代的非同义变化。其余8个单碱基取代涉及同义取代,不引起氨基酸变化。
不同物种间BiPs的系统发育和保守基序分析及TaBiP三级结构预测
根据Zhu等人的研究,利用42个BiP氨基酸序列构建了无根系统发育树[22],用于分析不同物种之间的进化关系,其中包括来自t . aestivum,两个来自o .漂白亚麻纤维卷,两个来自z梅斯,两个来自b . distachyon,以及来自其他物种的33个序列。由此得出的系统发育树清晰地将蛋白质分为三个分支,分别对应于植物、动物和微生物,这表明在长期的进化过程中,不同生物物种之间的BiPs存在较大的差异,并形成了一个独特的系统发育植物亚群(图2)2).在植物BiPs中,系统发育树被划分为几个独立的小亚群,包括豆科和禾科的物种。在Poaceae中还鉴定出两个密切相关的亚科,图中用绿色方框标记2.
对来自不同生物物种的BiPs保守基序的分析表明,所有BiPs都包含三个基序(见附加文件)3.),它们在位置和长度上都高度保守,只有很小的变化。Motif 3包含一个β Motif (Domain 1), Motif 2包含一个γ Motif (Domain 2), Motif 1是发生氢键的区域。β和γ基序属于atp酶结构域,而基序3是c端蛋白结合结构域的一部分。
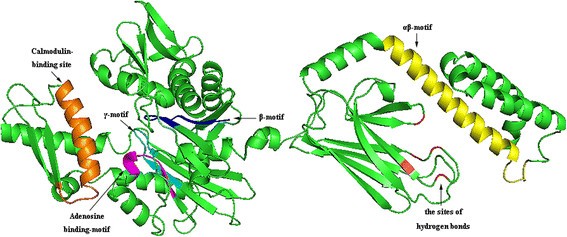
由于BiP是HSP70家族的成员,其三级结构应该与HSP70蛋白相似。事实上,使用pymol2构建的克隆同源BiP的预测三级结构(图2)3.)与HSP70蛋白非常相似[23].这些基序在不同物种BiPs的三级结构中占据相似的相对位置,如图所示3..n端结构域的atp结合位点位于位于两个结构叶之间的深裂缝的底部。令人惊讶的是,发现atp酶结构域的核苷酸结合“核心”具有与己糖激酶相似的三级结构[24],提示两种蛋白的磷酸转移酶机制和底物诱导的构象变化可能相似。肽结合域类似于大肠杆菌并在肽结合裂缝所在的位置形成β-三明治肽结合袋(图2)3.).排列在裂缝内的残基与未折叠和暴露的多肽链的疏水延伸相互作用(图2)3.).c端α-螺旋延伸作为一个盖子,在结合间隙中捕获肽结合,从而提供了一种维持长寿命复合物的机制[21].
TaBiP蛋白的三级结构。该蛋白结构是用PyMol 2服务器绘制的,在结构上与Sung等人预测的植物HSP70蛋白相似。23].β, γ,腺苷结合基序和钙调素结合基序位于n端atp酶结构域,分别以蓝色,青色,品红和橙色编码。αβ基序(黄色)和5个氢键结合位点(红色)位于c端结构域。
TaBiP基因在小麦不同器官中的表达谱
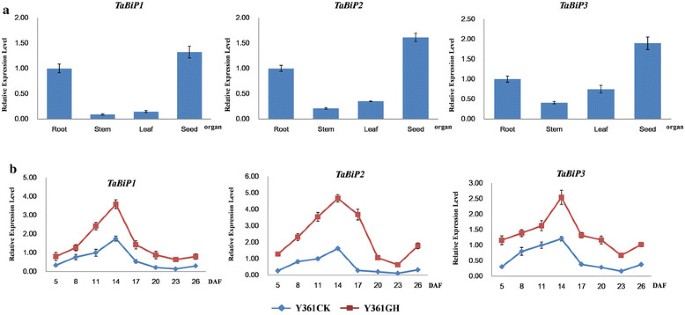
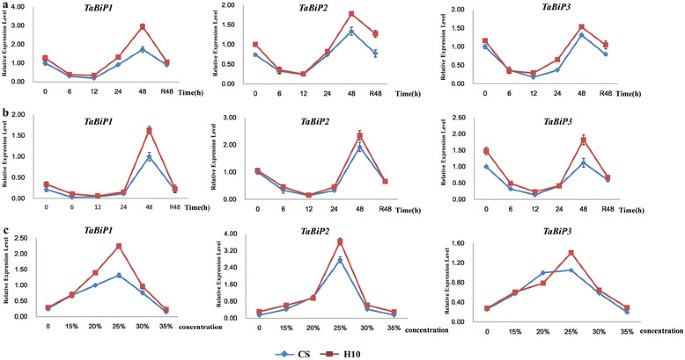
得到了三者的表达谱TaBiP采用qRT-PCR技术对小麦根、茎、叶和种子中的基因进行了分析(图2)4a).结果表明TaBiP基因在小麦根、茎、叶和种子中均有表达,但表达水平差异很大。显然,表达水平TaBiPs种子含量高,茎叶含量低。
干旱胁迫下TaBiP基因在籽粒发育中的动态表达谱
三者的动态表达谱TaBiP面包小麦品种Y361在籽粒发育8个阶段和干旱胁迫下的基因在籽粒发育过程中呈现出向上向下的表达谱(图2)4b).的最高表达量TaBiPs发生在种子发育的14 DAF,这可能与小麦贮藏蛋白在15 - 25 DAF的快速合成和积累阶段有关[25].在干旱的压力下,三者都是TaBiP与对照组相比,这些基因的表达明显上调,在14 DAF时达到最高表达水平(图2)4b)。
籽粒发育过程中TaBiP表达与HMW-GS合成的关系
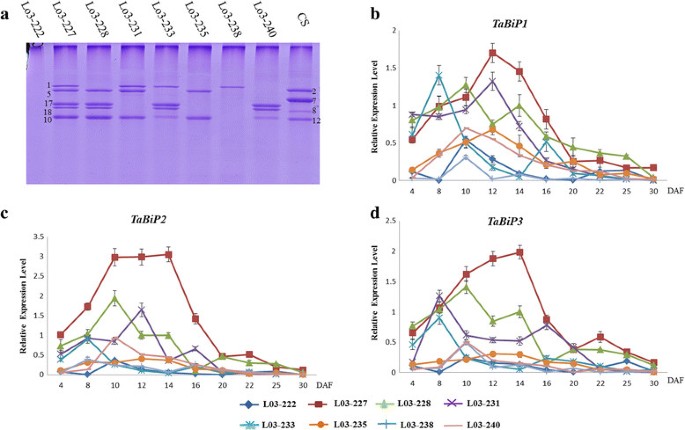
使用一组HMW-GS NILs来定义TaBiPHMW-GS在籽粒发育过程中的表达和合成(表1)3.).SDS-PAGE分析表明,8种NILs具有不同的HMW-GS组成Glu-A1,Glu-B1,Glu-D1其中,L03-222中HMW-GS基因全部沉默(图2)5a). qRT-PCR分析显示差异显著TaBiP不同NILs中不同HMW-GS沉默对应的表达谱(图2)5罪犯)。一般来说,TaBiP在籽粒发育过程中,基因的表达呈现出由上至下的表达模式,在10-14 DAF时表达量较高。所有三个TaBiP在HMW-GS沉默的同时,基因的表达明显下调,其中最低TaBiP表达水平发生在L03-222中,其中所有HMW-GS位点均沉默(图2)5罪犯)。这些结果证明了两者之间的密切关系TaBiPHMW-GS在籽粒发育过程中的表达及亚基类型。
小麦胚乳组织TaBiPs的透射电镜和免疫电镜鉴定
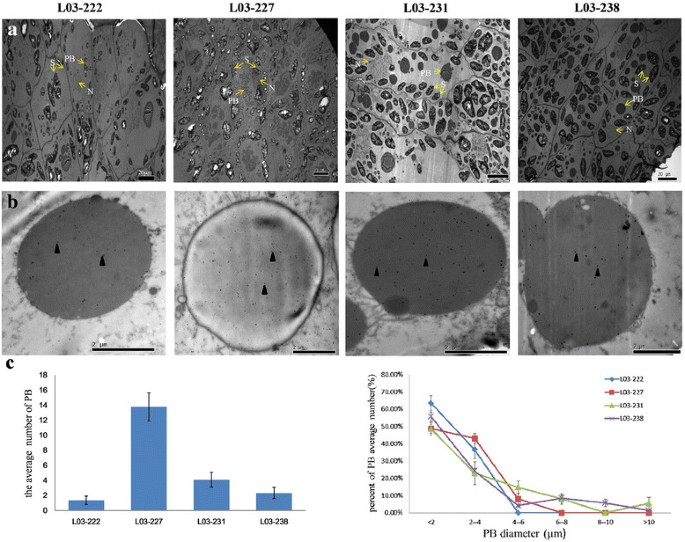
为了明确tabip在籽粒胚乳中的位置以及BiP和PBs之间的关系,我们用透射电镜观察了4个NILs发育中的小麦籽粒胚乳(14 DAF)的超薄切片(图2)6a)和免疫电子显微镜(图6b).结果表明,L03-222中只存在少量和较小尺寸的PBs, HMW-GS不表达(图3)6a).含有一个或两个HMW-GS(图中L03-231或L03-238)的NILs中可以观察到更多的PBs6a)与L02-222比较,HMW-GS表达正常的L03-227中PBs数量最多。免疫电镜显示,抗bip探针主要位于PBs的周围,并在PB发育的各个阶段都有观察到。可见,PBs中抗bip的含量随着HMW-GS数量的增加而增加(图2)6b)。在这些结果中观察到的趋势表明,PBs的平均数量(图2)6c左)和大直径PBs的百分比(图2)6c右)随着HMW-GS数量的增加而增加。
干旱胁迫下小麦幼苗TaBiP基因的表达模式
的表达模式TaBiPs干旱胁迫下不同时间、不同浓度PEG6000处理下幼苗根系和叶片中TaBiPs可能受到干旱胁迫的调控。结果如图所示7结果表明,PEG6000处理显著上调了TaBiP基因在CS和H10幼苗中的表达。一般来说,这三种TaBiP不同处理时间和不同浓度PEG6000处理下,基因在幼苗根和叶片中的表达模式相似。如图所示7在a-b中,20% PEG6000处理后6 ~ 48 h,根和叶中基因均显著上调。在PEG6000浓度低于20%的情况下,0 ~ 12 h表达量显著下调,12 ~ 48 h表达量上调,48 h恢复后达到与对照相近的水平(图2)7a, b).两个品种在不同PEG6000浓度下,三者的表达量TaBiP在15 ~ 30% PEG范围内,随着浓度的增加,基因表达量增加,以25% PEG表达量最大。而当PEG浓度为35%时,效果不显著,幼苗生长缓慢,枯萎严重(图2)7c)。
讨论
不同生物物种间BiP基因的进化保护与变异
在目前的研究中,有三个毕普利用RACE和PCR技术从小麦胚乳组织中分离出序列同源性较高的cDNA和DNA序列。三个BiP基因,TaBiP1,TaBiP2,和TaBiP3,分别位于6DS、6BS和6AS染色体上。推导出的BiP蛋白和其他BiP同源物在功能域和三级结构方面高度保守(图2)1和3.),表明不同物种的BiP具有保守的蛋白功能。最明显的保存证据是在图案中发现的(见附加文件)3.)的三磷酸腺苷酶和肽结合域(图2)1).在哺乳动物的BiP和HSP70中,以及在功能多样化的蛋白质如肌动蛋白和几种糖激酶中,已经发现了对n端atp酶活性重要的保守区域[19]、[26]、[27].这种保守性表明atp酶和肽结合结构域是不同生物物种生存所必需的。有趣的是,一个假定的钙调素结合基元存在于atp酶结构域,尽管在内质网管中未发现钙调素,这表明BiP可能与钙一起作用2+结合蛋白共同调节BiP的功能和活性。
不同物种间BiP序列的主要差异主要体现在内含子上(表2)1;额外的文件2)和单碱基替换(表1)2),尽管这些差异只涉及很少的氨基酸变化。尽管这些基序高度保守,但不同物种之间的BiP序列长度存在差异(见附加文件)3.),这可能是由于段重复或索引。在烟草中[28],大豆[29]、[30.],拟南芥[31]和玉米[32], BiPs是由一个多基因家族编码的。根据目前可用的小麦基因组信息(http://wheat-urgi.versailles.inra.fr/Projects),普通小麦基因组可能有三个毕普基因。tabip的独特分组与其他BiPs不同,表明tabip与其祖先有显著的差异,尽管有主要的序列保守区域。在不同位置共鉴定出14个单碱基替换,其中6个是非同义突变,这些突变似乎没有改变TaBiP的功能,尽管相关的结构变化导致了谷类作物的不同分类。然而,在n端信号肽中观察到显著的差异,其序列长度和同源性几乎不守恒,这种差异在不同物种中非常普遍[33].另一个明显的差异,可能是由于物种进化,在c端保留信号中观察到,该信号有助于在肽链折叠和组装完成后BiP返回内质网,这一差异可能作为区分不同物种的标记。
TaBiP表达及HMW-GS合成
研究发现,植物BiP蛋白在高分泌活性和高分裂细胞比例的组织中含量最高[34].使用原位杂交,Muench等。[9在水稻胚乳组织中发现了一个强烈的BiP条带,但在根和叶组织中没有可见的杂交,即使长时间暴露。没有可观察到的杂交信号表明,BiP的表达水平低于分析的检测极限。在本研究中,qRT-PCR显示TaBiPs没有器官特异性表达,但主要在种子中表达(图4a).与其功能一致的是,生理应激条件会诱导BiP的合成,从而促进内质网中蛋白质的积累[2]、[35].BiP参与储存蛋白在内质网中的导入、折叠和组装,可能对储存蛋白的翻译后加工至关重要[qh]36].BiP在胚乳发育中期积累到最高水平,并在储存蛋白积累最多的时候下降[37].当蛋白质基因作为储存蛋白或分泌蛋白高度表达时,内质网驻留伴侣蛋白的合成增加,以协助这些蛋白质的折叠和组装[38].小麦胚乳组织中TaBiP的免疫定位结果表明,TaBiP主要位于小麦胚乳的PBs中(图2)6b).此外,结果还表明,TaBiP在PB发育的各个阶段都有表达,表明TaBiP的表达水平与蛋白质合成活性水平有关。此外,BiP在水稻和玉米中的免疫定位与在小麦中的不同。先前的研究表明,BiPs主要表达于PB的外围,在水稻胚乳中很容易观察到[10].相比之下,在正常发育的玉米胚乳中,用相同的BiP抗血清探测的BiPs在免疫细胞化学中未被检测到[39]、[40].水稻、玉米和小麦的这些免疫定位差异可能是由与它们折叠相关的不同过程引起的。
研究发现,在种子发育的早期,BiP的表达量最高,通常在11 DAF左右4b),而蛋白质合成和蛋白质折叠的主要增加发生在大约15-25 DAF [25].在种子发育的早期阶段,蛋白质合成相对较低。随着种子的发育,面筋等蛋白质被合成,并在运输后折叠。组装、运输和折叠的过程似乎需要额外的BiP蛋白。然而,由于BiPs在脯氨酸折叠和组装中的重要作用,在发育过程中,BiP的丰度必须与脯氨酸的丰度相似,这表明,要么是BiP多肽链非常稳定,要么是BiP mRNA在种子发育后期的翻译效率更高。虽然BiP在储存蛋白积累过程中占总蛋白的比例下降,但其积累模式与伴侣蛋白在内质网中折叠和积累的作用是一致的[37].
不同亚基影响PBs的大小、数量和结构,最终影响小麦加工质量[41]、[42].PBs通过相互融合形成谷蛋白大聚合物(gmp)。GMP中麸质颗粒的存在与某些HMW-GS的存在直接相关,GMP的量随着HMW-GS数量的增加而增加[43].这表明HMW-GS的数量可能会影响PBs的大小和数量,从而影响PBs的合并,从而影响gmp。小麦胚乳组织透射电镜显示,PBs的含量随着HMW-GS数量的增加而增加(图2)6a和c)。HMW-GS越多,意味着种子发育过程中肽链合成越活跃,在蛋白质合成过程中起重要作用的分子伴侣(即BiP和PDI)也相应增加[17]、[44].先前的研究表明,过表达伴侣蛋白可提高烟草的折叠和分泌效率,增加外源蛋白的积累[45],酵母[46]、[47]、昆虫细胞和哺乳动物细胞[48].伴侣蛋白与种子贮藏蛋白合成关系的研究[j]6]的研究表明,在内质网腔中伴侣蛋白如BiP、CNX和PDIL水平充足的情况下,内质网应激的减轻可能会增加SSP水平,而内质网应激是由大量SSP合成引起的。他们进一步证明,在其他伴侣存在的情况下,水稻种子中稍高水平的BiP可能有利于SSP的积累,从而表明BiP是促进储存蛋白生物合成的关键因素。在本研究中,的表达TaBiP在NILs中(图4)5b-d)和小麦胚乳组织TaBiP免疫电镜分析结果(图2)6B)提示TaBiP与HMW-GS的数量密切相关,随着HMW-GS数量的增加而增加。HMW-GS越多,内质网应激越强,基于上述结果,我们假设以下机制来解释种子胚乳中BiP表达与HMW-GS合成之间的关系。虽然正常情况下,BiP在大多数组织中的表达相对稳定,但随着种子中该蛋白的组织特异性合成,其表达会增加,从而导致内质网产生生理压力。随后诱导BiP的表达以减轻内质网应激。因此,增加HMW-GS亚基的数量会导致内质网应激增加,从而诱导更高的BiP表达。
BiP表达与多种植物防御
BiP的表达可能受到各种应激条件的诱导,这些应激条件也会引起内质网应激[2]、[35].虽然毕普是在正常生长条件下本构表达,表达一些毕普由于高温暴露或使用还原剂二硫苏糖醇(DTT)或蛋白质糖基化抑制剂(tunicamycin)处理而导致未折叠或异常蛋白质水平增加,从而触发内质网应激条件下的基因[49]-[51].Buzeli等人(2002)确定了两个独联体-通过启动子缺失分析,在正常植物发育过程中对BiP表达的空间调控激活至关重要的调控功能域[52].Noh et al .(2003)也发现A.thaliana似乎是受管制的独联体-调控功能域,即ERSE和upe [53].这些结果表明,BiP基因的表达受到内质网应激或其他应激反应的诱导。关系的表达毕普内质网应激反应已经在动物和酵母中进行了研究。在动物细胞中,内质网应激反应包括至少三种不同的细胞内信号转导途径:一种异常的蛋白质重折叠和降解系统[54],翻译抑制[43]、[55]、[56],以及细胞凋亡通路的激活[57]、[58].BiP与上述途径密切相关,作为开/关开关或内质网应激感应的主调节器,通过结合和释放每个相关蛋白。
一些研究也调查了两者之间的关系毕普植物内质网的表达及逆境引起的内质网应激反应。在菠菜中,BiP因温度降低而上调,并且在植物暴露于低温、非冷冻温度后,BiP与非天然蛋白质的关系日益密切[59]、[60].植物暴露在低温下也被证明可以刺激细胞外蛋白质的产生,这些蛋白质被认为是在低温下生存所必需的[61]、[62].Hurkman等。[63]研究了温度对BiP mRNA和蛋白质积累水平的影响,发现小麦在37℃或40℃的温度下,蛋白质和BiP mRNA的积累水平随种子生长时期的不同而变化。与哺乳动物细胞一样,植物细胞已经进化出至少三种不同的介导内质网应激的机制:(1)编码伴侣蛋白和囊泡运输蛋白的基因的转录诱导,包括bzip型或ATF6转录因子;(2)由PEPK和ATF4同源蛋白调控的编码分泌蛋白基因的衰减和抗应激基因的诱导;(3) ERAD系统在IRE1、激酶和XBP1的调控下上调,消除内质网中未折叠的蛋白。植物中BiP与内质网胁迫反应之间关系的分子机制已被研究拟南芥和米饭。虽然拟南芥水稻的基因结构与ATF6和IRE1从酵母和人类,其他候选基因对应XBP1和活跃在植物中尚未发现。近年来,微阵列杂交实验揭示了几种未折叠蛋白反应(UPR)靶基因拟南芥参与内质网和分泌通路功能[64].在拟南芥,一些毕普基因由bZIP转录因子AtbZIP60直接控制,该转录因子具有跨膜结构域(TMD),相当于bZIP转录因子ATF6与水稻内质网应激反应有关的基因[49]-[51].当内质网不受内质网胁迫时,ATF6和AtbZIP60通过与BiP相互作用的c端TMD定位于内质网管内。当内质网检测到应激时,高尔基体中的c端TMD被切割,含有亮氨酸拉链的细胞质n端激活结构域被转移到细胞核中,在细胞核中通过与内质网应激反应元件(ERSE)结合参与一些内质网应激相关伴侣基因的表达。cis-element(CCAAT-N9-CCACG)和ERSE-IIcis-element(ATTGG-N-CCACG)。因此,由该基因编码的蛋白质可能负责调节伴侣基因的表达,包括BiP。
一种推测的BiPs参与蛋白质合成和多种防御反应的途径
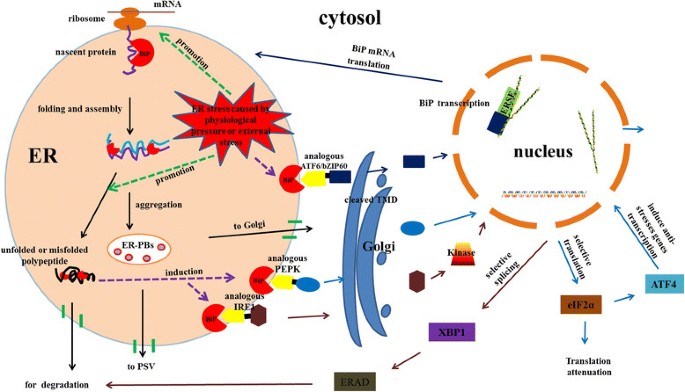
根据我们的结果和之前的研究,我们提出了一种推测的BiPs参与蛋白质合成和多种防御反应的途径(图2)8).通常,种子或其他器官中的BiP与新生蛋白肽结合以防止降解或错误折叠。随后,BiP帮助多肽在内质网内折叠和组装,形成内质网蛋白体(ER- pb)。ER- pbs通过不同的途径从内质网转运到高尔基体或蛋白质储存液泡(PSV)。错误折叠或未折叠的蛋白质被运输到细胞质中,并在BiP的帮助下被降解(图2)8).在非应激条件下,BiP结合类似的ATF6、PEPK和IRE1的管腔结构域以阻止它们的二聚化。由于内质网腔内的应激导致未折叠蛋白的积累,三种不同的信号通路将被诱导和激活以缓解内质网应激:(1)编码伴侣蛋白的基因转录诱导,包括从BiP中释放类似的ATF6或bZIP60,并将其转运到高尔基室,在高尔基室中,TMD的切割产生细胞质片段,该片段迁移到细胞核,进一步激活包括BiP在内的内质网伴侣蛋白基因的转录;(2) ERAD系统的激活,BiP释放的类似IRE1二聚体激活其激酶和RNAase活性,启动类似的XBP1 mRNA剪接,从而产生一个有效的转录激活因子,诱导负责编码ERAD功能的基因;(3)诱导编码抗应激因子的基因和编码分泌蛋白的基因的衰减,类似于植物细胞中从BiP二聚体释放的PERK,这些蛋白激活eIF2α,导致翻译起始的普遍衰减。此外,eIF2α磷酸化可诱导ATF4。PERK/eIF2α/ATF4调控轴诱导抗应激反应基因的表达[65],如图所示8.
BiPs参与蛋白质合成和多种防御反应的机制和信号通路。BiP结合新生蛋白肽,以防止降解或错误折叠。肽被折叠和组装,形成内质网蛋白体(ER- pb),并在BiP的帮助下运输出内质网。错误折叠或未折叠的蛋白质在BiP的帮助下被转运到细胞质中进行降解。在非应激条件下,BiP结合类似IRE1的管腔结构域以阻止其二聚化。当内质网受到胁迫时,从BiP释放的类似的ATF6或bZiP60被运输到高尔基室,TMD在那里切割产生细胞质片段,该片段迁移到细胞核,进一步激活upr应答基因的转录。同样,从BiP释放的IRE1二聚体激活其激酶和RNAase活性,启动XBP1 mRNA剪接,从而形成一个有效的转录激活因子,诱导ERAD的基因编码功能。最后,BiP释放的类似PERK二聚体激活eIF2α,导致翻译起始的普遍衰减,而eIF2α磷酸化诱导ATF4 mRNA的翻译。PERK/eIF2α/ATF4调控轴诱导抗应激反应基因的表达。
结论
在这项研究中,我们首次克隆了三个完整的TaBiP这些基因都与其他物种的BiP基因高度同源,这表明不同物种的BiP具有共同的蛋白质折叠、组装和合成机制,以及不同的防御反应。TaBiPs在发育中的谷物中大量表达,并与HMW-GS的合成密切相关,表明它们在储存蛋白的合成和面筋质量构象中起关键作用。干旱胁迫可诱导基因的显著上调TaBiPs在幼苗生长和籽粒发育中,表明它们也具有防御功能。
方法
植物材料
本研究选用的小麦材料包括我国优质面包小麦品种延优361 (Y361)和汉选10 (H10),这两个品种均具有高产、优质和抗旱能力强的特点。一组完整的HMW-GS近等基因系(NILs),见表3.由澳大利亚莫道克大学国家农业生物技术中心马武军博士提供。以中国春(CS)为对照,进行干旱胁迫和HMW-GS鉴定。
田间种植及抽样
所有材料均于2012-2013生长季在中国农业大学吴桥实验站采用当地大田栽培条件进行种植。每个品种和NIL种植在12 m的空间内2小区3个重复,10行(300株)。试验点位于东经116°37′23”,北纬37°41′02”,年平均日照2690 h,年平均气温12.6℃,小麦季节年降雨量124.8 mm。播种前施肥200 kg/hm2尿素,400kg /hm2磷酸二胺2O516%), 150kg /hm2K2所以4,15kg /hm2ZnSO4.对照组和处理组采用3个重复的分组设计,以22.5 kg/hm的播种量进行随机试验2间距为20厘米。
面包小麦品种穗部中部发育的籽粒分别在开花后5、8、11、14、17、20、23和26天采集,而无穗小麦品种穗部发育的籽粒分别在开花后4、8、10、12、14、16、20、22、25和30天采集。所有收集的材料在使用前快速冷冻在液氮中,并在- 80°C保存。
田间亏水处理与土壤水分测量
对Y361品种在生长季节进行了水分亏缺处理。水分充足的组通常浇水约750米3./嗯2在播种、拔节和开花期,而干旱处理组在生长季节不浇水。3个生物重复的丰水处理和干旱处理的土壤样品取自距表层土壤20 cm的试验田。土壤样品收集于铝盒中,在105°C烤箱中干燥48 h。每个样品测量三次,取平均值作进一步分析。土壤含水量(W %)的计算公式为:W % = (g2−g1)/(g1−g0) × 100%(其中g2为湿土重量;G1为干土重量;g0表示空盒子的重量)。
苗木栽培及PEG处理
CS和H10的种子用70%的酒精洗涤,然后用蒸馏水洗涤三次。然后,将种子在湿滤纸上室温黑暗萌发24 h,转入含有5 mM KNO的全强度Hoagland营养液的专用培养篮中3., 5 mM Ca(NO3.)2, 2毫米MgSO4, 1mM KH2阿宝4, 50 μM FeNa2(EDTA)2, 50 μm h3.薄3., 10 μM MnC120.8 μM ZnSO4, 0.4 μM CuSO40.02 μM (NH)4)6MoO24.每3天更换一次营养液。在Hoagland’s溶液中加入PEG6000,从三叶期开始对幼苗进行干旱胁迫分析。PEG处理浓度分别为0% (CK)、15%、20%、25%、30%和35%。20% PEG处理组在6、12、24、48和R48 h采集叶片和根,不同PEG浓度处理组在处理后48 h采集叶片。所有材料收获后立即在液氮中冷冻,并在RNA分离前保持在- 80°C。
mRNA提取、cDNA合成及cDNA末端快速扩增(RACE)
根据先前报道的方案分离总rna [66].采用NanoDrop ND-1000分光光度计(NanoDrop Technologies, Wilmington, DE, USA)测定1 μ l RNA样品的浓度和质量。纯化的和未降解的rna使用上标第一链合成试剂盒(Promega Madison, WI, USA),用OligdT和随机引物从大约100 ng mRNA合成cDNA。通过对BiP基因序列的比对分析,在高度保守序列的两端设计分离初始部分BiP cDNA的引物o .漂白亚麻纤维卷,z梅斯,b . distachyon.由于只分离到部分BiP cDNA克隆,因此采用5′和3′RACE聚合酶链反应(PCR)获得编码区,以及大部分5′和3′非翻译区(UTRs)。5 '和3 ' - Full RACE试剂盒来自TaKaRa Biotech。利用Primer Premier 5.0软件设计cDNA和DNA克隆的特异性引物,扩增产物经1%琼脂糖凝胶电泳分离,见附加文件1.使用Gel Extraction Kit (Omega)从凝胶中纯化扩增子片段,连接到pGEM-T Easy载体(Tiangen, Beijing, China)上,然后转移到大肠杆菌DH-5α的压力。克隆产物测序由中国上海三工生物技术有限公司完成。
序列比对和染色体定位,单碱基替换和插入/缺失(InDels)鉴定
利用ClustalX 1.81软件完成序列比对。通过WHEAT URGI (http://wheat-urgi.versailles.inra.fr/Projects).BiP基因的单碱基替换和indel的鉴定小麦属植物利用Bioedit 7.0软件进行多序列比对。
BiP家族蛋白的系统发育和保守基序分析及TaBiP三级结构预测
克隆的BiP序列,以及通过国家生物技术信息中心(NCBI)鉴定的不同物种的BiP序列:http://www.ncbi.nlm.nih.gov/),瑞士港(http://cn.expasy.org/sprot), embl (http://www.ebi.ac.uk/),以及Phytozome v9.1 (http://www.phytozome.net)数据库,利用MEGA软件5.10,采用邻接法(neighbor-joining, NJ)和1000次bootstrap重复构建系统发育树。所有氨基酸序列都包含在附加文件中4.利用ClustalX参数对整个编码区的BiP氨基酸序列进行比对。利用MEME (http://meme.sdsc.edu/meme4_3_0/intro.html).利用PyMol 2服务器完成小麦BiP的三级结构预测。
小麦胚乳组织TaBiP的透射电镜免疫定位
按照已有报道的方法,对nll03 -222、L03-227、L03-231和L03-238在14 DAF时的发育种子进行固定、包埋、切片、免疫染色和TEM观察[6].所用一抗为Abmart生物医药有限公司合成的玉米抗bip。一抗与阻断缓冲液的稀释比为1:500。用金标记二抗检测抗体-抗原复合物,用透射电镜观察(H-7100;日立公司;东京,日本)运行在80千伏。
谷蛋白提取及十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)
使用Bio-Rad PROTEAN II XL电泳装置进行谷蛋白提取和SDS-PAGE,方法基于[67].
实时定量逆转录聚合酶链反应(qRT-PCR)
使用TaKaRa提供的PrimeScript™RT试剂盒(含gDNA橡皮擦)按照制造商的说明进行RNA纯化和逆转录。使用Primer Premier 5.0(附加文件)设计实时qRT-PCR引物1), Paolacci等报道adp -核糖基化因子在不同组织和样品中的表达水平相对稳定,因此选择adp -核糖基化因子作为内参基因。[68].转录水平TaBiP采用CFX96 Real-Time PCR检测系统(Bio-Rad),以SYBR-green为插层染料,对3个不同处理的生物重复中的基因进行qRT-PCR定量——ΔΔCT方法(69].实时熔化温度曲线的每一个日式矿工鞋琼脂糖凝胶电泳证实,P基因仅呈现单峰。通过连续将cDNA稀释5倍来确定qRT-PCR的效率,标准曲线显示RT-PCR的效率很高(见附加文件)5).
附加文件
缩写
- 毕普:
-
结合蛋白
- CS:
-
中国的春天
- ERAD:
-
ER-associated退化
- UPRE:
-
UPR独联体元素
- HSP70:
-
70 kda热休克蛋白
- H10:
-
Hanxuan 10
- InDel:
-
插入/删除
- 零:
-
Near-isogenic线
- PDI:
-
蛋白质二硫异构酶
- PBs:
-
蛋白质的身体
- 种族:
-
cDNA末端快速扩增
- TaBiP:
-
小麦结合蛋白
- 战区导弹防御系统:
-
跨膜域
- UPR:
-
未折叠蛋白反应
- 存在:
-
实时定量逆转录聚合酶链反应
参考文献
李建军,李建军,李建军,等。植物细胞内质网及其在油脂体蛋白质成熟和生物发生中的作用。植物学报,1998,38(1):1- 9。10.1023 /: 1006011919671。
Boston RS, Viitanen PV, Vierling E:分子伴侣与植物蛋白折叠。植物生理学报,1996,32(2):391 - 391。10.1007 / BF00039383。
李建军,李建军,李建军,等。内质网蛋白折叠与质量控制。中国生物医学工程学报,2004,16(6):343-349。10.1016 / j.ceb.2004.06.012。
王晓东,王晓东,王晓东,等。分子伴侣蛋白调控的新机制。中国生物医学工程学报,2004,39(3):397 - 397。10.1080 / 10409230490900658。
张建平,张建平,张建平,等。内质网相关降解(ERAD)的研究进展。生物检测,2003,25:868-877。10.1002 / bies.10320。
Yasuda H, Hirose S, Kawakatsu T, Wakasa Y, Takaiwa F: BiP过表达对水稻胚乳细胞种子贮藏蛋白积累的抑制作用。植物生理学报,2009,35(5):1532-1543。10.1093 /卡式肺囊虫肺炎/ pcp098。
小泉N:一种编码肠内结合蛋白的基因的分离及其对应激的反应拟南芥.植物细胞生理学1996年,37:862 - 865。
Hatano K, Shimada T, Hiraiwa N, Nishimura M, Hara-Nishimura I:南瓜子叶中结合蛋白(BiP)水平的快速升高伴随着贮藏蛋白的合成和降解。植物生理学报,1997,38(3):344-351。10.1093 / oxfordjournals.pcp.a029172。
Muench DG,吴艳,张艳,李霞,Boston RS:水稻胚乳组织中BiP同源物的克隆、表达和亚细胞定位。植物生理学报,1997,38(4):444 - 444。10.1093 / oxfordjournals.pcp.a029183。
李霞,吴艳,张大志,Gillikin JW, Boston RS:水稻脯氨酸蛋白体的生物生成:bip介导的过程。科学,1993,26(2):1054-1056。10.1126 / science.8235623。
Lu DP, Christopher DA:通过测量BiP2基因表达和分泌GFP-2SC标记物,光增强了未折叠蛋白的反应拟南芥.Physiologia杆菌2008年,134:360 - 368。
马华伟,王晓明,王晓明,王晓明。大豆内质网结合蛋白(BiP)对干旱胁迫下大豆和烟草叶片衰老的影响。中国生物医学工程学报,2009,35(6):533- 536。10.1093 / jxb / ern296。
谢瑞PR, Halford NG, Tatham AS:小麦谷蛋白的高分子量亚基。谷物科学,1992,15:105-120。10.1016 / s0733 - 5210(09) 80062 - 3。
箭牌CW:巨大的蛋白质与面粉的力量。自然科学,1996,38(1):738-739。10.1038 / 381738 a0。
杜朋FM, Hurkman WJ, Tanaka CK, Chan R: BiP, HSP70。小麦胚乳中的NDK和PDI。1 .籽粒发育过程中mRNA和蛋白质的积累。植物生理学报,1998,23(3):70-79。10.1034 / j.1399-3054.1998.1030109.x。
griwade B, Tatham AS, Freedman RB, Shewry PR, Napier JA:小麦颖果发育过程中面筋蛋白和相关蛋白的表达模式比较。植物学报,1996,30:1067-1073。10.1007 / BF00020817。
海地傅:分子伴侣在细胞蛋白折叠。自然科学,1996,38(2):571-580。
Chappell TG, Konforti BB, Schmid SL, Rothman JE:网格蛋白脱壳蛋白的atp酶核心。中国生物医学工程学报,2002,26(2):746-751。
张建军,张建军,张建军,等。细胞周期蛋白、糖激酶、肌动蛋白和hsp70热休克蛋白的三磷酸腺苷酶结构域。美国国家科学促进会。[j] .中国科学:地球科学。10.1073 / pnas.89.16.7290。
Benjamin S, Misra S:花旗松管腔结合蛋白(PmBiP)的表达和特性。植物学报,2000,21(2):41-51。10.1007 / s004250000360。
朱鑫,赵鑫,Burkholder WF, Gragerov A, Ogata CM:分子伴侣蛋白DnaK结合底物的结构分析。科学,1996,27(2):1606-1614。10.1126 / science.272.5268.1606。
朱晨,罗宁,何敏,陈刚,朱军:大豆蛋白二硫异构酶基因家族的分子特征及表达谱分析Brachypodium distachyon.《公共科学图书馆•综合》2014年,9:e94704。
宋德勇,李春华,李春华。植物Hsp70分子伴侣蛋白的结构、基因家族、表达和功能。植物生理学报,2001,13(3):443-451。10.1034 / j.1399-3054.2001.1130402.x。
陈建军,陈建军,陈建军,等。热休克同源蛋白三磷酸腺苷酶片段的三维结构。自然科学,1990,34(6):623-628。10.1038 / 346623 a0。
刘伟,张亚忠,高翔,王凯,闫彦明:优质和劣质面包小麦品种籽粒发育中谷蛋白合成和积累的比较蛋白质组学分析。食品农业学报,2012,42(2):106-115。10.1002 / jsfa.4548。
Gaut JR, Hendershot LM:免疫球蛋白结合蛋白核苷酸结合位点突变抑制atp酶活性并干扰免疫球蛋白重链释放。生物化学学报,1993,26(6):748 - 755。
王晓明,王晓明,王晓明,等。热休克相关蛋白ATP水解活性的研究进展[j]。活性位点突变体的动力学分析。生物化学学报,1994,26(2):1293 - 1298。
Denecke J, Goldman MH, Demolder J, Seurinck J, Botterman J:烟草管腔结合蛋白的多基因家族编码。植物学报,2001,31(3):1025-1035。10.1105 / tpc.3.9.1025。
Kalinaki A, Rowley DL, Loer DS, Foley C, Buta G:大豆终末分化器官中结合蛋白的表达受温度、发育和胁迫调控。植物学报,1995,27(1):611-621。
Figueiredo JEF, Cascardo JCM, Carolino SMB, Alvin FC, Fontes EPB:水分胁迫下大豆BiP基因家族的分子分析。植物生理学报,1999,9(1):1 - 4。
小泉纯一,王晓明,王晓明,等。大豆中2个基因的分离纯化(Accession no . D89341和D89342)拟南芥.植物杂志1997年,113:664 - 665。
罗伯尔,陈建军,陈建军,等。玉米胚乳中BiP基因表达的比较分析。中国生物医学工程学报,2009,25(4):391 - 391。10.1016 / s0378 - 1119(97) 00529 - 5。
陈建军,陈建军,陈建军,等。原核和真核生物信号肽的鉴定及其裂解位点的预测。蛋白质工程学报,1997,10:1-6。10.1093 /蛋白质/大家。
冯志强,杨建军,黄建军,黄建军。玉米胚乳突变体免疫球蛋白结合蛋白的克隆与表达。植物学报,2001,31(3):483-496。10.1105 / tpc.3.5.483。
J .可溶性内质网驻留蛋白及其在蛋白质合成和转运中的作用。植物生理学报,1996,34(4):397 - 395。
李建军,刘建军,刘建军,等。小麦贮藏蛋白向液泡转移的新途径。中国生物医学工程学报,2009,31(2):444 - 444。10.1083 / jcb.119.5.1117。
Shimoni Y, Galili G:小麦麦胶蛋白中保守半胱氨酸之间的分子内二硫键控制它们在蛋白体中的沉积。生物化学学报,1996,31(1):869- 874。10.1074 / jbc.271.31.18869。
李建军,李建军,李建军,等。转基因植物ER-resident伴侣蛋白与重组抗体的相互作用。中国生物医学工程学报,2002,29(2):442 - 451。10.1046 / j.1432-1033.2002.03302.x。
Boston RS, Fontes EB, Shank BB, Wrobel RL:三种玉米蛋白调控突变体中免疫球蛋白结合蛋白同源物b-70的表达增加。植物学报,2001,31(3):497- 495。10.1105 / tpc.3.5.497。
张峰,Boston RS:玉米三种高赖氨酸突变体中结合蛋白(BiP)的增加伴随着蛋白体形态的变化。原生学杂志,1992,17(1):142-152。10.1007 / BF01403729。
高分子量谷蛋白亚基对小麦面包品质的影响。谷物食品世界,1994,38:76-82。
何振华,刘丽,夏晓春,刘建军,裴荣军:HMW和LMW谷蛋白亚基的组成及其对中国面包小麦面团性质、面饼和面条品质的影响。粮食学报,2005,32(2):344 - 344。10.1094 / cc - 82 - 0345。
张建军,张建军,张建军,等。高分子量小麦蛋白对面粉质量的影响。谷物科学,2006,44(4):127-136。10.1016 / j.jcs.2006.02.005。
张勇,张勇,张德龙:蛋白质翻译和折叠的内质网驻留激酶偶联。自然科学,1999,39(3):271-274。10.1038/16729。
张建军,张建军,张建军,等。烟草内质网应激的研究进展。植物学报,1999,11:459-469。10.1105 / tpc.11.3.459。
Smith JD, Tang BC, Robinson AS:蛋白二硫异构酶,但不是结合蛋白,过表达促进酵母非二硫结合蛋白的分泌。生物工程学报,2004,25(5):344 - 344。10.1002 / bit.10853。
张伟,赵海林,薛晨,熊小华,姚小强:异源蛋白在植物体内的分泌增强Pichiapastoris酿酒酵母伴侣蛋白的过度表达。Biotechnol掠夺2006年,22:1090 - 1095。
Kato T, Murata T, Usui T, Park EY:基于分子伴侣辅助的昆虫细胞表达系统生产gfpuv - β - 1- n -乙酰氨基葡萄糖转移酶2融合蛋白的改进。生物工程学报,2005,29(4):424-433。10.1002 / bit.20362。
岩田英,小泉宁:安拟南芥转录因子Atb-ZIP60以植物特有的方式调节内质网胁迫反应。美国国家科学促进会2005年,102:5280 - 5285。
李建平,李建平,李建平,等。拟南芥bZIP60是一种参与内质网应激反应的蛋白水解激活转录因子。植物细胞2008年,20:3107 - 3121。
Iwata Y, Yoneda M, Yanagawa Y, Koizumi N:核形式的特征拟南芥转录因子AtbZIP60在内质网应激反应中的作用。生物科学,生物技术,生物化学2009年,23:865 - 869。
Buzeli RA, Cascardo JC, Rodrigues LA, Andrade MO, Almeida RS: BiP基因的组织特异性调控:植物分生组织中BiP启动子活性需要一个顺式调控域。植物学报,2002,35(5):757-771。10.1023 /: 1019994721545。
卢世杰,权春春,吴德华,文景生,钟伟:拟南芥非折叠蛋白响应中BiP基因的表达。生物医学工程学报,2003,31(1):81-91。10.1016 / s0378 - 1119(03) 00559 - 6。
Yoshida H, Matsui T, Yamamoto A, Okada T, Mori K: XBP1 mRNA受ATF6诱导并被IRE1剪接,以响应内质网应激产生高活性转录因子。细胞学报,2001,31(2):881-891。10.1016 / s0092 - 8674(01) 00611 - 0。
张永华,张永华,张永华,张永华,Ron D:未折叠蛋白反应中BiP和内质网应激转导的动态相互作用。中国生物医学工程学报,2009,32(2):326-331。10.1038 / 35014014。
李建军,李建军,李建军,李建军。酵母内质网感知分子Ire1p的研究进展。生物化学学报,2000,29(2):445- 445。10.1006 / bbrc.2000.3987。
黄志强,王志强,王志强,等。CHOP/GADD153在内质网应激中的作用。细胞凋亡与细胞死亡。2004,11:381-389。10.1038 / sj.cdd.4401373。
刘明,张建军,张建军,Ramos-Castañeda .内质网应激反应激酶(erk)对细胞存活的影响。生物化学学报,2008,28(3):1720 - 1729。10.1074 / jbc.M802466200。
Anderson JV,李强,Haskell DW, Guy CL .:菠菜内质网-管腔70-千兆隆热激同源基因在冷驯化过程中的表达。植物生理学报,1994,25(4):559 - 567。10.1104 / pp.104.4.1359。
Guy C, Haskell D, Li Q .低温胁迫下70个分子伴侣蛋白与菠菜冷不稳定蛋白的关系。中国生物医学工程学报,1998,36(3):391 - 391。10.1006 / cryo.1998.2089。
王志强,王志强,王志强,等。杨树木质部汁液中贮藏蛋白的研究进展[J] .植物生理学报,2003,19(3):726 - 726。
杨德昌,杨立军,王文华,王立军。冬麦叶片抗冻蛋白的内源研究。植物生理学报,2002,26(2):593-596。10.1104 / pp.100.2.593。
Hurkman WJ, DuPont FM, Tanaka CK, Chan R:小麦胚乳的BiP、HSP70、NDK和PDI。2高温对蛋白质和mRNA积累的影响。植物生理学报,2002,30(3):80-90。10.1034 / j.1399-3054.1998.1030110.x。
Martinez IM, Chrispeels MJ:未折叠蛋白反应的基因组分析拟南芥显示了它与重要细胞过程的联系。植物细胞2003年,15:561 - 576。
Malhotra JD, Kaufman RJ:内质网和未折叠蛋白反应。中国生物医学工程学报,2007,18(2):516 - 531。10.1016 / j.semcdb.2007.09.003。
李小红,王凯,王世林,高丽丽,严艳梅:小麦lmw -m型基因的分子特征及比较转录分析(英文)小麦l .)和山羊草属物种.理论苹果基因2010年,121:845 - 856。
闫燕,胡世凯,于建忠,姜勇,Zeller FJ:小麦HMW谷蛋白亚基的等位基因变异山羊草属tauschii采用十二烷基硫酸钠(SDS-PAGE)、酸性聚丙烯酰胺凝胶(A-PAGE)和毛细管电泳检测。Euphytica12003年,30:377 - 385。
Paolacci AR, Tanzarella OA, Porceddu E, Ciaffi M:小麦定量RT-PCR标准化内参基因的鉴定与验证。中国生物医学工程学报,2009,32(1):1- 6。
Livak KJ, Schmittgen TD:利用实时荧光定量PCR分析相关基因表达数据−ΔΔCT.方法2001年,25:402 - 408。
致谢
国家自然科学基金项目(31271703,31101145)、北京市自然科学基金及北京市教委科技重点发展项目(6122002,KZ201410028031)、中国科技部中澳合作项目(2013DFG30530)资助。克隆的TaBiP序列沉积在NCBI中。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者声明他们没有利益冲突。
作者的贡献
JZ, PH和GC进行了所有实验和数据分析。CH进行了HMW-GS和生物信息学分析。ZFJ和HSLK协助撰写英文并校对稿件。XL, YH, YY构思研究,计划实验,并帮助起草手稿。所有作者都阅读并批准了最终的手稿。
电子补充资料
12870 _2014_260_moesm1_esm.pdf
附加文件1:用于实时定量RT-PCR (qRT-PCR)的部分全长cDNA、RACE、完整cDNA和全DNA序列的克隆引物和产物。(pdf 205kb)
12870 _2014_260_moesm4_esm.doc
附加文件4:利用42个BiP氨基酸序列构建了无根系统发育树,分析不同物种间的进化关系。(doc 73kb)
12870 _2014_260_moesm5_esm.pdf
附加文件5:qRT-PCR优化设计:TaBiP在小麦组织、种子发育和胁迫条件下的双标准曲线和溶出曲线。(pdf 2mb)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。
本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。
如欲查阅本许可证副本,请浏览https://creativecommons.org/licenses/by/4.0/.
创作共用公共领域免责声明(https://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
朱军,郝鹏,陈国强。et al。内质网分子伴侣的克隆、系统发育分析及表达谱分析毕普面包小麦(小麦l .)。BMC Plant Biol14,260(2014)。https://doi.org/10.1186/s12870-014-0260-0
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-014-0260-0
关键字
- 小麦
- 毕普
- 克隆
- 表达式
- HMW-GS沉默
- 干旱胁迫