摘要
背景
如今,生物技术面临的挑战是为农业和工业开发工具,以提供具有生产力和质量特征的植物,以满足对不同种类自然产物日益增长的需求。为了应对这一挑战,转基因植物的产生和应用是合理的。然而,由于社会对转基因生物的强烈抵制和欧洲联盟国家的限制性规定,必须开发一种新的植物类型生成技术,这种技术利用从分析转基因植物得到的知识来生成有利的转基因植物,同时省去向其基因组引入异源基因。四年的实验导致了一项技术的发展,诱导遗传表观遗传基因激活不转基因。
结果
该方法包括通过对编码区使用反义短寡核苷酸对植物进行处理,诱导内源基因的甲基化/去甲基化变化。在体外过度生产β-1,3-葡聚糖酶基因(EMO-βGlu flax)的培养植株和F3代亚麻植株,其特征是β-葡聚糖酶和几丁质酶基因上调,β-葡聚糖酶基因CCGG序列甲基化和DNA总甲基化降低,更重要的是对该基因产生了合理的抗性镰刀菌素感染。此外,该技术获得的EMO-βGlu亚麻与基因工程获得的EMO-βGlu亚麻具有相似的特性。
结论
据我们所知,这是第一个用与基因编码区同源的寡核苷酸处理植物基因激活的报道。除了明显的有效性外,最重要的问题是EMO方法允许产生有利的转基因植物,其培育使植物生产者独立于获取转基因生物释放到环境的协议的复杂程序,其产品可能更容易引入全球市场。
背景
亚麻(亚麻属植物usitatissimum)已经在人类社会中扮演了重要的角色。这个有双重用途的工厂是纺织用纤维和化工用石油的来源。基因组和生物学数据的大量增加有助于研究人员和育种人员利用生物技术方法提高亚麻产品的生产力和质量。例如,通过基因下调降低木质素含量,可改善亚麻纤维品质[1] - [3.].经基因工程与聚羟基丁酸酯改性的亚麻纤维用于生物医学产品的复合材料,如植入物和伤口敷料[4].亚麻中各种苯丙类化合物的过度生产为下列有前途的产品提供了原料:具有“理想特性”的油可作为预防动脉粥样硬化的膳食补充剂,作为“替代抗生素”的籽饼提取物可有效地保护抗菌,纤维成功地用于治疗慢性溃疡,微化短纤维似乎适合作为活性物质(药物、维生素、激素)的载体和稳定剂[5] - [7].此外,在所有这些情况下,提高了植物的抵抗力镰刀菌素已检测到[8].
亚麻的有益特性为恢复其大规模栽培提供了有力的依据。为了加快对栽培这种作物的兴趣,应该考虑不断关注种子的质量,特别是不断寻找提高亚麻抗性的方法。据估计,约20%的亚麻作物产量损失是由真菌引起的。由它们引起的疾病导致作物产量、种子和纤维质量下降,从而降低从作物中获得的产品,如食品、纺织品和动物饲料的质量。亚麻最危险的病原体有:尖孢镰刀菌,渗透到亚麻细胞根部,通过维管系统扩散到整个植株,导致根腐病和叶片枯萎镰刀菌素culmorum,导致嫩枝基部腐烂,导致植物逐渐坏死,从而导致植物死亡[9]、[10].
植物对病原体感染的反应可能是局部的或全身性的。病原体攻击的第一反应是过敏反应。它表现为感染部位周围细胞的局部坏死,常常引起植物代谢的改变,从而产生诱导系统免疫的驱动机制代谢物。免疫系统分为两种主要类型:系统性获得性抗性(SAR)和诱导性系统性抗性(ISR) [11].
在系统性获得性反应(SAR)中,包括感染部位周围的组织,导致植物对病原体可能的后续攻击的抗性水平上升,致病相关蛋白(PR)参与其中。它们具有抗真菌特性,与几丁质(PR-3、PR-8、PR-11)和β-葡聚糖(PR-2)的酶解有关,导致病原体细胞壁的削弱和破坏[12]、[13].β-1,3-葡聚糖酶和几丁质酶至少以两种不同的方式起作用:直接通过降解病原体的细胞壁,间接通过促进细胞壁衍生物质的释放,这些物质可以作为防御反应的激发子,刺激其他PR蛋白和低分子量抗真菌化合物的产生,如植物抗菌素[14]、[15].PR蛋白在植物中的表达与它们对感染的抵抗力之间存在相关性,例如在番茄中对感染具有抵抗力链格孢属以上[16或在马铃薯中产生抗性5种[17].
目前,为了提高植物对病原性侵染的抵抗力,基因工程是生产转基因生物最常用的工具。由于有针对性的行动,这是最有效的方法。抗致病特性的增强可能是通过编码致病相关蛋白和参与次生代谢物合成的基因的过表达实现的[18] - [24].
近年来,这项新技术已被应用于植物基因功能的研究。该技术的基础是用高浓度的短(18-25个核苷酸)、与目标基因同源的单链DNA片段进行植物处理。这是一种基因修饰的非载体技术(OLIGO),因此它被广泛应用于哺乳动物细胞的研究中,例如,在癌症治疗中沉默单个基因[25].该技术首次应用于植物细胞,诱导转录因子SUSIBA2基因的表达变化。26].OLIGO技术可能会取代载体介导转化(RNAi技术),因为两者都能以相同的效率沉默基因,并产生相似的表型效应[27].OLIGOs被引入植物细胞后,可以与转录本中的同源序列结合,从而激活RNA依赖的RNA聚合酶(RdRP), RdRP合成第二条链,形成双链RNA (dsRNA)。该片段可下调通过RNA干扰(RNAi)机制作用的基因[28].
最近有研究表明,小的外源DNA片段如果定位于调控序列,也可能激活同源基因。到目前为止,这种被称为RNA激活(rnana)的新机制只存在于哺乳动物细胞中。该rna机制似乎依赖于Argonaute 2,并与dsrna靶位点上的组蛋白变化(组蛋白3上赖氨酸-9甲基化的丢失)有关[29]、[30.].与RNAi机制相比,RNAi机制的作用在时间上发生了偏移(约24-48小时),表明两种反应的动力学不同。然而,在植物中,这种机制似乎是基于DNA甲基化,而不是组蛋白修饰。此外,已有研究表明,由rna机制引起的变化可以在诱导表观遗传变化后遗传[31].
人们一致认为表观遗传变化的分子背景是DNA甲基化,同样,基因组的高甲基化和低甲基化也经常被观察到,而诱导因素的性质是什么并不重要[32].基因甲基化的改变似乎是植物对胁迫条件反应的主要表观遗传机制之一,或者是外来DNA进入基因组的主要表观遗传机制。由RNA依赖的RNA聚合酶的活性或与聚合酶V的复合体中植物聚合酶IV的活性形成的双链RNA片段可能会募集能够进行DNA甲基化的甲基转移酶,从而修饰基因表达[33].短双链DNA片段影响同源基因调控片段和/或编码部分的甲基化程度,从而改变其表达水平。该过程由一种依赖rna的DNA甲基化酶(RdDM)介导,可导致基因活性的激活或抑制[34].
近年来,为了提高亚麻对病原菌侵染的抗性,我们培育了一株过表达β-1,3-葡聚糖酶的转基因植株。由此产生的转基因亚麻(称为B型)的特征是对尖孢镰刀菌而且镰刀菌素culmorum感染。在体外-培养的植物碳水化合物、脂肪酸和有机酸的含量显著下降,而选择性氨基酸、多胺和抗氧化剂的含量却增加了[21].本研究以转基因B型亚麻为参考植物,以诱导内源β-1,3-葡聚糖酶基因的非转基因新亚麻为研究对象。
本研究的目的是开发一种基于核酸表观遗传调控的新型亚麻无创性育种技术。特别地,主要目标是生产一种新的,基因稳定的亚麻,增加内源性基因编码β-1,3-葡聚糖酶的表达,从而提高亚麻的抗病性尖孢镰刀菌而且镰刀菌素culmorum感染。
结果
PR基因与PME1的表达分析
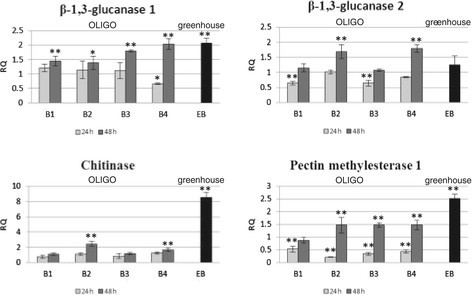
所选PR蛋白(β-1,3-葡聚糖酶的两种亚型和几丁质酶的一种亚型)和果胶甲基酯酶1 (PME1)的mRNA水平在经OLIGOs处理的亚麻和标记为EMO-βGlu的F3代中测定。PME1是参与植物对胁迫反应的另一种蛋白。得到的结果如图所示1.
对β-1,3-葡聚糖酶的分析显示,在接触OLIGOs 48小时后,经4种OLIGOs处理的亚麻中,第一种亚型的表达增强(B4的表达增加了2倍),而经OLIGOs B2和B4处理的亚麻中第二种亚型的表达增加(分别增加了1.7倍和1.8倍)。此外,OLIGOs B1和B3在24小时降低β-1,3-葡聚糖酶第二亚型的mRNA水平(降低65%),但在48小时不影响其表达。
同时,还检测了另外两个通常对环境胁迫有反应的基因几丁质酶和果胶甲基酯酶1的激活情况。与对照相比,处理过OLIGOs的亚麻在24小时后果胶甲基酯酶1基因的mRNA水平下降(B1、B2、B3和B4分别为53%、22%、35%和44%),而在48小时时,OLIGOs B2、B3和B4的mRNA表达量增加了1.5倍。编码几丁质酶的基因在48小时后被B2(2.45倍)和B4(1.7倍)激活。
与处理过OLIGOs的亚麻类似,F3代植株中β-1,3-葡聚糖酶、几丁质酶和果胶甲基酯酶1的第一亚型基因表达量显著高于对照。在EMO-βGlu植株中,β-1,3-葡聚糖酶、几丁质酶和PME1的转录水平分别高出2倍、8.5倍和2.5倍。SAR相关PR基因表达的变化与植物对病原菌侵染抗性的增强有关。
有硬块的内容
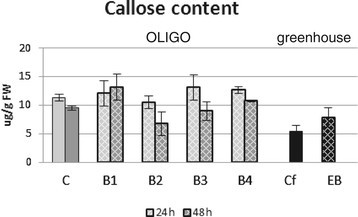
β-葡聚糖酶基因活性的诱导不反映在以胼胝质的含量测定的各自酶活性中。数字2结果表明,亚麻中胼胝质的含量仅在两种OLIGOs B2和B3处理后有所下降,但变化不具有统计学意义。在其余的样品中,胼胝质的水平与对照组相似。
相比之下,EMO-βGlu植株的胼胝质含量增加了1.5倍。F3代植株中胼胝质含量的增加可能是由于控制胼胝质合成过程的一种基因的表达增加所致1:图S2P),检测到CALS2基因表达量增加1.6倍。
β-1,3-葡聚糖酶基因的DNA甲基化模式
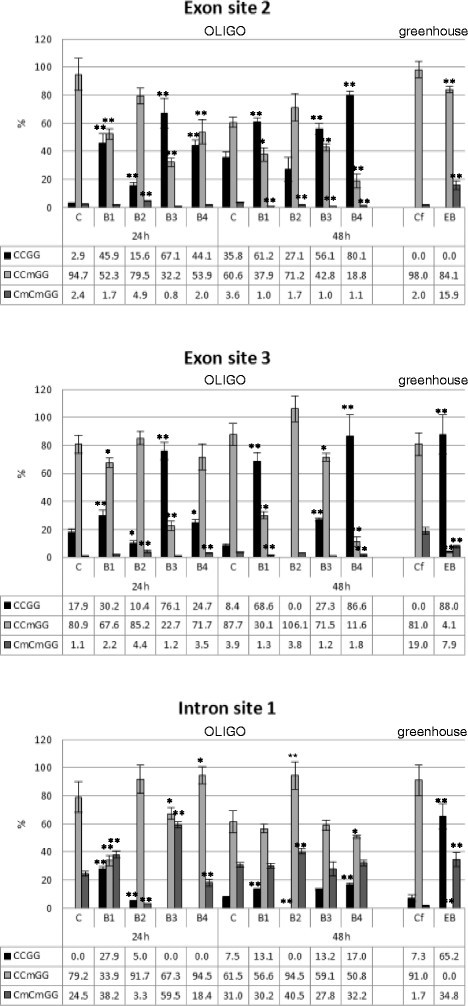
对经OLIGOs处理的亚麻和EMO-βGlu植株中β-1,3-葡聚糖酶基因在3个启动子位点、3个外显子位点和1个内含子位点的DNA甲基化进行了测定。
对经OLIGOs处理的亚麻和EMO-βGlu植物β-1,3-葡聚糖酶基因DNA甲基化的研究结果显示,所有检查位点的甲基化情况相似。3个被分析的启动子位点和外显子中的1个位点保持不变2:图S1)。然而,在大多数情况下,CCGG序列外显子的第二个和第三个位点在胞嘧啶内部去甲基化。此外,在OLIGOs处理过的植物中,内含子的第一个分析位点被去甲基化(图3.).OLIGOs B1、B3和B4处理后的24小时或48小时内,第二外显子位点的去甲基化在特定植物间没有明显变化。然而,在B2处理后的24小时和48小时,观察到CCGG序列内部胞嘧啶的去甲基化有较小的变化和缺乏变化。在β-1,3-葡聚糖酶的第三外显子位点,OLIGO B3处理的亚麻24小时后去甲基化程度最高,B1和B4处理的亚麻48小时后去甲基化程度最高。在内含子中观察到DNA甲基化的有趣变化,24小时后,只有OLIGO B1导致胞嘧啶甲基化水平降低。此外,在OLIGOs处理植物48小时后,B1、B3和B4有类似的甲基化模式,13-17%的CCGG位点没有甲基化。
与暴露于OLIGOs后的植株类似,被称为EMO-βGlu的F3代植株在外显子第3位和内含子第1位的去甲基化水平增加。然而,在这些植物中观察到外显子第二个位点的甲基化。同样,其他潜在的甲基化位点(启动子上的三个位点和外显子上的一个位点)没有改变(附加文件)2:图S1)。
OLIGO机制相关基因表达分析
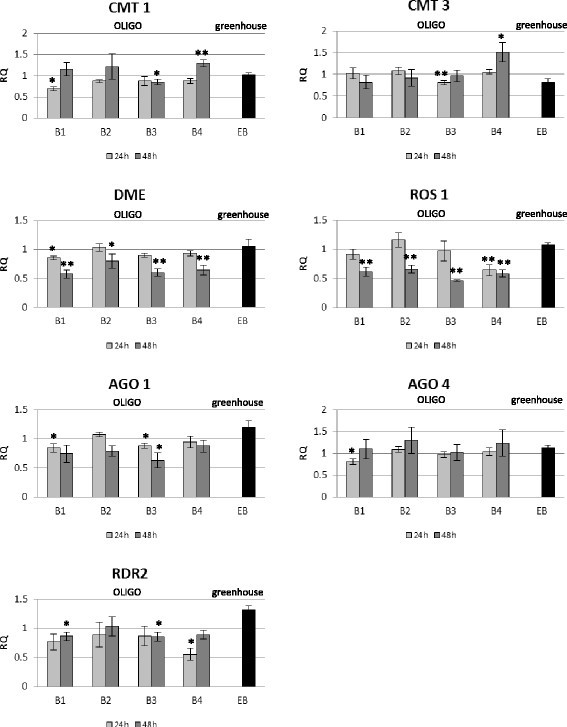
为了解释OLIGO作用的可能机制,我们研究了参与RNAi和rna机制的基因——RNA依赖的RNA聚合酶AGO1和AGO4的表达水平。假设这些变化也可能涉及到甲基化酶/去甲基化酶基因,我们测量了编码甲基化酶(CMT1、CMT3)和去甲基化酶(ROS1、DME)的基因表达水平(图)4).
OLIGO机制相关基因的表达水平。的mRNA水平CMT1 (chromomethylase 1), CMT3 (chromomethylase 3),测距装置(得墨忒耳),ROS1(沉默抑制因子1),AGO1 (Argonaute 1), AGO4 (Argonaute 4), RDR2 (RNA-depended RNA聚合酶2)在亚麻对待寡核苷酸(B1、B2、B3和B4)在24 h(浅灰色酒吧)和接触后48 h(深灰色酒吧)寡核苷酸与控制相比,摘要亚麻和EMO -βGlu亚麻(EB)(黑条)相比,控制亚麻从实时rt - pcr分析获得。以Actin作为内参基因,将转录水平归一化到对照植株(C = 1;图中未显示)。数据表示三个独立实验的平均值±标准差。采用Student’s t检验(*P < 0.05, **P < 0.01)确定均数之间差异的显著性。RQ -相对量。
暴露于OLIGOs 24小时后的亚麻植株的特征是测试基因的表达有微小变化。OLIGO 1 (B1)诱导CMT1基因(70%)、DME基因(85%)、AGO1(85%)和AGO4(76%)的转录水平下降。此外,OLIGO 3 (B3)导致CMT1基因(84%)、CMT3(80%)和AGO1(87%)的表达下降,而OLIGO 2和OLIGO 4对研究基因的表达水平无影响。
暴露于OLIGO 4 48小时后,亚麻植株的CMT1基因和CMT3基因的表达量分别增加了1.3倍和1.5倍。在所有OLIGOs的作用下,两种去甲基化酶(DME和ROS1)的mRNA水平均降低到80-50%。此外,RDR2基因表达在经OLIGOs处理的亚麻中仅发生轻微变化(尤其是B1和B3)。
在F3代EMO-βGlu亚麻植株中,甲基化酶和去甲基化酶的表达量与对照相似。仅观察到AGO1和RDR2基因的mRNA水平略有升高。
DNA甲基化的总水平
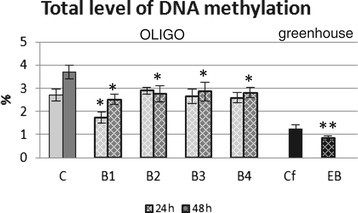
由于亚麻暴露于寡核苷酸的结果,基因组DNA甲基化的总水平的变化被观察到,并显示在图中5.24小时后,只有B1寡核苷酸导致DNA甲基化水平下降(35%),而48小时后所有使用的寡核苷酸都影响基因组DNA的甲基化状态(下降25%)。
此外,还测定了EMO-βGlu植物的DNA甲基化总水平(图5),且EMO-βGlu植株较对照植株低。这种变化,根据表观遗传学的原理,可能会引起基因的激活。
mRNA和OLIGOs的二级结构及OLIGOs二级结构与β-1,3-葡聚糖酶基因表达水平的相关性
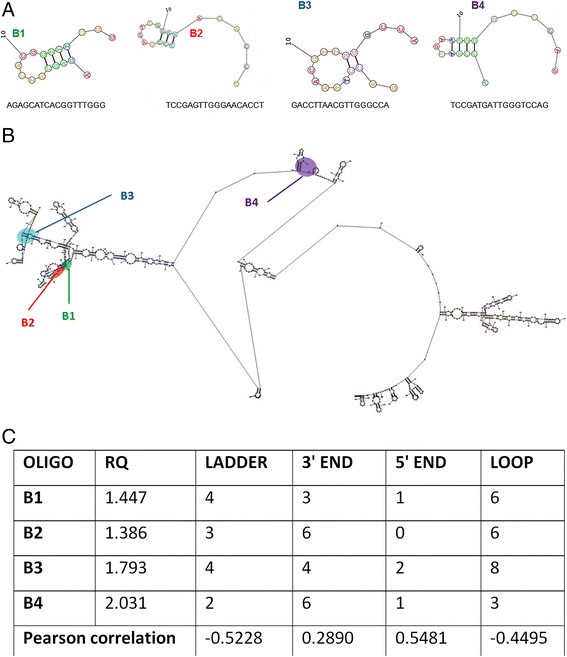
在设计和测试的几个oligo中,选择了四个对基因(β-葡聚糖酶)激活最有效的oligo进行进一步分析。所选OLIGOs (B1, B2, B3和B4)的核苷酸序列及其预测的二级结构如图所示6A. β-1,3-葡聚糖酶基因mRNA和OLIGO结合位点的二级结构如图所示6B。
oligo (B1, B2, B3和B4)和mRNA的二级结构都具有很大的多样性,主要有三种类型:茎(成对的双链片段)、单链环和长度可变的单链链。与mRNA序列互补的OLIGO相互位置非常接近(B1和B2),彼此平均距离(B3)和非常远(B4)。
所得数据用于计算确定的参数,如次级OLIGOs/mRNA结构和甲基化模式与β-1,3-葡聚糖酶基因表达的相关性。在OLIGOs的单链5'端长度和成对序列片段长度之间观察到最高水平的相关性(图6C).因此,OLIGO的二级结构对于其对同源序列和内源基因活性的影响非常重要。最重要的信息是从OLIGOs影响下内源基因的甲基化谱分析中获得的。然而在所有启动子甲基化位点,在内含子位点和第一外显子位点,甲基化模式的改变是不存在的,在大多数情况下外显子的第三位点在OLIGOs处理的植物中去甲基化。因此,这可能表明OLIGO处理后β-葡聚糖酶基因激活可能是由于基因编码区去甲基化。
EMO-βGlu植株对镰刀菌侵染的抗性
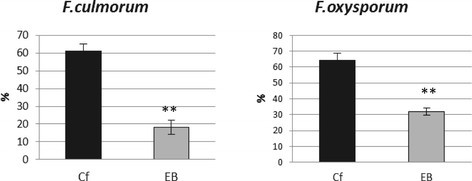
激活对亚麻感染反应的基因的结果是增加植物对感染的抗性镰刀菌素culmorum而且尖孢镰刀菌如图所示7.试验结果表明,亚麻EMO-βGlu的抗病性提高了3倍以上f . culmorum感染和两次以上来了F.oxysporum感染观察。EMO-βGlu植株的抗性甚至高于转基因b型植株[21].
EMO-βGlu植物细胞壁主要聚合物的分析
植物防御病原体感染的重要成分是细胞壁聚合物。我们评估了参与果胶合成和降解的基因表达(A和B),果胶水平(C和D),参与半纤维素合成和降解的基因表达(E和F),半纤维素水平(G和H),纤维素代谢基因(I),木质素基因(K)和这些聚合物水平(J和L),参与多胺合成和降解的基因mRNA水平(M和N),在EMO-βGlu植物中,这些化合物(O)的水平和胼胝质的合成基因(P)的表达1:图S2A-P)。绝大多数与果胶、半纤维素、木质素和纤维素代谢相关的基因在EMO-βGlu植物中被激活,而其活性的代谢产物仅在特定情况下反映了这些激活。
观察到果胶糖和半纤维素糖的总水平有轻微的变化(NSF和K1SF组分略有增加);然而,两种聚合物的个别组分的糖醛酸含量发生了显著变化。因此,果胶和半纤维素聚合物的重组而不是其数量的变化是对β-葡聚糖酶基因活性和这些聚合物代谢基因活性变化的响应。同样,EMO-β glu植株的木质素水平变化不显著,尽管某些基因(如SAD -芥子醇脱氢酶)的激活超过3倍。测量到的最大变化是纤维素水平,这对应于这种聚合物代谢基因表达的增加(高达1.6倍的CSL1;纤维素合成酶1和高达1.7倍的CSL4;EMO-βGlu植物中的纤维素合成酶4)。此外,多胺水平升高(2倍);然而,这种变化与多胺代谢基因的表达并不容易相关。
讨论
转基因技术是现代植物生物技术中用于科学和商业目的的转基因生物的最被开发的方法。然而,根据欧洲晴雨表的调查,超过60%的社会(根据国家的不同,61-90%)不接受转基因,这就锁住了转基因植物和产品商业化的大门。此外,转基因技术费时费力。因此,新生物技术面临的挑战是开发一种调节而不是修饰基因组的方法,这与农业转化的效果相似。
这项工作中利用的基因组无创调制新技术是基于诱导DNA修饰的。由于新技术不使用非线性的核苷酸序列,而且将它们引入植物的方式是维管系统,因此可以认为该技术是自然的,因此不涉及基因修饰。获得的过度生产β-葡聚糖酶的植物被定义为表观遗传修饰生物(EMO),它们被视为转基因生物的替代品。
β-葡聚糖酶基因在亚麻抵抗病原感染方面的根本重要性是通过对先前生成的过表达外源(马铃薯)β-葡聚糖酶基因的转基因植物的深入研究而确定的[21].这些植物的主要特征是碳水化合物、酚和多胺含量的变化。有趣的发现是,尽管转基因(β-葡聚糖酶)高表达,但修饰后的亚麻内源性几丁质酶基因大幅增加。有几篇报道描述了通过β-葡聚糖酶或几丁质酶或两者同时过表达诱导植物对病原体感染的抗性[35]、[36].然而,这些研究都没有报道转基因内源性基因交叉激活。我们推测过度生产时释放的酶(来自β-葡聚糖酶转基因)影响细胞壁化合物并诱导内源性对应物。事实上,β-葡聚糖酶的产物可能是激活植物代谢的激发子。例如,线性β-1,3葡聚糖是烟草中防御反应的激发子,它激活苯丙氨酸解氨酶、咖啡酸o -甲基转移酶和脂氧合酶[37].
增加了植物的抵抗力镰刀菌素与此同时,亚麻代谢发生了良好的变化,这是发展表观遗传改良植物,从而增强亚麻市场潜力的充分原因。
多年来,人们成功地利用了哺乳动物细胞的表观遗传修饰。虽然成功了,但这种基因活性调节新技术背后的分子机制还没有被完全理解。考虑到已经发表的数据,我们假设这些机制可能包括被称为RNA干扰(RNAi)的基因沉默或通过mRNA生物合成(RNAa)激活的基因,或通过胞嘧啶和/或组蛋白的DNA甲基化修饰的基因表达。
就植物而言,只有少数报道证实了寡核苷酸(OLIGOs)对同源植物基因的下调作用。例如,反义OLIGOs被用来降低烟草中核编码的植物烯去饱和酶、小麦中叶绿素a/b结合基因、小麦中叶绿体编码的psbA基因的表达拟南芥[38, SUSIBA2,一种转录因子,在糖处理大麦中[26和烟草中的GNOM LIKE 1基因[27].在所有这些情况下,植物处理导致基因下调,可能是通过RNAi机制。然而,与哺乳动物细胞相比,尚未有关于OLIGOs在植物细胞中上调调控作用的报道。
为了利用这项新技术对亚麻进行改良,研究人员研究了70多个不同的oligo(18个核苷酸长)对来自亚麻萜类途径的同源基因的影响。一项对来自该通路的9个不同基因的研究显示,其中40%的基因下调,46%的基因不受影响,最重要的是,14%的基因上调(数据尚未发表)。
因此,我们利用β-葡聚糖酶基因中不同区域的同源OLIGOs对亚麻植株进行处理。其中有4株表现出内源基因激活,并进一步对这种激活方式的植物进行了分析。在体外培养的植物β-葡聚糖酶基因表达增加,并伴有CCGG序列的去甲基化。这与基因去甲基化导致其更高活性的普遍观点是一致的[39] - [41].通过对培养植物的详细分析,我们可以发现几丁质酶、果胶甲基酯酶1和细胞壁代谢相关基因活性的变化。这种全球代谢变化的原因尚不清楚。我们推测,β-葡聚糖酶的过度生产可能导致诱导子的积累,通过例如基因组去甲基化来诱导植物代谢。确实,检测到基因组DNA的部分去甲基化,这支持了这种猜测。参与DNA甲基化过程的基因表达分析也部分反映了DNA甲基化水平的降低。例如,去甲基化酶基因(DME, ROS1)在所有情况下都被强烈下调。然而,在大多数情况下,甲基化酶基因也被下调。也许最终的DNA甲基化状态是由甲基化酶和去甲基化酶基因之间的相互作用调节的。
虽然OLIGOs处理植物背后的分子机制还不完全清楚,但从这篇报道中可以清楚地看到,它们可能会激活同源基因的表达,这一事件伴随着基因去甲基化。一些报告证实了这一点,结论是基因受甲基化/去甲基化状态的调节[42] - [44].
利用EMO技术进行作物植物基因调控的重要性可能受到植物世代稳定性的限制。为了研究OLIGOs诱导的第三代(F3)植株EMO-βGlu的稳定性。与F0代和参考转基因b型植株相似,EMO-βGlu型F3植株的特征是β-葡聚糖酶和几丁质酶基因上调和去甲基化β-葡聚糖酶基因中的CCGG序列。随着总DNA甲基化的减少,植物的初级和次生代谢也发生了变化。该过程涉及甲基化酶(CMT3 -下调)和去甲基化酶(ROS1, DME -上调)基因表达的改变。基因体甲基化对基因表达的重要性仍不清楚,但在大多数情况下,高表达的基因具有低水平的甲基化。由于OLIGO处理改变了几种不同类型的基因表达,其背后的机制可能是一般性质的。因此,推测OLIGO处理诱导基因组重排并减少总DNA甲基化,48 h的植物暴露足以做到这一点并保持这种重排遗传。也许基因组重排的直接信号来自于激活的β-葡聚糖酶基因的作用,从而产生激发子。EMO-βGlu和参考的GM亚麻的分子特征非常相似,这一观点得到了支持。
许多文献报告描述了暴露于物理和化学处理导致的基因甲基化模式的变化。例如,拟南芥受低温胁迫的植物[45显示了这些植物基因组DNA甲基化的广泛变化。用茉莉酸(JA)和水杨酸(SA)处理植物可以诱导基因组DNA甲基化的表观遗传变化。一个实验蒲公英officinale不仅显示了广泛的甲基化,而且JA和SA诱导的甲基化水平的74% - 92%的变化在下一代中保留了下来[46].
OLIGOs处理后亚麻基因表达和代谢变化对植物抗性的重要性镰刀菌素感染调查。随着聚合物(木质素、纤维素)和多胺的积累,PR2 (β-葡聚糖酶和几丁质酶)家族基因表达增加,这可能是其背后的分子背景。众所周知,这两种酶都参与了植物对病原体感染的反应。细胞壁聚合物在细胞保护中也很活跃,多胺是这种反应的信号分子。
由于EMO-βGlu植株在β-葡聚糖酶的表达变化和β-葡聚糖酶基因甲基化谱上与处理过的植株相似,最重要的是在抗感染能力上与稳定的转基因b型植株相似,因此可能提示OLIGOs引起的变化是遗传的。因此,这种新型植物被称为EMO-βGlu(来自β-葡聚糖酶表观遗传修饰生物),是一种很好的替代转基因植物。
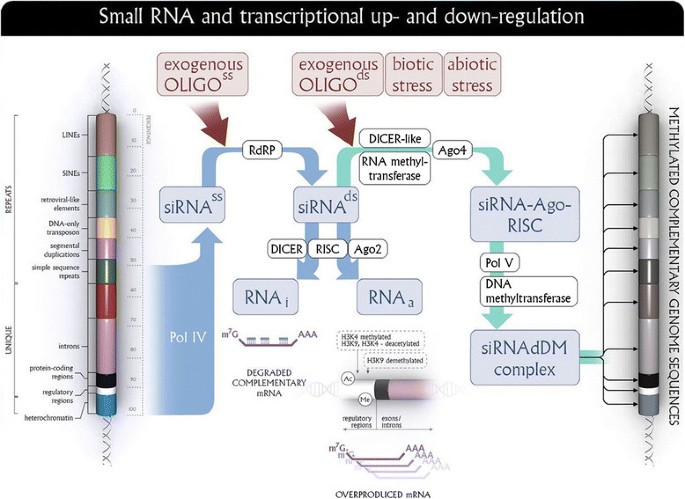
EMO技术是基于利用短寡核苷酸片段(OLIGOs)以非侵入性的方式引入植物。使用短的单链DNA片段可以改变同源基因的表达。该技术的效率取决于所用OLIGO的二级结构。OLIGOs的单链5'端长度和成对序列片段长度与β-1,3-葡聚糖酶基因表达的相关性最高。该技术不需要使用载体,由与被调控基因的编码和/或调节序列互补的义或反义定向的12- 21nt单链DNA短序列(oligo)通过营养物质(蔗糖)的渗透或吸收组成。假设随后产生的(内源性)双工RNAi和/或rna和/或siRNAdDM(与甲基转移酶相关的RNAi)作为各自内源性、依赖于ago的酶(RNA依赖的RNA聚合酶、DICER和RISC复合体、DNA甲基转移酶)活性的产物成为基因表达调控的信号。这些机制包括被称为RNA干扰(RNAi)的基因沉默和/或通过mRNA生物合成(rna)激活的基因和/或通过胞嘧啶的DNA甲基化修饰的基因表达。所有三种潜在机制如图所示8.到目前为止,对RNAi机制的研究最为深入,其余两种机制有待进一步研究。
寡核苷酸对同源mRNA代谢或同源DNA调节的影响。当一个短的(18-25个核苷酸)单链DNA片段被引入植物细胞时,可能会与转录本中的同源序列结合,从而激活RNA依赖的RNA聚合酶(RdRP)。RdRP合成第二条链,产生双链RNA (dsRNA),其存在使RISC和DICER复合体以及Argonaute (AGO)蛋白质起作用。dsRNA片段可以通过RNA干扰(RNA interference, RNAi)机制下调该基因,也可以通过RNA激活(RNA activation, RNAa)机制激活靶基因。此外,dsRNA的存在也会引起同源DNA片段的RNA依赖性甲基化。参与这一过程的有AGO蛋白、DNA甲基转移酶、去甲基化酶,以及只存在于植物中的聚合酶IV和V。
结论
总之,积累的数据表明,OLIGO技术相对来说非常简单和有效,足以实现改进的亚麻,在首选方向上进行修改,至少在第三代稳定。非转基因植株与参考转基因植株表现出相同的性状。这为基于核酸表观遗传调控的作物植株改良提供了一种新的工具。
本文作者指出,EMO-βGlu亚麻种子可根据科研需要提供。
方法
植物材料
亚麻籽(亚麻属植物usitatissimumL,简历。耐克)从波兰天然纤维研究所的亚麻和大麻收藏处获得。种子在用0.8%琼脂固化并添加1%蔗糖的Murashige和Skoog培养基(Sigma-Aldrich)上萌发,光照16小时(21°C),黑暗8小时(16°C)培养皿中进行。
设计与不同基因部分互补的OLIGO
oligo是使用MFOLD软件(Genetics Computer Group, Madison)设计的,该软件提供了最佳的RNA结合位点,还考虑了二级结构折叠的可能性,这可能促进或阻碍与序列的结合。在设计OLIGO时,我们考虑了核苷酸组成、熔化温度和GC对的数量,这些因素对OLIGO退火到同源基因序列至关重要。
设计了4个反义取向OLIGOs (B1, B2, B3和B4),分别位于β-1,3-葡聚糖酶(Acc。不。JQ670874),与亚麻基因组β-1,3-葡聚糖酶其他亚型mRNA不互补。它们都具有以下物理常数的特征:长度- 18个核苷酸;C + g - 55.6%;Tm - 50.3°C。他们有以下序列和位置(从ATG序列开始):
B1 - 3'agagcatcacggtttggg 5 ';背景:220 - 237;信使rna: 129 - 146。
B2 - 3 ';背景:274 - 291;信使rna: 183 - 200。
B3 - 3'gaccttaacgttgggcca 5 ';DNA: 356-373: mRNA: 264-281。
B4 - 3tccgatgatgggtccag 5 ';背景:1501 - 1518;信使rna: 493 - 510。
在mRNA β-1,3-葡聚糖酶的结构中,B1和B2的序列位置非常接近,B3的序列靠近B1和B2, B4的序列与其他的序列距离非常远。oligo由Genomed S.A.(波兰)合成。
用OLIGO处理植物
为了将OLIGO引入亚麻中,将组织培养的4周龄植株转移到10 μM OLIGO水溶液中,然后在真空中浸润15分钟。大约20株植物用于每次寡核苷酸处理。接下来,将亚麻植株转移到MS培养基上,分别在24和48小时后收集每株植物的组织样本进行进一步分析。一周后,植株被转移到土壤中,在温室中生长直到成熟。收集的种子被标记为F1。
根据β-葡聚糖酶表达量对F0植株进行筛选。每个OLIGO处理中约有15株植株的β-葡聚糖酶基因表达量增加。对β-葡聚糖酶基因表达量最高的5株植物进行DNA甲基化和详细基因表达分析。从这些植物中收集种子,然后在温室中,在优化的生长条件下生长,直到获得成熟的F2代种子。F1代和F2代植株与F0代植株一样进行分析,以检查是否存在理想的性状(未显示),每一代后选择最佳品系进行进一步培养。从B4 OLIGO的F2代中筛选出β-葡聚糖酶基因表达量最高、稳定性最好的一株。该植物(F2代)的收获和收集的种子再次在温室中生长,并在整个工作过程中分析这些植物的绿色部分样品,称为EMO-βGlu (F3代)。
基因表达分析
采用real-time PCR方法检测基因mRNA水平。按照制造商的协议,使用Trizol方法(Invitrogen)分离总RNA。剩下的DNA通过DNase I (Invitrogen)处理去除。然后,利用高容量cDNA逆转录试剂盒(Applied Biosystems)将RNA作为cDNA合成的模板。
实时PCR反应使用应用生物系统StepOnePlus实时PCR系统上的DyNAmo SYBR Green qPCR试剂盒(Thermo Scientific)进行。反应条件是根据试剂盒制造商的说明设计的。设计引物,并在附加文件中给出引物序列3.S1:表。反应分3个重复进行。肌动蛋白基因作为内参基因。转录水平的变化是与内参基因的相对定量。
DNA总甲基化分析
按照制造商的协议,使用DNeasy Plant Mini Kit (QUIAGEN)进行基因组DNA分离。用1.0% (w/v)琼脂糖凝胶电泳法检测DNA完整性,用分光光度法测定DNA含量。
总DNA甲基化由MethylFlash™甲基化DNA定量试剂盒(Epigentek)测定,该试剂盒包括一套完整的优化缓冲液和试剂,用于在类似elisa的基于微板的格式中专门测量5-甲基胞嘧啶(5-mC)的水平,以比色法定量全球DNA甲基化(Varioscan Flash, Thermo Scientific)。
β-1,3-葡聚糖酶基因的DNA甲基化模式测定
为了确定DNA甲基化的模式,使用限制性内切酶MspI和HpaII(新英格兰Biolabs)。基因中潜在的DNA甲基化位点(CCGG岛)由来自新英格兰生物实验室网站的NEBcutter V2.0程序确定。利用Oligo 7软件,设计了几对引物,并在适当的实验前在梯度PCR程序中进行检查,以估计正确的退火温度。
DNA被限制性内切酶连夜消化,然后被用作PCR反应的模板。PCR产物电泳于1.0%琼脂糖凝胶与溴化乙锭,紫外光下观察。用Bio 1D程序对凝胶图像进行密度分析,测定PCR产物的水平。用密度分析来估计DNA甲基化的模式。甲基化启动子、外显子和内含子位点的模式根据公式计算:
在β-1,3-葡聚糖酶基因中分析了7个CCGG位点(3个位于启动子(P)和外显子(E), 1个位于内含子(I))。这些位点的特征是DNA中从ATG开始的以下位置:P1 -1204-1201;P2 1147 - 1144;P3 344 - 341;E1 + 440 - 443;E2 + 1479 - 1482;E3 + 1763 - 1766;I1 + 2341 - 2344。
有硬块的内容
采用Hirano描述的改进方法测定亚麻植物中胼胝质的含量。47].在之前的论文中有详细的描述[48].用100 mg新鲜植物组织进行分析。
细胞壁多糖的分离和分离
使用Manganaris描述的方法的改进版本来分离和分离细胞壁成分[49和维森特[50].在之前的论文中有详细的描述[48].用100 mg新鲜植物组织进行分析。
糖醛酸测定
采用联苯法测定果胶含量[51]在硫酸中水解多糖后[52].在之前的论文中有详细的描述[48].
总糖量的测定
多糖在硫酸中水解后,用苯基法测定特定组分的总糖含量。水解后取0.3 ml上清液,加入0.6 ml硫酸。摇匀样品,加入50 μl 5%苯酚水溶液,50℃孵育20 min,冷却后在480 nm处用分光光度计测定总糖量。校正曲线采用葡萄糖醛酸。
纤维素含量
纤维素含量是用蒽酮试剂比色法测定的,如Ververis [53].在之前的论文中有详细的描述[48].用100 mg新鲜植物组织进行分析。
木质素含量
采用改进乙酰溴法测定总木质素含量[54].在之前的论文中有详细的描述[48].用100 mg新鲜植物组织进行分析。
UPLC萃取分析多胺
多胺的分离和分馏采用Imai [55].用1 ml 4% (w/v)高氯酸(PCA)在4℃振荡提取100 mg亚麻粉末。离心后,将颗粒重悬在0.5 ml的4% PCA中,在0.5 ml的上清液中加入0.5 ml的6 N HCl,两种样品在110℃下水解20小时。在70℃下快速真空干燥后,将残渣重新溶解在0.5 ml的4% PCA中。随后,进行多胺丹基化:0.2 ml等分物加入0.2 ml饱和碳酸钠和0.4 ml丹基氯(5 mg/ml在丙酮中)。短暂旋涡后,混合物在60°C的黑暗环境中孵育1小时。通过加入0.2 ml 150 mg/ml的脯氨酸去除多余的丹酚试剂。丹基化多胺用0.5 ml甲苯提取,在快速真空浓缩器中干燥,再悬浮在0.2 ml乙腈中。
样品分析采用Waters Acquity UPLC系统,2996 PDA检测器安装在Acquity UPLC BEH C18, 2.1 - 50 mm, 1.7 μM色谱柱上。流动相为A =水,B =乙腈,在60% A/40% B条件下梯度流动1 min;至2.5 min,梯度至40% A/60% B;至4 min,梯度至25% A/75% B;至5.5 min,梯度至0% A/100% B;梯度至60% A/40% B,流速0.4 ml/min。峰积分在366 nm处完成。
用丹基化多胺标准物(腐胺、亚精胺、精胺)的混合物对结果进行标准化。多胺总量测定为游离多胺、共轭多胺和与细胞壁结合的多胺之和。
感染测试
以组织培养法培养的4周龄亚麻B4系F3代植株为材料,测定了植株对病原菌侵染的抗性。真菌在18℃的马铃薯-右旋海草(PDA)培养基上生长7天。将亚麻植株转移到固体培养基上镰刀菌素culmorum而且尖孢镰刀菌, 10 ~ 14 d后,测定感染的亚麻植株(根和下胚轴)数量,并以其占试验所用亚麻植株总数的百分比表示。大约18株亚麻(每盆6株)镰刀菌素并对对照组进行分析。实验重复了三次。
统计分析
所有的实验都独立重复了至少三次。结果以独立重复的平均值±标准差表示。使用Statistica 7软件(StatSoft, USA)进行统计分析。用Student’s t检验来确定平均数之间差异的显著性。每个实验分别给出P值(*P < 0.05, **P < 0.01)。
作者的贡献
WW进行了所有的实验和统计分析,并撰写了手稿。AK参与了手稿的撰写。AB从亚麻基因组中分离并验证了参与DNA甲基化的基因,设计了实时PCR引物。JS参与了研究设计、协调和撰写稿件。所有的作者都阅读并认可了手稿的最终版本。
附加文件
缩写
- 情绪:
-
Epigenetically修改生物
- 益生元:
-
寡核苷酸
参考文献
Day A, Neutelings G, Nolin F, Grec S, Habrant A, Cronier D, Maher B, Christia R, David H, Chabber B, Hawkins S:咖啡酰基辅酶A o -甲基转移酶下调与亚麻次生木质部木质素和细胞壁结构的修饰有关。植物生理与生物化学,2009,47:9-19。10.1016 / j.plaphy.2008.09.011。
罗培尔-克亚特科斯卡,斯塔奇基,泽博斯基,奥斯米亚耶夫斯基,苏帕J:转基因亚麻木质素缺乏导致植株机械性能改善。生物工程学报,2007,29(4):394 - 394。
杨飞,Mitra P,张丽,Prak L, Verhertbruggen Y, Kim J-S,孙丽,柯剑Z, Tang K, Auer M, Scheller HV, Loque’D:植物次生细胞壁的工程沉积。植物生态学报,2013,31(4):359 - 359。10.1111 / pbi.12016。
Czemplik M, Boba A, Kostyn K, Kulma A, mituska A, Sztajnert M, wrobela - kwiatkowska M, Zuk M, Szopa J, Skórkowska- Telichowska K:亚麻工程在生物医学应用。生物工程技术趋势,2011,17:
dymikowska L, Szatkowski M, Wróbel- Kwiatkowska M, Żuk M, Kurzawa A, Syska W, goubgor A, Zawadzki M, Ptak M, moubczka M, Hanuza J, Szopa J:改良超微化转基因亚麻纤维的性能。中国生物医学工程学报,2013,38(4):359 - 359。10.1016 / j.jbiotec.2013.01.002。
Wróbel- Kwiatkowska M, Skórkowska-Telichowska K, dymikowska L, mzhaczka M, Hanuza J, Szopa J:产生生物塑料(聚β-羟基丁酸酯)的转基因亚麻纤维的生化、机械和光谱分析。生物技术进展,2009,25:1489-1498。10.1002 / btpr.194。
王晓燕,王晓燕,王晓燕,等。利用工程技术提高亚麻植物抗氧化能力,改善油脂成分和稳定性。农业食品化学学报,2012,60:5003-5012。10.1021 / jf300421m。
张国强,张国强,张国强,等。基于亚麻的生物医药和工业产品开发优化研究。农业兽医科学与资源,2009,4:1-10。
Berrocal-Lobo M, Molina A:拟南芥防御反应尖孢镰刀菌.植物科学进展,2008,13:145-150。10.1016 / j.tplants.2007.12.004。
Olivain C, Trouvelot S, Binet MN, Cordier C, Pugin A, Alabouvette C:接种致病性和非致病性菌株的亚麻根定植和亚麻细胞的早期生理反应尖孢镰刀菌.环境科学与技术,2004,24(3):366 - 366。10.1128 / aem.69.9.5453 - 5462.2003。
Király L,巴娜,Király Z:植物对病原菌侵染的先天和获得性抗性的表现形式和机制。植物病理学杂志,2007,30(4):385-396。10.1111 / j.1439-0434.2007.01264.x。
几丁质酶和脂质转移蛋白基因在转基因胡萝卜植株中的联合表达增强了对叶片真菌病原的抗性。植物科学进展,2007,26:1539-1546。10.1007 / s00299 - 007 - 0368 - x。
Borad V, Sriram S:植物保护的病原相关蛋白。中华医学杂志,2008,22:189-196。
张丽娟,张丽娟,张丽娟,等。植物致病性葡糖苷水解酶基因的初步研究。参与植物防御的基因。编辑:Boller T, Meins F Jr.施普林格,维也纳;1992:245 - 282。10.1007 / 978 - 3 - 7091 - 6684 - 0 - _10。植物基因研究
杨志强,张志强,张志强。植物致病相关蛋白的研究进展。CRC出版社,博卡拉顿,美国;1999.
Lawrence CB, Singh NP, Qiu J, Gardner RG, Tuzun S:本构水解酶与番茄对番茄枯病多基因抗性有关,可能是激发子释放机制。植物病理学杂志,2000,29(4):381 - 381。10.1006 / pmpp.2000.0298。
Vleeshouwers VGAA, Van Dooijeweert W, Govers F, Kamoun S, Colon LT:茄属植物的基础PR基因表达是否有助于对晚疫病的非特异性抗性?植物病理学杂志,2000,29(3):347 - 347。10.1006 / pmpp.2000.0278。
Lorenc-Kukula K, Amarowicz R, Oszmianski J, Doermann P, Starzycki M, Skala J, Żuk M, Kulma A, Szopa J:转基因亚麻中酚类化合物含量增加的多效效应。农业食品化学,2005,53:3685-3692。10.1021 / jf047987z。
Lorenc-Kukula K, Zuk M, Kulma A, Czemplik M, Kostyn K, Skala J, Starzycki M, Szopa J: GT家族工程亚麻茄属植物sogarandinum糖基转移酶SsGT1增加了对镰刀菌素感染。农业食品学报,2009,57:6698-6705。10.1021 / jf900833k。
蔡志军,陈晓燕,陈晓燕,陈晓燕,等:通过过表达酵母Met25基因提高亚麻中硫氨基酸含量。植物生态学报,2009,29(4):381 - 381。10.1016 / j.plantsci.2009.08.008。
Wróbel- Kwiatkowska M, Lorenc-Kukula K, Starzycki M, oszmiakowski J, kepczyzynska E, Szopa J: β-1,3-葡聚糖酶在亚麻中的表达增加了对真菌的抗性。植物病理学杂志,2004,29(4):354 - 354。10.1016 / j.pmpp.2005.02.008。
Shetty NP、Jensen JD、Knudsen A、Finnie C、Geshi N、Blennow A、Collinge DB、Jørgensen HJL: β-1,3-葡聚糖对Septoria tritici小麦的结构防御反应。中国机械工程学报,2009,30(4):369 - 369。10.1093 / jxb / erp269。
Sarowar S, Kim YJ, Kim EN, Kim KD, Hwang BK, Islam R, Shin JS:烟草植株中辣椒基本致病相关蛋白1基因的过表达增强了对重金属和病原胁迫的抗性。植物细胞学报2005,24:216-224。10.1007 / s00299 - 005 - 0928 - x。
伊克巴尔MM, Nazir F, Ali S, Asif MA, Zafar Y, Iqbal J, Ali GM:水稻几丁质酶基因在转基因花生中的过表达落花生hypogaeaL.)提高对叶斑病的抵抗力。生物化学学报,2012,30(5):359 - 361。10.1007 / s12033 - 011 - 9426 - 2。
李世东,黄磊:反义寡核苷酸和小干扰RNA靶向转染肺癌细胞。中华化学杂志,2006,3:579-588。10.1021 / mp060039w。
孙超,Höglund a - s, Olsson H, Mangelsen E, Jansson C:植物生物学中反义寡核苷酸抑制的一种有效策略:识别SUSIBA2作为植物糖信号的转录激活因子。植物学报,2005,34(4):378 - 378。10.1111 / j.1365 - 313 x.2005.02515.x。
廖芳,王超,杨丽波,张丽,彭旭,孙明:反义寡核苷酸抑制法是花粉管基因功能分析的一种简便方法。科学通报,2013,8:e59112-10.1371/journal.pone.0059112。
植物中的RNA沉默。自然学报,2004,431:356-363。10.1038 / nature02874。
李丽春,Okino ST,赵红,Pookot D, Place RF, Urakami S, Enokida H, Dahiya R:小dsRNAs在人细胞中诱导转录激活。中国生物医学工程学报,2006,29(3):369 - 369。10.1073 / pnas.0607015103。
黄伟,秦勇,王静,王鑫,Place RF,林刚,卢特芬,李丽春:哺乳动物细胞中rna是保守的。科学通报,2010,5:e8848-10.1371/journal.pone.0008848。
Shibuya K, Fukushima S, Takatsuji H: rna定向DNA甲基化诱导植物转录激活。中国生物医学工程学报,2009,38(6):669 - 669。10.1073 / pnas.0809294106。
王晓燕,王晓燕,王晓燕。植物的跨代表观遗传研究。生物化学学报,2011,29(4):459-468。10.1016 / j.bbagrm.2011.03.007。
López A, Ramírez V, García-Andrade J,弗洛斯V,维拉P: RNA沉默酶RNA聚合酶V是植物免疫所必需的。科学通报,2011,7:e1002434-10.1371/journal.pgen.1002434。
朱建军:植物rna定向的DNA甲基化和去甲基化。中国科学——生命科学,2009,52:331-343。10.1007 / s11427 - 009 - 0052 - 1。
Ebrahim S, Usha K, Singh B:植物防御机制中的PR相关蛋白。中华微生物学杂志,2011,2:1043-1054。
作物植物抗真菌基因工程:抗真菌基因的作用。生物工程学报,2012,34:995-1002。10.1007 / s10529 - 012 - 0871 - 1。
Klarzynski O, Joubert JM PBF, Yvin JC JJF, Yvin JC Fau-Kopp M, Kopp M Fau-Kloareg B, Kloareg B Fau-Fritig B, Fritig B:线性β -1,3葡聚糖是烟草中防御反应的激发子。植物生理学报,2004,24(3):378 - 378。10.1104 / pp.124.3.1027。
Dinc E, Toth SZ, Schansker G, Ayaydin F, Kovacs L, Dudits D, Garab G, Bottka S:合成反义寡核苷酸瞬时抑制高等植物叶绿体不同的核编码和叶绿体编码蛋白。植物生理学报,2011,37(4):378 - 378。10.1104 / pp.111.185462。
鸟A: DNA甲基化模式和表观遗传记忆。基因学报,2002,16:6-21。10.1101 / gad.947102。
和田勇,宫本强,王晓燕,王晓燕,等:烟草植株胁迫响应基因上调与基因组DNA低甲基化的关系。中国生物医学工程学报,2004,29(5):557 - 557。10.1007 / s00438 - 004 - 1018 - 4。
齐伯曼D, Gehring M, Tran RK, Ballinger T, Henikoff S:对拟南芥DNA甲基化的全基因组分析揭示了甲基化与转录之间的相互依赖性。中国生物工程学报,2007,39:61-69。10.1038 / ng1929。
Vining KJ, Pomraning KR, Wilhelm LJ, Priest HD, Pellegrini M, Mockler TC, Freitag M, Strauss SH:毛杨基因组中DNA胞嘧啶的动态甲基化:组织水平的变异及其与基因表达的关系。中国生物医学工程学报,2012,31(4):447 - 447。
Kim MY, Zilberman D: DNA甲基化作为植物基因组免疫系统。植物科学进展,2014,19:320-326。10.1016 / j.tplants.2014.01.014。
植物中的DNA甲基化系统和靶点。中华医学杂志,2011,585:2008-2015。10.1016 / j.febslet.2010.08.017。
朱家军,朱家军:植物胁迫反应的表观遗传调控。植物生物学杂志,2009,12:133-139。10.1016 / j.pbi.2008.12.006。
范霍芬,杨俊杰,范迪克,毕尔。胁迫诱导的无性蒲公英DNA甲基化变化及其遗传力。中国植物学报,2010,29(5):561 - 561。10.1111 / j.1469-8137.2009.03121.x。
Hirano Y, Pannatier EG, Zimmermann S, Brunner I:短时间接触铝后挪威云杉幼苗根中胼胝质的诱导。植物学报,2004,24:1279-1283。10.1093 / treephys / 24.11.1279。
wojtasasik W, Kulma A, Dyminska L, Hanuza J, Zebrowski J, Szopa J:过量生产-1,3-葡聚糖酶的亚麻纤维显示果胶和酚类物质的积累增加,因此具有更高的抗氧化能力。生物工程学报,2013,13:1472-6750。10.1186 / 1472-6750-13-10。
Manganaris GA, Vicente AR, Crisosto CH, Labavitch JM:低温损伤李果的细胞壁修饰。生物技术,2008,48:77-83。10.1016 / j.postharvbio.2007.09.017。
韦森特·AR,鲍威尔·A,格雷夫·LC, Labavitch JM:波森莓细胞壁分解事件(英文)悬钩子属植物idaeus L.x悬钩子属植物ursinus可汗。& Schldl水果发展。功能植物学报,2007,34:614-623。10.1071 / FP07002。
黄晓明,王晓明,王晓明,等。质酸含量测定的新方法。生物化学学报,2003,31(4):484-489。10.1016 / 0003 - 2697(73) 90377 - 1。
Ahmed AER, Labavitch JM:一种精确测定细胞壁uronide含量的简化方法。食品化学学报。1998,1:361- 361。10.1111 / j.1745-4514.1978.tb00193.x。
Ververis C, Georghiou K, Christodoulakis N, Santas P, Santas R:各种植物材料的纤维尺寸、木质素和纤维素含量及其造纸适应性。作物学报,2004,19:245-254。10.1016 / j.indcrop.2003.10.006。
AFA:用改进的乙酰溴法测定草本植物中的木质素。食品与农业学报,1990,51:145-161。10.1002 / jsfa.2740510202。
本井A,加藤T,佐藤S, Tabata S,山本KT,高桥T:精胺不是生存所必需的拟南芥.中华医学杂志,2004,2:148-152。10.1016 / s0014 - 5793(03) 01395 - 4。
确认
本研究获得美国国家科学中心(NCN) No. 2013/11/B/NZ9/00150、No. 2013/11/B/NZ1/00007和No. 2012/06/A/NZ1/00006资助。Wioleta Wojtasik的工作由欧盟作为欧洲社会基金的一部分共同资助。该项目由弗罗茨瓦夫生物技术中心支持,计划2014-2018年国家领先研究中心(KNOW)。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者声明他们没有竞争利益。
电子辅料
12870 _2014_261_moesm1_esm.doc
附加文件1:图S2。:Level of genes expression involved in cell wall polymer metabolism and their targets in EMO-βGlu flax. EMO-βGlu flax (EB) and the control flax (Cf) were analysed with RT-PCR, actin was used as a reference gene. (A) Pectin synthesis: UDP-D-glucuronate-4-epimerase, GAE; α-1,4-galacturonosyltransferase 1, GAU1; α-1,4-galacturonosyltransferase 7, GAU7; rhamnogalacturonan II xylosyltransferase, RGXT; arabinosyltransferase, ARAD; pectin methyltransferases PMT (B) Pectin degradation: pectin methylesterases 1; PME1; pectin methylesterases 3, PME3; pectin methylesterases 5, PME5; polygalacturonase, PG; pectate lyase, PLL; pectin lyase, PL; (E) Hemicellulose synthesis: glucomannan 4-beta-mannosyltransferase 9-like, GMT; galactomannan galactosyltransferase, GGT; xyloglucan galactosyltransferase, XGT; (F) Hemicellulose degradation: endo-1,4-β-xylanase, XYN; 1,4-β-xylosidase, XYLb; 1,4-β-xylosidase, XYLa; α-galactosidases, GS; endo-α-mannosidase, MS; α-glycosidase, GLS; (I) Cellulose metabolism: cellulose synthases (CLS1-4), cellulase, Cel; (K) Lignin metabolism: phenylalanine/tyrosine ammonia-lyase, PAL; 4-Coumarate-CoA ligase, 4CL; naringenin-chalcone synthase, CHS; 4-coumaroyl-CoA:shikimate O-(hydroxycinnamoyl)transferase, HCT; p-coumarate 3-hydroxylase, C3H; caffeoyl-CoA O-methyltransferase, CCoAOMT; caffeate O-methyltransferase, COMT; sinapyl alcohol dehydrogenase, SAD; glucosyltransferase, GT (M) Polyamine synthesis: arginine decarboxylase, ADC; agmatine iminohydrolase, AIH; N-carbamoylputrescine amidase, NCPAH; arginase, ARG; ornithine decarboxylase, ODC; spermidine synthase, SPDS; spermine synthase, SPS; (N) Polyamine degradation: diamine oxidase, DAO; polyamine oxidase, PAO; (P) Callose synthesis: callose synthase, CALS; (C) and (G) The uronic acid contents in fractions of the cell wall; pectin fractions: WSF, CSF and NSF and hemicellulose fractions: K1SF and K4SF D and (H) Total sugar content in fractions of the cell wall; pectin fractions: WSF, CSF and NSF and hemicellulose fractions: K1SF and K4SF. (J) Cellulose content. (L) Lignin content. (O) Total polyamine content. Analyses of metabolic products were performed as described in the Methods section. Data represent the mean values – SD from three independent experiments. The significance of the differences between the means was determined using Student’s t test (*P < 0.05, **P < 0.01). RQ – relative quantity. (DOC 19 MB)
12870 _2014_261_moesm2_esm.doc
附加文件2:图S1。:Methylation of complementary sites of β-1,3-glucanase gene in flax treated with OLIGOs and in EMO-βGlu flax. The methylation of three sites in the promoter and one site in the exon of the β-1,3-glucanase gene in flax treated with OLIGOs and in EMO-βGlu flax. The analysis of flax treated with OLIGOs (B1, B2, B3 and B4) at 24 h and 48 h after exposure to OLIGOs in comparison with control, non-treated flax (C) and in EMO-βGlu flax (EB) in comparison with control flax from field (Cf) was determined by digesting genomic DNA with restriction enzymes HpaII-MspI with subsequent semi-quantitative PCR reaction, separation of the PCR product on agarose gel and quantification of the bands by densitometry. Data represent the mean ± standard deviations from three independent experiments. The significance of the differences between the means was determined using Student’s t test (*P < 0.05, **P < 0.01). (DOC 1 MB)
12870 _2014_261_moesm3_esm.doc
附加文件3:表S1。:Primer sequences for real-time RT-PCR reactions. Primer sequences designed for real-time PCR: (A) PR genes and actin. (B) DNA methylation genes. (C) Callose synthesis genes. (D) Pectin metabolism genes. (E) Hemicellulose metabolism genes. (F) Cellulose metabolism genes. (G) Lignin metabolism genes. (H) Polyamine metabolism genes. (DOC 78 KB)
作者提交的图片原始文件
下面是作者提交的原始图片文件的链接。
权利和权限
本文由BioMed Central Ltd.授权发布。这是一篇开放获取文章,根据创作共用授权协议(http://creativecommons.org/licenses/by/4.0),它允许在任何媒体上不受限制地使用、分发和复制,只要原始作品的名称正确。创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条提供的资料。
关于这篇文章
引用这篇文章
Wojtasik, W., Kulma, A., Boba, A。et al。寡核苷酸处理通过改变基因体甲基化引起亚麻β-葡聚糖酶上调。BMC植物杂志14,261(2014)。https://doi.org/10.1186/s12870-014-0261-z
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-014-0261-z
关键字
- 亚麻的阻力
- 镰刀菌素感染
- Epigenetically修改生物
- DNA甲基化/脱甲基
- 益生元技术
- β1,3-glucanase