摘要
背景
MicroRNAs (miRNAs)是由dicer催化的茎环前体切除产生的约19 ~ 21个核苷酸的非编码rna。许多植物mirna通过与特定靶mrna的相互作用,在发育、营养平衡、非生物胁迫反应和病原体反应中发挥关键作用。茶树是世界上最重要的商业饮料作物之一。然而,与冷胁迫耐受性相关的mirnac . sinensis仍然是未知的。使用高通量测序可以提供对mirna更深入的了解。为了更深入地了解mirna在冷胁迫耐受中的功能,Illumina测序了c . sinensis进行sRNA检测。
结果
采用Solexa测序技术对茶叶冷处理后的小RNA文库进行高通量测序。为了使测序数据与已知的植物mirna相一致,我们鉴定了106个保守的mirnac . sinensismicrorna。此外,还发现了215个潜在的候选mirna,其中98个具有星型序列的候选mirna被选为新的mirna。获得了一致调控和差异调控的mirna,并通过基于芯片的杂交鉴定了应对冷胁迫的品种特异性mirna。定量实时聚合酶链反应也证实了结果。为了确定mirna的靶标,我们构建了来自两种处理的两个降解物文库。根据降解组测序,分别从冷处理文库和对照文库中鉴定出455个和591个基因作为miRNAs的切割靶点,其中283个靶点存在于两个文库中。对这些miRNA靶点的功能分析表明,它们参与了重要的活动,如发育、转录调节和应激反应。
结论
结果发现,‘迎爽’在低温胁迫下上调miRNA 31个,下调miRNA 43个;‘白叶1号’在低温胁迫下上调miRNA 46个,下调miRNA 45个。降解组测序共检测到763个相关靶基因。RLM-5'RACE程序成功地绘制了6个靶基因的切割位点c . sinensis.这些发现揭示了mirna调控机制的重要信息c . sinensis,促进对miRNA在冷反应中的功能的理解。miRNA基因型特异性表达模型可能解释了茶系间不同的冷敏感性。
背景
MicroRNAs (miRNAs)是一类非编码rna,长约19 ~ 21个核苷酸(nt),在真核生物中起转录后调控作用[qh]1]。miRNA基因经Pol II或Pol III酶转录为初级miRNA后,被dicer样蛋白加工成茎环miRNA::miRNA*双工[2]。miRNA::miRNA*双链随后被切割并从细胞核转运到细胞质中。然后单链miRNA与Argonaute (AGO)结合形成rna诱导的沉默复合体(RISC) [3.]。最后,RISC通过切割靶mrna或抑制翻译来下调靶标[4]。植物mirna在应对生物和非生物胁迫中具有重要功能[j]。5]。近年来,在植物基因组中发现了许多mirna [6],这表明鉴定它们的靶rna对于miRNA的功能分析至关重要。
冷胁迫对植物的生长发育产生负面影响,造成组织损伤和生长延迟,严重限制了植物的空间分布和经济作物的生产力[j]。7]。除了转录调控外,mirna还参与冷响应基因调控网络。孙卡和朱[8结果表明,冷处理上调了miR393和miR319c的表达水平。微阵列分析显示大约17%的拟南芥mirna在低温处理早期响应低温上调[j]9]。miR169和miR172的丰度拟南芥通过计算、基于转录组的方法和微阵列分析来确定低温胁迫[10]、[11]。Solexa测序分析显示,3个保守mirna (miR169e、miR172b和miR397)和25个预测mirna的表达水平在低温胁迫下发生显著变化Brachypodium[12]。植物的抗寒性取决于与生理、代谢和生长相关的不同调控基因表达类型[13]。在水稻中,使用微阵列鉴定了18个冷响应水稻mirna, miR171家族的成员表现出不同的表达模式[14]。深度测序鉴定了30个冷响应mirna人口tomentosa[15]。尽管mirna已被广泛研究拟南芥和其他植物物种,没有进行系统的miRNA检测c . sinensis.Prabu [16]和Das [17]鉴定了许多保守的mirna及其靶标c . sinensis通过计算机分析。分离并克隆了6个新的候选小RNA;小rna的表达分析证实了这些小rna在幼苗和老叶、非休眠期和休眠期的表达c . sinensis[18]。然而,需要进一步的研究来阐明mirna在全基因组水平上对低温胁迫的响应c . sinensis.
茶树(c . sinensis)是世界上最重要的商业饮料作物之一。冷胁迫会对茶树的生长发育和空间分布产生不利影响,降低茶树的产量和品质。一般来说,品种特异性表达与相应品种的生理功能有很强的相关性[19]。了解miRNA的品种特异性表达模式是深入了解miRNA功能的必要条件。因此,选择耐寒茶树品种‘迎爽’(YS)和寒敏茶树品种‘百叶1号’(BY)作为两个品种。在我们的研究中,采用高通量Solexa测序(Illumina基因组分析仪)鉴定c . sinensis在小RNA文库中获得了响应冷胁迫的mirna和106个保守mirna。然后通过定量实时聚合酶链反应(qRT-PCR)结合计算分析验证选定数量的冷响应和新的mirna。鉴定的miRNA及其潜在的miRNA靶标通过降解组测序进行预测和确认。大量保守的序列特征被确定为被保守的miRNAs切割的靶标,新的miRNAs靶向具有不同生物学功能的不同基因。
结果
茶树小rna的高通量测序
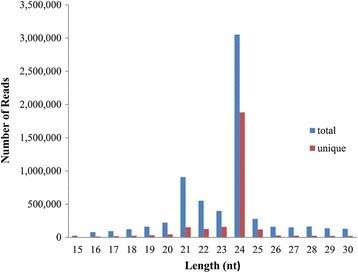
茶树在4°C和28°C下分别保存1、4、8、12、24和48 h。由每个冷处理阶段的总RNA混合物生成的茶叶小RNA文库通过Illumina平台进行高通量测序。原始序列首先经过供应商(Solexa 0.3)提供的Illumina Pipeline过滤器。总共获得了9,700,042个原始读取,代表3,145,122个不同的序列。不含小RNA序列的Reads,长度在15 ~ 30 nt之间(图2)1)。大多数RNA序列的大小在19 ~ 25 nt之间。文库中最丰富的小rna长度为24 nt。24 nt小rna在总序列和唯一序列中的分布分别约为45.96%和69.67%,而21 nt小rna在总序列和唯一序列中的分布分别约为13.68%和5.67%。从茶树中共获得1319,524个clean reads,包括Rfam、rRNA、tRNA、snoRNA、snRNA、miRNA、其他ncRNA和重复序列(表1)1)。通过去除适配器/受体序列,过滤低质量标签,清洗适配器-适配器连接形成的污染物和小于15 nt的短rna,获得了这些干净的reads。
茶树中保守的mirna
为了鉴定茶树中的保守miRNA,我们将我们的数据集与miRAlign的miRBase 19.0中已知的植物miRNA(如miRNA前体和成熟miRNA)进行了比较。经过BLASTN检索和进一步的序列分析,发现小RNA文库中属于25个科的106个独特序列与其他植物物种的已知mirna同源,这些mirna先前存放在miRBase数据库中(附加文件)1:表1)。此外,鉴定出57个miRNA*s,这被认为是真正的miRNA的有力证据[20.]。先前的研究已经预测了茶树中的一些mirna。6个保守mirna (ccn - mir156a, ccn - mir164, ccn - mir169, ccn - mir171a, ccn - mir399和ccn - mir408)被鉴定出来并与之前报道的一致[16]、[17]、[21]、[22]。
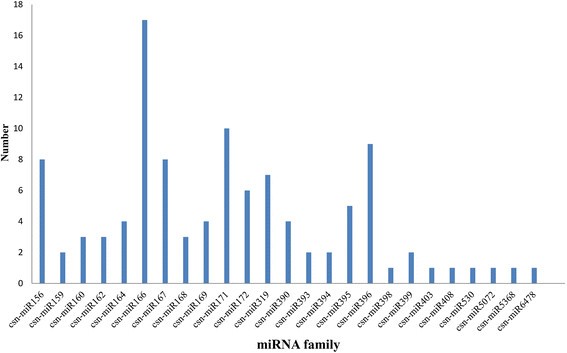
分析不同保守miRNA家族成员的数量。25个miRNA家族中的大多数包含多个成员,两个家族(miR166和miR171)拥有多个成员,分别有17个和10个成员,而7个miRNA家族只有一个成员(图1)2)。来自相同或不同miRNA家族的不同成员的测序频率也有很大差异,从1到159305次不等。在鉴定的25个保守的ccn - mirna中,6个mirna (ccn - mir166a -1、ccn - mir166a -2、ccn - mir166a -3、ccn - mir166a -4、ccn - mir166a -5和ccn - mir166a -6)的读取量最多,达到159,305个。此外,四个miRNA家族有成千上万个,而一些miRNA(例如,ccn - mir156d, ccn - mir395b和ccn - mir396f)只有一个读取序列。这种csn- mirna表达水平的巨大差异可以从测序的reads数推断出来,这可能反映了冷胁迫不同阶段潜在功能的差异。
茶树中新的mirna
在我们的研究中,我们利用miRNA前体的茎环结构来预测新型miRNA,并通过Mfold获得了新型miRNA前体的二级结构[23]。代表性mirna的次级发夹结构在附加文件中列出2:图S1预计共有215个序列是来自剩余未注释的srna的潜在非保守mirna。使用更新的植物miRNA标注标准[20.], 98个序列被高置信度地识别为新颖的mirna,并被指定为新颖的c . sinensismiRNAs(附加文件3.表2)。成熟mirna的长度从19 nt到25 nt不等,大部分为24 nt。此外,新型miRNA前体的长度在72 ~ 264 nt之间,平均长度为150 nt,最小自由能(MFE)在-114.3 kcal mol之间变化−1到- 17.6千卡摩尔−1,平均为- 61.79千卡摩尔−1.MFE指数(MFEI)是识别mirna的唯一标准。MFEI的计算公式为:MFEI = (100 × MFE/L) / (G + C)% (L: pre-miRNA长度)。当MFEI大于0.85时,该序列最有可能是miRNA [24]。与保守的mirna相比,这些新型mirna显示出较低的丰度水平,这与先前的研究一致[25]-[27]。新的mirna表现出不同的表达水平,它们的标准化读数从1到1644。因此,csn-smR30(1644)、csn-smR65(794)和csn-smR80(668)是最丰富的miRNAs。大多数新mirna的测序次数少于100次,而43个(43.89%)csn- smrna的测序次数少于10次。98个新鉴定的miRNA每个位置的核苷酸偏倚(附加文件)3.表S2)表明,新miRNA基因的首个核苷酸一般趋向于(U)。正如预期的那样,mirna在AGO1的协助下被加载到RISC中。研究表明,AGO1蛋白在miRNA的5′端与尿嘧啶具有更强的亲和力,因此克隆的miRNA序列中,尿嘧啶核苷酸偏在首位[28]。
miRNA微阵列芯片内容和阵列杂交
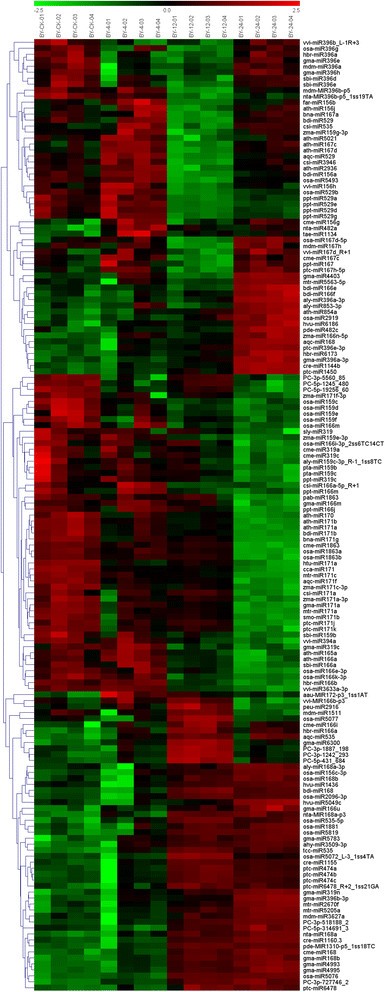
利用微阵列杂交技术分析了新鉴定的mirna在茶树中的表达。miRBase (http://microrna.sanger.ac.uk/sequences/),本研究新鉴定的序列作为芯片杂交探针。mirna在冷胁迫(4、12和24 h)和未处理条件下表现出不同的表达谱。在3511个miRNA探针中,在耐寒茶树品种‘英爽’(YS)和冷敏茶树品种‘百叶1号’(by)中分别发现了303个和349个保守miRNA(另附文件)4:图S2和附加文件5:图S3)。检测到的mirna定义为杂交信号值大于500,当信号比大于2 (|log|>1)和p< 0.01。基于这一原理,在YS中发现了158种茶树mirna在不同冷胁迫阶段的差异表达,在BY中发现了159种mirna的差异表达6:表S3和附加文件7(表S4),在两个品种中包括87个保守mirna (p <0.01, Signal >500)。
在我们的研究中观察到一致和差异调节的mirna,以及栽培特异性mirna。大多数差异表达的mirna在三个冷胁迫阶段或两个茶品种之间表现出不同的表达模式。在YS中,31种mirna均呈上调趋势,如miR164、miR167、miR168、miR171等,而43种mirna (miR156、miR319、miR474、miR529等)呈下调趋势。相比之下,miR168、miR474、miR1160等46个mirna在By中呈上调趋势,而miR159、miR166、miR171、miR529等45个mirna在By中呈下调趋势。三个miRNA家族(miR168、miR152和miR2936)在两个植物品种的4个冷胁迫阶段受到统一调控。而miR171和miR474的表达量在YS中逐渐升高,而在BY中逐渐下降。这些结果强烈表明,这种调控模式可能符合冷敏感茶品种的延迟表达模式,这在一定程度上解释了两个品种之间不同的冷敏感性。
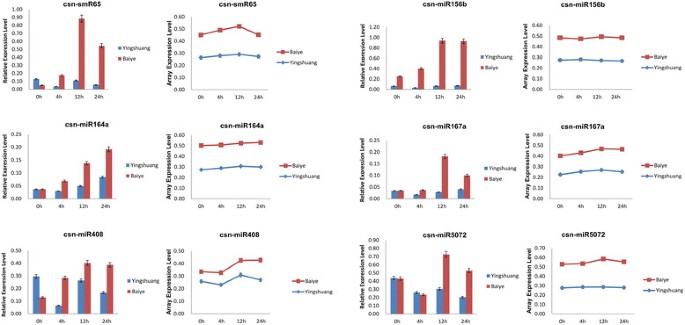
为了证实微阵列结果,我们用qRT-PCR进一步分析了几种mirna的丰度。qRT-PCR结果与微阵列丰度谱具有相似的趋势(图2)3.)。在不同的冷胁迫阶段,也发现了响应幅度的差异,这可能是由于探针与其他高度同源的miRNA家族成员之间的交叉杂交。差异也可能是由于两种方法之间的数据归一化。qRT-PCR数据归一化为5.8S rRNA的丰度,而微阵列数据归一化为微阵列检测到的所有miRNAs的全球丰度。使用5.8S rRNA作为微阵列数据的标准化标准在技术上是不可行的。
茶树miRNA靶点鉴定
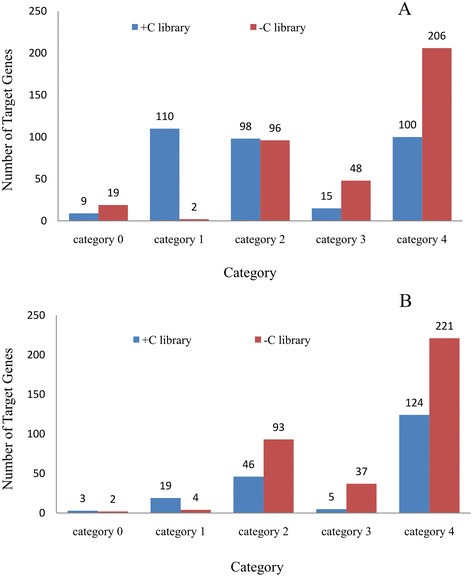
我们使用高通量降解组测序技术对miRNA-cleaved mrna进行全基因组分析,以鉴定miRNA靶点[29]、[30.]。我们对每个文库(−C和+ C)的9,224,714和6,736820个特征进行了测序。在去除重复后,C和+ C文库分别获得了7,439,589和5,376,267个不同的reads。将不同序列与茶树表达序列标签(EST)序列比对,分别得到-C和+ C文库的37,088个和37,011个唯一特征。我们基于CleaveLand管道方法确定了已知miRNA和新型miRNA候选物的切片靶标[31]。在每个转录本上绘制序列的丰度(附加文件)8:图S4和附加文件9:图S5),根据目标位点标签的相对丰度将切片的目标转录本分为5类[29]。基于这种方法,类别0和类别1在该位置有多个原始读取。该位置的丰度等于转录本上的最大值,并且转录本上只有一个最大值。类别2在该位置有多个原始读数。该位置的丰度小于最大值,但高于转录本的中位数。类别3在该位置有多个原始读数。该位置的丰度等于或小于转录本的中位数。类别4在该位置只有一个原始读取。
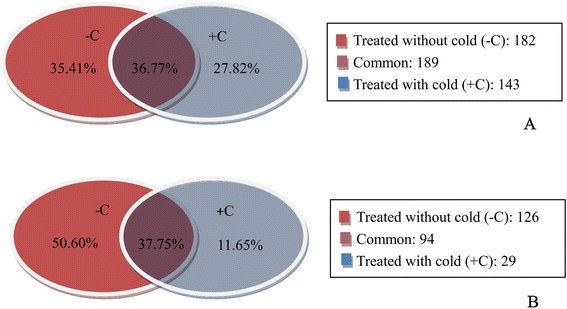
共鉴定出13个已知miRNA家族的514个靶转录本(附加文件)10表S5)基于我们的数据集,显示了大多数被保守的mirna切割的靶标。在+ C文库中共鉴定出332个已知保守miRNA家族的靶点,其中9个(2.71%)、110个(33.13%)、98个(29.52%)、15个(4.52%)和100个(30.12%)分别被分为0、1、2、3和4类。对于-C文库,共鉴定出371个靶点,其中19个(5.12%)、2个(0.54%)、96个(25.88%)、48个(12.94%)和206个(55.52%)分别被归为0、1、2、3和4类(图2)4其中,35.41%(182个)在-C文库中被鉴定,27.82%(143个)在+ C文库中被鉴定,36.77%(189个)在两种情况下均存在(图2)5A)。在13个保守的miRNA家族中,鉴定出4个(miR167、miR390、miR393和miR398)的靶点少于10个,而其他的靶点为多个转录本。miR319和miR160的靶标数量最多,分别有126个和85个转录本10表5)。
从249个新的候选靶点中鉴定出40个新的mirna(附加文件)11表6)。对+ C文库中的靶点进行分析,3个(2.44%)、19个(15.45%)、46个(37.40%)、5个(4.06%)、50个(40.65%)靶点可分别归为0、1、2、3、4类,C文库中的2个(0.91%)、4个(1.82%)、93个(42.27%)、37个(16.82%)、84个(38.18%)靶点可分别归为0、1、2、3、4类(图2)4B)。在这些靶点中,50.60%(126个)在-C文库中被鉴定,11.65%(29个)在+ C文库中被鉴定,37.75%(94个)在两种情况下都存在(图2)5B).两个文库的分布模式不同,这表明mirna对靶标的切割受到冷胁迫的影响。
基于BLASTX分析,39.58%的鉴定miRNA靶点与已发现的保守靶基因普遍同源拟南芥.这些保守的靶基因多为蛋白质编码基因,包括锌指家族蛋白(C2H2和C3HC4型)、胚胎发育晚期丰度家族蛋白(LEA)、休眠/生长素相关家族蛋白和干旱响应家族蛋白,分别参与植物的生长、分化、发育和非生物胁迫[qh]32]-[35]。在已鉴定的miRNA靶点中,含有VQ基序的蛋白是miR160和miR408靶点。VQ基序代表了蛋白相互作用域的核心,这与另一个VQ基序蛋白与RNA聚合酶σ-因子的相互作用是一致的[36]、[37]。因此,所鉴定的茶树mirna可以调节发育和其他生理过程中的广泛基因。
利用RLM-RACE鉴定mirna引导的靶mRNA切割
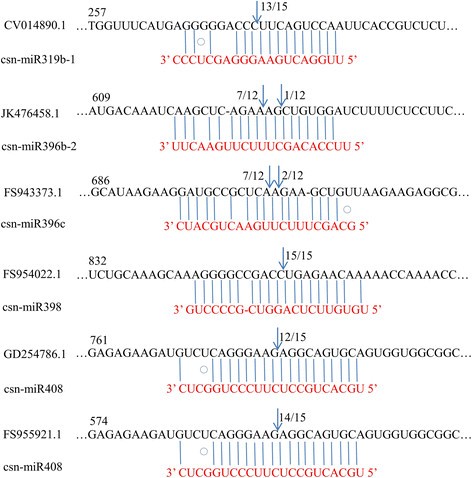
mirna,如小干扰RNA (siRNA),当这些信息与mirna具有广泛的互补性时,可以指导其mRNA目标的切割[38]-[41]。这种miRNA导向的切割可以通过使用改良形式的5 ' RNA连接酶介导的RACE (RLM-5 ' RACE)来检测,因为切割的3 '产物具有两个诊断特性:(1)5 '末端磷酸,使其成为使用T4 RNA连接酶连接RNA适配器的合适底物;(2)5 '末端精确映射到与miRNA的第10个核苷酸配对的核苷酸[39]、[42]。为了验证csn-miRNA靶基因的性质,研究csn-miRNA如何调控其靶基因,本研究采用RLM-5 ' RACE实验,进一步表征csn-miRNA的功能。mRNA片段的所有6个csn-miRNAs 5 '端都映射到与PCR验证的其中一个miRNAs的第10个核苷酸配对的核苷酸(图2)6)。CV014890.1、JK476458.1、fs94373.1、FS954022.1、GD254786.1和FS955921.1分别被确认为csn-miR319b-1、csn-miR396b-2、csn-miR396c、csn-miR398和csn-miR408的真正靶标,因为所有mRNA片段的5 '端都被映射到miRNA的第11个核苷酸上,频率高于每个配对寡核苷酸所描述的频率。从csn- mirna的精确序列结果中,我们知道mirna引导的切割在c . sinensis遵循miRNA 5 ' '种子区碱基配对是miRNA靶标识别的主导因素的原则,并且切割位点主要位于第11个核苷酸,仅为'种子'序列的3 ' ' [43]。这6个靶标均具有与miRNA互补序列对应的特异性裂解位点,可能受miRNA以sirna的方式调控[44]指导与mirna具有广泛互补的mRNA靶标的切割[42]。fs94373.1类似于拟南芥与植物钙调素结合蛋白相关的蛋白编码,FS954022.1编码一个与红霉素样超家族蛋白高度同源的蛋白,GD254786.1编码一个转座元件基因,FS955921.1编码一个与含VQ基序蛋白高度同源的蛋白(表1)2)。
目标基因本体(GO)功能分析
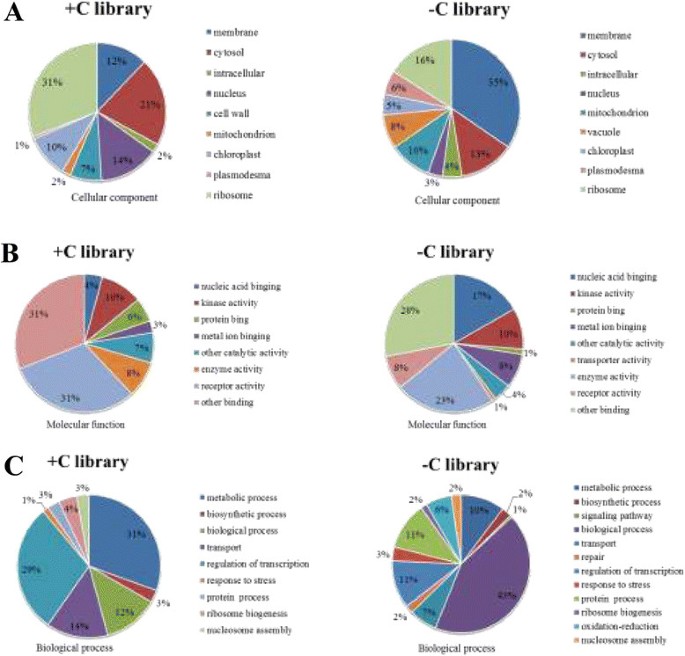
根据氧化石墨烯的三个本体:细胞成分、分子功能和生物过程,对所有靶标进行分类,包括514个已知靶标和249个新的候选靶标(图2)7)。比较两个文库的靶基因功能,超过50%的基因属于细胞成分,其中+ C文库中有11个基因功能属于细胞壁,而C文库中没有这样的靶基因(图2)7A)。根据分子功能,最终将基因分为8类,在+ C文库中,三个主要代表氧化石墨烯的项分别是受体活性(31%)、其他结合(31%)和激酶活性(10%),其中其他结合占28%,其次是酶活性(23%),C文库中受体活性仅占8%(图2)7B)。在生物学过程中,靶基因功能在+ C文库中主要集中于代谢过程(31%)和转录调控(29%),而在°C文库中这两类过程分别仅占10%和11%(图2)7C).靶基因功能的差异表明,在冷胁迫下茶树细胞结构受到严重破坏。此外,应激反应基因也被确定为miRNA的靶点,包括盐胁迫反应、热休克蛋白结合和缺水反应。这一结果暗示了mirna在调控冷胁迫相关生物过程中的可能功能。
讨论
茶树mirna的鉴定
许多高度保守的mirna表现出具有特定时间和组织特异性的特定表达模式,在生长、发育、分化、凋亡、代谢以及生物和非生物应激反应中具有关键功能,调节特定的靶mrna。一些茶树mirna及其靶基因已被生物信息学方法鉴定。14个新c . sinensis最近从47,452个可用的mirna中鉴定出c . sinensisest,这些miRNAs可能靶向51种mrna,这些mrna可以作为转录因子,参与转录和信号转导[21]。高通量测序方法的最新进展彻底改变了各种物种中低丰度的新型mirna的鉴定[27]、[45]-[47]。然而,目前还没有关于茶树miRNA新发现的全面研究报道。本研究旨在鉴定从冷胁迫茶树文库中恢复的进化上已知的和潜在的新型茶树特异性mirna。我们还分析了与冷应激反应相关的mirna的差异表达。因此,从sRNA文库中获得了大约900万个sRNA原始读数,其中成功鉴定了25个保守的miRNA家族和98个潜在的新型miRNA。读取数从1 (miR156、miR395和miR396)到159305 (miR166)不等(附加文件)1(表S1),表明每个miRNA家族的表达模式存在显著差异。然而,由于无法获得茶树的全基因组序列,仅检测到一小部分保守和新颖的茶叶mirna。从茶树中鉴定出的mirna数量似乎远未达到饱和,还有许多未知的mirna有待发现。
为了从更广阔的角度对茶树小rna进行高通量测序,我们观察到24nt的小rna在独特物种文库中占主导地位,这在其他植物物种中也有报道,如答:芥[27],柑橘trifoliata[48],Medicago truncatula[49),而素类[50]。长度分布分析是评估小RNA样品组成的有效方法。茶树小rna的总体分布格局(21 nt sRNAs =5.67%, 24 nt sRNAs =69.67%)与茶树有显著差异人口trichocarpa是一种模式森林物种,其中21 nt rna较丰富(37.16%),24 nt rna较少(<5%)[51]。茶树小rna与玉米单子叶品种之间也存在差异[52]。这些结果表明,小RNA转录组在植物物种中是复杂的,并且在系统发育上遥远的植物科之间可能存在显著差异[53]。
基于深度测序和发夹结构预测,我们成功鉴定了98个新的miRNA,以及53个具有互补miRNA*链的新miRNA。这些mirna前体形成二级发夹结构,自由能范围为- 114.3 kcal mol−1到- 17.6千卡摩尔−1(平均61.79千卡摩尔−1)(附加文件3.表2)。二级结构并不是mirna的独特特征,因为随机的反向重复也可能形成发夹结构[54]。候选miRNAs的反义miRNAs (miRNAs*)的鉴定提供了可信的证据,证明这些miRNAs是真实的miRNAs [20.]。保守mirna和新型mirna之间的一个区别是,新型mirna的表达水平低得多,或以组织特异性或环境诱导的模式表达[27]、[55]。
两种茶树品种冷响应性mirna的不同表达谱
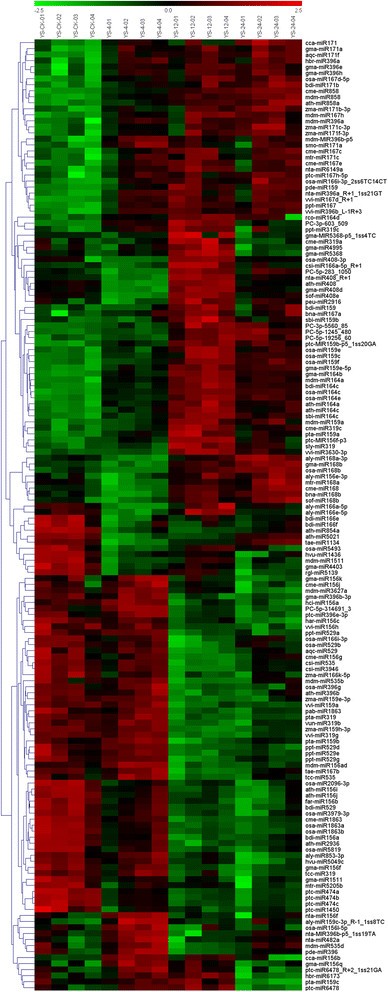
使用定制的微阵列进一步确定了品种特异性和冷响应性mirna。从YS和BY中分别鉴定出18个和14个保守的冷响应miRNA家族。此外,从YS和BY中分别鉴定出6个和9个新的冷响应miRNA家族。四分之一的mirna下调(YS中为27.2%,BY中为28.3%),表明这些mirna控制的靶基因表达被开启以适应冷胁迫。我们发现许多家族成员(miR156、miR159和miR396)对冷应激反应没有一致的调控模式,从而表明来自同一家族的mirna具有不同的功能(图2)8和9)。通过比较不同品种间mirna的表达模式,发现miR168、miR529和miR2936在冷胁迫途径上存在一定程度的重叠。相比之下,miR164、miR408、miR1511、miR5368、miR172、miR482、miR529和miR1160的表达量在两个品种中存在显著差异(图2)8和9)。
已知mirna通过引导靶mrna降解或抑制翻译在转录后沉默基因[5]。NADP-ME是催化l -苹果酸氧化脱羧生成丙酮酸,CO的关键酶2和NADPH在二价阳离子存在下[56]。在植物中,苹果酸盐可以在线粒体基质中通过nadd - me的作用脱羧,产生丙酮酸,丙酮酸被三羧酸循环氧化。这两种酶的基因被预测为miR474的靶标。miR474家族在YS中下调,在BY中上调。结果表明,低温诱导的非特异性反应途径可能参与了能量供应的维持。
miR171家族是一个很大程度上保守的miRNA家族,微阵列分析显示miR171a在拟南芥,在响应冷胁迫6 h时诱导[11]。在我们的研究中,miR171家族在YS中显著上调,而在BY中显著下调,这表明miR171成员可能具有不同的功能。AGO1受miR168调控,AGO1催化mRNA裂解,是唯一的拟南芥AGO家族参与mirna导向的mRNA切割过程。miR168和AGO1的共同调节表明miRNA通路的负反馈调控[57]。在我们的研究中,miR168被发现是一个冷响应miRNA,并且在低温处理12 h后,两个茶树品种中诱导了csn-miR168家族成员。
茶树mirna冷响应靶点的降解分析
准确鉴定靶基因是揭示miRNA调控功能的关键。以往对茶树基因鉴定的研究仅限于生物信息学预测[21]。最近开发的高通量实验方法允许鉴定已知和新的mirna的靶基因[29]、[58]。通过降解测序,共鉴定出13个已知miRNA家族的514个潜在靶点和40个新的茶树miRNA家族的249个新的茶叶特异性靶点(附加文件)10表S5和附加文件11表6)。鉴定了许多高度保守的mirna,并且没有可检测的切片靶标,包括miR159, miR166, miR168和miR394(附加文件)1:表1)。新的mirna靶向不同的基因,覆盖各种预测功能(附加文件)11表6)。例如,csn-smR5749靶向ras相关的小gtp结合蛋白家族的9个基因,而csn-smR2592影响锌指(c3hc4型环指)蛋白家族。据报道,这两个蛋白家族参与植物的各种生理过程[33]、[59]。相比之下,csn-smR2845靶向休眠或生长素相关蛋白家族,该家族在抑制生长和分化方面具有重要功能[35]。近年来,越来越多的遗传和生化结果表明,植物mirna引导的沉默具有广泛的翻译抑制成分[60]、[61]。
相邻的核苷酸(第9或11个th位置)在某些情况下是一些植物mirna的裂解位点[29]、[58]。这一观察结果解释了成熟mirna偶尔的位置异质性[55]和她们的乳沟产品[62]、[63]。通过比较两个降解文库,我们将许多冷响应miRNA靶标分类为0、1和2类10(表S5),从而证实了我们降解分析的准确性,因为类别0、1和2是miRNA靶点的特征拟南芥[29]。冷处理miRNA和冷处理miRNA的最明显的区别是371个冷处理miRNA靶点中有254个属于第3类和第4类(附加文件)10(表S5),其中切割丰度低于目标转录本的中位数。每个文库中的目标分布与最近报道的其他植物物种的目标分布大致相似[46]、[64]。此外,两个文库中靶点的分布模式和转录丰度存在差异,表明mirna对靶点的切割受到冷胁迫的影响。我们还发现了受mirna对调控的靶转录本。miR160/miR319对靶向5个不同的靶点,miR160/miR408对控制两个基序元件,miR319/miR396对靶向蛋白丙烯基转移酶,miR171/miR396对靶向ras相关的小gtp结合家族蛋白(附加文件)10表5)。这一现象提示在茶树中存在一种利用一对mirna的组合基因调控途径[46]。
降解组测序证实csn-miR164靶向LEA蛋白。LEA蛋白是一种功能元件,是在冷、热、干旱等代谢低水状态下维持生物体及其生物结构生存能力的重要因素[65]。部分机制可能与蛋白质稳定有关,但LEA蛋白的其他机制也被提出,因为LEA蛋白和其他亲水蛋白可以保持酶的活性在体外在干燥或冰冻后[66]-[70]。此外,csn-miR319被检测到靶向锌离子结合和跨膜氨基酸转运蛋白家族。金属离子(铜、锌或铁)的结合在正常呼吸功能和氧化应激时蛋白质损伤过程中起重要作用答:芥.固定的金属亲和层析相互作用蛋白组(预测含有金属结合基序的蛋白质)与在非生物胁迫下被氧化或降解的蛋白质组之间存在很强的相关性。71]。锌离子结合增加了脱落酸胁迫成熟蛋白的结构复杂性,这与DNA结合有关[72]、[73]。ww结构域结合蛋白(WBP)以前只在动物中发现,现在已经在茶树中被预测,并被csn-miR408靶向。ww结构域是在参与细胞信号传导或调节的各种蛋白质中发现的小蛋白质模块[74]。WBP靶向富含脯氨酸的序列识别结构域,这对信号传导的选择性很重要[75]。保守的miRNA家族可能具有调节茶树细胞分裂、脱落酸胁迫、信号转导和维持生物结构活力等功能,以应对冷胁迫。
降解组测序数据显示了6个新的mirna (csn-smR35、csn-smR3146、csn-smR5749、csn-smR7277、csn-smR8111和csn-smR9722),它们分别针对冷处理文库中的一些冷应答基因。预测csn-smR5749靶向KH结构域蛋白。KH结构域蛋白在RNA代谢、营养发育和生殖发育中很重要[76]-[78]。这些蛋白质还通过与其他蛋白质相互作用在干细胞的器官发生中发挥作用[79]。干旱响应蛋白基因家族被预测为csn-smR9722的靶标,表明干旱和冷胁迫信号通路之间存在串扰。
miRNA通常通过介导靶mrna的切割而起到基因表达的负调控作用[39或通过抑制它们的翻译[80],靶mrna的切割似乎是植物miRNAs基因调控的主要模式[81]。为了验证csn-miRNA靶基因的性质,研究csn-miRNA如何调控其靶基因,我们对单基因进行RACE,检测并克隆与miRNA加工产物精确对应的mRNA片段。我们总共对6个靶基因进行了rlm -5’race检测,即5个保守mirna的代表性靶基因(图2)6)。这一结果表明,降解分析是一种有效而有力的方法,可以成功地用于验证mirna序列。
结论
本研究基于两种茶树品种YS和BY之间构建的miRNAomes,鉴定出106个已知miRNAs和98个潜在的新miRNAs。使用定制的微阵列,从YS和BY中分别鉴定出18和14个保守的冷响应miRNA家族。从冷处理文库和对照文库中分别鉴定出455个和591个基因作为miRNAs的切割靶点,其中283个靶点存在于两个文库中。RLM-5'RACE程序成功地绘制了6个靶基因的切割位点c . sinensis.GO注释显示,排名靠前的miRNA靶基因与发育过程、转录调控和应激反应有关。这些发现为茶树冷胁迫相关mirna的进一步功能表征提供了有价值的信息.
方法
植物材料与冷胁迫处理
以耐寒茶树品种‘迎爽’(YS)和寒敏茶树品种‘百叶1号’(BY)为材料,在光照(28℃)12 h /暗光照(22℃)条件下(光强1800 Lx photos m)培养−2.s−2),为期20天。为了分析冷胁迫下茶叶的mirna,茶树在4°C下储存1、4、8、12、24和48 h。作为对照,茶树在28°C下储存1、4、8、12、24和48 h。然后将处理和未处理的幼叶收获到液氮中,并在- 80°C下储存直到总RNA提取。
小RNA文库构建及测序
按照说明书,用TRIzol试剂(Invitrogen, Carlsbad, CA, USA)分离总RNA。RQ1 RNase-Free DNase (Promega, Madison, WI, USA)用于去除基因组DNA污染。使用Agilent 2100生物分析仪检测rna的质量和完整性。取等量的对照和6期总rna(4°C处理1、4、8、12、24和48小时)后,将这些样本汇集在一起,构建冷应激小rna文库(CL)。
总RNA采用15%三硼酸edta (TBE)尿素变性聚丙烯酰胺凝胶电泳分离纯化,小RNA区域(15 ~ 30个核苷酸带)切除并恢复。然后将纯化的小rna与5 '接头(Illumina, San Diego, CA, USA)连接,并用Novex 15% tbe -尿素凝胶纯化连接产物(长度为40 - 60个碱基)以去除未连接的接头。随后,将一个3 '适配器(Illumina)连接到5 '连接产物上。在Novex 10% tbe -尿素凝胶(Invitrogen)上进行凝胶纯化后,对两端有接头的RNA片段(长度为70 - 90个碱基)进行逆转录,并使用接头引物进行15次PCR循环。然后用Genome Analyzer GA-I (Illumina, San Diego, CA, USA)对得到的小RNA文库进行测序。
茶树中保守和新颖mirna的鉴定
在去除所有低质量reads、污染物和小于15 nt的reads后,从原始序列中获得干净的全长reads。提取的干净reads用于计算长度分布,并映射到p . trichocarpa基因组序列,以及使用SOAP公开可用的tea EST序列[82]。NCBI GenBank中非编码rna,包括rRNA、tRNA、snRNA和snoRNA的序列匹配(http://www.ncbi.nlm.nih.gov/genbank/),重复(http://www.girinst.org/repbase/update/index.html)及Rfam (http://www.sanger.ac.uk/software/Rfam)数据库被淘汰。独特的miRNA序列与miRBase 19.0中已知的miRNA序列比对(http://www.mirbase.org/),最多不匹配两次。利用RNAfold软件(http://www.tbi.univie.ac.at/RNA/),以确定这些前体是否形成典型的miRNA茎环结构。对剩余的未知rna进行分析,并使用Mireap (http://sourceforge.net/projects/mireap/files/latest/download)。根据最近公布的新型mirna标准筛选新型mirna [20.]。新的miRNA和它们对应的miRNA*形成了一个茎环双工,有少于四个不匹配的碱基,来自相反的茎臂。新的mirna通常使用“miR”前缀来表示mirna,并使用三个字母的前缀来表示物种(例如。csn的代表山茶花。中国)。
miRNA微阵列芯片内容和阵列杂交
miRNA芯片包含3228个与Sanger miRBase release 19.0中列出的miRNA转录本相对应的miRNA探针,其中283个在茶树中发现新的miRNA探针。微阵列检测由服务提供商(LC Sciences, Houston, USA)进行。总rna分别从冷处理和未处理材料4 h、12 h和24 h的叶片样品中分离出来。然后用poly (a)聚合酶将总RNA样品(4 ~ 8 μg)进行3′延伸,并带有poly (a)尾部。将一个寡核苷酸标签连接到聚(A)尾部进行荧光染色。利用微循环泵(Atactic Technologies)在μParaflo微流控芯片上进行杂交过夜[30.]、[83]。在微流控芯片上,每个检测探针包括一个化学修饰的核苷酸编码片段,与miRBase或其他rna中的目标miRNA互补,以及一个聚乙二醇间隔段,将编码片段延伸到远离底物的地方。采用光生试剂化学原位合成方法制备检测探针。通过对探测探针进行化学修饰,平衡了杂交熔化温度。用100 μL 6xSSPE缓冲液(0.90 M NaCl, 60 MM Na)进行杂交2HPO4(6 MM EDTA, pH 6.8),含25%甲酰胺,温度34℃。RNA杂交后,标记偶联Cy3染料通过微流控芯片循环染色。使用激光扫描仪(GenePix 4000B, Molecular Device)收集荧光图像,并使用Array-Pro图像分析软件(Media Cybernetics)进行数字化处理。
数据分析的方法是首先减去背景,然后使用局部加权回归滤波器对信号进行归一化[84]。如果miRNA信号满足以下两个条件,即信号强度大于背景标准差的三倍,并且spot CV <0.5 (CV =信号标准差/信号强度),则miRNA信号被接受为可检测信号。来自胁迫植物和对照植物的每个RNA的四个技术重复的信号使用配对和双尾Student’s进行比较t测试。只有p <0.01的信号才被认为是显著的。采用Cluster 3.0进行聚类分析,采用Heatmap builder和TreeView对热图进行可视化处理[85]。
miRNA表达的qRT-PCR分析
使用mirVana miRNA分离试剂盒(Ambion, Austin, TX, USA)分离低温条件(4°C)处理4、12和24小时的样品中<200 nt的srna。逆转录采用茎环反转录PCR (Stem-loop reverse transcription PCR, RT-PCR)技术,该技术可用于小RNA克隆和多种检测,具有更好的特异性和效率[86]。茎环RT-PCR引物和qRT-PCR引物(附加文件12表S7)设计。使用One Step引物脚本miRNA cDNA合成试剂盒(TAKARA)和Platinum SYBR Green qPCR SuperMix-UDG (Invitrogen)。以5.8S rRNA作为内控[87]。在总反应体积为20 μL的条件下进行qRT-PCR,反应体积为0.5 μL稀释cDNA, 8 μM引物混合物,10.0 μL 2× SYBR Green mix, 8.7 μL ddH2O.在icycle iQ qRT-PCR检测系统(BIO-RAD)中进行反应,扩增条件为:50°C活化2 Min;95℃保温2 Min;然后在95℃下循环15 s, 60℃下循环30 s;最终保温于4°C。循环阈值(CT)定义为荧光通过固定阈值时的分数阶循环数。所有反应均为三次重复。qRT-PCR结果归一化处理如下:根据5.8S基因对照引物反应确定样品CT值并进行标准化处理——ΔΔCT方法计算qRT-PCR实验中基因表达的相对变化[88]。
降解文库构建与目标识别
为了获得潜在的目标mrna,我们从经过冷(+C)和无冷(- C)处理的茶叶中构建了两个降解文库,如前所述[58]、[64]。简而言之,将poly(A)富集的RNA分子分离并连接到含有3 ' MmeI识别位点的RNA寡核苷酸接头上,通过rt生成第一链cDNA,然后使用短链PCR扩增cDNA。为了获得足够数量的DNA,将产物连接到双链DNA接头上,并再次进行凝胶纯化以进行PCR扩增。最终的cDNA文库按照制造商的说明在Illumina GAIIx上纯化和测序。
原始序列读取使用Illumina Pipeline v1.5软件去除适配器序列和低质量的测序读取。提取的长度为20 nt和21 nt的测序reads随后通过CleaveLand管道识别潜在的裂解靶点,如前所述[29]、[31]。降解reads被映射到答:芥和茶树的mRNA和ESTs序列从NCBI (http://www.ncbi.nlm.nih.gov/)。只保留与给定序列完全匹配的序列,并通过添加15 nt的上游序列扩展到35 nt至36 nt。所有结果读取(t-signature)都是反向互补的,并与我们研究中鉴定的miRNA对齐。不匹配的排列不允许超过5次。5′退化序列位置与10′序列重合的比对th保留miRNA的核苷酸并使用先前描述的方法进行评分[89]。根据细胞成分、分子功能和生物学过程对靶点进行筛选和分类。所有确定的目标都进行BlastX分析以寻找相似性。使用氧化石墨烯分析揭示了mirna -基因对生物过程和分子功能的调控网络,如Xie等人先前所述。[qh]90]。
修饰的5 ' RNA连接酶介导的RACE用于定位mRNA切割位点
用Trizol试剂从不同处理和对照的幼叶中提取总RNA。保利(A)+根据制造商的说明,使用PolyA试剂盒(Promega, Madison, WI)从各种混合样本RNA中纯化mRNA。采用GeneRacer Kit (Invitrogen, CA)对RLM-5 ' RACE进行改良后的程序,如前所述[91]。采用GenRacer 5’引物和基因特异性引物进行PCR扩增(表2)2)。采用GeneRacer 5’巢式引物和巢式基因特异性巢式引物进行巢式PCR扩增(表5)2)。通过琼脂糖凝胶电泳分离PCR反应,纯化出适合mirna介导的切割的不同大小的条带(切除的凝胶切片对应的大小范围为~200个碱基对),克隆并测序。
访问日期
本研究的sRNA序列数据已提交给Gene Expression Omnibus (GEO),登录号为NO。GSE61719网址:http://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?token=uvmvkkcixrepvyv&acc=GSE61719.
作者的贡献
XL YZ WF设计并进行实验,YZ XZ XC CS ZZ YW MW WF分析数据,YZ XZ起草稿件,XL监督项目。所有作者都阅读并认可了这份手稿的最终版本。
附加文件
缩写
- microrna的:
-
微
- c . sinensis:
-
茶树
- 前:
-
Argonaute
- RISC:
-
rna诱导沉默复合体
- 存在:
-
实时定量PCR
- 核糖体rna:
-
核糖体核糖核酸
- tRNA:
-
转移核糖核酸
- snoRNA:
-
小核仁RNA
- 核内小rna:
-
小核RNA
- ncRNA:
-
非编码RNA
- MFE:
-
最小自由能
- MFEI:
-
最小自由能指数
- 答:芥:
-
拟南芥
- 李:
-
晚期胚胎发育丰富
- RLM-5的种族:
-
5 ' RNA连接酶介导的RACE
- 走:
-
基因本体论
- sRNA:
-
小核糖核酸
- 美国东部时间:
-
表达序列标签
- NADPH:
-
烟酰胺腺嘌呤二核苷酸2 ' -磷酸还原四钠盐
- 东盟地区论坛:
-
Auxin-responsive因素
- 辅助/ IAA:
-
生长素/吲哚-3-乙酸
- WBP:
-
WW-domain-binding蛋白质
- y:
-
Yingshuang
- 由:
-
Baiye 1
- 此种:
-
Tris-Borate-EDTA
- rt - pcr:
-
反转录PCR
- CT:
-
循环阈值
参考文献
张震,于军,李东,张震,刘峰,周旭,王婷,凌云,苏志:PMRD:植物microRNA数据库。核酸学报,2010,38(增刊1):D806-D813。10.1093 / nar / gkp818。
Kurihara Y, Watanabe Y:通过Dicer-like 1蛋白功能的拟南芥微rna生物发生。[j] .中国科学:自然科学,2004,31(4):12753-12758。10.1073 / pnas.0403115101。
Baumberger N, Baulcombe D:拟南芥ARGONAUTE1是一种选择性招募microrna和短干扰RNA的RNA切割器。中国科学:自然科学版,2005,32(3):11928-11933。10.1073 / pnas.0505461102。
MicroRNAs:基因组学,生物发生,机制和功能。细胞学报,2004,16(2):281-297。10.1016 / s0092 - 8674(04) 00045 - 5。
Sunkar R, Chinnusamy V,朱军,朱建奎:小rna在植物非生物胁迫响应和营养剥夺中的重要作用。植物科学进展,2007,12(7):301-309。10.1016 / j.tplants.2007.05.001。
李波,秦勇,段宏,尹伟,夏霞:干旱胁迫下水稻新mirna和新mirna的全基因组分析胡杨.实验学报,2011,62(11):3765-3779。10.1093 / jxb / err051。
Mahajan S, Tuteja N:《寒冷、盐度和干旱胁迫:综述》。中国生物医学工程学报,2009,35(2):559 - 564。10.1016 / j.abb.2005.10.018。
孙卡荣,朱建科:来自植物的新型和受胁迫调控的microrna和其他小rna拟南芥.科学通报,2004,16 (8):2001-
李柏辉,韩德胜,朱建奎拟南芥冷响应转录组及其调控ICE1.植物细胞学报,2005,17(11):3155-3175。10.1105 / tpc.105.035568。
周欣,王刚,苏德康,朱建科,张伟:植物冷诱导microrna的转录组分析。生物力学学报,2008,37(11):779 -788。
刘红红,田霞,李永军,吴春安,郑春春:基于微阵列的胁迫调控microrna分析拟南芥.RNA。2008, 14(5): 836-843。10.1261 / rna.895308。
张军,徐勇,环强,钟康:深度测序Brachypodium小rna在全球基因组水平鉴定参与冷应激反应的microrna。中国生物医学工程学报,2009,31(1):449- 4186 /1471-2164- 449。
朱建科,孙卡尔等。植物冷胁迫驯化过程中的基因调控。植物抗逆性。2010,Springer,柏林,39-55。10.1007 / 978 - 1 - 60761 - 702 - 0 - _3。
吕德康,白霞,李艳,丁晓东,葛艳,蔡辉,季伟,吴宁,朱永明:水稻冷胁迫响应mirna的微阵列分析。中国生物医学工程学报,2010,31(1):391 - 391。10.1016 / j.gene.2010.03.011。
陈丽,张勇,任勇,徐军,张志,王勇:植物冷响应microrna的全基因组鉴定Populus tomentosa通过高通量测序。生物化学学报,2012,31(2):892-896。10.1016 / j.bbrc.2011.12.070。
Prabu G, Mandal A:茶叶表达序列标签中mirna及其靶基因的计算鉴定(英文)茶树)。基因组学与生物信息学,2010,8 (2):113-10.1016/S1672-0229(10)60012-5。
Das A, Mondal TK:茶叶中保守microrna及其靶点的计算鉴定(茶树)。植物学报,2010,1:77-86。10.4236 / ajps.2010.12010。
Mohanpuria P, Yadav SK:茶叶中新型小rna的表征(茶树l .)。中华生物医学杂志,2012,39(4):3977-3986。10.1007 / s11033 - 011 - 1178 - 3。
丁丹,张丽,王慧,刘志,张志,郑勇:盐胁迫下玉米根系mirna的差异表达。植物学报,2009,31(1):29-38。10.1093 / aob / mcn205。
Meyers BC, Axtell MJ, Bartel B, Bartel DP, Baulcombe D, Bowman JL,曹霞,Carrington JC,陈晓霞,Green PJ:植物microrna的标记标准。植物细胞学报,2008,20(12):3186-3190。10.1105 / tpc.108.064311。
朱启伟,罗玉萍:茶叶中microrna的鉴定及其靶点(英文)茶树)。[J]浙江大学2013: DOI: 10.1631 / jzus。B 1300006,
王晓明,王晓明,王晓明,等。茶叶休眠芽中microrna的表达差异[J]。茶树(l)o . Kuntze]。植物细胞代表2014, DOI 10.1007/s00299-014-1589-4;
核酸折叠和杂交预测的Mfold web服务器。核酸学报,2003,31(13):3406-3415。10.1093 / nar / gkg595。
张斌,潘鑫,Cox S, Cobb G, Anderson T: miRNAs与其他rna的差异证据。细胞与生命科学,2006,63(2):246-254。10.1007 / s00018 - 005 - 5467 - 7。
毛伟,李震,夏霞,李勇,于杰:高通量测序和降解分析相结合的方法揭示了黄瓜中microrna及其靶点的组织特异性表达。科学通报,2012,7 (3):e33040-10.1371/journal.pone.0033040。
王峰,李丽,刘丽,李红,张燕,姚燕,倪铮,高军:白菜中保守和新颖microrna的高通量测序发现(英文)芸苔属植物拉伯l . ssp。学报)。中国生物医学工程学报,2012,31(7):555-563。10.1007 / s00438 - 012 - 0699 - 3。
Fahlgren N, Howell MD, Kasschau KD, Chapman EJ, Sullivan CM, Cumbie JS, Givan SA, Law TF, Grant SR, Dangl JL:高通量测序拟南芥microRNAs: microrna基因频繁出生和死亡的证据。科学通报,2007,2 (2):e219-10.1371/journal.pone.0000219。
米顺,蔡涛,胡勇,陈勇,Hodges E,倪峰,吴磊,李松,周宏,龙成,陈森,汉农广军,祁勇:小rna的分类拟南芥Argonaute复合物由5 '端核苷酸引导。细胞学报,2008,33(3):116-127。10.1016 / j.cell.2008.02.034。
Addo-Quaye C, Eshoo TW, Bartel DP, Axtell MJ:内源性siRNA和miRNA靶点的测序拟南芥degradome。中华生物医学杂志,2008,18(10):758-762。10.1016 / j.cub.2008.04.042。
高翔,古拉利,周霞:原位合成寡核苷酸微阵列。生物工程学报,2004,33(5):579-596。10.1002 / bip.20005。
张建军,张建军,张建军,等。一种利用降解数据寻找裂解小RNA靶点的方法。生物信息学,2009,25(1):130-131。10.1093 /生物信息学/ btn604。
黄健,孙生,徐东,蓝华,孙华,王铮,鲍勇,王杰,唐华,张华:一种tfiia型锌指蛋白赋予转基因水稻多种非生物抗性(英文)栽培稻l .)。植物化学学报,2012,31(3):357 - 357。10.1007 / s11103 - 012 - 9955 - 5。
马凯,肖军,李鑫,张强,连鑫:水稻c3hc4型环指基因家族的序列与表达分析。基因工程学报,2009,44(1):33-45。10.1016 / j.gene.2009.05.018。
Bies-Etheve N, Gaubier-Comella P, Debures A, Lasserre E, Jobet E, Raynal M, Cooke R, Delseny M:胚胎发育晚期丰度(LEA)蛋白家族的基因序列、进化和表达谱分析拟南芥.植物化学学报,2008,32(1):357 - 357。10.1007 / s11103 - 008 - 9304 - x。
李春华,李春华,李春华,等。植物腋芽生长和休眠的调控。植物生理学报,2001,27(4):1405-1413。10.1104 / pp.010841。
Andreasson E, Jenkins T, Brodersen P, Thorgrimsen S, Petersen NH, Zhu S,邱建良,Micheelsen P, Rocher A, Petersen M: mapk激酶底物MKS1在植物防御反应中的调控作用。中华微生物学杂志,2005,24(14):2579-2589。10.1038 / sj.emboj.7600737。
李建军,李建军,李建军,李建军,等。一种新型的核编码蛋白与遗传因子的相互作用拟南芥.生物工程学报,2002,18(2):393 - 394。10.1016 / s0014 - 5793(02) 02388 - 8。
胡特格纳,扎莫里,等。多翻转RNAi酶复合体中的microRNA。科学通报,2002,29(5):556 - 560。10.1126 / science.1073827。
Llave C, Xie Z, Kasschau KD, Carrington JC:一类稻草人样mRNA靶点的定向切割拟南芥microrna。科学,2002,29(9):2053-2056。10.1126 / science.1076311。
唐国华,李建军,李建军,等。植物RNA沉默的生物化学研究进展。基因工程学报,2003,17(4):449 - 463。10.1101 / gad.1048103。
Yekta S, Shih I-h, Bater DP: HOXB8 mRNA的microrna定向切割。科学通报,2004,31(6):594-596。10.1126 / science.1097434。
Kasschau KD, Xie Z, Allen E, Llave C, Chapman EJ, Krizan KA, Carrington JC:病毒抑制因子P1/HC-Pro对RNA沉默的干扰拟南芥发育和miRNA功能。生物医学工程学报,2003,4(2):205-217。10.1016 / s1534 - 5807 (03) 00025 - x。
Lewis BP, Burge CB, Batel DP:保守的种子配对,通常两侧有腺苷,表明成千上万的人类基因是microRNA的靶标。细胞学报,2005,20(1):15-20。10.1016 / j.cell.2004.12.035。
Elbashir SM, Lendechel W, Tuschl T: RNA干扰是由21和22核苷酸RNA介导的。中国生物医学工程学报,2001,25(2):387 - 398。10.1101 / gad.862301。
孙嘉荣,周霞,郑勇,张伟,朱建科:水稻新mirna和候选mirna的高通量测序鉴定。植物学报,2008,31(1):25-10.链接本文:
Pantaleo V, Szittya G, Moxon S, Miozzi L, Moulton V, Dalmay T, Burgyan J:葡萄microrna的高通量测序和降解分析。植物学报,2010,32(6):960-976。
陈丽,任勇,张勇,徐军,孙峰,张志,王勇:热响应性和新型microrna的全基因组鉴定和表达分析Populus tomentosa.中国生物医学工程学报,2012,31(2):369 - 369。10.1016 / j.gene.2012.05.034。
王歌C, C, C, Korir N, Yu H,马Z,方J:深度测序发现小说和守恒的三叶的橙色小分子核糖核酸(柑橘trifoliata)。生物医学工程学报,2010,11(1):431-10.1186/1471-2164- 1131。
王涛,陈丽,赵敏,田青,张文华:小麦干旱响应microrna的鉴定Medicago truncatula通过全基因组高通量测序。中国生物医学工程学报,2011,12(1):367-10.1186/1471-2164- 1267。
徐明军,刘强,Nisbet A,蔡小强,闫超,林荣强,袁志刚,宋华强,何小华,朱小强:植物中microrna的鉴定与表征Clonorchis sinensis对人类健康有重要意义生物医学工程学报,2010,31(1):521-10.1186/1471-2164- 1121。
帅鹏,梁东,张志,尹伟,夏霞:干旱响应型植物的鉴定杨树trichocarpa高通量测序的microRNAs和降解分析的靶标。生物医学工程学报,2013,14(1):233-10.1186/1471-2164-14-233。
王丽,刘华,李东,陈华:玉米种子萌发早期相关microrna的鉴定与表征。中国生物医学工程学报,2011,12(1):154-10.1186/1471-2164- 12.154。
高铮,石涛,罗旭,张震,庄伟,王丽:水稻雌蕊发育相关小rna高通量测序及差异表达microrna分析梅花.中国生物医学工程学报,2012,13(3):371-10.1186/1471-2164- 1371。
Ng KLS, Mishra SK:基于全局和内在折叠度量的基因组伪发夹前体microrna从头分类。生物信息学,2007,23(11):1321-1330。10.1093 /生物信息学/ btm026。
李建军,张建军,张建军,等。一种新型的生物信息学方法拟南芥.基因工程学报,2006,20(24):3407- 34025。10.1101 / gad.1476406。
程艳,龙明:水稻胞浆内nadp -苹果酸酶基因(栽培稻L.)赋予转基因拟南芥耐盐性。生物工程学报,2007,29(7):1129-1134。10.1007 / s10529 - 007 - 9347 - 0。
Vaucheret H, Mallory AC, Bartel DP: AGO1基因的共表达MIR168和AGO1以及ago2对miR168的优先稳定作用。生物化学学报,2006,22(1):129-136。10.1016 / j.molcel.2006.03.011。
引用本文:German MA, Pillay M, Jeong D-H, Hetawal A, Luo S, Janardhanan P, Kannan V, Rymarquis LA, Nobuta K, German R:基于RNA末端平行分析的microRNA-target RNA对的整体鉴定。生物工程学报,2008,26(8):941-946。10.1038 / nbt1417。
Zeba N, Isbat M, Kwon N- ji, Lee MO, Kim SR ., Hong CB:热诱导辣椒C3HC4型RING锌指蛋白基因对转基因烟草生长的影响植物学报,2009,29(4):861-871。10.1007 / s00425 - 008 - 0884 - 0。
Brodersen P, sakvarelidz - achard L, Bruun-Rasmussen M, dunnoyer P, Yamamoto YY, Sieburth L, Voinnet O:植物miRNAs和sirna的广泛翻译抑制。科学通报,2008,32(8):1185-1190。10.1126 / science.1159151。
李建军,陈建军,陈建军,陈建军,陈建军,陈建军,陈建军拟南芥小分子核糖核酸。植物细胞学报,2009,21(6):1762-1768。10.1105 / tpc.108.063412。
Jones-Rhoades MW, Bartel DP:植物microrna及其靶标的计算鉴定,包括胁迫诱导的microrna。生物化学学报,2004,14(6):787-799。10.1016 / j.molcel.2004.05.027。
陈建军,陈建军,陈建军,陈建军。植物早期进化过程中microrna调控的研究进展。植物学报,2007,37(1):13-10.链接本文:
李云峰,郑勇,Addo-Quaye C,张丽,Saini A, Jagadeeswaran G, Axtell MJ,张伟,Sunkar R:水稻microRNA靶点的转录组鉴定。植物学报,2010,32(5):742-759。10.1111 / j.1365 - 313 x.2010.04187.x。
张建军,张建军,张建军,等。蛋白质结构的研究进展。环境中的休眠与抵抗。2010,Springer,柏林,91-108。10.1007 / 978 - 3 - 642 - 12422 - 8 - _6。
Sanchez-Ballesta MT, Rodrigo MJ, Lafuente MT, Granell A, Zacarias L:柑橘中具有体外脱水和冷冻保护活性的脱氢酶是果实黄酮的组成部分,在果实黄酮中高度表达,但在叶片中对寒冷和水分胁迫有响应。农业食品化学,2004,52(7):1950-1957。10.1021 / jf035216 +。
李建军,李建军,李建军,等。水分胁迫下植物体内蛋白质聚集的研究进展。中国生物医学工程学报,2009,32(3):557 - 557。10.1042 / BJ20041931。
张建军,张建军,张建军,张建军,等。豌豆种子线粒体中干枯酶保护蛋白的克隆与表达。植物生理学报,2005,37(1):557 - 557。10.1104 / pp.104.052480。
Reyes JL, Campos F, Wei H, Arora R, Yang Y, Karlson DT, Covarrubias AA:体外冷冻保护过程中亲水性蛋白的功能分析。植物细胞环境,2008,31(12):1781-1790。10.1111 / j.1365-3040.2008.01879.x。
Nakayama K, Okawa K, Kakizaki T, Inaba T:晚期胚胎发生丰度(LEA)相关蛋白的保护作用评价Cor15am在体外的各种压力下。生物工程学报,2008,(6):1642-1642。10.1271 / bbb.80214。
谭玉峰,O 'Toole N, Taylor NL, Millar AH:二价金属离子在植物线粒体中与蛋白质相互作用和氧化应激诱导的呼吸功能损伤中的作用。植物生理学报,2010,32(2):747-761。10.1104 / pp.109.147942。
李建军,李建军,李建军,李建军,李建军。盐碱地盐胁迫对盐碱地生长的影响Asr1(脱落酸胁迫成熟)基因编码锌依赖的dna结合蛋白。中国生物医学工程学报,2004,31(1):373-378。10.1042 / BJ20031800。
金gur, m S, Ghirlando R, Shkolnik D, Shadrin N, Konrad Z, Bar-Zvi D:干旱和锌结合诱导番茄脱落酸胁迫成熟1蛋白从展开向折叠转变。植物生理学报,2007,43(2):617-628。10.1104 / pp.106.092965。
陆鹏军,周晓忠,沈敏,陆kp: WW结构域作为磷丝氨酸或磷苏氨酸结合模块的功能。科学通报,1999,31(5):1325-1328。10.1126 / science.283.5406.1325。
Jadwin JA, Ogiue-Ikeda M, Machida K:模块化蛋白结构域在蛋白质组学中的应用。生物工程学报,2012,35(6):556 - 556。10.1016 / j.febslet.2012.04.019。
程燕,加藤宁,王伟,李军,陈旭:两种RNA结合蛋白HEN4和HUA1参与了玉米的加工无性生殖的Pre-mRNA在拟南芥.生态学报,2003,4(1):53-66。10.1016 / s1534 - 5807(02) 00399 - 4。
Mockler TC,余霞,Shalitin D, Parikh D, Michael TP,刘军,黄军,Smith Z, Alonso JM, Ecker JR:花期调控拟南芥通过K同源结构域蛋白[j] .中国科学:自然科学,2004,31(4):12759-12764。10.1073 / pnas.0404552101。
josise Ripoll J, Ferrándiz C, Martínez-Laborda A, Vera A:胡椒一个新的k同源结构域基因,调控植物营养和雌蕊的发育拟南芥.中国生物医学工程学报,2006,31(2):346-359。10.1016 / j.ydbio.2005.10.037。
刘建军,刘建军,刘建军,等。玉米粗皮的研究进展拟南芥同源物不对称LEAVES1与HIRA(一种预测的组蛋白伴侣)相互作用,在器官发生过程中维持knox基因沉默和确定性。植物细胞学报,2005,17(11):2886-2898。10.1105 / tpc.105.035477。
陈曦:一种MicroRNA作为aptala2的翻译抑制因子拟南芥花的发育。科学通报,2004,33(6):1222 - 1225。10.1126 / science.1088060。
孙卡R, Girke T, Jain PK,朱军:水稻microrna的克隆与鉴定。植物细胞,2005,17(5):1397-1411。10.1105 / tpc.105.031682。
Hafner M, Landgraf P, Ludwig J, Rice A, Ojo T, Lin C, Holoch D, Lim C, Tuschl T:利用cDNA文库测序技术鉴定microrna和其他小调控rna。方法,2008,44(1):3-12。10.1016 / j.ymeth.2007.09.009。
朱强,洪安,盛宁,张翔,Matejko A, Jun K-Y, Srivannavit O, Gulari E,高翔,周翔:μParaflo™核酸和蛋白质分析用生物芯片。微阵列。Humana出版社,新泽西;2007:287 - 312。10.1007 / 978 - 1 - 59745 - 304 - 2 - _19。
Bolstad BM, Irizarry RA, strand M, Speed TP:基于方差和偏差的高密度寡核苷酸阵列数据归一化方法的比较。生物信息学,2003,19(2):185-193。10.1093 /生物信息学/ 19.2.185。
李建军,李建军,李建军,等。基因组表达模式的聚类分析。科学通报,1998,35(5):863- 868。10.1073 / pnas.95.25.14863。
陈超,Ridzon DA, Broomer AJ,周忠,Lee DH, Nguyen JT, Barbisin M,许宁玲,Mahuvakar VR, Andersen MR:茎环RT-PCR技术的实时定量。核酸学报,2005,33 (20):e179-e179。10.1093 / nar / gni178。
吕松,孙艳华,蒋维林:杨树逆境响应性microrna。植物科学学报,2008,35(1):391 - 391。10.1111 / j.1365 - 313 x.2008.03497.x。
Schmittgen TD, Livak KJ:比较CT法分析实时PCR数据。自然科学学报,2008,30(6):1101-1108。10.1038 / nprot.2008.73。
谢志强,谢志强,陈志强,陈志强,等。植物siRNA生物发生过程中microrna调控的研究进展。生物医学工程学报,2005,21 (2):207-10.1016/j.cell.2005.04.004。
谢峰,Frazier TP,张波:马铃薯microrna及其靶点的鉴定、表征和表达分析[j]。茄属植物tuberosum)。中国生物医学工程学报,2011,32(1):444 - 444。10.1016 / j.gene.2010.09.007。
宋超,方健,李霞,刘宏,Thomas CC:柑橘27个保守microrna的鉴定与特性。植物学报,2009,23(2):671-685。10.1007 / s00425 - 009 - 0971 - x。
致谢
本研究得到国家自然科学基金项目(31370688,31470690,31370014)、江苏省科技计划项目(BE2009313-1, BE2011319)、苏州市科技计划项目(SZGD201067, WNZ1002)资助。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们没有竞争利益。
电子补充资料
12870 _2014_271_moesm2_esm.pdf
附加文件2:图S1。:Mature and precursor sequences and the predicted stem-loop structures of newly identified miRNAs from制成。(pdf 797kb)
12870 _2014_271_moesm3_esm.pdf
附加文件3:表S2。:Novel miRNAs and potentially novel miRNAs identified from predicted RNA hairpins inc . sinensis冷应力.(pdf 114kb)
12870 _2014_271_moesm4_esm.tiff
附加文件4:图S2。:t-plot for targets of the known miRNAs found in + C and -C libraries ofc . sinensis.签名的丰富性贯穿整个文本的长度。箭头表示与mirna定向切割一致的特征。(tiff 1mb)
12870 _2014_271_moesm5_esm.tiff
附加文件5:图S3。:t-plot for targets of the new miRNA candidates found in + C and -C libraries ofc . sinensis.签名的丰富性贯穿整个文本的长度。箭头表示与mirna定向切割一致的特征。(tiff 1mb)
12870 _2014_271_moesm6_esm.pdf
附加文件6:表S3。:Relative expression analysis of cold-responsive miRNAs in ‘Yingshuang’. The threshold ofp数值设置为0.01,表示***p值小于0.0001,**表示p值从0.0001到0.001,*表示p取值范围为0.001 ~ 0.01。(pdf 167kb)
12870 _2014_271_moesm7_esm.pdf
附加文件7:表S4。:Relative expression analysis of cold-responsive miRNAs in `Baiye 1’. The threshold ofp数值设置为0.01,表示***p值小于0.0001,**表示p值从0.0001到0.001,*表示p取值范围为0.001 ~ 0.01。(pdf 252kb)
12870 _2014_271_moesm8_esm.pdf
附加文件8:图S4。:微阵列analysis of the known and new miRNAs from tea plant cultivar `Yingshaung’ treated with cold and cold-free. (PDF 8 MB)
12870 _2014_271_moesm9_esm.pdf
附加文件9:图S5。:微阵列analysis of the known and new miRNAs from tea plant cultivar `Baiye 1’ treated with cold and cold-free. (PDF 4 MB)
12870 _2014_271_moesm10_esm.pdf
附加文件10:表S5。:Targets for conserved miRNAs fromc . sinensis冷处理(+C)和不冷处理(- C)。(pdf 376kb)
12870 _2014_271_moesm11_esm.pdf
附加文件11:表S6。:Targets for new miRNA candidates fromc . sinensis冷处理(+C)和不冷处理(- C)。(pdf 297kb)
12870 _2014_271_moesm12_esm.pdf
附加文件12:表S7。:Sequences of primers used for the reverse transcription and Quantitative real-time PCR experiments. (PDF 81 KB)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。
本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。
如欲查阅本许可证副本,请浏览https://creativecommons.org/licenses/by/4.0/.
创作共用公共领域免责声明(https://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
张勇,朱晓东,陈晓东。et al。茶树冷响应microrna的鉴定与表征(茶树)和它们的靶标,使用高通量测序和降解分析。BMC Plant Biol14日,271(2014)。https://doi.org/10.1186/s12870-014-0271-x
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-014-0271-x
关键字
- 茶树
- 微
- 积极响应
- 微阵列
- 目标识别