摘要
背景
异源多倍体的形成由杂交和染色体加倍两个过程组成。杂交使不同的基因组在同一细胞内结合,在这一过程中发生基因组“休克”和不稳定,而染色体加倍则导致基因组剂量加倍和重建。近年来的研究表明,小rna在维持基因组的重建和稳定方面发挥着重要作用。然而,迄今为止,小rna在广泛杂交和染色体加倍过程中的作用尚不清楚,这对于阐明多倍体化机制至关重要。因此,在异体二倍体和其异体四倍体形成过程中,评估了遗传和DNA甲基化改变以及siRNA和miRNA的变化芸苔属植物拉伯和芸苔属植物黑质在本研究中。
结果
表型分析表明,异源四倍体与亲本及异源二倍体相比具有较高的杂种优势。甲基化敏感扩增多态性(methylation-sensitive amplification polymorphism, MSAP)分析表明,同种异体二倍体甲基化模式的变化比例显著高于同种异体四倍体,亲本DNA甲基化比例高于同种异体二倍体和同种异体四倍体。小rna检测结果表明,与亲本相比,异源二倍体和异源四倍体中miRNAs的表达量增加,而siRNAs的表达量与亲本相比有增有减b·拉伯和b .黑质,分别。此外,miRNAs的百分比随着多倍体水平的增加而增加,而siRNAs和DNA甲基化改变的百分比随着多倍体水平的增加而降低。此外,qRT-PCR分析表明,靶基因的表达水平被表达的miRNAs负校正。
结论
研究表明,siRNAs和DNA甲基化在维持基因组稳定形成异体四倍体中起着重要作用。miRNAs调控基因表达,诱导表型变异,可能在异体四倍体杂种优势的发生中起重要作用。本研究结果为阐明异体四倍体相对于亲本和异源二倍体具有生长优势提供了新的信息。
背景
广泛的杂交和多倍体化是植物进化中常见的现象,可导致新物种的形成[1] - [4].宽交杂交种通常比亲本表现出更旺盛的生长,这一效应主要表现在耐旱性、抗虫害性、花期、器官大小和生物量等因素的增加[5] - [7].此外,多倍体表现出二倍体祖细胞中没有的新特征[8].例如,同种异体四倍体棉花(基因组:AADD)产生更丰富和更高质量的纤维,这种效果来自于它们的AA和DD现存的二倍体物种[9].然而,宽杂交也表现出不育的缺点,正如宽杂交组合所观察到的b·拉伯和b . oleracea[10].然而,尽管有了这一发现,多倍体的生长和适应性优势一直是一个令人困惑的现象,其潜在的分子机制是植物育种中最有趣的课题之一。
异源多倍体的形成包括两个过程,即杂交和染色体加倍。杂交涉及同一细胞中不同的基因组组合,基因组经历“基因组休克”,而染色体加倍并重组基因组剂量[11]、[12].最近的研究表明,小rna,特别是24-nt siRNAs,在基因组重建和稳定中发挥着重要作用[13].24-nt siRNAs的作用主要体现在两个方面。第一个方面是转座子和重复序列的修饰,以维持基因组的稳定性,这是由rna依赖的DNA甲基化介导的,另一个方面是独联体-通过基因附近区域(如启动子表达区)的转座子基因片段调控基因表达[14] - [18].在F1可能导致表型和基因组不稳定拟南芥异源四倍体(13]、[19].种间杂交拟南芥时,F1异四倍体,但F7异体四倍体,其中DNA和染色质被显著修饰[13].然而,在小麦中,与在亲本中获得的相比,六倍体中24-nt siRNA转录本的数量显著减少,并且这种减少伴随着DNA链CpG岛甲基化水平的降低[20.].因此,这些研究得出结论,DNA甲基化水平的降低可能是异体多倍体早期基因组不稳定的原因之一[21]、[13].这种随着多倍体水平增加而改变的现象表明,siRNAs可能在染色体加倍后的基因组重建和稳定中发挥关键作用。然而,关于sirna在广泛杂交(不同基因组结合)和染色体加倍(基因组剂量加倍)过程中如何发挥这一作用,我们知之甚少。
miRNAs是基因表达反式调节的主要介质[22].mirna介导的基因沉默是转录后基因调控的重要策略[23]、[24].此外,mirna在进化中是保守的,但在多倍体化中变得活跃[25]、[13].miRNA表达水平的改变会影响靶基因的表达,这种影响被认为是导致多倍体表型变异的主要原因之一[21]、[26]、[27]、[13].在拟南芥,异体四倍体的miRNAs数量高于同源四倍体的亲本[13].在六倍体小麦的合成中也发现了类似的现象[20.]: mirna的数量随着倍性水平的增加而增加,这种效应与基因剂量平衡假说无关。这一现象表明,其他机制,如独联体-表观遗传调控,可能存在。因此,作为非编码rna的产物的小rna参与了基因表达的调节,并已成为异源多倍体化过程中基因表达的重要因素。然而,关于广泛杂交和染色体加倍过程中mirna的变化及其对基因表达和表型变异的调控尚不清楚,这些数据对于阐明杂种优势的机制至关重要。
在之前的研究中,我们进行了广泛的杂交b·拉伯(基因组:AA, 2n = 20)和b .黑质(基因组:BB, 2n = 16),获得了一个异源二倍体(基因组:AB)和异源四倍体(基因组:AABB)。此外,我们发现,与广泛杂交相比,染色体加倍导致更高水平的遗传和表型变异[28].本研究首先利用序列相关扩增多态性(SRAP)和甲基化敏感扩增多态性(MSAP)分析了异源二倍体和异源四倍体,确定了宽杂交和染色体加倍在遗传变化和表观遗传改变方面的差异。其次,通过小rna的高通量测序分析异源二倍体和异源四倍体,确定小rna在这两个过程中发生的变化。将不同基因组组合,将基因组剂量加倍,评估不同多倍体水平下siRNA与DNA甲基化之间的相关性。第三,分析已知miRNAs及其靶基因的不同表达水平,探讨miRNAs及其靶基因如何影响异源二倍体和异源四倍体的不同表型。
结果
亲本及其杂交种表型分析
在我们之前的研究中,广泛的杂交b·拉伯(基因组AB)和b .黑质(基因组AA),得到异源二倍体(基因组AB)和异源四倍体(基因组AABB)。我们的目的是确定广泛杂交和他们的父母之间的表型差异。比较了同种异体二倍体和同种异体四倍体及其亲本的性状(图1和2).结果表明,异体四倍体的叶长和花大小均高于亲本和异源二倍体(图)1和2).在我们之前的研究中,我们发现异源四倍体比它们的亲本和异源二倍体有更大的活力[28].由此可见,异体四倍体与亲本和异源二倍体相比具有较高的杂种优势。
亲本及其杂交后代的DNA甲基化模式
为了阐明与杂交和多倍体化过程相关的表观遗传机制,采用甲基化敏感扩增多态性(MSAP)分析方法对亲本及其异源二倍体(AB)和异源四倍体(AABB)进行了分析。双重限制治疗后EcoR我/Msp我或EcoR我/下丘脑-垂体-肾上腺轴的II,扩增片段被分为四种类型之一:(a)所有样本中非甲基化,(b)所有样本中甲基化,(c)与亲本相比,杂种中去甲基化,(d)与亲本相比,杂种中超甲基化(附加文件)1).
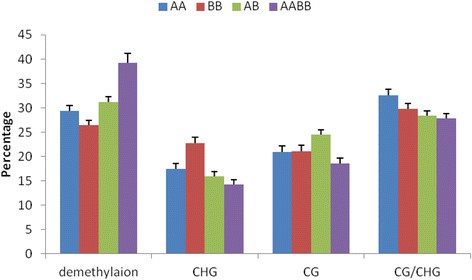
在这项研究中,使用36对引物获得了1449个可重复和清晰的位点(附加文件)2).根据亲本与同种异体二倍体和同种异体四倍体的变异模型,将1449个基因座分为4大类(a-d),包括60大类(附加文件)1).A组AB和AABB的单型位点分别占12.22%和12.08%。在B组中,11.94%的多态性位点在AB和AABB中特异性发现。C组中,AB和AABB分别有18.91%和28.64%的多态性位点特异性存在。与亲本相比,D组位点的DNA甲基化改变率分别为AB组的56.94%和AABB组的48.10%。AB和AABB在甲基化模式上有显著差异。在DNA甲基化状态方面,异源二倍体、异源四倍体及其亲本之间的比例表现出显著差异(附加文件)1).此外,与AABB相比,AB中CG甲基化程度较高(24.50%)(图3.和附加文件1).由此可见,AB的DNA甲基化改变明显高于AABB。此外,遗传研究发现,除了新片段外,两种类型的片段可用于估计异源二倍体和异源四倍体的基因组变化。AB组和AABB组的遗传改变比例分别为10.32%和21.41%(图2)4和附加文件3.).因此,与AB相比,AABB的遗传变化比例明显更高。
小rna的高通量测序
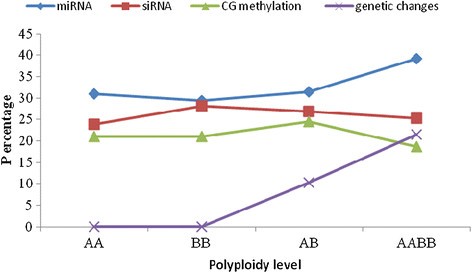
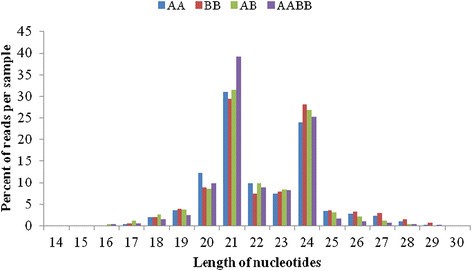
制备了一个小的RNA文库,用于分析亲本及其同种异体二倍体和同种异体四倍体。从四个文库的小RNA测序中获得了6000万个reads(附加文件)4).共获得41,810,504个reads,其中41,664,822个reads是高质量的,对应于28,426,693个唯一序列标签。小RNA的大小从18到30 nt不等,其中包括两类突出的21 nt和24 nt长小RNA(图5).21-nt类主要对应mirna,而24-nt类则对应siRNAs [29].24nt长小rna在亲本文库和AB文库中最多,而21nt长小rna在AABB文库中最多。有趣的是,miRNAs相对于总小rna的数量随着多倍体水平的增加而增加:AA的最低比例为30.9%,BB为29.34%,AB为31.44%,AABB为39.22%。然而,随着多倍体水平的增加,siRNAs相对于总小RNA的数量减少:AA的最高比例为23.93%,BB为28.14%,AB为26.90%,AABB为25.23%(图2)4).此外,总小rna在AA/AB中表现出81.31%的高互作水平,唯一小rna在AA/AB中表现出15.34%的高互作水平(附加文件)4).然后将基因组匹配的小RNA标记聚类到四个文库中的几个RNA类别(如已知mrna、重复相关RNA、rrna、tRNAs、snrna和snoRNAs)(附加文件)4).此外,小rna排序为unann rna的比例很高(AA为44.81%,BB为44.23%,AB为48.86%,AABB为53.55%)。重复相关的sRNAs在唯一标签和总标签中均按照LTR/Copia: 0、LTR/Copia: 1、LTR/Gypsy: 0和LTR/Gypsy: 1进行匹配。出乎意料的是,与AB相比,AABB中所有四种类型的重复相关sRNAs的积累水平都较低(补充文件)5).在这四种类型中,21-nt sRNAs的积累量高于24-nt sRNAs。
已知的microrna
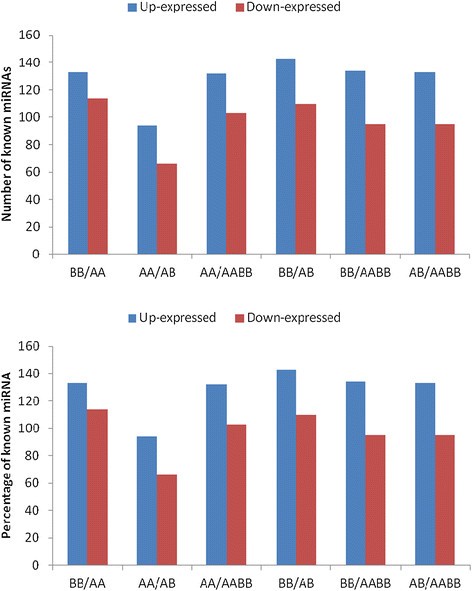
为了识别父母及其异源二倍体和异源四倍体中的保守mirna,使用Blastn对miRBase V17.0版本进行搜索,寻找长度为18-23个核苷酸的小rna。分别在AA和BB文库中发现的22,954和22,716个独特序列(2,526,482和2,176,470 reads)被注释为miRNA候选。在AB和AABB库中分别发现了24,143和23,061个独特序列(2,183,129和2,524,964个reads)(附加文件4).四个样本中已知mirna的表达通过绘制日志来证明2-ratio(附加文件6).结果显示有320个差异表达mirna:分别在BB/AA、AA/AB、AA/AABB、BB/AB、BB/AABB和AB/AABB中有133、94、132、143、134和133个上调mirna和114、66、103、110、95和95个下调mirna(图6).这些发现在四个图书馆之间有显著差异。在我们的研究中,进一步的分析分别在AA、BB、AB和AABB文库中鉴定出1235、2967、1189和2651个保守miRNAs,它们分别属于68个植物科7).
小说microrna
4个样本中新mirna的表达通过绘制日志来证明2-ratio(附加文件6).结果显示,在BB/AA、AA/AB、AA/AABB、BB/AB、BB/AABB和AB/AABB中,52种新型mirna分别为20、11、29、13、27和24种,上调mirna和下调mirna分别为16、16、7、17、12和7种(图7).这些发现在四个图书馆之间有显著差异。
qRT-PCR分析mirna及其靶基因
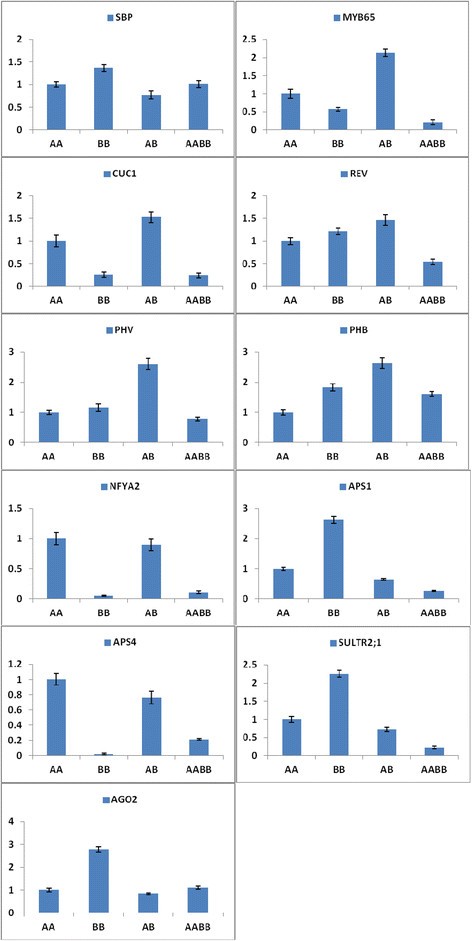
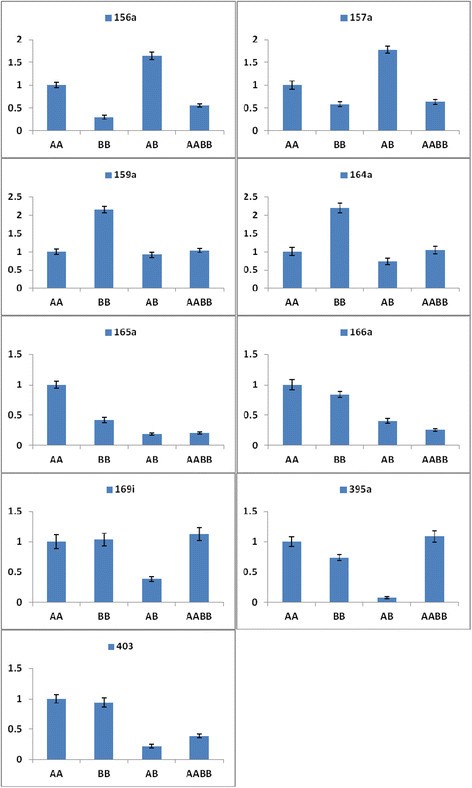
许多miRNA靶标在其表达调控中发挥重要作用。预测差异表达的mirna的目标,以阐明功能和表型之间的关系。该预测揭示了总共641个已知mirna和3734个靶基因:AA、BB、AB和AABB中分别有158、160、159和164个已知mirna和895、972、895和972个靶基因(附加文件)6).此外,在AA、BB、AB和AABB中共检测到68个新miRNAs和225个靶基因:分别为11、17、14和56个新miRNAs和49、53、20和103个靶基因(附加文件)6).此外,我们对涉及不同营养和生殖功能的9个mirna和11个靶基因进行了定量分析。此外,与AABB相比,AB中靶基因(MYB65、CUC1、PHV、PHB、REV、NFYA2、APS1、APS4和SULTR2:1)的表达水平更高。但AABB中SBP和AGO2的表达水平高于AB(图8).虽然AB中相应的各种mirna (miR159a、miR164a、miR165a、miR169i、miR395a、miR403)的累积丰度较AABB低,但AB中miR156a和miR157a的水平较AABB高(图9).此外,在AABB和AB中,只有miR165a、miR166a和miR395a与靶基因(REV、PHV和APS1、SULTR2;1)分别无负相关。因此,本研究中显著表达的miRNAs的丰度对靶标的表达水平进行了负校正。
讨论
宽杂交和多倍体表现出不同的DNA甲基化模式
在本研究中,同种异体二倍体(AB)和同种异体四倍体(AABB)的siRNAs和DNA甲基化模式有显著差异。DNA甲基化由24-nt siRNAs介导,这些siRNAs来源于重复DNA、转座子、基因间区和基因区[24]、[30.].根据小rna的长度分布,24-nt siRNAs的范围从26.90% (AB)到25.23% (AABB)(图5).重复相关的siRNAs在LTR(逆转录转座子)上匹配,与AABB相比,AB中显示出更高的水平5).LTR可以通过杂交重新激活,这已经被先前的几项研究所证明[31]、[32].因此,可以得出一个假设,反转录转蛋白激活的程度取决于广泛的杂交。因此,AB和AABB的基因组剂量调控可能呈现不同的模式。
DNA甲基化结合转座因子的激活被认为是siRNAs在杂交和多倍体化过程中介导的表观遗传变化的稳定机制[13]、[33] - [35].sirna在异源多倍体中维持基因组稳定性,以响应基因组休克[13].由此可以推测,当AB面临基因组休克时,siRNAs和DNA甲基化有助于AABB维持基因组的稳定性。此外,siRNAs水平的降低在很大程度上与基因相关,基因与siRNAs水平的改变相关,并与DNA甲基化和表达水平的变化相关[36].在本研究中,与异源二倍体相比,同种异体四倍体中检测到的siRNAs和DNA甲基化较低。因此,有人提出siRNAs在维持同种异体四倍体的基因组稳定性方面起着关键作用。
广泛杂交和多倍体过程中siRNA和miRNA的变化
sirna和miRNAs在异源多倍体形成早期诱导快速动态变化[13].本研究通过高通量测序发现的最丰富的小rna被鉴定为miRNAs和siRNAs,通过miRNAs和siRNAs的组成来评估,它们的长度通常分别为21-nt和24-nt [23].与miRNAs相对应的小rna的相对数量随着多倍体水平的增加而增加(图4).相反,转座子对应的siRNAs相对数量随着多倍体水平的增加而减少(图4).类似地,Cantu等人。37]的研究表明,与四倍体相比,六倍体中转座子对应的siRNAs水平较低。此外,表观遗传改变的相对数量随着多倍体水平的增加而减少(图4).Kenan-Eichler等人。[20.]也报道了六倍体中sirna和表观遗传变化的百分比下降,而miRNA水平升高。因此,miRNA的表达随着多倍体水平的增加而增加,而siRNA和表观遗传改变水平随着多倍体水平的增加而降低。此外,这种倍性依赖对基因组组成不敏感,但对剂量敏感,例如AB和AABB,它们在不同剂量(2×对4×)下具有相同的两个基因组(A和B),导致它们表达不同的小rna谱。
mirna及其靶基因在异体二倍体和异体四倍体中的表达
miRNAs作为基因表达的负调控因子,在影响分生组织、叶、根和花序的多种发育过程中发挥着显著的扩展作用[38].进化保守的miR164、miR165和miR166调控叶片的发育,有助于叶片形态的构建。miR164、miR165和miR166的过表达降低了所有CUC1、PHB、PHV和REV基因的水平,增加了SAM的发生,对叶片发育有影响[39] - [42].同样,与AB相比,AABB的miR164a、miR165a和miR166a水平较高,CUC1、PHB、PHV和REV水平较低(图9和8).在我们之前的研究中,AB和AABB在叶长和叶宽方面表现出显著不同的表型(图2) [28].
在营养到生殖阶段,miR156、miR157、miR159和miR169的靶标参与了花分生组织特征基因的激活。在拟南芥,随着发育的进行,SAM中miR156/miR157水平的降低和SPLs的增加导致花分生组织身份基因的激活[43]、[44].miR169的高表达水平对NFYA2下游花的时间和发育有积极影响[42]、[43]、[45]、[46].同样,在我们的表型研究中,AABB的花发育比AB高(图2,9,8).此外,miR159的过表达导致开花延迟,这与MYB水平的降低有关[47] - [49].在我们的研究中,与AB相比,AABB的开花时间延迟(图9和8和附加文件8).
来自不同植物的大量mirna已被鉴定为对金属胁迫的响应[50] - [52].最近的研究表明,miR395受硫饥饿诱导,并调节低亲和硫酸盐转运蛋白(SULTR2;1)和三种ATP硫酸化酶(包括APS1和APS4) [50]、[53] - [55].此外,过表达miR395的转基因植物在植株芽中积累了更多的硫酸盐,这表明miR395通过靶向APS基因和SULTR2参与了硫酸盐分配的调控;1 [55].在我们的研究中,与AB植物相比,AABB植物发现miR395过表达,其靶基因(APS1、APS4和SULTR2;1)表达较低(图9和8).这些结果表明,AABB植株对硫酸盐缺乏和重金属胁迫具有一定的耐受性。前期研究表明,AGO2 mRNA可被miR403靶向[54]、[56].此外,mirna及其靶标的调控可能导致异体多倍体出现新的表型[13].此外,与AB植物相比,AABB植物表现出更高的AGO2水平(图8).综上所述,这些数据表明,miRNAs在异体四倍体中调节基因表达并诱导表型变异,如杂种优势。
本研究探讨了小rna在大杂交和多倍体之间的作用b·拉伯和B黑质.不同mirna在异体二倍体和异体四倍体中表现出不同的表达水平,表现出表型变异。然而,一些问题仍然是难以捉摸的,包括非加性表达的miRNAs和siRNAs如何影响生长和发育性状,如叶片形状、植物高度、生物量、开花时间和同种异体二倍体和同种异体四倍体的适应性,以及siRNAs和DNA甲基化是否以及如何在这一过程中发挥作用。因此,对同种异体二倍体和同种异体四倍体的进一步研究是必要的。
结论
本研究探讨了小rna在广谱杂交和异体多倍体化中的作用芸苔属植物拉伯(基因组:AA)和芸苔属植物黑质(基因组:BB)。当A基因组与B基因组交叉时,siRNA水平相对于它们的父母增加或减少;b·拉伯和b .黑质而DNA甲基化水平相对于他们的父母有所增加。当基因组AB加倍时,同种异体四倍体的siRNA和DNA甲基化水平较其异体二倍体降低。当A基因组与B基因组交叉时,miRNA水平相对于它们的父母有所增加。当基因组AB加倍时,与异源二倍体相比,同种异体四倍体的miRNA水平增加。这一结果表明,siRNAs、DNA甲基化和miRNA通过调控小RNA水平在维持基因组稳定性方面发挥了关键作用。此外,大多数mirna在异体四倍体中高度过表达,这可能是由杂种优势诱导的,如miR159、miR169,以及miR164、miR165和miR166,这些mirna在异体四倍体的花和叶发育中起主要作用。综上所述,本研究的结果表明,siRNAs和miRNAs在同种异体四倍体中保持了基因组和表型的稳定性。因此,目前的研究结果可能为阐明小rna对异源多倍体形成的影响提供了新的信息。
方法
植物材料
广泛杂交之间b·拉伯(♀,基因组:AA)和b .黑质(♂,基因组:BB)得到异源二倍体(F1,基因组:AB),随后是异体四倍体(F1,基因组:AABB)通过用0.2%秋水仙碱处理异源二倍体16小时获得,如我们之前Ghani等人报道的研究所述,[28].同种异体四倍体自交后,F2获得异体四倍体(附加文件8).在22/18°C(昼夜)、光照16小时的生长室中,所有的植物都在蛭石与30%土壤混合的环境中生长。每种类型的3株植物在播种后45天营养期采集叶片,分析其遗传和表观遗传变化。
本研究使用20对引物(附加文件)进行序列相关扩增多态性(SRAP)分析2)按上述方法[57].改良版的CTAB方法用于提取基因组DNA [58].为了获得可重复和清晰的条带模式,每个扩增重复三次,只对显示一致扩增的条带进行评分。
MSAP分析
甲基化敏感扩增多态性(MSAP)分析如Xiong所述等艾尔。59].它包含双酶切(EcoRI, HpaII/MspI),适配器连接,预扩增和选择性扩增。用于选择性扩增的引物包含三个选择性核苷酸(附加文件)2).在数据分析中,1和0分别表示一个片段在MSAP中的出现和消失。此外,类型(1,1)表示在两个Msp我和下丘脑-垂体-肾上腺轴的II车道,类型(1,0)仅表示片段的出现下丘脑-垂体-肾上腺轴的II车道,类型(0,1)表示片段的外观仅在MspI巷,类型(0,0)表示在两个Msp我和下丘脑-垂体-肾上腺轴的二道。为了获得可重复和清晰的条带模式,每个扩增重复三次,只对显示一致扩增的条带进行评分。
小rna的高通量测序
以确定小RNA种群B. rapa, B. nigra和它们的祖细胞(包括异源二倍体和异源四倍体),四个基因型的叶片产生了小的RNA文库,即:b·拉伯(AA),b .黑质(BB)、异源二倍体(AB)和异源四倍体(AABB)。根据制造商说明书,使用Trizol试剂(Invitrogen, Carlsbad, CA, USA)分离总RNA,并将其送往北京华大基因研究院(BGI)进行测序。对原始数据处理后,洁净序列进行进一步分析,如前所述[60].通过长度分布和常见序列分析干净reads。然后将这些序列与所有植物的基因组进行匹配,以识别重复相关的sRNAs并评估sRNAs的表达。我们使用miRBase鉴定了已知的mirna。为了揭示mirna的差异表达,我们对所有文库中mirna的丰度进行了归一化。比较两个库之间的归一化值,并以折叠变化(fold-change = log2(处理/对照)的形式计算。此外,假定值使用先前描述的公式[61].为了预测靶点,分析了基因功能,包括生物过程、细胞成分定位和基因的分子功能。小RNA序列数据存放在GEO中,登录号为GSE61872 (http://www.ncbi.nlm.nih.gov/geo).
利用定量RT-PCR分析mirna和靶基因的表达
用Stem-loop qRT-PCR对miRNA进行了定量分析,结果显示表达差异显著。通过高通量测序获得9个mirna的序列,并使用Primer软件设计引物。然后,利用互补设计的引物将2 μg总RNA转化为cDNA。采用poly (A) tail qRT-PCR方法定量分析目的基因的表达。利用寡聚(dT)引物将2 μg总RNA转化为cDNA。使用GenScript设计了特定的正向和反向引物。采用ABI STEPONE Real-Time PCR扩增25 μl,其中SYBR 12.5 μl, cDNA 2.0 μl,正向引物1.0 μl,反向引物1.0 μl, 8.5 μl消毒蒸馏水。循环条件是95°C持续30秒,然后在95°C和60°C分别进行40次5秒和30秒的循环。所有反应均重复三次,分别以U6基因和25s rRNA作为miRNAs和靶基因的定量参考。本研究中使用的引物见附加文件2.使用ABI STEPONE自动获得阈值周期(CT)值,使用CT将每个基因的折叠变化量化为相对数量(RQ)值(2-ΔΔCt)。
支持数据的可用性
支持本文结果的序列数据集可在GEO中获得,登录号为GSE61872 (http://www.ncbi.nlm.nih.gov/geo).
附加文件
参考文献
- 1.
Rieseberg LH, Willis JH:植物物种形成。科学通报,2007,27(3):344 - 344。10.1126 / science.1137729。
- 2.
李志刚,李志刚,李志刚:多倍体植物的基因组可塑性与多样性。科学通报,2008,32(3):344 - 344。10.1126 / science.1153585。
- 3.
Soltis PS, Soltis DE:杂交在植物形成中的作用。植物学报,2009,30(4):366 - 366。10.1146 / annurev.arplant.043008.092039。
- 4.
Wood TE, Takebayashi N, Barker MS, Mayrose I, Greenspoon PB, Rieseberg LH:维管植物多倍体物种形成的频率。自然科学进展,2009,26(3):366 - 366。10.1073 / pnas.0811575106。
- 5.
陈志军:多倍体和杂种优势的分子机制。植物科学进展,2010,15:57-71。10.1016 / j.tplants.2009.12.003。
- 6.
陈s, Nelson MN, Chevre M, Jenczewski E, Li Z, Mason AS,孟J, Plummer JA, Pradhan A, Siddique KHM, Snowdon RJ, Yan G, Zhou W, Cowling WA:三基因组桥芸苔属植物改进。植物学报,2011,30(6):524-547。10.1080 / 07352689.2011.615700。
- 7.
耿xx,陈森,Astarini IA,严国杰,田娥,孟J,李志智,葛晓华,Nelson MN, Mason AS, Pradhan A,周文杰,Cowling WA:新三基因组双单倍体芸苔属植物衍生自不同种间杂交的中国生物医学工程学报,2013,26(3):344 - 344。10.1007 / s11240 - 013 - 0292 - 4。
- 8.
多倍体与分布:多倍体生物学相关性。基础生命科学第13卷。编辑:Lewis WH。施普林格,纽约;1980:45-60。1
- 9.
温德尔JF,克朗恩RC:多倍体和棉花的进化史。王志强,2003,(3):349 - 349。10.1016 / s0065 - 2113(02) 78004 - 8。
- 10.
马立克,伊斯梅尔先生,拉菲米,拉赫曼M:合成芸苔属植物显著L:形态性状、产量属性和产量的发展与研究。科学W J2012.doi: 10.1100 / 2012/416901。
- 11.
McClintock B:基因组对挑战反应的重要性。科学通报,1984,26(3):344 - 344。10.1126 / science.15739260。
- 12.
Comai L:多倍体的优点和缺点。中国农业科学,2005,30(6):366 - 366。10.1038 / nrg1711。
- 13.
哈敏,陆娟,田玲,Ramachandran V, Kasschau KD, Chapman EJ, Carrington JC,陈小敏,王新军,陈志军:小分子rna在抗基因组休克中的作用拟南芥种间杂交和异源多倍体。自然科学进展,2009,26(3):379 - 379。10.1073 / pnas.0907003106。
- 14.
李文杰,李志刚:内源性小RNA通路的分化和进化。中国农业科学,2007,30(4):344 - 344。10.1038 / nrg2179。
- 15.
Molnar A, Melnyk C, Baulcombe DC:植物中的沉默信号:小rna的漫长旅程。中国生物工程学报,2011,12:215-10.1186/ gb10-11-12 -219。
- 16.
Haag JR, Pikaard CS:多亚基RNA聚合酶IV和V:植物基因沉默的非编码RNA的提供者。中国生物医学工程学报,2011,12:483-492。10.1038 / nrm3152。
- 17.
Shivaprasad PV, Dunn RM, Santos BA, Bassett A, Baulcombe DC:杂交番茄异常的海侵表型受表观遗传学和小沉默rna的影响。中国生物医学工程学报,2012,31(3):357 - 357。10.1038 / emboj.2011.458。
- 18.
吴danny W-K,陆娟,陈志军:小rna在多倍体、杂交活力和杂种不亲和中的重要作用。植物学报,2012,15:154-161。
- 19.
Comai L, Tyagi AP, Winter K, Holmes-Davis R, Reynolds SH, Stevens Y, Byers B:新形成基因的表型不稳定性和快速沉默拟南芥异源四倍体。中国生物医学工程学报,2000,29(4):457 - 457。10.1105 / tpc.12.9.1551。
- 20.
Kenan-Eichler M, Leshkowitz D, Tal L, Noor E, melame - bessudo C, Feldman M, Levy AA:小麦杂交和多倍体化导致小rna失调控。中国生物医学工程学报,2011,29(3):344 - 344。10.1534 / genetics.111.128348。
- 21.
陈志军:植物多倍体基因表达与表型变异的遗传和表观遗传机制。植物学报,2007,29(3):377- 388。10.1146 / annurev.arplant.58.032806.103835。
- 22.
王晓明,李志刚,王晓明,王志刚,王志刚,王志刚,王志刚。microrna对基因表达的调控作用。电子学报,2010,30(4):344 - 344。10.1016 / j.cell.2009.12.023。
- 23.
巴特尔DP: MicroRNAs:基因组学,生物发生,机制和功能。电子学报,2004,34(1):1- 7。10.1016 / s0092 - 8674(04) 00045 - 5。
- 24.
Baulcombe D:植物中的RNA沉默。自然科学进展,2004,29(3):349 - 349。10.1038 / nature02874。
- 25.
Axtell MJ: microRNAs的进化和它们的靶标:所有的microRNAs都是生物学上相关的吗?生物化学学报,2008,27(3):344 - 344。10.1016 / j.bbagrm.2008.02.007。
- 26.
王娟,田玲,李hs,魏ne,姜华,Watson B, Madlung A, Osborn TC, Doerge RW, Comai L,陈志军:全基因组非加性基因调控拟南芥异源四倍体。遗传学杂志,2006,172:507-517。10.1534 / genetics.105.047894。
- 27.
Nikovics K, Blein T, Peaucelle A, Ishida T, Morin H, Aida M, Laufs P: MIR164A和CUC2基因之间的平衡控制着叶边缘锯齿拟南芥.植物学报,2006,18:2929-2945。10.1105 / tpc.106.045617。
- 28.
马加尼,钱松,李娟,曹玲,饶玲,邹霞,陈玲:大杂交和异源倍化过程中发生表型和遗传变异芸苔属植物拉伯和芸苔属植物黑质.科学通报,2014,37(3):344 - 344。10.1016 / j.scienta.2014.06.029。
- 29.
Ghildiyal M, Zamore PD:小沉默rna:一个不断膨胀的宇宙。学报学报,2009,10:94-108。10.1038 / nrg2504。
- 30.
Kasschau KD, Fahlgren N, Chapman EJ, Sullivan CM, Cumbie JS, Givan SA, Carrington JC:全基因组分析拟南芥siRNAs。公共科学图书馆,2007,5(3):57-71。10.1371 / journal.pbio.0050057。
- 31.
Labrador M, Farre M, Utzet F, Fontdevila A:种间杂交增加转位率Osvaldo.中国生物医学工程学报,1999,16:931-937。10.1093 / oxfordjournals.molbev.a026182。
- 32.
刘波,温德尔JF:逆转录转座子在水稻渗入植株中的激活和快速抑制。中国生物工程学报,2000,43:874-880。10.1139 / g₀₀- 058。
- 33.
哈敏,吴德坤,李文华,陈志军:组蛋白协调修饰与种内及种间基因表达变化相关。中国生物工程学报,2011,29(4):349 - 349。10.1101 / gr.116467.110。
- 34.
李文杰,李文杰:植物多倍体与基因组进化。中国植物学报,2005,30(4):531 - 531。10.1016 / j.pbi.2005.01.001。
- 35.
费德曼,列维AA:异源多倍体在小麦基因组进化中的塑造力。中国生物医学工程学报,2005,29(4):344 - 344。10.1159 / 000082407。
- 36.
Groszmann M, Greaves IK, Albertyn ZI, Scofield GN, Peacock WJ, Dennis ES: 24-nt siRNA水平的变化拟南芥杂交表明表观遗传对杂交活力的贡献。中国科学:自然科学,2012,29(2):344 - 344。10.1073 / pnas.1019217108。
- 37.
Cantu D, Vanzetti LS, Sumner A, Dubcovsky M, Matvienko M, Distelfeld f, Michelmore RW, Dubcovsky J:小rna。小麦DNA甲基化与转座因子。BMC基因组学杂志,2010,11:408-10.1186/1471-2164-11-408。
- 38.
Chuck G, Candela H, Hake S:小rna对植物发育的重大影响。植物学报,2009,12:81-86。10.1016 / j.pbi.2008.09.008。
- 39.
Kim J, Jung J, Reyes JL, Kim Y, Kim S, Kim JA, Lee M, Lee Y, Kim VN, Chua N, Park C: microrna定向的ATHB15 mRNA切割调控血管发育拟南芥花序梗。植物学报,2005,42(4):344 - 344。10.1111 / j.1365 - 313 x.2005.02354.x。
- 40.
Williams L, Grigg SP, Xie M, Christensen S, Fletcher JC: miR166靶基因对拟南芥茎尖分生组织和侧器官形成的调控。《科学进展》,2005,32(3):366 -366。10.1242 / dev.01942。
- 41.
周刚,郭波,钟瑞,Demura T,叶芝:miR165的过表达影响植物根尖分生组织的形成、器官极性的建立和血管发育拟南芥.中国生物医学工程学报,2007,34(4):366 - 366。10.1093 /卡式肺囊虫肺炎/ pcm008。
- 42.
李娟,王勇,张玲,刘波,曹玲,齐震,陈玲:杂交嵌合体后代的遗传变异和小rna芸苔属植物juncea和芸苔属植物oleracea.实验学报,2013,64(16):4851-4862。10.1093 / jxb / ert266。
- 43.
王俊伟,王俊伟,王志伟,魏格尔D: mir156调控的SPL转录因子在植物开花过程中的作用拟南芥.细胞学报,2009,38(3):344 - 344。10.1016 / j.cell.2009.06.014。
- 44.
吴刚,Park MY, Conway SR, Wang JW, Weigel D, Poethig RS: miR156和miR172的序列性分泌调控了小鼠的发育时间拟南芥.细胞学报,2009,38(3):344 - 344。10.1016 / j.cell.2009.06.031。
- 45.
Gandikota M, Birkenbihl RP, Hohmann S, Cardon GH, Saedler H, Huijser P: miRNA156/157基因3'UTR的识别元件拟南芥SBP box基因SPL3通过翻译抑制抑制幼苗早花。植物学报,2007,29(3):344 - 344。10.1111 / j.1365 - 313 x.2006.02983.x。
- 46.
Allen RS, Li J, sthle MI, Dubroue A, Gubler F, Millar AA:基因分析揭示了功能冗余,并指出了一些目标基因拟南芥miR159家庭。自然科学进展,2007,29(3):377 - 377。10.1073 / pnas.0707653104。
- 47.
Achard P, Herr A, Baulcombe DC, Harberd NP: agidellellin调控microRNA对花发育的调控。发展,2004,131:3357-3365。10.1242 / dev.01206。
- 48.
Wilson RN, Heckman JW, Somerville CR:拟南芥在短日照下开花需要赤霉素。中国农业科学,2003,27(3):344 - 344。10.1104 / pp.100.1.403。
- 49.
Mallory AC, Bartel DP, Bartel B: microrna定向调控拟南芥生长素反应因子17对植物的正常发育和调控早期生长素反应基因的表达至关重要。植物学报,2005,17:1360-1375。10.1105 / tpc.105.031716。
- 50.
黄淑琴,向艾尔,车丽丽,陈松,李华,宋俊杰,杨志明:一组mirna芸苔属植物显著对缺乏硫酸盐和镉胁迫的反应。中国生物工程学报,2010,29(3):349 - 349。10.1111 / j.1467-7652.2010.00517.x。
- 51.
谢福林,黄淑清,郭凯,朱友友,聂林,杨志明:新型microRNAs和靶标的计算识别芸苔属植物显著.清华大学学报(自然科学版),2007,29(3):344 - 344。10.1016 / j.febslet.2007.02.074。
- 52.
周志生,曾海海,刘志平,杨志明:全基因组鉴定Medicago truncatulamicroRNAs及其靶标揭示了重金属对其调控的差异。植物细胞环境学报,2012,35:86-99。10.1111 / j.1365-3040.2011.02418.x。
- 53.
Jones-Rhoades MW, Bartel DP:植物microrna及其靶标的计算鉴定,包括胁迫诱导的miRNA。生物化学学报,2004,14:787-799。10.1016 / j.molcel.2004.05.027。
- 54.
谢泽,谢志明,李志强,杨晓明:microrna定向相位调控反式-作用siRNA在植物中的生物发生。光子学报,2005,29(2):344 - 344。10.1016 / j.cell.2005.04.004。
- 55.
梁刚,杨凤霞,于德强:MicroRNA395介导了水稻硫酸盐积累和分配的调控拟南芥.植物学报,2010,29(4):344 - 344。
- 56.
lobby D, Rallapalli G, Schmidt DD, Martin C, Clarke J:锯齿状的:植物microRNA领域的新玩家。中国机械工程学报,2006,7:1052-1058。10.1038 / sj.embor.7400806。
- 57.
李G,奎洛斯CF: Sequence-related扩增多态性(SRAP)一个新的标记系统基于一个简单的、PCR反应:其应用程序映射,和基因标记芸苔属植物.应用理论,2001,30(4):455-461。10.1007 / s001220100570。
- 58.
Doyle JJ, Doyle JL:一种用于少量新鲜叶片组织的快速DNA分离程序。植物化学通报,1987,19:11-15。
- 59.
熊丽珍,徐春春,马saghai Maroof MA,张强:利用甲基化敏感扩增多态性技术检测水稻优良杂种及其亲本胞嘧啶甲基化模式。生物化学学报,1999,26(3):439-446。10.1007 / s004380050986。
- 60.
孙嘉荣,周晓霞,郑勇,张伟,朱建军:利用高通量测序鉴定水稻新mirna和候选mirna。中国生物医学工程学报,2008,8:25-10.1186/1471-2229-8-25。
- 61.
高志华,石涛,罗晓霞,张震,庄文彬,王丽娟:日本杏雌蕊发育相关小rna的高通量测序及差异表达microrna分析。中国生物医学工程学报,2012,13:371-384。10.1186 / 1471-2164-13-371。
致谢
国家自然科学基金项目(No. 31272159)、浙江省自然科学基金项目(No. 31272159)资助。LZ12C15001)和高等学校博士点专项科研基金(20110101110089)。我们感谢张凤兰先生、北京蔬菜研究中心(BVRC)和北京农林科学院(BAAFS)为中国北京提供种子(芸苔属植物拉伯).
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们没有竞争利益。
作者的贡献
MAG和JL生成SRAP、MSAP和sRNA数据并解释结果。NY、MAR、LC和RL分别进行qRT-PCR实验。MAG起草了手稿。LC, MAG, XZ和JL设计了研究并进行了统计分析。LC监督了这项研究。所有作者都阅读并批准了最终的手稿。
电子辅助材料
12870 _2014_272_moesm1_esm.doc
附加文件1:表S2。:DNA甲基化levels in the parents and their allodiploid and allotetraploid plants, as detected by the methylation-sensitive amplified polymorphism (MSAP) assay. Table S3 A comparison of DNA methylation patterns based on the MSAP data between parents and their allodiploids and allotetraploids. Figure S3 DNA methylation in the parents (AA and BB) and their allodiploid (AB) and allotetraploid (AABB): (a) demethylation in all of the samples, (b) methylation in all of the samples, (c) demethylation in the offspring compared with the parents, and (d) methylation in the offspring compared with the parents. (DOC 299 KB)
12870 _2014_272_moesm2_esm.xls
附加文件2:包含SRAP引物、本研究中使用的MSAP适配器和引物序列、miRNA引物序列和目标基因引物序列的Excel电子表格。(xl29kb)
12870 _2014_272_moesm3_esm.doc
附加文件3:表S1。:Genetic alterations in the parents and their allodiploid and allotetraploid plants. Figure S2 Genetic alteration in the parents (AA and BB), the allodiploid (AB), and the allotetraploid (AABB): (a) novel fragments, (b) loss of fragments compared with the parents, and (c, d) parents appear to fragment with offspring. (DOC 160 KB)
12870 _2014_272_moesm4_esm.doc
附加文件4:表S4。:The summary of small RNA sequencing data. Table S5 The interaction between parents and their allodiploid and allotetraploid plants. Table S6 The distribution of the genome-mapped sequence reads in the small RNA libraries. (DOC 71 KB)
12870 _2014_272_moesm6_esm.xls
附加文件6:一份Excel表格,包含已知的异源二倍体和异源四倍体植物之间的miRNA表达水平,亲本和异源四倍体之间的已知miRNA表达水平,亲本和异源二倍体之间的已知miRNA表达水平,亲本和异源二倍体之间的已知miRNA表达水平,亲本和异源二倍体之间的已知miRNA表达水平,亲本和异源二倍体之间的已知miRNA表达水平,亲本和异源二倍体之间的已知miRNA表达水平,亲本和异源二倍体之间的已知miRNA表达水平,亲本和异源二倍体之间的已知miRNA表达水平,亲本和异源二倍体之间的已知miRNA表达水平,异源二倍体与异源四倍体之间的新miRNA表达量,亲本与异源四倍体之间的新miRNA表达量,亲本与异源二倍体之间的新miRNA表达量,亲本与异源二倍体之间的新miRNA表达量,亲本与异源二倍体之间的新miRNA表达量,亲本与异源二倍体之间的新miRNA表达量,已知miRNA序列AABB,已知的microrna的序列AB,已知的microrna的序列AA,已知的microrna的序列BB,这部小说microrna的序列AABB,这部小说microrna的序列AB,这部小说microrna的序列AA,这部小说microrna的序列BB,和已知的microrna并预测目标基因AA,已知的microrna在BB和预测目标基因,已知的microrna在AB和预测目标基因,已知的microrna AABB和预测目标基因,和小说microrna基因AA和预测目标,BB中的新miRNAs和预测靶基因,AB中的新miRNAs和预测靶基因,AABB中的新miRNAs和预测靶基因。(xls2mb)
12870 _2014_272_moesm8_esm.doc
附加文件8:图S1。:The number of days for the flowering of the parents and their allodiploid and allotetraploid plants. (DOC 48 KB)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。
本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。
如欲查看本牌照的副本,请浏览https://creativecommons.org/licenses/by/4.0/.
创作共用公共领域奉献弃权书(https://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
贾尼,m.a.,李,J,饶,L。et al。小rna在广泛杂交和异体多倍体化中的作用芸苔属植物拉伯和芸苔属植物黑质.BMC植物生物学14,272(2014)。https://doi.org/10.1186/s12870-014-0272-9
收到了:
接受:
发表:
关键字
- 广泛的杂交
- Allopolyploidisation
- DNA甲基化
- 小rna