摘要
背景
拟南芥AtMYB80转录因子调控花粉发育相关基因,控制绒毡层程序性细胞死亡(PCD)的时间。Downregulation的AtMYB80表达先于绒毡层降解。抑制AtMYB80表达导致男性完全不育。全身的AtMYB80已在小麦、水稻、大麦和油菜中分离出同源物(C基因组)。
结果
完整的序列MYB80基因的芸苔属植物。显著(基因),b . juncea(基因),b . oleracea(C基因)和棉花的两个同源物(陆地棉)测定。推导出的氨基酸序列具有高度保守的MYB结构域、44个氨基酸区和18个氨基酸c端序列。棉花MYB80蛋白能充分恢复棉花的育性atmyb80突变体,而去除44个氨基酸序列则取消其功能。两个守恒MYB独联体元素的AtMYB80的下调需要启动子MYB80花药中的表达,明显通过负的自动调节。与拟南芥相比,棉花绒毡层的降解发生在花药发育的稍早阶段,与花药发育的早期增加和随后的下调相一致GhMYB80表达式。与EAR抑制子基序融合的MYB80同源体已被证实可诱导拟南芥雄性不育。构建的目的是使男性不育水平最大化。
结论
MYB80目前所研究的单子叶和双子叶植物的基因在结构和功能上都是保守的。的表达模式MYB80在这些物种中也高度相似。拟南芥的可逆雄性不育系统是通过操纵形成的MYB80表达应适用于所有主要作物。
背景
的AtMYB80转录因子参与绒毡层和花粉的发育,是拟南芥花药发育过程中绒毡层程序性细胞死亡(PCD)的调节所必需的[1] - [3.].使用3.2 kb的AtMYB80启动子熔合到格斯报告基因和现场杂交分析,表达AtMYB80在花药发育第5 ~ 9期绒毡层、中间层和发育中的小孢子中均有发现[1]、[4].功能紊乱的AtMYB80结果导致雄性完全不育并伴有早期绒毡层退化和花粉塌陷[2]、[4]、[5].利用ChIP分析已鉴定出三个直接受AtMYB80调控的基因,即一个A1天冬氨酸蛋白酶(不死的),果胶甲基酯酶(VANGUARD1)和乙二醛氧化酶(GLOX1).观察到绒毡层PCD过早和变性不死的而且atmyb80突变体(3.].
的AtMYB80水稻的同源物(栽培稻)、小麦(小麦),大麦(大麦芽)和油菜籽(芸苔属植物显著),它们的蛋白质序列显示出显著的保守性[6].R2R3的MYB结构域、MYB结构域下游的44个氨基酸区域和c端18个氨基酸序列之间存在高度相似性[2]、[6].驱动的表达式模式OsMYB80,TaMYB80而且BnMYB80拟南芥中的启动子与拟南芥中的相似AtMYB80在第6到10个阶段,被限制在绒毡层中,发育小孢子。当被AtMYB80或者它们的原生启动子,全长的OsMYB80,TaMYB80而且BnMYB80构造能够完全恢复不育男性的生育能力atmyb80本文分别突变(6].
油菜属是两种具有重要农业价值的油料油菜属(显著,基因组AACC)和褐芥(b . juncea,基因组AABB),起源于二倍体物种对之间的杂交b·拉伯(AA),b .黑质(BB),b . oleracea(CC) [7]、[8].的长篇BnMYB80C基因组的一部分已被分离出来[6),而MYB80的A基因组的同源物显著而且b . juncea和C基因组b . oleracea尚未确认身份。陆地棉(陆地棉L,基因组TDT)是栽培最广泛的同种异体四倍体种,起源于种间杂交g . arboreum(基因组1),g . raimondii就(基因组D5)[9].只有一个MYB转录因子,GhMYB24在棉花花药发育过程中起着重要作用[10].GhMYB80棉花是的同类吗AtMYB80.的两个部分编码序列GhMYB80推导出的氨基酸序列与其他物种的MYB80同源物具有高度的相似性[6].然而,每一个的全长DNA序列GhMYB80正交仪仍然缺乏。的表达模式GhMYB80也不知道AtMYB80和GhMYB80之间是否存在功能守恒。
利用细胞质雄性不育(CMS)和核编码育性恢复基因(射频)是杂交棉和油菜生产的重要技术[11]、[12].然而,基于cms的杂交系统很难开发和维护[13].此外,CMS表型在高温和低温下往往不稳定[14] - [16].操纵的表达MYB80转录因子提供了一种诱导和逆转雄性不育的新手段,促进杂交植物的生产[2].这里描述的实验是为了克隆MYB80从棉花和芸苔属植物(A和C基因组)中提取基因,并比较它们的蛋白质结构和启动子序列。的表达模式GhMYB80棉花花药中的基因及其挽救雄性不育的能力atmyb80变异测定。进一步评估了保守的44个氨基酸序列在MYB80功能中的作用。研究了将GhMYB80和BnMYB80蛋白与拟南芥EAR序列融合后诱导雄性不育的效果。
结果
芸苔属和棉花同源MYB80基因的克隆
相应的MYB80基因显著(基因),b . juncea(基因),b . oleracea(C基因)g .分子被克隆和测序。核苷酸序列和推导出的氨基酸序列与拟南芥进行了比较AtMYB80[1),显著MYB80 (C基因)[6),b·拉伯MYB80(A基因)从GenBank (GI: 110797058)中获得1和额外的文件1:图S1)。这八个的核苷酸序列MYB80同源体在外显子中高度保守。这些氨基酸序列在MYB结构域(氨基酸1 - 115)、与MYB结构域相邻的44个氨基酸区域(氨基酸125 - 168)和c端末端的18个氨基酸区域高度相似。在44个氨基酸和c端序列之间存在131 - 139个氨基酸的可变区域,具有10.7%的同一性(图1).芸苔属5个MYB80同源体中,3个A基因可变区氨基酸序列的相似性高于2个C基因的相似性(99.1% vs. 97.8%)。的MYB80B型芸苔属基因的同源体尚未克隆出来。这两个MYB80直接同源基因(GhMYB80-1而且2)g .分子是高度保守的,其核苷酸和肽序列的同一性分别为98.4%和99.4%(图1和额外的文件1:图S1)。这两个基因很可能来自A和D基因组。
AtMYB80启动子的缺失与突变分析
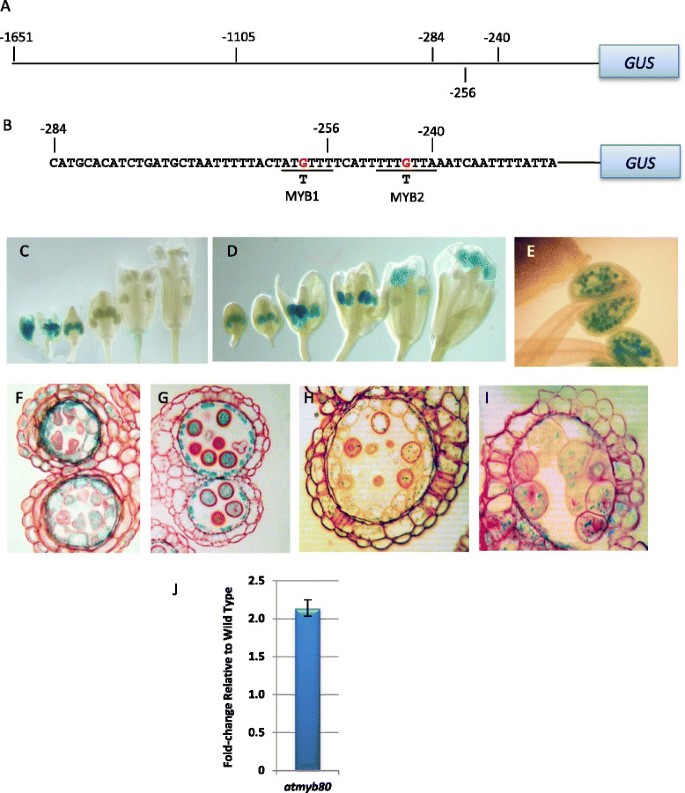
划定…的区域AtMYB805 UTR/启动子负责引导表达到绒毡层和花粉,一系列的四个AtMYB80启动子-格斯准备了删除构造。这些结构包含了1651,284,256或240bpAtMYB805 UTR序列(相对于ATG转译起始密码子)转入pBI载体,转化为野生型拟南芥(图2A).将转基因株系小花的组织化学GUS染色与具有3200bp的pPG结构进行比较AtMYB80启动子(1].在3200和1651bp启动子的幼花中,GUS的强度相似。未检测到GUS活性240 - pbi转基因线。当与1651 - pbi谱线中,极弱和弱/中等GUS强度存在256 - pbi而且284 - pbi行,分别(附加文件2:表S1)。
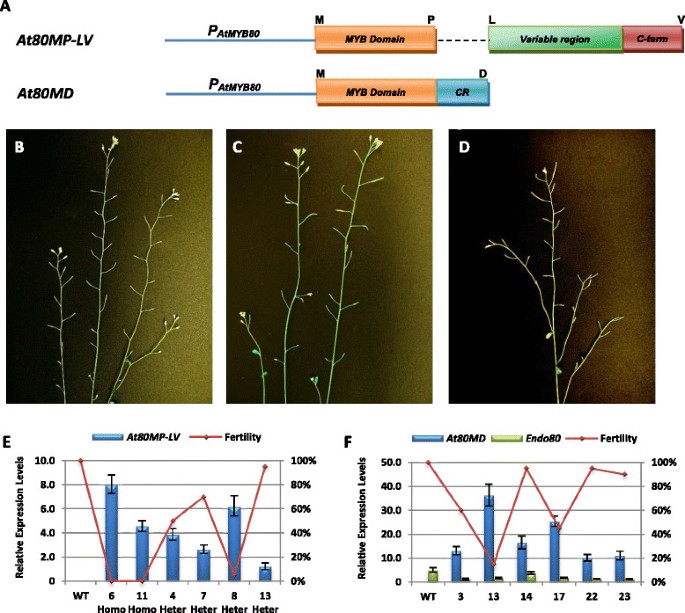
自动调整的AtMYB80启动子。一个.的原理图AtMYB80启动子-格斯删除结构。的长度AtMYB80用于每个结构的启动子。B.突变构造的原理图在−284到-240bp之间AtMYB80启动子区域。被靶向突变的核苷酸用红色表示,对应的变化直接显示在下面。C.对照株花芽排列(7 ~ 12期)显示GUS活性延长至第9期。D.花芽排列(第7至12期)平方米线显示GUS活性延长至第12期。E.GUS活性存在于平方米花药12期。F而且G.截面的平方米花药在绒毡层、绒毡层外细胞壁有GUS活性,9期发育小孢子(F)和11(G).H而且我.纯合子的绒毡层和塌缩花粉粒中存在GUS活性atmyb80具有野生型的突变体AtMYB80启动子-格斯第10阶段的建构(H)和12(我).J.qRT-PCR比较分析AtMYB80花药第5 ~ 9期的幼芽转录水平atmyb80突变体与野生型。的AtMYB80转录水平在atmyb80突变的幼芽。的UBQ10作为内参基因。误差条表示SD。
的−284 ~ -240bp序列AtMYB80启动子拥有两个假定独联体-元素,即MYB1和MYB2。当MYB1元素在1105bp的启动子(构建M1,单基变化,图2B),格斯花药中的表达不受影响(图2C).然而,当MYB1和MYB2元素都发生突变时(构建平方米,图2B), GUS活性持续到第12阶段(图2D,而不是在第10阶段被下调。第11期的活性局限于小孢子或退化的绒毡层(图2G)。12期花药的花粉粒也表现出GUS活性(图2E).的MYB1和MYB2元素AtMYB80启动子在芸苔属C基因组中是保守的,而在其他四种基因组中则不保守MYB80基因。MYB2是守恒的GhMYB80启动子和MYB1BnMYB80基因启动子(附加文件3.:图S3)。
检查是否表达AtMYB80自动调节,是一个启动子吗格斯具有1105bp的建筑AtMYB80启动子被引入到atmyb80T-DNA插入突变体(图2一)纯合子。atmyb80植物是完全雄性不育的,而杂合子植物是完全雄性可育的[2].在杂合子的花药中观察到GUS活性atmyb805 - 9阶段突变体,与前面描述的相同[1]、[2].格斯两个纯合子的表达扩展到第13期atmyb80突变行(附加文件4:表S2)。GUS活性存在于液泡化的绒毡层(阶段10)和坍缩的花粉粒(阶段12)中(图12)2H和I)。
转录水平的AtMYB80无论是野生型还是atmyb80采用real-time qRT-PCR方法分析突变株。截断的水平AtMYB80年轻突变体花蕾(花药发育第5至9期)的转录本约为野生型的2.1倍(图2J).以前的微阵列数据比较差异基因表达在野生型和atmyb80突变体花药的上调率为截断花药的3.2倍(p值为0.012)AtMYB80突变体中的转录(未发表数据)[3.].这些结果表明AtMYB80涉及到消极的自动调节。
八家公司的发起人MYB80基因在ATG密码子上游约−300 ~ -380bp处具有高度保守的序列。四个独联体-元素在6个基因中都是保守的,包括W-box (TTGAC)、MYB (A/TACC)、GTGANTG10 (TCAC)和DOFCOREZM (A/TAAAG)1:图S1)。
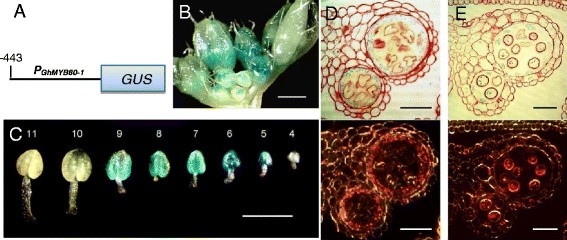
拟南芥中GhMYB80启动子驱动的GUS表达
以确定GhMYB80启动子与AtMYB80启动子在拟南芥花药中的表达格斯采用报告基因。的GhMYB80-1启动子的长度为443 bp(从ATG中编号)。另一组花药显示,GUS活性首次出现在第5期,并持续到第9期3.C).在第10和11阶段未检测到活性。花药切片的明暗场显微镜显示,在第8和第9期绒毡层和小孢子中的GUS活性3.D和E)。因此,表达模式驱动GhMYB80-1拟南芥中的启动子与AtMYB80启动子。
GhMYB80在棉花花药发育中的转录水平
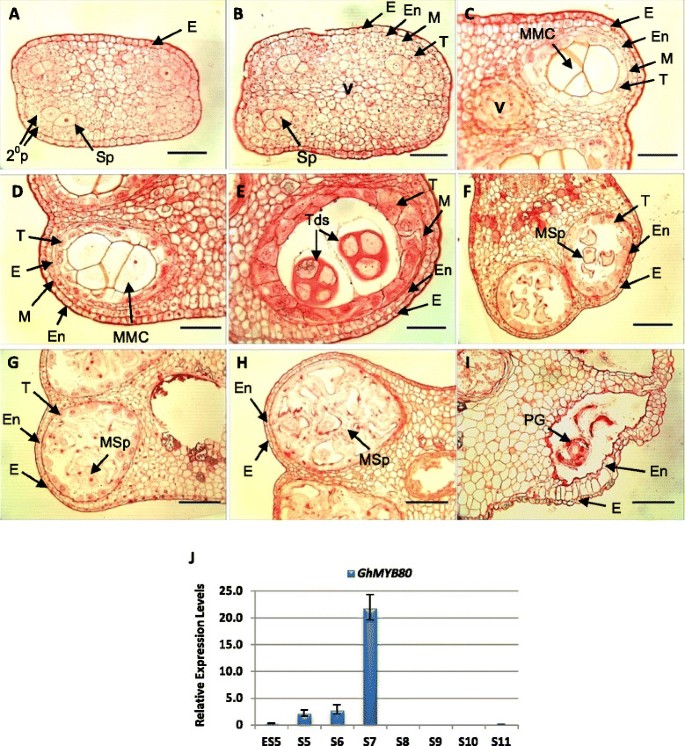
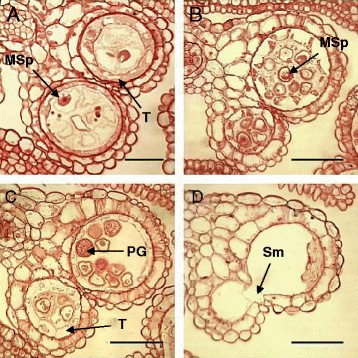
与花药发育阶段相对应的棉花花蕾的指示大小(长度和宽度)是用半薄片确定的(附加文件5:表S3)。根据拟南芥花药发育阶段的形态学变化对花药阶段(从3到11)进行编号[17]、[18].在第4阶段,棉花花药绒毡层开始形成4B).第6期,绒毡层空泡化(图4D).绒毡层细胞质在第7期收缩(图4E)和细胞壁在第8期降解(图4F).绒毡层细胞变性似乎开始于第9期(图4G)和绒毡层在第10期不再可见(图4H).的转录水平GhMYB80利用实时定量pcr技术对棉花花药发育第5 ~ 11期的基因进行了分析4J)和RT-PCR(附加文件6:图S2)。的GhMYB80转录水平在第5期早期非常低,随后在第5、6和7期升高。主要的增加发生在6 ~ 7期绒毡层细胞质浓缩和四分体出现时。在第八阶段后期,GhMYB80无法再检测到转录本。
显影的半薄片g .分子花药和相对转录水平GhMYB80在花药。测量每个花药发育阶段的指示芽大小(附加文件5:表S3)。一个.在第3期,次级壁层和孢子生细胞明显。B.在第4阶段,表皮、内膜、中间层和绒毡层开始形成。C.在第5阶段,小孢子母细胞出现。D.第6期,小孢子母细胞开始减数分裂,绒毡层细胞空泡化。E.在第7期,绒毡层细胞质收缩,在花药室中出现四分体。F.在第八阶段后期,小孢子从四分体中释放出来。绒毡层细胞壁已退化。G.在第9期,绒毡层开始退化。小孢子有液泡的。H.在第10阶段,绒毡层已被降解。绒毡层细胞的残余可见。小孢子仍处于液泡状态。我.在第11阶段,出现早期花粉粒。2 P,次级顶膜层;E表皮;恩,内层;MSp,小孢子;毫升,中间层;小孢子母细胞;MSp,小孢子;PG,花粉粒;Sp,产孢子的细胞;T,毯;Tds、四联球菌; V, vascular. Scale bars = 50 μm in一个,B,C,D而且E.比例尺= 100 μm inF,G,H而且我.J.相对表达水平GhMYB80在野生型陆地棉花药。的GhMYB80早期5期(ES5)、5期和6期的转录水平较低。它在花药发育的第7阶段达到峰值,在第8后期(LS8)到第11阶段没有。的g .分子泛素(UBI1)作为内参基因。S5至S11, 5至11期。误差条表示SD。
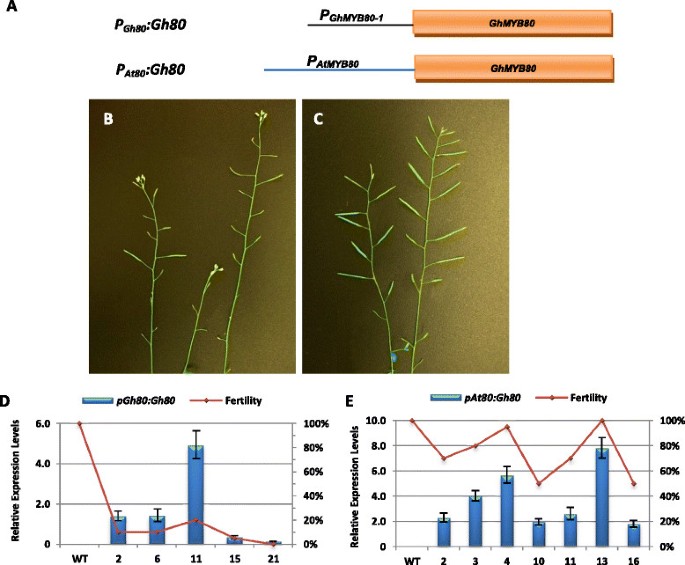
GhMYB80可以挽救拟南芥雄性不育突变体atmyb80 T-DNA
为了确定GhMYB80和AtMYB80是否在功能上是保守的atmyb80突变体用全长进行转化GhMYB80-1编码序列由自身启动子控制(443bp;PGh80: Gh80)或AtMYB80启动子(1100个基点;PAt80: Gh80)(图5纯合子)。atmyb80用PCR法鉴定了含有转基因的T-DNA插入突变体。植物的肥力被定义为伸长的角果占总角果的百分比。十个人中的一个PGh80: Gh80改变了atmyb80纯合突变体,育性部分恢复(20%育性)(图)5B).其他9个品系的可育性不足10%或保持完全不育。然而,生育力却有九个atmyb80纯合子线携带PAt80: Gh80转基因显著或完全恢复,导致50-100%的育性(图5C).的表达水平PGh80: Gh80而且PAt80: Gh80采用实时荧光定量PCR法检测相关转基因系的基因。植物的育性与转基因的相对表达量呈正相关(图5D和E)GhMYB80-1启动子显然不如AtMYB80启动子在拟南芥。
去除44-氨基酸或c端区域对MYB80活性的影响
为了检测MYB80蛋白44-氨基酸区和c -末端的功能,通过删除44-氨基酸区(At80MP-LV)或可变区和c端(At80MD)(图6一个)。At80MP-LV将结构引入atmyb80突变和At80MD构建转化为野生型拟南芥。研究了转基因株系的花萼伸长和花粉活力。所有12atmyb80纯合子系与At80MP-LV转基因未能延长角果(0%育性)(图6B).因此,44个氨基酸结构域对MYB80活性至关重要,可能是R2R3 MYB结构域与之结合所必需的独联体-目标基因启动子中的元素。在生育能力上有很大的差异(从5%到95%)At80MP-LV转基因atmyb80杂合的行(图6C). qRT-PCR检测At80MP-LV转基因在两atmyb80纯合子和四杂合子系。严重的男性不育(5%的生育能力)在第8行观察到高水平的At80MP-LV检测到的表达(图6E).在杂合子系中,At80MP-LV蛋白可能在竞争与内源性AtMYB80的c端结合的蛋白,这些蛋白是MYB80活性所必需的。
菊苣穗状伸长及转基因表达分析At80MP-LV而且At80MD拟南芥。一个.的示意图表示At80MP-LV而且At80MD截断结构。字母表示结构域开头和结尾的氨基酸。B.的At80MP-LV转基因无法挽救atmyb80纯合突变体和植株保持完全雄性不育(品系6)。C.杂合子降低了植株的育性atmyb80突变体与At80MP-LV转基因(第8行)。D.野生型拟南芥的部分雄性不育表型At80MD构造(13号线)。E.的表达At80MP-LV在纯合子atmyb80突变体(第6和11行,0%育性)和杂合子atmyb80突变体(第4、7、8和13行,5%到95%的育性)。F.At80MD测定了所选品系的转录水平和植株育性。内源性表达水平AtMYB80在所有的行中都减少了。野生型(WT)为阴性对照。误差条表示SD。
24个野生型行中有4个用At80MD15-50%的生育能力(图6D).其余株系保持部分(90%)或完全可育。的转录水平At80MD均明显高于内源性AtMYB80在所有选定的行(图6F).的最高表达水平At80MD在第13行中获得,其育性为15%。内源性的转录水平AtMYB80与野生型水平相比,所有品系均减少。部分不育的绒毡层和花粉发育At80MD用光镜检查花药部分。第8期,绒毡层细胞空泡化,四分体释放的小孢子增大(肥厚),形状不规则(图)7A).绒毡层细胞在10期高度空泡化和肥厚。小孢子已经开始降解,在花药室中观察到细胞碎片7B).在第11阶段,一个花药室中有少量花粉粒发育正常,绒毡层退化(图)7C).然而,在第二个子房室中,小孢子和绒毡层仍然高度空泡化和肥厚。小孢子碎片存在,绒毡层细胞壁完整。绒毡层细胞的细胞质含量大大降低。绒毡层在12期已完全退化。花粉粒塌陷,碎屑附着在内胚层上(图7D). At80MD截断蛋白可能能够与内源性AtMYB80竞争结合靶基因的启动子,但不能激活基因表达。
GhMYB80/BnMYB80-EAR融合抑制子诱导拟南芥雄性不育
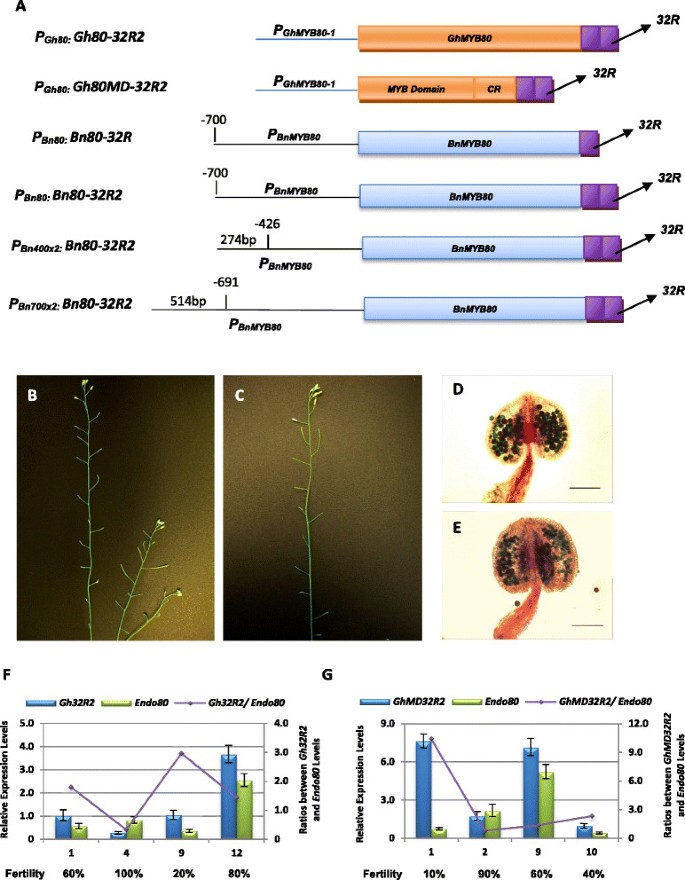
利用AtMYB80功能构建了拟南芥可逆雄性不育系统。全长AtMYB80与SRDX EAR基序的嵌合结构导致60%的转基因系表现出完全雄性不育[2].一个ear样基序(LDLNLELRISPP),命名为32R,被认为是AtMYB32中发现的负调控结构域(NRD),其他MYB蛋白在亚群4中共享[19]、[20.].我们希望确定GhMYB80和BnMYB80蛋白在拟南芥32R基序融合时是否能有效诱导雄性不育。此外,为了确定是否通过截断MYB80蛋白、添加两个而不是一个32R motif或增加启动子强度来增强效果。完整的或删节的GhMYB80和两份32 r序列(PGh80: Gh80-32R2而且PGh80: Gh80MD-32R2).截断序列由MYB结构域和44个氨基酸区组成。两种嵌合结构均由443bp驱动GhMYB80-1启动子(图8长篇)。BnMYB80(C基因)编码序列也与32R EAR的一个或两个拷贝融合,置于700bp的控制下BnMYB80启动子(PBn80: Bn80-32R而且PBn80: Bn80-32R2).用双400和双700bp的启动子来检验双启动子的效果BnMYB805 UTR序列驱动BnMYB80-32R2嵌合结构(PBn400x2: Bn80-32R2而且PBn700x2: Bn80-32R2)(图8一个)。
菊苣穗状伸长表型及转基因表达分析PGh80: Gh80-32R2而且PGh80: Gh80MD-32R2拟南芥。一个.的示意图表示PGh80: Gh80-32R2而且PGh80: Gh80MD-32R2嵌合结构。B而且C.野生型拟南芥PGh80: Gh80-32R2(B)或PGh80: Gh80MD-32R2(C)转基因具有部分不育表型。D而且E.亚历山大染色显示,大部分花粉粒缺乏细胞质,在花粉生长过程中流产PGh80: Gh80-32R2(D)而且PGh80: Gh80MD-32R2(E)囊里。比例尺= 85 μm。F而且G.的相对表达水平PGh80: Gh80-32R2(F)而且PGh80: Gh80MD-32R2(G)在所选系中的转基因。比率越高(PGh80: Gh80-32R2或PGh80: Gh80MD-32R2vs。AtMYB80),植株的育性越低。Gh32R2,PGh80: Gh80-32R2;GhMD32R2,PGh80: Gh80MD-32R2;Endo80,内源性AtMYB80.误差条表示SD。
PCR筛选出41个转基因基因PGh80: Gh80-32R2和六十三年转基因PGh80: Gh80MD-32R2行。对每一行的硅形伸长进行了检验。大约三分之一的转基因PGh80: Gh80-32R2线和一半PGh80: Gh80MD-32R2不育系的育性低于25%(图8在34%的转基因植株中观察到部分可育表型(超过75%的可育性)PGh80: Gh80-32R2和3%的转基因PGh80: Gh80MD-32R2行,分别(附加文件7:表。S4)。Alexander对具有任一结构的严重不育(育性低于25%)系的花药进行染色,结果显示大多数花粉粒缺乏细胞质含量(图8D和E)PGh80: Gh80-32R2而且PGh80: Gh80MD-32R2转基因和内源性基因AtMYB80用qRT-PCR方法对所选品系进行检测。研究表明,植物的育性取决于转基因和内源转录水平的比值AtMYB80.比率越高(PGh80: Gh80-32R2或PGh80: Gh80MD-32R2vs。AtMYB80),植株的育性越低(图8F和G)。在700 bp中加入两个32R拷贝BnMYB80启动子驱动BnMYB80(PBn80: Bn80-32R2)的有效性低于单个EAR序列(PBn80: Bn80-32R)(表1).两份700bp的复印件BnMYB80启动子驱动全长BnMYB80基因(PBn700x2: Bn80-32R2)比400 bp的两个拷贝更有效BnMYB80启动子(PBn400x2: Bn80-32R2).当两个嵌合结构由各自的启动子驱动时,BnMYB80-32R抑制子在拟南芥中诱导雄性不育的能力强于GhMYB80-32R。这种差异可能反映了较短的长度(强度)GhMYB80启动子。
讨论
MYB80结构与功能的比较
在八种编码的蛋白质中MYB拟南芥、芸苔属和棉花中克隆的基因,其MYB结构域、相邻44个氨基酸序列和18个氨基酸c端序列高度保守。后者由两种棉花蛋白中的8个氨基酸延伸。在44个氨基酸和c端序列之间有一个131 ~ 139个氨基酸的可变区域,8个MYB蛋白之间具有10.7%的同源性。
MYB80蛋白之间的序列守恒表明了类似的功能。OsMYB80,TaMYB80,BnMYB80(C基因)(6),GhMYB80-1都能恢复男性的生育能力吗atmyb80突变,意味着单子叶和双子叶之间的功能守恒。保守的44个氨基酸序列对MYB80的功能至关重要,因为当被移除时,蛋白质就无法恢复atmyb80生育能力。
GhMYB80在棉花花药发育中的作用
棉花花药的发育阶段与拟南芥花药的发育阶段非常相似7:表S4)。在拟南芥AtMYB809期表达最强,10期开始绒毡层细胞降解[1]、[4].然而,在棉花中,绒毡层细胞的降解开始于花药发育的第9阶段,并在第10阶段基本完成。这些差异与早期的增加(阶段7)和降低(阶段8)是一致的MYB80棉花中的转录水平。
MYB80启动子的比较
八家公司的发起人MYB基因共享一个80 bp的序列(大约在ATG上游-300到-380 bp),其中包括4个独联体-elements,其中一个是MYB绑定站点。我们还没有确定这些元素在驱动基因表达方面的重要性。GhMYB80是更有效地恢复男性的生育能力atmyb80驱动时的突变体AtMYB80(1105 bp)比GhMYB80启动子(443 bp),可能反映了启动子长度的差异。这个结果意味着附加独联体驱动表达式的-元素位于-464到- 1105区域。或者,时机GhMYB80启动子的表达,这可能略有不同于AtMYB80促进剂,也可能降低效果GhMYB80促进剂的补充atmyb80突变体。无效导致的自动调节降低独联体元素在GhMYB80启动子可能导致时间差异。
两个假定的myb结合位点,即MYB1和MYB2,位于转录起始位点上游-257bp和-246bp处AtMYB80启动子。格斯表达似乎不受MYB1突变启动子的驱动。然而,当两个MYB元素都发生突变时,格斯在拟南芥中,表达不再停止在花药第10期,在小孢子和退化绒毡层细胞中持续到第12期。虽然还不清楚是否一个突变的MYB2元素会单独影响AtMYB80的表达,这些结果表明MYB2元素在表达的下调中起主要作用MYB80后期的表达。这两个MYB独联体元素的AtMYB80的启动子是保守的b . napas MYB80C基因和两个GhMYB80基因。然而,在小麦和水稻中却没有MYB80基因启动子,暗示MYB80单株中下调调节的方式可能不同。
中断的AtMYB80基因也改变其启动子的表达模式。因此,格斯由野生类型驱动的表达式AtMYB80在纯合子的花药中,启动子扩展到第12期atmyb80突变体。截断的表达水平AtMYB80年轻时转录水平上调atmyb80花药微阵列和qRT-PCR分析结果显示。这些结果表明,AtMYB80蛋白参与了花药发育后期其表达的负向自动调控。AtMYB80正向调节部分基因的表达,但抑制其他基因的表达[3.].MYB80从激活剂变为抑制剂的机制尚不清楚。另外三个MYB蛋白AtMYB4、7和32具有类似ear的序列,并被证明可以抑制自身的启动子[20.] - [22].
AtMYB80正向调控天冬氨酸蛋白酶编码基因的表达亡灵。如果要实现绒毡层PCD的正确时间,必须下调该基因[3.].因此,至关重要的是MYB80在花药发育的适当阶段,表达被抑制。的差别,对这些GhMYB80与拟南芥相比,棉花花药第8期后期的绒毡层降解较早。
MYB80-EAR作为男性不育的诱导剂
拟南芥引入嵌合蛋白AtMYB80-EAR诱导雄性不育[2].GhMYB80和BnMYB80蛋白与ear样序列32R融合也导致了拟南芥的雄性不育。由于不育是可以逆转的[2与棉花、油菜、小麦和水稻的MYB80蛋白具有相似的功能,该系统为获得作物杂交种活力提供了一种新的手段。重要的是水平MYB80-EAR以确保男性不育的最高水平。
内源性转录水平AtMYB80是否所有行都过表达At80MD.过表达的截断蛋白可能与atmyb80相互作用的蛋白竞争,导致内源性的表达减少AtMYB80基因。而内源性的RNAi沉默AtMYB80在At80MD不育系不能被排除为雄性生育能力降低的原因,沉默似乎没有显著影响转基因的表达At80MD.
当32 r序列与截断的融合在一起GhMYB80MD序列转化为野生型拟南芥植株后,获得的雄性不育植株比例高于全长时的雄性不育植株比例GhMYB80使用序列。百分之五十的PGh80: Gh80MD-32R2不育率超过75%,而全株不育率为30%PGh80: Gh80-32R2行。的At80-耳朵(PAt80: At80-SRDX)构建结果表明,60%分离的拟南芥株系表现出完全雄性不育和siilique流产[2)而At80MD-耳朵(PAt80: At80MD-SRDX)这个数字上升到75% [6].
需要一个强启动子来驱动MYB80-EAR结构,以最大限度地提高获得的男性不育水平。700年英国石油公司BnMYB80启动子比400bp的启动子更有效,虽然700bp的两个拷贝BnMYB80发起者不比一个拷贝好多少。与MYB80蛋白融合的单个EAR序列比双序列更有效。的PBn700x2: Bn80-32R2(EAR x2)结构导致约60%的系完全雄性不育。然而,显示完全雄性不育的株系的百分比是相似的Bn80-32R(单副本EAR)由单副本驱动BnMYB80启动子(表1).
结果表明,一个强启动子(驱动绒毡层和小孢子表达)和一个与MYB80MD蛋白融合的EAR序列的单拷贝的组合将诱导高水平的完全雄性不育。此外,当与MYB80蛋白融合时,32R EAR比SRDX效果更差。这种多样性提示设计新的EAR序列具有更大的抑制活性的可能性。
结论
在本文中,我们扩展了我们的研究MYB80包括芸苔属A和C基因组和两个棉花同源系。对同源基因的启动子和功能分析发现,棉花同源基因的表达模式和功能是保守的MYB80表达是负自调节的。对棉花花药的发育阶段进行了研究GhMYB80在绒毡层退化开始之前,表达停止。
保护MYB80作物中的基因具有重要意义,因为对基因表达的操纵为获得杂交活力提供了一种新的可逆雄性不育系统。我们研究了优化抑制的方法AtMYB80使用嵌合MYB80与AtMYB32的EAR序列融合的表达。一个EAR拷贝在强启动子的驱动下融合到截断的MYB80上(例如,甘蓝型MYB80)被证明是获得男性不育的最有效的结构。
方法
植物材料及改造
野生油菜(显著的简历., Westar),棕芥(b . juncea)和棉花(g .分子(Coker 315)种子来自澳大利亚堪培拉联邦科学和工业研究组织植物工业部。野生型球芽菜(b . oleracea)是澳大利亚的一种商业品种。野生型拟南芥哥伦比亚(Col-0)和atmyb80T-DNA插入突变系来自欧洲拟南芥育种中心的GABI-Kat(马克斯普朗克植物育种研究所)。拟南芥、油菜、褐芥和抱子甘蓝在22°C恒定光照的植物生长室内生长。野生型棉花生长在温度为30°C/22°C(昼夜)的温室中。拟南芥转化用根癌土壤杆菌将约50 μL的渗透培养基(2天农杆菌培养液,5%蔗糖,0.03% Silwet)滴到每株小花上,培养菌株GV3101。滴液过程每周重复一次,持续三周。构建体转化为野生型或可育杂合子atmyb80植物。然后在T1代对分离群体进行基因型和表型分析。
质粒构建
的编码序列BnMYB80A GhMYB80-1 / 2,BjMYB80A,BoMYB80C用从保守DNA序列设计的引物进行PCR扩增得到。的GhMYB80-1 / 2启动子序列根据制造商的协议,使用BD GenomeWalker试剂盒(Clontech)通过基因组行走法获得。
的GhMYB80而且BnMYB80启动子片段克隆到pENTR/D-TOPO载体(Life Technologies),然后通过LR克隆酶反应转移到pKGWFS7或pGWB533目的载体上。DNA片段PGh80/ PAt80: Gh80,GhMYB80-耳朵,AtMYB80截断结构克隆到pGWB501目标向量中。四是串行删除的AtMYB80启动子片段从pPG结构中扩增[1],并利用限制性内切位点BamHI和hindii克隆到pBI101.1载体上。根据制造商的协议,使用Muta-Gene Phagemid试剂盒(Bio-Rad)进行位点特异性突变。两个突变启动子被克隆到pBI101.1载体中。双BnMYB80启动子是通过融合两个400或700个启动子重复而产生的。5'启动子重复序列包含TATA盒子(不包括TATA盒子)的上游序列,生成一个274 + 426 bp(双400启动子)和一个514 + 691 bp(双700启动子)序列。的BnMYB80-耳朵碎片与单片或双片融合BnMYB80然后将启动子克隆到pCAMBIA1380二元载体(CAMBIA)中。基因特异性引物列在附加文件中8:表S5。
花蕾测定及RT/qRT-PCR分析
在显微镜下测量了棉花花蕾的长度(从花蕾顶端到叶柄基部)和宽度(从一边到另一边的最长水平尺寸)。从每个花蕾中取出一半花药进行半薄切片。另一半用于RNA提取。测量和RNA提取复制每个尺寸。根据拟南芥花蕾长度确定花药期[23].
用RNeasy植物试剂盒(Qiagen)从分离的花药或花芽中提取总RNA。第一条cDNA链是根据原始协议使用SuperScript™III逆转录酶(Life Technologies, Catalog # 18080-044)合成的。然后通过DNA酶消化(Life Technologies, Catalog # 18068-015)消除基因组DNA污染。RT-PCR扩增cDNA的条件为:94℃,孵育3 min;26至28个周期,94°C 30秒;55-60°C 30 s, 72°C 40 s;RT-qPCR使用MyiQ iCycler (BIO-RAD)上的SensiFAST SYBR &荧光素试剂盒(Bioline,目录# BIO-96020)进行。PCR条件为:94℃,孵育3 min;94°C 30 s循环40次;55-60°C 30 s; 72°C for 20 s; one cycle at 72°C for 5 min. Data was analysed using the iQ5 (BIO-RAD) software. Relative gene expression level was calculated using the primer efficiency^(−deltaCT)方法。用引物效率计算折叠变化^(−δdeltaCT)方法。拟南芥的UBIQUITIN10(UBQ10),g .分子UBIQUITIN1(UBI1)基因作为参考。基因特异性引物列在附加文件中8:表S5。
树脂嵌入花蕾的切片
拟南芥小花按Li [2].从花芽中分离出的棉花花药用FAA固定(50%乙醇,5%醋酸,3.7%甲醛,41.3%水),然后包埋在LR White中。棉花花药的剖面图与拟南芥小花的剖面图相同。
转化拟南芥植株的组织化学分析
将新鲜的拟南芥花芽预先置于1%戊二醛溶液(由50 mM磷酸钠缓冲液组成,pH 7.4)中,然后用X-gluc溶液(0.5 mg/ml X-gluc在二甲基甲酰胺中,50 mM磷酸钠缓冲液,和0.05% Triton X-100)覆盖。样品在37°C下孵育4-16小时,用95%乙醇洗涤以去除叶绿素。解剖显微镜下观察GUS活性。拟南芥花药用亚历山大染色剂染色[24并在显微镜下进行了检查。
支持数据的可用性
支持本文结果的DNA序列数据集可在GenBank存储库中获得,登录号为KM675703 - KM675707。
作者的贡献
YX进行了研究,分析了数据,并写了手稿。SI进行了研究并分析了数据。SFL设计了这项研究并分析了数据。RWP撰写并编辑了手稿。所有作者阅读并批准了最终稿件。
附加文件
缩写
- CMS:
-
细胞质雄性不育
- 耳朵:
-
ERF-associated两亲性压抑
- 格斯:
-
β葡萄糖醛酸酶
- 纤毛运动:
-
程序性细胞死亡
- 存在:
-
定量一
参考文献
Li SF, Higginson T, Parish RW:一种新的myb相关基因拟南芥在发育中的花药中表达的。植物生理学报,1999,30(4):349 -347。10.1093 / oxfordjournals.pcp.a029548。
李顺丰,Iacuone S, Parish RW:利用转录因子抑制和恢复男性生育能力。植物生态学报,2007,5:297-312。10.1111 / j.1467-7652.2007.00242.x。
潘洪华,Iacuone S,李顺丰,Parish RW: MYB80转录因子在植物花粉发育和调节绒毡层程序性细胞死亡中是必需的拟南芥.植物学报,2011,23:2209-2224。10.1105 / tpc.110.082651。
higinson T, Li SF, Parish RW: AtMYB103调控绒毡层和毛状体的发育拟南芥.植物学报,2003,34(4):379 - 379。10.1046 / j.1365 - 313 x.2003.01791.x。
张志斌,朱军,高建峰,王超,李红,李红,张海萍,张松,王德明,王秋霞,黄红,夏海军,杨楠楠:转录因子AtMYB103通过调节拟南芥花药绒毡层发育、胼胼体溶解和外壁形成而参与花药发育。植物学报,2007,29(5):529 - 536。10.1111 / j.1365 - 313 x.2007.03254.x。
pan HA, Li SF, Parish RW: MYB80是一种植物绒毡层和花粉发育的调控因子,在作物中具有功能保守性。植物生理学报,2012,38(4):371 - 371。10.1007 / s11103 - 011 - 9855 - 0。
长春:芸苔属植物的基因组分析显著和独特的施肥方式。日本学报,1935,7:389-452。
王晓燕,王晓燕,王晓燕。芸苔属植物的分类、细胞遗传学及起源研究进展。歌剧学报,1980,55:1-57。
朱海燕,张志忠,杨立明,郭文忠:EST-SSR序列揭示了植物二倍体和四倍体d基因组的关系Gossypium.植物生态学报,2009,36(4):369 - 371。10.1016 / j.plantsci.2008.12.007。
李艳,蒋娟,杜明良,李亮,王晓丽,李晓波:棉花myb样转录因子基因在花粉中特异性表达,参与调控晚花药/花粉发育。植物生理学报,2013,34(4):394 - 394。10.1093 /卡式肺囊虫肺炎/ pct038。
张建峰,Stewart JM:棉花CMS-D8的恢复受一个显性基因的影响。作物科学,2001,41:283-288。10.2135 / cropsci2001.412283x。
Formanová N,李晓q, Ferrie A, DePauw M, Keller W, Landry B, Brown G:对位置克隆的研究芸苔属植物显著:双单倍体的生成与分析b·拉伯拥有的显著波尔CMS和招标书核恢复基因。植物生物学杂志,2006,29(4):369 - 371。10.1007 / s11103 - 006 - 0008 - 9。
Perez-Prat E, Van Lookeren Campagne MM:杂交种子生产和繁殖雄性不育植物的挑战。植物生态学报,2004,22(3):369 - 369。10.1016 / s1360 - 1385(02) 02252 - 5。
范铮,Stefansson BR:温度对油菜两种细胞质雄性不育系统不育性的影响(芸苔属植物显著l .)。中国植物学报,1998,27(2):366 - 366。10.4141 / cjps86 - 035。
刘文英,Gniffke PA:低温条件下AVRDC细胞质雄性不育(CMS)辣椒系的稳定性。辣椒茄子学报,2004,23:85-88。
Weider C, Stamp P, Christov N, H'sken A, Foueillassar X, Camp KH, Munsch M:不同环境条件下玉米细胞质雄性不育性的稳定性。作物科学,2009,49:77-84。10.2135 / cropsci2007.12.0694。
Sanders PM, Bui AQ, Weterings K, McIntire KN, Hsu YC, Lee PY, Truong MT, Beals TP, Goldberg RB:拟南芥雄性不育突变体的花药发育缺陷。有性植物学报,1999,11:297-322。10.1007 / s004970050158。
李顺生:绒毡层的死亡:发展中的利他主义计划。植物生态学报,2010,29(4):447 - 447。10.1016 / j.plantsci.2009.11.001。
Kranz H, Denekamp M, Greco R, Jin H, Leyva A, Meissner RC, Petroni K, Urzaiqui A, Bevan M, Martin C, Smeekens S, Tonelli C, Paz-Ares J, Wiesshaar B:拟南芥R2R3-MYB基因家族成员的功能特性研究植物学报,1998,16(3):366 - 366。10.1046 / j.1365 - 313 x.1998.00278.x。
Preston J, Wheeler J, Heazlewood J, Li SF, Parish RW:拟南芥花粉正常发育需要AtMYB32。植物学报,2004,29(4):369 - 371。10.1111 / j.1365 - 313 x.2004.02280.x。
Hussey SG, Mizrachi E, Creux NM, Myburg AA:调节植物次生细胞壁沉积的转录路线图导航。植物生态学报,2013,4:1-21。
Jin H, Cominelli E, Bailey P, Parr A, Mehrtens F, Jones J, Tonelli C, Weisshaar B, Martin C: AtMYB4转录抑制控制拟南芥抗紫外线防晒霜的产生。中华医学杂志,2000,19:6150-6161。10.1093 / emboj / 19.22.6150。
Peirson BN, Owen HA, Feldmann KA, Makaroff CA:三个拟南芥雄性不育突变体在减数分裂过程中的变化。有性植物学报,1996,9:1-16。10.1007 / BF00230361。
Alexander MP:败花粉和未败花粉的差异染色。生物技术组织化学。1969,44:117-122。10.3109 / 10520296909063335。
确认
我们感谢Edgar Sakers(拉筹伯大学)在拟南芥花药横断面上提供的技术支持,感谢Amila Avidic和Hanh Pham(拉筹伯大学)在质粒构建方面的帮助。第一作者获得了拉筹伯大学研究生研究奖学金的支持。这项研究的一部分是由澳大利亚研究理事会的联系基金资助的。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者声明他们没有竞争利益。
电子辅料
12870 _2014_278_moesm1_esm.pdf
附加文件1:图S1。:Nucleotide sequence alignment of MYB80 homologs from Arabidopsis (AtMYB80)、油菜(BnMYB80A而且BnMYB80C)和棉花(GhMYB80-1).(PDF 449 KB)
12870 _2014_278_moesm2_esm.pdf
附加文件2:表S1。:Summary of GUS activities in the transgenic lines possessing theAtMYB80启动子-格斯删除结构。(PDF 283 KB)
12870 _2014_278_moesm3_esm.pdf
附加文件3:图S3。:Partial promoter sequences alignment of theMYB80来自拟南芥的同源物(pAt80)、油菜(pBn80A而且pBn80C),棉花(pGh80)、小麦(pTa80)和大米(pOs80).(PDF 370 KB)
12870 _2014_278_moesm7_esm.pdf
补充文件7:表S4。:Plant fertility (percentage of the elongated siliques versus the total siliques) and number of thePGh80: Gh80-32R2而且PGh80: Gh80MD-32R2转基因线。(PDF 281 KB)
权利和权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。
本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。
欲查看此许可证的副本,请访问https://creativecommons.org/licenses/by/4.0/.
创作共用公共领域奉献放弃书(https://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
徐颖,Iacuone,李顺凤,李文华,李文华,李文华et al。拟南芥、棉花和芸苔属植物的MYB80同源物:绒毡层和花粉发育的调控和功能保护。BMC植物杂志14,278(2014)。https://doi.org/10.1186/s12870-014-0278-3
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-014-0278-3
关键字
- 芸苔属植物
- 棉花
- 陆地棉
- 男性不育
- MYB80
- 转录因子