摘要
背景
东莨菪内酯及其葡糖苷东莨菪素是植物合成的重要次生代谢产物,是植物抵御各种环境胁迫的防御机制。它们属于香豆素类,是一类具有重要生物活性的植物化学物质,广泛应用于医疗和化妆品工业。虽然大量的研究表明,各种香豆素自然地存在于几种植物中,但香豆素生物合成及其调控的细节尚不清楚。先前的研究表明,香豆素(主要是东莨菪碱和东莨菪内酯)存在于拟南芥(拟南芥)的根,但到目前为止,对其积累在这一模式植物的自然变异一无所知。因此,拟南芥香豆素生物合成的遗传结构尚未被研究。
结果
本研究通过比较7份拟南芥药材中东莨菪碱和东莨菪内酯的含量变化。随后,利用高级互交重组自交系(AI-RILs)群体EstC (Est-1 × Col)进行数量性状位点(QTL)定位。为了揭示东莨菪碱和东莨菪内酯生物合成的遗传基础,拟南芥根制备了两组甲醇提取物,其中一组经酶解得到之前高效液相色谱法(HPLC)定量。鉴定出1个与东莨菪碱相关的QTL和5个与东莨菪碱积累相关的QTL。这些qtl分别解释了13.86%和37.60%的东莨菪碱和东莨菪内酯表型变异。在网上对相关QTL区间的基因进行分析,发现了一些可能参与香豆素生物合成的候选基因。
结论
本研究结果首次表明拟南芥是研究植物香豆素合成自然变异的遗传和分子基础的良好模型。为进一步定位和克隆与东莨菪碱和东莨菪内酯生物合成相关的基因奠定了基础。重要的是,我们已经为这个生物合成过程确定了新的基因座。
背景
植物产生多种次生代谢物。据估计,每个物种可产生4000至20000种代谢物[1].这种巨大的生物化学多样性反映了植物生活环境的多样性,以及它们应对不同环境刺激的方式。专一次生代谢物的产生被认为可以保护植物免受生物和非生物胁迫[2].虽然拟南芥是一种小植物,世代时间短,基因组高度减少,但它拥有一组与其他植物类群一样丰富多样的次生代谢物[3.].近年来,这种模式植物被广泛用于鉴定参与次级代谢物生物合成和调控的复杂网络中的基因和酶[4].
目前,天然拟南芥种质间的遗传变异是植物生物学研究的重要基础资源[5] - [7].拟南芥具有广泛的遗传自然变异,为研究自然种群中次生代谢产物的生物合成变异提供了良好的模型。最近,对非靶向代谢组成自然变异的遗传分析发现,拟南芥种质之间的代谢物积累存在许多定性和定量差异[8] - [10].大量研究[8]、[10] - [12]证明了不同类别的次生代谢物存在丰富的遗传控制变异。香豆素(东莨菪素、东莨菪素、skimmin和盾叶甲素)是在拟南芥根部发现的次级代谢物[13] - [16].但到目前为止,对拟南芥材料间香豆素含量的自然变异尚不清楚。
香豆素是一组重要的天然化合物,为植物提供抗微生物和抗氧化活性,并作为抵御病原体攻击和非生物胁迫的防御机制产生[17].重要的是,香豆素因其广泛的治疗活性和药物开发的活跃来源而在制药行业得到广泛认可。许多香豆素在治疗烧伤和类风湿疾病方面有医学应用。呋喃香豆素属香豆素衍生物,用于治疗白癜风、白癜风和银屑病[18],这是由于它们的光反应性质。此外,它们还用于脱髓鞘疾病的对症治疗,特别是多发性硬化症[19].目前研究的产生呋喃香豆素的植物是非模式生物[20.],而且在这些物种中还没有许多方法来确定香豆素积累中潜在遗传变异的基因。东莨菪内酯是拟南芥的一种主要香豆素化合物,在许多植物物种中都有发现[21] - [29],并清楚显示其抗真菌和抗菌活性在医疗用途上很重要[30.].所有这些特性使香豆素具有商业吸引力。
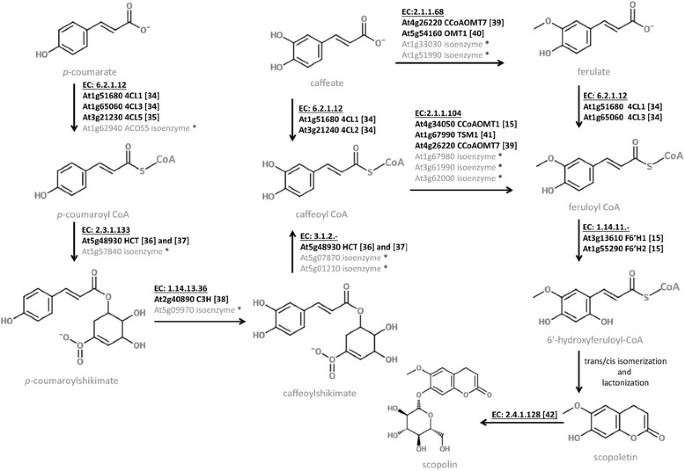
香豆素来源于苯丙素途径,苯丙素是植物中丰富的代谢物来源[31]、[32].这表明在拟南芥中可能有几种从苯丙素化合物到香豆素的分支途径[14].东莨菪内酯和东莨菪碱的生物合成对CYP98A3有很强的依赖性[14],这是细胞色素P450在苯丙素途径中催化对香豆酸酯单元的3'-羟基化[33].阿魏酰基辅酶a被认为是东莨菪内酯生物合成的主要前体[15].参与东东内酯生物合成最后一步的关键酶是将阿魏酰基辅酶A转化为2-羟基阿魏酰基辅酶A,该酶由铁(Fe) II-和2-氧戊二酸依赖双加氧酶(2OGD)家族成员编码,命名为F6'H1 [15].尽管前几年已经取得了一些进展[15]、[34] - [42)(图1),有关香豆素生物合成的许多问题仍未解决[43].特别是,香豆素生物合成的调控还没有被很好地理解。到目前为止,所有关于模式植物拟南芥香豆素生物合成的研究都是在实验室接入Col-0完成的,所有的突变和转基因植物都以Col-0为遗传背景。
东莨菪内酯和东莨菪碱的化学结构及其生物合成途径拟南芥.克隆和特征基因编码东莨菪内酯和东莨菪碱生物合成显示。相应的参考文献[15]、[34] - [42在参考资料部分列出。星号(*)表示的同工酶由内部集成酶预测管道(E2P2, 2.0版本)(植物代谢网络,http://pmn.plantcyc.org/ARA).所呈现的分子是用https://www.emolecules.com/的网站。(4CL1) 4-香豆酸:辅酶a连接酶1。(4CL2) 4-香豆酸:辅酶a连接酶2。(4CL3) 4-香豆酸:辅酶a连接酶3。(4CL5) 4-香豆酸:辅酶a连接酶5。(摘要)p-coumaroyl 3羟化酶。(CCoAOMT1)咖啡酰基辅酶A依赖性o -甲基转移酶1。(CCoAOMT7)咖啡酰基辅酶A依赖性o -甲基转移酶7。(f6’h1)阿魏酰基辅酶a 6’-羟化酶1。(f6’h2)阿魏酰基辅酶a 6’-羟化酶2。 (HCT) shikimate O-hydroxycinnamoyltransferase. (OMT1) caffeate O-methyltransferase 1. (TSM1) tapetum-specific O- methyltransferase.
为了解香豆素生物合成的遗传结构,我们对拟南芥材料中东莨菪碱和东莨菪内酯的含量进行了筛选,并进行了数量性状位点(QTL)定位。我们的研究解决了以下问题。拟南芥药材中东莨菪碱和东莨菪内素的积累是否存在自然变异?哪些遗传区域导致了这些差异?哪些可能参与东莨菪碱和东莨菪内酯生物合成的qtl的候选基因?
结果
种质间表型变异
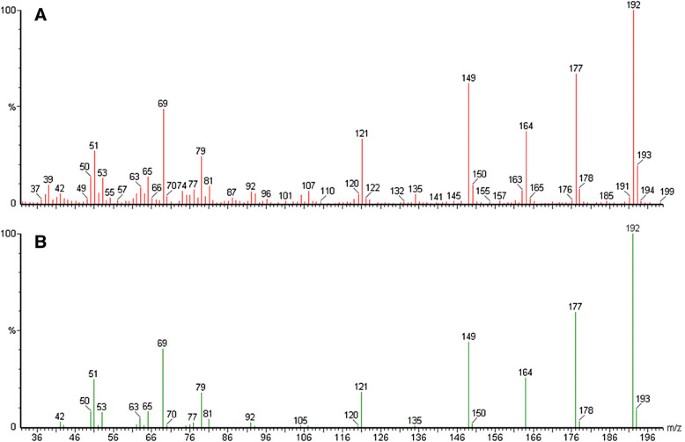
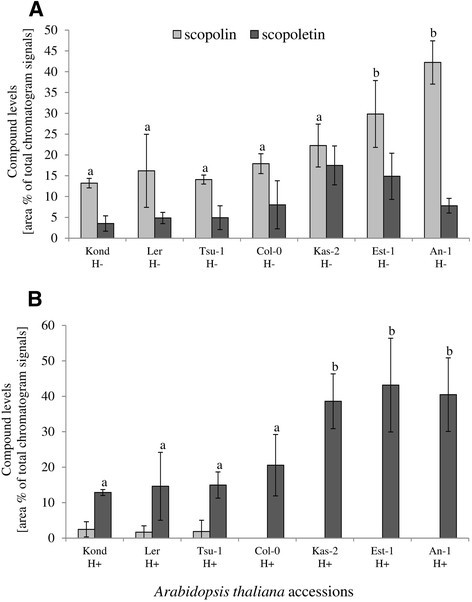
利用来自不同位置的7份天然拟南芥RIL群体的亲本,初步筛选了东莨菪碱和东莨菪内酯积累变异。登记入册种植在体外在液体培养中以获得植物根系的最佳生长。在这种条件下,大部分东莨菪内酯作为其糖苷形式,东莨菪内酯被储存在根细胞的液泡中。为了揭示东莨菪素和东莨菪素的含量,利用拟南芥根甲醇提取物的一个亚群进行酶解,以水解香豆素的糖苷形式。利用高效液相色谱法(HPLC),我们检测了根中东莨菪内酯(sct见图2),以及东莨菪碱(scl在图中2BC)。HPLC组分中东莨菪内酯的鉴别(图3.A)与谱库比较,用气相色谱/质谱(GC/MS)进一步证实(图1)3.B).对7份拟南芥药材甲醇根提取物中香豆素的定量分析清楚地表明,酶解前东莨菪素含量存在自然变化(图4A)和东莨菪内素水解后(图4B)尽管没有东莨菪碱标准,为了进一步统一分析,我们测量了东莨菪碱和东莨菪内酯的含量,作为总色谱信号的面积%。通过单因素方差分析(p < 0.001和p < 0.0001),确定了东莨菪碱和东莨菪内酯累积量组间差异有统计学意义。基于事后检验的差异不显著的值(最小差异[LSD])用相同的字母表示(图4).由于col0和Est-1在香豆素含量上存在显著差异,在此基础上,我们选择了一个由col0和Est-1杂交产生的高级互交重组自交系(AI-RILs)作图群体。利用酶解前东莨菪碱的积累值和甲醇提取物水解后东莨菪碱的含量值进行进一步的遗传分析。
东莨菪碱和东莨菪内酯积累的遗传分析
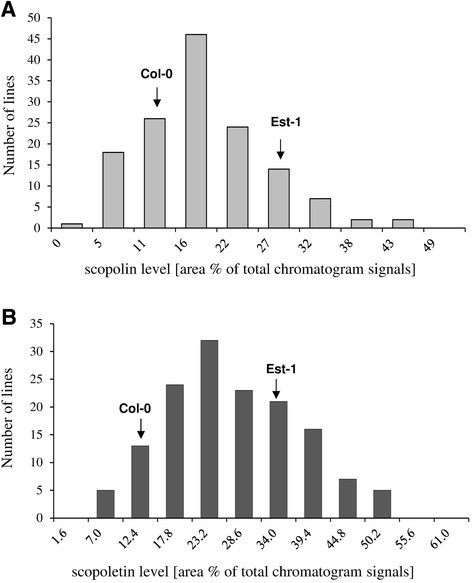
将AI-RILs (n = 144和n = 140)和亲本3个生物重复,在独立的瓶中液体培养,测定东莨菪碱和东莨菪碱的含量值。一组线条(AI-RILs)显示了更大范围的东莨菪碱(图5A)和东莨菪内酯(图5B)值高于亲本(Col-0和Est-1),这表明存在越界分离,表明EstC群体中存在多个位点的变异。AI-RILs中最低的东莨菪碱含量为1.90(测量的总色谱信号的面积%),对应于最小Col-0值的20%。东莨菪碱最大相对值为45.13,为Est-1最大值的159%。东莨菪内酯含量分别为7.82 (Col-0最小值的54%)和54.93 (Est-1最大值的159%)1).有了商业上可用的东莨菪内酯标准,我们能够在AI-RILs定位群体(Col-0和Est-1)的两个亲本(酶解前后)中量化东莨菪内酯的含量为μg/g鲜重(μg/gFW)。未水解的根中东莨菪内酯在Col-0和Est-1中含量分别为~3 μg/gFW和~10 μg/gFW,水解后的根中东莨菪内酯含量分别为~16 μg/gFW和~86 μg/gFW。这些数值分别为~18、54,82和449 nmol/gFW,在文献数据的范围内,根据不同的植物培养方式,其变化范围为~1 ~ 1200 nmol/gFW [14].计算得到的亲本株数(见表1)2)可以作为整个映射种群中产品总体数量的参考。
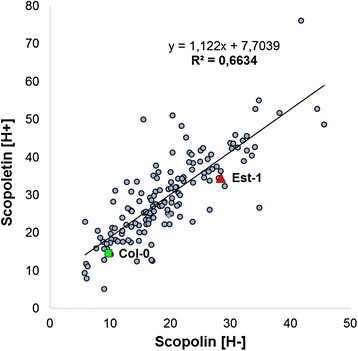
为了确定由基因决定的变异比例,广义遗传力(H2)中东莨菪碱和东莨菪内酯的含量在方法部分中描述。在AI-RIL群体中,东莨菪碱含量的广义遗传力范围为0.45 ~ 0.501).为探讨酶解前甲醇根提取物中东莨菪素含量与酶解后提取物中东莨菪素含量的关系,以每个AI-RILs的香豆素平均值作为表型值进行性状相关分析。相对较强的遗传相关性(R2= 0.6634)在AI-RILs种群水解前后测定的香豆素水平之间,表明东莨菪碱和东莨菪内酯生物合成的遗传共调控(图6).
东莨菪碱和东莨菪内酯积累的qtl定位
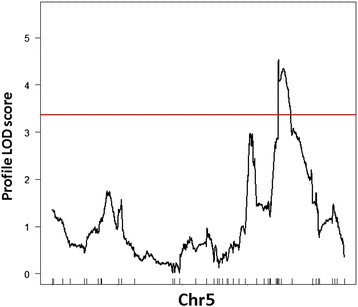
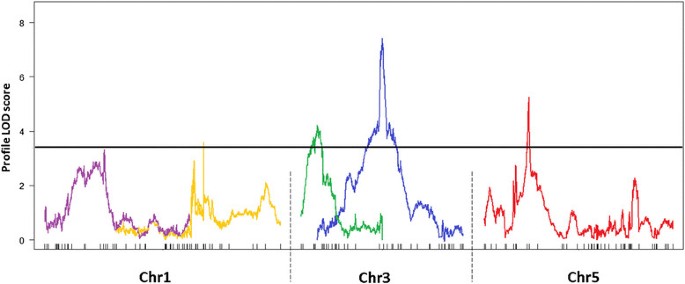
共检测到6个QTL,其中1个检测到东莨菪碱,5个检测到东莨菪内酯积累QTL (Table3.).结果表明,6个QTL中有3个效应量在10% PVE以下,其效应量占表型方差的7.0% ~ 16.7%。在第5号染色体底部检测到1个东莨菪碱积累QTL (SCL1)(图1)7)解释13.86%的PVE(表3.)和5个与东莨菪内酯积累相关的qtl (SCT1 - SCT5)分别位于染色体1、3和5上(图8、表3.).在第2、4染色体上未检测到qtl。为了改进解释东莨菪内素含量变异的QTL模型,采用两个QTL (SCT4和SCT5)作为辅助因子进行MQM方法。我们已经将1号染色体上的QTL (SCT1)纳入模型,尽管其LOD评分略低于阈值(3.327)。整个模型解释了东莨菪内酯含量的37.6%的差异。主效应位点之间未检测到上位性。
通过QTL定位发现香豆素生物合成的已知和新位点
AI-RILs群体中东莨菪碱(SCL1)和东莨菪碱(SCT1和SCT2)积累变异的部分qtl与香豆素生物合成过程(植物代谢网络,植物代谢网络)相关基因共定位。http://plantcyc.org/,图1).我们检测到了7个与检测到的qtl共定位的、用于东莨菪内酯和东莨菪碱生物合成的编码酶的克隆和特征化基因(见附加文件)1).在SCL1区间内,有两个非常好的候选者,该区间的特点是LOD评分值最高。其中At5g48930编码草酸o -羟基肉桂酰转移酶(HCT), At5g54160编码咖啡酸/5-羟基阿魏酸o -甲基转移酶(OMT1)。重要的是,这两个基因都在根中表达(表中的SCL1)4).在SCT1和SCT2区间内,发现了更多可能的东莨醇含量变化的候选基因:编码o -甲基转移酶家族蛋白的At1g33030、At1g51990、At1g67980和At1g67990 (TSM1);At1g51680和At1g65060编码4-香豆酸CoA连接酶(分别为4CL1和4CL3);At1g62940编码酰基辅酶a合成酶(ACOS5);At1g55290编码阿魏酰基辅酶a邻羟基化酶2 (f6’h2)。
为了揭示其他可能的潜在QTL,我们选择了2个与东莨菪碱含量相关的QTL (SCT4和SCT5)和1个与东莨菪碱积累相关的QTL (SCL1)进行进一步研究在网上分析。各QTL解释表型方差百分比最高,LOD评分值最高。对所选QTL区间内所有基因的注释功能进行检测。因此,我们选择了可能受环境胁迫诱导的转录因子编码基因和根据注释功能可能参与东莨菪碱和东莨菪内酯生物合成的酶编码基因。随后,我们执行在网上分析所选基因的组织分布和表达水平。只有在根中表达的基因被选择作为进一步研究的可能的候选人。因此,我们选择了一组值得密切关注的基因,认为它们可能是东莨菪碱和东莨菪内酯积累中潜在变异的新位点4).在可能与东莨菪内酯积累有关的候选者中,一个特别有趣的是CYP81D11基因(At3g28740)编码细胞色素P450家族的一个成员,位于3号染色体(表中SCT4)的QTL内4).根据1001基因组计划数据库(www.1001genomes.org)和我们实验室Est-1的重测序数据(见附加文件2而且3.,表示为Est-1*)CYP81D11该基因在EstC作图群体亲本系和本研究中测试的其他材料的编码序列中包含多个SNPs和一个indel(见附加文件)2).其他有趣的候选基因是位于5号染色体QTL区间内的3个基因(At5g14340, At5g14750, At5g15130)4),编码MYB和WRKY转录因子家族成员。这些基因在根中相对高表达,它们的表达是由各种环境胁迫诱导的[44].在5号染色体上的QTL中检测到一个可能与东莨菪碱积累有关的特别有趣的候选者(见表中的SCL1)4).它是At5g53990,编码一个udp -糖基转移酶,在拟南芥根中表达较高[44].根据1001基因组计划和我们对Est-1的重测序数据,该基因在包括亲本在内的测试材料的编码序列中包含多个snp(见附加文件)3.).有趣的是,CYP81D11而且UDP-glycosyltransferase来自Est、Est-1(均来自1001基因组计划数据库)和在我们实验室重新测序的Est-1*的序列是不相同的(见附加文件)2而且3.).这需要进一步核实。
讨论
本文报道了拟南芥两份材料中东莨菪素和东莨菪素积累变异的QTL定位研究,从而证明了拟南芥自然变异在阐明香豆素生物合成的遗传和分子基础方面的有效性。
拟南芥重组自交系(RIL)群体数量众多,被广泛应用于众多qtl的鉴定,这些qtl控制着拟南芥的生长发育、对不同生物和非生物胁迫的抗性以及化合物含量[5]、[7]、[9]、[45]、[46].在大多数研究中,发现的QTL平均数量在1 ~ 10个之间,至少检测到一个主要QTL [47].本研究检测到1个与东莨菪碱积累相关的QTL, 5个与东莨菪碱积累相关的QTL,与田间平均结果一致。与RILs相比,使用AI-RILs定位群体具有优势,因为在自交固定基因型之前,重组的机会会增加[48].因此,使用AI-RILs绘制种群,可以捕获更多的重组事件[48],使我们能够检测到效应量低至7.0% PVE的qtl。
一旦QTL被鉴定出来,接下来的挑战就是识别被检测QTL的基因。在大多数情况下,存在于QTL区间的大量基因不能直接检测候选基因。为了减少定位区域,对QTL周围的许多个体进行了精细定位。更准确的QTL定位有助于候选基因的选择。尽管如此,如果QTL效应相对较小,执行精细的映射实际上可能是困难的[49].当有多个数据集可用时(拟南芥就是如此),就有可能提高准确性,并在绘制的QTL区间内测试基因的候选资格[49]。因此,利用拟南芥的高通量表达数据和大量用于构建作图群体的全基因组序列来识别QTL下的候选基因似乎是一种现实的可能性。在植物和动物中,有使用表达阵列来识别与数量性状有因果关系的基因的成功例子[50]、[51].本研究在东莨菪碱和东莨菪内酯含量的QTL区间中发现了可能的候选基因,包括已知的和新的位点。需要进一步的功能分析,包括重测序、功能缺失等位基因的鉴定以及通过杂交或遗传转化进行基因互补,以证明所选择的可能的候选基因在香豆素生物合成及其调控中的作用。
从生态学的角度进一步认识香豆素生物合成的分子机制,有助于进一步探索香豆素生物合成相关基因的生理作用机制。最近有研究表明,2'-OG双加氧酶家族的一些成员,包括东莨菪内酯生物合成的关键酶F6'H1,可能参与了与铁稳态相关的植物细胞缺铁反应和代谢调节[52].其他最新研究表明,缺铁会诱导拟南芥根部分泌东莨菪内酯及其衍生物[53],而F6'H1是香豆素生物合成所必需的,香豆素作为战略i型铁获取机制的一部分被释放到根际[54].此前,在8份拟南芥材料中明确检测到根系渗出剖面存在自然变异[55].上述研究结果使利用天然发生的种内变异研究香豆素在拟南芥中的生物合成变得更加有希望和最新。
结论
综上所述,本文首次在7份拟南芥材料中发现东莨菪内酯及其葡糖苷、东莨菪碱的种内积累存在自然变异。尽管这些材料不能完全代表拟南芥中存在的广泛遗传变异,但我们认为这些材料应该反映了对当地环境因素的遗传适应[6].通过对东莨菪碱和东莨菪碱在EstC作图群体中的变异进行QTL定位研究,确定了新位点。这些结果表明,拟南芥香豆素含量的自然变异具有复杂的分子基础。重要的是,它们也为香豆素生物合成相关基因的精细定位和克隆提供了基础。
方法
植物材料
七个拟南芥安特卫彭(安-1,比利时),哥伦比亚(0号col,德国),埃斯特兰(Est-1,爱沙尼亚),克什米尔(卡斯-2,印度),康达拉(康德,塔吉克斯坦),兰茨贝格erecta(左呃(波兰)和Tsu(日本)是现有RIL群体的亲本,代表来自不同位置的材料,用于初步筛选东莨菪内酯和东莨菪碱积累的变异。利用哥伦比亚(Col-0)和Estland (Est-1)杂交产生的高级重组自交系(AI-RILs)作图群体(EstC)进行QTL作图实验[48].所有拟南芥种质和种群的种子均由德国科隆马克斯普朗克植物育种研究所的Maarten Koornneef提供。拟南芥品种可在NASC (http://arabidopsis.info/).EstC地图种群和标记数据可以在NASC的股票编号CS39389下获得。
生长条件
用70%乙醇浸泡2 min表面消毒,然后在5%次氯酸钙溶液中保存8 min,然后用微孔高压水冲洗3次,种植在0.5 Murashige和Skoog (MS)培养基上,MS中添加1%蔗糖,0.8%琼脂,并添加100 mg/l肌醇、1 mg/l硫胺素盐酸盐、0.5 mg/l吡啶醇盐酸盐和0.5 mg/l烟酸。为了分层,平板在4°C的黑暗中保存72小时,然后放置在规定的生长条件下。所有的植物都种好了在体外在植物生长室中,35 μmol m光照16 h-2年代-1),在18°C避光8小时。10天后,将幼苗从琼脂平板上转移到200 ml的玻璃培养皿中(直径5.5°Cm ×高10°Cm,洋红色B盖玻璃罐),其中含有8 ml无菌液体培养基。在液体培养基中生长的植物在旋转台摇床上以120转/分的速度培养。17天后采收th,叶片和根系分别冷冻于液氮中,-80°C保存。所有基因型在三个生物重复中培养(在独立的烧瓶中)。生长条件由HOBO U12数据记录器(Onset Computer Corporation, Bourne, MA)监测,每隔5分钟记录一次参数(温度、光强度和相对湿度)。
拟南芥根甲醇提取物的制备
用钢珠和超声均质处理根系组织。香豆素在4℃,80%甲醇萃取。24小时后,两组甲醇提取物在13000 rpm下离心20 min,另一组用溶解在乙酸缓冲液中的杏仁(Sigma-Aldrich)的β-葡萄糖苷酶(β-glucosidase)进行酶解,按照[56].
东莨菪内酯和东莨菪碱的高效液相色谱定量分析
分别对经和不经酶解处理的拟南芥根甲醇提取物进行分析2)使用Perkin Elmer系列200型高效液相色谱系统,该系统包括一个四系LC泵、自动进样器、柱箱和紫外检测器。所有样品加载前均用0.22 μm过滤器过滤。进样量为10 μl。在Perkin Elmer C18色谱柱SC18 (250×4.6 mm)上进行梯度洗脱,流速为0.7 ml/min,溶剂体系如下:(A) 50 mm醋酸铵pH 4.5, (B)甲醇:从30% B开始洗脱2分钟,30-80% B 40分钟,然后等压洗脱和柱再生。荧光检测器的激发波长为340 nm,发射波长为460 nm。数据分析包括东莨菪碱和东莨菪碱相对分析(占总色谱面积百分比)。
气相色谱/质谱(GC/MS)鉴定东莨菪内酯
收集含东莨菪内酯峰的高效液相色谱馏分,确定东莨菪内酯的鉴别(图3.A)用气相色谱/质谱(GC/MS)比对光谱库(图3.B).采用Perkin-Elmer GC XL气相色谱仪与质谱联用,Elite-5MS(5%二苯基/ 95%二甲聚硅氧烷)熔合在毛细管柱(30 × 0.25 μm ID × 0.25 μm df)上进行GC/MS分析。对于气相色谱/质谱检测,电子电离系统以电子冲击模式运行,电离能为70 eV。以氦气为载气,流速为1 ml/min,进样量为2 μl(分流比为10:1)。离子源温度为250°C,烘箱温度从100°C编程(等温5分钟),增加10°C/min至300°C。质谱为70 eV;扫描间隔为0.5 s,片段长度为30 ~ 450 Da。溶剂延迟为1 ~ 2 min,总GC/MS运行时间为38 min。本分析使用的质谱检测器为turbomass gold - perkins - elmer,质谱软件为turbomass ver-5.1。
定量特征
在所有AI-RILs个体的三个生物重复(在独立瓶中培养)的甲醇根提取物中定量香豆素。东莨菪碱的定量采用经酶解的甲醇提取物,东莨菪碱的含量采用未水解的甲醇提取物。
数量遗传分析
利用各ai - ril的东莨菪碱和东莨菪碱平均值进行QTL定位和性状相关分析。回归方程和R2通过在Scatterplot (Microsoft Excel)中绘制东莨菪素和东莨菪内酯的平均值来计算。广义遗传力(H2)根据公式进行了估算H2= VG/ (VG+ VE),在那里VG基因型间方差分量为和VE是剩余(误差)方差。
AI-RIL群体的QTL分析
表型资料采用Shapiro-Wilk正态性检验进行统计分析。表型数据呈正态分布,显著水平α = 0.05。QTL定位采用R软件(A Core Team, 2012,www.R-project.org)与R/qtl包[57]、[58];http://www.rqtl.org/).使用简单间隔映射(SIM)(数据未显示)进行QTL映射,然后使用多重QTL映射(MQM)程序。利用SIM检测到的LOD (odds, LOD)分数对数最高的QTL,利用MQM构建QTL模型。最终的QTL模型采用逆向消除协因子的方法,窗口大小为10°CM,最大协因子数为5。QTL存在的显著性阈值(LOD)值(P <0.05)来自10 000个排列,为3.4。“Addint”函数用于将成对的交互作用一次一个地添加到多qtl模型中。未检测到相互作用。
候选基因的选择
被标注参与香豆素生物合成过程的基因的物理位置(植物代谢网络,http://plantcyc.org/)均按TAIR (http://www.arabidopsis.org/).为了揭示其他可能的潜在qtl,我们根据以下标准构建了一个候选基因列表:(1)编码香豆素生物合成相关家族的酶的基因和编码环境胁迫诱导的转录因子的基因(http://www.arabidopsis.org/);(2)根中表达的基因(http://bar.utoronto.ca/).通过搜索TAIR (http://www.arabidopsis.org/)和拟南芥eFP浏览器(http://bar.utoronto.ca/)(表4).
统计分析
所有处理包括至少三个(或两个,如果亲本用于遗传图谱)生物重复。使用Microsoft Excel进行数据处理和统计分析(单因素方差分析、事后检验:最小显著性差异检验[LSD])。图中显示了代表标准偏差(SD)的误差条;所提供的数据为平均值。
DNA样品制备和测序
RNeasy®植物迷你试剂盒(Qiagen)按照制造商的说明使用,包括使用RNase-Free DNase Set (Qiagen)的柱上DNA消化步骤,以消除基因组DNA污染。用Maxima First Strand cDNA Synthesis Kit (Thermo Scientific)逆转录0.5 μg RNA。用从根中分离到的RNA合成cDNA, 0.4 U的铂®,20 μl的反应混合物进行基因编码序列的扩增TaqDNA聚合酶(Invitrogen), 200 μm dNTP, 1 μm引物,1 × PCR Buffer, 1.5 mm Mg2 +.反应混合物在94℃变性2分钟,然后在热循环器C1000 Touch (Bio-Rad)中进行34°循环,94°C 30秒,52°C 30秒,72°C 90秒。扩增AT5G53990 udp -糖基转移酶的基因特异性引物为5'- atgggccaaaatttttcacgct -3'和5'- TCATTCAAGATTTGTATCGTTGACT-3'和AT3G28740 CYP81D11 5'- ATGTCATCAACAAAGACAATAATGG-3'和5'- ttatggacaagagcatctaaaacc -3'。PCR产物克隆到pCR8载体(Invitrogen)中。对于质粒扩增和维持大肠杆菌使用菌株One Shot®(Invitrogen)。使用载体特异性引物M13fwd和M13rev以及BigDye®Terminator v3.1 (Life Technologies)对阳性克隆进行测序。测序反应产物用3730xl DNA分析仪分离分析。所有序列使用CLUSTALW [59].
支持数据的可用性
支持本文结果的数据集包含在本文及其附加文件中。
作者的贡献
JS对植物材料进行培养,进行次生代谢产物分离,进行QTL作图,有助于在网上分析,统计分析和结果解释。LK、RB、BB采用高效液相色谱法对香豆素进行定量。BB和RB对统计分析作出了贡献。AO参与了在网上分析。AGW为统计分析做出了贡献。EL有助于结果的解释。人工智能获得了该项目的资助,撰写论文,设计实验,解释结果,执行在网上并进行统计分析,参与植物生长优化和次生代谢产物的分离。所有作者阅读并批准最终稿。
附加文件
缩写
- 2 ogd:
-
2-oxoglutarate-dependent加双氧酶
- 4 cl1:
-
4-coumarate:辅酶a连接酶1
- 4氯:
-
4-coumarate:辅酶a连接酶2
- 4 cl3:
-
4-coumarate:辅酶a连接酶3
- 4 cl5:
-
4-coumarate:辅酶a连接酶5
- ACOS5:
-
酰coa合成酶5
- AI-RILs:
-
先进的杂交重组自交系
- 摘要::
-
p-coumaroyl 3 ' -羟化酶
- CCoAOMT1:
-
咖啡酰基辅酶A依赖的o -甲基转移酶1
- CCoAOMT7:
-
咖啡酰基辅酶A依赖性o -甲基转移酶7
- CYP:
-
细胞色素P450单加氧酶超家族
- F6'H1:
-
Feruloyl-CoA 6 '羟化酶1
- F6'H2:
-
Feruloyl-CoA 6的羟化酶2
- GC / MS:
-
气相色谱/质谱分析
- HCT:
-
Shikimate O-hydroxycinnamoyltransferase
- 高效液相色谱法:
-
高效液相色谱法
- LOD:
-
概率的对数
- 女士:
-
Murashige和Skoog中号
- 统一民族运动党:
-
多个QTL定位
- MYB:
-
转录因子超家族
- NASC:
-
诺丁汉拟南芥储藏中心
- OMT1:
-
Caffeate O-methyltransferase 1
- TSM1:
-
Tapetum-specific O -甲基转移酶
- 通过:
-
表型方差解释
- SIM卡:
-
简单的区间映射
- QTL:
-
数量性状位点
- WRKY:
-
转录因子超家族
参考文献
Fernie AR, Trethewey RN, Krotzky AJ, Willmitzer L:代谢物分析:从诊断到系统生物学。中国生物医学工程学报,2004,5(9):763-769。10.1038 / nrm1451。
Kliebenstein DJ, Osbourn A:制造新分子-植物中新代谢物途径的进化。植物学报,2012,15(4):415-423。10.1016 / j.pbi.2012.05.005。
D’auria JC, Gershenzon J:次级代谢拟南芥像野草一样生长。植物学报,2005,8(3):308-316。10.1016 / j.pbi.2005.03.012。
刘志强,刘志强,刘志强,刘志强。拟南芥植物代谢调控基因的QTL分析。植物生理学报,2011,32(3):394 - 397。10.1016 / j.jplph.2011.03.008。
Alonso-Blanco C, Aarts MG, Bentsink L, Keurentjes JJ, remond M, Vreugdenhil D, koornnef M:关于植物的发育、生理和适应,自然变异教会了我们什么?植物细胞。2009,21(7):1877-1896。10.1105 / tpc.109.068114。
koornnef M, onso-Blanco C, Vreugdenhil D:自然发生的基因变异拟南芥.植物学报,2004,19(3):357 - 362。10.1146 / annurev.arplant.55.031903.141605。
拟南芥的自然变异:从分子遗传学到生态基因组学。植物生理学报,2012,38(1):1 - 4。10.1104 / pp.111.189845。
王俊杰,傅俊,德沃斯,罗曼,郝瑞德,比诺,王俊杰,范德普拉斯,李彦宏,李彦宏:植物代谢的遗传学研究。中国生物医学工程学报,2006,38(7):842-849。10.1038 / ng1815。
李志强,李志强,李志强,李志强,李志强,李志强,李志强,李志强,李志强,李志强,李志强,李志强,李志强,李志强,李志强。植物代谢和生物量QTL的鉴定拟南芥平行分析RIL和IL群体。植物学报,2008,53(6):960-972。10.1111 / j.1365 - 313 x.2007.03383.x。
Rowe HC, Hansen BG, Halkier BA, Kliebenstein DJ:生化网络和上位性形成了拟南芥代谢物。植物细胞。2008,20(5):1199-1216。10.1105 / tpc.108.058131。
刘志强,刘志强,刘志强,等:脂肪型、吲哚型和苄基型硫代葡萄糖苷生产的比较数量性状位点定位拟南芥叶子和种子。中国生物医学工程学报,2001,15(1):369 - 369。
Tholl D, Chen F, Petri J, Gershenzon J, Pichersky E:两种倍半萜合成酶负责拟南芥花中发出的倍半萜的复杂混合物。植物学报,2005,42(5):757-771。10.1111 / j.1365 - 313 x.2005.02417.x。
张建平,张建平,张建平,等:拟南芥根中吲哚和苯丙素次生代谢的结构复杂性、对感染的不同反应和组织特异性。植物生理学报,2005,38(2):353 - 356。10.1104 / pp.104.057794。
Kai K, Shimizu B, Mizutani M, Watanabe K, Sakata K:香豆素在拟南芥.植物化学。2006,67(4):379-386。10.1016 / j.phytochem.2005.11.006。
Kai K, Mizutani M, Kawamura N, Yamamoto R, Tamai M, Yamaguchi H, Sakata K, Shimizu B:东莨菪内酯是通过2-氧戊二酸依赖的双加氧酶对阿魏酰基辅酶a进行邻羟基化生物合成的拟南芥.植物学报,2008,55(6):989-999。10.1111 / j.1365 - 313 x.2008.03568.x。
Rohde A, Morreel K, Ralph J, Goeminne G, Hostyn V, De RR, Kushnir S, Van DJ, Joseleau JP, Vuylsteke M, Van DG, Van BJ, Messens E, Boerjan W:分子表型pal1而且pal2突变体的拟南芥揭示了苯丙素、氨基酸和碳水化合物代谢的深远影响。植物细胞。2004,16(10):2749-2771。10.1105 / tpc.104.023705。
Baillieul F, de Ruffray P, Kauffmann S: α -、β -和γ -大孢子permin的分子克隆和生物学活性疫霉megaspermaH20.植物生理学报,2003,31(1):155-166。10.1104 / pp.012658。
补骨脂素和紫外光治疗银屑病。中国医学杂志2007,357(7):682-690。10.1056 / NEJMct072317。
武尔夫H, Rauer H, During T, Hanselmann C, Ruff K, Wrisch A, Grissmer S, Hansel W: Alkoxypsoralens,新型非肽阻断剂的shaker型K +通道:合成和光反应性。化学学报,1998,41(23):4542-4549。10.1021 / jm981032o。
Karamat F, Olry A, Doerper S, Vialart G, Ullmann P, Werck-Reichhart D, Bourgaud F, Hehn A: CYP98A22,一种专门用于合成绿原酸的酚酯3'-羟化酶,作为一种新的工具来提高呋喃香豆素的浓度太阳之graveolens.中国生物医学工程学报,2012,12:152-10.1186/1471-2229-12-152。
Bertolucci SK、Pereira AB、Pinto JE、Oliveira AB、Braga FC:不同遮荫水平下薇甘菊和glomerata叶中香豆素和贝壳兰型二萜含量的季节变化。生物化学,2013,10(2):288-295。10.1002 / cbdv.201200166。
王晓东,刘文华,刘文华,等:东莨菪内酯在烟草花叶病毒侵染株中的表达。植物生理学报。2002,15(2):349 - 356。10.1034 / j.1399-3054.2002.1150208.x。
王晓峰,王晓峰,王晓峰。不同品种木薯片中东莨菪内酯含量的变化。中国食品农业科学,2011,91(13):2344-2347。10.1002 / jsfa.4465。
Matsumoto S, Mizutani M, Sakata K, Shimizu B:甘薯伞形花酮和东莨菪内酯形成过程中对香豆酰基辅酶A/阿铁酰基辅酶A的原羟基化酶的分子克隆和功能分析林。植物化学。2012,74:49-57。10.1016 / j.phytochem.2011.11.009。
黄晓明,李彦宏,李彦宏,李彦宏,李彦宏,李彦宏。一种新型抗腐向日葵头状花序酚类化合物的抑菌活性研究。化学学报,2007,33(12):2245-2253。10.1007 / s10886 - 007 - 9388 - 9。
吲哚乙酸和激动素对东莨菪碱-东莨菪碱水平与烟草组织生长关系的影响在体外.植物生理学报,1960,35(6):934-941。10.1104 / pp.35.6.934。
Schmeda-Hirschmann G, Jordan M, Gerth A, Wilken D, Hormazabal E, Tapia AA:次生代谢产物含量菲比安娜imbricata植物和体外培养。张志强,张志强。2004,29(4):449 - 456。
田口G, Fujikawa S, Yazawa T, Kodaira R, Hayashida N, Shimosaka M, Okazaki M:东莨菪内酯在2,4- d处理的烟草细胞中从培养基中摄取并转化为东莨菪碱后在液泡中积累。植物学报,2000,15(2):393 - 397。10.1016 / s0168 - 9452(99) 00212 - 5。
向日葵植物抗毒素、阿亚平和东莨菪内素的代谢:植物与真菌的相互作用。植物生理学报。1986,82(1):167-172。10.1104 / pp.82.1.167。
东莨菪内酯——一种具有药用价值的香豆素植物抗毒素。植物学报,2012,31:47-56。10.1080 / 07352689.2011.616039。
苯丙素生物合成。Mol Plant. 2010, 3(1): 2-20。10.1093 / mp / ssp106。
拟南芥中的苯丙素途径。拟南芥图书。2011,9:e0152-10.1199/tab.0152。
Schoch G, Goepfert S, Morant M, Hehn A, Meyer D, Ullmann P, Werck-Reichhart D: CYP98A3 from拟南芥是酚酯的3'-羟基化酶,是苯丙素途径中缺失的一环。生物化学学报,2001,27(3):366 - 366。10.1074 / jbc.M104047200。
王强,王志强,王志强,张志强,张志强,张志强。四香豆酸酯类辅酶A连接酶的合成拟南芥代表被子植物中进化上不同的两个类。植物学报,1999,19(1):9-20。10.1046 / j.1365 - 313 x.1999.00491.x。
Hamberger B, Hahlbrock K: 4-香豆酸:辅酶a连接酶基因家族在拟南芥包括一种罕见的酸激酶激活酶和三种常见的同工酶。中国生物医学工程学报,2004,19(3):322 - 329。10.1073 / pnas.0307307101。
黄秋松:苯丙素代谢中控制莽草酸和喹酸酯中间体的酰基转移酶的纯化、克隆和性质。生物化学学报,2003,278(1):95-103。10.1074 / jbc.M209362200。
Hoffmann L, Besseau S, Geoffroy P, Ritzenthaler C, Meyer D, Lapierre C, Pollet B, Legrand M:羟基肉桂酰辅酶A沉默影响苯丙素生物合成。植物细胞。2004,16(6):1446-1465。10.1105 / tpc.020297。
Kuhnl T, Koch U, Heller W, Wellmann E:绿原酸生物合成:光诱导微粒体5-O-(4-香豆酰)- d -quinate/莽草酸3'-羟化酶的表征胡萝卜胡萝卜L.)细胞悬浮培养。生物化学,1987,258(1):226-232。10.1016 / 0003 - 9861(87) 90339 - 0。
古jon T, Sibout R, Pollet B, Maba B, Nussaume L, Bechtold N, Lu F, Ralph J, Mila I, Barriere Y, Lapierre C, Jouanin L:拟南芥o -甲基转移酶表达缺失对木质素和钠载酯的影响。植物生物学杂志,2003,51(6):973-989。10.1023 /: 1023022825098。
Wils CR, Brandt W, Manke K, Vogt T:一个氨基酸决定拟南芥ccoaomt样o -甲基转移酶的位置特异性。中国科学:地球科学,2013,31(6):683-689。10.1016 / j.febslet.2013.01.040。
Grienenberger E, Besseau S, Geoffroy P, Debayle D, Heintz D, Lapierre C, Pollet B, Heitz T, Legrand M: A BAHD酰基转移酶在拟南芥花药的绒膜中表达,参与羟基肉桂酰亚精的合成。植物学报,2009,58(2):246-259。10.1111 / j.1365 - 313 x.2008.03773.x。
张志明,张志明。2,4-二氯苯氧乙酸对烟草组织培养中东莨菪内酯转化为东莨菪碱的影响。植物生理学报。1982,69(4):810-813。10.1104 / pp.69.4.810。
刘志强,刘志强,刘志强,刘志强,刘志强。植物中香豆素的生物合成:细胞色素P450酶的一个重要途径。植物化学,2006,5:293-308。10.1007 / s11101 - 006 - 9040 - 2。
Winter D, Vinegar B, Nahal H, Ammar R, Wilson GV, Provart NJ:一个“用于探索和分析大规模生物数据集的电子荧光象形图形浏览器”。科学通报,2007,2:e718-10.1371/journal.pone.0000718。
Fernie AR, Klee HJ:利用自然遗传多样性来理解代谢组织和调节。植物学报。2011,2:59-
李志强,李志强,李志强,李志强,李志强,李志强,李志强,李志强,李志强,李志强拟南芥RIL和IL人群。植物学报,2009,59(5):777-788。10.1111 / j.1365 - 313 x.2009.03910.x。
李春梅,王丽娟,王丽萍,王丽萍,王丽娟:不同种群花期分化的遗传结构拟南芥.植物化学。2013,197(4):1321-1331。10.1111 / nph.12109。
Balasubramanian S, Schwartz C, Singh A, Warthmann N, Kim MC, Maloof JN, Loudet O, Trainer GT, Dabi T, Borevitz JO, Chory J, Weigel D: QTL定位新拟南芥先进的交叉重组自交系。科学通报,2009,4 (2):e4318-10.1371/journal.pone.0004318。
价格AH:信不信由你,qtl是准确的!植物学报,2006,11(5):213-216。10.1016 / j.tplants.2006.03.006。
结合定位和排列:候选基因鉴定的一种方法。中国生物医学工程学报,2002,30(3):393 - 393。10.1073 / pnas.222549199。
Werner JD, Borevitz JO, Warthmann N, Trainer GT, Ecker JR, Chory J, Weigel D:定量性状位点定位和DNA阵列杂交鉴定出FLM缺失是导致自然花期变异的一个原因。中国生物医学工程学报,2003,19(3):357 - 361。10.1073 / pnas.0409474102。
Vigani G, Morandini P, Murgia I:通过探索依赖于2'- og的双加氧酶、缺铁反应和缺铁条件下发生的代谢调节之间的联系来寻找植物中的铁传感器。植物学报。2013,4:169-
傅克roy P, Siso-Terraza P, Sudre D, Saviron M, Reyt G, Gaymard F, Abadia A, Abadia J, varez-Fernandez A, Briat JF: ABCG37转运蛋白参与拟南芥根对铁缺乏的反应中东莨菪内酯及其衍生物的分泌。叶绿醇。2014,201(1):155-167。10.1111 / nph.12471。
Schmid NB, Giehl RF, Doll S, Mock HP, Strehmel N, Scheel D, Kong X, Hider RC, von Wiren N: feruloyl - coa6 '-hydroxylase1依赖的香豆素介导拟南芥中碱性底物对铁的获取。植物生理学报,2014,35(1):393 - 393。10.1104 / pp.113.228544。
Micallef SA, Shiaris MP, Colon-Carmona A:影响拟南芥根际细菌群落的调查和根系分泌物的自然变异。应用生态学报,2009,60(6):1729-1742。10.1093 / jxb / erp053。
黄光裕,刘志强,刘志强,等:大豆黄酮和呋喃香豆素共轭物的定量分析补灰质l .(豆科)。植物化学。1997,8:27-31。10.1002 / (SICI) 1099 - 1565 (199701) 8:1 < 27: AID-PCA331 > 3.0.CO;通透。
王志强,王志强,杨森,王志强,KW: R/qtl:高通量多重qtl图谱。生物信息学。2010,26(23):2990-2992。10.1093 /生物信息学/ btq565。
王志强,刘志强,王志强,等。杂交组合的qtl定位。生物信息学。2003,19(7):889-890。10.1093 /生物信息学/ btg112。
Thompson JD, Higgins DG, Gibson TJ: CLUSTAL W:通过序列加权、位置特异性间隙惩罚和权重矩阵选择来提高渐进式多序列比对的灵敏度。中国生物医学工程学报,1994,19(3):393 - 397。10.1093 / nar / 22.22.4673。
确认
本研究得到了波兰国家科学中心(6815/B/P01/2011/40)、波兰科学基金会(HOMING计划)和LiSMIDoS博士奖学金(UDA-POKL.04.01.01-00-017/1000)的支持。开放获取出版费用由MOBI4Health项目支持,该项目已获得欧盟第七框架计划的研究、技术发展和示范资金,根据316094号赠款协议。我们感谢来自位于科隆的马克斯普朗克植物育种研究所的Maarten Koornneef提供了本研究中使用的所有拟南芥种子,并对手稿进行了批判性的阅读。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者声明他们之间没有利益冲突。
电子辅料
12870 _2014_280_moesm1_esm.pdf
附加文件1:图S1。:The position of known loci involved in scopolin and scopoletin biosynthesis. (PDF 161 KB)
12870 _2014_280_moesm2_esm.pdf
附加文件2:图S2。:Multiple Sequence Alignment of coding sequences ofAtCYP81D11CLUSTALW产生的基因。(PDF 73 KB)
12870 _2014_280_moesm3_esm.pdf
附加文件3:图S3。:Multiple Sequence Alignment of coding sequences ofAtUDP-glycosyltransferaseCLUSTALW产生的基因。(PDF 67 KB)
权利和权限
开放获取本文根据知识共享署名4.0国际许可协议授权,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和源代码,提供知识共享许可协议的链接,并说明是否进行了修改。
本文中的图像或其他第三方材料均包含在本文的知识共享许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的知识共享许可中,并且您的预期使用不被法定法规允许或超过允许的使用,您将需要直接从版权所有者获得许可。
如欲查阅本牌照副本,请浏览https://creativecommons.org/licenses/by/4.0/.
知识共享公共领域转让豁免书(https://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在对数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
J. Siwinska, L. Kadzinski, R. Banasiuk。et al。影响东莨菪碱和东莨菪内酯生物合成的qtl的鉴定拟南芥.BMC植物杂志14,280(2014)。https://doi.org/10.1186/s12870-014-0280-9
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-014-0280-9
关键字
- 香豆素类
- 自然变化
- 工厂环境交互
- 东莨菪亭
- Scopolin
- 次生代谢
- QTL定位