摘要
背景
重花驯化在观赏植物中具有重要的应用价值,为研究人类选择的形态改变机制提供了一个很好的系统。经典的ABC模型提供了一个控制花器官特征和器官发生的遗传框架,其中关键的调控因子已经在许多植物物种中被识别和评估。近年来的分子研究强调了c类同源基因的重要性,其功能衰减导致了不同物种的花多样性。培养山茶L.具有多种类型的重瓣花,但其形态分化的分子机制尚不清楚。
结果
在本研究中,我们克隆了c类同源基因CjAG在c .粳稻.我们分析了的表达模式CjAG在野生c .粳稻,并进行异位表达拟南芥.这些结果表明CjAG共同的c级保守功能,控制雄蕊和心皮的发育。进一步分析了CjAG在两个不同的地方c .粳稻双花品种“石八雪石”和“金盘梨芝”,均表现出这种表达CjAG“石八雪石”花瓣高度收缩,“金盘立枝”花瓣内部扩张。此外,通过对B类和c类基因的详细表达分析,揭示了“金盘荔枝”内部器官中B类基因的差异模式。
结论
这些结果表明,的收缩和膨胀CjAG表达与不同类型重瓣花的形成有关。我们的研究表明,在重瓣花的驯化中,c类基因的表达有两条不同的轨迹c .粳稻.
背景
植物育种是人类选择的过程,通过对控制植物发育的关键基因进行基因修饰,从而获得更理想的性状[1]、[2].已经报道了几个很好的例子,其中关键的调控基因经历了人类的选择,导致了基因功能或表达的改变,从而产生了理想的性状[3.]、[4].例如,墨西哥类蜀黍branched1(tb1),编码TCP转录因子,已被确定为玉米从其野生祖先分枝变化的主要贡献者,墨西哥类蜀黍,由于其规管要素的改变[3.]、[5].研究植物驯化的分子遗传机制可以为现代基因工程提供有价值的信息,也可以阐明形态适应的演化[1].
花发育的ABC模型最初是通过遗传研究建立的拟南芥而且金鱼草majus[6]、[7].花器官识别基因A、B、C三类均编码MIKCC-type mads域转录因子除外无瓣2,编码AP2结构域转录因子的a类基因[6]、[8]、[9].这两个答:芥而且答:majus具有典型的花结构——第一轮萼片,第二轮花瓣,第三轮雄蕊,第四轮和中间的心皮。根据ABC模型,A-功能基因决定萼片,B和A共同决定花瓣,B和C共同决定雄蕊,C单独决定心皮[6]、[9].随后的研究将该模型阐述为D功能控制胚珠发育的ABC(DE)模型,E功能(9月,SEPALLATA家族基因)编码A、B和C花器官特征基因的辅因子[10] - [12].近年来,很明显,“A函数”可能只针对于十字花科该模型的其余特征似乎在开花植物中广泛保守[12] - [14].
然而,不同物种花形态的显著多样性表明,A、B和C基因功能的进化改变可能是花多样性的基础。越来越多的“非模式”开花物种的特征强化了这一观点,即非典型的花结构通常是通过模式物种中发现的调控基因的转移表达或新功能化而进化的[15]、[16].例如,花的内外器官排列Lacandonia schismatica与B-和C-函数直方图的改变表达一致[17].相似地,b类基因的功能细化耧斗菜已被证明有助于发育独特的花瓣状器官[18].更令人惊讶的是,尽管水仙花的花冠呈花瓣状,但C-功能基因的晚期表达却在水仙花的花冠中被检测到[19],这表明花冠可能具有类似雄蕊的起源,但发育途径的变化决定了形态发生[19].无性生殖的(AG))是唯一的C类基因拟南芥它在包括单子叶植物在内的许多高等植物中的功能是高度保守的[20.]、[21].在Davidia involucrata,苞片器官与花瓣相似,但同时检测到B-和C-功能同源体的表达[22],这表明ABC基因的某些表达组合可能不足以指定预期的花器官特征。形态创新可能需要不同遗传途径的复杂相互作用或基因表达水平的重组,从最初的模式形成到器官形成。
重瓣花是观赏开花植物最重要的特征之一,其特征是花瓣过度发育。人类对审美特征的选择被认为在大量栽培的重瓣花的存在中起着关键作用[2]、[4].近年来,在一些观赏品种中已经发现了重瓣花的驯化。在大多数情况下,双花品种是从它们的野生祖先中衍生出来的。23]、[24].基于ABC模型的框架,对许多物种的重瓣花形成机制进行了深入的研究[1].与ABC模型一致,C功能缺失或C功能基因表达的改变是导致花瓣过多的关键因素。例如,在Thalictrum thalictroides的功能丧失AG)直接同源(ThtAG1)导致双花生长[25].也是外显子的突变AG)相同器官中李属lannesiana被发现导致该物种形成双瓣花[24].在栽培的玫瑰中,限制性的表达AG)Orholog已被证明有助于重瓣花的发育[1]、[26].这些研究在本质上支持了ABC模型的基本原则,并揭示了C类基因的操纵对观赏开花植物的双花驯化至关重要。然而,控制不同类型重瓣花形态的分子机制仍不清楚。人类的选择如何在一个物种中产生如此多的双花形式的问题仍然没有答案。在c .粳稻,像大多数其他观赏花卉一样,驯化过程导致了几种类型的重瓣花,其特征是不同程度和形态的花瓣过多[27] - [29].重瓣花有五种主要类型,其独特的花型排列方式表明,重瓣花可能经历了多个驯化过程。在这些重瓣花型中,“海葵”型因其内外花瓣的不同形状而特别,而典型的重瓣花型则显示出花瓣大小的梯度变化[27]、[29].因此培养c .粳稻可能为研究重瓣花发育和驯化的潜在机制提供一个独特的系统。在这项研究中,我们确定了C-function otholog,CjAG,从c .粳稻.转基因基因表达分析及异位表达拟南芥的守恒c类函数CjAG在确定雄蕊和心皮身份时。我们检查的表达模式CjAG两种不同的重瓣花品种。在完全缺乏雄蕊和心皮器官的“石八雪石”品种中,表达水平为CjAG明显减少或几乎检测不到。在花中心产生特殊的内花瓣、雄蕊和心皮的“金盘梨芝”中,在花内器官中均检测到该基因的表达水平。进一步分析“金盘荔枝”B类和C类基因的表达模式,认为内外花瓣形态的改变与器官发生过程中基因表达水平的变化有关。我们的结果揭示了两种不同的c类基因表达的调控修饰c .粳稻在复花驯化期间。
结果
植物c功能基因的鉴定与序列分析c .粳稻
为了在野生环境中鉴定c类基因c .粳稻,根据不同引物的排列设计简并引物AG)来自几种植物物种的同源物(附加文件1:表S1)。对同源克隆的扩增产物进行测序,设计用于快速扩增cDNA末端(RACE)克隆的基因特异性引物(引物列于附加文件)1:表S1)。全长序列CjAG经不同测序产物组装鉴定,并存入Genbank(登录号:KM027370)。推导出的蛋白质序列CjAG用于寻找与不同植物物种最接近的同源物,根据结果(未显示),CjAG被证明是AG)MADS-box基因家族。
以进一步描述与CjAG的26条同源序列AG)来自PLAZA 2.5和其他数据库中描述的23种植物(附加文件)2:表S2) [30.].我们发现CjAG通过序列比对分析,在所有选择的AG家族直系同源物中高度保守(图1A),二AG)位于c端区域的基序也被鉴定出来(图1A)支持CjAG的正交正交向量AG)在c .粳稻.利用这些同源序列构建了系统发育树(图1B)我们发现CjAG被置于欧迪科特支的核心中葡萄和小行星支(图1B).这个结果并行地支持了CjAG追溯至AG)共同的祖先。属山茶花属于演化枝小行星的一个目(Ericales),和的位置CjAG在系统发育树中与其系统发育关系良好。
异位表达CjAG在拟南芥
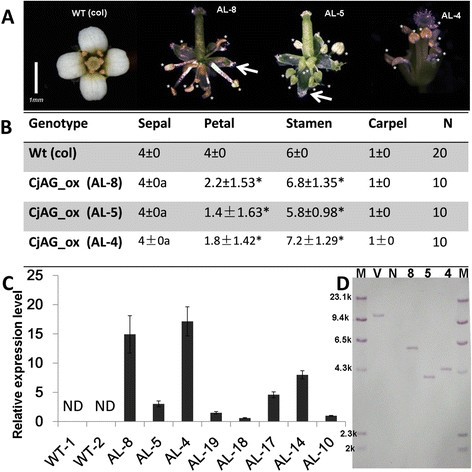
c类基因具有高度保守的决定花蕊和雌蕊特性的功能。以解决是否CjAG具有与其他物种相似的花型功能,我们产生的转基因答:芥异位表达CjAG.该构建物由花椰菜花叶病毒(CaMV) 35S启动子驱动,转化为野生型(wt)答:芥通过农杆菌介导的转化[29].我们通过可选择的标记试验和结构特异性引物PCR分析筛选和鉴定阳性株系(附加文件)1:表S1)。鉴定出8个阳性系(AL-8、AL-5、AL-4、AL-19、AL-18、AL-17、AL-14、AL-10)进行进一步表达分析(图2C).通过遗传隔离分析鉴定出3个潜在的T2单插入系,并用southern blotting分析进行检验(图2D). 3个T2系(AL-4, AL-5, AL-8)经southern印迹法显示单次插入,进一步进行表型分析(图2a - b)。为了解目的基因的异位表达水平,选择基因特异性引物进行qRT-PCR实验,提高基因的表达水平CjAG在拟南芥均被检测到(图2C).三行AL-4、AL-5、AL-8与最低行AL-18相比,分别表达了约16、14、4倍的表达2C)。
3个转基因株系(AL-8、AL-5和AL-4)与非转基因株系相比,花的发育均出现异常拟南芥.花瓣部分或全部无瓣,雄蕊数量增加(图2a - b)。详细的统计分析表明,与wt相比,花瓣数量显著减少,雄蕊数量显著增加(图2B).在萼片数量与wt相同的情况下,35S::CjAG转基因植株发育出具有柱头等雌蕊样特征的异常萼片(图2有趣的是,转基因植物没有长出额外的心皮(图2a - b)。由于C功能是已知的拮抗A功能基因和C功能的异位表达拟南芥导致萼片转变为心皮,花瓣缺失或转变为雄蕊[31],我们的数据支持这一点CjAG由于相似但较弱的效应,具有保守的c类函数。这种较弱的影响可以解释为CjAG在异源系统中起作用。
单花和重花图案的比较c .粳稻
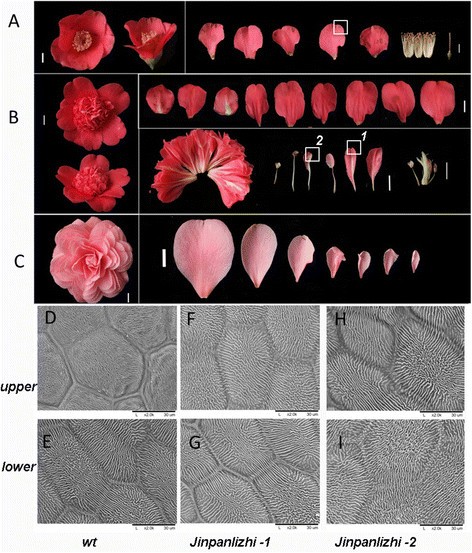
的野生单花c .粳稻具有典型的花结构,包括萼片、花瓣、雄蕊和雌蕊。在大多数情况下,在野外发现的是一个5到6瓣的单轮c .粳稻(图3.一个)。“金盘荔枝”和“石八雪石”是两种流行的双花品种,它们都有多轮花瓣,生殖器官发育迟缓或缺失(图3.a - c)。然而,“金盘梨之”和“十八雪石”的花瓣图案却有明显的不同。“金盘丽芝”是一种典型的海葵类型的重瓣花,其中两层不同的花瓣形成(图3.B).花瓣外层形态类似于单花的花瓣,9-11瓣通常呈2-3个重叠的轮生(图3.B).内部区域由大量花瓣状器官组成,其中一些是典型的花瓣和雄蕊镶嵌器官(补充档案)3.:表S3;数字3.B).详细的形态学解剖揭示了内花瓣与外花瓣在形状上的不同。从雄蕊到瓣状雄蕊再到内花瓣的梯度变化表明内花瓣可能通过雄蕊的转化部分获得花瓣身份。但总的花器官数量比wt增加(附加文件)3.:表S3)。为了进一步解决这一问题,我们利用扫描电镜(SEM)分析了金盘梨之野生花瓣和内花瓣表皮细胞的形态特征。结果表明,在大部分扩展区域,野生花瓣和金盘梨之花瓣两侧表皮细胞均为扁平,表皮细胞表面有褶皱纹理(图2)3.d - i)。金盘立枝内花瓣的表皮细胞与野生单花花瓣的表皮细胞相似。“石八雪石”品种是一个典型的正式的双花品种,其中雄蕊和雌蕊完全消失,被花瓣所取代(图2)3.C),也可以看到花瓣形状的梯度变化(图3.C)。
的表达CjAG“金盘立之”和“十八学时”呈现出不同的模式
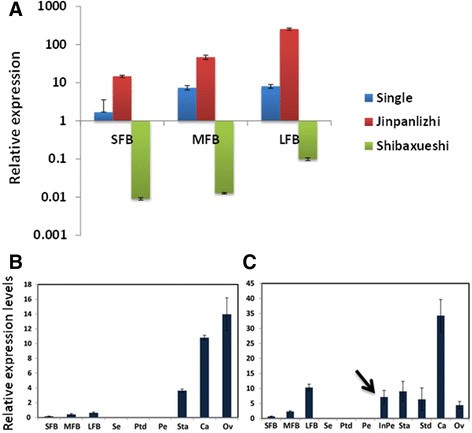
考虑到经典的ABC模型,我们想知道在‘金盘梨之’和‘十八雪石’中,c类基因的修饰是否参与了重瓣花的形成。首先,我们识别了基因的全长编码序列CjAG从“金盘荔枝”和“石八雪石”中提取,我们发现两个品种中都没有编码序列的变化(未显示)。进一步,我们比较了CjAG花芽不同发育阶段之间的差异(图4A).令人惊讶的是,我们发现CjAG在“金盘立志”和“十八学时”中,与wt相比显示出不同的模式(图4A).在《十八学时》中,的表达水平CjAG在所有三个阶段[SFB,花芽开始的早期(1-3毫米);MFB,花器官起始(4-8毫米);花芽出生长量(9 ~ 13 mm)显著降低(图4A),这表明c类基因表达的缺失与重瓣花的发育有关。然而,表达水平CjAG与wt相比,‘金盘立治’中显著增加(图4A).研究如何增加的表达CjAG我们检测了基因的表达水平CjAG在不同的花器官中。我们发现的表达式CjAG在雄蕊和心皮中检测到wt,而在萼片和花瓣中没有检测到,这是c类基因的预期结果(图4B);在《金盘丽志》中,的表达CjAG不仅在内雄蕊、瓣状雄蕊和心皮状器官中有检测,在内花瓣中也有检测。外花瓣未发现表达(图4C)。
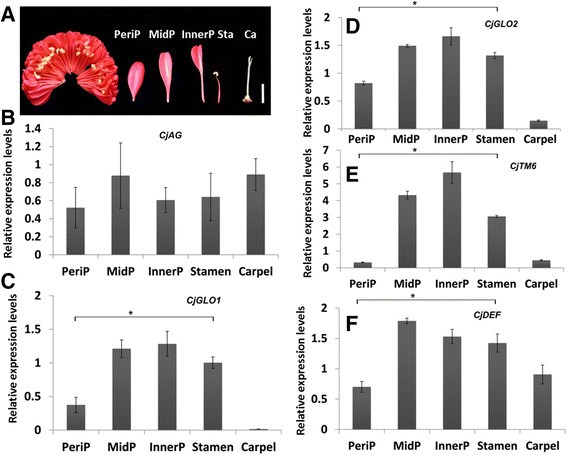
“金盘立之”内瓣形状由椭圆形逐渐演变为丝状(图5A). b类基因的表达被认为是花瓣进化和发育的关键,但与c类基因的共表达决定了雄蕊器官的身份。在c .粳稻b类基因最近发生重复,在花瓣、雄蕊和心皮中均有表达[32].为了探索B-和c -类基因在内部器官中的行为,我们检查了四种B-类和c -类基因的表达模式CjAG在不同类型的内部器官(图5B-F)。我们已经证明过了CjAG在所有内脏器官中均有表达,且表达水平相近(图5B)和B类基因(CjGLO1/2,CjTM6, CjDEF)在不同内部器官间表达量有差异,但仅外围内花瓣表达量显著低于雄蕊(图5氟)。考虑到缺乏CjAG这些结果表明,B-和C-类基因表达水平的差异可能有助于内部器官的形态发生。
讨论
重瓣花驯化的多重轨迹c .粳稻
重瓣花可能是观赏花卉中最重要的性状,而在许多商业花卉中,单瓣花的市场价值不高或很低[23]、[33]、[34].根据的研究AG)在拟南芥, c类基因不仅决定了雄蕊和心皮的特性,而且控制了花序的确定性[35].因此,减弱c类功能可以促进花瓣发育,抑制雄蕊发育,增加花器官数量,这很好地预测了重瓣花的形成[36].
目前对各种观赏植物的研究表明,许多重瓣花的驯化与c类功能的修饰有关[1]、[25]、[26].然而,与“金盘立之”不同的是,这些事件造成了c类基因功能的丧失或降低。因此,研究c类基因表达扩增与重瓣花形成的关系,不仅有助于新观赏性状的遗传改良,而且为研究表型适应机制提供了机会。特别是重瓣花的驯化山茶花和其他相关的物种导致了不同类型的重瓣花图案[27]、[33].值得注意的是,根据花器官数量、器官形状和组成的形态学特征,可以确定5种主要的重瓣花类型[27]、[28],提示了控制重瓣花发育的分子机制的多样性。ABC模型建立了花器官同一性决定的遗传模型,其中a类和b类基因共同控制花瓣的发育,而后来在其他高等植物中的研究表明,花瓣的进化和发育是由b类基因调控的[8]、[37]、[38],而A-功能可能是物种特有的[37].如前所述,AP1 /富尔语就像基因c .粳稻似乎与重瓣花的形成有关,这表明A-和C-型基因都在重瓣花发育过程中被修饰[31].对几种观赏花卉的研究表明,c类基因是导致重瓣花形成的原因[1].C-类基因表达缺失或减少都会促进花瓣发育,抑制雄蕊发育,这与经典的ABC模型在本质上是一致的。事实上,Lenser和Theissen已经回顾了目前的研究,并指出c类基因AG)是重瓣花的“节点”因素[1]、[26].
就像在c .粳稻的编码区无突变CjAG已在不同类型的重瓣花品种中发现。在《十八学时》中,的表达CjAG几乎检测不到,这可能解释了正式的重瓣花的形成(图4A).其他类型的重瓣花的表达分析明显表明了一个更复杂的改变场景CjAG表达式。在品种‘金盘丽芝’中的表达水平CjAG在花瓣、瓣状雄蕊和心皮等内部器官中表达上调,而在外部花瓣中未见表达(图4c)。内外花瓣独特的形状表明CjAG可能与内部花瓣的发育有关(图3.).最近的研究结果水仙bulbocodium而且Davidia involucrata在苞片和冠状器官中发现了意料之外的c类基因表达,这些器官属于ABC模型的非典型器官[19]、[22].因此,要了解c类基因在植物物种中的不同作用,需要对非模式物种进行广泛的功能分析。虽然目前尚不清楚转录后调控是否特别进化,但有关器官发育的调控途径的多样化是明显的。各种类型的重瓣花在c .粳稻提出一个系统来研究驯化如何影响花的发育途径,以产生新的花性状。的比较CjAG在“石八雪石”和“金盘荔枝”中的表达表明c类基因是重瓣花驯化的重要靶点;的表达模式的调整涉及多个轨迹CjAG.的调控区域序列发生变化CjAG可能是改变“金盘荔枝”和“十八雪石”品种表达模式的关键。不同的突变可能导致基因的上下调控CjAG这些重瓣花的表达。蛋白启动子和调控区域的进一步研究CjAG是否需要证明基因改造可能产生的影响CjAG表达式。
金盘梨之花瓣器官发生及ABC基因表达
有研究表明,b类基因在c .粳稻在花瓣和雄蕊中表达,也在心皮中表达较少[32].通过对金盘丽芝内部器官的基因表达量分析,发现b类基因在内花瓣、瓣状雄蕊和心皮之间的表达量不同CjAG在这些器官中表达一致(图5B-F)。这些观察表明CjAG在“金盘梨枝”中,花分生组织中的表达域可能保留,但GLO/ f样基因等其他发育调控基因的变化可能在花瓣器官发生阶段起关键作用。正如它所看到的答:majus,研究显示,花瓣的后期发育受B类基因的转录水平(DEF,如果留意)和其他转录调节因子,这些成分的自动调节环是花瓣发育的精细过程所必需的[39].可能在发育早期,C-类表达不足以决定器官发生过程以区分花瓣和雄蕊规格;在“金盘立枝”中,内部器官形态的变化可能依赖于花瓣生长基因网络的修饰。因此,介入CjAG内瓣发育可能是其与外瓣形态发生区别的主要因素。考虑到c类基因AG-和PLE-的谱系[40],另一种可能是PLE型基因可能在定义C-功能中起重要作用山茶花;同样由于缺乏全基因组分析,目前尚不清楚ABC基因的重复是否参与了重瓣花的形成。尽管C类基因的功能已经被广泛地研究,深入地分析CjAG为了进一步了解人类选择下的重瓣花形成机制,还需要其他花调控因子。
结论
在许多观赏品种中,重瓣花的驯化强调了c类功能基因的核心作用[1].研究发现,在各种重瓣花中,表达收缩或功能丧失突变有助于形成过多的花瓣[1]、[24] - [26].在这项工作中,我们分离了AG)直接同源基因,CjAG,从粳稻。CjAG野生的主要在雄蕊和心皮中表达c .粳稻的异位表达CjAG在拟南芥导致雄蕊数量增加,花瓣减少。这些结果支持的c函数守恒CjAG在c .粳稻.
此外,我们检查了表达模式CjAG在“石八雪石”和“金盘梨芝”两个重瓣品种中,呈现出不同的花瓣图案。我们发现的表达式CjAG在‘石八雪石’花发育过程中显著下调;而在“金盘立治”中上调。的详细表达分析CjAG在“金盘立治”的内脏中发现CjAG在花瓣内部扩展了它的表达。最后,对“金盘荔枝”b类基因的表达谱分析表明,花调节因子的表达模式可能参与了内花瓣的器官发生。
最后,我们证明了CjAG表达参与了两种重瓣花的驯化c .粳稻.这些结果揭示了在重瓣花形成过程中以c功能基因为靶点的两条不同的发育轨迹c .粳稻.
方法
植物材料和生长条件
本研究使用的山茶花材料生长在富阳(119°57′n, 30°04′E;中国浙江省阜阳市)自然光条件下。年平均气温约18℃,灌溉规律。为了收集RNA样本,收集处于不同发育阶段的健康花蕾或器官,并立即在液氮中冷冻,并在使用前保存在−80°C的冰柜中。拟南芥(Columbia)种子消毒后,在含有1/2 Murashige和Skoog培养基的琼脂板上4℃培养2天。然后,幼苗在22°C的长昼条件下(光照16小时/暗8小时)生长室中生长10天,然后移栽到土壤中。生长室的光强为150 mE m−2年代−1.所有原始资料均在当地有关部门许可下采集,代金券标本存放在亚热带林业研究所。
扫描电镜分析
将花瓣样品切成小片,按所述固定于FAA溶液(福尔马林:冰醋酸:70%乙醇= 1:1:18)[41].固定样品经逐步乙醇系列脱水,然后采用液态二氧化碳(型号HCP-2,日本日立)临界点干燥法干燥,然后用爱德华兹E-1010离子溅射涂布机(日本日立)涂金。用s - 3000n变压扫描电子显微镜(日立,日本)观察样品。
隔离CjAG在c .粳稻以及系统发育分析
采用柱状植物RNAout2.0试剂盒提取花蕾总RNA,用柱状DNA Erasol(北京天星基因科技有限公司,北京,中国)处理以避免DNA污染。为了生成RACE产品,纯化的总RNA按照制造商的说明书(Clontech, USA)使用合适的引物进行反转录。通过结合简并引物和适配器引物(Clontech, USA)进行触底PCR扩增靶基因。纯化梯度扩增(退火温度49℃~ 62℃)的多个PCR产物,克隆到pMD18-T easy vector (Takara, Dalian, China)进行测序。利用RACE的多个片段组装序列,通过PCR扩增和测序确认全长开放阅读框。的序列CjAG存入公共数据库[GenBank: KM027370]。引物在附加文件中列出1:表S1。推导出的蛋白质序列CjAG利用clustalW与PLAZA2.0中其他AG同源基因的蛋白序列进行比对[30.].系统发育树由MEGA5采用NJ法根据手册[42].
定量PCR分析
提取总RNA,用DNAse处理,如所述[29].利用PrimeScript RT reagent Kit (TAKARA, Japan)使用oligo (dT)引物对纯化的总RNA进行反转录。应用Primer Express 2.0 (Applied Biosystems)软件设计目的基因PCR扩增的基因特异性引物,并在定量实验前检测扩增特异性。如前所述,18S rRNA被用作内部对照[43].实时PCR反应在ABI PRISM 7300实时PCR系统(美国)上进行,使用SYBR Premix Ex Taq (TAKARA,日本)。扩增过程分为两步:95°C变性30秒,然后进行40个循环,95°C变性5秒,6060°C变性31秒。扩增步骤完成后,确定每次分析的熔化曲线,并用2- ? ?CT方法(44].
拟南芥的转化及转基因植物分析
的过表达向量CjAG,全部编码区由基因特异性引物扩增(附加文件1:表S1)克隆至pMD18-T载体(Takara, Dalian, China)。测序鉴定出序列正确、方向正确的质粒,克隆到pCAMBIA1300_35S二元载体[29].引入质粒转化为农杆菌GV3101热休克法。根癌土壤杆菌介导转化答:芥基本上按所述进行[29稍加修改。T1种子置于含50 mg/L Hyg的MS培养基上,阳性苗移栽于花盆中,在生长室中生长。鉴定T1和T2幼苗,进行进一步分析。图像通过徕卡MP6解剖显微镜获得。
基因组DNA提取和southern blotting
从三个独立的T2转基因株系中提取约5 μg基因组DNA,用限制性内切酶EcoRI (MBI Fermentas, Canada)在37℃下消化16小时,在1.2%琼脂糖凝胶上电泳分离,转移到带正电的尼龙膜上。使用地高辛标记的lambda DNA (Cat. 11218590910, Roche)作为标记。DNA在120°C下烘烤30 min固定在膜上。探针的制备、预杂交、杂交和免疫检测均按照digg - high Prime DNA Labeling and detection starter Kit (Roche, USA)的方案进行。使用附加文件中列出的引物扩增基因特异性探针1:表S1。
支持数据的可用性
支持我们结果的所有数据都包含在文章和附加文件中。
作者的贡献
HY、JL和ZL设计并构思了这项研究。YS和ZF进行了克隆、基因表达和转基因分析。YS和XL是山茶品种比较的特征。HY, JL和ZL解释数据并监督项目。HY和ZL写了这篇论文。所有作者都阅读并批准了最终的手稿。
附加文件
缩写
- 种族:
-
快速扩增cDNA端
- 扫描电镜:
-
扫描电子显微镜
- CaMV:
-
花椰菜花叶病毒
- wt:
-
野生型
参考文献
李志强,李志强:作物驯化的分子机制研究。植物科学进展,2013,18(12):704-714。10.1016 / j.tplants.2013.08.007。
Abbo S, Pinhasi Van-Oss R, Gopher A, Saranga Y, Ofner I, Peleg Z:植物驯化与作物进化:谷物和豆类的概念框架。植物科学进展,2014,19(6):351-360。10.1016 / j.tplants.2013.12.002。
杜伯利JF,高特BS,史密斯BD:作物驯化的分子遗传学。细胞学报,2006,27(7):1309-1321。10.1016 / j.cell.2006.12.006。
Ross-Ibarra J, Morrell PL, Gaut BS:植物驯化,一个确定适应遗传基础的独特机会。自然科学进展,2007,26(增刊1):1- 6。10.1073 / pnas.0700643104。
陈志伟,陈志伟,陈志伟,杜伯利,等:玉米驯化基因tb1的上游增强子对植物和花序结构有多效性影响。中国生物工程学报,2006,38(5):594-597。10.1038 / ng1784。
Coen ES, Meyerowitz EM:轮生战争:控制花发育的遗传相互作用。自然学报,1997,37(3):331 -37。10.1038 / 353031 a0。
王晓明,王晓明,王晓明,等:拟南芥花发育调控基因研究。植物细胞学报,1989,1(1):37-52。10.1105 / tpc.1.1.37。
利特A,克莱默EM: ABC模型与花器官身份的多样化。中国生物医学工程学报,2010,21(1):129-137。10.1016 / j.semcdb.2009.11.019。
鲍曼,李志刚,杨晓明,等:花卉发育的ABC模型:过去与现在。发展,2012,139(22):4095-4098。10.1242 / dev.083972。
Pelaz S, Ditta GS, Baumann E, Wisman E, Yanofsky MF: B和C花器官鉴定功能需要SEPALLATA MADS-box基因。自然科学,2000,40(6):344 - 344。10.1038 / 35012103。
Theissen G:花卉器官特性的发展:来自MADS住宅的故事。植物学报,2001,4(1):75-85。10.1016 / s1369 - 5266(00) 00139 - 4。
杨晓明,王晓明,李晓明,等。拟南芥花器官的研究进展。应用实验学报,2014,65(1):1-9。10.1093 / jxb / ert385。
Causier B, Schwarz-Sommer Z, Davies B:花器官身份:20年abc。中国生物医学工程学报,2010,21(1):73-79。10.1016 / j.semcdb.2009.10.005。
hejmans K, Ament K, Rijpkema AS, Zethof J, Wolters-Arts M, Gerats T, Vandenbussche M:矮牵牛ABC中的C和D的重新定义。植物细胞学报,2012,24(6):2305-2317。10.1105 / tpc.112.097030。
Endress PK:被子植物花的进化:形态发育框架。法令,2006,44:1-61。10.1016 / s0065 - 2296(06) 44001 - 5。
Soltis PS, Soltis DE:花的多样性和被子植物的多样性。方法Mol生物学,2014,1110:85-102。10.1007 / 978 - 1 - 4614 - 9408 - 9 - _4。
Alvarez-Buylla ER, Ambrose BA, Flores-Sandoval E, Englund M, Garay-Arroyo A, Garcia-Ponce B, de la Torre-Barcena E, Espinosa-Matias S, Martinez E, Pineyro-Nelson A, Engstrom P, Meyerowitz EM: lacandonia schismatica (Triuridaceae)花中心的B功能表达是同源异型表型的基础(vol 22, pg 3543, 2010)。植物细胞学报,2011,23(1):428-428。10.1105 / tpc.111.230160。
Kramer EM, Holappa L, Gould B, Jaramillo MA, Setnikov D, Santiago PM:植物B基因功能的研究。植物细胞学报,2007,19(3):750-766。10.1105 / tpc.107.050385。
Waters MT, Tiley AM, Kramer EM, Meerow AW, Langdale JA, Scotland RW:水仙花水仙(Narcissus bulbocodium)的花冠具有雄蕊状的特征,与传统的花轮不同。植物学报,2013,34(4):615-625。10.1111 / tpj.12150。
葛志刚,张志刚,张志刚,张志刚。柏科和杉科植物AGAMOUS亚科MADS-box基因的研究进展。生物进化与发展,2011,13(2):159-170。10.1111 / j.1525 - 142 x.2011.00466.x。
王晓明,王晓明,王晓明,陈晓明,等:被子植物MADS盒基因AGAMOUS亚家族多样性过程中的基因复制与功能进化。遗传学报,2004,16(2):1011-1023。10.1534 / genetics.166.2.1011。
杨晓明,王晓明,王晓明,王晓明。鸽树花序器官功能转移的研究进展。环境科学学报,2012,29(1):344 - 344。10.1111 / j.1469-8137.2011.03915.x。
Scovel G, Ben-Meir H, Ovadis M, Itzhaki H, Vainstein A:与石竹花型控制位点紧密连接的RAPD和RFLP标记。应用理论,1998,96(1):117-122。10.1007 / s001220050717。
刘志新,张德东,刘东,李福林,陆华:AGAMOUS同源物PrseAG外显子跳变在蔷薇科樱桃重瓣花发育中的应用。植物细胞学报,2013,32(2):227-237。10.1007 / s00299 - 012 - 1357 - 2。
Galimba KD, Tolkin TR, Sullivan AM, Melzer R, Theissen G, Di Stilio VS:双花毛蕊突变体中C类花同源异型基因功能的缺失及C-和e类蛋白相互作用。中国科学:自然科学,2012,29(3):344 - 344。10.1073 / pnas.1203686109。
Dubois A, Raymond O, Maene M, Baudino S, Langlade NB, Boltz V, Vergne P, Bendahmane M: c功能的修补:栽培玫瑰重瓣花选择的分子框架。公共科学学报,2010,5 (2):e9288-10.1371/journal. peer .0009288。
山茶花属的修订。伦敦皇家园艺学会;1958.
高俊:山茶属植物的已收集种-图解概述。浙江科学技术出版社,杭州;2005.
孙玉凯,范志强,李小林,李建勇,殷海峰:山茶APETALA1和果性同源体及其在重瓣花驯化中的作用。Mol育种,2014,33(4):821-834。10.1007 / s11032 - 013 - 9995 - 9。
Van Bel M, Proost S, Wischnitzki E, Movahedi S, Scheerlinck C, Vande Peer Y, Vandepoele K:利用PLAZA比较基因组学平台解剖植物基因组。中国植物学报,2012,29(2):379 - 379。10.1104 / pp.111.189514。
水上勇,马红:花同源异型基因AGAMOUS在转基因拟南芥中的异位表达改变了花器官的特性。中国生物医学工程学报,1992,71(1):119-131。10.1016 / 0092 - 8674 (92) 90271 - d。
Viaene T, Vekemans D, Irish VF, Geeraerts A, Huysmans S, Janssens, Smets E, Geuten K:雌蕊-复制作为(基底)菊科植物花多样化的模式。分子生物学杂志,2009,26(11):2627-2645。10.1093 / molbev / msp181。
观赏植物的育种:经典和分子方法。多德雷赫特施普林格;2002.
刘志刚,刘志刚,刘志刚:墨西哥矮牵牛花(Ruellia,棘皮科)的无果性研究。园艺学报,2012,47(9):1245-1251。
李文杰,李志刚,李志刚,李志刚,李志刚。拟南芥干细胞调控与花型形成的分子机制研究。光子学报,2001,30(6):793-803。10.1016 / s0092 - 8674(01) 00384 - 1。
Roeder AHK, Yanofsky MF:揭开重瓣花的奥秘。生物技术学报,2001,1(1):4-6。10.1016 / s1534 - 5807(01) 00013 - 2。
Litt A: A功能的评估:来自无瓣a1和无瓣a2基因谱系的证据。中国植物学报,2007,29(1):344 - 344。10.1086/509662。
爱尔兰VF:花瓣身份的演变。实验学报,2009,60(9):2517-2527。10.1093 / jxb / erp159。
Manchado-Rojo M, Delgado-Benarroch L, Roca MJ, Weiss J, Egea-Cortines M:在花瓣发育后期,缺陷和Globosa的数量水平显示了复杂的B功能转录网络拓扑。植物学报,2012,32(2):344 - 344。10.1111 / j.1365 - 313 x.2012.05080.x。
Dreni L, Kater MM: MADS重装:AGAMOUS亚家族基因的进化。植物学报,2014,201(3):717-732。10.1111 / nph.12555。
尹华,高鹏,刘超,杨军,刘忠,罗东:水稻穗穗家族基因编码磷脂酰丝氨酸合成酶及调控茎秆发育。植物学报,2013,237(1):15-27。10.1007 / s00425 - 012 - 1736 - 5。
Tamura K, Peterson D, Peterson N, Stecher G, Nei M, Kumar S: MEGA5:利用最大似然,进化距离和最大简约方法进行分子进化遗传学分析。分子生物学杂志,2011,28(10):2731-2739。10.1093 / molbev / msr121。
周晓文,范志强,陈艳,朱丽丽,李建勇,殷海峰:茶花黄酮醇合成酶样基因的功能分析揭示了其在花色素沉积过程中类黄酮代谢的作用。生物科学学报,2013,38(3):593-604。10.1007 / s12038 - 013 - 9339 - 2。
Livak KJ, Schmittgen TD:利用实时定量PCR和2(T)(?C)方法。方法,2001,25(4):402-408。10.1006 / meth.2001.1262。
确认
国家科技支撑计划重点项目(NO.2012BAD01B0703)资助。我们也承认国际科学。中国科技合作计划项目(2011DFA30490)、浙江省花卉新品种培育计划项目(2012C12909-6)、中国农业科学院公益性科研项目(RISF6141)。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。
本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。
如欲查看本牌照的副本,请浏览https://creativecommons.org/licenses/by/4.0/.
创作共用公共领域奉献弃权书(https://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
孙,Y,范,Z,李,X。et al。中明显的重瓣花品种山茶c类基因表达同时扩增和收缩。BMC植物生物学14日,288(2014)。https://doi.org/10.1186/s12870-014-0288-1
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-014-0288-1
关键字
- 重瓣花
- 无性生殖的
- 山茶花
- 驯化