抽象的
背景
植物腺毛状体是具有专门的代谢能力的化学工厂,用于生产各种化合物。芳香薄荷植物在称为盆状腺体(PGT)的专用腺毛状体中产生有价值的精油。在这里,我们进行了不同组织的下一代转录组测序Mentha Spicata.(绿薄荷)鉴定PGT特异性差异表达的转录本。我们的结果提供了PGT的动态代谢活动的全面概述,这将有助于途径工程。
结果
来自3种不同组织的留鲨鱼RNA:PGT,叶片和剥离PGT(叶PGT)的叶子(叶PGT)被Illumina成对结束测序测序。组装序列新创变成40,587个非冗余单基因;共有27025个unigene(67%)表达功能,其中3,919个unigene在PGT中相对于叶- PGT存在差异表达。在PGT转录组中缺乏光合转录本表明分离的PGT的纯度很高,因为薄荷PGT是非光合作用的。这些unigenes中有相当一部分仍未注释或编码假设的蛋白质。我们发现有16个萜类合成酶(TPS)、18个细胞色素p450、5个脂质转移蛋白和多种转录因子在PGT中优先表达。在16个tss中,有2个经生物化学鉴定为倍半萜合成酶。
结论
广泛的转录组数据集呈现在含有羽毛PGT中差异表达的基因的完整描述。这将促进薄荷萜烯途径的代谢工程来增加产量,并且还能够在薄菏中开发可持续生产的新型或改变珍贵的化合物。
背景
植物产生大量的专门代谢物,其中萜烯类是最大的、结构最多样化的天然产物。它们是植物精油的主要成分。许多萜烯是在一种叫做腺毛状体的特殊分泌结构中产生和储存的[1],[2].这些Terpenes为植物免受各种草食虫和病原体提供保护[3.而且在商业上也很有价值。因此,它们在植物中合成和储存的过程是基因操作提高产量的主要目标。但我们对分泌腺毛状体的发展和萜烯的产生及其调控的知识非常有限,因此很难设计这些代谢途径[4],[5].
生产的芳香族精油各种物种是最著名的单萜类,薄荷醇和香芹酮的来源,构成薄荷油的主要成分。它们广泛应用于香精和香料工业、制药和化妆品[6].薄荷品种主要生产薄荷醇,而留兰香薄荷品种主要生产香芹酮[7],[8].从薄荷品种的PGT (各种X、),随机选择1316个cDNA克隆或表达序列标签(ESTs),从而鉴定出参与薄荷脑精油生物合成主要途径的许多基因、酶和底物[9],[10.].鉴于他们研究时间的技术限制,EST方法可能只识别PGT中丰富的CDNA。最近的普氏PGT的蛋白质组学分析鉴定了1,666个蛋白,预计将参与次生新陈代谢[11.].但是,需要产生具有深度覆盖的足够的基因组信息,以获得对萜烯代谢和腺体培养的发育的调节机制的见解。这将促进成功的工程,以提高产量或发展薄荷作为新型/改变萜烯的生产平台。薄荷是一个非常适合的工厂,因为它能够在PGT内生产和存储大量的油,而不是将其渗出到叶面上。PGT内的储存也通过发射进入大气来减少挥发性油的损失。
高通量RNA测序(RNA-SEQ)越来越多地成为创造组织的基因转录模式的综合和定量型材的首选技术。在此,我们报告了留留下PGT,叶减去PGT(叶PGT)和叶片不同组织的RNA-SEQ转录组的比较分析。转录组数据提供了对PGT的代谢能力的基因组洞察力。PGT和叶PGT的比较显示,与叶PGT相比,3,919个unigenes以PGT(在PGT中的至少4倍)差异表达。其中许多与萜烯生产和其他次级代谢物途径有关。从鉴定的各种萜烯合成酶(TPS)转录物中,我们用薄荷的其特征在于这些先前无特征的TPS中的2个,并发现它们是倍半萜合酶。QRT-PCR验证了关键途径Unigene转录物。我们的结果显示了PGT的分子专业化,用于生产不同类代谢物。
结果与讨论
绿薄荷PGT及其发展
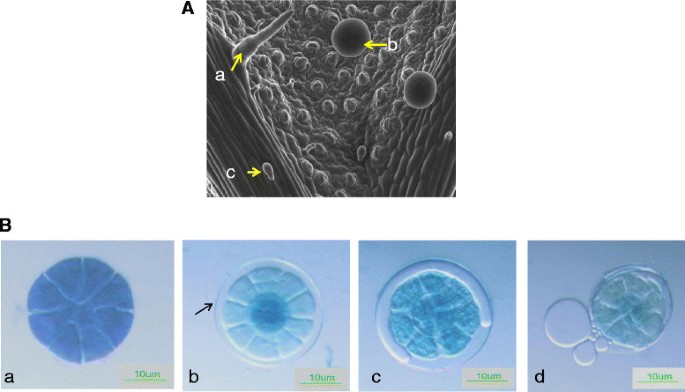
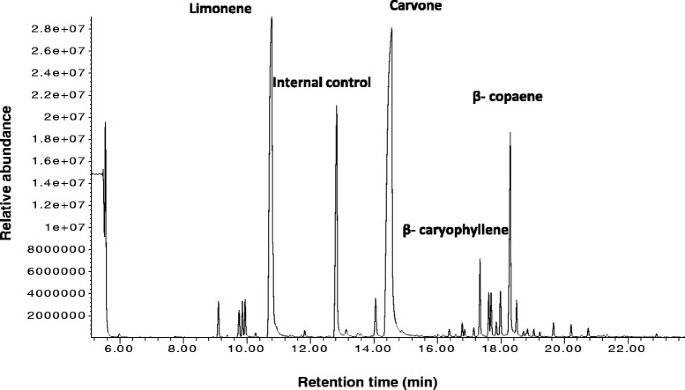
绿薄荷叶表面产生三种不同类型的毛状体:非腺状多细胞毛状体,有单个分泌头细胞的头状腺毛状体和PGTs,其分泌头由8个细胞组成,有单个茎和基底细胞(图)1A).这些PGT腺体拥有一个很大的角质层下储存空间,这是由角质层与顶端细胞分离而形成的,精油被分泌到这个腔内[12.)(图1b)。众所周知,新腺体在叶子上继续发起,直至扩张停止和单萜含量和组合物随着叶子的年龄而变化[13.] - [16.].不同的研究表明,单萜生物合成在薄荷12-20天的幼叶中最活跃,之后合成速度缓慢下降[17.] - [19.].我们利用气相色谱-质谱联用(GC-MS)对嫩薄荷叶(长约1-2cm)进行分析,发现柠檬烯和香芹酮单萜类化合物都很丰富(图)2).Limonene是迈向Carvone途径的首次承诺步骤。除了这些单波利,还观察到癫痫术的存在。这表明在这种发展阶段的叶子的动态萜烯生物合成活性。从该阶段的叶子和分离的RNA纯化pgt。刷涂相同阶段的叶子以除去从它们中提取的所有毛状体和RNA(附加文件1).
测序,新创转录组的组装和注释
利用Illumina技术制备了3个RNA文库并进行测序。从PGT、leaf-PGT和leaf中生成了超过1亿条101个碱基对(bp)的高质量reads (Additional file)2).使用三位一体方法[20.]最终将序列读数组装成40,587个非冗余的unigenes,跨越总共101 MB的序列,GC含量为43.14%。所有unegenes均超过200 bp。最终组装的转录物的N50是1,774bp。通过对各种蛋白质数据库进行BLASTX搜索来注释unigenes。在40,587个非冗余的未冗余unigenes中,27,025(67%)在Blastx搜索中至少有一个击中E值<= 1E-3。所有unigenes的基因本体(Go)项的功能分类是使用Trinotate进行的[20.].为了计算组装成绩单的表达水平,我们首先使用Bowtie映射到它们上的读取[21.].RSEM(RNA-SEQ通过期望最大化)用于估计组装成绩单的丰度并测量表达水平[22.].
绿薄荷PGT表达谱概述
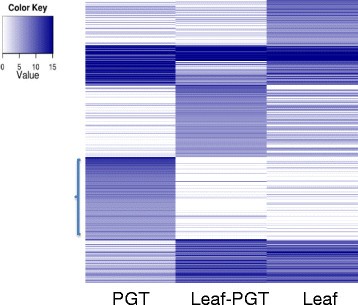
从RNA SEQ数据观察到约25,000个unigenes,以在Spearmint PGT中表达。图中的热图3.向PGT展示一些特定的表达模式。在PGT的这种特定模式中,我们发现萜烯生物合成的转录物,脂质转移蛋白和有趣的转录因子,如MyBS和Wrkys。PGT和叶PGT的比较表明,3,919个unigenes在pgt中差异表达(附加文件3.).与叶PGT相比,这些unigenes在PGT中表达水平的增加至少为4倍。大约30%的这些unigenes编码假设蛋白质或保持未经宣传。许多这些未经发布的unigenes在叶PGT中显示出无或最小的表达。它们可能代表对PGT开发和来自其他植物不同的新型基因,其基因组已经测序。Spearmint PGT蛋白质组学分析的数据还表明,所鉴定的蛋白质的最大功能类别是“尚不清楚的分类”,包括具有未知功能的蛋白质[11.].来自叶RNA SEQ数据的一些PGT特异性转录物的不存在或低水平表明总叶RNA中的PGT特异性RNA稀释,并重申分离这些器官进行分析的重要性。
在前1000个差异表达的unigenes中,我们鉴定了16个TPS,18个细胞色素P450s,5个脂质转移蛋白(LTPS),20转录因子,2 ATP结合盒(ABC)转运蛋白和与细胞壁相关的几个转录物。细胞色素P450s参与Terpenes的羟基化[23.]并提出LTPS参与细胞内运输和脂质的分泌和Terpenes [9],[24.].LTPS是PGT中最丰富的unigenes之一,并通过QRT-PCR确认(附加文件4).这些ltp的丰富表明它们在PGTs的代谢功能和发育中的重要性。ABC转运体也被提议参与次级代谢物的主动运输[11.],[25.].据推测,留兰香PGT经过细胞壁修饰形成角质层下存储空间[12.].在差异表达的ungenes中,很少有与细胞壁合成或修饰相关的,其中一部分通过qRT-PCR得到了证实(附加文件)4和5).它们是否在改变细胞壁层以形成存储空间方面发挥作用尚待研究。
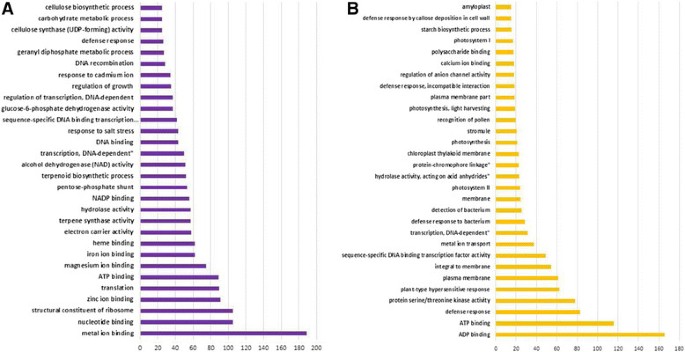
为了表征针对PGT的生物学方法,确定所有差异表达的unigenes的术语。另外,我们通过比较叶PGT和PGT来确定其表达在PGT中表达的ungenes。与叶PGT相比,这些unigenes在PGT中表达水平最小4次。Go术语也为他们确定了。数字4为更丰富和更少的unigenes显示前30名GO术语。与核糖体生物发生,核糖体结构基因和翻译相关的术语在PGT中高度代表,其可以反映PGT的高蛋白质生物合成活性。其他术语包括萜烯代谢和大多数主要能量产生术语,如糖酵解和三羧酸循环。此外,磷酸磷酸盐相关术语(氧化)也富含PGT。该术语为生物合成方法提供NADPH,例如脂肪酸合成,细胞色素P450介导的羟基化和无机氮的同化[26.].这些结果表明,提供能量等同物和氧化还原辅因子的GO功能在PGT中非常活跃。分泌毛细胞是生物合成的非常活跃,因此,这些细胞中存在高能量要求。从光合作用,叶绿素生物合成和淀粉生物合成方面的unigenes是较少丰富的。这表明我们的PGT样品制备纯度且没有被叶组织污染,因为薄荷PGT是非光合作用。
薄荷PGT是非光合作用和代谢的非常活跃的将可能依赖于从底层叶组织的外源供应,以用作能量产生的碳源。我们发现几种对蔗糖分解代谢的酶编码酶在PGT中表达更多的pGT,如蔗糖合成酶和中性/碱性转化酶,这对于在非光合组织中的蔗糖中的碳引发碳是重要的[27.].这些酶将蔗糖转化为己糖磷酸盐。PGT中的体积是次生新陈代谢的主要位点。与叶绿体相比,异养组组织的塑性必须依赖于ATP和碳的进口以驱动其代谢过程。我们检查了我们的差异表达的unigenes,以了解是否存在任何已知的运输车。在大多数植物中,葡萄糖6-磷酸盐似乎是非植物体积占用的优选的己糖磷酸盐。负责这种进口碳的转运蛋白被称为塑体,称为GLC6P-磷酸酯易偶联器(GPT),并且在PGT中富含GPT的转录物(PGT中的约30倍)。该碳可用于淀粉生物合成或培养物中的氧化戊糖磷酸途径[28.].氧化戊糖磷酸术途径的GO型富含PGT。另外,发现类似于塑性磷丙酮酸/磷酸铝蛋白丙酸酯的转录物在PGT中表达更多。它们参与磷酸丙酮酸的运输,从细胞质中的能量富含糖醇中间体进入塑性体[29.].此外,糖酵解或线粒体氧化磷酸化产生的ATP可通过质体核苷酸转运体(NTT)导入非绿色质体。与NTT相似的转录本也被观察到在PGT中更为丰富[29.].
陪斯PGT转录因子分析
虽然涉及萜烯生物合成的酶的克隆和功能表征在各种植物中已经非常成功,但是关于这些分泌毛细血管特异性途径的调节的知识是非常基本的。薄荷的研究表明所有基因/酶对的酶活性和转录性丰度之间的紧密关系,表明,精油生物合成主要影响转录水平[12.],[17.],[18.],[30.].因此,鉴定全球控制代谢途径的转录因子将为工程萜烯生产提供有吸引力的策略。同样,关于分泌腺体胎儿的发展的知识,重要的三萜产量所谓的工厂,非常有限。培养的大多数转录因子已从拟南芥中分离出来,这缺乏分泌胎儿。烟草和番茄的研究开始表明,拟南芥的多细胞分泌胎儿和单细胞胎儿不是同源结构,并且它们可能在不同的调节条件下发展[31.].我们对年轻叶片或PGT的转录组数据的分析没有发现与从拟南芥开始的主要已知的培养体中的主要已知培养体的转录物相匹配,如透明Testa Glabra1,Glabra1,Glabra3(32.].这些基因要么不表达,要么在与本研究使用的叶片或PGT不同的发育阶段表达。表格1显示前20个转录因子在PGT中含量显著高于叶-PGT。
在绿薄荷PGT中,MEP(2-甲基- d -赤藓醇-4-磷酸)途径比MVA(甲戊酸)途径更为丰富
植物生产的所有不同类别的萜类化合物都是异戊烯基二磷酸(IPP)及其烯丙基二磷酸二甲基烯丙基二磷酸(DMAPP)的C5单元。它们可以通过质体MEP或细胞质MVA途径产生。MEP途径需要7种酶从为单萜途径提供原料的丙酮酸酯和甘油醛3磷酸盐合成IPP和DMAPP [33.].从薄荷EST研究中发现,PGT中IPP/DMAPP形成的活性途径是MEP途径。这也与我们的分析一致,即MEP途径转录本在PGT中比MVA中更丰富。MEP途径转录本的高表达与PGT中单萜的产生密切相关。有报道称,该途径的第一个酶1-脱氧-d -木酮糖-5-磷酸合酶(1-脱氧-d -木酮糖-5-磷酸合酶(1-脱氧-d -木酮糖-5-磷酸合酶,DXS)对该途径的整体调控非常重要[34.].多个dx在植物中发现了基因玉米,Medicago Truncatula,Oryza Sativa,Ginkgo Biloba和赤松和Picea amies(35.] - [40].在所有这些植物中,两个或三个候选人dx基因也有报道。从我们的数据中,我们能够识别出2个不同的1-脱氧-d -木酮糖-5-磷酸合酶(DXS) unigenes,它们在PGT中显示出不同的丰度水平。每个MEP途径酶的基因编码数量因植物而异[33.],[41.].具有差异组织特异性表达水平的多种基因的存在可能导致植物不同器官的MEP途径的调节。数字5显示为MEP途径的每种酶及其RNA SEQ表达水平鉴定的未鉴定的未鉴定的unigenes的数量。在具有多于一个未成分的酶的情况下,考虑了PGT中具有最高丰度的UNIGENE。QRT-PCR进一步验证了它们的表达(附加文件4).从我们的RNA SEQ数据和QRT-PCR分析中,与MEP途径中的其他酶的水平相比,DXR和MCT转录水平低。这可能表明这两种酶可能是该途径的速率限制步骤。将来可能选择探索的可能选择是提高各种速率限制步骤的表达水平,以增强萜烯的生产。
涉及MEP途径的未成年人的表达水平。绿色的数字表示PGT中特定基因的表达水平(RSEM值估计转录本丰度的log2)。红色的数字表示与叶-PGT相比,表达水平的变化倍数(PGT与叶-PGT之间的变化倍数为log2)。在含有多个单基因的酶中,考虑丰度最高的单基因。括号中的数字表示该途径中每一种酶所鉴定的unigenes的数量。DXS:1-脱氧-D-木糖糖-5-磷酸盐(DXP)合成酶;DXR:DXP癸二异酶,MCT:MEP细胞基转移酶,CMK:4-(胞苷5-二磷)-2-C-甲基-d -赤藓醇激酶MCS: 2- c -甲基-d -赤藓醇2,4-环二磷酸(me - 2,4cpp)合酶,HDS: 1-羟基-2-甲基-2-丁烯基4-二磷酸(HMBPP)合酶,HDR: HMBPP还原酶,IPPI:异戊烯基二磷酸(IPP,C5) delta -异构酶。
与MEP途径相反,MVA酶的转录水平非常低。对于该途径中涉及的未经元的RNA SEQ表达水平引用附加文件6.通过qRT-PCR验证其表达(附加文件)4).MVA途径衍生的IPP通常被认为用于胞质倍半萜、三萜类和线粒体萜类的生产。除了单萜外,薄荷还能产生一些倍半萜,尽管倍半萜的数量比单萜低得多[9],[42.].MVA通路水平较低可能是原因之一。有趣的是,MEP通路中相关基因的转录本也富集在青蒿毛状体,臀部的腺毛状体和Scanddragon花朵,其中索西氏萜烯代谢占主导地位[43.] - [45.暗示MEP途径还可以喂养倍霉素生产。标记底物的研究预测MVA和MEP途径之间代谢物的交换[46.],[47.].MEP途径的IPP / DMAPP如何利用在薄荷中合成Sesquiterpenes仍有待研究。
绿薄荷PGT中富集了单萜
随后IPP和DMAPP之间的缩合反应被GPP合成酶(GPPS)催化,导致香叶酰二磷酸(GPP;C10)单萜前体。IPP向DMAPP的转化及其平衡是由IPP异构酶(IPPI)维持的。在大多数植物物种中,这种酶是由单个基因编码的,而拟南芥有两个IPPI基因[33.].我们在留兰薄荷中发现了2个IPPI ungenes,它们都在PGT中富集。Peppermint GPPS (Mp GPPS)是一种由一个大亚基和一个小亚基组成的双组分杂聚酶,两个亚基本身都不具有催化活性[48.],[49.].在留下留气中,我们发现了在PGT中显示出高表达的GPP合酶的小和大亚基的unigenes。留棉花精油的主要组成部分是( - )磁力酮,其在三步反应中由GPP合成。用于上述反应,柠檬烯合酶(LS),柠檬烯-6-羟化酶(L6OH)和Carveol脱氢酶(CD)的所有三种酶的转录物在PGT中高度表达并通过Q-RT-PCR验证(图6和附加文件4).
有趣的是,薄荷中薄荷醇和留兰香薄荷中香芹酮的前体是相同的柠檬烯。在薄荷中由(2)- 4s -柠檬烯-3-羟化酶(L3OH)氧化生成(2)-反式异哌烯醇并进入薄荷醇通路,而在薄荷中柠檬烯由(2)- 4s -柠檬烯- 6-羟化酶(L6OH)氧化生成(2)-反式异哌烯醇。这两种酶在氨基酸水平上显示了70%的同源性,主要差异定位于假定的活性位点[50.].与预期一样,薄荷L6OH转录本在PGT中高表达,但参与薄荷醇途径的全部下游氧化还原酶isopiperitenone reductase, (+)-pulegone reductase, menthone reductase也在PGT中表达较差。先前的一项研究表明(-)香芹酮不是初始双键还原酶的有效底物,因此(-)香芹酮在留兰薄荷中积累,即使存在下游的氧化还原酶[11.],[51.].因此,单一酶L6OH代替L3OH的丰度改变产生的最终的单萜。这表明单个中间生产的制造变化的简单变化可能导致代谢型材的变化变化。与异二聚体GPP合酶合成酶相比,法呢基二磷酸合酶的转录物负责形成羟基萜的羟基磷酸二磷酸盐前体,在PGT中表达少4倍。除了低MVA途径外,低水平的FPP合酶转录物也可能有助于薄荷PGT的降低的倍二萜产量。
留兰香中萜烯合成酶(TPS)的功能表征
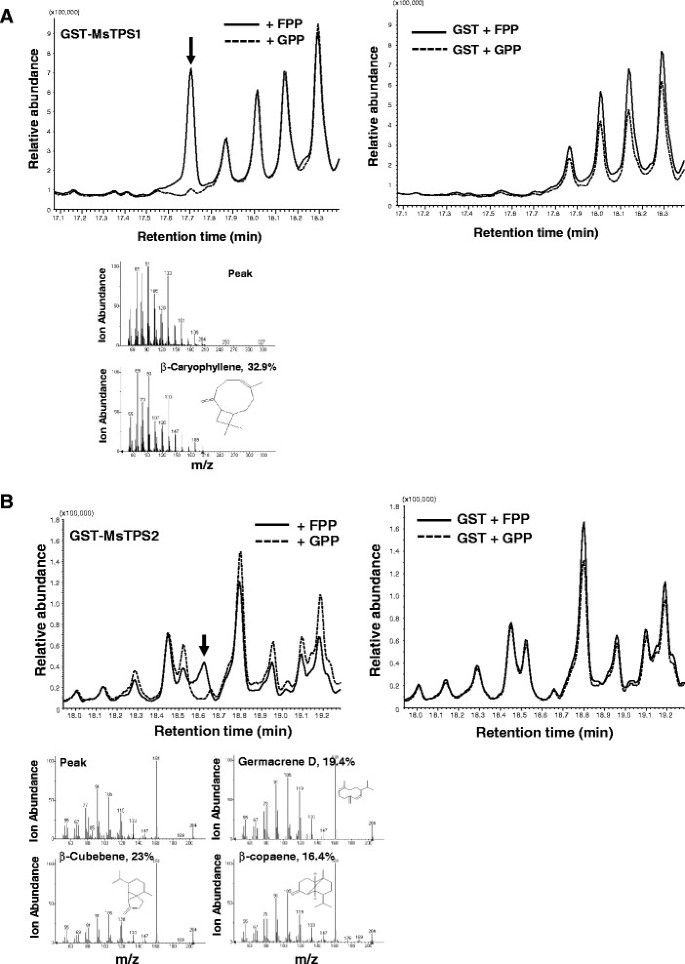
在植物中,特定的tps负责从共同的前体合成各种萜分子。我们的转录组数据为鉴定和功能鉴定留兰香中新的tss提供了丰富的资源。从我们富集的unigenes中,我们发现了16个被鉴定为萜烯合成酶;所有编码均大于1kb,其中10个编码为全长开放阅读框(orf)。我们发现PGT中有柠檬烯合成酶、(E)-β-法尼烯合成酶、双环丙烯合成酶和顺式muuroladiene合成酶的特异表达。然而,新的TPS的准确功能注释需要重组蛋白的活性表征。在薄荷类中,据我们所知,来自绿薄荷的柠檬烯合成酶[52.],(E来自Peppermint的 - β-法呢烯合成酶[42.[黑色薄荷]和Cis-uuroladiene合酶[53.先前已经表征了它们的功能。从我们的RNA SEQ数据中,我们选择了两个未经发布的全长TPS。系统发育比较(附加文件7)表明MsTPS1和MsTPS2都属于被子植物倍半萜合成酶TPS-a亚家族。气相色谱-质谱联用分析表明,绿薄荷中主要的倍半萜类化合物为(E)-β-法尼烯、β-石竹烯、α-石竹烯、顺式木榄烯-3-5二烯、β-copaene、双环菌烯和双环菌烯。
通过过表达MsTPS1和MsTPS2的全长开放阅读框,测定MsTPS1和MsTPS2的酶活性大肠杆菌,纯化并用于用GPP或FPP作为基质的体外测定。在FPP MSTPS1的存在下,在体外形成β-亚芳酮的形成(图7A)而MsTPS2从FPP中产生了一个峰,经gc - ms鉴定为β-立方苯/Germacrene D/β-copaene(图)7b)。在我们的薄荷叶GC-MS数据中观察到β-庚烯,表明MSTPS2最有可能是β-己二烯合酶。TPS都未能产生GPP作为基质的峰值(图7A和B)。因此,我们的体外研究确定它们是倍半萜合成酶。此外,瞬态根癌土壤杆菌-介导的植物表达[54.],用来研究由MsTPS1和MsTPS2在足底.这两个MsTPS1和MSTPS2.在35S启动子的控制下瞬时表达N. Benthamiana.叶子的农杆菌属介导的渗透。采用气相色谱-质谱联用技术对化合物进行分析。气相色谱-质谱分析显示,两种TPSs均未形成新峰。研究表明,过表达酶3-羟基-3-甲基戊二酰辅酶A还原酶(HMGR)是甲戊酸途径的限速步骤,可增加异源植物倍半萜产量[55.].因此,两种TPSs均与HMGR共同表达在Planta.观察倍半萜的生产情况。HMGR的MsTPS1产生β-石竹烯为主峰,β-石竹烯和氧化石竹烯为次要峰8.MsTPS2即使使用HMGR也不能产生任何新的峰值在Planta.表明MSTPS2形成的化合物可以通过工厂内源进一步代谢(数据未显示)。
倍半萜合成被认为是在细胞质中进行的,而单萜合成被认为是在质体中进行的。因为我们的生化特性证明了这一点MsTPS1和MsTPS2是SesquiterPene合成酶,我们检查了烟草叶片瞬态研究中这些蛋白质的亚细胞定位。标记yfp的mstp瞬时表达为N. Benthamiana.叶细胞农杆菌属介导的渗透和使用共聚焦显微镜的YFP通道可视化3DPI。MSTPS都显示出细胞质定位(附加文件9[它们的序列分析还显示出缺乏塑性靶向序列,进一步确认这些TPS是倍二萜合酶。因此,通过序列相似或通过功能表征,我们能够识别负责形成主要留留羽毛的精油组分的所有主要萜烯合成酶。
斯巴蒙PGTS作为植物化学防御器官
腺毛状体产生的许多次生代谢物在植物防御中起着重要作用。它们大多属于萜类、苯丙烯类、类黄酮类、甲基酮类、酰基糖类和防御蛋白类。除了具有丰富的萜烯途径外,留兰薄荷PGT还显示了参与不同次级代谢物生产的转录本,这些代谢物可能在植物防御中发挥作用。苯丙氨酸解氨酶、肉桂酸4-羟化酶和4-香豆酸辅酶a连接酶的转录本编码酶在PGT中表达。这些酶参与苯丙素的产生。在不同的薄荷种质的叶片中检测到多种小分子量苯丙素,如咖啡酸、迷迭香酸和阿瓦酸[56.].类似于咖啡因O-甲基转移酶的转录物,优先以PGT表达咖啡酸转化为阿魏酸中所需的酶。Chalcone Flavanone异构酶在植物中黄酮类化途径中的酶也优先于PGT表达。编码类似于植物转化酶/果胶甲基酯酶抑制剂的转录物的未成熟在PGT中高表达,这对于防御植物病原体是重要的[57.],[58.].以上转录本均通过qRT-PCR进行验证(补充文件)4).
Oxylipins是一类具有生物活性的氧化脂肪酸衍生物,在植物防御反应中起重要作用。它们主要是由脂肪酶、脂氧合酶(LOXs)和细胞色素P450 (CYP74)家族成员共同作用产生的,细胞色素P450家族主要代谢脂肪酸氢过氧化物(HPs)。HPs形成oxylipin途径不同分支的初始底物[59.] - [62.].我们发现参与脂肪酸氧化的酶在PGTs中表达更多。磷脂酶A、脂氧合酶、氧化丙烯合成酶和氧化丙烯环化酶等转录产物在PGT中富集。氧化丙烯合成酶和氧化丙烯环化酶是细胞色素P450 (CYP74)家族成员,参与LOX途径[63.],[64.].上述转录本均在PGT中至少富集8倍,经qRT-PCR证实。然而,为了了解这些酶在植物防御中的作用以及它们形成的oxylipin的确切性质,进一步的研究至关重要,特别是它们的位置特异性和底物特异性。植物具有基础机制和诱导机制来防御病原菌。转录组数据反映了留兰香PGT存在的基础或构成状态的防御机制。上述基因转录本丰度在胁迫诱导中的变化将为更好地理解PGT作为化学防御器官的作用机制提供依据。
结论
非模式植物基因组资源的可利用性各种是稀缺的。这是第一次尝试从头测序和组装来自不同组织的转录组Mentha Spicata.使用门店。通过PGT与叶-PGT的比较,鉴定出3919个差异表达的ungenes。对这些unigenes的分析为深入了解留兰香PGT的基因表达模式和生物学过程提供了依据。进一步鉴定各种未知的PGT特异基因有助于新的基因发现。我们的转录组数据为留兰香的未来遗传学研究提供了重要的信息。它也将有助于开发策略来设计萜烯的代谢过程,从而可以进一步外推到其他类似薄荷的具有商业重要性的、没有基因组资源可用的植物。
方法
植物材料,PGT和RNA的分离
商品绿薄荷品种是在自然光照条件下的温室中种植的。1-2cm叶片在类似于[9在50毫升的猎鹰试管中。浸泡1小时后,将叶片(约3克)转移到含有提取缓冲液的新鲜猎鹰管中,如[9].采用玻璃珠磨损法分离毛状体。将玻璃微珠(Sigma 425-600 μm)添加到猎鹰管中,并在冰上静置1分钟,旋流2次,30秒。然后将混合物仔细通过100 μM的细胞过滤器,去除细胞壁碎片和毛状毛,收集流过的液体。再用40 μM细胞滤器筛选,使头状腺毛通过,收集上述PGT。40 μM滤器顶部积累的PGT在隔离缓冲液中洗涤几次,最后用rnase游离水收集到1.5 ml离心管中。然后将收集的PGT纺丝,除去多余的水分,立即用液氮冷冻以供进一步使用。我们随机统计了大约500个分离的PGT,估计了样品的纯度,发现了毛发状毛26个,大部分是破损的,4个CPT表明分离的PGT纯度良好。在吸胀缓冲液中涂刷同期叶片,去除毛状体,在解剖显微镜下观察。使用Sigma的Spectrum™植物总RNA试剂盒从PGT、叶片和叶片-PGT中提取总RNA。 The quality of RNA was checked by measuring the ratio of OD260到了OD.280完整性通过使用安捷伦2100生物分析仪测量RNA完整性数(RIN)来评估。
测序和装配
根据制造商说明,使用TruSeq RNA样品制备试剂盒v2, set A (RS-122-2001, Illumina Inc.)制备RNA库。使用Agilent 2200 TapeStation系统(Agilent Inc.)检测用于测序的cDNA文库的质量和大小。图书馆在Hiseq的单行道上运行,100辆自行车(成对)™2000(Illumine Inc.)单独。通过FASTQC分析了原始读数[65.为他们的质量和发现高质量的阅读与Q > 20。三位一体法[20.用于生成ungenes的原始读数的De Novo组装。unigenes的功能基于序列相似性,与公共NR数据库(国家生物技术信息中心)和蛋白质序列数据库的序列相似拟南芥蒂利亚纳,vitis Vinifera和栽培稻.GO术语通过来自基因本体数据库的Trinote检索[20.].
重组蛋白的制备在体外酶测定
的全长cdnaMsTPS1和MsTPS2用来自PGT衍生的cDNA的以下引物组扩增。MsTPS1: 5 ' - caccatggaaattcctgcaccggtttcggcta -3 '和5 ' - aactgttaggggatcaacgagtatggattttgatc -3 ';和MsTPS2:和5'- 5'Caccatggctgaaatctgtgcgtcggctgct-3'和5'GTGCAGGGGATCTACGAGCACGGATTGAAT-3'。构建用于生产重组的GST标记蛋白的载体,PCR扩增MsTPS1和MsTPS2将cdna插入pGEX-4 T-1 (GE Healthcare Life Sciences)中,分别生成GST-MsTPS1和GST-MsTPS2。这两个构念都被转换成大肠杆菌BL21-CODONPLUS(DE3)-RIPL(Stratagene),并在20℃下用0.2mM异丙基1-THIO-β-D-半乳糖醇(IPTG)进行处理过夜以诱导GST标记的蛋白质表达。将收获的细胞粒料重悬于裂解缓冲液(20mM TRIS,pH 7.4,150mM NaCl,10mMβ-巯基乙醇,1mM苯基甲基磺酰芳基和蛋白酶抑制剂鸡尾酒中,并通过超声处理破裂。通过离心收集澄清的裂解物,并在4℃下与谷胱甘肽琼脂糖4B树脂(GE Healthcare Life Sciencess)孵育过夜。将与谷胱甘肽琼脂糖4B树脂结合的蛋白质用纯化缓冲液洗涤,用10mM谷胱甘肽从柱中洗脱,并透析含有25mM HEPES的缓冲液,pH 7.5,100mM KCl,1mM DTT和5%甘油。
为了在体外用于萜烯合酶活性的酶测定,10μg重组蛋白在500μl反应缓冲液的最终体积中使用(25mM Hepes,pH 7.5,100mM KCl,7.5mM MgCl210 μg底物(法尼基二磷酸,FPP或香叶基二磷酸,GPP;σ)。包裹250 μl己烷捕获挥发性产物,30°C孵育2 h。萃取物经气相色谱-质谱联用(安捷伦)分析。
MsTPS1的体内特征
拟南芥3-羟基-3-甲基戊二酰辅酶A还原酶(ATHMGR1.扩增引物为AtHMGR-F-XbaI (5 ' -AACTCTAGAATGAAGAAAAAGCAAGCTGGTCCCCAACAGA-3 ')和AtHMGR-R-AscI (5 ' - aaaggcgcgcctgttgttgttgtcgttgtcgtt -3 ')。pcr扩增产物经酶切XBA.我和AscI,克隆到pCAMBIA1300-3HA。体内描述是在Nicotianana benthamiana叶子的农杆菌属介导的渗透。最初农杆菌属应变窝藏MsTPS1单独使用,然后将携带AtHMGR1的菌株与MSTPS1菌株混合共渗。一夜之间的文化农杆菌属在28°C的环境下生长。在含有10 mM氯化镁的溶液中,在600 nm处重悬至最终浓度,吸光度为1.02,10 mm MES pH 5.6和100μm乙酰苯乙烯酮。在室温下孵育2小时后,农杆菌属将混合物注入N. Benthamiana.用无针注射器注射叶子。在生长室中在24℃下孵育渗透植物3天或6天。为GC-MS分析进行了三到四个渗透叶。
GC-MS分析方法
对于萃取约4-6叶以使用液氮研磨至细粉末,并在500μl乙酸乙酯中均化,包括1μl(10mg / ml)的樟脑作为内标,并在室温下在室温下培养至少2小时.将该混合物以12,000rpm离心5分钟。将顶部有机层转移到新管中并使用无水Na脱水2所以4。样品采用气相色谱分析(Agilent Technologies 7890A与5975C惰性质谱检测器与毛细管检测器)。在30 m HP-5 MS色谱柱(安捷伦技术)上,注入2 μl样品,分离程序为50°C 1 min,以8°C/min至300°C的速度增加,并保持5 min。
tps -的亚细胞定位
的全长cdnaMsTPS1和MsTPS2用来自PGT衍生的cDNA的以下引物组扩增。MsTPS1: 5 ' - caccatggaaattcctgcaccggtttcggcta -3 '和5 ' - aactgttaggggatcaacgagtatggattttgatc -3 ';和MsTPS2:和5'- 5'Caccatggctgaaatctgtgcgtcggctgct-3'和5'GTGCAGGGGATCTACGAGCACGGATTGAAT-3'。将CDNA克隆到PETR / D-TOPO载体(Invitrogen)中,然后转移到PBA-DC-YFP中[66.]其中含有CAMV 35s启动子和框架YFP中的C末端,分别产生MSTPS1-YFP和MSTPS2-YFP。将MSTPS1-YFP或MS-TPS2-YFP构建体引入农菌株GV3101通过电穿孔。YFP标记的MSTPS与CFP或单独的CFP表达以确认MSTPS-YFP的细胞定位。CFP表达用作细胞质制造蛋白。一夜之间的文化农杆菌属在28°C的环境下生长。在含有10 mM氯化镁的溶液中,在600 nm处重悬至最终浓度,吸光度为1.02,10 mm MES pH 5.6和100μm乙酰苯乙烯酮。在室温下孵育2小时后,农杆菌属将混合物注入N. Benthamiana.用无针注射器注射叶子。将渗透后的烟草植株置于24°C的生长室中3 d。荧光信号检测由共聚焦扫描激光显微镜(卡尔蔡司LSM 5激励器)与标准滤波器设置。
实时定量PCR (qRT-PCR)
使用QRT-PCR以验证转录组分析的基因表达模式。大约1μgRNA用于CDNA合成,具有IScript Supermix(Bio-rad)。通过在25℃下灌注5分钟进行反应,然后在42℃下逆转录30分钟,并在85℃下灭活5分钟。将cDNA储存在-20℃,直至进一步使用。使用ABI Prism 900HT实时PCR系统和Kapa Sybr Fast Mast(Kapa Biosystems)。PCR反应,使用0.3μl的cDNA进行384孔PCR板在384孔PCR板中进行,总共5μl反应体积和循环曲线为95℃,10分钟,40°C为95℃,持续60℃,60℃。在热循环后,进行解离分析(熔化曲线)以确认PCR反应的特异性扩增。所有反应一式三份,具有三种生物重复,包括非模板控制。阈值循环(CT)基因值为SYBR Green荧光信号在指数期检测核酸积累量时达到阈值所需的周期数[67.].在目前的研究中,伸长因子1(EF1.)被用作内部对照,由于其在植物中的稳定表达[68.],在我们的RNA seq数据中,它在所有组织中也显示了相似的表达水平。比较δCT目标基因的值EF1.取不同组织间的相对表达量。目标基因的数量,归一化为EF1.基因,由2计算-(CT目标gene-CTEF1.).结果表示为平均值±SD。使用的Unigene名称和使用的引物序列列于附加文件中10..
提供支持数据的可用性
支持本文结果的原始RNA seq数据可在日本的DDBJ: DNA数据库中获得,登录号为:DRA001856 (http://trace.ddbj.nig.ac.jp/DRASearch/submission?acc=DRA001856).
作者贡献
JJ、JL和LSW对RNA seq数据进行生物信息学分析,DNP对留兰薄荷组织进行毛状体分离和RNA制备,QW进行qRT-PCR分析,MJK和ICJ进行TPS表征;JLY做了GC-MS研究。国家卫生健康委和RS开发了这个项目并撰写了手稿。所有作者阅读并批准了最终的手稿。
附加文件
缩写
- 页面表:
-
佩拉特腺毛状体
- TPS:
-
萜烯合成酶
- 美东时间:
-
表达序列标签
- GC-MS:
-
气相色谱分析-质谱法
- RSEM:
-
通过采用RNA-seq
- LTP:
-
脂质转移蛋白
- GPT:
-
Glc6P-phosphate转运蛋白
- 日本电报电话公司:
-
核苷酸转运蛋白
- MVA:
-
米瓦洛酸盐途径
- MEP:
-
2-Cmethyl-D-erythritol-4-phosphate
- IPP:
-
Isopentenyl二磷酸
- DMAPP:
-
Dimethylallyl二磷酸
- GPP:
-
香叶二磷酸
- FPP:
-
通过二磷酸
- GGPP:
-
Geranylgeranyl二磷酸
- DXS:
-
1-deoxy-D-xylulose-5-phosphate合酶
- DXR:
-
1-deoxy-D-xylulose 5-phosphate reductoisomerase
- MCT:
-
2-C- 甲基-D-赤藓糖醇4-磷酸胞嘧啶细胞酰基转移酶
- CMK:
-
2 - 4 -(胞嘧啶核苷5-diphospho)C- 甲基-D-赤藓糖醇激酶
- MCS:
-
2-C-methyl-D-erythritol 4-cyclodiphosphate合成酶
- HDS:
-
1-羟基-2-甲基-2-丁烯基4-二磷酸合酶
- HDR:
-
1-hydroxy-2-methyl-2-butenyl 4-diphosphate还原酶
- IPPI:
-
异戊烯基二磷酸异构酶
- gpp:
-
香叶二磷酸合酶
- LS:
-
柠檬烯合酶
- L6OH:
-
柠檬烯-6-羟化酶
- CD:
-
Carveol脱氢酶
- ORF:
-
开放阅读框
- DPI:
-
天post-infiltration
- HMGR:
-
羟基-3-甲基戊芳族辅酶还原酶
- 熏鲑鱼:
-
脂氧合酶
参考文献
- 1。
McCaskill D, Croteau R:异戊烯二磷酸是植物中萜类生物合成脱氧木糖-5-磷酸途径的终端产物。acta photonica sinica, 1999, 40(4): 653-656。10.1016 / s0040 - 4039(98) 02496 - 4。
- 2。
毛状体中萜类生物合成的研究进展。生物技术学报,2013,11(1):2-22。10.1111 / j.1467-7652.2012.00737.x。
- 3。
高等植物萜类:以植物为中心对其生态作用的概述。化学学报,1994,20(6):1223-1280。10.1007 / BF02059809。
- 4。
Glas JJ, Schimmel BC, Alba JM, Escobar-Bravo R, Schuurink RC, Kant中国科学(d辑),2012,32(12):1497 - 1405。10.3390 / ijms131217077。
- 5。
组织A:腺毛状体:表达序列标签后的是什么?工厂J. 2012,70(1):51-68。10.1111 / J.1365-313x.2012.04913.x。
- 6。
Lange BM, Mahmoud SS, Wildung MR, Turner GW, Davis EM, Lange I, Baker RC, Boydston RA, Croteau RB:通过代谢工程提高薄荷精油的产量和成分。中国科学(d辑:地球科学),2011,38(4):591 - 598。10.1073 / pnas.1111558108。
- 7。
Saharkhiz MJ,Motiamei M,Zomorodian K,Pakshir K,Miri R,Heyari K:薄荷哌塔L. Isrn Phar精油的化学成分,抗真菌和抗血栓活性。2012年,2012年:718645-
- 8。
陈志强,陈志强,陈志强,等:薄荷精油的化学成分分析[J]。作物学报,2009,29(2-3):654-656。10.1016 / j.indcrop.2008.12.003。
- 9.
Lange BM, Wildung MR, Stauber EJ, Sanchez C, Pouchnik D, Croteau R:利用薄荷腺毛状体表达序列标签的功能评价精油的生物合成和分泌。中国科学(d辑:地球科学),2000,19(6):534 - 539。10.1073 / pnas.97.6.2934。
- 10。
Croteau RB,Davis Em,Ringer KL,Wildung Mr:( - ) - 薄荷醇生物合成和分子遗传学。NaturWissenschaften。2005,92(12):562-577。10.1007 / s00114-005-0055-0。
- 11.
香槟A,Boutry M:昆克蛋白蛋白质组学快照(Mentha Spicata L.)叶毛状体:一个真正的Terpenoid Factory。蛋白质组学。2013,13(22):3327-3332。10.1002 / PMIC.201300280。
- 12.
acta botanyyuni sinica(云南植物学报)。植物营养与肥料学报。2000,12(2):665-680。10.1104 / pp.124.2.665。
- 13。
Burbott AJ,Loomis WD:薄荷中单调思代谢营业额的证据。植物理性。1969,44(2):173-179。10.1104 / pp.44.2.173。
- 14。
Croteau R,Martinkus C:Monoterpenes的新陈代谢:(+) - NeoMenthyl-β-D-葡萄糖苷作为薄荷(Mentha Piperita)的主要代谢物(Mentha Piperita)。植物理性。1979,64(2):169-175。10.1104 / pp.64.2.169。
- 15.
王志强,王志强,王志强:薄荷属植物生长过程中腺体毛状体和精油的研究。中国生物医学工程学报,1998,16(3):457 - 461。10.1055 / s - 2007 - 969118。
- 16。
Brun N, Colson M, Perrin A, Voirin B:衰老对薄荷叶单萜成分影响的化学和形态学研究。acta photonica sinica, 2011, 40(10): 2271-2278.使用本文10.1139 / b91 - 285。
- 17。
Gershenzon J,McConkey Me,Croteau RB:在薄荷叶片中的单萜累积调节。植物理性。2000,122(1):205-214。10.1104 / pp.122.1.205。
- 18。
陈志强,陈志强,陈志强:薄荷腺毛状体中单萜生物合成的发育调控。植物生理学报。2000,22(1):215-224。10.1104 / pp.122.1.215。
- 19.
Kjonaas R, Croteau R:柠檬烯是胡椒薄荷和其他薄荷属植物含氧对甲烷单萜生物合成中的第一环中间体。中国生物化学学报,1998,22(1):79-89。10.1016 / 0003 - 9861(83) 90389 - 2。
- 20.
Grabherr MG,哈斯BJ, Yassour M,莱文生理改变,汤普森哒,阿米特我,Adiconis X,风扇L, Raychowdhury R,曾问,陈Z, Mauceli E, Hacohen N, Gnirke, Rhind N,迪帕尔马F, Birren B, Nusbaum C, Lindblad-Toh K,弗里德曼N, Regev答:全身没有参考基因组转录组装配从RNA-Seq数据。生物技术。2011,29(7):644-652。10.1038 / nbt.1883。
- 21.
Langmead B, Salzberg SL:快速间隙读对齐与领结2。中国生物医学工程学报。2012,9(4):357-359。10.1038 / nmeth.1923。
- 22.
李斌,杜威中国:RSEM:有或没有参考基因组的RNA-Seq数据的准确转录本定量。生物信息学。2011,12:323-10.1186/1471-2105-12-323。
- 23.
细胞色素p450酶参与单和倍半萜的生物合成。Phytochem Rev.2013队。
- 24.
Choi YE, Lim S, Kim HJ, Han JY, Lee MH, Yang Y, Kim JA, Kim YS:烟草NtLTP1是一种腺特异性脂质转移蛋白,是腺毛分泌脂质所必需的。植物学报,2012,70(3):480-491。10.1111 / j.1365 - 313 x.2011.04886.x。
- 25.
Yazaki K: ABC转运体参与植物次生代谢物的运输。中国科学(d辑),2006,33(4):531 - 534。10.1016 / j.febslet.2005.12.009。
- 26.
氧化戊糖磷酸途径:结构和组织。植物生态学报,2003,6(3):236-246。10.1016 / s1369 - 5266(03) 00039 - 6。
- 27.
Sturm A,Tang GQ:植物的蔗糖切割酶对发育,生长和碳分区至关重要。趋势植物SCI。1999,4(10):401-407。10.1016 / S1360-1385(99)01470-3。
- 28.
非绿色质体中碳的运输。植物科学进展,2002,7(8):345-351。10.1016 / s1360 - 1385(02) 02291 - 4。
- 29.
在植物质体中转运体的能量供应中的作用。中国生物医学工程学报。2011,27(7):2381-2392。10.1093 / jxb / erq361。
- 30.
陈志强,陈志强:薄荷中单萜生物合成的组织结构。香叶酰二磷酸合酶、柠檬烯-6-羟化酶、异哌烯醇脱氢酶和普勒酮还原酶的免疫细胞化学定位。植物营养与肥料学报。2004,36(4):421 - 427。10.1104 / pp.104.050229。
- 31。
杨C,YE Z:粒子作为研究植物细胞分化的模型。细胞mol寿命。2013,70(11):1937-1948。10.1007 / s00018-012-1147-6。
- 32。
Ishida T, Kurata T, Okada K, Wada T:毛发和根毛发育中的遗传调控网络。植物学报,2008,59:365-386。10.1146 / annurev.arplant.59.032607.092949。
- 33。
Vranova E, Coman D, Gruissem W:类异戊二烯合成的MVA和MEP途径的网络分析。植物生态学报。2013,32(4):665-700。10.1146 / annurev - arplant - 050312 - 120116。
- 34。
Bruckner K,Tissier A:尼古利亚纳·宾夕法尼亚州尼累累的瞬态表达高水平的沥青生产。植物方法。2013,9(1):46-10.1186 / 1746-4811-9-46。
- 35。
Cordoba E,Porta H,Arroyo A,San Roman C,Medina L,Rodriguez-Concepcion M,Leon P:在玉米中编码1-脱氧-D-木糖5-磷酸合酶的三种基因的功能表征。J Exp Bot。2011,62(6):2023-2038。10.1093 / JXB / ERQ393。
- 36。
沃尔特MH,HANS J,Strack D:编码1-脱氧-D-木糖糖5-磷酸合成酶的两个远端相关基因:射击中的差异调节和逐渐积累的菌根菌根。工厂J.2002,31(3):243-254。10.1046 / J.1365-313x.2002.01352.x。
- 37。
Kim Br,Kim Su,Chang YJ:三个1-脱氧-d的差异表达: - 水稻中的含有-5-磷酸合成酶基因。Biotechnol Lett。2005,27(14):997-1001。10.1007 / S10529-005-7849-1。
- 38。
张玉杰,宋淑娟,金苏:银杏2类1-脱氧-d -木糖- 5-磷酸合酶和1-脱氧-d -木糖- 5-磷酸还原异构酶基因的鉴定及其在银杏内酯生物合成中的转录。植物营养学报。2006,72(3):234-240。10.1055 / s - 2005 - 916180。
- 39。
金YB,金SM,康MK,Kuzuyama T,Lee JK,Park SC,Shin SC,Kim Su:通过编码多种1-脱氧-D-木糖5-磷酸合酶的基因的差异转录来调控Pinus Densiflora和1-羟基-2-甲基-2-(e) - 丁烯基4-二磷酸还原酶基因。树生理。2009,29(5):737-749。10.1093 / Treephys / TPP002。
- 40。
Phillips Ma,Walter MH,Ralph SG,Dabrowska P,Luck K,Uros Em,Boland W,Strack D,Rodriguez-Concepcion M,Bohlmann J,Gershenzon J:功能识别和差异表达1-DeOxy-D-木糖5-磷酸盐合成酶诱导的Terpenoid树脂形成挪威云杉(Picea Andea)。植物mol biol。2007,65(3):243-257。10.1007 / s11103-007-9212-5。
- 41。
Kim SM, Kuzuyama T, Kobayashi A, Sando T, Chang YJ, Kim SU:裸子植物银杏叶和针叶松的多拷贝基因编码1-羟基-2-甲基-2-(E)-丁烯基4-二磷酸还原酶(IDS)。植物学报。2008,227(2):287-298。10.1007 / s00425 - 007 - 0616 - x。
- 42。
Crock J,Wildung M,Croteau R:来自薄荷(Mentha X piperita,L.)的倍二萜合酶cDNA克隆的分离和细菌表达,产生蚜虫报警信息素(E)-beta-Farnesene。Proc Natl Acad Sci U S A. 1997,94(24):12833-12838。10.1073 / pnas.94.24.12833。
- 43.
王W,王Y,张Q,齐y,郭D:使用454焦磷酸盐的蒿属植物腺滴毛体转录组的全局鉴定。BMC基因组学。2009,10:465-10.1186 / 1471-2164-10-465。
- 44.
王刚,田磊,Aziz N, Broun P,戴旭,何杰,King A,赵PX, Dixon RA:啤酒花腺毛体萜的生物合成。植物营养与肥料学报。2008,29(3):441 - 446。10.1104 / pp.108.125187。
- 45.
Dudareva N, Andersson S, Orlova I, Gatto N, Reichelt M, Rhodes D, Boland W, Gershenzon J:非甲戊酸途径支持金鱼草花中单萜和倍半萜的形成。中国科学(d辑:地球科学),2005,32(3):534 - 538。10.1073 / pnas.0407360102。
- 46.
ARIGONI D,SAGNER S,LATZEL C,Eisenreich W,Bacer A,ZENK MH:Terpenoid Biosynesis通过分子内骨骼重排的高氧化物中的1-脱氧-D-木糖苷。Proc Natl Acad Sci U S A. 1997,94(20):10600-10605。10.1073 / pnas.94.20.10600。
- 47.
Hemmerlin A,Hoeffler JF,Meyer O,Tritritch D,Kagan Ia,Grohdemange-Billiard C,Rohmer M,Bach TJ:烟草甲酸胞菌甲酸胞菌和烟草溶液磷酸盐磷酸盐途径之间的串扰。J Biol Chem。2003,278(29):26666-26676。10.1074 / JBC.M302526200。
- 48.
Burke C,Croteau R:与小磷酸二磷酸二磷酸二磷酸二磷酸二磷酸二磷酸二磷酸二磷酸二磷酸合酶的链长特异性的相互作用改变为生产天竺葵二磷酸二磷酸酯。J Biol Chem。2002,277(5):3141-3149。10.1074 / JBC.M105900200
- 49.
常数,Hsieh fl,Ko tp,teng kh,梁pH,王啊:薄荷(Mentha piperita)的异淀粉磷酸酯合成酶的结构揭示了梭菌调节。植物细胞。2010,22(2):454-467。10.1105 / TPC.109.071738。
- 50。
来自薄荷(Mentha)物种的区域特异性细胞色素P450柠檬烯羟化酶:(-)- 4s -柠檬烯-3-羟化酶和(-)- 4s -柠檬烯-6-羟化酶的cDNA分离、特性和功能表达。中国生物化学学报,1998,18(1):101 - 101。10.1006 / abbi.1999.1298。
- 51.
Croteau R, Karp F, Wagschal KC, Satterwhite DM, Hyatt DC, Skotland CB:一种类似薄荷单萜含量的绿薄荷突变体的生化特性。植物营养与肥料学报,2001,21(3):429 - 434。10.1104 / pp.96.3.744。
- 52.
Colby SM, Alonso WR, Katahira EJ, McGarvey DJ, Croteau R:来自绿薄荷(薄荷)油腺的4s -柠檬烯合成酶。催化活性单萜环化酶的cDNA分离、表征和细菌表达。中国生物医学工程学报。1998,16(3):491 - 497。
- 53.
Prosser Im,Adams RJ,Beale Mh,霍金斯Nd,菲利普斯Al,Pickett Ja,田间LM:来自黑薄膜(Menthaxpiperita)的CIS-uuroladiene合成酶的克隆和功能表征,直接证据无法合成法呢尼。植物化学。2006,67(15):1564-1571。10.1016 / J.Phytochem.2005.06.012。
- 54.
Hellens RP,Allan AC,Friel Zh,Bolitho K,Grafton K,Templeton MD,Karunairetnam S,Gleave AP,Laing Wa:功能基因组学的瞬态表达载体,植物中启动子活性的定量和RNA沉默。植物方法。2005,1:13-10.1186 / 1746-4811-1-13。
- 55。
Song AA, Abdullah JO, Abdullah MP, Shafee N, Othman R, Tan EF, Noor NM, Raha AR:过表达3-羟基-3-甲基戊二酰辅酶A还原酶(HMGR)在异源植物倍半萜生产的甲戊酸乳杆菌途径。公共科学图书馆。2012,7 (12):e52444-10.1371/journal. pon.0052444。
- 56。
Tahira R, Naeemullah M, Akbar F, Masood MS:伊斯兰堡本地和外来薄荷种质的主要酚酸。植物学报,2011,43 (Special): 151-154。
- 57。
Lionetti V,Raiola A,Camardella L,Giovane A,Obel N,Pauly M,Favaron F,Cervone F,Bellincampi D:果胶甲基酯酶抑制剂的过度表达拟南芥限制了Botrytis Cinerea的真菌感染。植物理性。2007,143(4):1871-1880。10.1104 / pp.106.090803。
- 58。
Sh,Sohn Kh,Choi HW,Hwang是,Lee Sc,Hwang BK:胡椒果胶甲基酯酶抑制剂蛋白质Capmei1是抗真菌活性,基础疾病性和非生物胁迫耐受性所必需的。Planta。2008,228(1):61-78。10.1007 / s00425-008-0719-z。
- 59。
BLEE E:Phyto-Oxylipins在植物防御中的影响。趋势植物SCI。2002,7(7):315-322。10.1016 / s1360-1385(02)02290-2。
- 60.
脂氧合酶途径。植物营养与肥料学报,2002,21(4):429 - 434。10.1146 / annurev.arplant.53.100301.135248。
- 61.
Prost I,Dhondt S,Rothe G,Vicente J,Rodriguez MJ,Kift N,Carbonne F,Griffiths G,Esquerre-Tugaye Mt,Rosahl S,Castresana C,Hamberg M,Fournier J:植物氧化普斯抗菌活性的评价他们参与防御对抗病原体。植物理性。2005,139(4):1902-1913。10.1104 / pp.105.066274。
- 62.
Yang WY, Zheng Y, Bahn SC, Pan XQ, Li MY, Vu HS, Roth MR, Scheu B, Welti R, Hong YY, Wang XM:拟南芥(Arabidopsis thaliana)中含pattin的磷脂酶A pPLAIIalpha调控羟脂的形成和失水。植物学报。2012,5(2):452-460。10.1093 / mp / ssr118。
- 63。
氧化丙烯合成酶和氧化丙烯。前列腺素与脂质。2002,18 - 19:423-431。10.1016 / s0090 - 6980(02) 00046 - 1。
- 64。
拟南芥(Arabidopsis thaliana)基因家族成员:组织和器官特异性启动子活性和体内异质性。应用生态学报。2012,29(6):691 - 698。10.1093 / jxb / ers261。
- 65。
FastQC。(http://www.bioinformatics.babraham.ac.uk/projects/fastqc/]
- 66。
AIP2 E3连接酶通过促进ABI3的降解作用作为ABA信号转导的负调控因子。基因工程学报,2005,19(13):1532-1543。10.1101 / gad.1318705。
- 67.
沃克新泽西:Tech.Sight。这项技术的时代已经到来。中国科学:地球科学,2019,39(5):531 - 534。10.1126 / science.296.5567.557。
- 68.
关键词:马铃薯,非生物胁迫,实时RT-PCR,内源性基因选择植物营养与肥料学报。2005,32(4):427 - 434。10.1093 / jxb / eri285。
- 69.
Chen F,Tholl D,Bohlmann J,Pichersky E:植物中的萜烯合成酶系列:用于在整个王国中高度多样化的专业代谢的中等大小的基因系列。工厂J.2011,66(1):212-229。10.1111 / J.1365-313x.2011.04520.x。
确认
我们感谢Hufeng Zhou为生物信息学分析提供帮助。我们感谢洛克菲勒大学测序设施和惠卫博士为RNA SEQ。普拉斯坦尼亚诺里venkatesh维护温室。该研究由新加坡国家研究基金会(竞争性研究计划奖NO:NRF-CRP8-2011-02)提供资金,并向SR,ICJ和NHC以及新加坡千年基金会的授予NHC。JJ由新加坡教育部Tier-2 Grant,Moe2009-T2-2-004部分支持。我们还感谢Temasek Life Sciences实验室的中央设施。
作者信息
从属关系
通讯作者
附加信息
相互竞争的利益
提交人声明他们没有竞争利益。
电子辅料
QRT-PCR分析描述的unigenes。
附加文件4:DXS:1-脱氧-D-木糖-5-磷酸盐(DXP)合成酶;DXR:DXP癸二异酶,MCT:MEP细胞基转移酶,CMK:4-(胞苷5-二磷)-2-C- 甲基-D-赤藓糖醇激酶MCS:2-C-甲基-D-赤藓糖醇2,4-环二磷酸(ME-2,4cpp)合成酶,HDS:1-羟基-2-甲基-2-丁烯基4-二磷酸(HMBPP)synthase, HDR: HMBPP reductase, IPPI : Isopentenyl diphosphate (IPP,C5) Delta-isomerase, GPPS: geranyl diphosphate synthase, LS: limonene synthase, L6OH: Limonene-6-hydroxylase, CD: carveol dehydrogenase, LTP: Lipid transfer protein. (PPTX 288 KB)
12870_2014_292_moesm6_esm.pptx.
附加文件6:MVA路径中涉及的转录物的表达水平。绿色的数字表示PGT中特定基因的表达水平(RSEM值估计转录本丰度的log2)。红色的数字表示与叶-PGT相比,表达水平的变化倍数(PGT与叶-PGT之间的变化倍数为log2)。在含有多个单基因的酶中,考虑丰度最高的单基因。括号中的数字表示该途径中每一种酶所鉴定的unigenes的数量。(PPTX 63 KB)
全长MSTPS1和MSTPS2对其他植物萜烯合成酶的系统发育分析。
附加文件7:使用Mega5.2程序从对齐方式创建邻居加入树、(E)-β-法呢烯合成酶(AF024615),Lycopersicon esculentumgermacrene C合成酶(AF035630),鼠尾草officinalis1, 8-cineole合成酶(AF051899),Mentha Spicata.4 s-limonene合成酶(L13459),Perilla Citri奥戈拉柠檬烯合酶(AF241790),鼠尾草officinalis(+)-龙脑基二磷酸合酶(AF051900),鼠尾草officinalis(+)桧烯合酶(AF051901),Perilla frutescens.芳樟醇合成酶(AF444798),柑橘利森(+)-柠檬烯合酶1 (AF514287),拟南芥蒂利亚纳月桂烯/ ocimene合成酶(AF178535),青蒿(3 r)芳樟醇合成酶(AF154124),金鱼草majusNerolidol / Linalool合成酶1(EF433761),金鱼草majus(E) - β-外亚烃基合酶(AY195607),Solanum lycopersicum共甲基二磷酸合酶(AB015675),Cucurbita Maxima丙二磷酸合酶(AF049905);玉米萜烯合成酶1(AF529266),Cucurbita Maxima共甲基二磷酸合酶1(AF049905),abδ-硒合成酶(U92266),ab( - ) - 4S-柠檬烯合成酶(AF006193),abPinene合成酶(U87909),ab异松油烯合酶(AF139206),ab骨髓合酶(U87908),挪威云杉E-α-bisabolene合成酶(AY473619),Cichorium intybusgermacrene A合成酶简称(AF498000),摘要以Germacrene A合成酶LTC1(AF489964),加拿大一枝黄花Germacrene D合酶(AJ583447),加拿大一枝黄花germacrene A合成酶(AJ304452),青蒿β-石竹烯合成酶QHS1 (AF472361)青蒿amorpha-4 11-diene合成酶(JQ319661),青蒿(E) - - -β法呢烯合酶(AY835398),拟南芥蒂利亚纳二磷酸共酯合酶(NM_116512)拟南芥蒂利亚纳-kaurene合成酶GA2 (AF034774),斯蒂维亚莱巴迪亚洲人焦磷酸酯合酶(AF034545)斯蒂维亚莱巴迪亚洲人Kaurene合成酶(AF097310)。秤条表示每位位点的氨基酸取代数。五个TPS亚属,a到e基于TPS系列的分类分布[69.].(PPTX 74 KB)
GC-MS数据生成于
附加文件8:体内MsTPS1的表征。有或没有HMGR的MSTPS1瞬时表达N. Benthamiana.叶子的农杆菌属介导的渗透。采用气相色谱-质谱联用技术对化合物进行分析。通过质谱库的参考鉴定出编号峰,化合物的质谱显示在右侧。(PPTX 123 KB)
亚细胞本地化
附加文件9:MsTPS1和MsTPS2在N. Benthamiana.叶子。(一种)标记yfp的mstp瞬时表达为N. Benthamiana.叶细胞农杆菌属- 使用共聚焦显微镜的YFP通道显示渗透和可视化3DPI。(b)将yfp标记的mstps与CFP共同表达,以确定MSTPS-YFP的细胞质定位。CFP表达被用作细胞质制造蛋白。CFP: CFP通道图像,YFP: YFP通道图像,Auto:叶绿素自动荧光,Light:光学显微镜图像,Merged: Light与YFP合并图像。(PPTX 1 MB)
作者的原始提交的图像文件
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。
除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。
要查看本许可证的副本,请访问https://creativecommons.org/licenses/by/4.0/.
创作共用及公共领域专用豁免书(https://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
金,J, Panicker, D,王强。et al。下一代测序揭示绿薄荷的生物合成能力(Mentha Spicata.盾状腺毛通过比较转录组学。BMC植物BIOL.14,292(2014)。https://doi.org/10.1186/s12870-014-0292-5
已收到:
接受:
发表:
关键字
- 绿薄荷
- 下一代测序
- 转录组
- 腺毛状体
- 萜烯
- 香芹酮
- 萜烯合成酶