摘要
背景
根瘤在大豆生长过程中具有固定大气氮的重要作用。结节的过早衰老会对植物生长的氮利用率产生负面影响,因此,我们需要更好地了解结节的发育和衰老。半胱氨酸蛋白酶在大豆结节的发育和衰老过程中起着重要作用,但其抑制剂(半胱氨酸蛋白酶)在大豆结节发育和衰老过程中的作用尚不清楚。本研究首次提供了有关肿瘤发育过程中胱抑素表达的数据,并结合其抑制强度的生化表征。
结果
从大豆基因组中鉴定出79个与木瓜蛋白酶同源的非冗余半胱氨酸蛋白酶基因序列,属于不同的亚家族,以及几个豆科类半胱氨酸蛋白酶(空泡处理酶),其中18个半胱氨酸蛋白酶在结节发育和衰老过程中积极转录。此外,从大豆基因组中鉴定出19种非冗余的半胱抑素,类似于oryzacystatin-I,属于半胱抑素A和C亚群,其中7种在大豆结节中积极转录。大多数半胱抑素对组织蛋白酶l样半胱氨酸蛋白酶具有优先亲和力。半胱抑素Glyma05g28250, Glyma15g12211, Glyma15g36180的转录在衰老开始时尤其增加,可能在结节衰老和程序性细胞死亡时调节蛋白水解。积极转录和非积极转录的结节半胱抑素在不同年龄结节中均能抑制组织蛋白酶-l和b样活性,且从细菌细胞中表达和纯化后也能抑制木瓜蛋白酶和组织蛋白酶-l活性。
结论
活性和非活性转录的半胱抑素在活性和特异性上的重叠提出了一个问题,即非转录的半胱抑素是否为特定环境的反应提供了一个蓄水池。这些数据可能适用于发展战略,以延长结核的活性寿命或防止环境诱导衰老。
背景
在植物中,半胱抑素是木瓜蛋白酶C1A家族半胱氨酸蛋白酶的天然和特异性抑制剂,通常通过紧密和可逆的相互作用阻断C1A蛋白酶[1].已经提出了几种胱抑素功能,但所有功能都涉及到与半胱氨酸蛋白酶的平衡相互作用,以调节蛋白水解活性[2]、[3.].迄今为止的研究提供了强有力的证据,证明植物半胱抑素在生长和发育过程中调节内源性蛋白质的周转,包括衰老和程序性细胞死亡,并进一步参与储存蛋白质的积累和动员。另一个关键功能是保护植物害虫,其中半胱抑素阻止害虫蛋白质消化所需的半胱氨酸蛋白酶活性[3.]、[4].
半胱氨酸蛋白酶在结节衰老过程中的表达已有报道[5] - [8].感染结节中的蛋白水解活性限制了细菌的共生和固氮,以胞浆里的红蛋白和细菌为靶点。在Medicago trunctula半胱氨酸蛋白酶CYP15A的反义抑制导致结节衰老延迟[9],当结节特异性类木瓜蛋白酶半胱氨酸蛋白酶(AsNODF32)沉默时,结节寿命延长[10].然而,尽管有强有力的证据表明半胱氨酸蛋白酶参与结节的发育和衰老,但目前关于半胱氨酸蛋白酶在这些发育和衰老过程中的特定功能和活性的详细信息有限[6]、[8]、[11]、[12].关于内源性半胱氨酸蛋白酶在衰老过程中与内源性半胱氨酸蛋白酶相互作用的最详细的分析是,在衰老的菠菜叶片中,半胱氨酸蛋白酶和半胱氨酸蛋白酶的mrna的协调表达,其中发现了与衰老相关的半胱氨酸蛋白酶-半胱氨酸蛋白酶复合物[13].进一步的证据在活的有机体内对半胱氨酸蛋白酶的调控作用由皮莱提供et al。[14]表明在烟草植物中共表达水稻胱抑素OCI可以通过降低整体半胱氨酸蛋白酶活性来保护重组蛋白不被降解。
Phytozome数据库(www.phytozome.net)目前包含超过300个来自绿藻王国的半胱氨酸类序列、706个C1半胱氨酸蛋白酶序列和362个C13半胱氨酸蛋白酶(vpe型)序列。最近公布的大豆全基因组[15]以及在14种不同的大豆组织(包括大豆结节)中表达的RNAseq基因图谱的释放[16]进一步允许识别和表征所有19种大豆半胱氨酸蛋白,而不考虑转录活性和18种活性半胱氨酸蛋白酶。精确的研究现在可以确定结节中表达的半胱氨酸蛋白酶和半胱氨酸蛋白酶的种类,也可以研究内源性半胱氨酸蛋白酶是否优先与结节中特定的靶半胱氨酸蛋白酶相互作用。因此,我们的研究旨在通过识别和表征大豆结节中半胱抑素和半胱氨酸蛋白酶基因家族的所有成员,为这种相互作用提供第一个认识。我们将通过同源性搜索在大豆基因组数据库中识别的活性和非活性转录的半胱抑素和半胱氨酸蛋白酶都包括在内。用RNAseq技术开发了结节的转录图谱[17这使得我们能够在大豆冠结节的发育和衰老过程中测定所有稻制霉菌素i样半胱氨酸蛋白酶、木瓜蛋白酶样半胱氨酸蛋白酶以及液泡vpe型半胱氨酸蛋白酶的表达。这种VPE半胱氨酸蛋白酶类似于哺乳动物的半胱天冬酶,它们有助于衰老过程和PCD(程序性细胞死亡)[18],但可能通过翻译后修饰进一步激活前蛋白酶[19].
在我们的表征中,我们还想通过测试确定结节型半胱氨酸蛋白酶和半胱氨酸蛋白酶属于哪些家族和官能团,以及半胱氨酸蛋白酶的底物偏好在体外用各种含半胱氨酸蛋白酶的提取物生产半胱氨酸蛋白。半胱抑素是I25半胱抑素家族B亚家族的一部分,在谷物中可分为各种功能基团(A、B和C),大多数半胱抑素属于A和C组[20.].A组胱抑素能有效抑制组织蛋白酶l样半胱氨酸蛋白酶,优先表达于干燥和萌发的种子中,而C1组胱抑素是C1A肽酶的有效抑制剂,主要表达于发育中的种子胚乳中。半胱氨酸蛋白酶聚集成不同的亚族[21与木瓜蛋白酶最接近的半胱氨酸蛋白酶聚类,亚家族XCP1以拟南芥基因At1g20850和At4g35350。具有组织蛋白酶l样活性的半胱氨酸蛋白酶可以与RD21亚家族紧密聚集,RD21A (答:芥基因At1g47128)、RD21B (At5g43060)和RD21C (At3g19390)。c端粒粒结构域是RD21亚家族的特征。具有组织蛋白酶l样活性的半胱氨酸蛋白酶可进一步与SAG12亚家族聚集。具有cathepsin- f样活性的半胱氨酸蛋白酶簇具有RD19亚家族,成员为RD19A (At4g39090)、RD19B (At2g21430)和RD19C (At4g16190)和RD19,其亲域有一个特征性的ERFNAQ基序。具有组织蛋白酶h样活性的半胱氨酸蛋白酶簇属于AALP (At5g60360)和ALP2 (At3g45310)亚家族。
我们最终也有兴趣确定在结节发育和衰老过程中选择的主动和非主动转录的半胱抑素之间的相互作用亲和力。这将提供有关大豆中表达和非表达半胱抑素基因的相对活性和特异性的信息。在我们的研究中,我们发现表达和非表达的半胱抑素基因的活性和特异性有重叠,提出了一个问题,即非转录的半胱抑素是否为特定环境的反应提供了一个库。
结果
半胱氨酸蛋白酶抑制物的识别
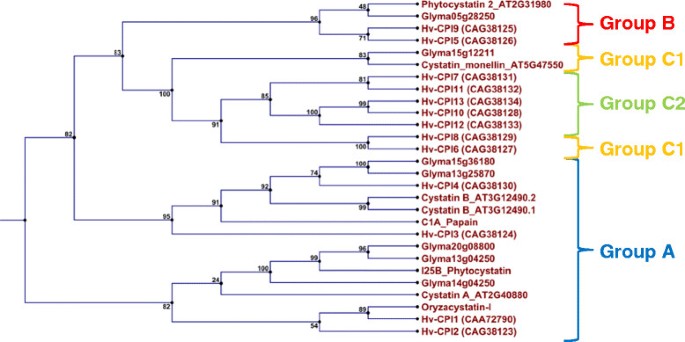
从我们的RNAseq数据中鉴定出所有表达的结节半胱抑素。当以米胞抑素- i(保守区域1EQK_A)作为模型胱抑素进行比较时,在组装的基因组中鉴定出25个胱抑素序列;这20个序列都是非冗余序列(附加文件1).当我们对半胱抑素进行系统发育遗传分析时,通过与来自不同I25亚家族的半胱抑素进行比较(图1)、Glyma13g04250和Glyma20g08800在结节发育和衰老过程中转录于结节中,与A族半胱抑素(豇豆属unguiculata胱抑素,OCI, HvCPI-1和HvCPI-2) [20.].Glyma13g04250与Glyma14g04250同源,位置相同,但在不同的染色体上。另外,两种胱抑素Glyma13g25870和Glyma15g36180与Cystatin B (At3g12490)和hvcp -4 (A组)高度相似,Glyma05g28250与B组胱抑素(Cystatin 2 (At2g31980)、hvcp -5和hvcp -9)高度相似。它们还含有一个含有SNSL氨基酸基序的c端延伸段,使其能够抑制豆科蛋白酶C13半胱氨酸蛋白酶[22].最后,结节中含量最多的胱抑素Glyma15g12211与C组(C1亚组)胱抑素(Monellin胱抑素(At5g47550)、hvppi -6和hvppi -8)相似。
我们还搜索了所有胱抑素序列的信号肽,以指示其可能的细胞定位(附加文件2).Glyma05g28250、Glyma07g39590和Glyma13g25870可能定位于分泌通路,而Glyma13g04250、Glyma14g04250和Glyma20g08800定位于除叶绿体、线粒体或分泌通路外的任何位置。Glyma15g36180的定位并不可靠,胱抑素可能位于线粒体或分泌通路中。
半胱氨酸蛋白酶识别
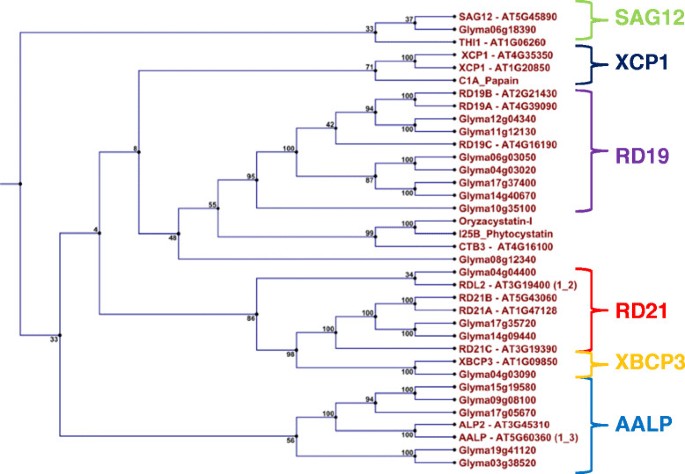
从大豆基因组中进一步鉴定出99个与模型半胱氨酸蛋白酶木瓜蛋白酶(E.C.3.4.22.2)同源性(1E≤−1.0)的半胱氨酸蛋白酶序列(附加文件)3.).有几个序列是其他半胱氨酸蛋白酶基因序列的等位基因、对等位基因和正交等位基因。从中我们鉴定出79个非冗余半胱氨酸蛋白酶基因序列,这些基因序列与8个不同半胱氨酸蛋白酶亚家族的成员相似。从我们的表达数据中区分出7个亚家族,我们确定了5个官能团(图2).然而,未发现与木瓜蛋白酶(XCP1亚家族)聚集的大豆半胱氨酸蛋白酶。具有组织蛋白酶l样活性的半胱氨酸蛋白酶包括Glyma04g03090(与RD21亚家族紧密聚类),以及两个蛋白酶Glyma14g09440和Glyma17g35720(与RD21亚家族成员相似)。我们还确认了这些半胱氨酸蛋白酶中具有RD21亚家族特征的c端粒蛋白结构域。Glyma04g04400 (cathepsin-L-like活性)与拟南芥基因RDL2 (At3g19400)相似度最高,与RD21亚家族成员紧密聚集。最后,Glyma04g36470和Glyma06g18390 (cathepsin- l样活性)与SAG12亚家族成员高度相似,尽管CG中缺少额外的C氨基酸CCWAFS主题。
7个具有cathepsin- f样活性的蛋白酶(Glyma04g03020、Glyma06g03050、Glyma10g35100、Glyma11g12130、Glyma12g04340、Glyma14g40670、Glyma17g37400)与RD19亚家族成员高度相似。然而,RD19亚家族特有的ERFNAQ基序(而不是原结构域的ERFNIN基序)缺失。Glyma08g12340与RD19和CTB3这两个亚家族没有明显的相似性。具有组织蛋白酶h样活性的半胱氨酸蛋白酶还有Glyma09g08100、Glyma15g19580和Glyma17g05670,它们与AALP和ALP2具有很高的相似性。这三种蛋白酶也具有n端NPIR空泡靶向信号和其他RD21亚家族基序(除了Glyma09g08100中缺少ATC基序)。虽然Glyma03g38520和Glyma19g41120与该亚家族有相似之处,但它们在C端含有ECGIE基序,具有CTB3亚家族的特征。
半胱氨酸蛋白酶抑制物转录
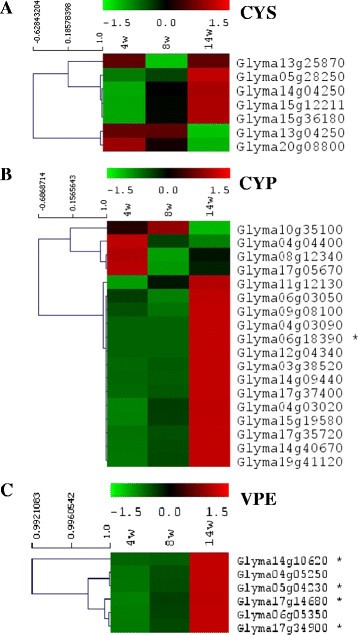
然后,我们研究了大豆结节发育和衰老的不同时间点(4周、8周和14周)的结节胱抑素和半胱氨酸蛋白酶的转录组3.).4周的时间点是结节发育初期,8周是成熟结节积极固氮,14周是衰老结节。在每个时间点产生3个生物重复并汇集后,对RNA进行测序,每个时间点产生约4000万对reads。如果在三个时间点中的任何一个获得的FPKM≥5.0,则胱抑素或半胱氨酸蛋白酶被认为具有转录活性[23].如果一个胱抑素或半胱氨酸蛋白酶在所有3个时间点都没有转录活性(FPKM <5),则胱抑素或半胱氨酸蛋白酶被认为是转录活性低下的。
半胱氨酸蛋白酶、半胱氨酸蛋白酶和液泡处理酶的表达变化。(一)半胱抑素的表达(半胱氨酸)(B)半胱氨酸蛋白酶(CYP),(C)液泡处理酶(汽相外延)在4、8和14周龄结节中表达为FPKM(每千碱基外显子每百万片段的转录丰度)。色标表示每个时间点的转录,标准化方法是用SD/RMS减少的每个基因的每个值减去三个值的平均值/中位数。*表示个体时间点间转录发生显著变化(p < 0.05)。采用多实验查看器(MeV v4.8.1)软件包对数据进行图形化表示[52].
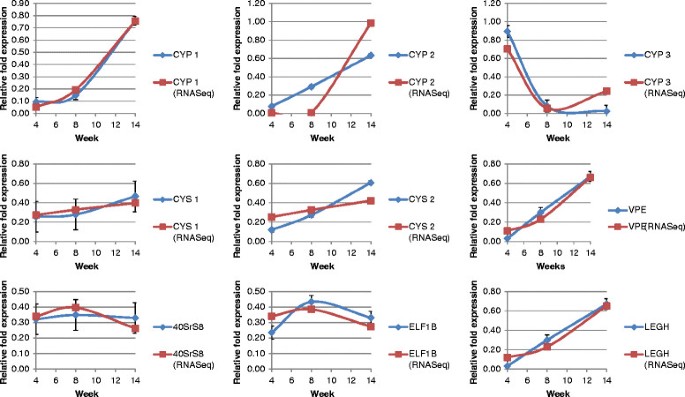
我们首先将我们的FPKM数据与之前在SoySeq数据库(http://soybase.org/soyseq/)在SoyBase网站上下载[16在接种后20-25天分析了各种组织类型(与我们的4周数据相比较)。两项研究的转录丰度估计是直接可比较的(数据未显示)。在I25B型胱抑素OC-I鉴定的20种大豆胱抑素中,只有7种胱抑素在结节中具有转录活性(图3.A). Glyma13g04250和Glyma20g08800在4周后表达量最高,但随着结节老化,其表达量下降(图3.A).相比之下,Glyma05g28250、Glyma15g12211(最丰富的胱抑素)和Glyma15g36180的转录在结节发展的后期增加(图3.A),尽管这些半胱抑素均无显著的转录变化(p≤0.05)。其余两种半胱抑素,Glyma13g25870和Glyma14g04250,要么没有变化(Glyma13g25870),要么表达低于或接近可检测阈值水平(Glyma14g04250)。我们还通过实时定量PCR对RNAseq数据进行了验证,在此基础上选择了具有代表性的每个研究基因家族的检测转录本。在发育过程中转录本的相对折叠表达的测定证实了我们的RNAseq数据,表明了我们的RNAseq分析方法的保真度(图4).
半胱氨酸蛋白酶转录
从最初的99个假定的与模型C1半胱氨酸蛋白酶木瓜蛋白酶同源的半胱氨酸蛋白酶序列中,18个半胱氨酸蛋白酶在结节中至少一个时间点具有转录活性(图3.B). 4周龄结节中最丰富的半胱氨酸蛋白酶是Glyma15g19580 (cathepsin-H样活性),14周龄结节中最丰富的半胱氨酸蛋白酶是Glyma17g37400 (cathepsin-F样活性)。大多数半胱氨酸蛋白酶的转录随着衰老的开始而增加,其中5种半胱氨酸蛋白酶(Glyma04g04400、Glyma08g12340、Glyma10g35100、Glyma11g12130和Glyma17g05670)在4周和8周大的结节中高度表达。除了Glyma06g18390转录外,其余半胱氨酸蛋白酶转录均无显著变化(p≥0.05),相对丰度极低,由于衰老而发生变化(p≤0.05)(图)3.B)。
我们还研究了VPE蛋白酶(C13半胱氨酸蛋白酶)的转录(图)3.C).这些蛋白酶类似于哺乳动物的半胱天冬酶。在结节衰老过程中VPE转录显著升高,4个序列(Glyma05g04230、Glyma14g10620、Glyma17g14680、Glyma17g34900)转录显著升高(p≤0.05)(4.0 log)2-fold变化)的Glyma14g10620和Glyma17g34900,其中,由于衰老,Glyma17g34900的转录增加最大(图3.C).从基因组中确定的7个VPE基因序列中,只有Glyma16g07190在结节发育过程中没有转录。
胱抑素抑制强度和特异性
下一步,我们用结节提取物进行半胱氨酸蛋白酶活性测定,以确定转录的半胱氨酸抑素的效力。荧光测定法与市售的组织蛋白酶- l或组织蛋白酶- b,以及代表结节中活性的总蛋白水解补体的分离结核蛋白提取物进行相互作用测定。为了建立对每个胱抑素的优先结合,我们首先用市售的组织蛋白酶- l和组织蛋白酶- b酶制剂测试了胱抑素的效力。在结节中转录的半胱抑素对组织蛋白酶- l的亲和力通常强于对组织蛋白酶- b的亲和力,其中Glyma13g27980和Glyma14g04250对两种组织蛋白酶活性的抑制效果相同(见表1).此外,Glyma15g36180抑制cathepsin-L,但不能抑制cathepsin-B,即使使用1 mM的抑制剂浓度。相比之下,在结节中没有转录活性的半胱抑素对cathepsin-L表现出更高的抑制率,其中Glyma18g12240同时抑制cathepsin-L和-B。Glyma14g04260的第二个结构域和Glyma14g04291的两个结构域进一步不能抑制cathepsin-B,即使在浓度为1 mM时(表1).
然后我们测试了胱氨酸抑制素对各种结节提取物的效力(表2).我们首先使用模型水稻胱抑素OC-I和半胱氨酸蛋白酶抑制剂E64。OC-I和E64在4周大的结节中都能抑制组织蛋白酶l样活性,但对8周和14周大的结节提取物的抑制效果较差2).这两种抑制剂也能阻止组织蛋白酶b样活性在4周大的结节提取物中。然后,我们将OC-I和E64的效力与各种重组大豆半胱抑素的效力进行了比较,这些重组大豆半胱抑素要么在结节中积极转录,要么在结节中不活跃2).经测试的半胱抑素通常对较年轻结节的提取物更有效(表2).在结节中有5种半胱抑素活性转录阻断了结节提取物中半胱氨酸蛋白酶的活性。然而,只有Glyma05g2850在所有三个时间点(4、8和12周)的结节提取物中抑制了组织蛋白酶l样活性,在4和8周的结节提取物中抑制了组织蛋白酶b样活性。在表达的胱抑素中,最有效的胱抑素是Glyma15g36180,当从4周大的结节提取液中测量组织蛋白酶l或B活性时,这种胱抑素的效力与oci和E64相当。
最后,我们还对检测在结节发育过程中不积极转录的半胱抑素感兴趣。这些半胱抑素对结节提取物的活性通常高于结节中转录的半胱抑素(表2).所有未转录的半胱抑素与OC-I和E64的效力相当,从4周大的结节提取提取。其中,Glyma14g04260结构域1和Glyma18g12240对半胱抑素的抑制率最高,分别为58.9%和54%。三种胱抑素(Glyma04g10360, Glyma07g39590和Glyma18g12240)抑制了从所有三个时间点提取的cathepsin-L和cathepsin-B样活性。此外,从14周衰老结节提取的提取物中,Glyma07g39590是所有测试的半胱抑素中抗组织蛋白酶- l和B活性最强的。
讨论
我们利用RNAseq技术鉴定了大豆结节中表达的8个半胱抑素基因。由于我们对冠状结节组织进行了宏观解剖,而不是对所选组织进行微观解剖,RNAseq数据代表了整个结节的转录谱,也包含了衰老结节皮层周围区域的转录本。当我们将它们的转录与已经发表的来自其他各种组织类型的RNAseq数据进行比较时[16],没有一个确定的结节半胱抑素是唯一转录的。一些半胱抑素在结节发育和衰老过程中进一步积极转录,但在衰老等特定时间点不完全转录。在所有三个选择的时间点上,只有Glyma05g28250被积极转录,并且也抑制了结节提取物中的组织蛋白酶l样活性。胱氨酸抑制素很可能在结节发展和衰老过程中起维持作用并调节半胱氨酸蛋白酶活性。其他积极转录的半胱氨酸蛋白只能在特定的时间点抑制特定类型的半胱氨酸蛋白酶的活性(组织蛋白酶L或B)。组织蛋白酶B是肽酶C1家族的一员,这种半胱氨酸蛋白酶是参与植物抗病高敏反应的PCD所必需的[24].在衰老开始时,随着几种半胱氨酸蛋白酶的同时诱导,Glyma05g28250, Glyma15g12211, Glyma15g36180的转录增加了约两倍。这些半胱抑素很可能在结节衰老时调节蛋白水解,并进行PCD,以尽可能长时间地维持大豆结节的氮固定。
胱抑素是I25胱抑素家族B亚家族的一部分,从我们的系统发育分析来看,它属于不同的类群(A、B和C) [20.].然而,任何单纯基于系统发育分析的分类都可能无法准确提供关于特定功能的信息[20.].几种在结节发育和衰老过程中几乎相同转录的半胱抑素与A类半胱抑素高度相似。在谷物中,A族半胱氨酸蛋白,包括水稻半胱氨酸蛋白,能有效抑制组织蛋白酶l样半胱氨酸蛋白酶,并优先在干燥和发芽的谷物种子中表达。它们可能调节在萌发时参与储存蛋白质动员的内源性酶[20.]、[25]、[26].
结节A组胱抑素簇中还包含两种胱抑素,分别为Glyma13g25870和Glyma15g36180,其c端延伸。在Glyma05g28250中也发现了这种扩展,与B类半胱抑素高度相似。羧基末端延伸的植物半胱抑素含有SNSL氨基酸基序,可抑制豆科蛋白酶C13家族(VPEs)的半胱氨酸蛋白酶[22].它们在结节发育过程中的一致转录以及在结节衰老过程中发现的Glyma15g36180和Glyma05g28250的转录增加,表明它们很可能是为了严格控制细胞破坏和任何可能破坏氮固定的半胱氨酸蛋白酶的激活。VPE蛋白酶类似于哺乳动物的半胱天冬酶,它们通过促进液泡膜的崩溃,释放蛋白酶到细胞中,从而促进衰老过程和PCD [18].也有证据表明,VPEs通过翻译后修饰激活前蛋白酶,导致I19抑制区域被移除后的成熟和蛋白水解活性[19].半胱氨酸蛋白酶,表达为前蛋白,由I29抑制结构域组成,防止非特异性活性[27].在我们的研究中,整个结节VPE半胱氨酸蛋白酶的转录随着衰老的进展而强烈增加。因此,VPEs主要在衰老结节中转录,并可能在半胱氨酸蛋白酶的激活中发挥重要作用。这些激活的半胱氨酸蛋白酶最终降解类细菌和结节细胞[28] - [32],与氮化酶活性降低有关[8]以及冠结节生物量和结节数量的减少[12].
在Phytozome数据库中发现的Glyma15g12211是最丰富的结节胱抑素,与C1组胱抑素相似。在结节中,这种胱抑素的转录水平几乎是其他所有活性转录胱抑素的四倍。Glyma15g12211与之前描述的Glyma15g12210相同[16]在结节和包括种子在内的其他组织中都被发现高度转录。在谷物中,C1群半胱抑素优先在种子中表达,特别是在发育中的胚乳中,是C1A肽酶的有效抑制剂[20.].未来的研究需要确定特定的靶半胱氨酸蛋白酶以及为什么Glyma15g12211优先表达在结节中。
我们还发现了在结节中不积极转录的半胱抑素。当表示在体外这些半胱抑素对结节蛋白水解补体的抑制活性比活性转录的半胱抑素具有更广泛的抑制活性。与主动转录的半胱氨酸相比,它们对组织蛋白酶l样半胱氨酸蛋白酶活性的抑制能力几乎是前者的两倍,对组织蛋白酶b样半胱氨酸蛋白酶活性的抑制能力也有部分提高。这可能表明,随着衰老和氮的再动员的开始,大量的胱抑素表达不应影响蛋白水解活性。然而,这些非主动转录的半胱抑素可能还有其他特定的功能,只有在某些生物和非生物胁迫条件下才会被激活,以防止结节过早死亡。
根据RNAseq数据,18种半胱氨酸蛋白酶在结节发育和衰老过程中被积极转录。鉴定出的半胱氨酸蛋白酶在功能上进一步多样化,属于不同的蛋白水解亚家族。在早期和成熟结节发育过程中,半胱氨酸蛋白酶的转录物丰度相对稳定,不同的半胱氨酸蛋白酶参与了整体的蛋白水解补体(组织蛋白酶- b -, F-, L-和h -样)。我们测试的大多数结节半胱抑素对组织蛋白酶l样半胱氨酸蛋白酶具有优先亲和力。然而,随着衰老的开始,半胱氨酸蛋白酶转录本丰度几乎翻倍,并与衰老的进展相关。然而,由于衰老的开始,只有极低转录的Glyma06g18390的转录发生了显著的变化。该半胱氨酸蛋白酶与衰老相关的SAG12 (At5g45890)同源。然而,在之前的一项综合转录组学研究中Medicago truncatula要理解Medicago与SAG12高度同源的4个半胱氨酸蛋白酶基因最为丰富[33].未来的研究需要确定大豆结节中SAG12同源半胱氨酸蛋白酶转录差异的原因Medicago不确定的结节。
要分析结节中任何内源性半胱氨酸蛋白的功能,关键是确定其可能的内源性靶半胱氨酸蛋白酶。到目前为止,我们对半胱抑素和靶蛋白酶之间可能的直接相互作用知之甚少在活的有机体内[4].因此,我们搜索了半胱抑素和半胱氨酸蛋白酶的信号肽序列,以获得有关其细胞定位的一些信息。胱抑素Glyma05g28250、Glyma07g39590和Glyma13g25870可能局限于分泌途径。内质网具有巨大的蛋白质储存能力和相对较低的蛋白水解活性,半胱抑素可能导致该细胞器蛋白水解活性较低[34].结节半胱抑素,如Glyma05g28250, Glyma07g39590和Glyma13g25870,具有信号肽,将能够与C1A蛋白酶相互作用,在其基因序列中也有分泌序列[2].MJ Chrispeels和NV Raikhel [35]进一步预测两种半胱氨酸蛋白酶的开放阅读框包含假定的空泡靶向信号。我们也在Glyma04g36470和Glyma06g18390中发现了这样的信号,尽管Glyma06g18390在结节衰老过程中明确表达,这引发了关于Glyma06g18390靶向液泡时的特殊功能的问题。一种可能的解释是,这个液泡靶向信号将这些半胱氨酸蛋白酶引导到含有拟杆菌的共生体腔室,进行类杆菌蛋白降解,影响菌周膜的稳定性。细菌周围膜的破裂会消灭微生物伙伴[30.].
结论
在本研究中,我们对大豆结节发育和衰老过程中半胱氨酸蛋白酶-半胱抑素系统各组分的系统发育关系和转录进行了研究。其中包括豆科植物素在内的一些成分在结节衰老过程中具有协同转录,这强烈表明它们直接参与了结节的衰老。总的来说,我们的研究创造了关于半胱氨酸蛋白酶和半胱氨酸蛋白酶转录的类型、系统中两组分协同转录的时间以及主动转录和非转录半胱氨酸在结节中的抑制活性的新知识,为未来更详细的相互作用研究提供了基础。这一知识的应用可能最终允许开发工程策略,以避免特别是应力诱导的结节过早衰老[36].在过表达半胱氨酸抑制素的转基因大豆系中,研究人员证实了利用半胱氨酸抑制素调节半胱氨酸蛋白酶活性的潜力,从而调节重要的农艺性状(如耐胁迫、延迟叶片衰老等)[36].通过调节半胱氨酸蛋白酶活性来延缓根瘤的衰老,延长活性固氮期可能会带来更好的大豆生长和提高产量[10并可能有助于未来的粮食安全[37].然而,由于目前对在活的有机体内系统的两个组成部分之间的相互作用,我们目前正在确定,作为下一步,它们的相互作用通过在体外用纯化的重组半胱氨酸蛋白酶和纯化的半胱氨酸蛋白酶进行分析,并通过免疫组织化学研究它们的个别定位。
方法
大豆中半胱氨酸蛋白酶和半胱抑素的鉴定
大豆基因组数据库[http://soybase.org/], Phytozome数据库[http://www.phytozome.net/soybean]和NCBI-BLAST [http://blast.ncbi.nlm.nih.gov/的在线资源,以确定半胱氨酸蛋白酶和半胱氨酸蛋白酶的整个家族大豆.为了鉴定半胱氨酸蛋白酶同系物,从水稻中提取的oryzacestatin - i [PDB: 1EQK_A]被用作半胱氨酸蛋白酶抑制剂I25家族的模型代表,在大豆中鉴定半胱氨酸蛋白酶同系物,半胱氨酸蛋白酶木瓜蛋白酶[E.C.3.4.22.2;基因库:P00784]番木瓜作为C1A半胱氨酸蛋白酶家族的模型代表。应用BLASTn、tBLASTx和BLASTp程序鉴定所有I25半胱氨酸蛋白酶和所有C1半胱氨酸蛋白酶,e值截断值为1E-1.0,以鉴定同源基因序列。自2011年7月和11月首次访问数据库以来,该基因命名一直保持与Glyma 1.89参考装配相对应[15应用于RNA-Seq读映射。用于研究的基因序列列在附加文件中1而且3..
植物材料及RNA制备
大豆(大豆商品品种Prima 2000的种子来自南非的Pannar Seed。每罐接种0.5 g SoyGro接种剂(SoyGro biofertilizer Limited),含Bradyrhizobium日本血吸虫在细蛭石(Mandoval PC)中种植之前,对菌株WB74-1进行了筛选。植株在控制条件下生长,光强为600 mmol.m,光周期13 h−2.s−1使用3小时的金属卤化物灯辅助照明,昼夜温度为25℃/17℃,相对湿度为60%。蒸馏水用于浇灌植物,每周用贫氮营养液浇灌两次[38].灌溉制度促进了植物与植物之间的共生关系根瘤菌具有高共生固氮性的刺激结节[39].至少在发育4周、8周和14周的时间点从三株植物中收获冠状结节,将其快速冷冻在液氮中,并在−80°C保存,直到RNA提取。使用Qiagen RNeasy®试剂盒(Qiagen,德国)收集3个生物重复进行RNA提取。RNA数量用Thermo Scientific NanoDrop 2000测定,RNA质量用2%琼脂糖凝胶分析,然后在Case Western Medical Institute进行测序。使用Illumina mRNA-SEQ试剂盒制备样品,用Illumina Genome analyzeriκ生成RNAseq文库。
转录组测序,数据处理,归一化和数据挖掘
用Galaxy服务器分析测序的RNA [http://galaxy.bi.up.ac.za/(比勒陀利亚大学林业和农业生物技术研究所生物信息部)。Glyma1.89基因组组装和转录组模型,可在Phytozome上获得[15,作为映射读的注释参考。RNA-Seq读取首先转换为Sanger FASTQ格式,使用FASTQ Groomer(版本1.0.4)和FASTQ Quality Trimmer(版本1.0.0)评估读取质量评分[40]、[41].使用Tophat2(版本0.6)工具将裁剪后的配对reads映射到参考基因组[42], Cufflinks(0.0.5版本)工具被用于将对齐的阅读组合到转录本/外显子isoofom中[23].应用Cuffcompare(0.0.5版本)工具跟踪时间点(结节年龄4周、8周和14周)的转录本,并将组装的转录本与参考注释进行比较。最后,使用Cuffdiff(0.0.5版本)工具寻找转录时间点的显著变化[23].生成的FPKM数据(Fragments Per Kilobase of exon model Per Million mapped Fragments)采用多实验查看器(MeV v4.8.1)软件包图形化表示数据[43].生成的颜色标度表示每个时间点的转录(FPKM),标准化方法是用SD/RMS减少的每个基因的每个个体值减去三个值的平均值/中位数。*表示个体时间点间转录发生显著变化(p <0.05)。此外,将FPKM数据与[16]可在SoySeq网上查询[http://soybase.org/soyseq/].利用在线资源TargetP搜索任何信号肽的基因序列[http://www.cbs.dtu.dk/services/TargetP/,以确定任何细胞定位,结果总结在附加文件2.RNAseq数据可在Soybase (http://soybase.org/projects/SoyBase.A2014.01.php).
转录物定量和RNA-Seq验证
使用Thermo Scientific RevertAid第一链cDNA合成试剂盒(Qiagen, Germany)对RNA和cDNA合成进行DNase I (1 U/μl)处理后,通过定量实时PCR (QPCR)对RNAseq数据中获得的转录进行确认。1 μg RNA, 0.5 μg Oligo(dT)在20 μl的反应体积中进行反转录。18引物(100 μM)和1 μl RevertAid™M-MuVL逆转录酶(200 U/μl)。反应在42℃下进行60分钟,然后在70℃下失活5分钟。用IDT的PrimerQuest设计工具设计QPCR引物[http://eu.idtdna.com/PrimerQuest/Home/Index]和引物组应用于300 nM(附加文件4).Bio-Rad CFX96-C1000热循环使用Touch Lightcycler,初始温度为95°C,循环10分钟,随后循环温度为95°C,循环15秒,60°C,循环30秒,循环温度为72°C,循环40°。通过熔融曲线分析(75°C ~ 95°C)和PCR扩增扩增子测序确定PCR扩增的特异性。扩增子特异性通过BLAST搜索进行筛选,以检测任何脱靶。逆转录酶阴性对照对每个RNA样本使用一次,以检测任何基因组DNA污染。所有反应均建立在三份副本中。采用Bio-Rad CFX Manager v2.1软件进行数据分析和计算问.任何异常值均由Grubbs检验确定,并从后续分析中删除[44]、[45].用于归一化的管家基因为核糖体蛋白40S亚基S8 (40S)或延伸因子1 β (ELF1) [46和SYBR Green I ntc阈值C问使用s40。使用ΔΔCq方法进行相对定量和归一化,并进行两次转录本定量以确定可重复性。对每个引物组的每个标准曲线进行三次测量,并检查其有效性,只有当其标准曲线的斜率在- 3.3到- 3.8之间时,才接受引物对。只有R2PCR效率在90% ~ 110%之间。90≤Cq≤1.1)被接受。
半胱氨酸蛋白酶和半胱抑素的系统发育分析
用CLC Main Workbench v6.7.1对每一种半胱氨酸蛋白酶和半胱氨酸蛋白酶的全长蛋白序列进行比对,生成系统发育树。采用邻居连接算法对100个Bootstrapping重复进行处理。不同胱抑素亚家族的模型代表序列由[20.]用于系统发育分析:Hv-CPI1 (CAA72790), Hv-CPI2 (CAG38123), Hv-CPI3 (CAG38124), Hv-CPI4 (CAG38130), Hv-CPI5 (CAG38126), Hv-CPI6 (CAG38127), Hv-CPI7 (CAG38131), Hv-CPI8 (CAG38129), Hv-CPI9 (CAG38125), Hv-CPI10 (CAG38132), Hv-CPI11 (CAG38132), Hv-CPI12 (CAG38133), Hv-CPI13 (CAG38134),以及Monellin胱抑素(At5g47550),胱抑素A (At2g40880),胱抑素B (At3g12490),植物胱抑素2 (At2g31980)和I25B胱抑素的代表豇豆属unguiculata.胱抑素系统发育分析的外组为木瓜蛋白酶。
8个不同半胱氨酸蛋白酶亚家族的模型代表序列由[21]分别为RD21A (At1g47128), RD21B (At5g43060), RD21C (At3g19390), RDL2 (At3g19400), XBCP3 (At1g09850), XCP1 (At4g35350), XCP1 (At1g20850), THI1 (At1g06260), SAG12 (At5g45890), RD19A (At4g39090), RD19B, (At2g21430), RD19C (At4g16190), AALP (At5g60360)。将ALP2 (At3g45310)和CTB3 (At4g1610)也包括在系统发育树中,以推断蛋白酶可能的功能活性。用于C1半胱氨酸蛋白酶系统发育分析的外基为OCI (Os01g58890)和I25B半胱氨酸蛋白酶豇豆属unguiculata(Q06445)。
半胱氨酸蛋白酶抑制物重组表达
用GenScript合成了Glyma04g10360、Glyma07g39590、Glyma08g11210和Glyma13g27980以及Glyma14g04260、Glyma15g36180和Glyma18g12240的基因序列。用5 ' -BamHI和3 ' -EcoRI酶切位点合成序列,用于后续的亚克隆。其余半胱抑素(Glyma05g28250, Glyma13g04250, Glyma14g04250, Glyma20g08800)的基因序列用基因特异性引物从cDNA制备物中分离(附文件)5).正向引物有一个5 ' -BamHI限制性内切酶位点,反向引物有一个3 ' -EcoRI限制性内切酶识别位点进行亚克隆。确定的基因序列被克隆到质粒pGEX-3X (Amersham Pharmacia Biotech, UK)作为BamHI-EcoRI片段和大肠杆菌菌株BL21 (DE3) (Invitrogen, USA)用于重组胱抑素的表达。所有用于细菌培养的化学试剂和用于质粒制备的GenElute™质粒提取试剂盒均来自英国Sigma Aldrich公司。所有分子生物学酶,例如用于PCR分离基因序列的聚合酶和用于克隆的酶均来自Thermo Scientific(美国)。蛋白纯化过程中使用Thermo Scientific gsh -琼脂糖,重组蛋白纯化过程中使用Xa因子(NEB, UK)。通过SDS-PAGE对重组蛋白表达过程中的蛋白制备进行分析[47],并用商业蛋白质测定法进行蛋白质定量[48].
的决心Ki值
荧光底物z - ph - arg - mca(来自Sigma-Aldrich的组织蛋白酶l样底物)从溶解于DMSO (Sigma-Aldrich, UK)的400 μM溶液中以10 μM最终浓度使用。木瓜蛋白酶(σ;EC 3.4.22.2, UK), cathepsin-L (Sigma;EC 3.4.22.15, UK)和cathepsin-B (Sigma;以EC 3.4.22.1, UK)为蛋白酶标准品。采用z - ph -精氨酸-7-氨基-4-甲基香豆素(Z-FR-AMC)和z -精氨酸-精氨酸-7-氨基-4-甲基香豆素(Z-RR-AMC)作为半胱氨酸蛋白酶底物,测定组织蛋白酶- l和组织蛋白酶- b样活性。(Z-FR-AMC/Z-RR-AMC)、cathepsin-F (Z-FR-AMC)、cathepsin-H (Z-RR-AMC)和cathepsin-L (Z-FR-AMC)半胱氨酸蛋白酶活性。测定半胱氨酸蛋白酶活性K我确定了每种不同重组半胱抑素的值。解离(抑制)常数(K我不同重组半胱氨酸蛋白酶与模型半胱氨酸蛋白酶之间的相互作用,根据[49].底物水解过程曲线由[50],确定线性方程为[51].木瓜蛋白酶(pH 7.0)、组织蛋白酶L (pH 5.5)和组织蛋白酶B (pH 6.0)在50 mM磷酸钠缓冲液、4 mM EDTA和8 mM L-半胱氨酸中测定其酶pH最佳值,水解温度为25°C。半胱氨酸蛋白酶活性测定采用Fluostar Galaxy荧光计(BMG,德国),使用360 nm激发过滤器和450 nm发射过滤器。K米木瓜蛋白酶13.6 μM,组织蛋白酶B 2.0 μM,组织蛋白酶L 1.0 μM [49].使用MARS数据分析软件v2.10 (BMG,德国)计算每秒斜率(FU/sec)。E-64 (Sigma-Aldrich, UK)作为广谱抑制剂(阳性对照)应用于浓度为10nM的半胱氨酸蛋白酶[52].首先测试了模型胱抑素OCI的浓度,在实验条件下降低蛋白质水解活性40-60%,并使用相同的浓度来测定不同大豆胱抑素的抑制效力。空白用不含酶的缓冲液和底物的斜率/秒表示,阴性对照用未抑制蛋白酶标准物的斜率/秒表示。所有反应均为三份。
胱抑素效力的测定
植物总蛋白提取物作为半胱氨酸蛋白酶活性的来源,用于测定半胱氨酸抑制素的效力。分别从不同时间点(4周、8周和14周)的大豆冠结节中提取提取物。在液氮和50mm磷酸钠缓冲液中粉碎,以1:3的比例(50mg: 150 μl;样本-缓冲)。溶液在冰上孵育30分钟,然后在15000 g下4℃离心15分钟,以去除任何碎片。除去上清液,测定总蛋白浓度,每次酶反应共使用100 ng蛋白。测定的蛋白酶活性以相对于缺乏抑制剂的百分比表示。ID50计算每一种胱抑素的浓度以达到50%的蛋白水解活性抑制。所有反应均在三份中进行。
统计分析
为了确定RNA-Seq数据中显著的转录变化,使用0.05的假发现率,并在应用多重检测的Benjamini-Hochberg校正后确定变化的显著性。用MeV软件包生成热图时,采用Pearson相关系数。使用GraphPad Prism Software 5.00版本的Windows (www.graphpad.com).
支持数据的可用性
支持本文结果的数据集可在Soybase上获得,[BioProject: PRJNA261105;http://soybase.org/projects/SoyBase.A2014.01.php或包含在附加文件中1,2,3.,4而且5.
作者的贡献
SGVW通过执行在线数据库的同源性搜索、编译基因列表、执行RNA-Seq读映射和数据分析,为数据的获取做出了贡献。此外,还对qPCR进行了贡献,对生成数据的解释和手稿的起草也有贡献。MDP通过进行初步的半定量PCR实验,在18周的时间内测定冠结节中的蛋白酶活性,对数据的获取做出了贡献,此外,还对生成数据的解释和起草手稿做出了贡献。CAC负责RNASeq数据的获取以及对手稿的严格修改。BJV和KJK都对研究的概念和设计做出了同样的贡献,并对手稿重要的知识内容进行了批判性的修改,并最终批准了即将出版的手稿的当前版本。所有作者阅读并批准了最终稿件。
附加文件
缩写
- FPKM:
-
每千基的外显子模型每百万映射的片段
- 纤毛运动:
-
程序性细胞死亡
参考文献
- 1.
朱明辉,刘克亮,吴红燕,叶克伟,程永生:塔半胱抑素-木瓜蛋白酶复合物的晶体结构及其对2组植物半胱抑素抑制作用的影响。植物生态学报,2011,34(2):354 - 354。10.1007 / s00425 - 011 - 1398 - 8。
- 2.
植物半胱氨酸蛋白酶的多功能作用。生物化学学报,2004,51(3):609-624。
- 3.
benabane M, Schlüter U, Vorster J, Goulet M- c, Michaud D:植物半胱抑素。中国生物工程学报,2010,29(11):359 - 359。10.1016 / j.biochi.2010.06.006。
- 4.
Diaz Mendoza M, Velasco Arroyo B, Gonzalez Melendi P, Martinez M, Diaz I: C1A半胱氨酸蛋白酶-胱氨酸抑制素在叶片衰老中的相互作用。中国机械工程学报,2014,29(6):694 - 694。10.1093 / jxb / eru043。
- 5.
李宏,许志刚,吴cj,金hb, Pakr SY,张志强,黄豆根瘤增强转录组分析。分子生物学杂志,2004,18(1):53-62。
- 6.
吴长杰,李宏,金红红,安春春:大豆根瘤特异性半胱氨酸蛋白酶cDNA的分离与鉴定。植物学报,2004,47(3):216-220。10.1007 / BF03030511。
- 7.
Espinosa-Victoria D, Vance CP, Graham PH:大豆冠结节衰老相关性状的寄主变异。作物科学,2000,40(1):103-109。10.2135 / cropsci2000.401103x。
- 8.
Pfeiffer NE, Torres CM, Wagner FW:大豆根瘤的蛋白水解活性:在生理发育和衰老过程中宿主细胞胞浆和类细菌的活性。植物生理学报,2003,21(4):369 - 369。10.1104 / pp.71.4.797。
- 9.
王晓燕,王晓燕,王晓燕,等:半胱氨酸蛋白酶对转基因紫花苜蓿种子萌发、营养生长和根瘤发育的影响。植物生态学报,2004,25(5):366 - 366。10.1016 / j.plantsci.2005.07.003。
- 10.
李艳,周亮,陈东,谭鑫,雷磊,周娟:绿肥豆科植物黄芪结节特异性植物半胱氨酸蛋白酶AsNODF32参与了黄芪结节衰老和固氮活性。植物生态学报,2008,30(1):184 -192。10.1111 / j.1469-8137.2008.02562.x。
- 11.
Alesandrini F, Frendo P, Puppo A, Hérouart D:大豆根瘤衰老分子标记的分离。植物生理与生物化学,2003,41(8):727-732。10.1016 / s0981 - 9428(03) 00110 - 4。
- 12.
Vorster B, Schlüter U, du Plessis M, van Wyk S, Makgopa M, Ncube I, Quain M, Kunert K, Foyer C:半胱氨酸蛋白酶°半胱氨酸蛋白酶抑制系统在大豆结节发育中的探索。农业工程学报,2013,3(3):550-570。10.3390 / agronomy3030550。
- 13.
田jima T, Yamaguchi A, Matsushima S, Satoh M, Hayasaka S, Yoshimatsu K, Shioi Y:菠菜叶中与衰老相关的半胱氨酸蛋白酶-胱氨酸抑制素复合物的生化和分子特征。植物工程学报,2011,41(2):378 - 378。10.1111 / j.1399-3054.2010.01425.x。
- 14.
皮莱,王晓燕,王晓燕,王晓燕。重组蛋白在生物工程植物细胞中的水解作用。生物地球科学,2014,5(1):15-20。
- 15.
Schmutz J、Cannon SB、Schlueter J、Ma J、Mitros T、Nelson W、Hyten DL、Song Q、Thelen JJ、Cheng J、Xu D、Hellsten U、May GD、Yu Y、Sakurai T、Umezawa T、Bhattacharyya MK、Sandhu D、Valliyodan B、Lindquist E、Peto M、Grant D、Shu S、Goodstein D、Barry K、Futrell-Griggs M、Abernathy B、Du J、Tian Z、Zhu L等:古多倍体大豆基因组序列。自然学报,2010,463(7278):178-183。10.1038 / nature08670。
- 16.
Severin AJ, Woody JL, Bolon YT, Joseph B, Diers BW, Farmer AD, Muehlbauer GJ, Nelson RT, Grant D, Specht JE, Graham MA, Cannon SB, May GD, Vance CP, Shoemaker RC: Glycine max的RNA-Seq图谱:大豆转录组指南。植物生物学杂志,2010,10(1):160-10.1186/1471-2229-10-160。
- 17.
McIntyre LM, Lopiano KK, Morse AM, Amin V, Oberg AL, Young LJ, Nuzhdin SV: RNA-seq:技术变异和采样。中国生物医学工程学报,2011,29(3):394 - 394。
- 18.
原西村I,初井N,中根S,黑柳木M,西村M:液泡处理酶:植物细胞死亡的执行者。植物生态学报,2004,8(4):404-408。10.1016 / j.pbi.2005.05.016。
- 19.
Roberts IN, Caputo C, Criado MV, Funk C:植物衰老相关蛋白酶。植物工程学报,2012,32(1):1 - 4。10.1111 / j.1399-3054.2012.01574.x。
- 20.
Martinez M, Cambra I, Carrillo L, Diaz- mendoza M, Diaz I:大麦中整个胱抑素基因家族及其靶组织蛋白酶L样半胱氨酸蛋白酶的特性,在种子萌发过程中hordein动员的伙伴。植物生理学报,2009,29(3):359 - 359。10.1104 / pp.109.146019。
- 21.
Richau KH, Kaschani F, Verdoes M, Pansuriya TC, Niessen S, Stüber K, Colby T, over左HS, Bogyo M, Van der Hoorn RAL:植物木瓜样半胱氨酸蛋白酶的亚分类和生化分析显示亚家族特异性。植物生理学报,2012,29(4):359 - 359。10.1104 / pp.112.194001。
- 22.
Martinez M, Diaz- mendoza M, Carrillo L, Diaz I:羧基末端扩展型植物胱抑素是木瓜蛋白酶和豆科蛋白酶半胱氨酸蛋白酶的双功能抑制剂。中国生物医学工程学报,2007,29(5):533 - 533。10.1016 / j.febslet.2007.05.042。
- 23.
Trapnell C, Williams BA, Pertea G, Mortazavi A, Kwan G, van Baren MJ, Salzberg SL, Wold BJ, Pachter L: RNA-Seq转录本组装和量化揭示了细胞分化过程中未注释转录本和亚型转换。中国生物工程学报,2010,28(5):511-515。10.1038 / nbt.1621。
- 24.
Gilroy EM、Hein I、Van Der Hoorn R、Boevink PC、Venter E、McLellan H、Kaffarnik F、Hrubikova K、Shaw J、Holeva M、Lopez EC、Borras-Hidalgo O、Pritchard L、Loake GJ、Lacomme C、Birch PR:组织蛋白酶B在植物抗病超敏反应中的作用植物学报,2007,42(1):1-13。10.1111 / j.1365 - 313 x.2007.03226.x。
- 25.
清崎T,松本I,浅仓T, Funaki J, Kuroda M, Misaka T, Arai S, Abe K:麦胶溶蛋白是一种赤霉素诱导的半胱氨酸蛋白酶,发生在小麦小麦(Triticum aestivum L.)的萌发种子中,专门消化麦胶溶蛋白,受内部半胱氨酸调控。中国科学(d辑),2007,38(4):447 - 447。10.1111 / j.1742-4658.2007.05749.x。
- 26.
Arai S, Matsumoto I, Emori Y, Abe K:植物种子半胱抑素及其内源和外源靶酶。农业食品化学,2002,50(22):6612-6617。10.1021 / jf0201935。
- 27.
Wiederanders B: CA1类半胱氨酸肽酶前肽的结构-功能关系。生物化学学报,2003,50(3):691-713。
- 28.
文森J,牛顿W,奥姆约翰逊W:豆类-根瘤菌共生的控制因素。在固氮卷2:共生关系和蓝藻。1980:103 - 129。
- 29.
Malik NSA, Pfeiffer NE, Williams DR, Wagner FW:大豆根瘤的肽水解酶:无类杆菌提取物中酶的鉴定、分离和部分表征。植物生理学报,2001,27(2):388 - 388。10.1104 / pp.68.2.386。
- 30.
苜蓿有效根瘤和植物基因控制的无效根瘤发育和衰老过程中的蛋白质水解。植物生理学报,2003,23(2):369 - 371。
- 31.
半胱氨酸蛋白酶基因在豌豆结瘤发育和衰老中的表达。植物-微生物相互作用MPMI。科学通报,1996,9(8):689-695。10.1094 / mpmi - 9 - 0689。
- 32.
Vincent JL, Brewin NJ:半胱氨酸蛋白酶在豌豆结节细胞液泡、囊泡和共生体中的免疫定位。植物生理学报,2004,23(2):533 - 536。10.1104 / pp.123.2.521。
- 33.
Van de Velde W, Guerra JC, de Keyser A, de Rycke R, Rombauts S, mauoury N, Mergaert P, Kondorosi E, Holsters M, goomachtig S:豆科植物共生中的衰老。从分子角度看苜蓿根瘤衰老。植物生理学报,2006,26(2):441 - 441。10.1104 / pp.106.078691。
- 34.
Erwin Ivessa N, Kitzmüller C, de Virgilio M:内质网内外与内质网相关的蛋白质降解。中国生物工程学报,1999,29(4):326 - 326。10.1007 / BF01294709。
- 35.
短肽结构域靶向植物液泡中的蛋白质。科学通报,1992,38(4):613-616。10.1016 / 0092 - 8674 (92) 90134 - x。
- 36.
Quain MD, Makgopa ME, Márquez García B, Comadira G, Fernandez Garcia N, Olmos E, Schnaubelt D, Kunert KJ, Foyer CH:异位表达植物胱抑素可通过作用于左曲内酯途径增强大豆(Glycine max)和拟南芥(Arabidopsis thaliana)的抗旱能力,并可改善种子性状。植物生态学报,2014,29(4):369 - 369。10.1111 / pbi.12193。
- 37.
Drevon JJ, Abdelly C, Amarger N, Aouani EA, Aurag J, Gherbi H, Jebara M, Lluch C, Payre H, Schump O, Soussi M, Sifi B, Trabelsi M:提高地中海盆地盐渍化地区普通豆(Phaseolus vulgaris)共生固氮和产量的跨学科研究策略中国生物工程学报,2001,29(3):366 - 366。10.1016 / s0168 - 1656 (01) 00339 - x。
- 38.
Fenta BA, Driscoll SP, Kunert KJ, Foyer CH:结瘤大豆耐旱性状的表征:在干旱引起的氮代谢限制下维持光合作用和芽生生物量的重要性。中国农业科学,2012,32(2):447 - 447。10.1111 / j.1439 - 037 x.2011.00491.x。
- 39.
Van Heerden PDR, De Beer M, Mellet DJ, Maphike HS, Foit W:生长介质对大豆芽部生理、根瘤数量和共生固氮的影响。中国生物医学工程学报,2007,32(4):366 - 366。10.1016 / j.sajb.2007.05.009。
- 40.
Cock PJ, Fields CJ, Goto N, Heuer ML, Rice PM: Sanger FASTQ文件格式的序列与质量分数,和Solexa/Illumina FASTQ变体。中国生物医学工程学报,2010,38(6):1767-1771。10.1093 / nar / gkp1137。
- 41.
Blankenberg D, Gordon A, Von Kuster G, Coraor N, Taylor J, Nekrutenko A:使用Galaxy操作FASTQ数据。生物信息学,2010,26(14):1783-1785。10.1093 /生物信息学/ btq281。
- 42.
Kim D, Pertea G, Trapnell C, Pimentel H, Kelley R, Salzberg SL: TopHat2:存在插入、删除和基因融合的转录组的精确对齐。基因组生物学,2013,14 (4):R36-10.1186/gb-2013-14-4-r36。
- 43.
Saeed AI、Sharov V、White J、Li J、Liang W、Bhagabati N、Braisted J、Klapa M、Currier T、Thiagarajan M、Sturn A、Snuffin M、Rezantsev A、Popov D、Ryltsov A、Kostukovich E、Borisovsky I、Liu Z、Vinsavich A、Trush V、Quackenbush J: TM4:一种用于微阵列数据管理和分析的免费、开源系统。生物技术,2003,34(2):374-378。
- 44.
Bustin SA, Benes V, Garson JA, Hellemans J, Huggett J, Kubista M, Mueller R, Nolan T, Pfaffl MW, Shipley GL, Vandesompele J, Wittwer CT: MIQE指南:定量实时PCR实验发表的最低信息。临床化学,2009,55(4):611-622。10.1373 / clinchem.2008.112797。
- 45.
Burns MJ, Nixon GJ, Foy CA, Harris N:实时定量PCR方法数据的标准化——异常值的评估和校准曲线的比较。生物工程学报,2005,5(1):31-10.1186/1472-6750-5-31。
- 46.
Mortier V, Fenta BA, Martens C, Rombauts S, Holsters M, Kunert K, Goormachtig S:在Glycine max基因组中寻找结节相关CLE基因。实验与应用学报,2011,62(8):2571-2583。10.1093 / jxb / erq426。
- 47.
Laemmli UK:结构蛋白在T4噬菌体头部组装过程中的裂解。自然学报,1970,227(5259):680-685。10.1038 / 227680 a0。
- 48.
Bradford MM:利用蛋白质与染料结合的原理,对蛋白质的微克量进行定量的一种快速、灵敏的方法。生物化学学报,2004,22(1):1 - 4。10.1016 / 0003 - 2697(76) 90527 - 3。
- 49.
Goulet M-C, Dallaire C, Vaillancourt L-P, Khalf M, Badri AM, Preradov A, Duceppe M- o, Goulet C, Cloutier C, Michaud D:通过在阳性选择的氨基酸位点上的单突变,使植物半胱氨酸蛋白特异性针对草食昆虫消化半胱氨酸蛋白酶。植物生理学报,2008,26(3):378 - 378。10.1104 / pp.108.115741。
- 50.
Salvesen G, Nagase H:蛋白水解酶的抑制。IRL出版社,纽约;1989.
- 51.
Henderson PJ:描述酶和亚细胞颗粒与紧密结合的抑制剂相互作用的稳态动力学的线性方程。中国生物医学工程学报,2004,24(3):369 - 369。
- 52.
米胞抑素I和II对科罗拉多马铃薯甲虫组织蛋白酶H的选择性抑制作用。中国生物医学工程学报,2003,31(1-2):173-176。10.1016 / 0014 - 5793 (93) 80320 - t。
确认
这项工作由国际科学基金会(IFS拨款C/5151-2)、NRF国家生物信息学功能基因组学计划(86947)(BJV)和NRF获奖研究人员激励资助计划(KJK)资助。在此也感谢从比勒陀利亚大学基因组研究所获得的资金。SGVW和MDP感谢NRF/DST和南非蛋白质研究基金会(MDP)提供的奖学金。感谢Kyle Logue和David Serre对RNASeq数据开发的帮助。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
国家研究基金会(NRF)对这项研究的财政援助在此得到确认。所表达的观点和得出的结论都是作者的观点,并不一定归属于NRF。
电子辅料
12870 _2014_294_moesm1_esm.xlsx
附加文件1:通过RNAseq分析在大豆结节中发现的胱氨酸抑素序列与水稻抑素i相似。*表示结节中半胱抑素转录活性。(XLSX 9 KB)
12870 _2014_294_moesm2_esm.xlsx
附加文件2:TargetP生成的预测信号肽数据,包括名称,蛋白质长度,最终预测的最终NN评分(cTP, mTP, SP等),定位预测(Loc),可靠性等级(RC), TPlen(预测序列前长度),叶绿体(C),线粒体(M),分泌通路(S)和任何其他位置(−)。可靠性等级表示为最佳次最佳预测之间的差异(diff),从高到低表示;1: diff >0.800, 2: 0.800 > diff >0.600, 3: 0.600 > diff >0.400, 4: 0.400 > diff >0.200和5:0.200 > diff (XLSX 16 KB)
12870 _2014_294_moesm3_esm.xlsx
附加文件3:通过RNAseq分析发现大豆结节中半胱氨酸蛋白酶序列与木瓜蛋白酶相似。*表示结节中半胱氨酸蛋白酶的转录活性。(XLSX 11 KB)
权利和权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。
本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。
欲查看此许可证的副本,请访问https://creativecommons.org/licenses/by/4.0/.
创作共用公共领域奉献放弃书(https://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
范威克,s.g.,杜普莱西,M.,卡利斯,C.A.et al。半胱氨酸蛋白酶和半胱抑素在大豆根瘤发育和衰老过程中的表达和活性。BMC植物杂志14日,294(2014)。https://doi.org/10.1186/s12870-014-0294-3
收到了:
接受:
发表:
关键字
- 半胱氨酸蛋白酶抑制物(年代)
- 半胱氨酸蛋白酶(s)
- 程序性细胞死亡
- RNASeq
- 衰老
- 大豆
- 共生固氮作用
- 转录组