摘要
背景
在开花植物中,无融合生殖(通过种子进行无性繁殖)被广泛认为是由于性雌性生殖途径的关键调控因子的失效。在过去的几年里,包括有性植物生殖器官及其无融合生殖器官的差异显示和RNA-seq比较方法已经获得了广泛的候选基因列表。然而,这些基因的功能特征只有有限的一部分,因此很少有线索来理解无融合生殖的分子控制。我们之前已经鉴定了几个与RNA生物学相关的基因高度相似的cDNA片段,并在有性和无融合生殖之间存在差异扩增柑橘植物Notatum.植物。在这里,我们报道了其中一个候选基因的特性,即N69编码s -腺苷- l-蛋氨酸依赖性甲基转移酶超家族的蛋白。本研究的目的是扩展N69 cDNA序列,并对其在有性生殖和无融合生殖个体不同发育阶段的表达进行分析。
结果
N69 cDNA的分子特征显示其与酵母和哺乳动物三甲基鸟苷合成酶/ prip相互作用蛋白相似的蛋白编码基因同源。这些蛋白作为erk2控制的转录辅激活因子和sn(o)RNA和端粒酶RNA帽三甲基化的介质发挥双重作用,参与哺乳动物和酵母的发育。n69扩展序列因此被重新命名pntgs1样.的表达pntgs1样与无融合体相比,有性基因型的花器官在生殖发育过程中有显著的增加。在营养组织中没有发现这种差异。几种基因型的生殖组织表达水平与兼性无融合生殖率呈负相关。此外,原位杂交观察显示pntgs1样表达是在整个开发过程中的性植物的胚珠相对较高,从premeiosis成熟。其中检测差异表达的组织包括珠心细胞,aposporous缩写分化的无融合生殖基因型的部位。
结论
我们的结果表明pntgs1样(原N69)编码一种三甲基鸟苷合成酶样蛋白,该蛋白在哺乳动物和酵母中的功能对发育(包括生殖)至关重要。我们的发现也表明该候选基因在珠心细胞命运中的关键作用,因为它的表达减少与植物无融合途径的启动相关。
背景
在开花植物配子体无融合生殖是指无性繁殖通过种子[1].这种繁殖模式可以通过多种途径实现[2],在被子植物中广泛存在[3.].有两个主要的区别,支配植物性的发育程序通常构成无融合生殖的基础。第一个重要的差异涉及一个或多个功能未退化的雌性配子体的分化,这发生在珠心内减数分裂失败(双孢子型)或珠心细胞命运改变(无孢子型)。第二,种子的形成不需要雌性配子受精,可以通过孤雌生殖形成母体胚胎。胚乳自主产生或在极核受精后产生(假配子)。
雀稗[4]是禾本科(禾本科)中最大的属之一,约有370种,分为4个亚属(Anachyris,Ceresia,Harpostachys, 和百狭义)(在[5])。柑橘植物Notatum.是亚属的成员吗雀稗并形成一个由自不育的有性二倍体和自不育的同源四倍体组成的无生殖复合体[5].柑橘植物Notatum.无融合生殖基因型通过离体生殖。在减数分裂前的未成熟胚珠中,大孢子母细胞周围的一个到几个伴珠心细胞扩大,发生一系列有丝分裂,最终分化为未缩小的胚囊,称为离孢子胚囊(aposporous embryo囊,AESs)。AESs可以与单个减数分裂衍生胚囊共存,也可以与单个减数分裂衍生胚囊竞争,占据成熟胚珠的整个体积[5].a的结构柑橘植物Notatum.MES是禾草科植物的典型物种:一个卵细胞,两个增效细胞,一个双核中央细胞和大量增殖的反足[6].另一方面,AESs表现出独特的五核形态结构(雀稗型胚囊)的特征是存在一个卵细胞,两个增效细胞和一个双核中央细胞,但没有反足;这种结构可以通过澄清胚珠的细胞胚胎学分析直接进行分类[7].开花时,MESs进行典型的被子植物双受精,产生可存活的种子。相反,AESs通常在中央细胞受精形成孤雌胚胎(假配子)后发育成种子。专性离孢子个体的胚珠中几乎100%只含有AESs,而兼性离孢子个体的成熟混合胚珠中含有MES和一个或多个AES的比例不同。虽然在自然界中不存在完全有性的多倍体个体,但通过秋水仙碱诱导有性二倍体染色体加倍,人工产生了一些基因型[8]或通过越过兼职庇护[9].
单性生殖的柑橘植物Notatum.是作为一种显性的单基因性状遗传,具有扭曲的分离比,并与单个基因组区域,Apospory control region (ACR)相关[7],[10] - [13].作图方法揭示了细胞内强烈的重组抑制柑橘植物Notatum.ACR和二体遗传,而其余基因组区域显示多体遗传[12],[13].的ACR的部分分辨率已经推出了包含同线水稻染色体2和12,而是通过倒置,易位广泛的基因组重排扇区相当复杂的基因组结构,和/或低和高拷贝数的反转录因子的插入[10],[11],[13] - [15].这些特征与通过遗传作图检测到的缺乏重组和在某些后代中观察到的与离体分离的扭曲比率强烈一致。然而,这种特殊的ACR基因组结构是否在从性向生殖转变所需的转录组变化中起关键作用尚不清楚。有趣的是,我们目前的知识表明,尽管ACR基因贫乏,但它包含几个推定编码蛋白质的序列,包括一个mt - a70样候选蛋白(mRNA n6 -腺苷甲基转移酶)[14].该酶催化新生mRNA中n6 -腺苷甲基化,并在多种真核生物系统的细胞命运决定中发挥关键作用[16].特别是MT-A70在模型厂的功能丧失拟南芥蒂利亚纳导致早期胚胎发育失败[17].映射到ACR另一个有趣的序列是K的同源性(KH)结构域的蛋白,其是在转录后水平在mRNA稳定性和基因表达的调节中涉及的RNA结合蛋白[18],[19].KH蛋白已与维持活性染色质状态有关诺克斯玉米叶片正常发育所需的茎尖分生组织外围区的基因[20.].
转录组调查使得在植物种类中鉴定与植物物种中的牙孢菌相关的众多候选基因Brachiaria brizantha.,Poa pratensis,柑橘植物Notatum.,Panicum最大值,Boecheraspp。雀稗单纯形和Hieraciumspp。21] - [27].比较转录组分析柑橘植物Notatum.在无融合生殖系统中普遍存在的几个主要缺陷:缺乏真正的近同基因无融合生殖和性系,高杂合性和有限的基因组资源(在[5])。基于差异显示的RNA谱分析旨在克服这些困难,并已被用于识别一组45个候选基因,这些候选基因在无融合生殖发育过程中与性形成相比通常下调[23],[28].有趣的是,其中两个基因(N4和N69)与编码RNA甲基转移酶的基因具有显著的相似性[23].
鉴定了rna - n6 -腺苷甲基转移酶基因和rna结合蛋白基因柑橘植物Notatum.ACR,再加上性和无融合生殖植物花卉差异表达的另外两个RNA甲基转移酶,促使我们去探索RNA甲基化aposporous生殖发育中的作用。作为这种努力的一部分,我们试图推断N69候选基因繁殖发育的可能的功能。为了实现这个目标,我们的特点候选人,在模型物种已查明,其公认的直系同源基因,并在关键的发展步骤的性和无融合生殖基因型的生殖组织分析其表达。
结果
N69序列特征
888核苷酸N69 cDNA片段的推导氨基酸序列最初分离柑橘植物Notatum.[23]与RNA-cap鸟嘌呤- n2甲基转移酶结构域(PF09445;E-值:1.4 × 10−46) [23].在酵母、哺乳动物和果蝇PF09445由一个基因TGS1 (trimethylguanosime synthase)编码,TGS1是一个保守的核仁甲基转移酶,负责sn-, sno-和端粒酶rna的m(7)G帽转化为m(2,2,7)G,以及减数分裂前mrna的核仁组装和剪接[29] - [31].另一方面,植物基因组包含两个不同的基因编码tgs1样蛋白。第一个在真核生物中是保守的,仅包括RNA-cap鸟嘌呤- n2甲基转移酶结构域(GRMZM2G151887, OS06T0187100和AT1G30550,分别在玉米、水稻和水稻中拟南芥)的RNA甲基转移酶结构域,与WW结构域相关,参与蛋白-蛋白相互作用(玉米、水稻和水稻中的GRMZM2G347808、OS03T0396900和AT1G45231)拟南芥).利用从有性生殖和无融合生殖植物生殖组织中获得的Roche 454 RNA测序数据,结合RACE实验使用Marathon cDNA文库,我们组装了一个代表N69扩展的cDNA共识序列的单个contig,覆盖整个N69 CDS(见方法和图)1).BLAST分析进一步证明它来自A的转录物柑橘植物Notatum.基因与tgs1家族的一个植物特定成员(WW + AdoMet donains)同源,我们随后将其命名pntgs1样.注意,n69扩展序列包含了完整的cdpntgs1样但我们无法解决完整的5 '和3 ' uts。
N69部分cDNA来源于一个植物特有的基因编码一个三甲基鸟苷合成酶。(一)使用RACE获得的N69 cDNA(黑色条)和N69延伸片段(白色条),并从RNA 454测序的性(C4-4x)和无融合生殖(Q4117)组织(白色条)中获得一致的cDNA序列。该序列包含一个与酵母三甲基鸟苷合成酶1 (TGS1)同源的预测ORF编码序列。(B)设计引物,从无融合生殖(Q4117)和有性生殖(C4-4x)基因型的生殖组织中扩增4个不同的序列片段(F1、F2、F3、F4),并进行测序验证。(C)对几种酵母和植物模型种中与酵母TGS1相似的蛋白进行系统发育分析柑橘植物Notatum.预测的产品是由RNA帽鸟嘌呤-N2甲基域的与WW结构域的关联所定义的TGS1蛋白家族的植物特定成员高度相似。域显示为彩色刻度。ClustalW比对显示在右(箭头指示Pasalum喜序列)。
利用这些信息,我们设计了一套引物,从Q4117(无融合生殖)和C4-4x(有性生殖)植物的花中提取的mRNA样本中扩增重叠片段(F1, F2, F3)和完整序列(F4)并进行测序(图)1;表格1).我们恢复了两个完整的序列(ApoPnTgs1和性PnTgs1)和同义变异位点,包括snp和一些INDELs(存于GeneBank,登录号为bank1742582 ApoPnTgs1KM114904和BankIt1742582PnTgs1KM114905),但在氨基酸水平上共享96.9%的同一性,从而表明PnTGS1例如在有性和无融合生殖植物中都有作用。系统发育树的构建包含了来自酵母和植物的16个tgs1样蛋白序列,与植物特异性序列具有较高的相似性,同时包含WW + AdoMet结构域(图)1).
pntgs1样表达与生殖行为的相关性
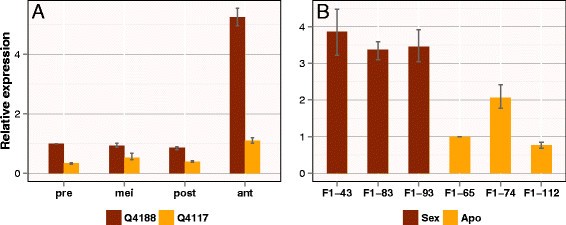
我们第一次测量pntgs1样利用从减数分裂前、减数分裂后和开花期收集的小穗中提取的RNA样本,研究了无融合生殖(Q4117)和有性(Q4188)植物生殖发育过程中的表达水平。如图所示2定量分析显示,在所有发育阶段,性别基因型的表达水平均显著升高。与减数分裂前相比,花期性基因型的表达量增加了5倍左右。这种增加在无融合基因型中没有观察到。
为了确定这种差异表达是否真的与生殖模式有关,我们进行了研究pntgs1样在花期收集的三个有性和三个无融合生殖的小穗的表达1由Q4188 × Q4117杂交获得。所有基因型显示pntgs1样表达水平与相应的有性和无融合生殖祖细胞相似(图2B)。
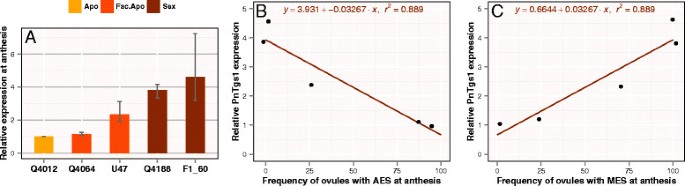
接下来我们验证了pntgs1样表达水平与先前记录的兼性无融合生殖率相关柑橘植物Notatum..为此,我们使用了几种已被Quarin等人报道过的apospore /sex表达比率的基因型[9, Stein等人[12, Espinoza等[32)(表2).有趣的是pntgs1样与所测试的基因型的性欲程度(图增加3.一种)。此外,我们检测到阳性相关性pntgs1样胚珠携带MESs (R2= 0.889);相反,表达水平与卵巢携带AESs的百分比呈负相关(R2=(图0.889)3.B和C)。
的相关性pntgs1样花期表现为生殖行为。(一)根据携带减数分裂胚囊和离孢子胚囊的胚珠的百分比(MES和AES),有性、兼性和完全无融合植物的相对数量表达如表所示2.PnTgs1表达量与胚珠携带AESs的百分比呈负相关(B)与混乱相比(C).B和C显示了由线性回归得到的拟合值的图LM.R程序的命令。误差线指示的qPCR重复范围
最后,我们发现了类似的情况pntgs1样有性和无融合生殖植物营养组织(叶和根)的表达水平(附加文件)1).PnTgs1在较低的水平下可检测到表达,但从花组织中测量的那些没有显着差异。这些结果表明,该基因可能在非金属和性植物的非生殖组织中对非生殖组织进行共同作用,但在与生殖模式相关的花组织中显示特定功能。
在PnTgs1状表达的原位定位
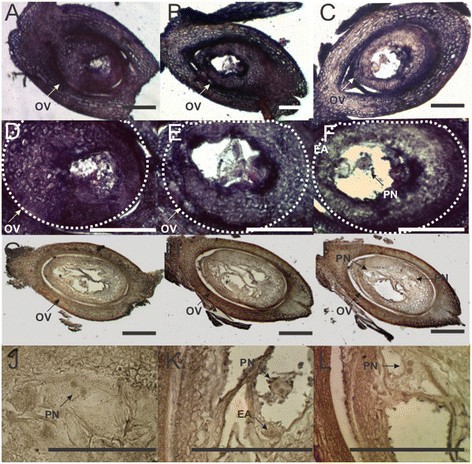
使用原位mRNA杂交,我们调查了pntgs1样表达柑橘植物Notatum.小穗在两个发育阶段取样,这两个发育阶段对离体、减数分裂前/减数分裂后期和开花的成功至关重要,分别伴随离体初始分化和胚胎孤雌生殖。
在减数分裂前后期,在性基因型的珠心细胞和花药绒毡层中观察到强烈的信号。在无融合基因型中检测到类似位置的较弱信号(图)4).在开孔处观察到相同的表达趋势:Nucellar和整数组织均在性基因型中显示出强烈信号。另一方面,在APOMICTIC基因型中几乎没有信号(图5).
这些结果表明pntgs1样在珠心中活跃的性吗柑橘植物Notatum.植物从早期发育阶段到成熟,而无融合基因型的表达在生殖发育过程中强烈减少。
讨论
N69 cDNA片段在筛选过程中被初步恢复,以鉴定有性生殖和无融合生殖小穗之间的转录差异柑橘植物Notatum.植物 [23].随后的序列分析显示,该片段属于一个编码PIMT(与甲基转移酶域prip相互作用蛋白)/TGS1的基因,TGS1是一个参与sn(o)RNA生物发生、mRNA剪接和PPAR(过氧化物酶体增殖物激活受体)共激活调控基因表达的甲基转移酶(综述于[33])。
pit /TGS1,首次作为prip相互作用的转录共激活蛋白分离酿酒酵母[34],已被广泛研究在酵母,果蝇和哺乳动物(综述[33),但在植物中仍然缺乏特征。有趣的是,所有真核生物都有一个tgs1复制——除了植物基因组,它们通常至少携带两个拷贝。PIMT/TGS1通常包含一个甲基转移酶结构域和两个结合结构域;这种结构允许与RNA和s -腺苷- l-蛋氨酸相互作用,s -腺苷- l-蛋氨酸是甲基转移反应中的甲基供体[34].转录后的7-甲基胍胶囊的转化转化(m7G)为2,2,7- trimethylguanosine(米3.G)由PIMT/TGS1催化,在sn(o) rna和端粒酶rna的生物发生中起中心作用[30.],[35].此外,PIMT / TGS1是枢轴在若干上下文转录调制。它具有和共定位相互作用以细胞核组蛋白乙酰转移酶(HAT)沿着含转录辅激活物如CBP / EP300和非含-HAT-共激活剂如中保亚基MED1(PPAR结合蛋白; PBP / TRAP220 / DRIP205)和PRIP [34],[36],[37].pit被认为是HAT和非HAT转录复合物之间的分子桥梁,并控制核受体介导的转录。此外,ERK2在丝氨酸位点的磷酸化298在一些启动子上激活转录活性,提示信号转导通路在调节转录中起直接作用[38].
PIMT / TGS1功能的取消导致宽范围的不同的真核非植物模型系统表型缺陷。在S. Cerevisiae.,这些改变包括冷敏感剪接缺陷、低温下生长迟缓、核仁结构组织丧失、rrna前处理缺陷和关键调控因子异常剪接后减数分裂失败[29],[31],[35].在哺乳动物中,PIMT/TGS1功能的丧失导致细胞周期进程的改变、胚胎致死率和肝脏糖异生增加[38] - [40].在果蝇,有报道在蛹早期的胚胎致死率[41.].
有趣的是,植物有性生殖和无融合生殖的转录组比较分析,包括柑橘植物Notatum.在真核生物中,已经提供了一套丰富的与PIMT/TGS1功能密切相关的本体论家族调控基因。一组主要由核糖体rna和核糖体蛋白质基因组成[22],[23],[27],观察与PIMT / TGS1在两个核仁组织中的作用是一致的和预rRNA的加工[29].在有性植物和无融合植物中差异表达的其他tgs1相关功能类包括蛋白酶体相关蛋白、细胞骨架蛋白和ERK2级联成员基因[22],[23],[27].在非植物物种中收集的关于TGS1功能的数据中,我们观察到TGS1的表达减少pntgs1样这表明,从性向无孢子发育的转变可能取决于与erk2介导的转录调控相结合的剪接机制的改变。在营养组织中未观察到这种差异表达。是否减少pntgs1样表达是无融合生殖的原因,哪些机制是生殖组织中表达差异的原因还需要进一步的研究,包括三甲基鸟苷合酶活性分析、RNA甲基化分析和模式植物物种的突变分析。
比较转录分析和突变体特征显示,无融合生殖发育可能是在有性植物的生殖组织或细胞的普遍转录动态发生改变后出现的[42.].特别是,女性生殖组织或细胞的表达模式在发育过程中受到特定rna依赖的DNA甲基化途径的调节,有趣的是,一些参与这些途径的染色质重塑酶在玉米中下调Tripsacum单性生殖的混合动力车;它们在玉米中的功能丧失导致转录活性的深刻重塑和发育的异时性,部分模拟无融合生殖的发育[43.],[44.].定义这些沉默途径所针对的序列的性质对于解决两个问题至关重要:从性行为从性行为繁殖的透氧繁殖演变中的精确鉴定,以及负责其年代学和空间抑制的机制阐明。关于后一种问题,我们认为TGS1在RNA生物学和转录模式规则中的功能为涉及改变RNA处理的有吸引力模型的基础,以解释关键调节器的功能协调损失。
方法
植物材料
以下四倍体(2n=4x= 40)柑橘植物Notatum.基因型在本研究中使用:1)完全无融合生殖基因型Q4117和Q4012 [32],[46.];ii)兼性无融合生殖基因型Q4064和U47 [32];III)完全性基因型C4-4x和Q4188 [8],[9];(4)三个完全有性的(#43,#60,#93)和三个完全无融合的(#40,#65,#74)1Q4188 × Q4117杂交后代[12],[13].这柑橘植物Notatum.基因型取自IBONE活种质(Instituto de Botánica del Nordeste, IBONE- conicet, Argentina)。
互补脱氧核糖核酸测序
竞赛实验(47.根据制造商的说明,对两个cDNA Marathon文库(Clontech, Mountain View, California, USA)进行了研究,该文库取自减数分裂前/减数分裂后期(Laspina等人的发育阶段I/II)的颖花中提取的Q4117和Q4188 mRNA样本。[23])。引物设计与底漆3加号(http://www.bioinformatics.nl/cgi-bin/primer3plus/primer3plus.cgi/) [48.].使用DNA进行PCR扩增引擎珀尔帖热循环(Bio-Rad,赫拉克勒斯,加州,美国)25 -μl反应包含tricine缓冲区(tricine 0.01米和0.1毫米EDTA)补充1μl的摘要马拉松图书馆稀释,0.2μM的每个特定底漆,0.2μM AP1底漆(匹配马拉松适配器AP1),1× Taq-LOADTM母料(MP Biomedicals), 1.5 UTaq聚合酶(Promega, Madison, Wisconsin, USA), 1.5 mM氯化镁2,以及200pm dntp。扩增产物在1.5% (w/v)琼脂糖凝胶上电泳,1% (v/v)溴化乙啶染色。用QIAquick凝胶提取试剂盒(Qiagen, Valencia, California, USA)纯化感兴趣的片段,克隆到p-GEM-T Easy载体(Promega)中,通过热休克转移到大肠杆菌DH5α TOPO活性链(Invitrogen/Life Technologies, Carlsbad, California, USA)。质粒用QIAprep Spin Miniprep试剂盒(Qiagen)纯化,扩增出的RACE片段送到Beckman Coulter Genomics (London, UK)测序。
对于焦点,Q4117(APOMicic)和C4-4X(性)总RNA样品被从收集在预热,减数分裂,产水病和开花间收集的平衡小块的尖峰中提取。mRNA的富集,文库制备,乳液PCR,454基因组测序仪FLX +(罗氏,彭茨贝格,德国)测序和生物信息学分析通过INDEAR(研究所德Agrobiotecnología德罗萨里奥,阿根廷Rosario)进行。
序列分析
RACE片段序列在NCBI (www.ncbi.nlm.nih.gov),并且使用Sequencher 4.1.4(基因代码公司)消除引物序列。这pntgs1样然后从RACE扩展的N69序列和Roche 454转录本在Sequencher中组装contig。利用NCBI (www.ncbi.nlm.nih.gov)及Gramene数据库(http://ensembl.gramene.org/genome_browser/index.html).使用Clustal Omega在EBI-EMBL网站(http://www.ebi.ac.uk/Tools/msa/clustalo/).开放阅读框用ORF finder (http://www.ncbi.nlm.nih.gov/gorf/),使用ExPASy翻译工具进行翻译(http://web.expasy.org/translate/).
定量实时聚合酶链反应
利用SV总RNA分离试剂盒(Promega)从多个发育阶段(减数分裂前、减数分裂后和开花)收集的小穗中提取总RNA。使用Superscript II逆转录酶(Invitrogen/Life Technologies)从1 μg总RNA中合成cdna。最终反应体积为25 μl,包含200 nM基因特异性引物(N69F1和N69R1;表格1), 1× qPCR Real Mix (Biodynamics, Buenos Aires, Argentina), 20ng cDNA。在Rotor-Gene Q热循环仪(Qiagen)中进行扩增,程序如下:94°C下2分钟,94°C下15秒,55°C下30秒,72°C下40秒,45个循环。在循环周期结束时产生了熔化曲线(从72°C到95°C的10秒循环,每循环温度升高0.2°C)。对从两个生物复制中获得的3个重复的cdna进行实时定量pcr。将β-微管蛋白作为内参基因进行归一化处理,因为在之前的研究中,该基因在具有相同倍性水平的有性植物和无融合植物的花中表现稳定Poa pratensis和柑橘植物Notatum.[22],[49.],[50.].使用REST-RG软件(Corbett Life Sciences)计算相对表达水平。
原位杂交实验
有性生殖小穗(Q4188)和无融合生殖小穗(Q4117)柑橘植物Notatum.收集基因型,固定在4%多聚甲醛/0.25%戊二醛/0.01 M磷酸盐缓冲液(pH 7.2)中,乙醇/二甲苯系列脱水,石蜡包埋。将标本切成10 μm薄片,置于100 μg ml处理的载玻片上−1poly-L-lysine。用二甲苯/乙醇系列去除石蜡。使用含有N69 5’RACE克隆的质粒,产生了意义(T7)和反义(SP6) RNA探针。探针用罗氏DIG RNA标记试剂盒(SP6/T7)标记,水解成150 - 200 bp的片段。在含有1 μg ml的0.05 M Tris-HCl缓冲液(pH 7.5)中37°C预杂交10分钟−1蛋白酶K,在37℃下杂交过夜,缓冲液中包含10 mM Tris-HCl (pH 7.5), 300 mM NaCl, 50%去离子甲酰胺,1 mM EDTA (pH 8), 1× Denhardt 's溶液,10%硫酸右旋糖酐,600 ng ml−1总RNA和相应探针的60 ng。采用Roche DIG检测试剂盒说明书,以anti-DIG AP和NBT/BCIP为底物进行检测。
可获得的支持数据
该数据集支持该研究的结果被包括在手稿和它的附加文件(S)内。
额外的文件
参考文献
- 1.
Nogler GA:配子体无融合生殖。被子植物胚胎学。编辑:Johri BM。1984,施普林格,柏林,475-518。10.1007 / 978 - 3 - 642 - 69302 - 1 - _10。
- 2.
Crane CF:无融合生殖机制的分类。无融合生殖开花:从机制到基因工程。编辑:Savidan Y, Carman JG, Dresselhaus T. 2001, CIMMYT, IRD,欧洲委员会DG VI (FAIR),墨西哥城,24-43。
- 3.
无融合生殖:发育特征和遗传学。植物科学进展,2006,25:199-214。10.1080 / 07352680600563926。
- 4.
Linnaeus C: Systema Naturae. 1758,大口,Impensis直接。Laurentii Salvii (Salvius出版社),斯德哥尔摩,10岁
- 5。
Ortiz JPA, Quarin CL, Pessino SC, Acuña C, Martínez EJ, Espinoza F, Hojsgaard DH, Sartor ME, Caceres ME, Pupilli F:利用草类的无融合生殖:我们从中学到了什么雀稗.Ann Bot伦敦,2013,112:767-787。10.1093 / aob / mct152。
- 6。
无融合生殖的性质及其在菊科禾草中的起源。无融合生殖通讯,1992,5:8-15。
- 7。
Martínez EJ, Urbani MH, Quarin CL, Ortiz JPA:百喜草胞外孢子的遗传,柑橘植物Notatum..遗传。2001,135:19-25。10.1111 / j.1601-5223.2001.00019.x。
- 8.
Quarin Cl,Espinoza F,Martínezej,Pessino Sc,Bovo OA:倍增性水平的兴起会诱导Apomixis的表达柑橘植物Notatum..性植物团体。2001,13:243-249。10.1007 / S004970100070。
- 9.
quin CL, Urbani MH, Blount AR, Martinez EJ, Hack CM, Burton GW, Quesenberry KH:百夏草有性四倍体种质Q4188和Q4205的登记。作物科学,2003,43:745-746。10.2135 / cropsci2003.0745。
- 10.
Martínez:四倍体离体孢子的遗传特性柑橘植物Notatum.基于连锁分子标记的鉴定。摩尔品种。2003,12:312-327。10.1023 / B: MOLB.0000006868.12568.32。
- 11.
Pupilli F, Martínez EJ, Busti A, Calderini O, Quarin CL, Arcioni S:比较映射揭示了在无融合生殖位点上的共同性部分保守雀稗SPP。Mol Genet基因组。2004,270:539-548。10.1007 / s00438-003-0949-5。
- 12.
Stein J,Quarin Cl,Martínezej,Pessino sc,Ortiz JPA:四倍体比赛柑橘植物Notatum.在离体控制位点周围显示多体遗传和优先染色体配对。中国科学(d辑):地球科学(英文版)。10.1007 / s00122 - 004 - 1614 - z。
- 13.
Stein J, Pessino SC, Martínez EJ, Rodríguez MP, Siena LA, Quarin CL, Ortiz JPA:四倍体的遗传图谱柑橘植物Notatum.Flügge(百喜草)基于单剂量分子标记。昆虫学报。2007,20:153-166。10.1007 / s11032 - 007 - 9083 - 0。
- 14.
Podio M, Rodriguez MP, Felitti S, Stein J, Martinez E, Siena LA, Quarin CL, Pessino SC, Ortiz JPA: Sequence characterization, in silicon mapping and cytosine methylation analysis of markers linked to apospory in柑橘植物Notatum..中国生物医学工程学报。2012,35(6):827-837。10.1590 / s1415 - 47572012005000070。
- 15.
acta botanica sinica(云南植物研究中心);acta botanica sinica(云南植物研究中心)柑橘植物Notatum.(禾本科)。植物生态学报。2012,29(6):691 - 698。10.1007 / s00606 - 012 - 0664 - y。
- 16。
Jia G, Fu Y, He C:可逆RNA腺苷甲基化在生物调控中的作用。趋势学报,2012,29:108-115。10.1016 / j.tig.2012.11.003。
- 17。
Zhong S, Li H, Bodi Z, Button J, Vespa L, Herzog M, Fray RG: MTA是一个拟南芥信使RNA腺苷甲基化酶,并与性别特异性剪接因子的同源物相互作用。acta botanica sinica(云南植物学报),2008,29(6):643 - 648。10.1105 / tpc.108.058883。
- 18.
rna结合蛋白的保守结构和功能多样性。中国科学:地球科学。10.1126 / science.8036511。
- 19.
Lorkovic ZJ,Barta A:基因组分析:RNA识别基序(RRM)和K同源性来自开花植物的蛋白质植物蛋白拟南芥蒂利亚纳.核酸学报2002,30:623-635。10.1093 / nar / 30.3.623。
- 20.
玉米RIK基因的表达与核苷酸多样性研究。王志强。10.1093 / jhered / esn013。
- 21.
Rodrigues JC, Cabral GB, Dusi DMA, Mello LV, Rinden D, Carneiro VTC:中国无性生殖和无融合生殖植物子房差异表达cDNA序列的鉴定Brachiaria brizantha..植物生态学报。2003,29(6):759 - 762。10.1023 / B: PLAN.0000023664.21910.bd。
- 22.
阿尔贝蒂尼E,马可尼G,巴尔卡恰G,RAGGI L,Falcinelli的L:在无融合生殖的候选基因的分离Poa pratensis.植物mol biol。2004年,56:879-894。10.1007 / s11103-004-5211-γ。
- 23.
Laspina NV, Vega T, Martelotto L, Stein J, Podio M, Ortiz JP, Echenique V, Quarin C, Pessino SC:未成熟花序无孢子无融合生殖开始时的基因表达分析柑橘植物Notatum..植物生态学报。2008,32(6):691 - 698。10.1007 / s11103 - 008 - 9341 - 5。
- 24.
山田秋山H,秋山Y,海老名男,徐Q,鹤田S,矢崎Ĵ,岸本齐N,菊池S,高原男,Takamizo T,杉田S,中川H:无融合生殖羊草表达序列标签的分析(Panicum最大值).植物营养与肥料学报。2009,29(6):741 - 746。10.1016 / j.jplph.2008.10.001。
- 25.
Sharbel TF,Voigt ML,Corral JM,Galla G,Kumlehn J,Klukas C,SchreiBer F,Vogel H,转子B:Apomictic和性卵形Boechera显示异源慢性整体基因表达模式。acta botanica sinica(云南植物研究),2010,22(6):655-671。10.1105 / tpc.109.072223。
- 26.
Polegri L,Calderini O,Arcioni S,PhiLioni F:性能和曝光的比较转录组分析揭示的Apomix-Linked等位基因的特异性表达雀稗单纯形莫荣花。实验植物学。2010,61:1869年至1883年。10.1093 / JXB / erq054。
- 27。
Okada T, Hu Y, Tucker MR, Taylor JM, Johnson SD, Spriggs A, Tsuchiya T, Oelkers K, Rodrigues JCM, Koltunow AMG:扩大细胞启动无融合生殖Hieracium praealtum在进入有丝分裂之前向胚囊程序的转变。植物营养与肥料学报。2013,29(3):429 - 434。10.1104 / pp.113.219485。
- 28。
acta botanica yunnanica(云南植物研究中心);acta botanica yunnanica(云南植物研究中心)柑橘植物Notatum..遗传。2001,134:35-42。10.1111 / j.1601-5223.2001.00035.x。
- 29。
Colau G, Thiry M, Leduc V, Bordonné R, Lafontaine DLJ:小核(ol)ar RNA帽三甲基转移酶是核糖体合成和完整核仁形态所必需的。中国生物医学工程学报。2004,24(4):593 - 598。10.1128 / mcb.24.18.7976 - 7986.2004。
- 30.
作者:Franke J, Gehlen J, Ehrenhofer-Murray AE:酵母端粒酶RNA通过snRNA和snoRNA甲基转移酶Tgs1的高甲基化。中国生物医学工程学报。2008,31(4):593 - 598。10.1242 / jcs.033308。
- 31。
邱志荣,舒曼,许华:三甲基鸟苷RNA帽在细胞内的重要作用酿酒酵母减数分裂及其对剪接的要求SAE3和PCH2减数分裂pre-mRNAs。中国生物医学工程学报,2011,39(4):533 - 536。10.1093 / nar / gkr083。
- 32.
埃斯皮诺萨楼Daurelio LD,Pessino SC,Quarin CL,山谷EM:遗传特征柑橘植物Notatum.通过AFLP标记进行鉴定。植物生态学报,2006,27(6):723 - 732。10.1007 / s00606 - 005 - 0401 - x。
- 33.
Xu J, Xu J, Xu J, Xu J: co - activators in PPAR-regulated gene expression.西北农林科技大学学报(自然科学版)。PPAR研究》2010。
- 34.
Zhu Y, Qi C, Cao WQ, Yeldandi AV, Rao MS, Reddy JK:一种与核受体辅激活因子PRIP相互作用并增强其功能的甲基转移酶结构域蛋白的克隆与鉴定。中国科学(d辑:地球科学),2001,21(4):531 - 534。10.1073 / pnas.181347498。
- 35.
MouaikelĴ,Verheggen C,贝特朗E,塔齐Ĵ,BordonnéR:既酵母snRNAs和snoRNAs的盖结构的甲基化需要定位于核仁的保守甲基转移酶。Mol细胞。2002年,9:891-901。10.1016 / S1097-2765(02)00484-7。
- 36.
米斯拉P,齐C,宇S,SH国王,曹WQ,Sambasiva饶呒,Thimmapaya B,朱Y,雷迪JK:PIMT的转录调控的相互作用与转录共激活因子CBP,P300,以及PBP差的作用。J Biol Chem。2002年,277:20011-20019。10.1074 / jbc.M201739200。
- 37.
科恩伯格:真核生物转录的分子基础。中国科学(d辑:地球科学),2007,34(4):591 - 598。10.1073 / pnas.0704138104。
- 38.
Kapadia B, Viswakarma N, Parsa KVL, Kain V, Behera S, Suraj SK, Babu PP, Kar A, Panda S, Zhu Y, Jia Y, thimapaya B, Reddy JK, Misra P: erk2介导的转录共激活因子结合蛋白PIMT/NcoA6IP在Ser位点的磷酸化298增强肝脏糖质新生。公共科学图书馆。2013,8:e83787-10.1371/journal. pon. 0083787。
- 39。
Enünlü I, Pápai G, Cserpán I, Udvardy A, Jeang K, Borors I:与甲基转移酶结构域/三甲基鸟苷合酶相互作用的不同亚型蛋白定位于细胞质和细胞核。生物化学学报。2003,31(4):451 - 457。10.1016 / s0006 - 291 x(03) 01514 - 6。
- 40.
Jia Y, Viswakarma N, Crawford SE, Sarkar J, Sambasiva Rao M, Karpus WJ, Kanwar YS, Zhu YJ, Reddy JK:转录辅助因子PIMT/NCOA6IP/Tgs1基因中断小鼠的早期胚胎致死率。机械开发,2012,129:193-207。10.1016 / j.mod.2012.08.002。
- 41。
Komonyi O, Pápai G, Enünlü I, Muratoglu S, Pankotai T, Kopitova D, Maróy P, Udvardy A, Boros I: DTL, the果蝇pit /Tgs1核受体共激活因子相互作用蛋白/RNA甲基转移酶的同源物,在发育中具有重要作用。中国生物医学工程学报。2005,28(3):497 - 498。10.1074 / jbc.M409251200。
- 42。
被子植物生殖发育和无融合生殖出现的表观遗传调控。植物生态学报。2012,15:57-62。10.1016 / j.pbi.2011.10.002。
- 43。
玉米生殖器官DNA甲基化途径失活导致无融合生殖表型。acta botanica sinica(云南植物研究),2010,22(4):369 - 372。10.1105 / tpc.109.072181。
- 44.
Singh, Goel S, Meeley RB, Dantec C, Parrinello H, Michaud C, Leblanc O, Grimanelli D:缺乏ARGONAUTE蛋白的玉米无减数分裂可育配子的产生。acta botanica sinica, 2017, 36(4): 457 - 462。10.1105 / tpc.110.079020。
- 45.
曼奇尼男,Woitovich N,Permingeat H,波迪奥男,锡耶纳LA,奥尔蒂斯JPA,Pessino SC,Felitti SA:一个修改后的转换平台的开发与无融合生殖候选基因研究柑橘植物Notatum.(巴哈)。体外细胞发育生物学植物。2014年。
- 46.
Ortiz JP, Pessino SC, Leblanc O, Hayward MD, Quarin CL:用于确定生殖模式的遗传指纹柑橘植物Notatum.,亚热带无融合生殖饲草。中国科学(d辑):地球科学(英文版)。10.1007 / s001220050635。
- 47.
Chenchik A,Diachenko L,Moqadam楼Tarabykin V,卢科亚诺夫S,西伯特PD:全长cDNA克隆和测定mRNA的5'和3'通过接头连接的cDNA的扩增结束。生物技术。1996年,21:526-534。
- 48.
JAM: Primer3Plus,一个增强的Primer3 web界面。核酸学报2007,35(6):741 - 743。10.1093 / nar / gkm306。
- 49.
Podio M, Felitti SA, Siena LA, Delgado L, Mancini M, Seijo G, González AM, Pessino SC, Ortiz JPA:表征和表达分析体细胞胚胎发生受体激酶(SERK)基因的有性和无融合生殖柑橘植物Notatum..植物mol biol。2014年,84:479-495。10.1007 / s11103-013-0146-9。
- 50.
Felitti SA, Seijo JG, González AM, Podio M, Laspina NV, Siena L, Ortiz JPA, Pessino SC:表达罗蕾莱类基因在无孢子和有性中柑橘植物Notatum.植物。植物生态学报。2011,32(4):489 - 494。10.1007 / s11103 - 011 - 9814 - 9。
致谢
这项工作得到了协作Ecos-Mincyt France-Argentina计划(项目A11B02)的支持;Agencia Nacional dePromociónCientíficaYTecnológica,阿根廷(项目PICT 2011-1269);NationaldAcional de Rosario,阿根廷(Project Agr189)和Consejo Nacional deInvestigacionesCientíficasYTécnicas(Conicet),阿根廷(Project Pip 11220090100613)。作者L. Siena,J.P.A. Ortiz和S. Pessino是Conicet的研究人员。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
提交人声明他们没有竞争利益。
作者的贡献
LAS进行RACE实验,原位杂交实验,参与花序采集,样品制备,细胞胚胎学分类,实时荧光定量PCR检测。JPAO参与了花序的采集、样品制备、序列分析,并帮助起草了手稿。CM参与了样品制备、测序和克隆实验。OL构思了这项研究,帮助收集了花序,参与了实验设计和协调,并帮助起草了手稿。SP构思了研究,进行了real-time PCR检测,参与了实验设计,并起草了手稿。所有作者阅读并批准了最终的手稿。
电子辅料
12870 _2014_297_moesm1_esm.pdf
附件1:图S1:实时PCR分析PnTgs1表达在叶和根。数据描述:在叶和根中都有表达,但在无融合生殖和有性基因型之间没有显著差异。相反,在花中有差异表达。误差棒表示qPCR的重复范围。(PDF 445 KB)
作者的原始提交的图像文件
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。
本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。
如欲查阅本许可证副本,请浏览https://creativecommons.org/licenses/by/4.0/.
创作共用及公共领域专用豁免书(https://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
锡耶纳,洛杉矶,奥尔蒂斯,j.p.a.,勒布朗,O。et al。pntgs1样生殖发育过程中的表达支持RNA甲基转移酶在胞外途径中的作用。BMC植物BIOL.14,297(2014)。https://doi.org/10.1186/s12870-014-0297-0
已收到:
接受:
发表:
关键字
- 无融合生殖
- 阿姆斯科弗
- 基因表达
- p
- RNA加工
- Trimethylguanosine合酶