抽象的
背景
双子病毒AC2是一种多功能蛋白,作为致病因子发挥作用。AC2的转录调控似乎是通过与植物特异性DNA结合蛋白PEAPOD2(PPD2)的相互作用介导的,该蛋白特异性结合已知的序列,以介导基因的激活人物配对关系启动子的卷心菜曲叶病毒(CaLCuV)和番茄金色马赛克病毒(TGMV)。AC2抑制植物的基础和先天免疫反应是通过拟南芥SNF1相关蛋白激酶SnRK1.2和腺苷激酶(ADK)的失活介导的。一种间接启动子靶向策略,通过ac2 -宿主dsDNA结合蛋白的相互作用,以及snrk1.2介导的防御反应的失活,可以为双生病毒改变宿主基因表达提供机会,从而重编程宿主以支持病毒感染。本研究的目的是鉴定AC2的转录激活功能和SnRK1.2的失活诱导拟南芥转录组的变化。
结果
使用全长和截断的AC2蛋白质,微阵列分析鉴定了834个基因,差异表达鉴于治疗后一天和两天的AC2蛋白的转录调节功能差异表达。我们还鉴定了499个基因,差异表达响应于治疗后一及两天的AC2蛋白在AC2蛋白的SNRK1.2灭活。这两组差异调节基因的网络分析鉴定了由四到八个高度连接基因组成的几个网络。定量实时PCR分析验证了在测试的11个基因中的10个中的微阵列表达结果。
结论
越来越明显的是,双生病毒通过几种方式操纵宿主,以促进有利于感染的环境,主要是通过使用多功能蛋白质。我们识别高度连接的基因网络的方法,可能是在感染期间由双生病毒共同调控的,这将使我们能够识别共同调控基因的新途径,这些基因在一般情况下对病原体感染,特别是病毒感染的反应中受到刺激。
背景
这个Geminiviridae科由一组大而多样的病毒组成,它们感染范围广泛的重要的单子叶和双子叶作物,并造成重大的产量损失[1.]、[2.].病毒发病机制取决于病毒,宿主和昆虫载体之间的一系列相互作用。由于少量病毒蛋白由GeminiviRuses编码,它们在很大程度上依赖于宿主的复制和转录机制。这种宿主依赖的一种结果是,本inIniviruses是用于提供对植物和动物DNA复制和转录的控制的有用模型。
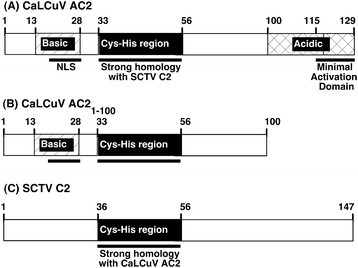
双生病毒的环状单链DNA (ssDNA)基因组在受感染细胞的细胞核中通过滚动圆(RCR)和利用细胞DNA聚合酶进行重组依赖(RDR)复制而扩增[3.]、[4.].由此产生的双链DNA复制形式(RF)被用作宿主RNA聚合酶II生成病毒转录本的模板。双生病毒产生小的多功能蛋白质以补偿有限的编码能力。例如,细菌病毒包括卷叶菜(CaLCuV)和番茄金色马赛克(TGMV)病毒,致病性蛋白AC2的编码(图1.A)调节新陈代谢的物质[5.]、[6.],调节转录[7.]、[8.和抑制RNA沉默[9] - [11].
AC2(也称为AL2和TrAP)是外壳蛋白表达所必需的(人物配对关系)并且两个CaLCuV和TGMV [BR1的运动蛋白基因12] - [15].研究表明,AC2具有诱导作用人物配对关系通过两种不同的和独立的机制表达。在叶肉细胞中,AC2激活人物配对关系启动子,但在血管组织中AC2作用于去抑制启动子[7.]、[12].不同的序列介导AC2的激活和去抑制。激活所需的序列位于共同区域的上游人物配对关系转录起始点[8.]、[12],而抑制所需的序列位于CP转录起始位点上游1.2 - 1.5 kbp [7.]、[12].在begomovirus中,AC2的转录功能不是病毒特异性的,因为CaLCuV或TGMV AC2蛋白都能转激活TGMV外壳蛋白(人物配对关系)启动子[12]、[16].
AC2似乎不是一个典型的转录因子,因为它不能有效地结合dsDNA,而且似乎是通过与细胞因子的蛋白-蛋白相互作用靶向响应启动子。最近的一项研究发现了一种植物特有的DNA结合蛋白,PEAPOD2 (PPD2),它能特异性地结合已知的序列,介导细胞的激活人物配对关系CaLCuV和TGMV在叶肉细胞中的启动子[17].如果AC2通过蛋白质:蛋白质相互作用靶向响应性启动子,我们将预测这些相互作用又导致激活对发病机制重要的宿主基因。通过AC2-宿主DSDNA结合蛋白质相互作用的间接启动子靶向策略可能为Geminiviruss改变宿主基因表达并反过来重新编程宿主以支持病毒感染。一个找到支持这个想法的一个发现是AC2可以反式激活人物配对关系启动子 - 报告转基因整合入细胞染色体[7.]、[12],表示AC2可以访问宿主染色体。
AC2的转录功能依赖于c端29个氨基酸[18,它包含一个酸性激活域(图1.A). AC2也表现出转录独立的功能,包括通过缺乏激活域的序列与参与RNA沉默抑制和代谢调节的不同细胞蛋白相互作用(图)1.b)。饼干的L2 / C2同源物(图1.C),包括甜菜曲顶(质疑)和菠菜卷前(SCTV)病毒,与CaLCuV AC2具有有限的序列同源性,并且缺乏任何转录激活域的外观[19].尽管同源性有限,但curtovirus C2蛋白确实抑制RNA沉默并调节代谢,但不调节转录[16].TGMV AC2、BCTV C2和SCTV C2蛋白已被证实与SnRK1.2相互作用;一种拟南芥SNF1相关蛋白激酶(AKIN11) [5.]、[19].这种相互作用的结果是抑制激酶活性。反义SnRK1.2转基因的表达烟草benthamiana植物对感染的敏感性增加[5.].SnRK1蛋白激酶在调节真菌体能量平衡中发挥重要作用,是蛋白激酶家族的保守成员[5.].
与此相关的是,AC2和C2 [6.]、[19]、[20]也与腺苷激酶(ADK)相互作用并灭活。腺苷激酶活性在病毒感染组织和表达AC2/C2的转基因植物中降低的证据[6.]、[20, adk缺乏的植物表现出沉默缺陷[21,支持AC2/C2、ADK的沉默抑制与甲基化之间的联系。最近的研究表明,双生病毒AC2/C2蛋白的沉默抑制活性是ADK失活的结果。结果表明,这些蛋白抑制转录基因沉默的能力是通过抑制ADK来实现的,这导致了甲基化的干扰[22].
ADK和SnRK1.2之间的联系是由已知SnRK1激酶在5'-AMP结合时被激活的证据提供的[23],和ADK磷酸化产生腺苷5'-AMP [6.].因此,AC2和C2可能与SnRK1.2和ADK互作并灭活,以防止snrk1介导的代谢(应激)反应,从而增强对双生病毒感染的抗性[5.].这强调了snrk1介导的宿主防御反应的重要性,但这些反应的抑制究竟如何导致宿主防御的抑制,特别是宿主基因表达的结果,尚未得到研究。双生病毒AC2在调控转录和抑制宿主防御机制中的复杂相互作用和功能,需要进一步研究在感染过程中响应双生病毒AC2蛋白的宿主基因。
对双子病毒感染引起的转录组全基因组变化进行了一些微阵列分析[24].然而,感染的非同步性质造成了确定对单个病毒基因产物作出反应的宿主基因的重大困难。为了克服这些困难,我们选择分析单个基因AC2的影响下基因表达的整体变化。之前的研究使用了绿豆黄花叶病毒和非洲木薯马赛克病毒AC2蛋白[25].在这些研究中,RNA图谱是在拟南芥原生质体中进行的,因此我们选择使用拟南芥全植物灌注分析[26].本研究的重点是鉴定病毒AC2蛋白的转录依赖功能以及AC2与SnRK1相互作用引起的宿主基因表达的变化。在这两种情况下,我们都发现宿主基因表达发生了大规模的变化。此外,计算分析确定了响应AC2两种功能的潜在调控网络。最后,我们验证了这些网络中点击率最高的响应。
结果和讨论
CaLCuV AC2、AC21-100、SCTV C2和asSnRK1.2在渗透拟南芥植株中的表达分析
对于这些实验,我们使用了全长和截断的版本AC2来自Calcu的基因,和全长C2从SCTV(图基因1.),因为这两种病毒都能在拟南芥中引起感染。SnRK1.2是一种内源性拟南芥基因,与AC2和C2相互作用,反义(as) SnRK1.2的表达增加了植物对感染的易感性[5.]我们检测了CaLCuV-AC2,AC2的表达1-100,SCTV C2、asSnRK1.2和空质粒载体对照(pMON530)三天,以确定能够检测到能够表达每个基因的RNA的时间。在注射后1至3天(dpi)用农杆菌属含有每个DNA的培养物。通过RT-PCR分析证实了每个构建体的转录,并使用特定探针得到对DNA凝胶印迹杂交分析进行的cDNA产物。在所有情况下,预测尺寸的特异性cDNA产物在一次输液后的样品中检测到样品中(数据未显示数据)。由于预期蛋白质和随后的宿主基因表达的变化将在这些时间点中可检测到,我们使用RNA分离了一个和两天DPI。另外,在这些时间点,在该时间点不观察到表型效应拟南芥植物。因此,这些时间点可能更能代表早期事件,而不是表型(如衰老)代表信号反应结束的晚期时间点。为了进行微阵列分析,拟南芥被真空渗透农杆菌属能够表达每一种结构,并结合病媒控制(pMON530)来消除由于农杆菌属感染。对于三个独立的植物,将总RNA分离出四个单独的植物,一个和两个DPI,用于与不同的构建体脱墨。这导致每次治疗三个独立样本。将来自样品的总RNA转化为CRNA,与拟南芥ATH1基因组阵列杂交,并行加工和扫描。使用Matlab BioInformatics工具箱中的鲁棒多阵列平均(RMA)程序预处理和标准化原始强度数据。使用具有0.05的P值为截止的双样本T检测检测实验样品和对照之间的差异表达基因。总体而言,测定的可变性在合理的范围内和预期。生物重复之间的平均皮脂相关系数(PCC)为0.971,载体对照之间的平均PCC略小,0.956。
CaLCuV AC2应答基因的差异表达
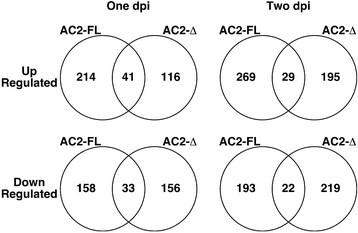
本研究的主要目标之一是鉴定鉴别差异表达的基因,响应AC2的剖视激活函数。为此,我们将表达全长AC2(FL)或截短的AC2(Del)的拟南芥叶中的转录组进行了比较,缺乏含有酸性活化结构域的C末端29氨基酸(AC21-100)在一个和两个dpi(附加文件1.:表S1和附加文件2.:表S2)。我们观察到214个基因在一个dpi处被AC2蛋白的全长特异性上调,在两个dpi处被AC2蛋白的全长特异性上调(图)2.).对于基因表达下调的是,共有158个基因特别是以两个dpi的回应全长AC2蛋白在一个dpi的,和193。由于这两种蛋白之间的差异的C-末端激活结构域的全长蛋白质的存在,我们得出结论,这些潜在的代表基因响应于AC2的转录功能差异调节的。
在过表达截短AC2蛋白的样本中,我们分别检测到116和195个基因在一个dpi和两个dpi特异上调。在AC2截断蛋白特异性下调的基因中,1 dpi检测到156个,2 dpi检测到219个。鉴于截短的AC2蛋白缺乏c端激活域,我们推断这些可能代表了AC2与细胞蛋白SnRK1.2和/或ADK已知相互作用的响应中差异调节的基因[5.]、[6.].当然,AC2蛋白中还有一些迄今未知的功能,可能导致基因表达的差异。
有趣的是,我们观察到41个和29个基因在拟南芥叶片中表达完整的AC2蛋白和截断的AC2蛋白,分别在一个dpi和两个dpi。此外,在表达AC2全长和截断蛋白的叶片中,分别有33和22个基因在1和2 dpi处表达下调(图)2.).考虑到AC2全长蛋白和截短蛋白都具有相同的功能,我们预计这些基因在与SnRK1.2和/或ADK的相互作用中会受到不同的调控。
为了进一步分析响应AC2转录功能的表达差异调控的基因,我们与感染CaLCuV的拟南芥的微阵列数据进行了比较[24].在我们的研究中,我们观察到一些基因也在CaLCuV感染期间被检测到(附加文件3.:表S3)。在全长AC2和calcuv感染在两个dpi上上调的基因中,有几个基因具有与RNA代谢相关的功能,包括一个DEA(D/H)盒RNA解螺旋酶(At3g58510)和Argonaute 2 (AGO2) (At1g31280)。有趣的是,AGO2,结合病毒sirna并调节先天免疫对抗病毒感染,在响应AC2时上调,而AC2抑制RNA沉默。我们还检测到一个RNA依赖的RNA聚合基因(RdRp) (At2g19930),该基因在RNA沉默信号的扩增中发挥作用,该基因在AC2和calcuv感染的一个dpi下均下调。因此,AC2有可能作为一种被植物识别的效应体,激活固有免疫反应,然后作用于克服RNA沉默。两组实验数据中共有的基因数量非常少,没有统计意义。然而,我们观察到两个数据集之间共享的基因数量在两个dpi时增加了3到4倍(附加文件3.:表S3)。两个实验数据集之间观察到的差异可能反映了每个实验使用的不同时间尺度。CaLCuV的分析研究是在感染后12天进行的,而本研究是在输注后1天和2天进行分析。此外,这项研究使用了农业渗透,AC2会在所有细胞类型中表达,相比之下,系统性感染中只有少数韧皮部细胞实际上含有病毒[24].尽管如此,观察到一些ac2应答基因在病毒感染过程中受到不同的调控,使我们更加确信我们正在分析与病毒感染相关的基因。
响应CaLCuV AC2转录功能的差异调控基因的功能分类
我们将分析重点放在了那些对全长AC2有特异性差异调节的基因上。这被解释为至少部分代表了那些对全长AC2蛋白转录激活域有差异调节的基因。为了通过生物学过程对这些基因进行分类,我们使用大卫生物信息学资源(http://david.abcc.ncifcrf.gov/summary.jsp).大多数氧化石墨烯生物过程类别都在显著基因中,但与拟南芥基因组整体相比,有几个类别显著富集。具体来说,第一天和第二天,DNA/RNA代谢、转录、应激反应、蛋白质代谢、信号转导、细胞组织和生物发生、运输和电子运输或能量途径等类别的基因富集(附加文件)4.:表S4和附加文件5.:表S5)。
响应全长AC2差异调节基因的网络分析
为了让我们更明确地关注AC2蛋白转录功能共同调控的基因,我们进行了网络分析。为此,我们将这些基因叠加到一个来自1000多个拟南芥Affymetrix微阵列实验的全基因组共表达网络中,如果两个基因在所有实验条件下的表达水平高度相关,那么它们就通过一条边缘连接起来(见方法)。我们之前的研究结果表明,基因之间的联系确实表明了功能关联,整个网络包含许多相对独立、紧密相连的子网络,这些子网络包含协同调控的功能基因模块[27]有趣的是,虽然大多数全长AC2特异性基因与其他AC2反应基因没有直接联系,表明AC2调节多种功能过程,但其中一小部分相互紧密联系,导致密集的子网络,可能代表由全长AC2转录功能调节的核心功能模块。
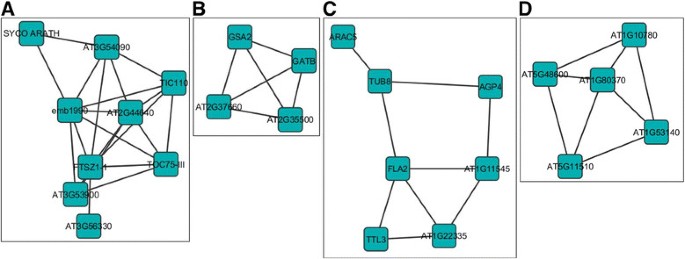
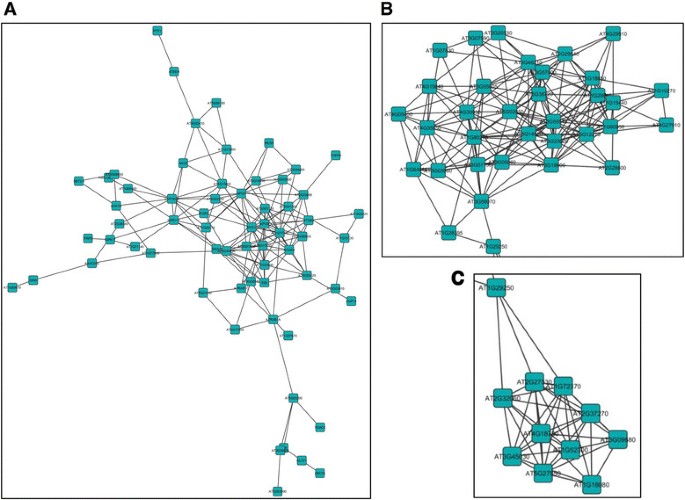
在一个dpi上,214个独特的基因对全长AC2的响应被上调,其中5个亚网络由4到8个高连接基因组成(附加文件)6.:图S1A)。在这些中,有趣的是要注意两个子网(附加文件6.:图S1A;I和V)含有与叶绿体相关的功能基因(图3.由于叶绿体含有水杨酸和茉莉酸生物合成途径的成分,从而引发对病毒和细菌病原体的防御反应,因此叶绿体转录组的改变可能对双生病毒感染感兴趣[28].例如,亚网络I中的两个高度连接的基因,在叶绿体75-III(TOC75-III(TIC75-III)的外壳膜的叶绿体110(TIC110)和摇滚膜的内包膜膜中的两个高度连接基因与蛋白质中涉及的复合物相关进口到叶绿体中。似乎有两个系统驱动蛋白质进口到叶绿体基质中,两者都利用热休克蛋白作为电动机[29].其中一个系统利用热休克同源蛋白70kda (cpHSC70-1)作为叶绿体转位子的一部分,用于一般进口,可能与双生病毒感染有关。最近研究表明,含cpsc70 -1的基质(质体的薄突起)在感染cpsc70 -1的植物中被诱导青麻花叶病毒(AbMV)[30].已知在病毒感染期间发生体积结构和分子生物发生的改变,并且与RNA病毒感染也相关[30].因此,考虑到cpHSC70-1和AbMV运动蛋白之间的相互作用,有人认为这可能对双生病毒的细胞内和细胞间运动很重要[30].值得注意的是,在响应病原体感染的植物中强烈诱导分子形成,并且叶绿体结构可能会在病原体识别后进行改变[31].
拟南芥基因组中响应全长CaLCuV AC2蛋白上调的基因亚网络该图响应于AC2的转录激活结构域,示出了可以在拟南芥中共调节的基因的子网络。子网i(一),V(B)第四,(C)在一个dpi上调高。子网IV中的高度连接基因(D)在2 dpi处上调。子网络是从网络分析中选择的(附加文件)6.:图S1)。
另一个子网络(附加文件6.:图S1A;IV),由编码与细胞壁和/或细胞骨架相关的蛋白质的基因组成(图)3.C).已经有大量关于细胞骨架和膜组分参与植物病毒运动的研究,许多病毒编码与细胞骨架相互作用的蛋白质[32].病毒利用宿主膜进行移动的可能性增加了,这是基于观察到的,有许多不同的病毒与膜相关复制[32].Geminiviruses包括豆矮花叶病毒,编码运动蛋白(MP),改变胞间连丝的大小排除限制,以促进病毒基因组向邻近细胞的运动[33].相比之下,南瓜曲叶病毒MP诱导er源性小管的形成,它介导病毒蛋白- dna复合物向邻近细胞的运输[34].虽然这些亚网络中的基因与病毒发病机制的关系目前尚不清楚,但我们有兴趣推测AC2可能诱导宿主基因,这些基因对病毒的细胞间和长距离移动非常重要。这将支持AC2在激活begomovirus中BR1核穿梭蛋白转录以促进病毒运动中的已知作用[14].
在269个基因中鉴定出的6个亚网络中,在两个dpi处对AC2全长蛋白的响应中上调(附加文件)6.:图S1B),一个可能特别感兴趣。子网IV中的高度连接基因(图3.d),均出现有相关的细胞周期功能。一个基因编码MYB结构域蛋白3R-4(At5g11510),其是一种转录因子正调节胞质分裂[35].然而,激活似乎需要蛋白c端结构域的磷酸化,因为未磷酸化的MYB3R4作为有丝分裂的抑制因子[36].事实上,似乎需要官能的MyB3R4蛋白来建立终循环,这是响应粉末状霉菌感染而诱导的36].这可能与双生病毒极其相关,特别是当CaLCuV感染期间倍性增加时[24],及玉米条纹病毒惹巴蛋白诱导核内复制[37].CaLCuV感染后细胞周期相关和核心细胞周期基因表达的改变提示特异性激活S期和抑制M期,可能是诱导内循环的机制[24].第二个基因,细胞周期蛋白A2;4(At1g80370)也因全长AC2而上调,在决定有丝分裂和内循环之间的平衡中发挥作用。然而,有人认为CYCA2水平的缺失或降低控制着内复制,并且CYCA2的表达是通过蛋白质,即多倍体1(ILP1)水平的增加来实现的[38]有趣的是,CaLCuV感染的叶片中ILP1水平升高,尽管没有检测到CYCA2基因表达的变化[24].相反,在表达BCTV L2的转基因拟南芥植物中检测到Cyca2的表达的增加[39].
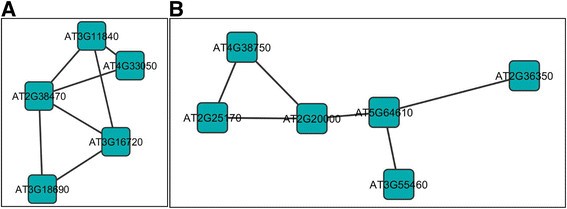
在一个dpi下,158个独特的基因对全长AC2的响应下调(附加文件)7.图S2A),其中5个高度连接在一个共同调控的基因网络中,所有5个似乎都参与了对病原体感染的防御反应(图S2A)4.A). MAP Kinase Substrate 1 (MKS1)是MAP Kinase 4 (MPK4)的底物,在拟南芥中调控病原体防御反应。MKS1的过表达似乎足以激活sa依赖的抗性,MKS1与WRKY转录因子相互作用,包括WRKY33在体外MPK4的底物[40].由于MKS1的不同区域与MPK4和WRKY相互作用,有人认为这些蛋白在转录或染色质重塑复合物中发挥作用,有助于MPK4调控的防御激活[40].MKS1和Wrky33的稳态mRNA水平由AC2下调的事实可以被解释为将SA依赖性对病毒感染的依赖性反应的策略。与MKS1和WRKY33相连的另外两种基因是E3泛素连接酶。Pub24是一种U字箱型E3泛素连接酶,其作用于对韧带触发的免疫(PTI)进行负面调节(PTI)[41].病原体感染导致pub24表达的增加,但表达的表达降低导致纸浆触发的下调响应的损害能力[41].at2是一种环- h2泛素e3连接酶,对几丁质等激发子有快速诱导作用,可能介导防御反应负调控因子的泛素化[42].因此,AC2下调该基因可以防止参与关闭防御反应的蛋白质的降解,从而防止宿主启动对感染的反应。有趣的是,该调控网络中的钙调素结合蛋白WRKY33、ATL2和胚囊发育阻滞39 (EDA39)也被诱导对壳聚糖的应答,壳聚糖是植物对病原体的防御反应的激发子[43].因此,它看起来好像基因的这个网络可能是双生病毒具有高价值的目标。
拟南芥基因组中因全长CaLCuV AC2蛋白而下调的基因亚网络。该图响应于AC2的转录激活结构域,示出了可以在拟南芥中共调节的基因的子网络。子网中的基因I(一)和子网络IV(B)分别在一个和两个DPI下调。从呈现的网络分析中选择子网络(附加文件7.:图S2)。
在两个dpi上,193个基因对全长AC2蛋白的响应下调,并检测到两个由高连接基因组成的亚网络(附加文件)7.:图开通)。子网络II(图4.B),有两个基因可能与双生子病毒的致病性有关。AC2全长表达下调细胞分裂素超敏感2 (CKH2;At2g25170),它编码PICKLE,一种类似于SWI/SNF染色质重塑因子CHD3类的蛋白质[44].该基因突变导致绿色愈伤组织快速生长,这归因于对细胞分裂素的超敏感,其中细胞分裂素应答基因对较低水平的细胞分裂素作出反应[44].CaLCuV AC2下调CKH2可能是一种诱导细胞分裂素应答以促进细胞增殖从而促进病毒复制的机制。数据表明,begomovirus AC2和curt virus C2的蛋白增加了细胞分裂素响应启动子的活性,外源细胞分裂素的应用增加了对双生子病毒感染的易感性,为这一结论提供了一些证据[26].
在这个亚网络中被AC2下调的第二个基因是Hobbit (HBT;At2g20000),它编码了后期促进复合物(APC)的CDC27/Nuc2/BimA/APC3亚基的同源物[45].HBT蛋白调节m期进展。HBT成绩单主要聚集周围的摹2./M期细胞分裂,突变HBT基因干扰不同细胞类型的胚后细胞分裂和分化[45]因此,该基因可能是双子病毒的一个有价值的靶点,因为下调可能会干扰细胞分化的进程,改变有利于细胞增殖的平衡,可能与下调CKH2促进细胞增殖相结合。
实时荧光定量PCR验证微阵列结果
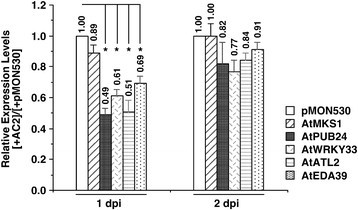
在这项分析中,我们专注于一个包含5个下调的与植物防御相关的基因的网络,发现它们在全长AC2表达后的一个dpi高度连接(图)4.一种)。尽管这五个基因差异只在微阵列分析一个DPI调节,总RNA,在一个和两个DPI从注入拟南芥的叶片都隔离农杆菌属含有能够表达全长AC2或载体控制的DNA。生成cDNA后,使用基因特异性引物进行实时定量PCR (qPCR)分析(附加文件)8.:表S6)来验证差异规则。如图所示(图5.), AtPUB24、AtWRKY33、AtATL2和AtEDA39的表达量均显著下调,与空白载体(pMON530)处理的叶片相比,AC2处理叶片的AtPUB24、AtWRKY33、AtATL2和AtEDA39的表达量下降了两倍。然而,在两个dpi时,四个基因的表达没有显著差异,尽管表达仍然低于用空载体处理的叶子样本(图)5.).这些结果与微阵列数据一致,其中这些基因在一个dpi时显著下调,而在两个dpi时则没有下调1.:表S1和附加文件2.:表S2)。有趣的是,在一次dpi时,AtMKS1的表达没有显著改变(图)5.)在用空载体处理的叶子的样品中与AC2注入的叶片的样品中(PMON530)。对此的原因不明确,但可能是两种方法之间的差异,包括但不限于利用巨大的正常化程序,探针设计和敏感性敏感性限制的不同策略与基于杂交的方法[46].
SCTV C2或asSnRK1.2对SnRK1失活反应的基因差异表达
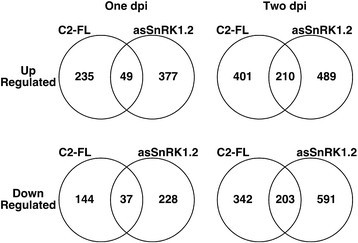
本研究的第二个目的是检验SCTV C2与SnRK1.2相互作用的结果。为此,我们比较了拟南芥叶片中表达全长SCTV C2或SnRK1.2反义结构(asSnRK1.2)的转录组9:表S7和附加文件10:表S8)。这种方法的基本原理是geminvirus AC2和C2蛋白之间的相互作用导致激酶失活[5.]、[19],而asSnRK1.2预计会通过siRNA途径导致sense mRNA的降解,导致SnRK1.2活性的丧失。因此,在对两种治疗的反应中发现有差异调节的基因被推测是SnRK1.2活性降低的结果。在对C2或asSnRK1反应上调的基因中,在1 dpi处理和2 dpi处理中,共有49个基因上调(图)6.).对于响应于C2或AssnRK1.2在一个或两个DPI的基因下,我们分别观察到37和203,这对于两种治疗是共同的(图6.).因此,这些基因被解释为响应geminvirus C2蛋白抑制SnRK1活性的基因。这里需要注意的是,在C2和asSnRK1的反应中受到差异调控的基因总数在第2天增加了5倍(图)6.).
一些差异调节的基因是针对每一种治疗的。在那些被SCTV C2特异性上调的基因中,我们检测到1个dpi的235个基因和2个dpi的401个基因(图6.).144和342个基因分别在一个和两个dpi处被SCTV C2特异性下调。推测这些基因在SCTV C2的额外功能(包括与ADK的相互作用和失活)反应中受到差异调节[6.,可能还有其他未知函数。也有许多基因的表达发生了特异性的变化,以响应asSnRK1.2的表达。在第一天和第二次dpi时,我们分别检测到377和489个基因对单独的asSnRK1表达上调(图)6.).对于响应于ASSNRK1的基因单独,分别在一个和两个DPI检测到228和591(图6.).由于这些基因对SCTV C2的响应没有差异调节,我们推断这可能是SnRK1.2活性特异性的结果。
响应asSnRK1.2差异调控基因的功能分类
该分析的重点是描述在SCTV C2和asSNRK1.2反应中被发现有差异调节的基因。我们利用DAVID生物信息学资源对这些基因进行了生物过程分类。大多数氧化石墨烯生物过程类别都在显著基因中,但与拟南芥基因组整体相比,有几个类别显著富集。在这种情况下,与转录、蛋白质代谢和运输以及电子运输或能量途径相关的基因过多(附加文件)11:表S9和附加文件12:表S10)。
SnRK1.2失活后差异调控基因的网络分析
我们将asSnRK1.2响应基因叠加到拟南芥共表达网络中,并提取稠密的亚网络进行进一步研究。考虑到上升的基因数量很少(附加文件13:图S3a)或下降 - (附加文件14图S4A)在一个dpi上同时调控SCTV C2和asSnRK1.2,没有发现由高连接基因组成的网络。然而,在两个dpi时,基因数量的大幅增加-(附加文件13:图S3B)和下降 - (附加文件14:图S4B)调节揭示了复杂网络(附加文件15:表S11)。在对SCTV C2和asSnRK1.2在两个dpi水平上上调的209个基因中,发现了一个大型复杂的网络(图)7.其中几个基因具有与自噬相关的功能。这是一个包括蛋白质和细胞器在内的细胞质内容物被隔离在自噬体内的过程,自噬体是一种双膜囊泡,它可以通过融合将内容物递送到溶酶体或空泡中降解[47].自噬参与了包括病毒感染在内的生物胁迫反应和衰老调控,许多自噬基因已经在植物中被鉴定和功能分析。在该网络中发现的响应C2和asSnRK1.2上调的三个基因中,APG9 (At2g31260)复合物的作用尚不清楚。然而,APG7 (At5g45900)是一种E1泛素激活酶,结合磷脂酰乙醇胺到ATG8H (AT3G06420) [48].越来越多的证据表明,自噬可以促进或防止病毒发病[49]、[50].自噬作为一种对病原体感染的防御,在病原体诱导的超敏感细胞死亡(HR)和植物抗病毒免疫应答中都发挥了重要作用。携带n -抗性基因的烟草植株在感染时产生包括HR在内的快速免疫反应烟草花叶病毒(TMV)。这样做的结果是限制了病毒的复制和系统传播[51].沉默BECLIN1 / ATG6,ATG3或APG7导致细胞死亡扩散,提示自噬在病原体感染过程中发挥抗死亡作用,限制HR在最初感染细胞之外的扩散[52].番茄程序性细胞死亡抑制因子Adi3已被证明与番茄ATG8H相互作用,尽管目前尚不清楚Adi3是否被自噬靶向[53].由于自噬是宿主免疫系统使用的一种新兴抗病毒过程,某些病毒已成功进化,以避免、破坏或甚至积极诱导自噬,以确保产生性感染[54].有趣的是,包括ATG8H和ATG9,包括ATG8H和ATG9的自噬相关的转录物,在番茄感染期间调节番茄黄卷叶撒丁病毒(TYLCSV) [55]和感染CaLCuV的拟南芥[24].
与双生病毒特别相关的是最近的研究,这些研究表明自噬在RNA沉默中发挥了作用[50].这是一种抗病毒反应,导致DSRNA介导的病毒RNA的降解。作为防范,病毒编码了用于抑制RNA沉默机械的RNA沉默抑制器(RSS)[9].最近的一项研究表明,一种基因沉默钙调素样蛋白(Nt-rgsCaM)烟草调节剂与一些病毒rss中的富含精氨酸的区域结合,导致通过自噬体降解[56].这支持了自噬可以通过靶向病毒rss降解提供二级抗病毒机制的观点。然而,我们最近已经证明,在双生病毒的情况下,似乎有一个不同的机制,AC2, begomovirus RSS,诱导rgsCaM,并可能实际上隔离rgsCaM在细胞核中,以防止靶向AC2通过自噬途径降解[57].虽然我们无法解释这种明显的差异,但它可能反映了一项研究中使用的RNA病毒之间的差异[56和我们研究中的双生病毒[57].最近,它已经表明,polerovirus P0 RSS通过自噬途径降解目标的Argonaute 1(AGO1)58]目前尚不清楚AC2是否特异性靶向自噬途径中的基因以促进发病机制。
对双生病毒发病机制进一步感兴趣的是,在应激条件下,包括病原体感染,AMPK似乎通过两种机制调控自噬途径。首先,AMPK通过磷酸化直接与自噬启动子Ulk1相互作用[59].AMPK可以通过猛禽的磷酸化间接诱导自噬,这抑制了MTORC1复合物[60].因此,通过的mTORC1 ULK1的磷酸化分别和/或AMPK的结果在自体吞噬负或正调节[61].geminvirus AC2/C2蛋白已被证明与AMPK的植物同源物SnRK1相互作用并失活[5.].下病毒感染的应力,这将防止猛禽的磷酸保持活动的mTORC1复合物。这将确保自噬途径被抑制。其次,抑制SnRK1的由AC2 / C2将防止ULK1的直接磷酸化,再次防止authophagy途径的活化。然而,有鉴于我们检测上调自噬基因的响应于两个全长SCTV C2和asSnRK1.2一个明显的矛盾。这可以通过观察该自噬体标记ATG8迅速向上在酵母饥饿条件下调节部分地说明,并且在转录水平,大部分的自噬基因的进行调节[62].这重申了SnRK1作为双生病毒高价值靶点的重要性[5.]、[6.]、[20]、[26],通过阻止自噬在该途径中基因上调时的激活。
对于在两个dpi下调的203个常见基因,确定了一个包含高度连接的基因的大型复杂网络,这些基因似乎是共同调节的(补充文件14:图S4B)。这个网络中的两个较小的基因簇(图7.B和C)具有与核糖体和翻译相关的功能。虽然鉴定的基因未被具体据报道在病毒性发病机制中发挥作用,但是存在在抗病毒防御中发挥作用的核糖体蛋白质的实例,因此,发芽性降低了这些基因,以促进感染可能并不令人惊讶。关于Geminiviruses,已显示核梭蛋白(BR1)靶向NSP相互作用的激酶(NIK),其是抗病毒防御的亮氨酸富含重复(LRR)受体样激酶(RLK)[63].NIK1使核糖体蛋白rpL10A磷酸化,rpL10A作为NIK1介导反应的直接下游效应体,NSP与NIK1结合抑制其激酶活性,防止抗病毒防御途径影响geminvirus感染[63]、[64].
通过定量实时RT-PCR验证微阵列数据
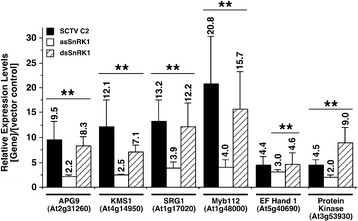
我们选择分析与自噬和衰老相关的六个基因(图)7.A) C2和asSnRK1.2同时上调。从拟南芥叶片中分离到1 dpi和2 dpi的总RNA农杆菌属含有能表达全长C2、asSnRK1.2或载体对照(pMON530)的DNA。此外,我们还使用了一种旨在表达dsRNA (dsSnRK1.2)的倒置重复结构,该结构已知可降低注入中的靶mRNA水平N.benthamiana叶子(20].cDNA生成后,利用基因特异性引物进行qPCR分析(附加文件)8.:表S6)来验证差异规则。如图所示(图8.),在对SCTV C2、asSnRK1.2和dsSnRK1.2的两个dpi检测中,均观察到显著的表达增加。在一次dpi时未检测到显著的表达变化(数据未显示)。这与微阵列数据一致,这些基因的表达增加对SCTV C2和asSnRK1.2的响应(附加文件10:表S8)。考虑到我们还观察到这些基因在SnRK1.2的沉默中通过反向重复结构(dsSnRK1)表达上调,我们认为这是SnRK1.2失活/抑制的结果。
结论
越来越明显的是,双生病毒通过几种方式操纵宿主,以促进有利于感染的环境,主要是通过使用多功能蛋白质。例如TGMV AL1蛋白是RCR起源识别和启动所必需的[65]、[66]TGMV AL1还与植物视网膜母细胞瘤(pRb)蛋白结合[67]、[68],并足以使PCNA积累[69].这类似于小DNA肿瘤病毒,腺病毒,其中SV40和经由与pRb的和p53途径[相互作用解除管制的细胞周期70] - [73].此外,CaLCuV感染已被证明影响宿主转录组[24,再次证明了双生病毒操纵宿主以确保有效感染的能力。第二种由双胞病毒编码的影响宿主对感染反应的多功能蛋白是AC2/C2蛋白。我们最近展示了CaLCuV人物配对关系通过与PPD2的相互作用,植物特异性DNA结合蛋白的相互作用来调节启动子,该植物特异性DNA结合蛋白,其特异性结合已知的介导激活的序列人物配对关系CaLCuV和TGMV的启动子[17].间接启动子靶向机制可能为病毒(通过AC2)改变宿主基因表达提供机会。这可能反过来对主机重新编程以支持病毒感染和/或逃避主机防御反应。AC2/C2与SnRK1.2和ADK之间的额外相互作用导致宿主防御抑制[5.]、[6.],这也可能导致宿主转录组的改变。为了支持这一点,我们的研究与其他人一起使用全病毒感染[24或ACMV或MMYMV中AC2的过表达[25]、[74,确定主题转录组的大规模变化。其他研究是在整个拟南芥植物中进行的[24,利用拟南芥原生质体进行瞬时测定[25]或转基因Nictotiana烟草组成性表达AC2[74].AC2可能影响的复杂性使我们有必要在不同条件下扩展这种类型的分析,以确定独立于实验室和宿主植物-病毒相互作用的关键宿主因子。因此,本研究具有互补性,为功能分析提供了全新的视角。与其他研究一样,我们鉴定了几类与拟南芥基因组相比显著富集的基因,包括DNA/RNA代谢、转录、应激反应、蛋白质代谢、信号转导、细胞组织和生物发生、运输和电子运输或能量的基因。我们的分析使我们能够识别包含高度连接基因的网络,这些基因可以反映共同调控的功能基因模块。其中两个突出了我们的方法在发现双胞病毒RSSs靶向的新基因簇的重要性。例如,含有与叶绿体、细胞壁和/或细胞骨架相关功能的基因的亚网络,可以反映AC2在诱导对病毒运动重要基因表达方面的直接作用。后者可能已经揭示了TGMV内突变现象的解释AC2基因导致感染性的丧失[75].这主要是由于AC2对于BR1核穿梭蛋白的转录激活是必需的,而BR1核穿梭蛋白对于病毒的移动是必需的[14]因此,与叶绿体、细胞壁和/或细胞骨架相关的基因的改变可能反映了AC2在诱导对病毒运动重要的基因表达方面的直接作用。确定已鉴定基因的启动子是否具有独联体-与的共同作用元素BR1begomoviruses的基因。
在第二个例子中,我们基于网络的方法已经确定了RNA沉默抑制物SnRK1.2和自噬之间的潜在联系(图7.).最近的证据表明,自噬在引导DICER和AGO2的降解中发挥作用,DICER和AGO2是miRNA加工和DICER mRNA转录后调控的重要蛋白[76].因此,有人提出自噬可能是维持miRNA群体稳态的一个检查点[76因此,我们有兴趣推测双生病毒AC2/C2蛋白对SnRK1.2的抑制可能对RNA沉默和自噬都有广泛的影响。然而,关于自噬在病毒发病机制中的作用仍有许多未解决的问题,但针对这一途径的靶向强调了自噬作为抗病毒免疫的一个组成部分的可能重要性。
我们鉴定差异受AC2差异调节的高相连基因的方法揭示了在感染期间由Geminiviruses潜在的共调节基因网络。许多这些基因未被认为是在网络中运作的,但这种方法允许我们将它们评估为功能单元,并在病毒性发病机制中确定整个网络的重要性。我们现在可以识别响应于病原体感染的共调节基因的新型途径,以及特别是病毒感染。我们目前正在确认在所有子网中基因的差异表达,并正在研究每个子网络在病毒性发病机制中的作用。
方法
DNA结构
从CaMV 35S启动子中克隆出能够构成性表达CaLCuVAC2 (p35s calcuvac2)或SCTV C2 (p35s-SCTV C2)的dna已被描述[12]、[26]。CaLCuV AC2蛋白一种DNA构建物,能够构成性地表达缺失c端激活域的截断的CaLCuV AC2蛋白(CaLCuV AC2)1-100)。以CaLCuV DNA A为模板,利用引物CaLCVAC2F (5'-gcgagatctatgcaaaattcatcactcttg-3')和CaLCVAC2Rdel (5'-gcgctcgagctacgtaggttgtggttgaac-3')扩增出一个300 bp的片段。以下限制与XHO.我- - - - - -Bgl将该片段克隆到同样剪切的pMON530中,生成p35S-CaLCuVAC21-100.为了从CaMV 35S启动子中生成一个能够构成性表达拟南芥SnRK1.2 (AKIN11)反义RNA的DNA结构,pAS2-AKIN11 DNA [19]被限制以区域我和克莱诺一起做了一个钝头手术。以下限制与BamHI,将所得的1.5kbp片段克隆到植物二元载体pMON530 [76]在这件事BglII及SmaI位点,生成包含反义方向SnRK1.2编码区域的DNA (asSnRK1.2)。DNA测序证实了每个ORF在正确方向上的存在。将所得的Ti质粒载体移入农杆菌属品系GV3111SE通过三亲本交配[77]并用于农药。作为对照,将含有CAMV 35s启动子的载体DNA(PMON530)引入农杆菌属.
农杆菌注入试验和RNA分离
的真空浸润拟南芥植物与农杆菌属进行了基本描述的培养[26].拟南芥渗透前,向Col-0植物洒水,将整个植物浸没在水中农杆菌属培养确保所有莲座叶片浸没在溶液中。在大约0.05 Bar的压力下抽真空20-30分钟。植物从烧杯中取出,重新种植到潮湿的土壤中,在长日照条件下(16小时光照和8小时黑暗)覆盖并放置在生长室中,并在21°C下培养。在下午进行渗透,并在接种后1 ~ 3天下午采集4种不同植物的叶片组织,根据试验情况而定。使用制造商(Invitrogen, Carlsbad, CA)提供的植物RNA试剂从拟南芥的渗透叶片中分离出总RNA,用DNaseI (Ambion, Austin, TX)处理,并通过RNeasy MiniElute清洁试剂盒(Qiagen, Valencia, CA)纯化。
基因芯片杂交和微阵列数据分析
整个实验使用了Affymetrix ATH1基因芯片(Affymetrix P/N 510690),包含22500多个探针组,代表约24000个基因,所有步骤都按照制造商说明(Affymetrix, Santa Clara, CA)进行。作为一个比较,拟南芥被注入了农杆菌属含CaLCuV AC2, CaLCuV AC21-100或空质粒载体(pMON530)。在第二个比较中,拟南芥被注入农杆菌属含SCTV C2、asSnRK1.2或空质粒载体(pMON530)的培养物。每次比较都在不同的时间进行三个独立的实验,并在浸渍后的第1天和第2天从浸渍植物中分离总RNA。这导致每次比较在1和2 dpi时总共有9个样本。比较1:9个阵列分别为530 × 3、CaLCuV AC2 × 3、CaLCuV AC2样品1-100第一天和第二天× 3 = 18。比较2:第1天和第2天共9组样品530 × 3, SCTV C2 × 3, asSnRK1.2 × 3 = 18。总RNA (10 μg)通过一步标记协议(Affymetrix)处理,片段cRNA (15 μg)与拟南芥ATH1基因组杂交,采用推荐的标准程序(45°C, 16 h)。使用标准协议EUkGEWS2v4,并使用Agilent generearray Scanner扫描。根据Affymetrix(基因芯片表达分析,技术手册,701021 rev 1)推荐的参数评估阵列质量。使用MATLAB生物信息学工具箱中的鲁棒多阵列平均(RMA)程序处理原始强度数据。首先在探针水平上进行背景调整和分位数归一化,然后将每个探针集的强度水平总结为对数尺度下的基因水平表达值[[78].计算未用于差异表达基因选择的Fold changes,首先取3个生物重复的log2(基因表达量)的算术平均值,然后线性比例尺计算平均表达值的比值。从阵列上的共22810个基因中,使用双样本t检验检测实验样本和对照组之间的差异表达基因,以多次检验校正的p值0.05作为截止值。以1000个排列进行排列试验,以纠正多次试验[79].
定义/选择差异表达(DE)基因有许多不同的方法,每一种方法都可能产生一组不同的基因。一般来说,fold change虽然简单直观,但并不是选择DE基因的首选标准,因为在置信度和重现性方面缺乏指示[78].值得注意的是,fold change在生物学上并不一定比统计学上的显著性更有意义,因为有些基因可以在fold change非常低的水平上产生影响,而有些基因则需要在更高的水平上发挥作用。此外,折数变化方法通常存在偏倚,因为它倾向于选择折数变化值方差大于高强度基因的低强度基因。最后但并非最不重要的是,来自微阵列实验的原始强度数据经常需要预处理和归一化,这可能会极大地影响折叠变化估计,取决于使用的程序,使折叠变化的定义模糊。我们选择我们的方法是基于一项研究,该研究表明,特别是Affymetrix阵列,t检验通常导致更准确地发现DE基因,特别是当结合RMA进行预处理和标准化时[80].同时,研究还表明,RMA对折叠变化的估计往往存在偏倚,这可能是我们实验中观察到的DE基因折叠变化相对较小的原因。他们研究中的模拟表明,RMA可以将折叠变化减少多达2倍(例如,RMA后,4倍的变化可以减少到2倍)。
统计和基于网络的分析
使用在DAVID生物信息学资源上实现的次几何测试在每个基因列表中进行基因本体论(GO)术语的过度表示[81]为了确定一系列基因的子网络,我们将这些输入基因叠加到一个拟南芥基因共表达网络上[27利用>1300微阵列实验的基因表达数据,检索了仅由输入基因及其连接组成的亚网络。对于asSnRK1.2在两个dpi上下调的基因,由于返回的网络非常大,我们迭代删除了亚网络中连接少于4个的基因,剩余的亚网络用于进一步分析。
定量实时PCR
定量实时PCR(qPCR的)用于通过比较一个质粒载体处理的对照,以评估基因响应于目标蛋白质的稳态mRNA水平的差异。从拟南芥属叶组织中分离的总RNA(1微克)用DNase I和使用高容量cDNA库试剂盒逆转录仪(Applied Biosystems,福斯特城,CA)处理。使用基因特异性探针(附加文件用SYBR Green进行qPCR分析8.表S6),采用7500 Real-time PCR系统(Applied Biosystems, Foster city, CA),如前所述[26]或使用Biomark HD系统(Fluidigm Corporation)。使用引物Express 2.0软件(Applied Biosystems)设计了引物序列。对于每个实验,将靶样品标准化为EF1α,其用作参考。在每个实验中,使用来自三个独立的生物样品的样品用于分析。在数据分析之前检查每个井位置的CT值。使用7500系统SDS软件包(Applied Biosystems,Foster City,CA)计算基因表达(ΔΔct)的差异,其在每次重复中测量了靶基因和内源对照(Δct)的表达差异。
可获得的支持数据
本手稿中使用的微阵列数据集已存放在基因表达综合数据库(GEO)中,并分配了以下GEO登录号:GSE62180。所有数据均可通过以下链接访问:http://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE62180.
作者的贡献
GS构思和协调研究,设计了实验,并帮助起草了稿件,HC设计并进行了QPCR确认实验,并在稿件上提供了输入,JR协调了统计分析,并帮助起草了手稿,SB和GL参加了设计实验并进行了微阵列实验,LL进行了统计分析并在稿件上提供输入。所有作者阅读并认可的终稿。
附加文件
缩写
- 35S:
-
Camv推动者
- 5'-AMP:
-
5 '腺苷monophosphateAbMV,青麻花叶病毒
- AC2:
-
Begomovirus转录激活蛋白
- 理应:
-
腺苷酸激酶
- Akin11:
-
拟南芥SNF1相关蛋白激酶1.2
- asSnRK1.2:
-
反义版本ofArabidopsis SnRK1.2
- Atg:
-
自噬相关基因
- ATL2:
-
环H2泛素E3连接酶
- 质疑:
-
甜菜卷顶病毒
- BR1:
-
Begomovirus核穿梭蛋白
- CaLCuV:
-
卷心菜曲叶病毒
- CAMV:
-
花椰菜花叶病毒
- CP:
-
外壳蛋白
- cpHSC70-1:
-
叶绿体热休克同源蛋白70 kDa
- CRNA:
-
互补的RNA
- 新闻部:
-
天和
- 背景:
-
脱氧核糖核酸
- dsDNA:
-
双链DNA
- EDA39:
-
胚囊SAC开发逮捕39
- EF1α:
-
真核延伸因子1α
- 如果遇到:
-
真核启动因子
- 呃:
-
内质网
- 走:
-
基因本体
- HBT:
-
霍比特人
- ILP1:
-
增加的多倍体水平1
- L2 / C2:
-
柯托病毒致病蛋白
- 远程雷达:
-
富亮氨酸重复
- MKS1:
-
MAP激酶底物1
- 议员:
-
运动蛋白
- MPK4:
-
地图激酶4.
- MYB3R4:
-
MYB结构域蛋白3R-4
- 尼克:
-
NSP-interacting激酶
- NSP:
-
核班蛋白
- p53:
-
肿瘤抑制蛋白
- PAMP时:
-
病原体相关分子模式
- PCNA:
-
增殖细胞核抗原
- 聚合酶链反应:
-
聚合酶链反应
- PPD2:
-
拟南芥peapod2蛋白质
- 复审委员会:
-
植物视网膜母细胞瘤蛋白
- PTI:
-
PAMP触发的免疫力
- PUB24:
-
u -box型E3泛素连接酶
- qPCR:
-
实时定量PCR
- 软:
-
滚动循环复制
- RDR:
-
重组相关的复制
- 射频:
-
复制形式
- RLK:
-
远程雷达受体激酶
- RMA:
-
稳健的多阵列平均蛋白PL、核糖体蛋白L
- RNA:
-
核糖核酸
- RSS:
-
RNA沉默抑制因子
- RT-PCR:
-
逆转录酶聚合酶链反应
- 入:
-
菠菜卷顶病毒
- SNF1:
-
蔗糖非发酵蛋白
- SnRK1:
-
SNF1相关蛋白激酶
- 单链DNA:
-
单链DNA
- SV40:
-
猿猴病毒40
- TGMV:
-
番茄金色马赛克病毒
- Tic110:
-
叶绿体内层膜的转位
- 烟草花叶病毒:
-
烟草花叶病毒
- TOC75-III:
-
叶绿体外膜上的转位75-III
- WRKY33:
-
植物特异性转录因子
参考文献
- 1.
马拉提VG:新兴双子病毒问题:对作物生产的严重威胁。年鉴应用生物学2003,142(2):145-164.10.1111/j.1744-7348.2003。tb00240.x。
- 2.
Navas-Castillo J, fialo - olive E, Sanchez-Campos S:由白蝇传播的新发病毒疾病。植物病理学杂志。2011,49:1-30。10.1146 / annurev -发朵- 072910 - 095235。
- 3.
Preiss W,Jeske H:在Geminiviruses中复制中的多任务处理。J病毒。2003,77:2972-2980。10.1128 / JVI.77.5.2972-2980.2003。
- 4.
Stenger DC, Revington GN, Stevenson MC, Bisaro DM:双病毒基因组从串联重复复制中复制释放:植物病毒DNA滚动循环复制的证据。中国科学(d辑:地球科学),1998,16(4):531 - 534。10.1073 / pnas.88.18.8029。
- 5.
王洪波,王洪波,王洪波,王洪波。双生子病毒AL2和L2蛋白与SNF1激酶相互作用并灭活。acta botanica sinica(云南植物学报),2003,27(5):457 - 461。10.1105 / tpc.009530。
- 6.
王H,Hao L,Shung C-Y,Sunter G,Bisaro DM:腺苷激酶通过Geminivirus Al2和L2蛋白灭活。植物细胞。2003,15:3020-3032。10.1105 / TPC.015180。
- 7.
Sunter G,Bisaro DM:Al2蛋白(陷阱)的Geminivirus Coat蛋白启动子的调节:激活和Dereplate机制的证据。病毒学。1997年,232:269-280。10.1006 / Viro.1997.8549。
- 8.
SUNTER G,Bisaro DM:一个最小序列的鉴定所需的活化番茄金色马赛克病毒原生质体中的外壳蛋白启动子。病毒学。2003,305:452-462。10.1006 / viro.2002.1757。
- 9.
Voinnet O,Pinto YM,Baulcombe DC:抑制基因沉默:植物的不同DNA和RNA病毒使用的一般策略。美国科学院学报,1999年,96:14147-14152.10.1073/pnas.96.24.14147。
- 10.
植物病毒RNA沉默的激活和抑制。病毒学。2001,281:1-5。10.1006 / viro.2000.0812。
- 11.
范维泽,刘洪,田平,洪勇:三种半胱氨酸残基的突变番茄黄曲叶病毒-China C2蛋白导致发病和转录后基因沉默抑制功能障碍。分子植物微生物相互作用。2002年,15:203-208。10.1094 / MPMI.2002.15.3.203。
- 12
Lacatus G, Sunter G:二部begomovirus外壳蛋白启动子序列的功能分析。病毒学。2008,376:79-89。10.1016 / j.virol.2008.03.012。
- 13
双生病毒的反式激活:AL2基因产物是外壳蛋白表达所必需的。病毒学。1991,180:416-419。10.1016 / 0042 - 6822 (91) 90049 - h。
- 14
Sunter G, Bisaro DM:双生病毒AR1的反转录激活和病毒AL2基因产物的BR1基因表达发生在转录水平。植物学报。1992,4:1321-1331。10.1105 / tpc.4.10.1321。
- 15
Berger MR, Sunter G: al2介导的激活所需序列的鉴定番茄金色马赛克病毒 - 黄静脉BR1启动子。中华卫生杀虫药杂志,2013,33(4):514 - 514。10.1099 / vir.0.050161-0。
- 16
双生病毒AL2和AL3基因的异源互补。病毒学杂志,1994,19(4):423 - 427。10.1006 / viro.1994.1477。
- 17.
Lacatus G,Sunter G:拟南芥PEAPOD2转录因子与双子病毒AL2蛋白和外壳蛋白启动子相互作用。病毒学。2009,392:196-202.10.1016/j.virol.2009.07.004。
- 18.
双生病毒转激活因子(TrAP)是一种具有酸性激活域的锌结合磷酸蛋白。病毒学杂志。1999:1-14。10.1006 / viro.1999.9925。
- 19.
陈志强,陈志强,陈志强,等:水稻中互补感基因的转录分析菠菜卷顶病毒《植物-微生物相互作用》2007,20(2):194-206.10.1094/MPMI-20-2-0194。
- 20。
王H,Buckley KJ,Yang X,Buchmann RC,Bisaro DM:Geminivirus Al2和L2蛋白的腺苷激酶抑制和RNA沉默的抑制。J病毒。2005,79:7410-7418。10.1128 / JVI.79.12.7410-7418.2005。
- 21。
Moffatt BA, Stevens YY, Allen MS, Snider JD, Pereira LA, Todorova MI, Summers PS, Weretilnyk EA, Martin-McCaffrey L, Wagner C:腺苷激酶缺乏与发育异常和转甲基化减少相关。植物营养与肥料学报。2002,22(2):429 - 434。10.1104 / pp.010880。
- 22.
布赫曼RC,阿萨德S,狼JN,Mohannath G,Bisaro DM:双粒AL2和L2蛋白抑制胞嘧啶甲基转录基因沉默和原因的全基因组减少。J病毒。2009年,83:5005-5013。10.1128 / JVI.01771-08。
- 23.
Sugden C, Crawford RM, Halford NG, Hardie DG:蛋白激酶和磷酸酶对菠菜snf1相关(SnRK1)激酶的调节与T环的磷酸化有关,并受到5'-AMP的调控。植物学报,1999,19:433-439。10.1046 / j.1365 - 313 x.1999.00532.x。
- 24.
Ascencio Ibañez JT、Sozzani R、Lee T-J、Chu T-M、Wolfinger路、Cellab R、Hanley Bowdoin L:全球风险分析拟南芥基因表达在Geminivirus感染期间揭示了影响病原体反应和细胞周期的复杂变化阵列。植物理性。2008,148:436-454。10.1104 / pp.108.121038。
- 25.
Trinks d,Rajeswaran R,Shivaprasad PV,Akbergenov R,Oakeley EJ,Veluthambi K,霍恩T,Pooggin MM:由双生病毒RNA沉默的抑制核蛋白,AC2,与宿主基因的反式激活相关因素。J病毒。2005年,79:2517年至2527年。10.1128 / JVI.79.4.2517-2527.2005。
- 26。
Baliji S, Lacatus G, Sunter G:双生病毒致病性蛋白与腺苷激酶相互作用导致原代细胞分裂素应答基因表达增加。国家自然科学基金项目:病毒学。10.1016 / j.virol.2010.03.023。
- 27。
引用本文:阮建军,刘建军,刘建军,等:系统识别系统的功能模块独联体监管元素拟南芥.生物信息学。2011,12:52-10.1186/1471-2105-12-S12-S2。
- 28.
琼斯AME,托马斯V,班尼特MH,曼斯菲尔德J,格兰特M:修改拟南芥防御蛋白质组在接种接种时在显着转录变化之前发生假单胞菌含油.植物营养与肥料学报。2006,32(4):457 - 461。10.1104 / pp.106.086231。
- 29.
SU P-H,Li H-M:基质HSP70对蛋白质易位成豌豆很重要拟南芥叶绿体。植物细胞。2010,22:1516-1531.10.1105/tpc.109.071415。
- 30.
Krenz B, Jeske H, Kleinow T:植物dna病毒在表皮叶组织中诱导形成stromule,提示了一种新的细胞内和细胞间大分子运输途径。植物科学学报,2012,30(3):491 - 498。
- 31。
Caplan JL,Mamillapalli P,Burch Smith TM,Czymmek K,Dinesh Kumar SP:叶绿体蛋白NRIP1介导病毒效应器的先天免疫受体识别。Cell.2008,132:449-462.10.1016/j.Cell.2007.12.031。
- 32。
Scholez JE,Harries PA,Nelson RS:植物病毒的细胞内运输:找到细胞外的门。Mol plant.2011,4:813-831.10.1093/mp/ssr070。
- 33.
植物DNA病毒的两种蛋白质协调核和胞间连接的运输。细胞。1994,76:925-932。10.1016 / 0092 - 8674(94) 90366 - 2。
- 34.
病毒运动蛋白作为植物细胞内和细胞间运输的探针。acta botanica sinica(云南植物学报). 1999,11:535-548。10.1105 / tpc.11.4.535。
- 35.
Haga N,Kato K,Murase M,Araki S,Kubo M,Demura T,Suzuki K,Müller I,VoßU,Jürgens G,Ito M:R1R2R3 Myb蛋白通过激活细胞中的Knole转录来积极调节胞质分裂拟南芥.发展。2007,134:1101-1110。10.1242 / dev.02801。
- 36
Chandran D, Inada N, Hather G, Kleindt CK, Wildermuth MC:激光显微解剖拟南芥在白粉病感染位点的细胞揭示了位点特定的过程和调控。中国科学(d辑:地球科学),2010,32(6):591 - 598。10.1073 / pnas.0912492107。
- 37
关键词:视网膜母细胞瘤,视网膜母细胞瘤,E2F通路,细胞类型特异性拟南芥叶的发展。植物营养与肥料学报,2006,30(4):427 - 434。10.1104 / pp.105.071027。
- 38
Yoshizumi T, Tsumoto Y, Takiguchi T, Nagata N, Yamamoto YY, Kawashima M, Ichikawa T, Nakazawa M, Yamamoto N, Matsuia M:增加的水平的POLYPLOIDY1, CYCLINA2转录的保守抑制因子,控制核内复制拟南芥.acta botanica sinica, 2017, 36(6): 772 - 772。10.1105 / tpc.106.043869。
- 39
Caracuel Z, Lozano-Durán R, Huguet S, Arroyo-Mateos M, Rodríguez-Negrete EA, Bejarano ER: C2 from甜菜卷顶病毒促进适合于高效复制的细胞环境,提供了一种病毒协同作用的新机制。新的植物学家。2012年,194:846-858。10.1111 / J.1469-8137.2012.04080.x。
- 40.
Andreasson E, Jenkins T, Brodersen P, Thorgrimsen S, Petersen NHT, Zhu S, Qiu J- l, Micheelsen P, Rocher A, Petersen M, Newman M-A, Bjorn Nielsen H, Hirt H, somsich I, Mattsson O, Mundy J: mapkinase substrate MKS1是植物防御反应的调控因子。中国海洋大学学报(自然科学版)10.1038 / sj.emboj.7600737。
- 41.
特鲁希illo, Ichimura K, Casais C, Shirasu K:拟南芥中泛素连接酶E3三联体对pamp触发免疫的负调控。生物工程学报。2008,29(6):591 - 598。10.1016 / j.cub.2008.07.085。
- 42.
Serrano M,GuzmánP:隔离和基因表达分析拟南芥一个早期诱导反应RING-H2 zizncfinger基因ATL2的组成性表达突变体。中国生物医学工程学报。10.1534 / genetics.104.028043。
- 43.
李志强,王志强,王志强:植物防御诱导子几丁质诱导的118个拟南芥转录因子和30个泛素连接酶基因的鉴定。植物营养与肥料学报。2007,20(4):489 - 494。10.1094 / mpmi - 20 - 8 - 0900。
- 44。
研究表明,CKH2/PKL染色质重塑因子负调控细胞分裂素的反应拟南芥愈伤组织。植物营养与肥料学报。2011,32(4):429 - 434。10.1093 /卡式肺囊虫肺炎/ pcr022。
- 45。
Blilou I,Frugier F,Folmer S,Serralbo O,Willenfelt H,Wolkenfelt H,Eloy NB,Ferreira PCG,Weisbeek P,Scheres B:拟南芥霍比特基因编码一个CDC27同源物,将植物细胞周期与细胞分化进程联系起来。基因发展。2002,16:2566-2575。10.1101 / gad.237302。
- 46.
王Y,Barbacioru C,海兰楼小W,汉凯皮勒KL,布雷克Ĵ,陈楼冈萨雷斯C,张L,萨马哈RR:对基因表达的测量大规模的实时PCR验证从两个商业的长寡核苷酸微阵列。BMC基因组学。2006年,7:59-75。10.1186 / 1471-2164-7-59。
- 47.
Klionsky DJ:自噬的分子机制:悬而未决的问题。中国生物医学工程学报,2003,22(4):427 - 434。10.1242 / jcs.01620。
- 48.
Kim Sh,kwon c,lee jh,chung t:植物自噬基因:功能和互动。mol细胞。2012,34:413-423。10.1007 / s10059-012-0098-y。
- 49.
自噬、抗病毒免疫和病毒对抗。Acta botanica sinica(云南植物研究),2009,33(4):457 - 461。10.1016 / j.bbamcr.2009.02.008。
- 50.
周军,于建强,陈智:自噬在植物固有免疫应答中的复杂作用。植物学报。2014。
- 51.
Marathe R, Anandalakshmi R, Liu Y, Dinesh-Kumar SP烟草花叶病毒植物抗病基因,2002,3:167-172。10.1046 / j.1364-3703.2002.00110.x。
- 52.
Liu Y Y, Schiff M, Czymmek K, Tall°Czy Z, Levine B, Dinesh-Kumar SP:自噬调节植物固有免疫反应中的程序性细胞死亡。细胞。2005,121:567-577。10.1016 / j.cell.2005.03.007。
- 53.
Devarenne TP:植物细胞死亡抑制因子Adi3与自噬蛋白Atg8h相互作用。中国生物化学学报。2011,31(4):491 - 498。10.1016 / j.bbrc.2011.08.031。
- 54。
当自噬遇到病毒时:具有防御和进攻功能的双刃剑。免疫病理杂志。2010,32:323-341。10.1007 / s00281 - 010 - 0226 - 8。
- 55。
李志刚,李志刚,李志刚:韧皮部限制双生体病毒相互作用的转录组学研究番茄黄卷叶撒丁岛病毒和番茄在感染过程中植物激素、自噬和植物免疫系统微调的作用。公共科学图书馆。2014,9:e89951-10.1371/journal. pon. 0089951。
- 56。
Nakahara KS、Masuta C、Yamada S、Shimura H、Kashihara Y、Wada TS、Meguro A、Goto K、Tadamura K、Sueda K、Sekiguchi T、Shao J、Itchoda N、Matsumura T、Igarashi M、Ito K、Carthew RW、Uyeda I:烟草类钙调蛋白通过结合并指导病毒RNA沉默抑制物的降解提供二级防御.2012,109:10113-10118.10.1073/pnas.1201628109。
- 57.
钟海英,拉卡图斯G,桑特G:双子病毒AL2蛋白诱导钙调素样基因的表达并与之相互作用,钙调素样基因是基因沉默的内源性调节因子。病毒学。2014,460-461:108-118。10.1016/j.virol.2014.04.034。
- 58.
Derrien B, Baumberger N, Schepetilnikov M, Viotti C, De Cillia J, Ziegler-Graff V, Isono E, Schumacher K, Genschik P:自噬途径对抗病毒成分ARGONAUTE1的降解。中国科学(d辑:地球科学),2012,32(4):591 - 598。10.1073 / pnas.1209487109。
- 59.
AMPK和mTOR通过Ulk1的直接磷酸化调控自噬。生物谷biosciences . 2011, 13: 132-141。10.1038 / ncb2152。
- 60.
Gwinn DM, Shackelford DB, Egan DF, Mihaylova MM, Mery A, Vasquez DS, Turk BE, Shaw RJ: raptor AMPK磷酸化介导代谢检查点。环境科学学报。2008,30(4):489 - 494。10.1016 / j.molcel.2008.03.003。
- 61.
Alers S,吕弗勒AS,Wesselborg S,鹳B:串扰,快捷方式和反馈:在自体吞噬调节AMPK-mTOR信号-ULK1 / 2中的作用。分子细胞生物学。2012年,32:2-11。10.1128 / MCB.06159-11。
- 62.
HE C,KLIONSKY DJ:自噬的调节机制和信号通路。Ann Rev Gen 2009,43:67-93。10.1146 / annurev-genet-102808-114910。
- 63.
Fontes EPB, Santos AA, Luz DF, Waclawovsky AJ, Chory J:双生病毒NSP作为毒力因子抑制先天跨膜受体激酶介导的防御信号。基因发展。2004,18:2545-2556。10.1101 / gad.1245904。
- 64.
Carvalho CM, Santos AA, Pires SR, Rocha CS, Saraiva DI, Machado JPB, Mattos EC, Fietto LG, Fontes EPB:由NIK1介导的rpL10A核转运调控是植物细胞对抗病毒的一种防御策略。PLoS Pathog. 2008, 4: 1-13。10.1371 / journal.ppat.1000247。
- 65.
双生病毒复制蛋白和原始DNA之间的相互作用是病毒复制的必要条件。中国生物医学工程学报。
- 66.
一种DNA结构是双生病毒起源功能所必需的。中华卫生杀虫药杂志,1996,19(4):421 - 428。
- 67.
Ach RA,Durfee T,Miller AB,Taranto P,Hanley Bowdoin L,Zambriski PC,Gruissem W:玉米中的一个选择性剪接多基因家族编码视网膜母细胞瘤相关蛋白,可与植物D型细胞周期蛋白和双子病毒复制蛋白相互作用。Mol Cell Biol.1997,17:5077-5086。
- 68。
双生病毒复制辅助蛋白与植物细胞周期调节剂的双重相互作用。《病毒学》,2001年第4期。10.1006 / viro.2000.0719。
- 69。
关键词:双生病毒,寄主DNA合成蛋白,植物细胞,末端分化acta botanica sinica(云南植物研究),2012,28(5):593 - 598。10.1105 / tpc.7.6.705。
- 70.
Bargonetti J,Reynisdottir I,Friedman Pn,Prives C:SV40 T抗原和突变体P53抑制了野生型P53与细胞DNA的特异性野生型P53的结合。基因开发。1992,6:1886-1898。10.1101 / gad.6.10.1886。
- 71.
de Stanchina E, McCurrach ME, Zindy F, Shieh S-Y, Ferbeyre G, Samuelson AV, Prives C, Roussel MF, Sherr CJ, Lowe SW: p53的E1A信号涉及p19ARF肿瘤抑制因子。基因工程学报,1998,12:2434-2442。10.1101 / gad.12.15.2434。
- 72.
Dobbelstein M, Arthur AK, Dehde S, van Zee K, Dickmanns A, Fanning E:间隙内互补揭示了SV40 T抗原与Rb和p53结合刺激静止细胞DNA合成的新功能。中华肿瘤杂志。1992,7:837-847。
- 73.
Whyte P, Buchkovich KJ, Horowitz JM, Friend SH, Raybuck M, Weinberg RA, Harlow E:癌基因和抑癌基因之间的关联:腺病毒E1A蛋白结合到视网膜母细胞瘤基因产物。自然科学。1988,334:124-129。10.1038 / 334124 a0。
- 74.
Soitamo AJ, Jada B, Lehto K:双生病毒AC2 RNA沉默抑制基因的表达改变了转基因烟草植株中糖和茉莉酸响应基因的表达。生物谷bioon . 2012, 12: 204-10.1186/1471-2229-12-204。
- 75.
Sunter G, Hartitz MD, Hormuzdi SG, Brough CL, Bisaro DM:遗传分析番茄金色马赛克病毒.ORF AL2是外壳蛋白积累所必需的,ORF AL3是DNA有效复制所必需的。病毒学杂志。1999,179:69-77。10.1016 / 0042 - 6822 (90) 90275 - v。
- 76.
Gibbings D, Mostowy S, Jay F, Schwab Y, Cossart P, Voinnet O:选择性自噬降解DICER和AGO2并调节miRNA活性。中国生物医学工程学报。2012,31(4):513 - 514。10.1038 / ncb2611。
- 77.
4 . Rogers SG, Klee HJ, Horsch RB, Fraley RT:植物转化的改良载体:表达盒载体和新的可选择标记。甲安非他明酶。1987,153:253-277。10.1016 / 0076 - 6879(87) 53058 - 0。
- 78。
Irizarry RA, Bolstad BM, Collin F, Cope LM, Hobbs B, Speed TP: affymetrix基因芯片探针水平数据摘要。石油学报。2003,31 (4):e15-10.1093/nar/gng015。
- 79。
陈志强,王志强,王志强,等。基因芯片技术在不同基因表达差异检测中的应用。中国统计。2002,12:111-139。
- 80
崔X,邱吉尔GA:cDNA微阵列实验中差异表达的统计检验。基因组生物学,2003,4:210-10.1186/gb-2003-4-4-210。
- 81
黄德伟,谢立文,林丕基:利用DAVID生物信息学资源对大基因序列进行系统综合分析。自然协议。2009,4(1):44-57。10.1038 / nprot.2008.211。
致谢
这种材料是基于工作支持下由美国国家科学基金会资助号码ios - 0948669 GS和格兰特iis数——0948669 JR .任何意见,结果,结论和建议表达了这种材料的作者的,不一定反映美国国家科学基金会的观点。
作者信息
隶属关系
相应的作者
额外的信息
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
电子辅料
12870 _2014_302_moesm1_esm.xls
附加文件1:表S1。:Genes differentially expressed in response to CaLCuV AC2. Genes that are up- or down regulated at one dpi, in response to full-length AC2 (FL) or a deletion derivative lacking the transcription activation domain (DEL), are shown. (XLS 338 KB)
12870 _2014_302_moesm2_esm.xls
附加文件2:表S2。:Genes differentially expressed in response to CaLCuV AC2. A list of genes that are up- or down-regulated at two dpi, in response to a full-length AC2 (FL) or a deletion derivative lacking the transcription activation domain (DEL), are shown. (XLS 426 KB)
12870 _2014_302_moesm3_esm.xls
附加文件3:表S3。:A comparison of differentially regulated genes found in CaLCuV-infected Arabidopsis with those found in response to full-length (FL) AC2. The first two worksheets list genes up- or down-regulated in Arabidopsis plants infected with CaLCuV at 12 days post infection [24],并表明相同的基因在FL AC2反应中是否也有差异调控。超几何分布显示在第三个工作表。(XLS 926 KB)
12870 _2014_302_moesm4_esm.xlsx
附加文件4:表S4。:GO biological process categories represented among the genes differentially expressed in response to CaLCuV AC2 at one dpi. (XLSX 71 KB)
12870 _2014_302_moesm5_esm.xlsx
附加文件5:表S5。:GO biological process categories represented among the genes differentially expressed in response to CaLCuV AC2 at two dpi. (XLSX 90 KB)
(一)
附加文件6:图S1。:Network analysis using genes that were up-regulated specifically in response to full length AC2. Sub-networks (red boxes) containing highly connected genes that were up-regulated in response to full length AC2 at one or two(B)dpi。(TIFF 14 MB)
(一)
附加文件7:使用了基因图S2:网络分析响应于全长AC2特异性下调。亚网络(红框)包含高度连接的基因,在对全长AC2的反应中有一两个基因上调(B)dpi。(TIFF 4 MB)
12870 _2014_302_moesm9_esm.xls
附加文件9:表S7。:Genes differentially expressed in response to inactivation of Arabidopsis SnRK1.2. Genes that are up- or down-regulated at one dpi, in response to SCTV C2 or antisense SnRK1.2, are shown. (XLS 478 KB)
12870 _2014_302_moesm10_esm.xls
附加文件10:表S8。:Genes differentially expressed in response to inactivation of Arabidopsis SnRK1.2. Genes that are up- or down-regulated at two dpi, in response to SCTV C2 or antisense SnRK1.2, are shown. (XLS 973 KB)
12870_2014_302_moesm11_esm.xlsx.
附加文件11:表S9。:GO biological process categories represented among the genes differentially expressed in response to inactivation of Arabidopsis SnRK1.2 at one dpi. (XLSX 26 KB)
12870 _2014_302_moesm12_esm.xlsx
附加文件12:表S10:在两个dpi下,响应拟南芥SnRK1.2失活而差异表达的基因中代表的GO生物过程类别。(XLSX 86 KB)
(一)
附加文件13:图S3。:Network analysis using genes that were up-regulated specifically in response to full length AC2. Sub-networks (red boxes) containing highly connected genes that were up-regulated in response to SCTV C2 and antisense SnRK1.2 at one or two(B)dpi。(TIFF 226 KB)
(一)
附加文件14:图S4。:Network analysis using genes that were down-regulated specifically in response to full length AC2. Sub-networks (red boxes) containing highly connected genes that were up-regulated in response to SCTV C2 and antisense SnRK1.2 at one or two(B)新闻部(TIFF 1MB)
12870 _2014_302_moesm15_esm.xlsx
附加文件15:表S11.:网络边缘:图中所示网络中两个基因之间的连接列表7..(XLSX 15 KB)
作者提交的原始图像文件
以下是作者提交的原始图像文件的链接。
权利和权限
开放存取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。
本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。
如欲查阅本许可证副本,请浏览https://creativecommons.org/licenses/by/4.0/.
创作共用及公共领域专用豁免书(https://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
Liu,L.,Chung,H.Y.,Lacatus,G.et al。一种多功能双生病毒致病性蛋白对拟南芥基因表达的改变植物生物学14,302(2014)。https://doi.org/10.1186/s12870-014-0302-7
已收到:
认可的:
发表:
关键字
- Geminiviruses
- 微阵列
- 发病机理
- 表达
- 监管网络