摘要
背景
转录组的生物钟和日动态被认为在调节植物环境的生理、生物和发育过程中起着重要作用,与昼夜周期和年周期同步。然而,我们对包括针叶树在内的裸子植物的生物钟及其调节知之甚少。在这里,我们展示了日本雪松的日转录组动态(日本柳杉粳稻(L.f)。D.Don)在活跃期(夏季)和休眠期(冬季)。
结果
微阵列分析显示夏季和冬季转录本存在显著差异,仅在夏季存在转录组日动态。芯片上约7.7%的独特基因(7254个中的556个)在夏季周期性表达。一些基因,特别是光相关基因的表达模式在日本杉中没有明显的振荡,因此与被子植物中报道的不同。对微阵列数据的基因网络分析揭示了一个与假定的核心时钟基因相关的网络(CjLHYa,CjLHYb,CjTOC1,CjGI和CjZTL),它们也被分离出来,这表明它们在转录组的昼夜调节中具有重要意义。
结论
本研究揭示了日本雪松在夏季转录组中存在核心时钟基因和昼夜节律。冬季昼夜节律的减弱表明昼夜节律随环境条件的变化而发生季节变化。数据还显示,与被子植物相比,松柏植物的基因表现出不同的表达模式,这表明松柏植物中存在独特的基因调控网络。本研究为了解针叶树的转录调控机制提供了基础数据。
背景
针叶树与其他植物物种一样,许多生理和生物过程与环境的昼夜周期同步,如光合作用、枝条伸长、高度生长和树苗的木质部压力势[1] - [4].在细胞水平上,观察到了木质部细胞径向生长、体积变化和细胞壁成分供应的每日动态[5] - [8].此外,原产于温带和北方地区的树木每年都有一个活跃-休眠周期,这影响了生理方面的生长,如高度和光合作用能力[3.],[9] - [14].这些昼夜和季节的变化被认为是在每天和全年变化的环境中生存和生长的重要特征。
转录组动态在植物的昼夜和季节适应中发挥重要作用,使其与环境变化同步,并可能受到时钟控制[15] - [17].光照变化引起的信号转导机制在被子植物模型中得到了很好的研究拟南芥.光信号通过感光感受器光敏色素和隐色素被感知和转导到时钟的中心振荡器,时钟的中心振荡器由三个互锁的反馈回路组成[18] - [21].第一个环,称为中心环,由TOC1 (CAB表达时间1,也称为PRR1或伪反应调节因子1),LHY(晚期延长下胚轴)和CCA1(昼夜节律相关1)组成TOC1启动子对生物钟的调节至关重要[22], TOC1抑制的表达LHY和CCA1[21],[23].第二个循环被称为早晨循环,由LHY、CCA1、PRR7和PRR9组成。LHY和CCA1诱导PRR7和PRR9的表达,PRR7和PRR9抑制LHY和CCA1的表达[24],[25].第三个环是evening loop,由GI (GIGANTEA)、TOC1和evening complex protein LUX (LUX心律失常)、ELF3和ELF4 (EARLY blossom 3和4)组成[21].GI的稳定性和TOC1的降解受蓝光受体ZTL (ZEITLUPE)的控制[26] - [28], ZTL蛋白在蓝光下被GI稳定[29].晚间复合体蛋白ELF3的活性受光的调控,通过泛素E3连接酶COP1 (CONSTITUTIVE phomorphphogenic 1)降解[21].一些转录本的表达动态受生物钟控制。根据实验和计算方法,有2 - 16%的基因被报道为昼夜节律调节拟南芥[30.] - [33].光合作用基因的表达高峰出现在主观白昼的中午,苯丙类生物合成基因的表达高峰出现在主观黎明之前[30.].编码淀粉动员酶的基因、与细胞伸长有关的基因和与激素有关的基因也受昼夜节律的调节[33],[34].
最近,的同源词CCA1,胃肠道,ZTL,PRR1是从针叶树中分离出来的挪威云杉,并对四种基因的异位表达进行了分析拟南芥表明该蛋白具有PaCCA1,四和PaZTL是部分保守的[35].这表明针叶植物中也存在三环网络。然而,Gyllenstrandet al。报告了生物钟基因的循环p .冷杉属在自由运行条件下,与大多数其他植物物种中时钟基因表达的观察结果相反[36].由于被子植物和裸子植物被认为是在3亿年前进化上分离的[37],如果针叶树有不同的控制机制,也不足为奇。在针叶树中,时钟及其与转录组昼夜动态的关系在很大程度上仍然未知。此外,虽然这种差异在多年生植物中可能发挥重要作用,但生长期和休眠期之间的昼夜转录组动态差异尚未得到广泛研究。
日本雪松(日本柳杉粳稻(L.f)。D.Don)是日本主要的林业树种。研究其转录组的昼夜和季节调节是了解环境适应机制的基础,也是推进研究受昼夜节律控制的重要特征(如木材形成、高度生长和开花)不可避免的。此外,从时钟进化的角度研究日本雪松很有趣,因为日本柳杉是裸子植物,是进化上古老的针叶树属,化石可追溯到白垩纪时期[38].在本研究中,我们重点研究了夏季(7月)和冬季(12月)的转录组日动态。我们首先收集了芽中表达基因的序列数据,使用三种不同的方法设计了日本雪松的微阵列(附加文件)1):建立了两个抑制消减杂交(SSH)文库和一个归一化互补DNA (cDNA)文库,以获得夏季白天和夜间表达基因的序列数据。进行了下一代测序(NGS)以获得全天和全年表达的基因的详尽序列数据。微阵列分析发现,在树木生长最快的夏季,转录组的日动态变化,而在树木休眠的冬季,转录组没有动态变化。对微阵列数据的基因网络分析揭示了针叶树转录本的时间调控的新见解,包括可能影响昼夜转录组动态的时钟基因。此外,我们还分离出核心时钟的假定同系物(LHY,CCA1,TOC1,胃肠道和ZTL)和感光基因,并确定了它们的表达模式和日本雪松在植物王国系统发育树中的位置。本研究为了解针叶树昼夜适应和季节适应的分子机制提供了基础基因表达数据。
结果
从日本雪松枝中采集序列数据并设计微阵列
构建了两个SSH文库和一个归一化cDNA文库,以获得夏季白天和夜间特异性表达的基因序列(附加文件1).通过从正午芽中分离的检测RNA中减去午夜芽中分离的驱动RNA,构建了一个包含正午表达基因的前向文库(SSH12)。通过从午夜芽中分离的检测RNA中减去正午芽中分离的驱动RNA,构建了一个含有午夜表达基因的逆向文库(SSH24)。SSH12和SSH24分别由595个和594个表达序列标签(est)组成,长度从89 ~ 799 bp不等,平均长度为488 bp。这些ESTs被组装成969个序列,其中33个contigs共享来自两个文库的ESTs。然而,我们在中午和午夜都没有发现明显上调的基因。BLASTX算法用于搜索每个序列的最高命中数拟南芥e-value cutoff为e-10的蛋白质数据库,从SSH12和SSH24中分别得到325条和354条经GO注释分类的EST序列(附加文件2A).标准化cDNA文库是从正午和午夜收集的芽中提取的RNA混合物构建的,以获得在夏季白天和夜间广泛表达的基因序列(附加文件1).共获得2653条cDNA序列,长度为149 ~ 828 bp,平均长度为655 bp。2653条cDNA序列被组装成2333条序列,其中包括264个contigs。GO分类使用2,653个序列中的2,133个注释序列进行(附加文件2B)。
对从昼夜和季节序列样本的芽中分离的RNA混合物进行NGS,以获得全天和全年表达的基因序列(附加文件)1).我们获得了116 Mbp的测序数据,以273,104个reads的形式,平均长度为426 bp,通过了GS RunProcessor的质量过滤器。修剪适配器序列,并从序列数据中删除短于50 bp的reads。随后,读取匹配拟南芥为了在组装前去除不必要的序列,在Sugi基因组数据库中注册的日本雪松的逆转录转座子和简单序列重复(SSRs)被排除在NGS数据中。在附加文件中说明了111 Mbp的265,962个读取的频率分布3.答:这些读取是作为在GS De Novo Assembler中运行的程序集输入的,265,962个读取被放置到7,613个contigs(超过100 bp)和45112个singletons中。进行进一步组装以预测假定的转录序列,7613个contigs被放入6890个isotigs中。isotigs的频率分布在附加文件中进行了说明3.B.用BLASTX预测等tigs和单子的基因描述,并对10275个命中唯一的NGS目标进行GO分类拟南芥附加文件中提供了e值截断值为e-10的基因id2C。
基于SSH和cDNA文库的序列和NGS等tigs设计了微阵列探针。长度为>400 bp的NGS单例与任意单例同源性较高拟南芥e值阈值为e-40的基因,命中到的单子拟南芥与昼夜节律、光合作用或激素相关的基因被列在KEGG途径中(京都基因和基因组百科全书,http://www.genome.jp/kegg/pathway.html),没有任何e值截断,优先选择作为探测候选。从已验证的候选序列中剔除相同序列(序列同一性>95%,重叠>90%),最终设计了由4个探针组组成的微阵列,对应15728个序列(目标)。包含15,728个序列的原始库的摘要在附加文件中1.
转录组概述
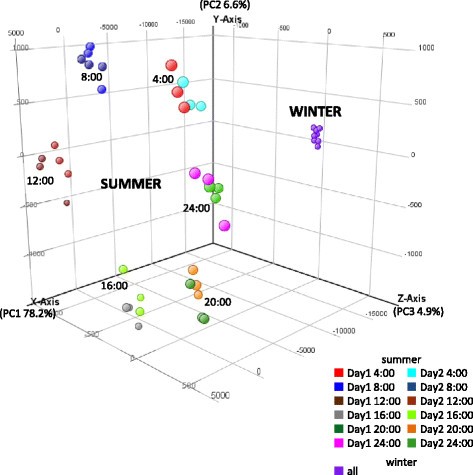
夏季(7月30日、31日),从4时起每隔4小时采集一次幼苗样本,共采集2天(12个时间点)。我们在每个时间点从三个岩屑中收集样本作为生物复制。所有36个夏季样本都使用微阵列进行分析,并根据采样时间分为12类。选取8份冬季样品(12月22日4:00/8:00/12:00/16:00/20:00/24:00,12月23日12:00/24:00,无重复)进行微阵列分析。由于在12:00到24:00之间没有靶标出现显著差异,我们估计冬季的表达变化非常小或没有周期性变化,所有冬季样本的数据被分组在一起。对13个组(12个夏季组和1个冬季组)的所有可能组合进行了比较,观察到14,342个靶点,对应于6,838个独特基因,在一个或多个组中显著差异表达。对6838个独特基因的主成分分析(PCA)表明,夏季和冬季的转录组差异主要由主成分1 (PC1, 78.2%)表示,夏季的日转录变化主要由PC2(6.6%)和PC3(4.9%)表示1).
夏季循环基因的鉴定与聚类
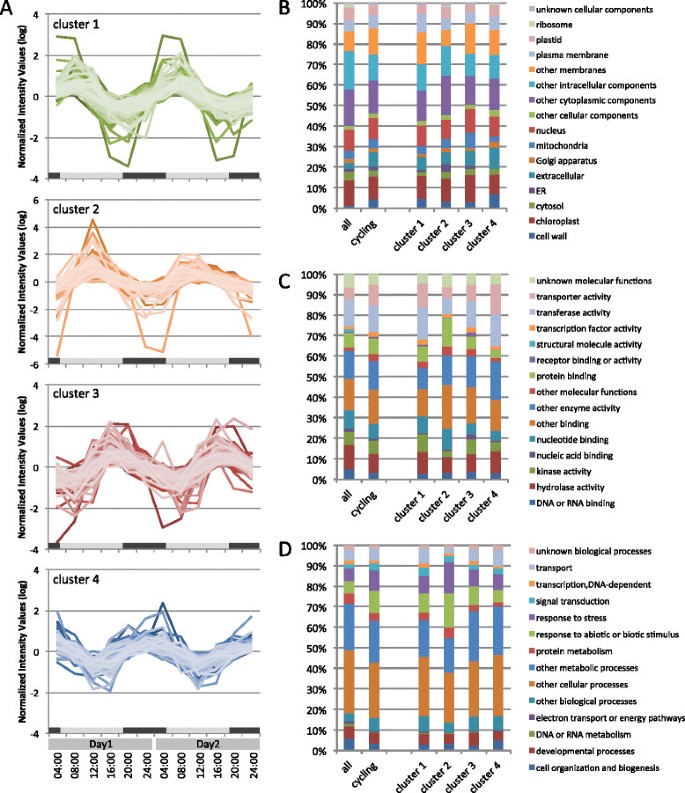
使用GeneCycle软件包进行统计分析[39]表明微阵列上的999个目标在1天周期内周期性地表达,在夏季有两倍的差异(附加文件4).在999个靶点中,817个靶点对应556个独特基因(占微阵列中独特基因的7.7%)通过BLASTX分析被注释拟南芥蛋白质,而其他182个目标则不是。根据峰谷振幅的折叠变化排序,核心时钟基因的靶点(LHY,PRR7和胃肠道)在前10名之内(附加文件4).热休克蛋白,叶绿素的假定基因a / b结合家族蛋白(ELIP1和ELIP2)、牙本质涎磷蛋白相关蛋白、循环CDF因子2 (CDF2)和B-box型锌指家族蛋白也出现较大振荡,变化超过15倍。在前100个目标中有27个未注释的目标。GO分析表明,556个循环基因在“细胞壁”(4.3%)和“细胞外”(7.2%)细胞成分类别中功能的基因比例比微阵列上的整套基因高两倍多(图2)2B).根据表达模式的相似性将556个循环基因分为4个聚类,每个聚类由早晨(聚类1)、中午(聚类2)、晚上(聚类3)和晚上(聚类4)表达高峰的基因组成(图2A、附加文件5).比较单元组件类别中的集群(图2B),簇4包含较高比例的“细胞壁”相关转录本(7.0%),其他簇包含3.1 - 4.4%。聚类3包含更高比例的ER功能基因(3.6%),而其他聚类包含高达1.4%。聚类3中“线粒体”功能基因的比例(7.6%)是聚类4(2.4%)的三倍多。在分子函数类(图2C),集群1和集群4包含的与“转运蛋白活性”相关的基因(分别为11.6%和14.5%)大约是集群2(5.3%)的两倍,集群2包含的“蛋白质结合”类别的基因(13.9%)大约是集群4(3.3%)的四倍。在生物过程范畴(图2D),聚类2包含更多的“对非生物或生物刺激的反应”(16.5%)和“对压力的反应”(15.1%)功能的基因,而与“运输”相关的基因(2.8%)比其他聚类少。
夏季基因网络
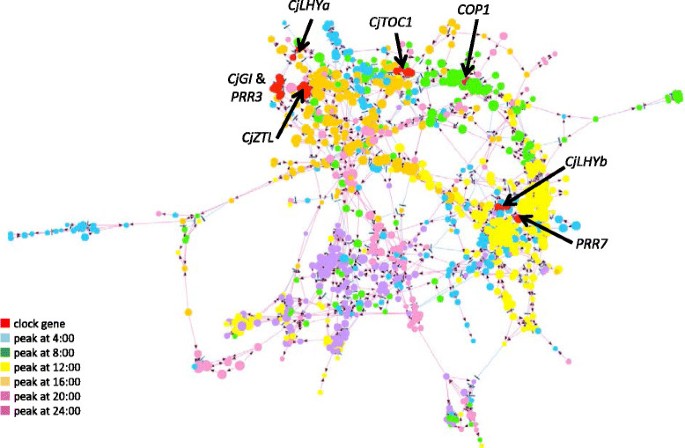
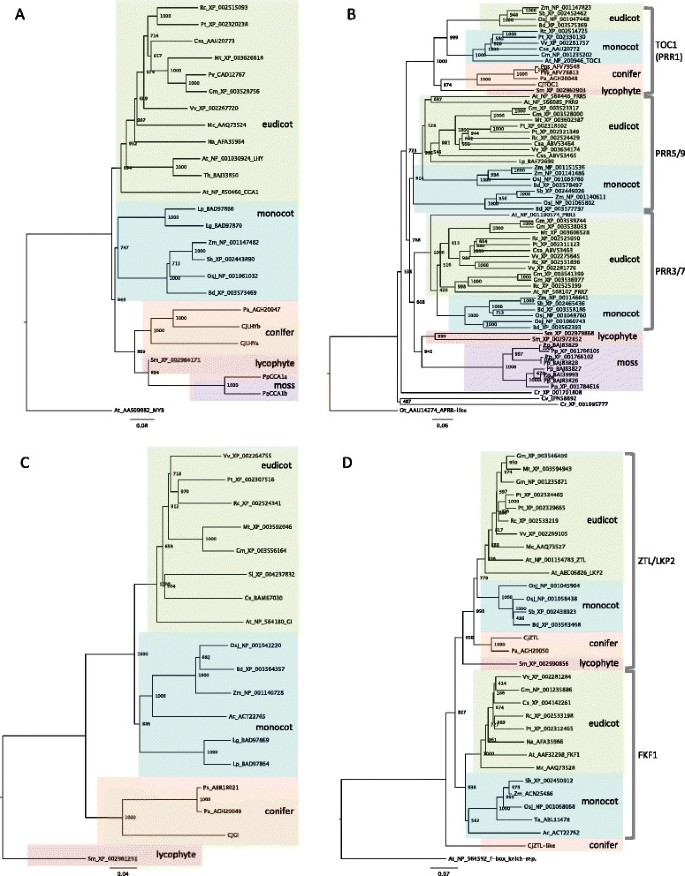
利用36个夏季样本归一化数据集中变异系数最高的1000个目标进行基因网络分析(附加文件)6).我们发现这1000个靶点组成了一个基因网络。具有大量儿童的靶点可能是转录调控的核心基因。顶部BLASTX命中陪伴DNAJ结构域超家族蛋白的靶点拥有最多的子代靶点(128个),其次是命中DNAJ热休克n端结构域含蛋白的靶点(123个靶点,附加文件6).另外50个靶点,如脱氧木酮糖-5-磷酸合成酶(CLA1)、母体效应胚胎阻滞14 (MEE14)、西格玛因子E (SIGE)、丙酮酸磷酸二激酶(SEX1)、细胞色素P450家族成员(CYP76C3)和CDF2的假定基因也有超过50个子代(附加文件)6).为了获得更可靠的数据,我们从整个基因网络中提取了2,604条显示自举概率高于0.7的边和886个对应于447个独特基因的相关目标(图3.).网络文件可从附加文件中获取7.我们关注的时钟基因是新的概念框架的组成部分拟南芥时钟由Pokhilko提供et al。[21].分离出的五个基因(CjLHYa,CjLHYb,CjTOC1,CjGI和CjZTL)和推定PRR3,PRR7和COP1提取的基因网络包括e值分别为9e-42、7e-82和3e-75的基因。虽然PRR3不被认为是会员拟南芥Pokhilko设计的时钟框架et al。,我们包括PRR3在日本雪松中,由于PRR家族的功能在针叶树中仍然未知。在估计的网络中,四个时钟基因(CjLHYa,CjGI, CjZTL和假定的PRR3)在基因网络中位置接近。CjLHYa和假定的PRR3直接的子基因是CjGI自举概率分别为0.739和0.942。CjZTL是编码DNA/RNA聚合酶超家族蛋白的基因(HI9HAF202CL26P, e-value 3e-44)的子基因,该基因是CjGI.这两个时钟基因,CjLHYb和假定的PRR7都是……的孩子绪论3(isotig03899, e-value 7e-82)和伴侣dnaj结构域超家族蛋白基因(isotig00872, e-value 4e-24)。CjLHYb是未注释目标SSH24-3-25_002_A04的子目标,而SSH24-3-25_002_A04是PRR7.
夏季和冬季转录组差异
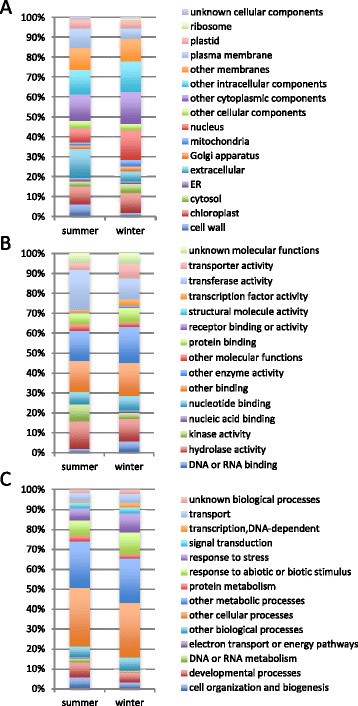
通过比较夏季和冬季的微阵列数据,不考虑采样时间,13318个靶标的表达水平存在显著差异。其中,与759个独特基因对应的1329个靶点显示了4倍以上的差异,其中475个基因在夏季上调,284个基因在冬季上调。附加文件中列出了前100个差异表达目标8.四氰蛋白8 (TET8)、葡萄糖-甲醇-胆碱氧化还原酶家族蛋白、膨胀蛋白A8 (EXPA8)和过氧化物酶超家族蛋白(RCI3)的推测基因在夏季上调了200倍以上,而含BURP结构域蛋白(RD22)和ELIP1的推测基因在冬季上调了200倍以上。GO分类显示细胞成分类中与“细胞外”(14.5%)和“细胞壁”(6.0%)相关的基因所占比例(图4A),在分子功能类别中具有“激酶活性”(8.7%)(图4B),并且“DNA或RNA代谢”(2.1%)属于生物过程类别(图4C)夏天的面积是原来的两倍多。另一方面,“细胞核”(14.9%)和“线粒体”(3.4%)在细胞成分类别(图4A),“转运蛋白活性”(7.3%),“DNA或RNA结合”(5.8%)和“转录因子活性”(2.9%)在分子功能类别(图4B),生物过程类别中的“转录,dna依赖”(2.1%)在冬季占比超过两倍(图4C)。
日本雪松感光基因和时钟相关基因的鉴定
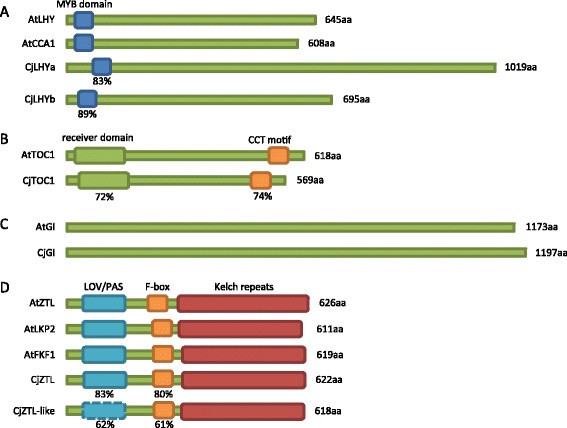
我们从日本雪松中分离到6个时钟基因同源体。的两个同系物LHY和CCA1被命名为CjLHYa和CjLHYb[日本DNA数据库(DDBJ): AB894539和AB894540]。它们在单个myb结构域中表现出高度同源性[40)与拟南芥LHY在氨基酸水平(分别为83%和89%,图5A)和苔藓中的两个同系物Physcomitrella金属盘, PpCCA1a和PpCCA1b(89%至100%,附加文件9) (41].而其他区域的氨基酸序列差异较大。我们利用植物LHY和CCA1同源物的氨基酸序列构建了系统发育树(图2)6A).种子植物的基因分为真子叶、单子叶和针叶三个簇,其中CjLHYa和CjLHYb位于针叶簇内。的同音词拟南芥TOC1为日本雪松的PRRs成员,命名为CjTOC1 (e-value 6e-77) [DDBJ: AB894541]。受体结构域和CONSTANS/CONSTANS- like /TOC1 (CCT)基序的氨基酸序列同一性[42]的比例分别为72%和74%(图5B、附加文件9B).植物prr的系统发育树显示由PRR1、PRR3/PRR7和PRR5/PRR9同源物组成的三个簇(图6B). CjTOC1属于与其他针叶树同源的PRR1簇,p .冷杉属,抗旱性和松果体松树。从日本雪松中分离得到的CjGI氨基酸序列与日本雪松的GI序列具有较高的同源性拟南芥和一个石松(卷柏moellendorffii) GI, e值为0.0 [DDBJ: AB894538](附加文件9C). GI的系统发育树显示了由单子叶、真子叶和针叶树同源体组成的三个集群(图6C).分离出的CjGI属于一个针叶树类群p .冷杉属和云杉sitchensis.CjZTL与CjZTL样具有较高的氨基酸序列相似性拟南芥ZTL,两者的e值都为0.0 [DDBJ: AB894543和AB894542](附加文件9D). LOV/PAS域与F-box域的同源性[43]对CjZTL和类CjZTL分别为83%和80%,对CjZTL-like为62%和61%拟南芥ZTL(图5D).通过Pfam数据库的域搜索,在CjZTL和CjZTL-like中也检测到6个kelch重复序列,阈值e-10。我们用其他蓝光受体LKP2 (LOV KELCH PROTEIN 2)和FKF1 (FLAVIN BINDING, KELCH REPEAT, F-BOX)构建了系统发育树。植物的ZTL/LKP2/FKF1基因被分为ZTL/LKP2和FKF1两组6D). CjZTL属于ZTL/LKP2类群,CjZTL-like从两个类群中分离出来。
LHY和CCA1 (A), TOC1 (B), GI (C), ZTL, LKP2和FKF1 (D)的结构域结构拟南芥(在),日本柳杉粳稻(Cj)。每个结构域的氨基酸相似度以百分比表示。CjLHYa和CjLHYb均与AtLHY比较,CjZTL和CjZTL-like与AtZTL比较。Pfam搜索在cjztl样(折线)中未检测到LOV/PAS结构域。NCBI的接入编号拟南芥蛋白包括NP_001030924 (AtLHY)、NP_850460 (AtCCA1)、NP_200946 (AtTOC1)、NP_564180 (AtGI)、NP_001154783 (AtZTL)、AEC06826 (AtLKP2)和AAF32298 (AtFKF1)。
植物LHY和CCA1 (A)、PRR家族(B)、GI (C)、ZTL、LKP2和FKF1 (D)的系统发育分析邻接法[77]来构建系统发育树。日本雪松分离的基因名称(日本柳杉粳稻)从Cj开始。其他种名缩写如下:Ac,洋葱(洋葱);在,拟南芥(thale水芹);双相障碍,Brachypodium distachyon(紫假雀梅);铬、衣藻reinhardtii(绿藻);计算机科学,菊花seticuspef。boreale(菊花);Csa,齿栗叶的可能(栗);简历,衣藻摘要(绿藻);通用,大豆(大豆);Lg、浮萍属gibba(凸浮萍);Lp,浮萍属paucicostata(浮萍);Mc,Mesembryanthemum crystallinum(共同iceplant);太,Medicago truncatula(桶医生);Na,烟草attenuata则(狼烟草);不,Ostreococcus金牛座的(picoplankton);Osj,栽培稻(日本大米);爸爸,挪威云杉(挪威云杉);页,Physcomitrella金属盘无性系种群。金属盘(苔藓);聚苯硫醚、松果体松树(海上松树);Ps,云杉sitchensis(西加云杉);小组,抗旱性(欧洲赤松);Pt,杨树trichocarpa(黑色的棉白杨);Pv,菜豆(菜豆);钢筋混凝土,萝藦(蓖麻);某人,高粱二色的(高粱);Sl,茄属植物lycopersicum(番茄);Sm,卷柏moellendorffii(lycophyte);助教,小麦(面包小麦);Th,Thellungiella halophila(盐沟);Vv,葡萄(酿酒葡萄);Zm评选,玉米(玉米)。物种名称后面的数字表示其NCBI加入号。PpCCA1a和PpCCA1b的氨基酸序列均来自Okadaet al。[41].拟南芥MYB蛋白AAS09982,o .金牛座的apr样蛋白(AAU14274),美国moellendorffiiGI蛋白(XP_002961231)和拟南芥以F-box kelch-repeat蛋白(NP_564592)为各系统发育树的外群。
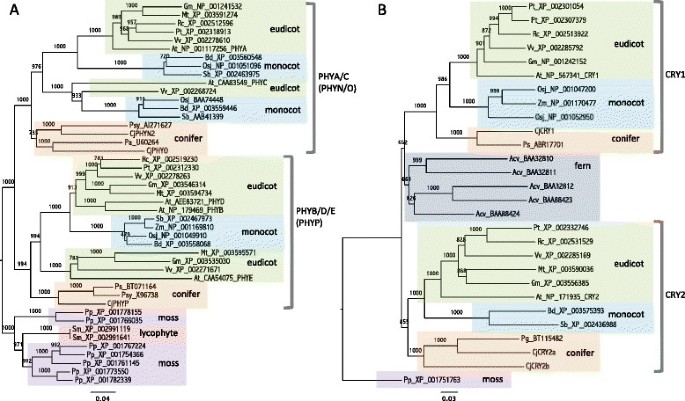
三个光敏色素基因的全长序列[DDBJ: AB894547 (CjPHYN2), ab894548 (CjPHYO)及AB894549 (CjPHYP)]和三个隐花色素基因[DDBJ: AB894544 (CjCRY1), ab894545 (CjCRY2a)及AB894546 (CjCRY2b)]是从日本雪松中分离出来的。三者均表现出较高的同源性拟南芥光敏色素(e值0.0)。CjCRY1高度同源拟南芥CRY1 (e-value 0.0)与CjCRY2a、CjCRY2b高度同源拟南芥在氨基酸水平上,CRY2 (e值分别为e-176和0.0)。利用植物光敏色素氨基酸序列的系统发生树显示,种子植物从苔藓和石松植物分化后,种子植物的基因聚集成PHYA/C和PHYB/D/E两组(图7A)。CjPHYN2和CjPHYO属于PHYA/C集群,CjPHYP属于PHYB/D/E集群。隐色植物的系统发育树显示,种子植物的基因分为CRY1和CRY2两个簇,蕨类隐色植物形成了一个独特的簇(图2)7B).种子植物CRY1和CRY2的聚类分为三组,包括真子叶、单子叶和针叶树。CjCRY1被归为CRY1簇,CjCRY2a和CjCRY2b被归为CRY2簇。
植物光敏色素(A)和隐花色素(B)基因的系统发育分析。邻接法[77]来构建系统发育树。日本雪松分离的基因名称(日本柳杉粳稻)从Cj开始。其他种名缩写如下:Acv,铁线蕨capillus-veneris(蕨类植物);在,拟南芥(thale水芹);双相障碍,Brachypodium distachyon(紫假雀梅);通用,大豆(大豆);太,Medicago truncatula(桶医生);Osj,栽培稻(日本大米);爸爸,挪威云杉(挪威云杉);Pg,云杉glauca(白云杉);页,Physcomitrella金属盘无性系种群。金属盘(苔藓);Ps,云杉sitchensis(西加云杉);小组,抗旱性(欧洲赤松);Pt,杨树trichocarpa(黑色的棉白杨);钢筋混凝土,萝藦(蓖麻);某人,高粱二色的(高粱);Sm,卷柏moellendorffii(lycophyte);Vv,葡萄(酿酒葡萄);Zm评选,玉米(玉米)。物种名称后面的数字表示其NCBI加入号。用苔藓和石松的光敏色素和隐花色素来生根。
生物钟相关基因转录的昼夜节律
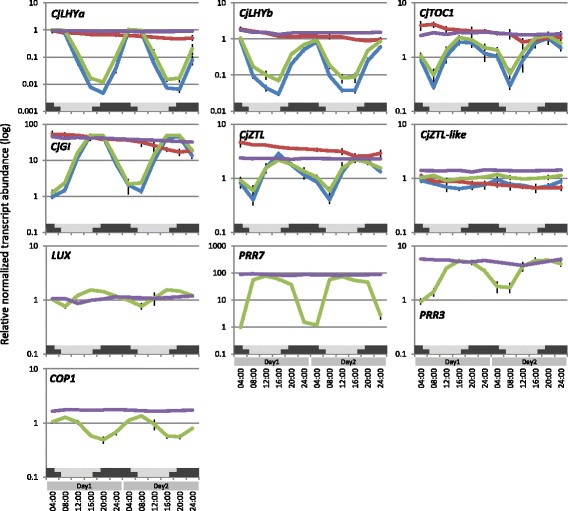
我们通过定量PCR (qPCR)分析了本研究中分离出的12个假定的时钟相关和光受体基因的转录本的表达模式,以估计微阵列数据的可靠性。使用这两种技术进行表达分析得到了非常相似的结果(上调或下调)8,附加文件10),说明本研究获得的数据是可靠的。基因芯片和qPCR数据显示,在表达上有明显的振荡CjLHYa,CjLHYb,CjTOC1,CjGI和CjZTL在夏天,除了CjZTL-like(图8).pu推定的转录水平勒克斯(e-value 3e-42),一种晚复合蛋白[21],在16:00达到峰值(图8).推定的PRR成员基因PRR3和PRR7也显示了日表达模式。推定的转录水平PRR78:00 ~ 20:00为最大值PRR3在16:00达到峰值,随后下降(图8).转录水平推定COP1在8:00达到峰值(图8).在冬季,核心时钟基因的转录水平没有振荡(图8).表达水平CjLHYa,CjLHYb,CjTOC1,CjGI,CjZTL,PRR7,PRR3和COP1冬季表达量与夏季表达量相近。在分离出的六个感光基因中,只有CjPHYP和CjCRY1显示出小振幅的日振荡,在4:00达到峰值(附加文件10).通过比较夏季和冬季之间的转录水平,而不考虑采样时间,我们观察到的转录水平增加了4倍以上CjCRY2a冬日里的表情。
利用微阵列和qPCR技术分析了夏季(2012年7月30-31日)和冬季(2011年12月22-23日)相对转录本丰度的日变化。夏季样品的芯片数据(绿线)和夏季(蓝线)和冬季(红线)样品的qPCR数据代表了12个时间点的3个生物重复的平均值。冬季样品的芯片数据(紫色线)来自8个选定的时间点(第1天的4:00/8:00/12:00/16:00/20:00/24:00和第2天的12:00/24:00),没有生物复制。将每个时间点的数据与2012年7月30日4:00的嫩枝数据进行比较。下图中的灰色和黑色柱状图分别代表了夏季(上)和冬季(下)的自然昼夜长度(从日出到日落之间测量),由日本国家天文台提供。在这项研究中分离出的基因名称中有前缀“Cj”。
讨论
通过微阵列数据的主成分分析,可以清楚地证明夏季转录组日动态的存在(图1).约7.7%的独特基因(7254个中的556个)显示出峰值到低谷振幅的两倍以上的昼夜节律(附加文件)5).虽然使用了不同的计算程序来检测循环基因,但循环基因的比例几乎相同(2,608个中的217个,或8%)桉树据报道,在早春时在田间种植[44].在杨树在树木中,微阵列上18%的基因表现出受日影响的表达模式[45].另一方面,在日本雪松中显示出明显振荡且日振幅差异超过两倍的182个目标没有BLASTX命中拟南芥蛋白质(附加文件)4).这些目标可能包括针叶树特有的基因,这些基因参与了昼夜节律的独特调节。
我们根据556个循环基因的表达模式将其分为4个聚类,每个聚类中GO类的比例不同(图2).这可能是昼夜转录组动态与生理和生物条件昼夜变化之间关系的一个指示。日本雪松的高度增长率在正午之后开始增加,在黎明左右达到峰值,随后下降(补充文件)11C).日本雪松生长模式的昼夜节律与Gyokusen [4],并与报道的分化细胞的体积变化一致[7].Hosooet al。报道了向发育中的第二壁供应细胞壁成分的日周期性与光周期周期中光强度的变化有关[7].我们的微阵列数据表明,相对于微阵列上的所有基因(1.2%),与细胞壁组分相关的基因在循环基因中所占的比例(4.3%)不成比例,并且在夜间这一比例有所增加(图2)2B).在本研究中,三个编码与细胞增大和细胞壁变化有关的扩张素的基因振荡并在中午达到峰值表达(聚类2,附加文件5).假定的编码木葡聚糖内转葡萄糖酶/水解酶的基因在细胞生长中也起着重要作用,也发生了振荡,但表达的峰值时间有所不同(附加文件5).在拟南芥,被认为负责激素生物合成和信号转导的激素相关基因在一天中下胚轴生长速度最大的时间共表达,即在短日照条件下的早晨[46].为了确定日本雪松是否存在同样的现象,我们分析了代表激素生物合成和信号通路的激素相关基因的表达模式:Michael等人列出的植物激素基因。[44], KEGG数据库中列出的激素信号通路相关基因,以及RIKEN植物激素研究网络中列出的激素合成途径基因(http://hormones.psc.riken.jp).在556个循环基因中,22个可能与生长激素(生长素、赤霉素、细胞分裂素和油菜素类固醇)有关的基因显示出昼夜节律(附加文件)5).在这22个基因中,有16个属于聚类1或聚类22A、附加文件5).这一结果表明,大多数生长激素相关基因的表达高峰出现在上午到中午,但日本雪松的生长速度在晚上最高,而不是在晚上拟南芥(附加文件11C) (4],[7],[46].
根据GO注释,许多被归类为“应激反应”和“非生物和生物刺激反应”的基因在中午达到峰值表达(图2D簇2).实验期间夏季温度接近30℃,光合有效辐射超过2000 μmol/m2/sec正午(其他文件11A和B),树木可能受到了压力。热休克蛋白作为分子伴侣来帮助应对热应激,超过20个假定的基因显示出周期性的转录水平,大多数在中午达到峰值表达(图2集群2,附加文件5).植物激素脱落酸(ABA)和乙烯被认为是胁迫信号通路之间相互作用的重要组成部分。在日本雪松中,11个推定的aba相关基因受到了日调节,包括推定的同源基因,这些基因也由干旱胁迫诱导拟南芥(CYP707A3,CYP707A4,NCED3) [47] - [49],其中6个在白天达到峰值表达(图2集群2,附加文件5).乙烯受体ERS1(乙烯响应传感器1)和ETR1(乙烯传感器1)的推测基因在早晨有峰值表达(图2集群1,附加文件5).还有,表达ERF6(乙烯响应元件结合因子6),是植物叶片在限水条件下生长的中心调节因子拟南芥[50],在晚上上调(图2集群3,附加文件5).卡温顿et al。研究了昼夜节律微阵列数据,揭示了植物激素和多种应激反应途径受到昼夜节律钟的影响[34].超过40%的aba诱导基因受到昼夜节律的调控拟南芥,这些基因中的大多数在早晨达到转录峰值水平拟南芥.此外,在各种应激条件下(如强光、干旱或极端温度)氧化应激或活性氧产生诱导的基因中,34%是由时钟调节的[34].仅从这项研究很难知道日本雪松中这些与压力相关的基因的表达是由环境线索还是生物钟的综合控制的。然而,日本雪松调节应激相关基因的转录,这可能有助于适应恶劣的白天环境。
我们观察到,在夏季连续两天出现表达变化的基因是一个大网络的一部分,这表明它们的表达是密切协调的。为了得到更可靠的结果,我们从整个基因网络中提取了显示出0.7以上自举概率的网络边及其相关目标(图3.,附加文件7).虽然还需要进一步的研究来评估这一网络,但这一研究为选择在针叶树昼夜转录组动态调控中起重要作用的基因提供了许多线索。在这个提取的网络中假定的核心时钟基因的存在表明了它们在转录组的昼夜调节中的重要性。分离出的五个基因(CjLHYa,CjLHYb,CjTOC1,CjGI和CjZTL),它们被预测为同源的拟南芥核心时钟基因,因为它们在系统发育树中的位置和它们域的相似性(图5和6)均包含在提取的网络中。日本雪松的每一种同系物都与日本雪松构成了一个针叶丛p .冷杉属Karlgren报道et al。[35].的表达模式(早晚上调或下调)CjLHYa,CjLHYb,CjTOC1和CjGI(图8)的结果与拟南芥根据莫克勒实验室网站上的每日数据库,唐纳德·丹福斯植物科学中心(http://diurnal.mocklerlab.org).两个同源基因,CjLHYa和CjLHYb,氨基酸序列同源性高;然而,它们的转录表达模式略有不同。而抄本CjLHYa四点到八点是高峰,CjLHYb4时达到峰值,8时开始下降(图8),而转录水平CjLHYa显示最大值和最小值之间有超过100倍的差异CjLHYb只有10倍的差异。基因网络分析表明,这两个同源基因位于不同的位置(图3.),并提出它们可能在网络中扮演不同的角色,在不同的时间调节不同的基因。蓝光受体基因ZTL是构成性表达,但在蛋白质水平上显示昼夜波动拟南芥[51].同时,PaZTL在p .冷杉属在光/暗周期下不会振荡[36].然而,我们观察到CjZTL日本雪松的转录本振荡(图8),亦为EtZTL在桉树在野外条件下McZTL在冰厂(Mesembryanthemum crystallinum)在光/暗循环及自由运行条件下[44],[52].另一种蓝光受体,FKF1,是转录本水平的时钟调控,而LKP2不在拟南芥[53],[54].由于这些基因的表达模式(振荡与否)没有系统发育关系(图6D),它们表达的差异可能是由进化过程中发生的独立事件造成的。或者,表达的差异可能是由环境或发育条件的差异引起的。
有趣的是,在日本雪松中,大多数光感受器基因和光合作用相关基因没有显示出任何显著的振荡10),尽管光是影响昼夜节律的最重要因素之一,而且大多数这类基因在被子植物中表现出昼夜或昼夜节律的表达模式。在拟南芥,光感受器光敏色素和隐色色素通过将光信号转导到核心时钟而参与设置时钟,所有的光感受器基因都受到时钟的调节[55].的序列CjPHYO和CjPHYP的部分序列同源性高phyO(AJ286622)和phyP(AJ286623)的日本雪松[56].然而,顺序的CjPHYN2不匹配phyN1(AJ286624),正如Schmidt和Schneider-Poetsch所报道的[56].由于独立复制导致了两份拷贝PHYN在针叶树中除了松科[57),CjPHYN2可能是另一本PHYN.表达分析表明,3个光敏色素基因中,仅有CjPHYP以小幅度振荡(附加文件10).此外,在三个分离的隐色素基因中,只有CjCRY1以小幅度振荡。振荡光感受器CjPHYP和CjCRY在基因上与其他同系物不同,它们没有振荡(图7).编码叶绿素的基因a / b-结合多肽的光收集系统(Lhca / b,也叫出租车)是由某些植物的生物钟所控制的[58] - [61].11Lhca / b基因在拟南芥揭示昼夜节律[30.,一共19个Lhca / b番茄的基因(茄属植物lycopersicum)显示昼夜节律的表达[59].同时,奇迹苔藓原丝体细胞中的mRNAp .金属盘和LHCA1绿藻中的信使rna衣藻reinhardtii在明暗循环中振荡[60],[61].我们从日本雪松的NGS序列中获得了13条完全开放阅读框(ORF)序列,这些序列与日本雪松的NGS序列具有较高的相似性拟南芥Lhca / b基于顶部BLASTX命中的基因(附加文件12).13个序列的e值均低于5e-74。用同源物构建了系统发育树拟南芥、日本大米、石松(美国moellendroffii)和苔藓(p .金属盘),使用的不同亲戚Lhca / b基因在拟南芥,ELIP1,ELIP2[62,作为一个外群体。该树表示由13组组成的12个集群,Lhca1到6,Lhcb1到7(附加文件12).一两个大型强子对撞机日本杉的基因除Lhcb7外,其余均可归为各类群。虽然是截然不同的亲戚Lhca / b的基因,ELIP1,ELIP2[62],显示明显的振荡(附加文件4:表S4),只有8个中的4个奇迹基因(CjLHCB1b,CjLHCB3,CjLHCB4a和CjLHCB6)显示每天都有振荡,但振幅很小,而且没有一种Lhca基因振荡。在日本雪松中,编码光系统I和II反应中心的基因并没有发生超过两倍的变化拟南芥[30.].的phyD苔藓的基因也有昼夜节律,高峰出现在光相[63].在针叶树中,光合基因的光不依赖性表达似乎是一种普遍现象[64].奇迹和公安局花旗松的A(光系统II亚基A) mRNA水平在光照/黑暗周期下只有很小的昼夜波动,在持续光照或黑暗条件下没有昼夜节律。Pseudotsuga menziesii) [65].通过对深色生长的幼苗进行分析,发现奇迹基因已被证明出现在各种针叶树物种的黑暗中[64] - [69].黑生植物中PHYA/ c相关基因的表达p .冷杉属也有报道称,有树苗[69].这些光相关基因在针叶树中的调控机制可能与被子植物不同。
微阵列数据显示了夏季和冬季之间大量的转录变化(图1).在“发育过程”和“细胞组织和生物发生”中起作用的基因在夏季上调(图4),包括与赤霉素相关的基因(赤霉素调控家族蛋白和GA要求3)和与细胞分裂和伸长相关的基因(细胞周期蛋白、扩张蛋白和木葡聚糖内转葡萄糖酶/水解酶)(附加文件)8).在冬季,碱性几丁质酶、渗透素、ELIP1和胚胎发生晚期丰富蛋白14 (LEA14)基因的表达,被报道为抗寒性的标志p的抗旱性[70],也被诱导(附加文件8).在冬季没有检测到昼夜转录组动态,核心时钟基因的转录构成性较高(图8).在栗子中也观察到生物钟基因的冬季中断(齿栗叶的可能) [71],[72].据报道,低温(4°C)降低了时钟组件的周期振幅拟南芥而板栗,输出基因的周期被抑制或中断拟南芥[72],[73].冬季的日本雪松也可能出现类似的现象。在拟南芥,核心时钟成分CCA1和LHY调控CBF (C-REPEAT BINDING FACTOR)通路的表达,该通路在植物中高度保守,在植物抗冻性中起主要作用[74].减少表达LHY基因通过RNA干扰降低抗冻性杨树树(16].时钟基因的表达可能会受到季节环境变化的影响,因此,可能会导致下游通路的激活,从而有助于抗冻性,这对树种在冬季的生存至关重要。
结论
直到最近,对植物昼夜机制的研究都集中在模式种上拟南芥,而被子植物以外的数据有限。据我们所知,这项研究是对裸子植物日间转录组动态的首次探索。基因芯片分析显示,夏季和冬季转录组动态差异显著。它还显示了夏季转录组的日动态,并揭示了微阵列上7.7%的基因有节奏地表达,而在冬季这种节奏被打乱了。夏季周期基因与核心时钟基因构建了一个基因网络,这可能有助于适应昼夜环境变化。夏季,激素相关基因在上午至中午有上调的趋势,应激相关基因在中午有上调的趋势。这些结果表明,转录本随着采样时间的不同而不同,转录分析应考虑收集时间,因为它可能会影响结果。系统发育分析表明,针叶树与被子植物具有不同的时钟基因。针叶树可能包含独特的昼夜调节机制。有趣的是,与被子植物不同,日本雪松的光感受器和光合作用相关基因没有明显的振荡。 We also identified 182 cycling targets (sequences) that did not have BLASTX homologues in拟南芥.这些蛋白质可能在控制针叶树特有的昼夜节律中发挥重要作用。裸子植物的独立研究是必要的,本研究为了解针叶树的昼夜转录调控提供了基础数据。
方法
植物材料及RNA提取
为了图书馆的建设,样本采集自2008年在林业和林产品研究所(日立,茨城市,日本)森林树木育种中心(FTBC)种植的日本雪松(当时有2年树龄)。为了构建SSH和cDNA文库,分别于2010年6月2日中午(12:00)和午夜(24:00)从相同的4个个体(共8个样本)中采集芽。从三个不同的分支收集的10°Cm长的侧枝尖的混合物被称为芽样。对于NGS,于2011年7月2日4点至24点每隔4小时从3个个体(共8个样本)中采集日时间序列样本。在每一个时间点(共24个样本),分别于10点(2010年12月27日,2011年2月4日,4月4日,5月20日,7月11日,8月24日,10月7日,11月22日)采集3个个体的季节性时间序列样本。季节性时间序列的所有样本均来自不同个体。
为了构建微阵列,从36株盆栽3年扦插中收集qPCR和RACE (cDNA末端快速扩增)样本,并放置在FTBC的室外位置。分别于冬季(2011年12月22日4:00 - 12月23日24:00)和夏季(2012年7月30日4:00 - 7月31日24:00)采集2天,每4小时采集一次茎叶样本。根据日本国立天文台网站(http://eco.mtk.nao.ac.jp/cgi-bin/koyomi/koyomix.cgi).我们在每个时间点从三个岩屑中收集样本作为生物复制。所有样品都是从不同的岩屑中采集的。气温、光合有效辐射和树高生长的日变化在附加文件中给出11.
所有样品立即冷冻在液氮中,保存在-80°C,直到使用。从500 mg样品中提取总RNA作为Gehriget al。报告(75]使用RNeasy Plant Mini Kit (Qiagen, Hilden, Germany)或RNeasy Midi Kit (Qiagen),并使用RNase-free DNase Set (Qiagen)在柱上进行DNase消化。使用NanoDrop 1000分光光度计(Thermo Scientific, Waltham, MA, USA)精确测量RNA浓度。RNA完整性由Agilent 2100生物分析仪(Agilent Technologies, Mississauga, ON, Canada)进行评估,仅使用RNA完整性数高于8的总RNA。
图书馆建设
使用Clontech PCR-Select cDNA Subtraction试剂盒(Takara Bio, Shiga, Japan)构建了两个SSH文库。从四个个体的样本中提取的总RNA被等量汇集,一个池用于中午提取的样本,一个池用于午夜提取的样本,生成的混合物中100 ng用于文库建设。将午夜芽中分离到的驱动RNA与正午芽中分离到的检测RNA相减,构建正向文库(SSH12)。用午夜芽中分离到的检测RNA减去中午芽中分离到的驱动RNA,构建了一个反向文库(SSH24)。SSH产物使用QIAquick PCR纯化试剂盒(Qiagen)进行纯化,并连接到pT4 Blue t载体(Novagen, Los Angeles, CA, USA)。蓝/白选择在含有氨苄西林、异丙基- d -硫半乳糖苷和x -半乳糖的板上进行。随机选择克隆,使用与载体序列匹配的U19引物单次测序。每个文库使用ABI PRISM 3130遗传分析仪(应用生物系统公司,福斯特城,CA, USA)对864个克隆进行测序。使用Sequencher 4.10.1版本软件(Gene Codes Corp., Ann Arbor, MI, USA)对得到的序列进行手动修剪和编辑,以识别用于SSH过程的克隆载体序列、poly(A)序列和适配器序列以及低质量序列的区域。选择长度大于89 bp的优质序列进行进一步分析。 A total of 1,189 EST sequences were submitted to DDBJ [HX950378 through HX951566].
标准化cDNA文库使用总RNA混合物构建,该混合物由从正午和午夜收集的相同四个个体的样本中分离出的等量总RNA组成。使用Oligotex-dT30
NGS是使用日序列和季节序列的RNA混合物进行的。首先,从18个日时间序列样本和24个季节时间序列样本中分离出的总RNA分别混合在不同的池中。随后,将昼夜和季节总RNA混合物按等比例混合,作为RNA样本。使用MicroPoly(A)Purist Kit (Ambion, Austin, TX, USA)从115 μg总RNA混合物中分离Poly(A) + mRNA。根据制造商(Roche, Basel, Switzerland)的协议,使用Primer Random、cDNA Synthesis System和GS-FLX Titanium Rapid library Preparation试剂盒从720 ng poly(A) + mRNA构建cDNA文库,然后在Roche GS-FLX系统上测序。使用GS Run Processor version 2.6 (Roche)对SFF格式的原始454序列文件进行基调用,以获得干净的est。对poly(A/T)尾、低复杂度重复序列和短序列(<50 bp)进行适配器修剪和去除。对在Sugi基因组数据库中登记的日本雪松ssr进行BLASTN筛选。http://www.ffpri.affrc.go.jp/labs/cjgenome/),拟南芥拟南芥信息资源(The Arabidopsis Information Resource;http://www.arabidopsis.org),读取满足匹配条件(对准长度≤200 bp;身份≤90%)排除。使用GS De Novo Assembler version 2.6 (Roche)在默认设置的cDNA项目模式下组装通过筛选的reads,并通过将reads组装到isotigs中来预测假定的转录本序列。包含这些序列及其质量分数的文件已保存在DDBJ [DRA001261]。
基因注释将每个序列的预测蛋白产物的BLASTX命中得分最高的结果表示为对TAIR的查询拟南芥蛋白质数据库TAIR10-pep-20101214,阈值e-10。使用CLC Genomic Workbench 4.1.1版本软件包(CLC bio, Aarhus, Denmark)进行BLASTX搜索,用于SSH和标准化cDNA文库的序列数据,以及NCBI(国家生物技术信息中心)BLAST v2.2.25算法(独立;http://www.ncbi.nlm.nih.gov/guide/data-software/#downloads_)查阅NGS数据。基于GO注释在TAIR网站上进行功能分类。
基因表达微阵列分析
使用Roche NimbleGen (Madison, WI, USA)生产的NimbleGen定制真核基因表达4 × 72 K阵列进行微阵列分析。为了确定转录本的日节律,我们使用芯片对36个夏季样本和8个选定的冬季样本(12月22日4:00/8:00/12:00/16:00/20:00/24:00,12月23日12:00/24:00)进行了分析。按照NimbleGen基因表达分析方案,使用SuperScript双链cDNA合成试剂盒(Invitrogen, Carlsbad, CA, USA)在100 pmol oligo(dT)20引物(Invitrogen)存在下,将总RNA (10 μg)转录为双链cDNA。使用NimbleGen单色标记试剂盒对双链cDNA进行清洗和标记。用3 μg cy3标记的双链cDNA在NimbleGen杂交系统中,在42℃下杂交17 h。杂交后,使用NimbleGen洗涤缓冲试剂盒清洗微阵列。使用NimbleGen MS 200扫描仪以2 μm/pixel分辨率扫描载玻片。微阵列设计和数据已提交给NCBI GEO [GSE53945]。
微阵列数据处理与统计分析
扫描图像(TIFF格式)导入到NimbleScan软件版本2.6中进行网格对齐和稳健的多阵列平均归一化。为了能够直接比较文本配置文件,中位数日志2使用genspring 12.5版软件(安捷伦科技)将每个时间点的-转换比率归一化至基线。
采用genspring软件对36个夏季和8个冬季样本归一化数据集进行主成分分析。将夏季样品的微阵列数据按采样时间分为12组。由于genspring中度t检验显示,在12:00和24:00之间,微阵列上的靶标没有显著差异(p >0.05),我们估计冬季很少或没有循环基因,并将所有8个冬季样本的数据分组在一起。采用genspring两两比较(单因素方差分析,p值≤0.05,Benjamini和Hochberg多重检验校正)对13组进行所有可能组合的比较,以选择差异表达基因。为了避免分析来自相同基因的靶标,命中一个唯一的靶标拟南芥BLASTX搜索后e值较低的基因ID被选为PCA差异表达基因中的唯一基因。
采用GeneCycle R包对36个夏季样本归一化数据集中表达差异有统计学意义(假发现率q值≤0.05)的周期性表达靶标进行鉴定[39].随后,我们比较了每个时间点平均表达值的所有可能组合,并从循环基因中选择了至少一个成对比较中差异超过2倍的表达靶点。从这些目标中选择独特的基因,并通过genspring软件将其分为四个聚类(算法:k-means,相似性度量:差分,最大迭代次数:10,000)。
我们使用贝叶斯网络估计程序SiGN-BN(在36个夏季样本的标准化数据集中,1000个具有最高变异系数的目标之间的关系的概率网络。http://sign.hgc.jp/signbn/index.html) [76],在东京大学医学科学研究所人类基因组中心的超级计算机系统上实施(https://supcom.hgc.jp/english).利用基因网络分析平台Cell Illustrator (https://cio.bioillustrator.com/cionlineserver/apps/usersman/main).
为识别夏季和冬季转录组差异,将36份夏季和8份冬季样本的微阵列数据分别分组,不参考采样时间,采用调节t检验(p值≤0.05,Benjamini and Hochberg多重检验校正)进行比较,筛选出夏季和冬季差异表达的基因。随后,目标显示出四倍以上的差异和命中独特拟南芥选择e值较低的基因id,采用GO分类法进行冬夏比较。
日本雪松核心时钟和感光基因的分离
核酸序列拟南芥核心时钟组件[TAIR: AT1G01060 (LHY), at2g46830 (CCA1), at5g61380 (TOC1),电话1g22770 (胃肠道)及AT5G57360 (ZTL)]和感光器[AT1G09570 (巴), at2g18790 (、), at4g08920 (CRY1)及AT1G04400 (CRY2)]均来源于KEGG通路数据库。对CLC基因组工作台上的NGS数据进行TBLASTN搜索拟南芥以确定日本雪松中假定的同源。此外,TBLASTN搜索对日本雪松树顶表达的另一个NGS转录本数据集进行了搜索et al。未公开的数据)。同源contigs和单基因使用Sequencher软件进行重组,5 ' -和3 ' - race引物使用Oligo软件包版本7设计(National Biosciences Inc., Cascade, CO, USA,附加文件)13A).将2012年7月31日6个时间点采集的嫩枝中提取的总RNA等量混合。从总RNA混合物中提取500 ng,使用Takara Bio的SMARTer RACE cDNA Amplification Kit合成第一链cDNA样本,加入100 μl Tricine-EDTA buffer进行稀释。PCR混合液(20 μl)由0.4 μl KOD-Plus聚合酶(1.0单位/μl,日本大阪Toyobo)、2.0 μl KOD-Plus聚合酶10×缓冲液、2.0 μl 2.0 mM dNTPs、0.8 μl 25 mM MgSO组成44.0 μl 1.0 μM RACE引物,2.0 μl 10×通用引物A混合物和1.0 μl稀释的5 '或3 ' cDNA样品。对每个引物对的反应条件进行了优化,包括94℃初始变性2 min, 94℃15 sec, 60℃30 sec, 68℃1.5-4.0 min,最终在68℃扩展5 min(附加文件)13A).将15 μl PCR产物电泳在1.2%琼脂糖凝胶上,并根据制造商的说明使用QIAEX II凝胶提取试剂盒(Qiagen)提取和纯化预期长度的片段。当第一次PCR未检测到条带时,进行巢式PCR。巢式PCR基本按照上述方法进行,用4.0 μl 1.0 μM second RACE引物(附加文件13A)、0.4 μl 10 μM Nested Universal Primer A和1.0 μl第一PCR产物用消过毒的水稀释1/100。磷酸化反应混合物(10 μl)由2.0 μl纯化PCR产物、0.2 μl T4多核苷酸激酶(Takara Bio)、1.0 μl 10× T4多核苷酸激酶缓冲液和0.1 μl 100 mM ATP组成,在37℃下孵育30 min。磷酸化产物使用QiaQuick PCR纯化试剂盒(Qiagen)进行纯化,使用DNA Ligation Kit version 2.1 (Takara Bio)连接到载体pBSK上,然后转化为ECOS功能区大肠杆菌DH5α (Nippongene, Tokyo, Japan)。选择耐氨苄西林菌落,使用质粒MiniPrep试剂盒(Millipore, Bedford, MA, USA)纯化质粒。用U19和M13反向引物进行测序。根据RACE产物序列设计PCR引物对,利用Oligo软件程序扩增核心时钟和光感受器基因的全长ORF区域。使用PrimeScript第一链cDNA Synthesis Kit (Takara Bio)从500 ng用于RACE反应的相同总RNA中合成第一链cDNA。PCR基本按照上述方法进行,取1.0 μl cDNA,用消毒水稀释1/100;修改后的条件列在附加文件中13B.如上所述进行凝胶纯化、克隆和测序。用Sequencher软件对序列进行组装和比对。利用CLC Main Workbench version 6.5软件(CLC bio)将比对的序列翻译成氨基酸序列,并在TAIR蛋白数据库中进行BLASTP搜索,确认克隆基因。利用DDBJ网站上的ClustalW version 2.1软件(http://clustalw.ddbj.nig.ac.jp/index.php?lang=ja)的默认模式。邻接法[77]来构建系统发育树。
时钟和光感受器基因的qPCR
对本研究中分离出的12个基因进行了qPCR,这些基因显然编码了假定的核心时钟组件或感光器。在每个ORF区域内设计一个基因特异性引物对(附加文件13C).第一链cDNA使用高容量RNA- cDNA试剂盒(Life Technologies, Carlsbad, CA, USA),从36个夏季的日序列和36个冬季样本的总RNA中提取500ng,合成第一链cDNA。qPCR检测权力SYBR Green PCR Master Mix (Life Technologies)和StepOnePlus实时PCR系统(Life Technologies),如制造商说明书所述。取6 μl cDNA,用消毒水稀释1/24,每孔反应量为20 μl。从60℃到95℃进行熔解曲线分析,每0.3℃捕获一次数据,以确保单个产物扩增。使用标准曲线检查反应效率,该标准曲线基于从500ng总RNA合成的cDNA的四倍稀释系列(1至1/256稀释)。每个样品都使用所有引物进行独立和三份测试。将转录丰度归一化至ForestGEN数据库中登记的泛素(http://forestgen.ffpri.affrc.go.jp/ja/info_cj.html(Cj)。2620]使用ΔΔCt方法[78],并将各时间点的数据与2012年7月30日4:00采集的嫩枝数据进行比较。
支持数据的可用性
DDBJ中有NGS数据[DRA001261], SSH和cDNA文库的EST序列[HX950378到HX954219],以及时钟相关基因的序列[AB894538到AB894549]。微阵列设计和数据可在NCBI GEO [GSE53945]中获得。
作者的贡献
AW设计并监督了这项研究。MN设计实验,分析数据,撰写稿件。两位作者都阅读并批准了最终的手稿。
附加文件
参考文献
- 1.
萩原A:树木光合作用和呼吸作用的研究(II):针叶光合作用的日变化日本柳杉粳稻和Chamaecyparis obtusa.中国林业大学学报,2003,29(6):516 - 516。
- 2.
Cremer KW:芽伸长的日模式松果体放射虫纲和桉树regnans.环境科学学报,2004,27(3):379 - 379。10.1111 / j.1469-8137.1976.tb01482.x。
- 3.
佐藤A:日本幼树木质部压力势的日变化趋势和季节变化日本柳杉粳稻.中国林业大学学报,2004,27(3):357 - 357。
- 4.
日本雪松主茎伸长的季节和日动态。中国林业科学,2012,29 (3):527 - 528
- 5.
Antonova GF, Cherkashin VP, Stasova VV, Varaksina TN:苏地松木质部细胞径向生长的日动态(抗旱性l .)。树木学报,1995,10(1):24-30。10.1007 / BF00197776。
- 6.
Hosoo Y, Yoshida M, Imai T, Okuyama T:场发射扫描电镜检测分化针叶树管胞发育次生壁最内表面免疫金标记葡萄糖甘露聚糖含量的日差异。植物学报,2002,29(6):344 - 344。10.1007 / s00425 - 002 - 0824 - 3。
- 7.
Hosoo Y, Yoshida M, Yamamoto H:光照强度对发育期S细胞壁成分向最内表面供给日差异的影响2里面有多层管胞日本柳杉粳稻.木材科学,2011,57(5):345-351。10.1007 / s10086 - 011 - 1196 - 8。
- 8.
Hosoo Y:木材细胞壁形成过程中细胞壁组分供给的日周期性。纪海石牧载。2012,58(3):109-117。10.2488 / jwrs.58.109。(日语,英文摘要)
- 9.
多姆林I,古斯塔夫松A,冯维特斯坦D:生命周期的实验控制在挪威云杉(l)岩溶。一、关于营养周期的一些基本实验。林业遗传,1968,17(23):44-64。
- 10.
休眠I:光周期和温度在植物休眠诱导和释放中的作用抗旱性l .幼苗。森林科学,1999,26(增刊):366 - 366。10.1051 /森林:19890554。
- 11.
Malcolm DC, Pymar CF:温度对锡特卡云杉高度生长停止的影响(云杉sitchensis(锣)。卡尔)产地。中国林业科学,2004,27(4):379 - 379。
- 12.
Itoh T, Shimaji K:受控环境下的树木生长及其年际节律:我在杉木、卡拉松、科亚木和库努木的幼龄阶段进行了生长。科学通报,1998,20:1-21。(在日本)
- 13.
Konopka B, Noguchi K, Sakata T, Takahashi M, Konopkova Z:日本雪松细根动态(日本柳杉粳稻)在整个生长季节种植。生态环境学报,2006,26(1):379 - 379。10.1016 / j.foreco.2006.01.004。
- 14.
Zarter CR, Demmig-Adams B, Ebbert V, Adamska I, Adams IIIWW:亚高山针叶树冬春过渡时期的光合能力和光收集效率。植物保护学报,2006,29(2):379 - 379。10.1111 / j.1469-8137.2006.01816.x。
- 15.
Yakir E, Hilman D, Harir Y, Green RM:植物生物钟输出的调控。中国生物医学工程学报,2007,27(2):339 - 344。10.1111 / j.1742-4658.2006.05616.x。
- 16.
Ibanez C, Kozarewa I, Johansson M, Ogren E, Rohde A, Eriksson ME:生物钟成分调节季节性休眠的进入和影响退出以及冬季抗寒杨树树。中国生物医学工程学报,2010,29(4):344 - 344。10.1104 / pp.110.158220。
- 17.
杨晓燕,杨晓燕,杨晓燕:树木芽休眠的动态特性:环境控制和分子机制。植物细胞环境,2012,35(10):1707-1728。10.1111 / j.1365-3040.2012.02552.x。
- 18.
Somers DE, Devlin PF, Kay SA:光敏色素和隐色素的夹带拟南芥生物钟。科学通报,1998,29(3):344 - 344。10.1126 / science.282.5393.1488。
- 19.
Devlin PF, Kay SA:隐色素是光敏色素向生物钟传递信号所必需的,而不是节律性。植物学报,2000,12(12):2499-2509。10.1105 / tpc.12.12.2499。
- 20.
miller AJ:一套光感受器控制着植物的生物钟。生物节律杂志,2001,18(3):217-226。10.1177 / 0748730403018003004。
- 21.
Pokhilko A, Fernandez AP, Edwards KD, Southern MM, Halliday KJ, Millar AJ:时钟基因电路在拟南芥包括一个抑制器与额外的反馈回路。中国生物医学工程学报,2012,8:574-10.1038/msb.2012.6。
- 22.
Alabadi D, Oyama T, Yanovsky MJ, Harmon FG, Mas P, Kay SA:相互调节TOC1和LHY / CCA1在拟南芥生物钟。科学通报,2001,29(3):344 - 344。10.1126 / science.1061320。
- 23.
Gendron JM, Pruneda-Paz JL, Doherty CJ, Gross AM, Kang SE, Kay SA:拟南芥生物钟蛋白TOC1是一种dna结合转录因子。中国科学:自然科学,2012,29(3):349 - 349。10.1073 / pnas.1200355109。
- 24.
Farre EM, Harmer SL, Harmon FG, Yanovsky MJ, Kay SA:重叠和不同的角色PRR7和PRR9在拟南芥生物钟。动物学报,2005,15(1):47-54。10.1016 / j.cub.2004.12.067。
- 25.
Nakamichi N, Kita M, Ito S, Yamashino T, Mizuno T: PSEUDO-RESPONSE regulator, PRR9, PRR7和PRR5,共同发挥靠近昼夜节律钟的重要作用拟南芥.植物生理学报,2005,46(5):686-698。10.1093 /卡式肺囊虫肺炎/ pci086。
- 26.
马春梅,金文伟,宋文杰,凯萨:ZTL靶向降解TOC1对小鼠昼夜节律功能的影响拟南芥.自然科学学报,2003,26(6):567- 567。10.1038 / nature02163。
- 27.
Fujiwara S, Wang L, Han L, Suh SS, Salome PA, McClung CR, Somers DE:拟南芥通过选择性蛋白水解和伪反应调节蛋白磷酸化对生物钟的翻译后调控。中国生物医学工程学报,2008,29(3):344 - 344。10.1074 / jbc.M803471200。
- 28.
金J,耿R, Gallenstein RA, Somers DE: F-box蛋白ZEITLUPE控制巨茶的稳定性和核质分配。发展,2013,140(19):4060-4069。10.1242 / dev.096651。
- 29.
Kim WY, Fujiwara S, Suh SS, Kim J, Kim Y, Han L, David K, Putterill J, Nam HG, Somers DE: ZEITLUPE是一种由GIGANTEA在蓝光下稳定的昼夜光受体。自然科学,2007,39(4):359 - 366。10.1038 / nature06132。
- 30.
韩波,朱涛,王晓霞,韩波,韩波,王晓霞,韩波,韩波,韩波拟南芥通过生物钟。科学通报,2000,29(4):344 - 344。10.1126 / science.290.5499.2110。
- 31.
谢建平,李志强,李志强,李志强,等:基因芯片技术在植物生长发育中的应用拟南芥.植物科学学报,2001,29(3):344 - 344。10.1105 / tpc.13.1.113。
- 32.
Edwards KD, Anderson PE, Hall A, Salathia NS, Locke JCW, Lynn JR, Straume M, Smith JQ, Millar AJ:开花位点c调节高温响应的自然变化拟南芥生物钟。植物学报,2006,18:639-650。10.1105 / tpc.105.038315。
- 33.
Covington MF, Harmer SL:生物钟调节生长素信号和反应拟南芥.公共科学图书馆,2007,5 (8):e222-10.1371/journal.pbio.0050222。
- 34.
Covington MF, Maloof JN, Straume M, Kay SA, Harmer SL:全球转录组分析揭示植物生长发育关键途径的昼夜调控。中国生物医学工程学报,2008,9 (8):R130-10.1186/gb-2008-9-8-r130。
- 35.
郭志刚,郭志刚,郭志刚,李志刚:挪威云杉裸子植物核心时钟蛋白的保守功能(挪威云杉l .岩溶)。公共科学学报,2013,8 (3):e60110-10.1371/journal.pone.0060110。
- 36.
Gyllenstrand N, Karlgren A, Clapham D, Holm K, Hall A, Gould PD, Källman T, Lagercrantz U:没有时间云杉:昼夜节律的快速衰减挪威云杉(l .岩溶)。植物生理学报,2014,35(3):344 - 344。10.1093 /卡式肺囊虫肺炎/ pct199。
- 37.
Bowe LM, Coat G, de Pamphilis CW:基于所有三个基因组区室的种子植物系统发育:现存裸子植物是单系植物,而裸子植物的近亲是针叶树。中国科学:自然科学,2000,29(4):489 - 497。10.1073 / pnas.97.8.4092。
- 38.
植村K:日本雪松的鼻祖和分销转移。生态学杂志,1981,35(4):74-79。(在日本)
- 39.
Wichert S, Fokianos K, Strimmer K:在微阵列时间序列数据中识别周期性表达的转录本。生物信息学,2004,20(1):5-20。10.1093 /生物信息学/ btg364。
- 40.
王志强,孙玲,王志强,王志强,王志强,王志强。拟南芥myb相关转录因子在光敏色素调控中的作用奇迹基因。中国生物医学工程学报,1997,19(4):491-507。10.1105 / tpc.9.4.491。
- 41.
冈田R,近藤S, Satbhai SB,山口N, Tsukuda M,青木S:功能表征CCA1 / LHY同族体基因,PpCCA1a和PpCCA1b,在苔藓里Physcomitrella金属盘.植物学报,2009,30(3):551-563。10.1111 / j.1365 - 313 x.2009.03979.x。
- 42.
Strayer C, Oyama T, Schultz TF, Raman R, Somers DE, Mas P, Panda S, Kreps JA, Kay SA:克隆拟南芥时钟基因TOC1,一个自动调节反应调节器同源物。科学通报,2000,29(4):344 - 344。10.1126 / science.289.5480.768。
- 43.
Somers DE, Schultz TF, Milnamow M, Kay SA:ZEITLUPE编码一种新的与时钟相关的PAS蛋白拟南芥.光子学报,2000,19(3):319-329。10.1016 / s0092 - 8674(00) 80841 - 7。
- 44.
杨晓明,王晓明,王晓明,王晓明:植物木质部发育过程中基因表达的昼夜变化规律桉树树。华南植物学报,2010,76(3):425-439。10.1016 / j.sajb.2010.02.087。
- 45.
霍夫曼DE, Jonsson P, Bylesjö M, Trygg J, Antti H, Eriksson ME, Moritz T:青藏高原的日模式变化杨树转录组和代谢组对光周期变化的响应。植物细胞环境,2010,33(8):1298-1313。
- 46.
Michael TP, Breton G, Hazen SP, Priest H, Mockler TC, Kay SA, Chory J:植物节律性生长的早晨特异性激素基因表达程序。公共科学图书馆,2008,6 (9):e225-10.1371/journal.pbio.0060225。
- 47.
Iuchi S, Kobayashi M, Taji T, Naramoto M, Seki M, Kato T, Tabata S, Kakubari Y, Yamaguchi-Shinozaki K, Shinozaki K: 9-基因调控对抗旱性的调控独联体-环氧类胡萝卜素双加氧酶是脱落酸生物合成中的关键酶拟南芥.植物学报,2001,27(4):325-333。10.1046 / j.1365 - 313 x.2001.01096.x。
- 48.
Kushiro T,冈本M, Nakabayashi K, Yamagishi K,北村S,麻美T,平井N, Koshiba T,神谷Y, Nambara E: The拟南芥细胞色素P450 CYP707A编码ABA 8 ' -羟化酶:ABA分解代谢的关键酶。环境科学学报,2004,23(7):1647-1656。10.1038 / sj.emboj.7600121。
- 49.
斋藤S,平井N,松本C,大东H,大田D,坂田K,水谷M:拟南芥CYP707AS编码(+)-脱落酸8′-羟化酶,脱落酸氧化分解代谢的关键酶。植物科学进展,2004,34(4):344 - 344。10.1104 / pp.103.037614。
- 50.
Dubois M, Skirycz A, Claeys H, Maleux K, Dhondt S, De Bodt S, Vanden Bossche R, De Milde L, Yoshizumi T, Matsui M, Inzé D:乙烯响应因子6在拟南芥水分限制条件下作为叶片生长的中心调节因子。中国生物医学工程学报,2013,26(1):319-332。10.1104 / pp.113.216341。
- 51.
Kim WY, Geng R, Somers DE: F-box蛋白ZTL的昼夜相特异性降解是由蛋白酶体介导的。自然科学进展,2003,29(3):349 - 349。10.1073 / pnas.0736949100。
- 52.
王晓明,刘志刚,王志刚,王志刚,王志刚,王志刚:植物生理时钟对应激的补偿机制及其对植物生理时钟功能的影响。植物营养学报,2005,37(3):379 - 379。10.1104 / pp.104.054577。
- 53.
Nelson DC, Lasswell J, Rogg LE, Cohen MA, Bartel B:FKF1这是一种时钟控制基因,调节植物向开花的过渡拟南芥.细胞科学,2000,101:331-340。10.1016 / s0092 - 8674(00) 80842 - 9。
- 54.
舒尔茨TF, Kiyosue T, Yanovsky M, Wada M, Kay SA: LKP2在昼夜节律中的作用拟南芥.植物科学学报,2001,26(3):357 - 357。10.1105 / tpc.13.12.2659。
- 55.
Toth R, Kevei E, Hall A, Millar AJ, Nagy F, Kozma-Bognar L:拟南芥光敏色素和隐色素基因的生物钟调控表达。植物学报,2001,27(4):344 - 344。10.1104 / pp.010467。
- 56.
施密特M,施耐德-波奇HAW:由光敏色素基因重绘的裸子植物的进化:虎目出现在裸子植物的基部。中华生物医学杂志,2002,54(6):715-724。10.1007 / s00239 - 001 - 0042 - 9。
- 57.
Mathews S:陆生植物光敏色素介导的发育:红光感应进化以应对不断变化的光环境的挑战。分子生态学报,2006,15(12):3483-3503。10.1111 / j.1365 - 294 x.2006.03051.x。
- 58.
Millar AJ, Kay SA:昼夜节律控制出租车基因转录和mRNA的积累拟南芥.植物生理学报,2004,18(5):344 - 344。10.1105 / tpc.3.5.541。
- 59.
Kellmann JW, Merforth N, Wiese M, Pichersky E, Piechulla B: 19转录水平的一致昼夜节律振荡方面/ b(出租车)番茄的基因(西红柿)。分子生物学杂志,1993,37(3):439-448。
- 60.
黄晓明,黄晓明,黄晓明:生物钟对lhc基因转录的控制衣藻reinhardtii.植物分子生物学,1994,26(2):557-569。10.1007 / BF00013743。
- 61.
Aoki S, Kato S, Ichikawa K, Shimizu M:昼夜节律表达PpLhcb2编码一种主要的光收集叶绿素的基因a / b-结合蛋白Physcomitrella金属盘.植物细胞生理学杂志,2004,45(1):68-76。10.1093 /卡式肺囊虫肺炎/ pch006。
- 62.
绿色B, Pichersky E, Kloppstech K:叶绿素a / b-结合蛋白:一个扩展的家族。生物化学进展,1998,16:181-186。10.1016 / 0968 - 0004(91) 90072 - 4。
- 63.
Ichikawa K, Sugita M, Imaizumi T, Wada M, Aoki S:小立碗藓质体sigma因子基因的日差异表达。由隐色素介导的PpSig5、生物钟和蓝光信号之间的调节相互作用。植物科学学报,2004,26(3):344 - 344。10.1104 / pp.104.053033。
- 64.
叶海平,李志刚,李志刚:光收集叶绿素的光依赖性和组织特异性积累a / b暗生松幼苗的结合蛋白和二磷酸核酮糖羧化酶。植物生理学报,2001,32(8):1303-1306。
- 65.
Alosi MC, Neale DB:光和光敏色素介导的基因在杉木幼苗中的表达。中国生物医学工程学报,2002,26(1):1- 6。10.1111 / j.1399-3054.1992.tb01313.x。
- 66.
山本N,向井Y,松冈M,村上佳野Y,田中Y,大桥Y,大泽木Y,大谷K:光无关表达出租车和红细胞表面暗色生长的松树幼苗中的基因。植物营养学报,2004,26(2):379-383。10.1104 / pp.95.2.379。
- 67.
小岛K,山本N,佐佐木S:松木结构(松果体thunbergii)叶绿素a / b-结合蛋白基因在缺乏光的情况下表达。植物分子生物学,1992,19(3):405-410。10.1007 / BF00023388。
- 68.
Peer W, Silverthorne J, Peters JL:光收集复合体个体成员的发育和光调节表达b基因家族松果体palustris.植物科学进展,2004,27(2):344 - 344。10.1104 / pp.111.2.627。
- 69.
Clapham DH, Kolukisaoglu HU, Larsson CT, Qamaruddin M, Ekberg I, Wiegmann-Eirund C, Schneider-Poetsch HA, von Arnold S:光敏色素类型云杉和松果体。phya相关类型的表达模式。植物分子生物学,1999,40(4):669-678。10.1023 /: 1006204318499。
- 70.
Joosen RV, Lammers M, Balk PA, Brønnum P, Konings MC, Perks M, Stattin E, van Wordragen MF, van der Geest AL:冷驯化过程中基因表达与生理参数和环境条件的相关性抗旱性,利用cDNA微阵列鉴定分子标记。树物理学报,2006,26(10):1297-1313。10.1093 / treephys / 26.10.1297。
- 71.
Ramos A, Perez-Solis E, Ibanez C, Casado R, Collada C, Gomez L, Aragoncillo C, Allona I:栗子冬季生物钟中断。中国科学:自然科学,2005,26(3):344 - 344。10.1073 / pnas.0408549102。
- 72.
Ibanez C, Ramos A, Acebo P, Contreras A, Casado R, Allona I, Aragoncillo C:栗低温反应中生物钟基因表达的整体改变。公共科学学报,2008,3 (10):e3567-10.1371/journal.pone.0003567。
- 73.
Bieniawska Z, Espinoza C, Schlereth A, Sulpice R, Hincha DK, Hannah MA:拟南芥生物钟的中断是冷响应转录组广泛变化的原因。中国生物医学工程学报,2008,27(1):344 - 344。10.1104 / pp.108.118059。
- 74.
马东,马东,马东,马东:生物钟相关的1和延长下胚轴调节c -重复序列结合因子(CBF)通路的表达拟南芥.中国科学:自然科学,2011,29(3):344 - 344。10.1073 / pnas.1103741108。
- 75.
王晓明,王晓明,王晓明,王晓明,等。多酚类多肉植物RNA分离方法的研究。植物分子生物学学报,2000,18(4):369-376。10.1007 / BF02825065。
- 76.
Tamada Y, Shimamura T, Yamaguchi R, Imoto S, Nagasaki M, Miyano S: SiGN:用于高性能计算的大规模基因网络估计环境。基因组学通报,2011,25(1):40-52。
- 77.
齐藤,倪明:邻居连接法:一种重建系统发育树的新方法。分子生物学杂志,1987,4(4):406-425。
- 78.
Pfaffl MW:一种新的实时RT-PCR相对定量数学模型。中国生物工程学报,2001,29 (9):e45-10.1093/nar/29.9.e45。
致谢
我们感谢Doi Atsushi博士(Cell Innovator,福冈,日本)使用SiGN-BN计算机程序进行基因网络分析。这项研究是日本农林水产省支持的“响应气候变化的循环食品生产系统技术开发”项目的一部分。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
电子辅助材料
12870 _2014_308_moesm2_esm.pdf
附加文件2:SSH、cDNA和NGS数据的基因本体分配。(A)日本雪松SSH库ESTs注释的比例。正向文库(SSH12)和逆向文库(SSH24)是夏季中午和午夜主要表达的基因。(B)日本雪松夏季样本归一化cDNA文库中注释ESTs的比例。(C)日本雪松NGS数据中标注的等标和单标的比例。(pdf 497 kb)
所选择的999个目标,显示出在峰值到低谷振幅上有两倍以上的昼夜节律差异。
附加文件4:1根据BLASTX的最高命中值e-value cutoff为e-10预测序列的假定函数。只有命中唯一的序列拟南芥基因ID列在这里。2p-value和错误发现率(q-value)为GeneCycle统计分析的结果[39].这里只列出q值≤0.05的基因。3.褶皱变化表示夏季最大表达量与最小表达量之比。4用微阵列观察表达量最大和最小的时间。(pdf 347kb)
将556个循环基因用于聚类分析。
附加文件5:1根据BLASTX的最高命中值e-value cutoff为e-10预测序列的假定函数。只有命中唯一的序列拟南芥基因ID列在这里。2褶皱变化表示夏季最大表达量与最小表达量之比。3.聚类数表示聚类分析定义的表达模式的相似性。参见图2A表示每个聚类的表达式模式。4这里列出了代表激素生物合成和信号通路的假定的激素相关基因(ABA,脱落酸;辅助,生长素;BR, brassinosteroids;CK,细胞分裂素;乙,乙;赤霉素GA;JA,茉莉酸)。(pdf 194kb)
具有最高变异系数的目标用于基因网络分析。
附加文件6:1根据BLASTX的最高命中值e-value cutoff为e-10预测序列的假定函数。2假设的时钟基因,在估计的基因网络中节点为红色(图4).3.利用SiGN-BN贝叶斯网络估计程序(http://sign.hgc.jp/signbn/index.html) [76].4目标达到最大表达的时间。(pdf 298kb)
前100个目标在夏季和冬季表现不同。
附加文件8:1根据BLASTX的最高命中值e-value cutoff为e-10预测序列的假定函数。(pdf 94kb)
LHY与CCA1 (A), TOC1 (B), GI (C), ZTL, LKP2和FKF1 (D)的氨基酸序列比对。
附加文件9:物种名称缩写如下:拟南芥;Cj,日本柳杉粳稻;页,Physcomitrella金属盘无性系种群。金属盘;Sm,卷柏moellendorffii。(A)蛋白的NCBI登录号为AtLHY (NP_001030924)和AtCCA1 (NP_850460)。PpCCA1a和PpCCA1b来自Okadaet al。[41].该结构域的氨基酸序列(下划线)来自Wanget al。[40].(B)蛋白的NCBI登录号为NP_200946 (AtTOC1)和XP_002963903 (SmTOC1)。结构域的氨基酸序列(下划线)来自Strayeret al。[42].(C)蛋白的NCBI登录号为NP_564180 (AtGI)和XP_002961231 (SmGI)。(D)蛋白的NCBI登录号为NP_001154783 (AtZTL)、AEC06826 (AtLKP2)、AAF32298 (FKF1)和XP_002990856 (SmFKF1-2)。结构域的氨基酸序列(下划线)来自Somerset al。[43].(pdf 544 kb)
12870 _2014_308_moesm10_esm.pdf
附加文件10:光感受器基因在夏季和冬季的日表达模式。利用微阵列和qPCR技术分析了夏季(2012年7月30日-31日)和冬季(2011年12月22日-23日)相对转录本丰度的日变化。夏季样品的芯片数据(绿线)和夏季(蓝线)和冬季(红线)样品的qPCR数据代表了12个时间点的3个生物重复的平均值。冬季样品的芯片数据(紫色线)显示在8个选定的时间点(第1天的4:00/8:00/12:00/16:00/20:00/24:00和第2天的12:00/24:00),没有生物复制。将每个时间点的数据与2012年7月30日4:00的嫩枝数据进行比较。下面的灰色和黑色柱状图分别代表了日本国家天文台报告的夏季(上)和冬季(下)自然昼夜(日出和日落之间)的长度。(pdf 101kb)
日本雪松的日温度变化、光合活性辐射和高度生长。
附加文件11:(A)冬季(2011年12月22-23日)和夏季(2012年7月30-31日)两天内的温度变化。日立(36°34′n 140°38′e 34 m,距采样地点约15公里)每10分钟采集一次气温数据,由日本气象厅(http://www.jma.go.jp/jma/index.html).(B)夏季两天内光合有效辐射的变化。每20分钟从采样点与HOBO气象站记录器(Onset Computer Corp., Bourne, MA, USA)一起工作的光合活性辐射智能传感器获得数值。(C) 5天高度生长变化(2012年7月26-30日)。由WG-II数码相机(宾得,东京,日本)每小时拍摄一次树梢的图像。用ImageJ64软件(http://rsbweb.nih.gov/ij/).(pdf 156kb)
LHCa/b的系统发育树
附加文件12:拟南芥、水稻、苔藓和日本雪松。从NGS数据中提取日本雪松LHCa/b基因序列。物种名称缩写如下:拟南芥(thale水芹);日本雪松(日本柳杉粳稻);Osj,栽培稻(日本大米);页,Physcomitrella金属盘无性系种群。金属盘(苔藓)。物种名称后面的数字表示NCBI的加入号。邻接法[77]来构建系统发育树。树木都被拟南芥ELIP1和ELIP2。(pdf 129kb)
权利和权限
本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用属性许可协议(http://creativecommons.org/licenses/by/4.0),允许在任何媒介上不受限制地使用、传播和复制,前提是原创作品的名称要注明出处。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
Nose, M., Watanabe, A.日本雪松夏季和冬季时钟基因与昼夜转录组动态(日本柳杉粳稻(L.f)。D.Don)。BMC植物生物学14,308(2014)。https://doi.org/10.1186/s12870-014-0308-1
收到了:
接受:
发表:
关键字
- 时钟
- 针叶树
- 昼夜节律
- 基因网络
- 光感受器
- 季节
- 转录组
- 冬天中断