摘要
背景
辣椒果实中含有多种类胡萝卜素。红辣椒素是一种红色类胡萝卜素,它使成熟的辣椒果实呈现红色。辣椒果实的红色主要受辣椒红蛋白/辣椒红蛋白合酶基因(Ccs)、八氢番茄红素合成酶(小组),番茄红素-β环化酶(Lcyb)和β-胡萝卜素羟化酶(Crtz).在果实形成过程中,当某个基因或多个基因被删除时,果实红色的发育和变化相关的研究工作非常有限。本研究利用烟草响尾蛇病毒(TRV)构建病毒载体,携带靶基因侵染离体辣椒果实,观察果实颜色变化。采用实时荧光定量PCR技术分析基因沉默效率。同时,采用高效液相色谱法测定辣椒果实中关键基因沉默时与辣椒素合成相关的辣椒素和类胡萝卜素的含量。
结果
这些基因(Ccs,小组,Lcyb而且Crtz)通过病毒诱导基因沉默(VIGS)技术单个沉默,红色果实品种的辣椒果实呈现橙色或黄色。当几个基因同时沉默时,果实也没有显示出正常的红色。实时荧光定量PCR分析表明,VIGS方法沉默靶基因的效率为70-80%。高效液相色谱分析表明,当一个基因或多个基因同时沉默时,与辣椒素合成相关的类胡萝卜素(β-胡萝卜素、β-隐黄质或玉米黄质)含量均有不同程度的降低,但辣椒素含量显著降低。当某个关键基因被沉默时,辣椒素的合成会受到直接或间接的影响。通过对靶基因进行靶向沉默,证实了靶基因对辣椒果实颜色变化的影响。
结论
VIGS是研究辣椒果实颜色形成的分子机理的一种较好的方法。利用病毒诱导基因沉默技术,对辣椒果实中辣椒红素合成基因进行单独或同时沉默,观察辣椒果实颜色变化。这为进一步探索辣椒果实颜色形成的分子机制提供了一个平台。
背景
烟草响尾蛇病毒(TRV)具有两种主要长度的直管状颗粒,较长的约为190 nm,较短的约为50 ~ 115 nm,这取决于分离物的不同。正常的产生颗粒的分离株(称为m型)有两种基因组RNA,即RNA1和RNA2。这些很容易通过接种液传播,并通过线虫家族的毛孢。
TRV具有二部RNA,是一种有用的载体。TRV的RNA1和RNA2序列可以在植物和植物细胞中独立用作载体。一个TRV-RNA2载体可以被改造成携带异源核酸进入植物。TRV载体诱导非常轻微的症状,感染邻近的大面积细胞,并使生长点的基因表达沉默。此外,它通常用于基因鉴定。TRV是一种具有二部基因组的正链RNA病毒。由RNA1编码的蛋白质足以在宿主植物内复制和移动,而由RNA2编码的蛋白质可以在植物间形成病毒粒子和线虫介导的传播[1].
转录后基因沉默(PTGS)是植物抵御病毒最有效的方式之一。在这种情况下,植物的RNA沉默机制被激活,病毒将受到RNA沉默。因此,PTGS是一个有吸引力的内源过程,可以用来研究基因功能。病毒诱导基因沉默(VIGS)是激活PTGS过程的最有效方法之一。当携带宿主源目的基因序列的重组病毒载体(VIGS载体)感染植物时,TRV病毒双链RNA被合成,导致抗病毒RNA沉默通路被激活,继而内源性宿主基因被敲除。如今,VIGS技术被广泛应用于通过类似于RNA干扰的过程来实现基因功能的短暂中断[2].这项技术的基础是植物内在的一种对抗病毒的机制[3.]、[4].携带一个或多个目标基因的工程病毒被引入植物。病毒复制过程中产生的双链RNA会触发任何具有序列相似性的RNA的降解,包括目标基因的内源性转录本。
辣椒是一种重要的蔬菜作物,它丰富了我们的饮食。辣椒的颜色主要由叶绿素、花青素和类胡萝卜素色素决定;类胡萝卜素决定了成熟辣椒果实的颜色。先前的研究表明,一系列的基因负责类胡萝卜素的形成,正是这些基因导致了辣椒果实颜色的变化[5]、[6].辣椒素是一种红色类胡萝卜素,使成熟的辣椒果实呈现红色,是辣椒类胡萝卜素生物合成途径的最终产物。辣椒素的生物合成途径从香叶香叶二磷酸(GGPP)开始,然后是植物烯合成酶(小组)将两分子GGPP转化为植物烯。在此之后,四次去饱和反应将植物烯转化为番茄红素,番茄红素在番茄红素β-环化酶(Lcyb),从而产生β-胡萝卜素。β-胡萝卜素在β-胡萝卜素羟化酶(Crtz).玉米黄质氧化酶催化玉米黄质转化为蒽黄质和紫黄质(齐柏林飞艇);然后,将蒽黄质和紫黄质转化为辣椒素Ccs而且齐柏林飞艇[6].的小组,Lcyb,Crtz而且Ccs已经从辣椒中克隆了参与辣椒素生物合成途径的基因[7].的se genes are directly involved in the red color of fruits [8]、[9].的capsanthin and capsorubin pigments are responsible for the red color in pepper fruits, and they are regulated byCcs基因。当水果开始成熟的时候Ccs基因开始表达,催化玉米黄质转化为辣椒素[10].的yellow color in pepper fruits is due to aCcs基因缺失或Ccs突变意味着辣椒素无法合成[11].这里提出的问题是胡椒水果的颜色是否与Ccs是否有基因表达。因此,了解调控辣椒颜色发育的主要基因的功能具有重要意义。
关于离体辣椒果实颜色变化的研究还很少。利用病毒诱导基因沉默(VIGS)技术,探讨了离体果实颜色形成的分子机制。本文以辣椒红素生物合成途径的关键基因沉默为重点,探讨不同基因被去除对辣椒果实颜色形成的影响。
结果
某些基因沉默对辣椒果实颜色的影响
的Ccs将TRV病毒载体携带的基因注射到离体果实中甜椒简历。R15。与对照相比,经TRV载体处理后的果实呈现不同的颜色Ccs基因,接种后15天(图1).的color of the fruits injected with the TRV vector carrying theCcs基因由绿色变为黄色(图1d),对照果实为绿色至红色(图2)1b).这些结果表明,黄色的果实颜色是由于沉默Ccs基因。我们用TRV/00进一步证实了这些结果,其中空载体(TRV/00 = TRV1和TRV2, noCcs基因)注射到离体辣椒果实中,发现果实与对照果实颜色相同(图1c).这证实了辣椒果实颜色的黄色是由于沉默的Ccs基因(图1).
利用vvigs对辣椒果实的表型变化进行了观察小组,Lcyb而且Crtz基因沉默。水果的颜色是橙色的小组基因被沉默(图2),而黄色当Lcyb而且Crtz基因被沉默(图3.而且4).
我们利用VIGS技术确定了参与辣椒果实颜色发育的关键基因的目的,并通过在成熟果实中观察证实了这些变化。
几个关键基因同时沉默过程中果实颜色的变化
同时对关键基因进行沉默,观察基因缺失对辣椒果实颜色的影响。首先,我们同时沉默两个基因(小组而且Lcyb),得到的辣椒果实颜色略为橙色(图5;额外的文件1:表S1)。其次,我们同时沉默了三个基因(小组,Lcyb而且Crtz),并观察到水果的颜色从绿色到黄色(图6).第三,我们同时沉默了4个关键基因(Ccs,小组,Lcyb而且Crtz),观察到辣椒果实的颜色从绿色变成了亮黄色(图7;额外的文件1:表S1)。的se results showed that single gene silencing and multi-gene silencing had different effects on the pepper fruit color, which revealed that several genes had synergistic effects on fruit color formation.
VIGS技术在辣椒果实中靶基因表达的变化
为了更好地了解水果颜色与基因表达的关系,我们分别从正常水果、TRV空载体注入水果和基因沉默水果中提取RNA。纯化总RNA,用逆转录酶合成第一链cDNA。实时荧光定量PCR检测基因表达。
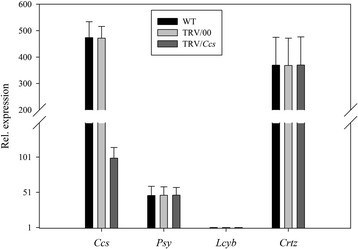
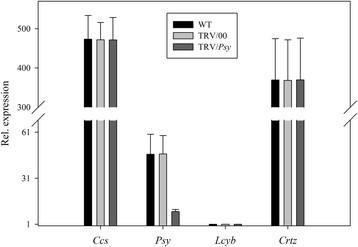
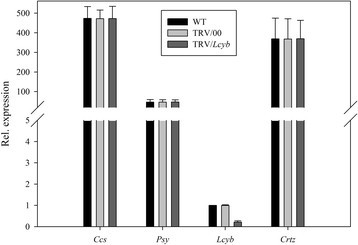
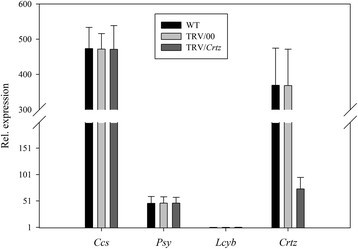
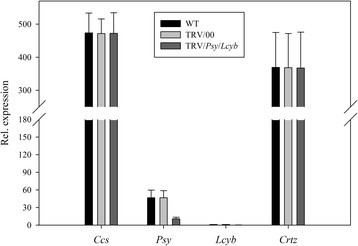
首先,我们研究了单个目标基因沉默时的表型水果颜色变异。从图8可以看出,当Ccs基因沉默,无显著差异CcsWT和TRV/00组的基因表达水平Ccs基因表达水平在TRV/Ccs组与WT组比较明显降低CcsTRV/Ccs组约为WT和TRV/00组的20%。所有其他基因(WT和TRV/00组或TRV/Ccs)的表情正常。这说明辣椒果实的黄色表型是由黄化引起的Ccs当TRV携带Ccs基因侵染离体辣椒果实(图8).同样的,当小组基因沉默,无显著差异小组WT和TRV/00组的基因表达水平小组基因表达水平在TRV/小组组与WT组比较明显降低小组TRV/小组组约为WT和TRV/00组的20%。所有其他基因(WT和TRV/00组或TRV/小组组)表现正常。这表明辣椒果实的橙型表型是由于小组当TRV携带小组基因侵染离体辣椒果实(图9).和/Lcyb和和/Crtz的表达式Lcyb,Crtz等基因在WT组、TRV/00组和TRV/靶基因组中相似。结果表明,辣椒果实呈深黄色的表型是由黄花色素引起的Lcyb基因或Crtz当TRV携带小组基因或Crtz基因感染离体辣椒果实(图10而且11).
其次,我们研究了几个关键基因同时沉默时果实颜色变异的表型。当小组而且Lcyb基因沉默的同时,无显著差异小组而且LcybWT和TRV/00组的基因表达水平小组而且LcybTRV/小组/Lcyb组与WT组比较显著降低小组而且LcybTRV/小组/Lcyb组约为WT和TRV/00组的20% ~ 30%。例如,所有其他基因,Ccs而且Crtz(WT和TRV/00组或TRV/小组/ Lcyb组)表现正常。这说明辣椒果实的微橙表型是由于小组而且Lcyb当TRV携带小组而且Lcyb基因感染离体辣椒果实(图12).
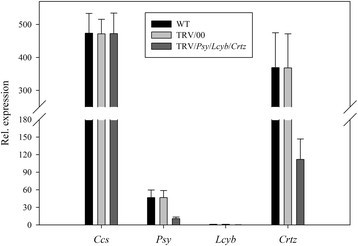
当小组,Lcyb而且Crtz基因沉默的同时,无显著差异小组,Lcyb而且CrtzWT和TRV/00组的基因表达水平小组,Lcyb而且CrtzTRV/小组/Lcyb/Crtz组与WT组比较,均显著降低小组,Lcyb而且CrtzTRV/小组/Lcyb/Crtz组约为WT和TRV/00组的20% ~ 30%。所有其他的基因,比如CcsWT和TRV/00组或TRV/小组/ Lcyb / Crtz)的表情正常。这说明辣椒果实的黄色表型是由黄化引起的小组,Lcyb而且Crtz当TRV携带小组,Lcyb而且Crtz基因感染离体辣椒果实(图13).
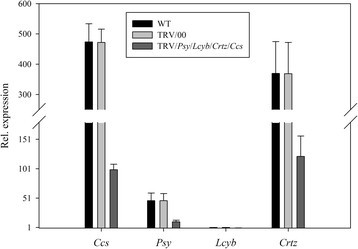
当小组,Lcyb,Crtz而且Ccs基因沉默的同时,无显著差异小组,Lcyb,Crtz而且CcsWT和TRV/00组的基因表达水平小组,Lcyb,Crtz而且CcsTRV/小组/Lcyb/Crtz/Ccs组与WT组比较显著降低小组,Lcyb,Crtz而且CcsTRV/小组/Lcyb/Crtz/Ccs组约为WT和TRV/00组的20% ~ 30%。这说明辣椒果实呈亮黄色的表型是由黄花色素引起的小组,Lcyb,Crtz而且Ccs当TRV携带小组,Lcyb,Crtz而且Ccs基因感染离体辣椒果实(图14).
相对基因表达水平与同时沉默小组,Lcyb,Crtz而且Ccs通过VIGS研究辣椒果实的基因。小组不同处理(包括不注射、注射空载体(TRV/00)和注射TRV/)对果实基因表达量的影响小组/Lcyb/Crtz/Ccs。Lcyb不同处理(包括不注射、注射空载体(TRV/00)和注射TRV/)对果实基因表达量的影响小组/Lcyb/Crtz/Ccs。Crtz不同处理(包括不注射、注射空载体(TRV/00)和注射TRV/)对果实基因表达量的影响小组/Lcyb/Crtz/Ccs。Ccs不同处理(包括不注射、注射空载体(TRV/00)和注射TRV/)对果实基因表达量的影响小组/Lcyb/Crtz/Ccs.显示的值是相对的LcybWT果实中的基因表达量被认为值为1。
综合以上结果可以看出,将携带目的基因的TRV载体注射到离体水果中,其基因表达水平为正常水果和空载体注射的基因表达水平的20%-30%(图3)8,9,10,11,12,13而且14).这表明靶基因沉默效率达到了70% ~ 80%。这些结果证明,基因沉默引起了果实颜色的变化。因此,目的基因沉默是导致果实颜色变化的原因之一。
当一个或一些基因沉默时,辣椒果实中类胡萝卜素的组成变化
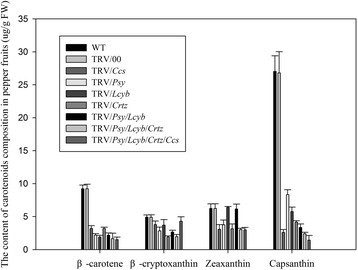
目的基因的高或低表达水平不足以解释辣椒果实颜色变异的表型。因此,我们采用高效液相色谱法测定辣椒果实中类胡萝卜素的组成(图15).采用高效液相色谱法分离β-胡萝卜素、β-隐黄质、玉米黄质和辣椒素,在454 nm吸光度下检测其含量。额外的文件2:图S1,附加文件3.:图S2,附加文件4:图S3,附加文件5:图S4,附加文件6:图S5,附加文件7:图S6,附加文件8:图S7,附加文件9:图S8,附加文件10:图S9包含HPLC概要文件。
我们知道β-胡萝卜素、β-隐黄质、玉米黄质和辣椒素是辣椒果实类胡萝卜素生物合成途径的主要成分。当一个或多个基因沉默时,这些类胡萝卜素成分会受到影响。从图15,可以看出WT和TRV/00在类胡萝卜素组成上没有明显差异。在辣椒果实中,当一个或几个关键基因被沉默时,辣椒素合成途径中代谢中间产物(β-胡萝卜素、β-隐黄质或玉米黄质)的含量有不同程度的降低,但辣椒素含量略有显著变化。因此,为了获得更深入的了解,需要更详细地考虑这些结果。首先,当沉默Ccsβ-胡萝卜素、β-隐黄质、玉米黄质和辣椒素的含量均低于对照组,但辣椒素含量高于对照组Ccs沉默显著减少。这表明,果实颜色的变化是由沉默引起的Ccs基因。其次,当沉默小组与野生型相比,TRV/ /中β-胡萝卜素、β-隐黄质、玉米黄质和辣椒素的含量小组水果显著减少。这表明辣椒素生物合成途径的中间产物受到沉默的负面影响小组基因,导致辣椒红素含量降低。这导致了正常和不发声的果实颜色存在显著差异。第三,当沉默Lcyb与野生型相比,TRV/ /中β-胡萝卜素、β-隐黄质和辣椒素的含量Lcyb果实以不同速率下降,辣椒素含量较对照显著降低。第四,当Crtz基因沉默,与野生型相比,β-胡萝卜素、β-隐黄质和玉米黄质含量略有下降,辣椒素含量显著下降。最后,当沉默几个关键基因时,我们可以看到β-胡萝卜素、β-隐黄质和玉米黄质含量有不同程度的降低,其中辣椒素含量显著降低。以上结果表明,无论是单基因沉默还是多基因同时沉默,辣椒红素含量均显著降低。这表明,果实颜色的变化是由于这些关键基因的异常表达,从而导致辣椒素生物合成途径中中间代谢产物(β-胡萝卜素、β-隐黄质或玉米黄质)的含量降低。最终,这影响了辣椒素的正常合成,导致水果的颜色不是正常的红色(图15).
讨论
VIGS是一种快速沉默靶基因以产生表型变化的方法;因此,VIGS可以用于快速识别基因的功能[12].TRV作为一种VIGS载体能够穿透植物生长的部分。这意味着感染既可以通过细胞分裂传播,也可以通过运输传播。因此,感染将更加均匀,而非感染细胞对沉默的稀释作用将更小。此外,trv诱导的沉默可以在未分化的生长点细胞中启动,而在未感染的细胞中,由于靶基因在感染前表达,沉默会被基因表达掩盖。
然而,沉默效应在大多数情况下仍然是短暂的,其出现的时间和持续时间是物种特有的。例如,大麦条纹花叶病毒(BSMV)在大麦中诱导持续1-2周的VIGS效应,以及TRV介导的加利福尼亚罂粟(Eschscholzia californica)在16周后消失,而由苹果潜伏球形病毒(ALSV)介导的沉默在大豆植株的整个生命周期内保持,甚至传播到下一代[13] - [15].使用这项技术的另一个挑战是营养组织和生殖组织中渗透水平的变化,这需要更多的植物进行表型筛选。沉默效应通常见于植物的分割部分,或局限于由几个连续节点形成的植物器官[13].本研究表明,trv诱导离体辣椒果实中VIGS效应持续30天,足以确定基因与果实颜色的关系。
从图中可以看出15WT组;当水果成熟时,主要的色素是辣椒素,它的含量比其他类胡萝卜素的含量高得多。辣椒果实中辣椒素含量越高,红色越深。接下来,我们分析了当关键基因被VIGS沉默时,果实颜色形成的原因。
首先,我们分析了单靶基因沉默时果实颜色形成的原因。通过分析基因表达水平和类胡萝卜素的组成,发现当Ccs基因表达量较低,辣椒素合成降低,辣椒果实呈黄色Ccs基因沉默。后小组基因沉默,小组基因表达量也较低,辣椒素合成降低,但辣椒素水平在TRV/小组组比TRV/Ccs组,所以辣椒果实的颜色是橙色的时候小组基因沉默。同样,和/Lcyb组,和/Crtz组后造成果色呈黄色小组基因或Crtz基因沉默。
其次,分析了多个关键基因同时沉默时果实颜色形成的原因。通过分析类胡萝卜素的基因表达水平和组成,发现小组而且Lcyb基因表达水平较低,辣椒素合成降低(TRV/小组/Lcyb组远低于WT组)小组而且Lcyb基因同时被沉默,这意味着辣椒果实的颜色是黄色的。后小组,Lcyb而且Crtz基因同时被沉默小组,Lcyb而且Crtz基因表达量也较低,辣椒素合成降低(TRV/小组/Lcyb/Crtz组远低于WT组),因此辣椒果实呈黄色。同样的,当小组,Lcyb,Crtz而且Ccs基因同时被沉默小组,Lcyb,Crtz而且Ccs基因表达量也较低,辣椒素合成降低(TRV/小组/Lcyb/Crtz/Ccs组远低于WT组),因此果实的表型为黄色(图15).
以往研究的重点一直是红色和黄色相反的遗传特征,他们确定红色是显性的,由第6染色体y座的一个单基因控制[11]、[16].辣椒成熟果实的颜色是由辣椒素决定的。研究人员发现,辣椒素是由capsanthin-capsorubin synthase (Ccs).Ha等[5]决定…Ccs黄椒中不存在基因。序列分析Ccs基因揭示了黄辣椒的两个结构突变,要么是过早的停止密码子,要么是帧移位的结果。一个Ccs在黄辣椒中未检测到转录本。的删除Ccs基因不是黄化成熟的原因辣椒[5].
以往有关辣椒果实颜色的研究有一个重点Ccs基因缺失或突变,而其他与水果颜色变化相关的关键基因研究较少。本研究的实验结果表明,果实颜色变黄和变橙不仅限于Ccs基因沉默,但它也与小组,Lcyb而且Ctrz基因沉默。这表明,在水果颜色基因方面仍有很多工作要做。VIGS技术可以用来分析基因功能,我们的实验分析了离体水果中与水果颜色相关的基因。由于基因被沉默,辣椒果实的颜色发生了变化,从而产生了许多不同的颜色。但这究竟是一个基因作用的结果,还是几个基因作用的结果,还有待进一步研究,这将在未来得到解决。将VIGS技术应用于离体果实,可以提供可靠的基因与果实颜色形成关系的信息,快速得出结果,具有重要意义。
结论
通过VIGS技术,我们确定了辣椒果实颜色变化与靶基因(小组,Ccs,Lcyb而且Crtz)沉默;而单基因沉默和多基因沉默对果实颜色的影响是不同的,这是由本文的数据确定的。与辣椒素相比,辣椒果实中β-胡萝卜素、β-隐黄质或玉米黄质含量极低。沉默单基因或一组基因后,辣椒红素含量显著降低。沉默任何一个关键基因都会直接或间接地影响辣椒素的合成。这导致了辣椒果实的颜色变化。将VIGS技术应用于辣椒离体果实,简化了研究辣椒果实颜色变化相关基因的研究过程。这为了解彩椒果实与遗传调控的关系提供了一个更好的平台。
方法
实验材料
的种子甜椒简历。耐贮运品种R15由中国科学院提供辣椒西北农林科技大学园艺学院课题组
辣椒种子播前处理
为打破辣椒种子的休眠,先用55°C的热水处理20 min,然后在28°C的水中浸泡5 h。然后用湿棉布覆盖种子,并将其放置在黑暗的生长室中。四天后,种子开始发芽,并转移到花盆中作为幼苗饲养。
植物生长情况及样品采集
一旦幼苗长出8-10片真叶,就被移栽到自然田间条件下的塑料高洞中。采自开花期(青熟期)后第35天的同龄果实,移送实验室进行VIGS试验。
病毒载体建设
烟草响尾蛇病毒(TRV)具有二部RNA。其RNA1和RNA2序列可以独立作为载体在植物和植物细胞中使用。TRV-RNA2载体可以携带异源核酸进入植物体内。TRV向量的示意图显示在附加文件中11:图S10。根据TRV的结构,设计了携带该病毒的引物BamH我网站上游和KpnI位点位于下游,他们将目的基因转移到TRV载体(附加文件12:表S2)。
利用基于trv的VIGS技术对辣椒品种R15进行了VIGS检测。3 '端四个片段Ccs,小组,Lcyb而且Crtz将开放阅读框克隆到pTRV2载体中,用于生成pTRV2/CcspTRV2 /小组pTRV2 /Lcyb和pTRV2 /Crtz向量(附加文件13:图S11),空载体pTRV/00作为阴性对照。
目的基因片段的克隆
沉默表达所需的载体基因片段大小为150 ~ 500 bp;PCR引物设计参考GenBank (http://www.ncbi.nlm.nih.gov/genbank)使用类胡萝卜素相关基因(附加文件12:表S2)。用Trizol纯化果实总RNA,进行cDNA合成,以cDNA为模板进行PCR扩增后,对PCR产物进行琼脂糖凝胶电泳,用DNA提取试剂盒回收目的基因片段;利用T4 DNA连接酶将回收的产物在16℃连接到克隆载体pMD19-T上过夜,转化为大肠杆菌DH5a。然后如果PCR成功,通过重组质粒的回收(附加文件14:图S12),从该基因片段可以得到基因沉默载体。分别将携带目的基因的质粒pTRV2和PMD19-T消化BamH我和Kpn然后将pTRV2酶切片段与目的基因片段连接在一起(附加文件15:图向)。
农杆菌的遗传转化
将pTRV1和pTRV2载体导入农杆菌属用冻融法提取GV3101 [17].通过PCR检测培养物中细菌,并将培养物保存以备后续实验使用。
病毒诱导基因沉默(VIGS)
The pTRV1, pTRV2, pTRV2/CcspTRV2 /小组pTRV2 /Lcyb和pTRV2 /Crtz带菌者与根癌土壤杆菌菌株GV3101的比例为1:1。的文化农杆菌属接种含有pTR1和pTRV2/00, pTRV2/CcspTRV2 /小组pTRV2 /Lcyb和pTRV2 /Crtz(OD600= 1.0),用1.0 ml无针消毒注射器注射到离体辣椒果实中。同时沉默多个基因的TRV载体组成为strv /Ccs,和/小组,和/Lcyb和和/Crtz1:1的比例。具体来说,和/小组/Lcyb/Crtz/Ccs是由TRV/Ccs,和/小组,和/Lcyb和和/Crtz以1:1的比例;和/小组/Lcyb/Crtz是由TRV/小组,和/Lcyb和和/Crtz以1:1的比例;和和/小组/Lcyb是由TRV/小组和和/Lcyb1:1的比例。处理果实(TRV/00, TRV/Ccs,和/小组,和/Lcyb和和/Crtz)接种15 d后进行基因分析。
水果中TRV病毒载体接种
在处理之前,用自来水仔细清洗水果,然后用蒸馏水再清洗三次,在室温下干燥。然后,在放入一个消毒的层流罩之前,这些水果的柄用融化的蜡封住。然后将水果放入75%酒精中消毒30秒,用消毒过的蒸馏水清洗3次。在果柄基部挖一个小洞,用1 ml无菌无针注射器将0.5 ml TRV病毒载体培养物注射到果实中。
水果放在消毒过的滤纸上,放在不锈钢板上,用食品级保鲜膜包裹。将钢板放置在暗室(18°C, 35% RH)中两天。处理2天后,将处理后的果实移入23°C/20°C、光周期为16 h /暗8 h、相对湿度为35%的生长室。对照果(TRV/00)和沉默果(TRV/Ccs,和/小组,和/Lcyb和和/Crtz)接种15 d后分别进行基因分析。
RNA分离及qRT-PCR分析
用Trizol (Invitrogen)法从正常水果(对照)和基因沉默水果中提取总RNA [18].使用NanoDrop仪器(Thermo Scientific NanoDrop 2000C Technologies, Wilmington, USA)用分光光度计测量总RNA的浓度,使用NanoDrop Technologies提供的A260/280和A260/230比值评估纯度。为了进行实时定量逆转录聚合酶链反应(RT-PCR)分析,使用PrimeScript™Kit (TaKaRa, Bio Inc, China),按照制造商的协议,从总RNA中提取500 ng合成第一链cDNA。使用SYBR®Premix Ex Taq™II (TaKaRa, Bio Inc,中国)进行实时RT-PCR。取SYBR®Premix Ex Taq™II 10.0 μl、cDNA稀释2.0 μl和正反引物0.8 μl的20 μl混合物进行Real-time RT-PCR分析。以95°C循环参数1 min完成扩增,95°C循环10s, 48°C循环30s, 72°C循环20s。内参基因为无论在哪里3 (AY486137.1)基因,如前所述[19].用于实时RT-PCR的引物序列显示在附加文件中12表S2。采用Delta-Delta Ct法计算各基因的相对表达量[20.].所有样本在3个重复中获得,每个处理至少有3个独立的生物重复。
WT、TRV/00和基因沉默辣椒果实中主要类胡萝卜素含量分析
利用Lopez-Raez等人的方法[21],提取并鉴定类胡萝卜素。具体来说,5.0 g果皮组织样品用含0.1%丁基羟基一甲苯(BHT)的丙酮5 ml提取。在黑暗中摇匀并冰上孵育10分钟后,在室温下3500 rpm离心10分钟,提取液转移到干净的试管中。样品用含0.1% BHT的丙酮5.0 ml重新提取2次。混合提取物在氮气流下干燥,试管密封并保存在−20°C,直到高压液相色谱(HPLC)分析。按照之前描述的高效液相色谱法进行[22].HPLC:样品采用垫片-pack VP-ODS C-18高效液相色谱柱(5 μm, 150 mm × 4.6 mm)分析(20 μL);洗脱液为乙腈:2-丙醇:水,比例为39:53:8 (a),乙腈:2-丙醇,比例为60:40 (B),梯度分布为0 - 30min,范围为0 - 100% B,流速0.3 mL/min,柱温40℃。取β-胡萝卜素、β-隐黄质、玉米黄质、辣椒素标准溶液(0.001 ~ 0.1 mg/mL),在454nm处作校准曲线。采用光电二极管阵列检测器捕获类胡萝卜素的吸收光谱,并与真实标准品进行HPLC滞留时间比较。此外,样品加标以验证具有相似保留时间的样品峰的身份。β-胡萝卜素产自日本东京丰岛北区;玉米黄质来自上海源业生物技术有限公司;β-隐黄质和辣椒素购自Extrasynthèse(法国Genay),作为正宗标准品。所有标准都是在冰上的弱光条件下处理的。 Standard solutions of β-carotene, β-cryptoxanthin, zeaxanthin and capsanthin standard were in methanol:acetonitrile (1:1,V/V). Aliquots were diluted in methanol:acetonitrile (1:1) to provide standard concentrations [22]、[23].
附加文件
缩写
- 和:
-
烟草使病毒
- 中收取:
-
病毒诱导基因沉默
- 发现:
-
转录后的基因沉默
- Ccs:
-
Capsanthin-capsorubin合酶
- Crtz:
-
β-胡萝卜素羟化酶
- Lcyb:
-
番茄红素-β环化酶
- 小组:
-
八氢番茄红素合成酶
- Ubi3:
-
泛素蛋白共扼
- 发现:
-
转录后的基因沉默
- DAA:
-
天开花
- 高效液相色谱法:
-
高压液相色谱法
- 二叔丁基对甲酚:
-
叔丁基羟基hydrox-ytoluene
- GGPP:
-
Geranylgeranyl diphospahate
参考文献
托布拉病毒的分子生物学。袁志军。1999,80:2799-2807。
Becker A, Lange M: vigs基因组学发挥作用。植物学报,2010,15:1-4。10.1016 / j.tplants.2009.09.002。
基于病毒诱导基因沉默的快进遗传学。植物学报,1999,2:109-113。10.1016 / s1369 - 5266(99) 80022 - 3。
刘倩,王欣,刘倩。rna诱导的沉默复合体的生化机制研究。细胞研究。2007,17:187-194。
Ha SH, Kim JB, Park JS, Lee SW, Cho KJ:类胡萝卜素积累的比较辣椒显示不同成熟颜色的品种:删除辣椒素-辣椒素合酶基因并不是形成黄色辣椒的先决条件。中国生物医学工程学报,2007,58(12):3135-3144。10.1093 / jxb / erm132。
张志刚,李志刚,张志刚。类胡萝卜素生物合成的研究进展辣椒植物学报,2010,37(3):393 - 393。10.1016 / j.plantsci.2010.04.014。
植物中维生素的合成:生育酚和类胡萝卜素。植物学报,2006,35(3):329 - 336。10.1146 / annurev.arplant.56.032604.144301。
Ronen G, Cohen M, Zamir D, Hirschberg J:番茄果实发育过程中类胡萝卜素生物合成的调控:番茄红素epsilon-环化酶基因在成熟过程中表达下调,在突变体Delta中表达升高。植物学报,1999,17:341-351。10.1046 / j.1365 - 313 x.1999.00381.x。
王志强,张志强,张志强,等:万寿菊花瓣发育过程中类胡萝卜素生物合成基因的表达分析。植物生理学报,2001,21(3):329 - 331。10.1023 /: 1006417009203。
Lefebvre V, Kuntz M, Camara B, Palloix A:辣椒红果色y位点的候选基因。植物化学学报,1998,36:785-789。10.1023 /: 1005966313415。
李文华,李文华,李文华,等:器官色素沉着位点的候选基因分析茄科.中国生物医学工程学报,2000,20(3):319 - 319。10.1073 / pnas.97.21.11192。
付德强,朱宝珠,朱海林,姜文斌,罗亚斌:病毒诱导番茄果实基因沉默的研究。植物学报,2004,19(3):393 - 393。10.1111 / j.1365 - 313 x.2005.02441.x。
张建平,刘建平,张建平,等:高效病毒诱导基因沉默(vis)在罂粟中的应用(Eschscholzia californica):将VIGS作为一种获取非模式植物功能数据的策略进行评估。机器人。2007,100:641-649。10.1093 / aob / mcm118。
以苹果潜伏球形病毒为载体的大豆种子中病毒诱导的基因沉默及大豆植株的出苗期。植物化学学报,2009,35(3):349 - 356。10.1007 / s11103 - 009 - 9505 - y。
张志强,张志强,张志强,等:大麦条纹花叶病毒诱导的单子叶植物基因沉默。植物学报,2002,30:315-327。10.1046 / j.1365 - 313 x.2002.01291.x。
金丝桃J,金丝桃K:辣椒类胡萝卜素系统基因型。生物学报,1996,6:305-319。
王杰杰,刘kkk,李大伟,张艳玲,赵强,何永明,龚志辉:一个新的辣椒过氧化物酶CaPOD基因参与辣椒对辣椒病害的防御反应和非生物胁迫抗性。化学学报,2013,34(3):357 - 361。10.3390 / ijms14023158。
王红梅,尹维成,王兆坤,To KY:应用微阵列技术从番茄不同组织中分离出适合发育分析的功能RNA。植物学报,2009,50:115-125。
万海杰,袁伟,阮美英,叶清军,王荣强,李志明,周广志,姚志平,赵军,刘世杰,杨玉军:辣椒逆转录实时荧光定量PCR归一化内参基因的鉴定(甜椒l .)。中国生物工程学报,2011,32(4):449 - 456。10.1016 / j.bbrc.2011.10.105。
Livak KJ, Schmittgen TD:使用实时定量PCR和2(T)(-Delta Delta C)方法分析相对基因表达数据。方法。2001,25:402-408。10.1006 / meth.2001.1262。
张建平,张建平,李文伟:番茄高色素2dg突变体对Orobanche spp.感染的敏感性研究。农业食品化工学报,2008,56:6326-6332。10.1021 / jf800760x。
Rodriguez-Uribe L, Guzman I, Rajapakse W, Richins RD, O’connell MA:橙色色素中的类胡萝卜素积累甜椒水果,受到多个层面的监管。中国生物医学工程学报,2012,63(1):517-526。10.1093 / jxb / err302。
黄秋梅,刘文华,刘文华:黄秋梅果实中β -胡萝卜素和类胡萝卜素含量的变化辣椒.植物科学,2001,36(4):746-749。
确认
国家自然科学基金(No. 31272163)、浙江省重点科技项目(No. 2011C02001)、国家农村科技“十二五”规划(No. 2011bad12b03)、陕西省科技协同创新工程项目(No. 2012KTCL02-09)。语言编辑由MogoEdit(西安)有限公司完成http://www.mogoedit.com).
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者声明他们之间没有利益冲突。
作者的贡献
ZHG, SLT和LL设计了研究,分析了数据,起草了手稿。SLT和WGC为RT-qPCR设计引物并收集病毒样本。SLT和ZHG开展了病毒载体构建和VIGS技术。LL和WGC对RT-qPCR检测方法进行了优化,参与了研究的设计、引物设计、样品收集、统计分析和双工RT-qPCR方案的设计。LL和SNMS从辣椒果实中提取RNA。SLT撰写了论文,所有作者阅读并通过了最终稿。
电子辅料
12870 _2014_314_moesm1_esm.docx
附加文件1:表S1。:的measurement of color variation in yellow, deep yellow and orange fruits between the phenotypes. WT: fruits not injected; TRV/00: fruits injected tempt vector; the vectors that tobacco rattle virus (TRV) carried target gene. They are demarking TRV/小组/Lcyb/Crtz/Ccs,和/小组/Lcyb/Crtz,和/Ccs,和/小组/Lcyb,和/Crtz,和/Lcyb,和/小组.平均值用色度仪(日本制造)测定。以野生型果实的色度作为测定的参考△l△一个和△b.每个研究材料为3个独立的生物重复。(多克斯19 KB)
12870 _2014_314_moesm2_esm.jpeg
附加文件2:图S1。:解决辣椒UPLC提取果皮类胡萝卜素。类胡萝卜素在454nm处被吸收,随后在C18色谱柱上分离,如方法所述。(A)标准物(每个10ppm):辣椒素(7.36分钟),玉米黄质(7.93分钟),β-隐黄质(10.88分钟)和β-胡萝卜素(23.04分钟)。(B)提取的果皮WT格式(JPEG 83 KB)
12870 _2014_314_moesm3_esm.jpeg
附加文件3:图S2。:解决辣椒UPLC提取果皮类胡萝卜素。类胡萝卜素在454nm处被吸收,随后在C18色谱柱上分离,如方法所述。(A)标准物(每个10ppm):辣椒素(7.36分钟),玉米黄质(7.93分钟),β-隐黄质(10.88分钟)和β-胡萝卜素(23.04分钟)。(B) TRV/00中提取的果皮。(JPEG 85 KB)
12870 _2014_314_moesm4_esm.jpeg
附加文件4:图S3。:解决辣椒UPLC提取果皮类胡萝卜素。类胡萝卜素在454nm处被吸收,随后在C18色谱柱上分离,如方法所述。(A)标准物(每个10ppm):辣椒素(7.36分钟),玉米黄质(7.93分钟),β-隐黄质(10.88分钟)和β-胡萝卜素(23.04分钟)。(B) TRV/Ccs.(JPEG 86 KB)
12870 _2014_314_moesm5_esm.jpeg
附加文件5:图S4。:解决辣椒UPLC提取果皮类胡萝卜素。类胡萝卜素在454nm处被吸收,随后在C18色谱柱上分离,如方法所述。(A)标准物(每个10ppm):辣椒素(7.36分钟),玉米黄质(7.93分钟),β-隐黄质(10.88分钟)和β-胡萝卜素(23.04分钟)。(B) TRV/小组.(JPEG 96 KB)
12870 _2014_314_moesm6_esm.jpeg
附加文件6:图S5。:解决辣椒UPLC提取果皮类胡萝卜素。类胡萝卜素在454nm处被吸收,随后在C18色谱柱上分离,如方法所述。(A)标准物(每个10ppm):辣椒素(7.36分钟),玉米黄质(7.93分钟),β-隐黄质(10.88分钟)和β-胡萝卜素(23.04分钟)。(B) TRV/Lcyb.(JPEG 87 KB)
12870 _2014_314_moesm7_esm.jpeg
附加文件7:图S6。:解决辣椒UPLC提取果皮类胡萝卜素。类胡萝卜素在454nm处被吸收,随后在C18色谱柱上分离,如方法所述。(A)标准物(每个10ppm):辣椒素(7.36分钟),玉米黄质(7.93分钟),β-隐黄质(10.88分钟)和β-胡萝卜素(23.04分钟)。(B) TRV/Crtz.(JPEG 91 KB)
12870 _2014_314_moesm8_esm.jpeg
附加文件8:图S7。:解决辣椒UPLC提取果皮类胡萝卜素。类胡萝卜素在454nm处被吸收,随后在C18色谱柱上分离,如方法所述。(A)标准物(每个10ppm):辣椒素(7.36分钟),玉米黄质(7.93分钟),β-隐黄质(10.88分钟)和β-胡萝卜素(23.04分钟)。(B) TRV/小组/Lcyb.(JPEG 90 KB)
12870 _2014_314_moesm9_esm.jpeg
附加文件9:图S8。:解决辣椒UPLC提取果皮类胡萝卜素。类胡萝卜素在454nm处被吸收,随后在C18色谱柱上分离,如方法所述。(A)标准物(每个10ppm):辣椒素(7.36分钟),玉米黄质(7.93分钟),β-隐黄质(10.88分钟)和β-胡萝卜素(23.04分钟)。(B) TRV/小组/Lcyb/Crtz.(JPEG 92 KB)
12870 _2014_314_moesm10_esm.jpeg
附加文件10:图S9。:解决辣椒UPLC提取果皮类胡萝卜素。类胡萝卜素在454nm处被吸收,随后在C18色谱柱上分离,如方法所述。(A)标准物(每个10ppm):辣椒素(7.36分钟),玉米黄质(7.93分钟),β-隐黄质(10.88分钟)和β-胡萝卜素(23.04分钟)。(B) TRV/小组/Lcyb/Crtz / Ccs.(JPEG 87 KB)
12870 _2014_314_moesm11_esm.jpeg
附加文件11:图S10。:Schematic representation of TRV. LB: left borders of the T-DNA; RB: right borders of the T-DNA; 2 × 35S: two copies of the cauliflower mosaic virus 35S promoter; CP: coat protein; RdRp: RNA-dependent RNA polymerase; MP: movement protein; 16 K: 16 KDa protein; R: ribozyme; N: nos-terminator; and MCS: multiple cloning sites. (JPEG 87 KB)
12870 _2014_314_moesm12_esm.docx
附加文件12:表S2。:Primers were used in quantitative real-time RT-PCR and plasmid construction.小组:植物烯合酶基因;Crtz: β-胡萝卜素羟化酶基因;Lcyb:番茄红素-β环化酶基因;Ccs:红辣椒素/红糖苷合酶基因;Ubi3作为内参(内参基因);强调GGATCC是BamH我的核酸内切位点,下划线是GGTACCKpn我酶位点。(多克斯15 KB)
12870 _2014_314_moesm13_esm.jpeg
附加文件13:图S11。:Schematic representation of recombinant TRV vectors carrying target genes. From theBamH我和KpnI限制性内切酶位点,将目的基因片段与TRV载体连接为pTRV2/CcspTRV2 /小组pTRV2 /Lcyb和pTRV2 /Crtz.(JPEG 101 KB)
12870 _2014_314_moesm14_esm.jpeg
附加文件14:图S12。:Detection of cloned PMD19-T vectors by PCR. The target gene fragments were detected by colony PCR and ligated into the cloning vector pMD19-T before being transformed into大肠杆菌DH5a。从测序结果可知,克隆载体已成功构建,其中包含该基因的片段Ccs,小组,Lcyb而且Crtz基因。(JPEG 29 KB)
12870 _2014_314_moesm15_esm.jpeg
附加文件15:图S13。:Construction of TRV expression vectors. The target gene fragments were detected by colony PCR and gene sequences that showed the TRV expression vectors carrying fragments of theCcs,小组,Lcyb而且Crtz基因构建成功。(JPEG 45 KB)
作者提交的原始图像文件
权利和权限
开放获取本文根据知识共享署名4.0国际许可协议授权,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和源代码,提供知识共享许可协议的链接,并说明是否进行了修改。
本文中的图像或其他第三方材料均包含在本文的知识共享许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的知识共享许可中,并且您的预期使用不被法定法规允许或超过允许的使用,您将需要直接从版权所有者获得许可。
如欲查阅本牌照副本,请浏览https://creativecommons.org/licenses/by/4.0/.
知识共享公共领域转让豁免书(https://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在对数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
田SL,李L,柴WG。et al。沉默辣椒红素合成途径关键基因对离体辣椒果实颜色的影响BMC植物杂志14,314(2014)。https://doi.org/10.1186/s12870-014-0314-3
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-014-0314-3
关键字
- 烟草使病毒
- 中收取
- 分离的水果
- 水果的颜色
- 辣椒(Capsicum annuum L.)
- 辣椒红