摘要
背景
香蕉是热带和亚热带地区最重要的农作物之一。它是一种更年期水果,经历乙烯依赖的成熟过程。一旦开始成熟,其进行速度很快,使采后寿命短,这可能导致严重的经济损失。在果实成熟过程中,会发生许多生理和生化变化,来自不同代谢途径的数千个基因被吸收,从而产生成熟的可食用的果实。为了更好地理解成熟的潜在机制,我们进行了一项研究,评估了果实在成熟过程中转录组的整体变化。
结果
我们测序了香蕉的未成熟和成熟阶段的转录组(穆萨accuminata;矮人腔体积果实。使用454 GSFLX钛平台测序转录om,导致超过7,00,000个高质量(HQ)读数。读取的组装导致19,410个葡萄片和92,823单身。鉴定的大量差异表达基因与成熟的依赖性方法相关联,包括乙烯生物合成,感知和信号,细胞壁降解和芳族挥发物的产生。在香蕉水果转录om中,我们发现在Kegg数据库中描述的120例途径中包含的转录物。在成熟期间,扩展素和木糖葡聚糖胰蛋白酶或水解酶(xth)基因家族的成员是高度上调的,这表明它们可能在果实软化中发挥重要作用。还鉴定了涉及合成芳族挥发物和先前涉及成熟的转录因子家族成员的几种基因。
结论
在香蕉果实成熟过程中发现了大量的差异调控基因。其中许多都与细胞壁降解和芳香挥发物的合成有关。大量差异表达基因与任何数据库都不一致,可能是香蕉中的新基因。这些基因可以作为未来研究的候选基因,以确定它们在香蕉果实成熟中的作用。本研究开发的数据集将有助于制定控制香蕉果实成熟和减少收获后损失的策略。
背景
香蕉水果是大约4亿人的主食。香蕉是一种大型草本植物,常绿,开花的单子叶植物,属于芭蕉属(芭蕉科姜目)。大多数栽培的香蕉是由杂交得来的穆萨acuminata和穆萨balbisiana。果实开发和成熟是一种受大量因素影响,包括光,激素,温度和基因型的复杂过程。在包括香蕉的情况下,在包括香蕉的情况下成熟相关事件,导致基因表达的发育和生理学上调节的变化,最终会带来果实颜色,质地,味道和香气的变化[1] - [3.].果实成熟和软化涉及不可逆的生理和生化变化,有助于香蕉果实的易腐性。早熟给农民和消费者都带来了重大损失。因此,迫切需要开发利用基因工程方法延缓成熟和软化过程的工具。
最近,使用Dh-Pahang的Banana的基因组进行测序,双倍单倍体(523 MB)衍生自亚种的种子二倍体m . malaccensis,导致鉴定36,542蛋白编码基因[4.].为了支持和加速香蕉的遗传和基因组研究,最近开发了香蕉基因组枢纽[5.].通常观察到香蕉的成熟涉及细胞壁的广泛变化[6.].早期对香蕉的研究发现了与细胞壁降解相关的多个基因家族[7.] - [11.].除了软化相关基因外,在香蕉中还发现了一些与乙烯生物合成、信号转导和转录因子有关的基因[12.]、[13.].采用了减法杂交和差异文库筛选等方法[11.]、[14.] - [16.]在香蕉果实成熟期间鉴定差异表达的基因。然而,除了这些基因之外,成熟可能涉及在香蕉中尚未识别的数百个基因的上调和下调。
表达序列标签(ESTs)在基因发现方面是一个有用的工具,特别是在基因组信息有限的非模式植物中[17.]、[18.].EST数据集的深入生成和比较提供了基因组中所有表达区域的信息,可用于表征果实成熟过程中基因的表达模式。利用下一代测序技术(NGS),这样的数据库已经被开发出来,用于发现和预测与水果发育和成熟有关的基因。在转录组分析Curcumas的Melo.[19.]、[20.),柑橘类(21.]、[22.蓝莓(23.], 辣椒 [24.杨梅[25.,甜橙[26.猕猴桃[27.)、葡萄(28.]、[29.]番茄[30.,西瓜31.和许多其他研究提供了深入了解参与果实发育和成熟的基因和途径[32.].这些数据库也是一种丰富的基因衍生的分子标记来源(例如,简单的序列重复,SSR)可用于种质育种或物理映射。
我们研究的主要目的是在分子水平上增加对香蕉果实成熟的基本认识。在本研究中,我们基于454 GS FLX Titanium平台,利用NGS技术建立了未成熟和成熟香蕉果实转录组数据集。我们确定了参与乙烯生物合成及其感知、水果软化和其他启动成熟过程以生产可食用香蕉果实的基因。这项分析提供了关于香蕉果实成熟过程中表达的许多以前未被识别的基因的新信息。其中一些基因可能是潜在的候选基因,可以通过操纵这些基因来延长香蕉的采后货架期,减少经济损失。作为本研究的一部分,我们鉴定了EST-SSRs的分子标记,这将有助于香蕉的标记辅助育种。此外,我们将读取映射到穆萨渐尖香蕉基因组,以及德诺维组装考虑物种序列的变异差异。然后再次映射到Banana基因组中获得的Contigs以鉴定不同基因家族的成员。
结果与讨论
对香蕉基因组的测序,注释和映射
在454-GS FLX Titanium平台上,对未成熟和成熟香蕉果肉(品种Harichhal)的cDNA文库进行了半平板测序,以研究香蕉果实成熟过程中发生的整体变化。每个转录组产生超过700万个高质量(HQ) reads(见表)1),用材料和方法中描述的GS汇编程序进行组装。
为了研究Banana果实成熟期间基因的差异表达,使用GSassembler程序中描述的材料和方法中描述的参数标记,汇集和组装了未成熟和成熟果实转录om的总数。总共14,83,544名读数组装成19,410个Contigs和92,823单身。在该组件中,10,715个Contigs被认为是具有914 bp的平均大小的大折叠。所有Contig的平均Contig长度为642bp,具有80个读数的Contig深度。将这些Contigs和单身汇集在一起,并称为对比转录物。比较转录物的总数为1,12,233。由于许多基因家族具有多个成员,部分组装的转段可能导致差异分析的错误结果。为了排除这种可能性,未成熟和成熟转录om的组合组装优于成熟和未成熟om的单独组装成绩单。为了向比较转录物进行注释,使用BLASTX程序和使用RPSBLAST程序对CDD查询转录物。使用BLASSX程序和CDD对MSU米蛋白查询。附加文件中提供了由不同数据库注释的比较转录物总数的信息1额外的文件2额外的文件3.额外的文件4.。
组装的斑块也被映射到Musa基因组以注释该基因,并研究两种文库中的差异表达。将获得的19,410个葡萄片和92,823单身映射到目前在Musa基因组中鉴定的36,542个基因。在葡萄球基因组中的15,978个ContIgons,15,978个Contigs和59,410个单例中映射到21,298个基因,并均为映射的映射基因的8,490个映射基因。使用NCBI NR数据库,TAIR蛋白,MSU7版本米蛋白与使用BLASTX程序的CDD注释,与Musa Genome不匹配的剩余3,432个葡萄蛋白。其中,247个Contigs被注释,剩余的3,185个Contigs对香蕉转录组是独一无二的。与MUSA Genome不匹配的3,432个Contig可能是由于DH-Pahang和Harichhal品种或转移元素的基因组序列之间的差异,实验人工制品或Dh-Pahang基因的错误预测。此外,不能排除在成熟过程中替代转录事件的转录事件的可能性,导致唯一的转录物导致独特的转录物。在其他植物中报道了植物生长和发育期间的这种替代剪接[33.]、[34.].15,978个Contigs匹配到12,315个Musa基因。其中,9,809个Contigs在Musa Genome中有一个CD匹配;虽然6,169个Contigs匹配为2,506个Musa CD,表明映射到CDS序列的多个Contig。这可能是由于部分聚体或由于转录物的替代剪接。为了识别替代的拼接转录物,如材料和方法中所述分析这些6,169个ContIgs和2,506个Musa CD,以识别可选的剪接转录物。发现映射到402个CD的1,243个Contigs是拼接到2,104个Musa CD的4,926个ContIG,均为部分转录物。
比较转录组分析和差异基因表达
一般来说,特定contig中的读序列数是该特定contig的转录本丰度的衡量标准,然而,这也可能是由于取样错误,而不是真正的基因表达差异。为了排除这种可能性,我们应用了三种统计检验P-value, FDR和R统计检验。在R统计检验中[35.只有R值> =8被过滤,>可信度为99%。在这个测试中,单例在统计学上是不重要的,因此被丢弃,因为contigs是由未成熟和成熟文库的读集组成的。使用19,410个contigs的统计数据,只有1,921个contigs受到了显著差异的监管。其中,与未成熟果实相比,成熟果实中有653个基因表达上调(超过2倍),837个基因表达下调(超过2倍)5.).在这些基因中,107个上调基因和83个下调基因在分析的任何数据库中都没有给出结果,它们可能是新的基因,可能参与了香蕉果实成熟过程中的不同途径或分子网络。当D'Hont等人利用DH Pahang品种成熟过程中的差异表达基因进行分析时[4.[353个基因显示出差异表达。大量基因(98%)在我们的分析与D'Hont等人之间具有类似的表达模式。(2012)[4.].一组569个差异表达基因在Musa基因组中具有CDS对应物,但在早期的研究中没有显着表达[4.].这569个差异表达基因可能在香蕉品种Harichhal的成熟过程中发挥重要作用。为了进一步注释基因,研究代谢途径和功能注释,我们将TIGR和TAIR基因ids的KEGG描述转移到同源香蕉转录本上。
参与香蕉成熟的基因
在香蕉果实成熟过程中,纸浆组织损失其趋势,软化并产生芳族挥发性。为了实现这些变化,差异地表达了基因的曲目以调节这些过程。在以下部分中,我们基于其在软化和香气和风味中的预测作用总结了基因表达的变化。
香蕉果实成熟期间上调基因
软化香蕉组织
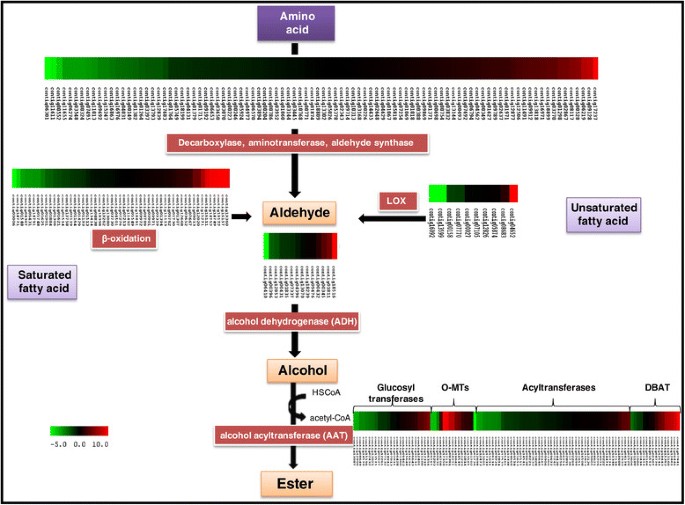
细胞壁水解在植物生长和发育中起重要作用,包括成熟和应力反应。参与细胞壁水解的大多数基因是多烯家族的成员,许多人在细胞壁代谢中具有高度专业化的功能[36.].软化的过程开始于成熟的开始。收集成熟组织的阶段是已经开始软化的果实。之前报道,负责香蕉软化的基因家族包括扩展蛋白,枸杞酶和Xylogulcan内转糖基酶[6.] - [9.].在本研究中,与未成熟的果实相比,这些基因家族的几个成员在成熟水果中表达了显着更高的表达,每个家庭的表达式增加12倍(表2).在我们的研究中,我们分析了作为纤维素酶,多肢乳糖酶(PG),果胶酯酶,果胶酶(PL),Xth和Anginein(图)的基因的表达1).我们观察到,基因表达的最大增加与基因家族PL,xth和扩展蛋白相关。
本研究鉴定了5个不同的扩展蛋白基因,其中4个基因在成熟果实中显著上调。从XTH基因家族中鉴定出13个成员,其中几个在成熟果实中表达显著上调。木葡聚糖是单子叶植物细胞壁的主要组成部分,它在香蕉成熟过程中的作用是可以理解的。XTH基因家族的成员也被证明在其他肉质水果如番茄和桃子的成熟中发挥重要作用[37.].同样地,PL基因家族鉴定出5个成员,这些成员都在成熟过程中高表达。
PolyGalactulOnase和纤维素酶也以香蕉中的多烯烃家族存在。这些家庭的一些成员在成熟期间显着上调;然而,它通常不如扩展蛋白,xth和Pl基因家族的成员那么高。PME基因家族的一些成员也上调;然而,由于PME的一个功能是修改果胶,以使它们更易获得PL和PG,因此PME的转录物可能已经在研究中使用的成熟水果(乙烯后4天)中有所下降。据报道,乙烯暴露后2天观察到最高PME活性,并在第3天下降明显下降[6.].每个基因家族的fold change的详细信息在附加文件中提供6.。
beta葡萄糖苷酶(GH家族17)在香蕉果实软化过程中也起着重要作用。在我们的分析中,多达7个β葡萄糖苷酶基因在成熟香蕉果实中的表达比未成熟香蕉果实中的表达高出两倍以上。除了在细胞壁降解的作用外,beta葡萄糖苷酶也参与植物激素的水解(即赤霉素、脱落酸和细胞分裂素的苷)和氰苷的代谢。在禾本科中,这些糖苷已被证明参与莽草酸以及芳香酸的生物合成途径[38.].细胞壁软化相关基因是上调最多的基因之一,表明在分子水平上,果实软化是香蕉果实成熟过程中的一个主要过程。
与香气和风味化合物相关的基因
香蕉果实的香气归因于异戊醇,乙酸异戊酯,乙酸丁酯,elemecine和其他几种挥发物存在39.].这些挥发物主要由苯丙酸途径、脂肪酸生物合成途径和异亮氨酸生物合成途径产生[40].由于香气和风味挥发物的主要成分是酯类,本文分析了氨基酸、脂肪酸和不饱和脂肪酸生物合成酯类相关基因的表达。每一步所涉及的基因都被鉴定出来(图)2)和差异表达检测。糖到醇的转化是由抗利化酶介导的,抗利化酶通过AATs进一步转化为酯类。至少有10个注释为ADH基因的contigs在成熟果实中比未成熟果实中表达了2倍以上的上调。同样,与未成熟的水果相比,成熟水果中的脂肪加氧酶基因也显著上调。成熟样品中大量转移酶表达上调,可能在香气挥发物的生产中起一定作用。
我们的分析还表明,与未成熟的果实相比,丁基转移酶,乙酰转移酶,乙酰转移酶,O-甲基转移酶的基因在成熟的水果中显着上调(表3.).已知BAHD酰基转移酶基因家族成员参与乙酰辅酶a依赖的次级代谢产物酰化,从而形成酯和酰胺。Hoffmann等人,[41]将这些在四个不同的组中分类,即(a)丙烯麻酰基转移酶参与紫杉醇生物合成(b)酰基转移酶参与与未键合的底物和(d)羟基氨基酰基酰基转移酶的花青素生物合成酶(c)酶。在本研究中,在成熟的果实中,至少30个酰基转移酶显着上调。作为3-N-Debenzoyl-2-脱氧酸N-苯甲酰基转移酶注释的其中一种基因是成熟果实中最高调节的基因(10倍)之一。该酶系列参与紫杉醇生物合成途径的最后一步的酰化。羟基氨基酰基酰基转移酶还显示成熟水果中的显着增加(5.8倍)(附加文件6.).这些基因在成熟果实中的显著高表达表明它们参与了香蕉挥发性酯的生产,而挥发性酯可能有助于成熟果实的香气。AAT在酯形成中的作用已经确定[42].在成熟果实中,包括4-香豆酸-辅酶A连接酶1、过氧化物酶体-辅酶A合成酶在内的一组其他基因也上调2和额外的文件6.).我们的分析表明,挥发性酯一般由氨基酸合成而不是脂肪酸降解途径(图)2).
香蕉果实成熟期间的下调基因
当果实成熟成熟时,生长和发育所需的基因就不需要了,因此被下调了。我们利用比较转录组数据进行分析,以识别这些基因。液泡ATP转运体在果实发育过程中起着重要的作用,它有助于在液泡膜上形成一个质子梯度,从而有效地运输营养物质、代谢物和蛋白质。随着软化过程的开始,这些蛋白质不再需要,因此编码V-ATPases的基因在成熟水果中的表达比未成熟水果中的表达明显下降。在本研究中,下调幅度最大的基因是跨膜转运体和反转运体。其中,编码atp酶/氢转运焦磷酸酶的基因AVP1在成熟果实中的表达量比未成熟果实中的表达量减少了12倍,是我们分析的所有转录本中下降幅度最大的3.).这些基因主要涉及维持pH平衡和重要代谢物的运输。随着成熟的进行,水果液泡膜开始退化,因为这些类型的转运蛋白可能不需要。随着各种家庭的运输司机被调控,多达112个基因被注释(附加文件5.).
在我们的分析中,负责RNA加工和蛋白质合成的许多基因在成熟的果实中下调。在添加中,下调了与花和水果发育相关的大量转录因子和基因。我们观察到几种花卉归属基因,FT基因,胃苷浓度在成熟果实中的响应基因表达的下降。在成熟阶段,这些调节蛋白可能不再需要,因此与未成熟的果实相比,成熟果实中的基因表达显着降低。
香蕉果实成熟过程中的调控途径
匹配与TAIR IDS匹配的所有CONTIG的KO ID,并使用KEGG PATWAY数据库分析不同途径中基因的参与。分析表明,未成熟和成熟果肉的转录组包括与许多不同的Kegg途径相关的基因。在新陈代谢,遗传信息处理,环境信息处理,细胞过程和生物系统下,来自香蕉的基因被映射到Kegg途径上。鉴定的代谢途径包括碳水化合物,脂质,氨基酸,核苷酸,能量代谢。用于水稻基因组的Kegg途径数据库具有120个途径,并且在香蕉中鉴定了每种途径的途径和基因(附加文件7.),表明在我们的研究中完全覆盖了转录om。差异表达基因的去分析表明,大多数熟化的分子化基因表达被分配给转录因子,核酸活性和受体结合活性的有机群。超过50%的转录om中的转录物参与能量途径,水解酶活性,对非生物和生物刺激和其他生物过程的反应。这些是在成熟期间活跃的一些途径,而且该数据可能提供探索成熟相关基因的平台(附加文件8.).
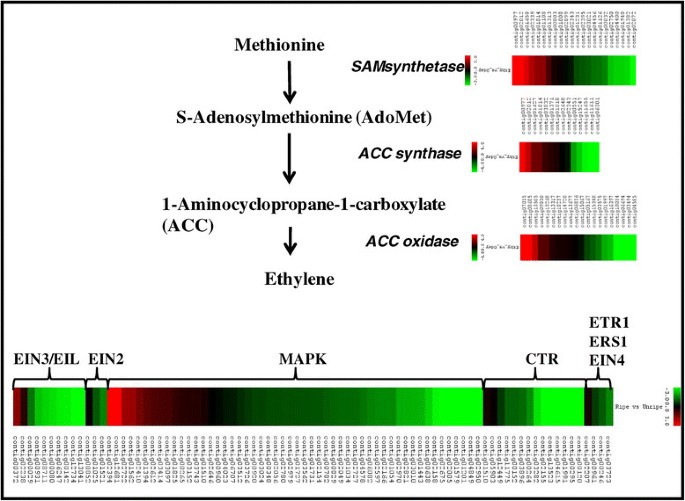
由于乙烯的合成和感知是香蕉果实成熟的关键,本文对乙烯合成和信号转导相关基因进行了综合分析。几个contigs被鉴定为与乙烯生物合成相关的基因,包括SAM、ACS和ACO(图)3.).每个基因家族的不同成员在成熟和未成熟的果实中表现出不同的基因表达。由于每个基因家族都有几个成员,所以有的基因表达上调,有的基因表达下调或保持不变。可以认为,上调基因与系统2乙烯生物合成有关,而下调基因与系统1乙烯生物合成或其他生物过程有关[43].此外,在我们的分析中也鉴定出与乙烯信号转导相关的大量基因。许多这些基因也是在香蕉中首次鉴定出来的。在我们的研究中确定了与CTR1和CTR1相关的14个成员。类似地,在转录组数据库中也鉴定了与ETR1,ETR1,ET1,EN,EIN2,EIN3,EIN4,EIL相关的基因。在另一个研究中,通过基因组分析,还确定了25个MAPK成员。其中,许多人进行了差别调节[44]并且可以握住在果实成熟过程中找到乙烯信号转导通路的缺失成员的关键。
转录因子及其在成熟中的作用
通过转录因子(TFS)的基因调节在生物和细胞过程中起重要作用。为了研究香蕉果实成熟中的转录因子的潜在作用,植物转录因子(TF)数据库中的所有基因[45下载并使用blastx程序对香蕉转录组中的supercontigs进行查询。植物TF数据库中有29473条序列,分布在74个TF基因家族中。使用可接受e值10的下限−10,我们在我们的联合转录组中鉴定了74个不同的TF基因家族(表4.).最丰富的转录因子与C3H、MADS、myb相关、bZIP、NAC、WRKY基因家族相关。这些转录因子在植物中由多基因家族编码,在香蕉中很可能以多基因家族的形式存在。部分MADS、bHLH、WRKY、AP2-EREBP、myb相关和NAC结构域TF家族在成熟果实中均有高表达。据报道,MADS域转录因子参与了果实成熟的各个过程[3.]、[12.]、[43]、[46].在我们收集的成熟水果阶段,最重要的过程是细胞壁降解和芳族挥发物的合成。已知MAD和NAC结构域蛋白质彼此相互作用,以及其他细胞壁相关的基因促进剂,如膨胀蛋白和其他相互作用[43].由于这些TFS中大多数属于多烯家族,因此许多TF在成熟过程中被调节,表明它们在熟化和果实发育的各个阶段期间的差异作用。
香蕉果实成熟过程中调控表达的新基因
在本研究中确定了没有显示任何数据库但是显着且差分调节的大量基因(附加文件9.).这些基因可能与细胞壁软化、芳香挥发物的产生、果皮颜色的变化和风味化合物的形成等过程有关。其中548个基因上调2倍,648个基因下调2倍,3185个基因未在NR、AGIprot、Rice、CDD数据库中得到任何结果。
鉴别差异基因表达
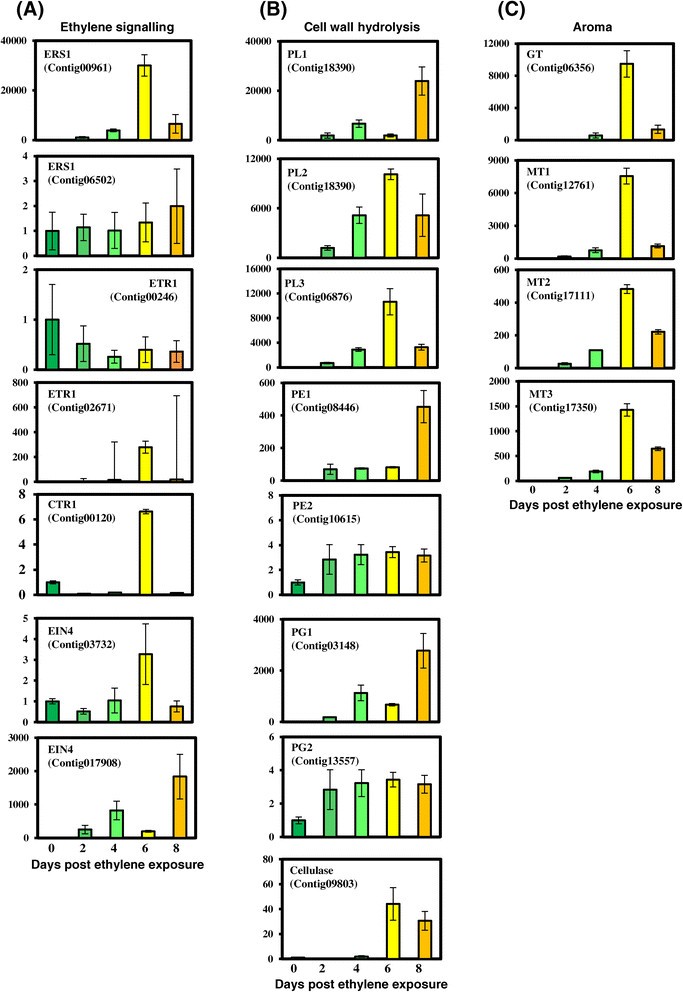
通过RT-qPCR证实了部分基因的差异表达。这些基因是从三个类别中随机选择的,包括与乙烯信号传递、芳香和软化相关的基因。在未成熟果实(0)和乙烯处理后2、4、6和8天检测了每个基因的表达(图)4.).关于与乙烯信号传导相关的基因,在检查的乙烯受体基因中,在成熟期间,ERS1样基因的表达和EIN4样基因显着增加(> 10倍)。从乙烯受体下游的Ctr1基因最初显示出在熟化的早期阶段中表达的表达还原,但在乙烯暴露后6天表达显着增加(图4.).同样,ETR1基因在乙烯暴露后第2天表达减少,第6天表达增加。在选择的所有分析基因中,有一个ERS1基因在成熟过程中表达无明显变化,EIN4基因表达下调。通过实时定量PCR分析这些基因的差异表达与比较转录组分析中观察到的相似。香气相关GTs和MTs的表达量随着成熟期的进行呈显著增加趋势,且一般从成熟期第4天开始增加,在成熟期第6天达到最大值。香气基因的表达似乎与果实发出特有香气的阶段以及衰老和过熟导致果实口感不佳的阶段相关。不再需要香气挥发物,因此这些基因的表达开始减少。
对软化相关基因进行了PE、PL XTH、Cellulase和PG基因家族成员的表达研究。在比较转录组数据中,定量rt分析也表明,随着成熟进程,XTH和PL基因的表达显著增加。这些基因的表达量在果实第4天开始急剧增加,并持续到果实衰老。通过定量rt分析研究了1个纤维素酶成员和2个PG基因家族成员的表达情况。这些基因在成熟过程中表达量增加,但没有XTH、PL和PE基因表达量增加显著。定量rt分析得到的结果与成熟果实和未成熟果实的转录组比较分析结果一致,得到了验证和延伸差异表达。
SSR标记
EST衍生的SSR标记是基因定位的重要工具。对香蕉SSR标记的研究较早,已有香蕉SSR数据库;然而,对SSRs的鉴定是使用公开的无害环境技术进行的,这在香蕉上有些限制。为了丰富香蕉的SSR标记,我们利用Misa管道在成熟和未成熟转录组组合数据中鉴定了SSR5.).筛选组合的转录物用于存在二 - ,四,五核苷酸和六核苷酸SSR基序和1,042 ssrs,在超肠中鉴定了未成熟和成熟的水果转录om。DI-和三重复形成SSR的主要部分,占SSRS总计的70%。使用自定义Perl脚本提取与不同SSRS关联的contig的注释。几个SSRS在成熟过程中上调的基因。CONTIG17908和CONTIG03660分别包含一个SSR,分别作为扩展素和Xth注释,并且两者在成熟期间都强烈上调(附加文件10.).本研究将为香蕉改良品种的选育提供遗传标记。
结论
香蕉是世界许多地方的经济上重要的水果;然而,由于过度成熟,农民和消费者所产生的巨大收获后损失。在分子水平下,香蕉中成熟的乙烯在香蕉中尚未研究。进行的大多数研究与单一基因或单一基因家族有关。然而,最近详细研究了与乙烯生物合成和信号传导相关的十个基因家族[47].更加全局分析香蕉中的基因表达已被限制为减去杂交和页面DDGE,这两者都没有给出转录组的全面图像。在本研究中,我们已经测序了香蕉果浆的两个阶段的转录组,并鉴定了熟化过程中的鉴定基因。与香蕉果实成熟有关的两个最重要的过程是软化和生产香气挥发物。详细研究了这两种方法,并确定了许多与香气形成有关的基因。鉴定了几种酰基转移酶,其可能参与合成芳族挥发物和风味组分。此外,本研究突出了扩展蛋白,PL和XTH在水果软化中的重要性。除了富集的Banana基因在数据库中,我们还发现了许多可以在香蕉成熟期间扮演一个组成部分的新基因,并且可能是未来基因操纵研究的好候选者。
方法
植物材料和RNA隔离
果实穆萨accuminata(Dwarf Cavendish, Genome AAA, var. Robusta, Harichhal,印度国家香蕉研究中心的种质代码TRY0081)是从印度勒克瑙的csir -国家植物研究所种植的植物中收获的。果实洗净,擦拭,100 μL/L乙烯处理24 h催熟,如前所述保存4天[6.].选择果实,乙烯处理,RNA分离,重复4次,每次10个果实。每组随机选取2个水果,将果肉混合在液氮中冷冻,在−70°C中保存以备后续使用。成熟和未成熟水果的冷冻组织被用研钵和杵在液氮中磨成细粉。从未成熟和成熟组织中提取的总RNA使用前面描述的方法[48],然后根据制造商说明(安必恩,美国)进行DNaseI治疗。用琼脂糖/EtBr凝胶检测RNA质量,用分光光度计测定数量(Nanodrop, Thermo Scientific, USA)。
cDNA文库构建及454测序
合并来自四种不同制剂中的每种不同制剂中的每一个的等量总RNA,并用于文库制剂。使用Oligo-DT引物和上标II逆转录酶(Invitrogen,Carlsbad,Ca)使用5μg合并的RNA制备第一链cDNA。然后如双链cDNA合成试剂盒(Invitrogen,Carlsbad,Ca)中所述合成双链cDNA文库,以及通过基因芯片样品清洁模块(Affymetrix,USA)纯化的双链cDNA。在Agilent 2100 Bioanalyzer DNA芯片(Agilent Technologies Inc.,Santa Clara,CA)上检查了双链cDNA文库的质量。通过雾化将大约三种微量的双链cDNA剪切,以产生长度为约250-800bp的随机片段。使用QIAGEN QIA快速PCCR纯化旋柱进一步纯化雾化cDNA并合并。除去小于300bp的片段,并将纯化的cDNA样品在DNA芯片(Agilent 2100 Bioanalyzer,USA)上进行分析,以分析数量,并确认片段大小(350-800 bp)。根据制造商的指示(Roche,USA)完成了适配器连接库的适配器连接和纯化。图书馆的质量和数量分别评估了Agilent高敏感性芯片和光谱仪(Perkin Elmer,USA)。然后使双链cDNA片段变性以产生单链cDNA片段,然后通过乳液PCR扩增,按照制造商的说明(454生命科学,罗氏,美国)进行测序。 Reads from unripe and ripe libraries were processed and trimmed to remove low quality and primer sequences.
从头序列组装和注释
利用GS FLX焦磷酸测序软件对成熟和未成熟香蕉果实库中的454条原始序列进行筛选,并对微弱信号进行修剪,获得高质量的(HQ)序列(>单碱基读的准确性为99.5%)。从HQ序列中剪切引物和适配器序列,并在组装前去除小于50 bp的序列。用ROCHE GS Assembler (version 2.5.3)将裁剪后的序列组装成具有40个碱基对重叠、96%同一性的独特的contigs和单次序列。contigs和singleton是使用NCBI BLASTx程序的独立版本注释的[49[拟南芥信息资源(Tair;http://www.arabidopsis.org), MSU水稻基因组注释和NCBI非冗余蛋白(Nr)数据库(http://www.ncbi.nlm.nih.gov.;发布于06/23/23/2009)和香蕉基因组枢纽(http://banana-genome.cirad.fr/)使用BLASTX算法具有10的电子值截止−5并且只提取每个序列的最高点击率。对CDD数据库的注释(http://www.ncbi.nlm.nih.gov.)是使用爆破套件的rpsblast程序完成的,pfam是使用hmmer v3程序完成的。利用基于隐马尔科夫模型(HMM)的程序进行ESTScan,以确定unigenes中是否存在潜在编码区域。为了分析部分转录本和替代转录本,这些contigs被计算成100 bp的片段,标记并使用bowtie2程序定位到香蕉基因组[50].在映射期间跳过外显子的裂缝的部分被识别为Banana Genome上的拼接拼图[4.].
功能分类和生物路径分配
为了了解在成熟期间操作的代谢和遗传网络,在我们的转录组中鉴定的基因根据它们在基因和基因组(Kegg)途径数据库的Kyoto Encocclopia中的连杆映射。根据蛋白质数据库的BLASTX搜索,酶委员会(EC)将数量分配给独特的序列,使用切断的电子值10−5。kegg分析的输出包括kegg orthology(ko)分配和kegg路径(http://www.genome.jp/kegg/),由KO分配。使用e值为>10的香蕉supercontigs的GO项进行了基因本体论(GO)分析−5在TAIR数据库中的Arabidopsis基因的爆炸中搜索。
数字基因表达和通路分析
为了分析差异基因表达,计算每折叠的读数,并计算每百万的转录物。使用DESEQ包来鉴定差异表达基因[51].为了统计确定差异基因表达r统计[35.], R≥8为极显著性。为计算阈值R值,按照前面描述的随机泊松分布生成每个库的1000个数据集[35.].对于与Musa基因组的比较表达分析,将包括单身的所有未成熟剂映射到预测的Musa基因组的注释基因模型。使用TPM(每百万百万百百万百万)计算表达水平,并且预测水平再次使用DESEQ Pacakge检查[51].途径分析是使用拟南芥和稻米的Kegg和Biocyc程序进行的,并且Contigs使用定制的Perl脚本捕获。使用MEV软件产生基因和热图的聚类(http://www.tm4.org/mev.html.).
寡核苷酸引物的设计与实时PCR分析
一套寡核苷酸引物(附加文件11.),在序列分析获得序列信息的基础上,设计用于RT-qPCR。对于RT-qPCR,根据规定的方案,使用Revert Aid H负第一链cDNA合成试剂盒(Fermentas life Sciences, USA)中的总RNA合成第一链cDNA。半定量PCR检测cDNA,琼脂糖凝胶电泳。Real time PCR混合物包含1 μl稀释cDNA (10 ng), 10 μl 2× SYBR Green PCR Master mix (Applied Biosystems, USA),每个基因特异性引物200 nM,最终体积为20 μl。每个引物对也进行无模板对照。应用生物系统公司7500 Fast Real time PCR系统对表达进行定量分析。所有pcr都在以下条件下进行:95°C 20秒,95°C 3秒,96孔光学反应板(应用生物系统公司,美国),60°C 30秒,40个循环。扩增产物的特异性在40个循环后通过熔化曲线分析(60°C至95°C)得到验证。每个cDNA进行3个技术重复。
可获得的支持数据
支持本文结果的数据集可在NCBI GenBank知识库中找到[http://www.ncbi.nlm.nih.gov/bioproject/?TERM=PRJNA172246.]在NCBI SRA存储库中[http://www.ncbi.nlm.nih.gov/sra/?term=SRA057081].
附加文件
参考文献
- 1。
果的成熟:对乙烯的分子观察和作用。生物技术学报,2010,28:94-107。10.1016 / j.biotechadv.2009.10.002。
- 2。
黄志强,王志强:番茄果实成熟和品质性状的遗传与控制。2011, 45: 41-59。10.1146 / annurev -麝猫- 110410 - 132507。
- 3.
植物基因表达的调控。在《分子和细胞生物学及分子医学百科全书》第二版。德国RA M. Weinheim编辑:Wiley-VCH Verlag Gmbh & Co; 2005:307-358。卷。10。
- 4.
D 'Hont, Denoeud F, Aury JM, Baurens FC, Carreel F, Garsmeur O,诺尔B,中行,Droc G, Rouard M Da Silva C, Jabbari K,开襟羊毛衫C J,也不会Souquet M,她们K, Jourda C, Lengelle J, Rodier-Goud M,阿尔贝蒂,伯纳德·M,科雷亚M, Ayyampalayam年代,Mckain先生,Leebens-Mack J,伯吉斯D, Freeling M, Mbeguie-A-Mbeguie D, Chabannes M,柳条T,等:香蕉(穆萨acuminata)基因组和单子叶植物的演变。自然。2012,488:213-217。10.1038 / Nature11241。
- 5.
Droc G,Larivièred,guignon v,yahiaoui n,这个d,garsmeur o,dereper a,hamelin c,argout x,dufayard jf,lengelle j,Baurens fc,cenci a,pitollat b,d'hont a,ruiz m,Rouard M,Bocs S:香蕉基因组枢纽。数据库(牛津)。2013,2013:Bat035-10.1093 / Database / Bat035。
- 6.
Lohani S,Trivedi PK,Nath P:香蕉乙烯诱导成熟过程中细胞壁水解酶活性的变化:1-MCP,ABA和IAA的作用。波萨斯匹配Biol Technol。2004,31:119-126。10.1016 / J.Postharvbio.2003.08.001。
- 7.
香蕉果实成熟过程中多聚半乳糖醛酸酶基因的表达。植物营养与肥料学报。2005,43(4):489 - 494。10.1016 / j.plaphy.2005.01.011。
- 8.
Trivedi PK,Nath P:Maexp1,一种乙烯诱导的扩展蛋白从成熟的香蕉果实。植物SCI。2004,167:1351-1358。10.1016 / J.Plantsci.2004.07.005。
- 9.
Asha,Sane Va,Sane AP,Nath P:在香蕉果实成熟和开发期间表达了多种形式的α-Expansin基因。波萨斯匹配Biol Technol。2007,45:184-192。10.1016 / J.Postharvbio.2007.03.003。
- 10。
Roy Choudhury S, Roy S, Singh SK, Sengupta DN:香蕉果实成熟过程中β -1,3-葡聚糖酶对乙烯、生长素、ABA、伤害、冷光和暗循环的响应的分子特征和差异表达。植物营养与肥料学报,2010,29(6):813-828。10.1007 / s00299 - 010 - 0866 - 0。
- 11.
乙烯诱导香蕉成熟引起了果实组织中防御和逆境相关基因的表达。生物技术学报。2007,46:136-143。10.1016 / j.postharvbio.2007.04.010。
- 12.
Elitzur T,VREBALOV J,Giovannoni JJ,Goldschmidt Ee,Friedman H:在香蕉成熟期间对疯箱基因表达的调节及其与乙烯的调节互动。J Exp Bot。2010,61:1523-1535。10.1093 / JXB / ERQ017。
- 13。
关键词:香蕉果实,乙烯信号通路,温度,1-MCP,基因表达中国农业科学,2011,31(6):643 - 648。10.1002 / jsfa.4226。
- 14。
香蕉果实成熟过程中基因表达的差异。植物营养与肥料学报。1997,19(4):469 -469。10.1104 / pp.115.2.463。
- 15.
Gupta Sm,Srivastava S,Sane AP,Nath P:Banana果实开发期间基因的差异表达,成熟和1-MCP治疗:存在不同的果实特异性,乙烯诱导和乙烯抑制表达。波萨斯匹配Biol Technol。2006,42:16-22。10.1016 / J.Postharvbio.2006.05.002。
- 16.
Medina-Suarez R,Manning K,Fletcher J,Aked J,鸟Cr,Seymour GB:在成熟的香蕉纸浆中的基因表达。二维十二烷基硫酸钠 - 聚丙烯酰胺凝胶电泳的体外翻译产品和CDNA克隆25种不同熟化的MRNA。植物理性。1997,115:453-461。10.1104 / pp.115.2.453。
- 17.
关键词:Withania somnifera,叶和根,转录组,功能注释,比较分析公共科学图书馆。2013,8:1932-6203。10.1371 /注释/ 0 b2b0a8b fb01 - 410 a - 8416 f961e92c9fac。
- 18.
Pathak S,Lakhwani D,Gupta P,Mishra,Brij K,Shukla S,Asif Mh,Trivedi PK:使用高罂粟碱突变体的比较转录组分析Somniferum揭示罂粟碱生物合成的途径和不表达步骤。Plos一个。2013,8:e65622-10.1371 / journal.pone.0065622。
- 19.
Blanca J,Esteras C,Ziarsolo P,Pérezd,蕨类植物福尔斯·v,Collado C,RodrÃguez de Pablos R,Bramenter A,Roig C,CañizaresJ,Picób:Cucumis Melo对SNP发现的转录组测序。BMC基因组学。2012,13:280-10.1186 / 1471-2164-13-280。
- 20。
Gonzalez-Ibeas D, Blanca J, Donaire L, Saladie M, mascarel - creus A, Cano-Delgado A, Garcia-Mas J, Llave C, Aranda MA:甜瓜的分析(Cucumis梅洛)通过高通量焦磷酸测序的小rna组。基因组学杂志。2011,12:393-10.1186/1471-2164-12-393。
- 21。
Martinelli F,Riatsu Sl,Albrecht U,Regan RL,Phu ML,Britton M,水牛夫,小组J,Leicht E,Zhao W,Lin D,D'Souza R,Davis Ce,Bowman KD,Dandekar AM:转录omperompom剖面柑橘类果实反应黄龙bing病。Plos一个。2012,7:e38039-10.1371 / journal.pone.0038039。
- 22。
云Z,金S,丁y,王z,gao,pan z,徐j,cheng y,deng x:柑橘类水果的比较转录组和蛋白质组学分析,提高了低温效果对维持水果质量的影响冗长的收获后储存。J Exp Bot。2012,63:2873-2893。10.1093 / JXB / ERR390。
- 23。
罗兰LJ,Alkharouf N,Darwish O,Ogden El,Polashock JJ,Bassil NV,Main D:通过脱节凝固从冷驯化的叶子,发展果实和花蕾的蓝莓转录组序列的产生和分析。BMC植物BIOL。2012,12:46-10.1186 / 1471-2229-12-46。
- 24。
gonora - castillo E, Fajardo-Jaime R, Fernandez-Cortes A, jofrea - garfias AE, Lozoya-Gloria E, Martinez O, Ochoa-Alejo N, Rivera-Bustamante R:辣椒转录组DB:基因组研究的“热门”工具。生物信息学。2012,8:43-47。10.6026 / 97320630008043。
- 25。
杨梅的转录组分析(英文)Myrica Rubra.)果实发育和成熟的RNA-Seq。基因组学杂志。2012,13:19-10.1186/1471-2164-13-19。
- 26。
yu k,xu q,da x,guo f,ding y,deng x:转录组在水果开发过程中的变化和甜橙成熟(柑橘sinensis.).中国生物医学工程学报。2012,13:10-10.1186/1471-2164-13-10。
- 27.
(1)猕猴桃二倍体果实发育的研究,猕猴桃对'hort16a'。BMC植物BIOL。2011,11:182-10.1186 / 1471-2229-11-182。
- 28.
牧场C,Zenoni S,Tornielli GB,Allegro G,Dal Santo S,Valentin G,Intrieri C,Pezzotti M,Filippetti I:增加血管血管中的源/水槽比(CV Sangiovese)诱导广泛的转录组重编程和改变浆果成熟。BMC基因组学。2011,12:631-10.1186 / 1471-2164-12-631。
- 29.
Guillaumie S, Fouquet R, Kappel C, Camps C, Terrier N, Moncomble D, Dunlevy JD, Davies C, Boss PK, Delrot S:葡萄果实成熟后期的转录分析。植物营养与肥料学报。2011,32(6):514 - 514。
- 30。
Lee JM,Joug JG,McQuinn R,Chung My,Fei Z,Tieman D,Klee H,Giovannoni J:番茄果实中的转录组合,遗传多样性和代谢物分析表明,乙烯反应因子Slerf6在成熟和类胡萝卜素中起重要作用积累。工厂J. 2012,70:191-204。10.1111 / J.1365-313x.2011.04863.x。
- 31。
郭树华,刘杰,郑玉华,黄敏,张宏红,何华,任玉华,钟树华,费智,徐永华:西瓜果实发育过程中转录组动态变化特征及其基因表达谱分析。基因组学杂志。2011,12:454-10.1186/1471-2164-12-454。
- 32。
柑橘ABA信号体在甜橙果实成熟和叶片脱水过程中的识别和转录调控。中国生物医学工程学报。2012,31(4):491 - 498。10.1093 / jxb / ers168。
- 33。
水稻硫酸盐转运体家族成员的差异表达和选择性剪接调控植物生长发育和胁迫条件下的硫状态。基因组学杂志。2011,11:259-273。10.1007 / s10142 - 010 - 0207 - y。
- 34。
王宝强,周伟,王宝强,王宝强。玉米选择性剪接的全基因组分析:景观和遗传调控。acta botanica sinica, 2017, 36(4): 497 - 503。10.1105 / tpc.114.130773。
- 35。
来自多个cDNA文库的基因表达比较。基因组Res. 2000, 10: 2055-2061。10.1101 / gr.gr - 1325 rr。
- 36。
转基因植物果实软化和品质的细胞壁代谢及其调控。acta botanica sinica(云南植物学报),2001,31(4):593 - 598。10.1023 /: 1010656104304。
- 37。
乙烯处理苹果和番茄果实中木葡聚糖内转葡萄糖基酶/水解酶(XTH)基因的表达及XET活性。植物营养与肥料学报,2013,29(6):641 - 646。10.1016 / j.jplph.2013.03.015。
- 38。
莽草酯途径:芳香族化合物生物合成的早期步骤。植物生理学。1995,7:907-919。
- 39.
香蕉成熟和风干过程中芳香成分的变化。食品科学技术。2003,36:633-642。10.1016 / s0023 - 6438(03) 00083 - 5。
- 40。
乙烯在果实成熟中的作用。乙烯在植物中的作用。编者按:NA K. 2006,施普林格出版社,柏林海德堡,151-176。10.1007 / 978 - 3 - 540 - 32846 - 9 - _8。
- 41。
Hoffmann L,Maury S,Martz F,Geoffroy P,Legrand M:酰基转移酶控制Shikime和Quinate酯中间体的纯化,克隆和性质。J Biol Chem。2003,278:95-103。10.1074 / jbc.m209362200。
- 42。
草莓和香蕉挥发性酯形成酶的功能特性研究。植物营养与肥料学报。2004,29(4):429 - 434。10.1104 / pp.104.042580。
- 43。
asif mh,pathak n,solomos t,Trivedi pk:低氧,温度和1-甲基环丙烯对苹果熟化期间调节乙烯生物合成和感知的基因表达的影响。S AFR J BOT。2009,75:137-144。10.1016 / J.SAJB.2008.09.002。
- 44。
Asif MH, lakwani D, Pathak S, Bhambhani S, Bag SK, Trivedi PK:香蕉丝裂原激活蛋白激酶基因家族的全基因组鉴定和表达分析表明,特定成员参与了果实成熟的不同阶段。基因组学杂志。2013,14:161-175。10.1007 / s10142 - 013 - 0349 - 9。
- 45。
金军,张海涛,孔亮,高光,罗建军:植物转录因子功能和进化研究的门户。核酸学报2014,42(数据库版):D1182-D1187。10.1093 / nar / gkt1016。
- 46。
番茄MADS-box转录因子成熟抑制因子(RIPENING INHIBITOR, MADS-box transcription factor RIPENING INHIBITOR)以无色非成熟依赖的方式与参与众多成熟过程的启动子相互作用。植物营养与肥料学报。2011,31(4):457 - 461。10.1104 / pp.111.181107。
- 47。
Jourda C,Cardi C,Mbeguie AMD,Bocs S,Garsmeur O,D'Hont A,Yahiaoui N:Banana(穆萨acuminata)家族特异性全基因组复制后参与乙烯生物合成和信号传递的基因家族。植物生态学报,2014,33(6):691 - 698。10.1111 / nph.12710。
- 48。
Asif M, Dhawan P, Nath P:一种从成熟香蕉果实中分离高质量RNA的简单程序。植物学报2000,18:109-115。10.1007 / BF02824018。
- 49。
Altschul SF,Gish W,Miller W,Myers EW,Lipman DJ:基本的本地对齐搜索工具。J Mol Biol。1990年,215:403-410。10.1016 / s0022-2836(05)80360-2。
- 50.
Langmead B, Salzberg S: Bowtie2快速间隙读对准。Nat Methods. 2012, 9: 357-359。10.1038 / nmeth.1923。
- 51。
Anders S,Huber W:序列计数数据的差异表达分析。基因组Biol。2010,11:R106-10.1186 / GB-2010-11-10-R106。
确认
作者承认印度科学和工业研究理事会(CSIR),为网络项目提供资金(BSC-107)。SP和PG致谢科学和工业研究委员会(CSIR),印度高级研究奖学金。作者承认Mark Tucker博士,大豆基因组学和改进实验室,USDA / ARS,Maryland,USA用于汇编稿件来改进英语。
作者信息
隶属关系
相应的作者
附加信息
利益争夺
两位作者宣称他们没有相互竞争的利益。
作者的贡献
SP和PG采集乙烯处理后的果实,分离RNA进行测序,并进行测序和实时PCR分析。DL和MHA对测序数据进行组装、注释和分析。PKT设计了实验并给出了实验建议。PN, PKT和MHA撰写了这篇论文。SKB编写自定义脚本,在组装和分析过程中提供帮助。所有作者阅读并批准了最终的手稿。
电子辅料
12870 _2014_316_moesm5_esm.xlsx
附加文件5:计算折叠变化和R值以识别在未成熟和成熟的转录组文库中差异表达的基因。(XLSX 2 MB)
12870_2014_316_moesm6_esm.xlsx.
附加文件6:热图所对应的基因在不同数字中的折数变化计算。(XLSX 3 MB)
在KEGG数据库中存在的水稻途径列表,以及存在于KEGG数据库中的基因数量
额外的文件7:穆萨acuminata比较记录。(XLSX 199 KB)
作者为图像提交的原始文件
权利和权限
本文在BioMed Central Ltd.的许可下发布了这是一个开放的访问文章,根据Creative Commons归因许可(http://creativecommons.org/licenses/by/4.0)如果原始工作正确记入,则允许在任何媒体中进行无限制使用,分发和再现。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
Asif, m.h., lakwani, D, Pathak, S。et al。通过对香蕉成熟和未成熟果实组织的转录组分析,确定了参与果实成熟过程的主要代谢网络。BMC植物杂志14,316(2014)。https://doi.org/10.1186/s12870-014-03161.1.
已收到:
公认:
发表:
关键字
- 香蕉
- 乙烯
- 果实成熟
- 穆萨acuminata
- 转录组