摘要
背景
拟南芥的突变DMR1.,编码HomoSerine激酶,导致均静脉和叶面抗性对生物营养病原体的升高Hyaloperonospora Arabidopsidis.和粉孢子neolycopersici通过激活身份不明的防御机制。本研究调查了突变的效果DMR1.关于抗截止带病原体的抵抗力镰刀菌素graminearum和F死胡同在小粒谷物上引起镰刀菌穗疫病(FEB)。
结果
我们最初发现DMR1.-2突变等位基因增强了对烟草的抗性F死胡同和f . graminearumSilique感染,并降低莲座叶的殖民。与此同时DMR1.-1等位基因支持较少莲座叶定殖,但有野生型角果抗性。三个额外的DMR1.随后检查等位基因因改变而被检查F死胡同敏感性和均表现出增强的穗状抗性,而叶片定殖率在2个(DMR1.-3.和DMR1.-4.).氨基酸分析DMR1.SILIQUES揭示了野生型植物中未检测到的均菌氨酸积累。L-HomoSerine的外源性应用降低芽感染DMR1.而d -高丝氨酸则没有。叶片衰老也有延迟DMR1.植物与野生型相比,并与减少相关镰刀菌素叶子殖民。
结论
这些研究结果表明常见的拟南芥DMR1.介导的易感性机制在感染期间发生感染,无论是强烈的生物养殖粪便粪便,不仅在营养植物组织中的植物,还发生了植物。这有可能有助于提高抗抗谷物作物的抗性。
背景
镰刀菌穗疫病(Fusarium Ear Blight, FEB)又称镰刀菌头痂病(Fusarium head scab disease),是一种全球性的对小麦、大麦和玉米等小型谷类作物花组织的重大威胁,由该属的几种子囊菌真菌引起镰刀菌素. 英国二月的主要致病因素是镰刀菌素graminearum和F死胡同(院长等.[1、戈斯瓦米和基斯特勒[2],帕里等.[3.])。在流行年份,由于粮食产量或粮食品质的下降,以及由于诸如脱氧雪腐镰刀菌烯醇(DON)等真菌毒素的污染,使粮食不适于人类和动物消费(Rocha),这种疾病会造成巨大的作物损失等.[4.]). 小麦品种对FEB没有完全抗性,抗性的基础是复杂的,主要的数量性状位点(QTL)为基础(Bai和Shaner)[5.), Buerstmayr等.[6.), Jayatilake等.[7.周),等.[8.])。
这两个f . graminearum和F死胡同感染植物的花和西力克组织拟南芥在实验条件下,为研究FEB病(城市)过程中宿主与病原菌的相互作用提供了一个可操作的模型等.[9.])。许多拟南芥基因在对镰刀菌的抗性/易感性中的作用已经被利用这个致病系统(Cuzick等.[10],Cuzick.等.[11), Makandar等.[12), Makandar等.[13), Savitch等.[14],van hemelrijck等.[15])。此外,转基因和化学方法已被用于改变拟南芥叶和对2月的花卉易感性镰刀菌素物种(浅野等.[16],法拉利等.[17],kaur.等.[18),科赫等.[19],克里伯斯等.[20.]). 这些发现有可能通过常规方法和转基因方法提高谷类作物对FEB的防御能力,并增强我们对植物生殖组织防御反应的理解。
拟南芥抗霜霉病(DMR.)从功能筛网的增益中分离突变体,用于抗oomycete病原体Hyaloperonospora Arabidopsidis.对敏感基因型L的植株进行EMS诱变呃-0窝藏了增强疾病易感性突变EDS1-2(Van Damme等.[21.])。这EDS1-2L的突变呃-0以前被证明不会改变F死胡同以及拟南芥花或西力克组织(Cuzick)等.[11])。五DMR.确定的突变等位基因,三(DMR3.那DMR4.那DMR5.)显示出水杨酸介导的防御相关基因的组成型表达公关-1.剩下的突变体,DMR1.和DMR6.,分别被定位和鉴定为编码拟南芥高丝氨酸激酶和推测的2-氧谷氨酸加氧酶的突变(van Damme)等.[22.],范达姆等.[23.])。DMR6.与水杨酸介导的防御信号有关,但在H. Arabidopsidis.敏感性。突变DMR1.结果在非接种植物中的均静脉积聚,以及对L-型鼠鼠的外源应用H. Arabidopsidis.接种使野生型植物产生抗性。然而,L-高丝氨酸在抗药性中的确切作用尚不清楚。
我们使用了镰刀菌-拟南芥花病系统(Urban等.[9.),以评估该措施的效果DMR.突变对镰刀菌素拟南芥花、角果和莲座状叶组织的敏感性。突变体DMR1.-1那DMR1.-2那DMR5.和DMR6.(它们都携带EDS1-2突变)进行了初步研究;DMR3.和DMR4.具有影响花卉形态的肺炎矮人表型,因此不适合纳入本研究。在这里,我们提出了一种新颖的发现,拟南芥同源鼠激酶DMR1赋予抵抗力f . graminearum和F死胡同在花柱和/或减少莲座叶组织的定殖,与不同水平的抗性授予不同DMR1.突变等位基因。西班牙的西力克DMR1.植物积累高丝氨酸,但不耗尽苏氨酸和蛋氨酸等氨基酸,这是高丝氨酸激酶活性的下游产物。我们还发现了DMR1.导致延迟叶片衰老,其可与观察到的叶片定植表型相关。L-HomoSerine的外源性应用减少了两者的花卉和硅疾病严重程度EDS1-2和DMR1.植物,但不抑制体外镰刀菌素生长。
结果
拟南芥霜霉病抗性突变体的选择改变了对霜霉病的易感性镰刀菌素culmorum西力克侵染与莲座叶定植
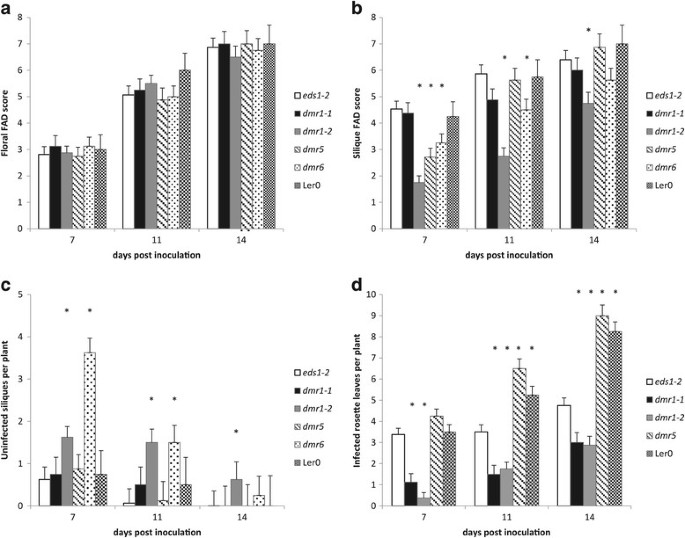
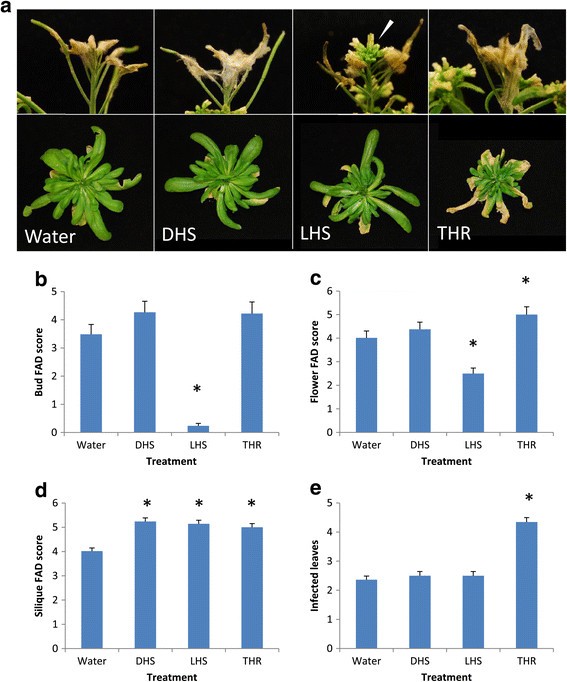
的拟南芥突变体DMR1.-1那DMR1.-2那DMR5.和DMR6.,它们是在L中生成的呃-0EDS1-2背景,筛选易感性改变F死胡同感染相比EDS1-2.野生型L.呃-0也包含在试验中。然后用喷雾接种F死胡同在7、11和14天后,测定植株的花和角果病水平,以及莲座叶侵染和未侵染的绿角果数量(图)1和2).花FAD (Fusarium-Arabidopsis Disease)评分(Urban)差异无统计学意义等.[9.)的基因型(F4, 93= 0.7, p = 0.591),所有基因型的疾病进展速度相同(图1一种)。在接种时,这种组织已经未开封的绿芽。
药物敏感性分析F死胡同四人感染抗霜霉病(DMR.)突变系,与野生 -类型L.呃- - - - - -0和亲本基因型L呃- - - - - -0.eds1公司-2.每个基因型为6株(一)植物疾病的水平,(b)Silique疾病水平,(c)健康的西力克的数量,以及(d)接种后7天、11天和14天感染的莲座叶数(dpi)。对于花和西力克的评价,采用FAD-拟南芥镰刀菌病害评分系统。星号表示基因型与EDS1-2在每个时间点(回归分析后计算LSD,p = <0.05). 误差线代表平均值的标准误差。重复实验,结果相似。自从DMR6.突变花晚于EDS1-2那DMR6.在该实验中使用的植物比其他基因型的那样超过1周,因此由于增加的衰老增加,因此莲甜叶数据没有可比性DMR6.突变体。
而基因型对果龄FAD评分有显著影响(F4, 91 = 16.23, p = <0.01). The siliques assessed had been open flowers at the time of inoculation. The disease progression in the L呃-0和L.呃-0EDS1-2植物是相同的(图1b).突变等位基因DMR1.-2在所有时间点都显著降低了西力克病的发病率EDS1-2(数字1B,图2a).这一发现在多个独立实验中得到了证实。基因型DMR5.和DMR6.在显示的实验中,在接种后7天和11天(dpi)时,已经减少了西力克病的症状,但这些结果在整个实验中并不一致。这个DMR1.-2植物具有比未感染的绿色单片机更高EDS1-2在任何时间点,同时DMR6.在7和11 dpi时观察到明显更多的绿色西力克,但在14 dpi时没有观察到(图3)1c)。
而健康的莲座丛叶组织不受影响镰刀菌素在我们的实验条件下感染,真菌的定植在叶片衰老期间发生。在观察结果之后,正式评估莲座叶的定植DMR1.树叶支持较少的真菌生长。首次喷淋接种后莲座叶定植数受基因型(F4, 93= 66.06, p = <.001)。这两个DMR1.等位基因比殖民化玫瑰花叶的含量明显更少EDS1-2在所有时间点(图1D,图2b)。有趣的是,L.呃-0株的丛生莲座叶数显著多于0株EDS1-2,表示EDS1突变可能对此有影响F死胡同在以前的研究中未发现的叶易感性,其重点是花卉感染(Cuzick等.[11])。
突变的DMR1降低易感性f . graminearum
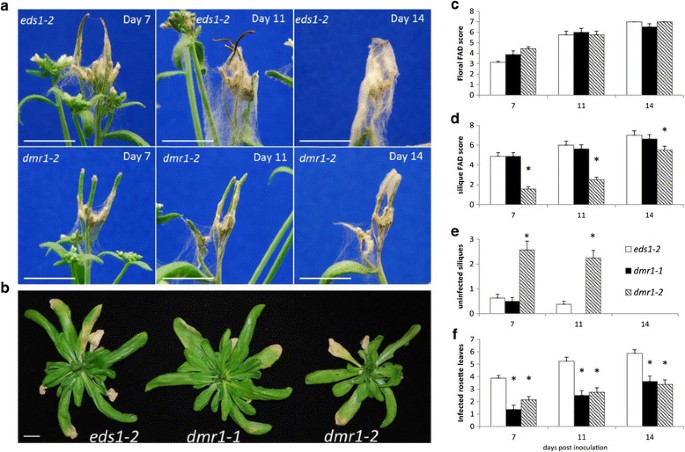
FEB病是由几种谷类作物感染镰刀菌引起的。因此,对f . graminearum比较两组间感染情况DMR1.突变等位基因DMR1.-1和DMR1.-2和亲本基因型EDS1-2在7、11和14 dpi(图3.).结果与F死胡同:对花的敏感性(F2,62= 2.25, p = 0.114)。莲座叶定殖受基因型(F2,62= 37.10, p < .001)DMR1.等位基因的病蔷薇叶少于EDS1-2(数字3.b和f)。基因型间的西力克FAD评分和未感染西力克数也存在差异(F2,62 = 48.63 and 55.31 respectively, p = <.001). Silique FAD scores were lower inDMR1.-2比EDS1-2在所有时间点,与未感染的绿色角质层较高DMR1.-2在7和11 dpi(图3.a, d和e)f . graminearum接种试验,完全感染和坏死的角质层可见EDS1-2从7 dpi开始的植株,而从11 dpi开始的植株都很少观察到这种极端的角果表型DMR1.-1或者是DMR1.-2植物。总体而言,这些结果表明,叶片和硅抗性均由突变赋予DMR1.在至少两种谷物感染中是保守的吗镰刀菌素物种。
药物敏感性分析f . graminearum携带不同等位基因的植物的感染DMR1.突变,dmr1 -1和dmr1 -2,与亲本系相比eds1公司-2.面板(一个)显示感染的顶端花序和角果EDS1-2和DMR1.-2在7 11 14 dpi处。在面板(b)玫瑰花的叶子DMR1.等位基因与EDS1-2,并且茎和花组织已被除去。酒吧= 1厘米。每个基因型的八种植物被评分为(c)植物疾病的水平,(d)Silique疾病水平,(e)绿色,未感染角质层和(f)感染莲座叶的数量,分别为7、11和14 dpi。星号表示基因型与EDS1-2(回归分析后计算lsd, p = <0.05)。误差条表示均值的标准误差。这个实验重复了一次,结果相似。
多个DMR1.等位基因增加了对F死胡同
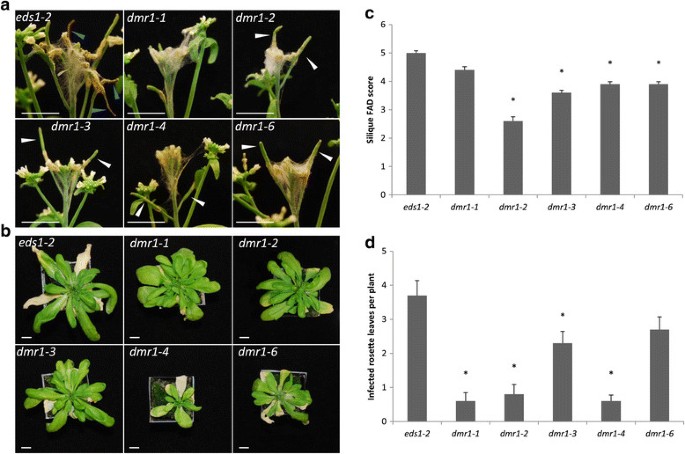
为了验证在大肠杆菌中观察到的西力克抗性表型DMR1.-2是基因突变的结果吗DMR1.而不是由第二个EMS诱导的突变引起的,另外三个等位基因DMR1.(DMR1.-3.那DMR1.-4.和DMR1.-6.)进行了抗性改变测试F死胡同(数字4.).这DMR1.-2那DMR1.-3.那DMR1.-4.和DMR1.-5.突变体均具有较低的含硅疾病水平EDS1-2(数字4.a、c) (F5,49 = 2.31, p = 0.005), whilst no differences in floral susceptibility were observed between the variousDMR1.基因型和EDS1-2.这再次表明,开放的花和很不成熟的角果在接种的时候DMR1.突变植物更耐受F死胡同感染的比未开的绿芽。莲座叶上真菌的生长在不同基因型间也存在差异5,49= 15.04, p = <0.001)DMR1.-1那DMR1.-2那DMR1.-3.和DMR1.-4.相比EDS1-2(数字4.综上所述,这些结果证实了多倍体的角果抗性和叶片抗性增加DMR1.因此可能是等位基因被破坏的结果DMR1.函数。
多个DMR1.等位基因减少了疾病症状镰刀菌素culmorum花柱和莲座状叶的感染。用喷雾接种植物F死胡同在早期开花的分类,在7 dpi评估疾病水平。顶端花序的代表性图像显示为7 dpi(一)EDS1-2那DMR1.-1那DMR1.-2那DMR1.-3.那DMR1.-4.和DMR1.-6..莲座状叶的代表性图像显示为13 dpi(b)EDS1-2那DMR1.-1那DMR1.-2那DMR1.-3.那DMR1.-4.,和DMR1.-6.-minus花和干组织。酒吧= 1厘米。蓝色箭头头 - 可见的严重坏死的单片机EDS1-2.白色箭头头 - 绿色三个DMR1.植物。西力克时尚得分(c)和感染的莲座叶每株植物(d)以7dpi显示。星号表示基因型与EDS1-2(回归分析后预测LSD,p = <0.05). 误差线代表平均值的标准误差。显示的数据来自两个独立的实验复制品。N= 10 (EDS1-2那DMR1.-3.那DMR1.-4.那DMR1.-6.),N=5 (DMR1.-1那DMR1.-2).
携带突变等位基因的植物DMR1.-1和DMR1.-2还评估了改变的易感性F死胡同采用第二种接种法,即孢子滴接种法,单棱点接种法。该方法首先从每个未成熟的角果顶端去除1毫米的组织,然后将1μl的孢子滴放在切面上。基因型之间通过花梗和花柱可见疾病进展的距离没有明显差异1:图S1)。
HomoSerine积累在SILIQUES中DMR1.突变体植物
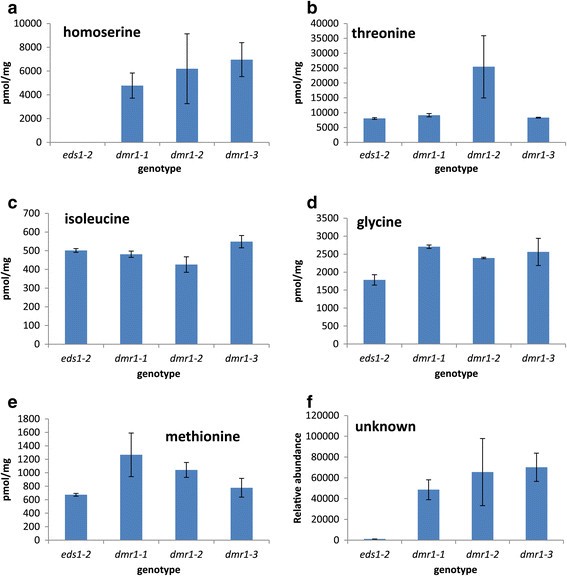
电阻DMR1.叶子H. Arabidopsidis.以前,感染与10天龄幼苗高同丝氨酸水平有关(van Damme等.[23.])。我们分析了三种角质层的氨基酸组成DMR1.突变等位基因与EDS1-2为了鉴别高丝氨酸是否也在DMR1.单片机(图5.).HomoSerine在EDS1-2西力克,但有丰富的DMR1.单片机(图5.a).同丝氨酸水平在所有三个突变等位基因之间具有可比性,但平均较高DMR1.-2和DMR1.-3.是耐用的单片机F死胡同,与DMR1.-1具有野生型抗性水平的西力克。正如van Damme和同事先前在幼苗组织中观察到的那样,高丝氨酸激酶的突变不会降低下游氨基酸的水平(图1)5.b-e)。苏氨酸水平升高DMR1.-2SILIQUES,而蛋氨酸更丰富DMR1.-1长角果。有趣的是,这些变化水平观察到的角质层与这些氨基酸水平的幼苗相关。甘氨酸(可由苏氨酸合成)在所有种类中含量较高DMR1.长角果比EDS1-2.中还检测到一种非同丝氨酸缀合物的未知氨基酸DMR1.样品但缺席EDS1-2.
外源性高丝氨酸用量减少F死胡同拟南芥芽和角果的侵染
外源施用L-高丝氨酸(而非D-高丝氨酸)可提高拟南芥和番茄对专性生物营养体的抗性Hyaloperonospora Arabidopsidis.,和粉孢子neolycopersici而同丝氨酸对孢子萌发无抑制作用在体外oomycete病原体的生长(Van Damme等.[23.],Huibers.等.[24.])。因此,我们研究了是否在均菌氨酸的映体的应用受影响的生长镰刀菌离体培养,或者有能力模仿DMR1.抗性表型在Planta..我们也研究了在Planta.苏氨酸治疗镰刀菌素生长,因为苏氨酸在一些DMR1.等位基因和先前显示减少H. Arabidopsidis.增长(Stuttmann等.[25.])。
无论是均鼠同种型的强烈抑制作用在体外增长被发现F死胡同或f . graminearum,在添加了浓度为0-80mM的L-或D-高丝氨酸的合成营养不良培养基中培养48小时后(附加文件2:图S2)。
评估在Planta.氨基酸处理对大豆生长的影响F死胡同结果表明,在生长过程中,分别喷施10 mM L-或D-高丝氨酸(LHS, DHS)、L-苏氨酸(THR)或水,同时喷施接种F死胡同在早期开花。每天重复氨基酸/水处理5 dpi。显着差异F死胡同处理间未开放芽(F3, 31= 41.38, p = <0.001),开放花(F3, 31 = 7.31页 = <0.001),西力克(F3, 31 = 1.68, p = <0.001) and rosette leaves (F3, 31 = 7.71页 = <0.001). 在7dpi时,与DHS和水处理的对照植物相比,LHS处理的芽很少或没有感染,并且开放的花的感染也减少了(图1)6.A,B,C)。与这些实验中的水对照相比,所有氨基酸处理植物中的Silique感染水平略微升高(图6.d)。苏氨酸治疗增加F死胡同在露天花和莲座叶中的殖民化(图6.和e)。
外源氨基酸处理对小麦幼苗生长的影响镰刀菌素拟南芥花卉易感性,西力克和蔷薇叶组织。基因型的拟南芥植物EDS1-2分别用10mm d -高丝氨酸(DHS)、l -高丝氨酸(LHS)、苏氨酸(THR)或不育水进行喷施F死胡同.氨基酸/水处理每天重复6 dpi。疾病评估为7 dpi。(一)图像显示受感染的顶端花序(上图)和玫瑰花叶(下面的面板) - 茎和花组织已从玫瑰花中取出。白色箭头 - 绿色和打开芽在LHS治疗的植物中存在。植物被评分为(b)芽的疾病,(c)开放的花朵,(d)长角果疾病和(e)感染莲座叶数。星号表示与H有统计学差异2o治疗植物(回归分析,然后通过LSD预测,P = <0.05,N= 8)。结果代表了两个独立实验。
用苏氨酸处理的植株在没有苏氨酸的情况下也表现出叶片黄化和病斑形成F死胡同感染,表明苏氨酸喷雾治疗及以上10毫米可诱导细胞死亡反应。这两种结果都是一致的EDS1-2和野生类型l呃-0个植物(附加文件)3.:图S3)。
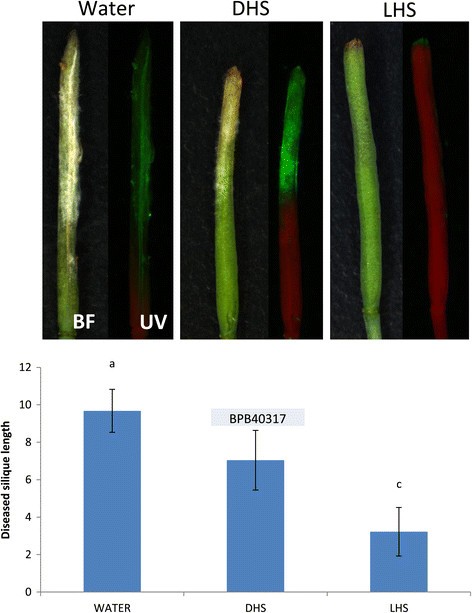
我们还分析了D-和L-高丝氨酸对细胞凋亡的影响F死胡同感染EDS1-2单次西力克伤口接种后的西力克(图7.).接种水、DHS或LHS后滴注5 dF死胡同接种。两组间有显著性差异F死胡同治疗之间的感染发生(ANOVA,P = <0.001)。DHS治疗导致了更适度的F死胡同与水处理相比,接种的西力克生长,而LHS处理的结果明显较少镰刀菌素生长而不是水或DHS治疗,大多数植物显示没有外部可见的感染。然而,F死胡同在一些LHS处理的具有外部未感染果皮的西力克种子上和种子之间存在菌丝(附加文件)4.:图S4)。
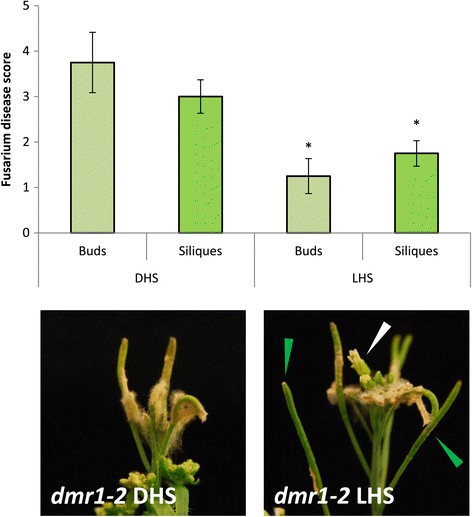
我们还分析了LHS处理的效果DMR1.使用喷淋处理方法(图8.).结果表明,与DHS相比,外源LHS的应用效果更好F死胡同中的阻力DMR1.-2芽(没有抗性)相当于LHS处理EDS1-2芽(图6.b) 是的。此外,LHS处理进一步提高了玉米对西力克的抗性DMR1.-2SILIQUES,尽管突变已经赋予了高水平的抗性。
DMR1的突变会影响植物生长和衰老
在实验植物的生长过程中,DMR1.-2植物的尺寸似乎略小EDS1-2植物。因此,测量了胶囊直径和叶次数,并在5周的基因型植物之间进行了比较DMR1.-1那DMR1.-2和EDS1-2. 生长的量化证实DMR1.-2植株的莲座平均比一般植株小约25%EDS1-2(附加文件5.:图S5a&b),但基因型之间的叶数相似(附加文件5.:图S5c)。这支持了Huibers最近的发现等.[24.一些拟南芥DMR1.突变体的鲜重比普通突变体要轻EDS1-2.还通过计算开花后7,11和14天的明显衰老叶的数量来评估基因型之间的叶片(对应于7,11和14dpi的感染植物的评估),发现延迟两者DMR1.-1和DMR1.-2相比EDS1-2(附加文件5.:图S5d&e)。
在开花的7,11和14天的基因型之间比较了Silique数量(对应于7,11和14dpi的感染植物的评估),以确保观察到的未感染的单片机数增加DMR1.-2并不是因为这种基因型产生了更多的角质层。在评估的任何时间点,没有发现基因型之间的差异(附加文件5.:图S5f)。没有证据表明另一个地方的西力克数目增加了DMR1.在这项研究中调查的等位基因,虽然这没有被正式评估。
外源L-高丝氨酸仅部分且不一致地影响小麦穗镰刀菌的定殖
研究了外源高丝氨酸对小麦穗镰刀菌侵染的影响f . graminearum每天用L-HomoSerine,D-HomoSerine或无菌水感染麦小麦穗,7 DPI。与两种实验性复制品中的其他治疗相比,在L-HomoSerine处理的植物中观察到较少的平均漂白的尖峰和弯曲AWNs和更高的晶粒数和重量。然而,只有减少的漂白小穗数在统计学上显着,并且只在第一次实验复制中(附加文件6.:图S6) (p = 0.03)。
讨论
为了识别控制枯萎病-拟南芥相互作用结果的其他宿主基因,以及在响应不同病原体类型时保守的防御信号成分,我们筛选了一些抗霜霉病突变体改变了对真菌病原体的敏感性F死胡同和f . graminearum感染了谷物和拟南芥的花组织。我们鉴定了拟南芥的多个功能缺失突变等位基因高丝氨酸激酶基因DMR1.增加了对镰刀菌素culmorum:长角果DMR1.-2那DMR1.-3.那DMR1.-4.和DMR1.-6.被发现对感染更有抵抗力DMR1.-1那DMR1.-2那DMR1.-3.和DMR1.-4.,支持减少叶片殖民。这些表型也在下面观察到f . graminearum感染DMR1.-1和DMR1.-2.
这些结果表明,可能存在一种共同的易感性机制发生的响应感染霜霉卵菌病原菌H. Arabidopsidis.是一种叶适应的专性生物营养体,真菌半生物营养体镰刀菌素适合花的物种。突变的DMR1.及其番茄正轨SlDMR1最近也有研究表明它能提高对专性生物营养真菌霉病的抵抗力吗粉孢子neolycopersici以等位基因依赖的方式,但尚未发现改变对任何其他评估病原体的抗性,包括兼性生物营养细菌两(van Damme等.[23.],Huibers.等.[24.])。就像易感性一样粉孢子neolycopersici(Huibers.等.[24.]),抗抵抗力镰刀菌素在DMR1.等位基因依赖性;而DMR1.-1等位基因支持较少的莲座丛叶定殖和延缓衰老,它不赋予抗性的角果,尽管高丝氨酸积累在这个组织。一种假设是高丝氨酸的积累是由DMR1.突变并不是导致镰刀菌素硅抗性,DMR1有一种额外的功能,有助于硅易感性,这些功能不会被废除DMR1.-1等位基因。同时,该等位基因和其他等位基因的叶片衰老延迟和真菌定植减少是由于同丝氨酸激酶功能降低,因此在等位基因之间是保守的。然而,这并不能解释外源性应用高丝氨酸所带来的疾病减少。另一种假设是DMR1.-1通过阻断高同丝氨酸的活性或通过另一途径独立地提高角质层的易感性,可以缓解角质层抗性表型。后者可能不太可能影响衰老叶组织的腐生定植。需要进一步的研究来检验这些假设。
突变DMR1.尽管影响叶子和二氧化硅感染,但没有发现易于感染未开封的芽和幼花的感染。拟南芥分析DMR1.使用Genevestigator(Hruz)表达等.[26.)表明,DMR1.在一些花组织中的较低水平表达,而不是在植物组织中,即在雄蕊,花药,耻辱和萼片中(附加文件7.:图S7a)。由于HomoSerine激酶活性已被显示为由HomoSerine积累驱动(Lee等.[27.]),可能是这些组织不产生高水平的高丝氨酸,因此不受DMR1活性降低的影响。在花的早期发育过程中,花萼和雄性生殖组织的易感性可能导致花的损失,而传粉后这些组织的感染对抗性植株的西力克几乎没有影响DMR1.植物,由于这种组织在角果发育时脱落。
自DMR1.诱导抗性H. Arabidopsidis.外源l -高丝氨酸可在野生型植物中被模拟,我们研究了高丝氨酸对镰刀菌生长的影响在体外和在Planta..治疗EDS1-2喷雾接种后用L-均静脉(LHS)的植物F死胡同导致真菌对芽和花的定植显著减少。这与肿瘤的表型形成对比DMR1.突变体,增加了硅酸和叶,但不是花卉,抵抗力。如前所述,Genevestigator分析表明,一些花动器可能具有比其他植物组织更低的HSK表达(附加文件7.:图S7)。这可能导致在芽中施用高丝氨酸的时间比在角果和其他组织中更长,导致真菌的生长比其他组织减少。外源l -高丝氨酸应用于耐药的发现证实了这一点DMR1.-2角果,积累高丝氨酸,进一步增强抗性F死胡同(数字8.).我们确实发现,与水和DHS处理对照相比,更直接地将真菌和LHS应用于受伤的角果尖,导致真菌沿角果的生长减慢,这表明高丝氨酸处理增强了野生型角果在这些感染条件下的抗性。然而,在这些实验中我们也观察到较少F死胡同用D-HomoSerine治疗比水进行治疗后感染,表明HomoSerine的D-映体也可以降低某些情况下的镰刀菌生长。该发现与喷雾接种后获得的结果形成对比,其中氨基酸形式增加了硅氏疾病。这样做的生物学原因尚不清楚。正式地,日常将蒸馏水应用于硅尖可能会增强镰刀菌的生长,这需要对感染的高湿度,而氨基酸溶液的各种渗透性质不具有。或者,D-HomoSerine可以引出来自受伤的硅尖的响应,然后影响真菌生长。这证明了使用生物活性对映体作为对照的重要性。
外源高丝氨酸施于小麦小穗上f . graminearum受感染的小麦品种Apogee并未始终如一地减少感染。在一个实验复制品中接种后10天,LHS处理植物(P = 0.03)中漂白的尖峰的数量显着降低,但AWN弯曲,粒子数或谷物重量没有显着差异。因此,与拟南芥相比,L-HomoSerine对镰刀菌感染和疾病发育的影响对小麦花组织不太明显。这种间隙差异很可能是由于透射型麦芽素激酶的普生素静脉曲化的快速代谢,预防均静脉积聚和活性。因此,未来的研究应专注于小麦均鼠激酶功能的破坏。
本研究还提出了新的发现,外源施用苏氨酸诱导宿主细胞死亡,增加拟南芥叶片F死胡同殖民。这进一步提出了氨基酸代谢对植物防御不同病原体种类和生活方式的影响的问题。van Damme和他的同事并没有发现外源苏氨酸的作用H. Arabidopsidis.用真空渗透法测定氨基酸的敏感性。然而,Stuttmann等.[25.]发现喷涂施加1-5毫米苏氨酸导致减少H. Arabidopsidis.孢子形成呃-0EDS1-2植物。这些对比结果很有趣。H. Arabidopsidis.是一种典型的专性生物菌,因此对任何宿主诱导的细胞死亡都很敏感,这将限制病原体进入活组织。相比之下镰刀菌素被证明有一个转换在Planta.宿主细胞死亡是后期疾病形成过程的一个完整特征的生活方式(Brown等.[28.),德斯蒙德等.[29.],泰勒等.[30.])。感染镰刀菌的谷物也能在腐生死亡的植物组织中定植。因此,苏氨酸介导的褪绿症可能起促进作用镰刀菌素殖民化,同时防止迫使生物营养病原体的生长。
与此相关的是发现DMR1.导致延缓衰老。分析DMR1.使用Genevestigator植物开发期间的表达(Hruz等人。[26.])表明,在整个植物发育过程中表达相当静态,但在衰老期间增加(附加文件7.:图S7b)。这表明DMR1功能可能在细胞程序性死亡和衰老中起作用。大鼠迟发性DMR1依赖性细胞死亡DMR1.突变体可能会限制镰刀菌病进展,并防止其成功利用宿主细胞死亡(Thaler等.[30.])。对于病原体镰刀菌素通过半生物营养和腐生相结合的生活方式策略,延迟细胞死亡可以阻止充分的组织开发和从细胞碎片获得额外的营养。这一点得到了以下发现的支持DMR1.叶片显示衰老延缓,同时衰老减少镰刀菌素殖民。然而,延迟的细胞死亡可能不是耐药性增强的根本原因。例如,延迟细胞死亡的方式可能有助于保护植物免受专性生物营养病原体的侵害,如H. Arabidopsidis.不清楚。正式可能在健康拟南芥组织中发现的正常氨基酸比在DMR1.突变体,这改变了通过吸器界面获取营养的效率在专性生物营养相互作用,以及改变半生物营养病原体切换生活方式。在此基础上,鉴定了三种新型积累氨基酸DMR.突变体,但不EDS1-2(数字5.)仍然是优先事项。
Huibers等.[24.]发现拟南芥鲜重降低与不同品种间存在相关性DMR1.所赋予的突变等位基因和抗性水平O。新菌.作者的结论是,它可能很难获得DMR1.在缺乏适应成本的情况下增强对该病原菌抗性的作物物种中的等位基因。而DMR1.-3.突变等位基因没有达到显着的增长惩罚,同样它没有赋予抵制O。新菌.但是,在目前的研究中,DMR1.-3.赋予抵抗力F死胡同在拟南芥的叶和角果组织中均有明显的差异,但叶片表型不如其他等位基因强。因此,有必要研究高丝氨酸激酶中断对二月敏感谷物作物的影响。这可能通过稳定的转基因和使用诱导启动子来驱动RNAi构建来实现。或者,使用短暂的病毒诱导基因沉默(Lee等.[31.),李等.[32.])可以部署谷物均丝氨酸激酶。
在这项研究中和Van Damme的研究et al。[21.它被发现DMR1.植物的叶面和角果组织中蛋氨酸、苏氨酸和异亮氨酸水平均为野生型或升高(图5.).这些氨基酸被认为是通过高丝氨酸激酶的活性直接合成的。这三种氨基酸在高丝氨酸激酶功能严重减弱的植物中大量存在,因此对目前对氨基酸生物合成途径的理解提出了挑战。这可能是情况下,这些氨基酸是通过替代的,目前不明的途径(s)在DMR1.突变体,其与均静脉激酶无关。或者,突变的均静脉激酶可以保留一些残留功能:通过拟南芥天冬氨酸的活性合成HomoSerine,其通过由甲硫氨酸合成的S-腺苷(SAM)积累的α-腺苷(SAM)负调节)et al。[33.]、[34.])。减少的蛋氨酸生物合成可能因此导致增加的天冬氨酸激酶活性,分流更多的高丝氨酸进入途径。一些积累的高丝氨酸可能随后被突变的高丝氨酸激酶磷酸化,恢复该途径的平衡。然而,野生型和野生型之间的天冬氨酸水平没有变化DMR1.突变体植物。比较不同基因型间天门冬氨酸激酶表达和活性的实验将为我们提供信息。
结论
本研究确定了拟南芥甲鼠激酶基因中的一系列突变DMR1.使角质层组织对谷物FEB病的主要致病因子具有抗性,这种疾病是作物产量损失和谷物污染的来源。长角果的DMR1.突变体积累高丝氨酸,外源应用l -高丝氨酸使两个突变体对花和花柱组织产生抗性DMR1.和野生型DMR1.植物。这些发现提供了开发对经济上重要的花卉作物疾病的新抗性的可能性,其中存在少数其他阻力机制。进一步的工作将使用病毒诱导的小麦的基因沉默DMR1.目的:探讨高丝氨酸的应用潜力镰刀菌素小麦的抗性。然而,植物组织中均静脉积聚的机制介导的抗性仍然没有完全理解,并且可能是完全利用的关键DMR1.基于基于多种作物物种的电阻。
方法
植物生长
拟南芥抗霜霉病突变体收集和亲本基因型EDS1-2是来自荷兰乌特列支大学的Guodo-Van Dan Akvvink的礼物。生态型L呃-0(NASC股票NW20)是英国约翰因内斯中心Graham McGrann的礼物。植物生长在莱文顿 + 在Fiotron®“步入式”植物生长室中进行堆肥(www.fitotron.co.uk),在20°C(光)和17°C(暗)的温度下,16小时光/ 8小时暗循环,150μmolm-2S.-1荧光照明,湿度70%。
镰刀菌的生长与贮藏
F死胡同菌株98/11 (NRRL 54112)和f . graminearum菌株ph1 (NRRL 31084)按上述方法(Urban等.[9.]; 库济克等.[10]);分生孢子从-80°C保存的冻存物转移到合成营养差的琼脂平板上(SNA -0.1% KH)2阿宝4., 0.1%的人知道3., 0.1% MgSO4.7小时2○,0.05%KCl,0.02%葡萄糖,0.02%蔗糖,2%琼脂)8-11天,然后转移到马铃薯葡萄糖琼脂(PDA)板上48小时以促进高水平的分枝产量。然后将Conidia悬浮在无菌蒸馏水中,并通过无菌Miracloth(Calbiochem)过滤,并在植物接种前储存在-80℃。使用研究f . graminearum菌株PH-1在PHSI许可证101948/198285/2下进行。
拟南芥镰刀菌侵染试验
采用喷雾接种法,在开花期(每株2-4朵花)选择植株,对整株进行喷雾接种F死胡同或f . graminearum分生孢子悬浮在浓度为10的无菌水中6.对照植株用无菌水喷雾接种。
在氨基酸处理研究中,接种的植物每天喷洒10 mM l -高丝氨酸、d -高丝氨酸或l -苏氨酸溶液,或无菌水作为对照。接种后每天重复5天。
单角果疮点接种时,选择6个幼角果的植株进行接种。用无菌剪子除去每个角果的顶部1毫米,并接种1 μl含有约。105.镰刀菌素孢子悬浮在无菌H2o .无菌H2单独用O作为对照。对于氨基酸处理,在接种20 mM l -高丝氨酸或d -高丝氨酸时添加分生孢子悬液,或无菌水作为对照。接种6天后,再施用氨基酸悬液。
实验期间将植株移入相对湿度为100%的接种箱中,接种后置于黑暗中保存20 h。
镰刀菌病症状的评分
利用Urban设计的拟南芥镰刀菌病(FAD)评分系统对植物的花和角质层病症状进行评分等.[9.].每个植株的病害评分从0(无病害症状)到7(主茎收缩的严重病害症状)分配给顶端花和角果(附加文件8.:表S1)。角果分数适用于每株植株上患病最严重的角果,只有当所有角果表现出相同的病害时才增加,因此不考虑脱离病害的角果数量。因此,每株未感染的绿色角质层也被计算。并计算每株病莲座叶数。每个处理或基因型在每个试验中至少使用5株,每个试验至少进行两次。
在体外镰刀菌素增长测试
F死胡同和f . graminearum孢子浓度为2x105.conida毫升-1在96孔平底培养皿中,在200μl添加l-或D-高丝氨酸(浓度范围为0-80mM)的合成贫营养液体培养基中培养2天。吸光度作为真菌生长的替代物,如前所述,对每个高丝氨酸浓度进行测量(Fan)等.[35.]). 每个真菌分离物/氨基酸处理包括三个生物重复,重复实验。
小麦侵染及氨基酸处理
矮小麦品种Apogee (Bugbee, Koerner等.[36.])用于小麦侵染试验。花期第8和第9穗点接种5μl的玉米粉f . graminearum分生孢子悬浮液5.毫升-1.另外,用5 μl 10 mM l -高丝氨酸或d -高丝氨酸或无菌水处理第6 ~ 11粒。3种不同处理每天重复,连续7 d。根据Baldwin的方法,评估了漂白的小穗和弯曲的芒刺的数量(染病小穗之前的漂白),并在轴解剖后的10 dpi记录了粒重和数量等.[37.].
西力克氨基酸分析
对15 mg冻干和研磨的角质层样品进行氨基酸含量测定DMR1.突变体,EDS1-2根据制造商的说明,使用Ezfaast GC-MS生理氨基酸分析试剂盒进行分析植物。修正了该方案,使得省略了添加试剂盒的内标标准,并用有机溶剂(试剂6)稀释1:10稀释,用有机溶剂中的重建的最终溶剂蒸发步骤。Samples were analysed on an Agilent 5975 Inert MSD coupled to a 7890A Gas Chromatograph fitted with a Zebron Amino acid ZB-AAA column (10 m × 0.25 mm I.D. Phenomenex, Cheshire, UK), Gestel MPS2 autosampler and split/splitless injector (fitted with quartz wool packed SGE FocusLiner). For each genotype three biological replicates were analysed, each consisting of siliques from ~8 pooled 6-week old plants. The internal standard, amino acid standard solutions and glutamine standard were obtained from Sigma (Dorset, UK). Homoserine standard was obtained from Koch-Light Laboratories, Colnworth, Bucks, UK.
显微镜
利用leicam205-FA立体显微镜和LAS-AF6000软件,用白光或紫外光和紫外滤光片(激发波长425/40nm,发射波长475nm)对感染镰刀菌的拟南芥进行成像。
统计分析
拟南芥-镰刀菌病易感性数据进行回归分析,拟合一般线性模型假定泊松分布。在多时间点突变实验中,考察了基因型和时间的影响,以及基因型和时间的相互作用。如果发现基因型或治疗的显著影响(p = <0.05),基因型或治疗之间的基因型/治疗平均值和最小显著差异(lsd)在5%的置信水平下计算,所有基因型的平均值与基因型EDS1-2,并将所有氨基酸处理与水处理进行比较,找出显著差异。在基因型和时间之间没有相互作用的情况下,通过将所有时间点的数据与相应的LSD进行合并来预测每个基因型的平均值。如果观察到基因型和时间之间存在显著的交互作用,则平均数和LSDEDS1-2在评估的每个时间点计算每个基因型。用于分析LHS对环境的影响DMR1.-2相比EDS1-2每个基因型/治疗组合之间的LSD用于确定治疗之间的统计显著性差异。对于单一的西力克点伤口接种,使用方差分析(ANOVA)来比较沿西力克的真菌生长(单位:mm)。迷幻剂(p = 0.01)。所有统计分析均采用genstatv16(Payne)进行等.[38.])。
支持数据
所有相关的支持数据都可以在本文附带的补充文件中找到。
Arabidopsis突变基因座
以下拟南芥基因座与本研究相关联:DMR1.;AT2G17265,DMR6.;AT5G24530,EDS1-2;AT3G48090。进一步的信息可以从www.arabidopsis.org.
附加文件
参考文献
- 1.
Dean R,Van Kan Ja,Pretlorius Za,Hammond-Kosack Ke,Di Pietro A,Spanu PD,Rudd JJ,Dickman M,Kahmann R,Ellis J,Foster Gd:分子植物病理学的前10名真菌病原体。莫尔植物途径。2012,13:414-430。10.1111 / J.1364-3703.2011.00783.x。
- 2。
Goswami RS, Kistler HC:走向灾难:镰刀菌素graminearum关于谷类作物。Mol Plant Pathol. 2004, 5: 515-525。10.1111 / j.1364-3703.2004.00252.x。
- 3.
Parry DW,Jenkinson P,Mcleod L:小谷物中的镰刀菌穗枯病(赤霉病)-综述。植物病理学。1995年,44:207-238.10.1111/j.1365-3059.1995.tb02773.x。
- 4.
关键词:木霉烯,霉菌毒素,真核细胞,生物活性食品添加剂,2005,22:369-378。10.1080 / 02652030500058403。
- 5。
白光华,沙尔克:小麦和大麦对赤霉病的防治。植物病理学杂志,2004,42:135-161。10.1146 / annurev.phyto.42.040803.140340。
- 6。
关键词:小麦,赤霉病,QTL定位,分子标记辅助选择《植物育种》,2009年第1期。10.1111 / j.1439-0523.2008.01550.x。
- 7。
Jayatilake-DV,Bai-GH,Dong-YH:小麦7A染色体抗赤霉病数量性状的新位点。理论应用基因。2011年,122:1189-1198.10.1007/s00122-010-1523-2。
- 8.
3 .周明平,海登MJ,张志勇,陆文忠,马洪霞:苏麦3号染色体3BS抗赤霉病主要QTL的饱和定位。应用生物医学工程学报,2010,51:19-25。10.1007 / BF03195706。
- 9
Urban M,Daniels S,Mott E,Hammond-Kosack K:拟南芥易患谷物耳朵枯萎的真菌病原体镰刀菌素graminearum和镰刀菌素culmorum.植物学报,2002,32:961-973。10.1046 / j.1365 - 313 x.2002.01480.x。
- 10
Cuzick A,Lee S,Gezan S,Hammond-Kosack Ke:NPR1和EDS11有助于抵抗抵抗镰刀菌素culmorum在拟南芥的芽和花中。植物病理学杂志。2008,9:697-704。10.1111 / j.1364-3703.2008.00488.x。
- 11
Cuzick A,Maguire K,Hammond Kosack KE:缺乏植物信号成分SGT1b可增强植物的抗病性镰刀菌素culmorum在拟南芥的芽和花中。新植醇。2009,31(4):431 - 431。10.1111 / j.1469-8137.2008.02712.x。
- 12
Makandar R,Essig Js,Schapaugh Ma,Trick HN,Shah J:通过拟南芥的表达,遗传工程对镰刀菌的抗性枯萎病NPR1. 植物与微生物相互作用。2006年,19:123-129。10.1094/MPMI-19-0123。
- 13。
Makandar R,Nalam V,Chaturvedii R,Jeannotte R,Sparks AA,Shah J:拟南芥中的水杨酸和茉莉酸己酸的途径参与拟南芥互动镰刀菌素graminearum. 植物与微生物相互作用。2010年,23:861-870.10.1094/MPMI-23-7-0861。
- 14。
Savitch L,Subramaniam R,Allard G,Singh J:GLK1‘调节子’编码疾病防御相关蛋白并赋予对疾病的抗性镰刀菌素graminearum在拟南芥中。Biochem Biophys Res Communce。2007,359:234-238。10.1016 / J.BBRC.2007.05.084。
- 15.
Van Hemelrijck W、Wouters PFW、Brouwer M、Windelinkx A、Goderis IJWM、De Bolle MFC、Thomma BPHJ、Cammue BPA、DelauréSL:拟南芥防御反应突变体esa1.作为发现针对镰刀菌疾病的新抗性特征的模型。植物SCI。2006,171:585-595。10.1016 / J.Plantsci.2006.06.013。
- 16。
Asano T, Miwa A, Maeda K, Kimura M, Nishiuchi T:分泌的抗真菌蛋白硫氨酸2.4 in拟南芥抑制真菌子体凝集素的毒性镰刀菌素graminearum. 公共科学图书馆。2013, 9: 8-
- 17。
Ferrari S, Sella L, Janni M, De Lorenzo G, Favaron F, D'Ovidio R:转基因拟南芥和小麦中多聚半乳糖醛酸酶抑制蛋白的表达增加了对花的抗性镰刀菌素graminearum.植物BIOL。2012,14(1):31-38。10.1111 / J.1438-8677.2011.00449.x。
- 18。
Kaur J,Thokala M,Robert-Seilaniantz A,Zhao P,Peyreet H,Berg H,Pandey S,Jones J,Shah D:亚细胞靶向进化保守的植物防御素MTDEF4.2确定了转基因植物病原体相互作用的结果拟南芥。莫尔植物途径。2012,13(9):1032-1046。10.1111 / J.1364-3703.2012.00813.x。
- 19
Koch A,Kumar N,Weber L,Keller H,Imani J,Kogel K-H:宿主诱导细胞色素P450 LanterolC14α-脱甲基酶编码基因的基因沉默赋予对镰刀菌种的强抗性。PROC NAT ACAD SCI。2013,110(48):19324-19329。10.1073 / pnas.1306373110。
- 20.
Schreiber KJ, Nasmith CG, Allard G, Singh J, Subramaniam R, Desveaux D:在翻译中发现:高通量化学筛选拟南芥识别在小麦中减少镰刀菌头枯萎病的小分子。Mol植物微生物相互作用。2011,24:640-648。10.1094 / MPMI-09-10-0210。
- 21.
Van Damme M,Andel A,Huibers RP,Panstruga R,Weisbeek PJ,Van Den Ackerveken G:鉴定令人害羞的霉菌病原体易感性所需的拟南芥基因座Hyaloperonospora parasitica.Mol植物微生物相互作用。2005,18:583-592。10.1094 / mpmi-18-0583。
- 22.
Van Damme M, hubers RP, Elberse J, Van den Ackerveken G G:拟南芥DMR6.编码一种假定的2OG-Fe(II)加氧酶,该酶与防御相关,但对霜霉病的敏感性是必需的。植物学报,2008,54:785-793。10.1111 / j.1365 - 313 x.2008.03427.x。
- 23.
Van Damme M,Zeilmaker T,Elelbere J,Andel A,De Sain-Van der Velden M,Van Den Ackerveken G:通过突变造成拟南芥的柔软效力高丝氨酸激酶.植物细胞。2009,21:2179-2189。10.1105 / TPC.109.066811。
- 24.
Huibers RP,Loonen AE,Gao D,Van den Ackerveken G,Visser RG,Bai Y:番茄对SlPMR4和SlDMR1损伤的抗白粉病性。公共科学图书馆一号。2013年8月:e67467-10.1371/journal.pone.0067467。
- 25.
Stuttmann J, Hubberten HM, Rietz S, Kaur J, Muskett P, Guerois R, Bednarek P, Hoefgen R, Parker JE:拟南芥氨基酸代谢的扰动导致与适应的生物营养病原体不相容Hyaloperonospora Arabidopsidis..植物细胞。2011,23:2788-2803。10.1105 / TPC.111.087684。
- 26.
Hruz T, Laule O, Szabo G, Wessendorp F, Bleuler S, Oertle L, Widmayer P, Gruissem W, Zimmermann P: genev调查者V3:转录组meta分析参考表达数据库。生物信息学Adv . 2008, 2008: 5-10.1155/2008/420747。ID 420747条
- 27.
甲硫氨酸和苏氨酸的合成受到高丝氨酸可用性的限制,而不是高丝氨酸激酶的活性拟南芥. 植物J。2005年,41:685-696.10.1111/j.1365-313X.2004.02329.x。
- 28.
黄志明,张国栋,张国栋,等:黄曲霉的感染生物学镰刀菌素graminearum:确定小麦穗中小穗到小穗定植的途径。中国生物医学工程学报。2010,31(3):457 - 461。10.1016 / j.funbio.2010.04.006。
- 29.
Desmond OJ, Manners JM, Stephens AE, Maclean DJ, Schenk PM, Gardiner DM, Munn AL, Kazan K:镰刀菌毒素脱氧雪腐镰刀菌素诱导小麦过氧化氢产生,程序性细胞死亡和防御反应。《植物病理学杂志》,2008,9:435-445。10.1111 / j.1364-3703.2008.00475.x。
- 30
Thaler JS,Owen B,Higgins VJ:茉莉酸盐反应在植物对多种生活方式的病原体敏感性中的作用。植物生理学。2004年,135:530-538.10.1104/pp.104.041566。
- 31
Lee Ws,Rudd JJ,Hammond-Kosack Ke,Kanyuka K:格拉米菌球LysM效应介导的隐形发病机制通过小麦的CERK1和CEBiP同源物破坏识别。植物分子微生物的相互作用。2013,27(3):236-243。10.1094 / mpmi - 07 - 13 - 0201 r。
- 32
利用大麦条纹花叶病毒介导的工具研究谷类植物及其病原体的基因功能:病毒诱导的基因沉默、宿主介导的基因沉默和病毒介导的异源蛋白过表达。植物营养与肥料学报,2012,31(5):529 - 533。10.1104 / pp.112.203489。
- 33
关键词:异构单功能天门冬氨酸激酶,拟南芥2 .中国科学院研究生院学报,2007,25(1):1 - 6。10.1111 / j.1742-4658.2006.05573.x。
- 34
刘志明,张建平,李建平。六种新型变构效应物的鉴定。北京:化学工业出版社拟南芥天门冬氨酸激酶同丝氨酸脱氢酶亚型:生理背景决定特异性。中国生物医学工程学报。2005,28(5):531 - 531。10.1074 / jbc.M509324200。
- 35
Liu X, Fan J, Urban M, Parker JE, Brewer HC, Kelly SL, hamd - kosack KE, Fraaije BA, Liu X, colhj:甾醇14α-去甲基化酶的表征镰刀菌素graminearum鉴定了一个新的属特异性CYP51功能。新植醇。2013,37(3):431 - 434。10.1111 / nph.12193。
- 36
[11]张国栋,张国栋,张国栋,等。“USU-Apogee”小麦品种的选育。作物学报,2006,40(3):457 - 464。作物科学,1997,37 (2):626-10.2135/cropsci1997.0011183X003700020053x。
- 37。
Baldwin TK,Gaffoor I,Antoniw J,Andries C,Guenther J,Urban M,Hallen-Adams He,PiTkin J,Hammond-Kosack Ke,Trail F:由随机质粒整合引起的部分染色体缺失导致减少的毒力表型镰刀菌素graminearum.Mol植物微生物相互作用。2010,23(8):1083-1096。10.1094 / mpmi-23-8-1083。
- 38。
Payne RW、Murray DA、Harding SA、Baird DB、Soutar DM:GenStat for Windows简介。第14版。Hemel Hempstead,英国:VSN国际;2011
确认
作者要感谢Julian Franklin和他的同事维护受控环境设施,Stephen Powers帮助进行统计分析,Guido van den Ackerveken提供拟南芥种子。显微镜是在洛桑研究所的生物成像设备中完成的。我们感谢Jason Rudd博士和Martin Urban博士对手稿的评论,也感谢Peter Hedden教授对这项研究的讨论。
这项工作是由英国生物技术和生物科学研究委员会(BBSRC)资助的博士学位配额研究项目(S2055)的一部分。Rothamsted Research获得了BBSRC的资助。KHK从BBSRC研究所战略拨款20:20小麦(BB/J/00426X/1)获得额外支持。
作者信息
从属关系
通讯作者
额外的信息
相互竞争的利益
提交人声明他们没有竞争利益。
作者的贡献
HB设计并进行了所有实验和数据分析,除GC-MS外。NH进行了GC-MS和随后的数据分析。KHK参与了实验设计,手稿起草和编辑和监督研究项目。所有作者阅读并认可的终稿。
电子辅助材料
12870 _2014_317_moesm1_esm.pptx
附加文件1:图S1。:Images of individual siliques point inoculated at the cut tip. (a-c) Water inoculated controls show comparable development and seed set betweeneds1-2和dmr1-1型和dmr1-2型基因型。(d-i)可比水平镰刀菌素culmorum感染DMR1.突变体,eds1-2接种后7天的西力克。在图d到图f中,显示了整个被感染的分裂(左)和完整(右)的西力克。图g到图i是受感染种子的特写照片。所示为多个生物复制体中的代表性图像(PPTX(4 MB)
12870 _2014_317_moesm2_esm.pptx
附加文件2:图S2。:HomoSerine不抑制镰刀菌菌丝生长在体外.孢子的F死胡同或f . graminearum在含(a, b) d -高丝氨酸和(c, d) l -高丝氨酸的合成贫营养培养基中培养2天,浓度从0到80 mM。图显示真菌菌落生长2天后在600 nm处的光密度。这个实验重复了一次,结果相似。(PPTX 83 KB)
12870\ 2014\ 317\ MOESM3\ ESM.pptx
附加文件3:图S3。:Threonine (THR) mediated chlorosis in rosette leaves of Arabidopsis genotypes L呃-0和eds1-2.植株每日喷施10 mM苏氨酸或水,连续5天,第一次处理相一致F死胡同或嘲笑(水)喷雾接种。苏氨酸的作用在镰刀菌接种叶片中最为明显。两种不同商业供应商的苏氨酸进行了相同的结果。(PPTX 375 KB)
12870 _2014_317_moesm4_esm.pptx
附加文件4:图S4。:高丝氨酸治疗减少了F死胡同接种点生长eds1-2长角果。Tip-woundededs1-2用10mM L-HomoSerine(LHS),D-HomoSerine(DHS)或无菌水相结合,处理单片机。与F死胡同接种。氨基酸/水处理重复5 dpi。图像显示在8 dpi打开西力克部分。组织坏死和真菌生长在水和D-高丝氨酸(DHS)处理的西力克的果皮(P)和种子(S)中是明显的。L-高丝氨酸(LHS)处理的西力克主要有未感染的果皮,但一些外部未感染的LHS处理的西力克在打开时显示,西力克内存在真菌定植(最右侧)(PPTX(419 KB)
12870_2014_317_moesm5_esm.pptx.
附加文件5:图S5:发育形态与衰老之间的差异dmr1-1型和dmr1-2型突变等位基因eds1-2. (a、 b)5周龄基因型植株的花环直径减小dmr1-2型相比eds1-2.(c)基因型之间的叶子数可相当。(D,E)叶片衰老延迟dmr1-1型和dmr1-2型.图d为开花植物开花后14天的莲座形态。(f)各基因型间的角果数在整个结实期均相等。这些表型在多个实验重复中观察到。星号表示与有显著差异eds1-2.* P <0.05,** P = <0.01(B - Anova,电子回归分析)。(PPTX 705 KB)
12870\ 2014\ 317\ MOESM6\ ESM.pptx
附加文件6:图S6。:Effect of L-homoserine application on Fusarium infection of wheat. Spikes of wheat cultivar Apogee were point inoculated withf . graminearum然后用L-高丝氨酸(LHS)、D-高丝氨酸(DHS)或水处理7天。在10dpi条件下,测定了弯芒数(a)和漂白小穗数(b)以及单株粒重(c)和粒数(d)LHS处理植株的漂白小穗数显著减少(p = 0.03). 其他参数在治疗组间无统计学差异(方差分析,p=>0.05)。酒吧 = 标准误差(PPTX(64 KB)
12870\ 2014\ 317\ MOESM7\ ESM.pptx
附加文件7:图S7。:GENEVESTIGATOR analysis of the expression profile of ArabidopsisDMR1..a)不同花组织的组织特异性表达水平。b)发展阶段特异性表达水平。(PPTX 109 KB)
12870 _2014_317_moesm8_esm.pptx
附加文件8:表S1.:拟南芥花和西力克组织中镰刀菌病的评分,改编自Urban等人[9.].将植物分别用于0(无疾病)至7(主干的收缩)的花卉和二氧化硅感染分数。预留2和4(f)和2,4和6(S)的中间分数,当单个植物上的所有组织表现出用于前一分数的疾病表型。(PPTX 48 KB)
权利和权限
开放存取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。
除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。
要查看本许可证的副本,请访问https://creativecommons.org/licenses/by/4.0/.
知识共享公共领域放弃(https://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非信用额度中另有规定。
关于这篇文章
引用这篇文章
Brewer,H.C.,Hawkins,N.D.&Hammond-Kosack,K.E.拟南芥均菌氨酸激酶基因的突变DMR1.增强抵抗力镰刀菌素culmorum和f . graminearum.BMC植物BIOL.14,317 (2014). https://doi.org/10.1186/s12870-014-0317-0
收到:
公认:
发表:
关键字
- 拟南芥
- 镰刀菌素culmorum
- 镰刀菌素graminearum
- 高丝氨酸激酶
- 抗病性
- 功能的增益
- 镰刀菌头痂