抽象的
背景
麻风树是一个潜在的生物燃料工厂。在其花序芽上施用外源细胞分裂素(6-苄基腺嘌呤,BA)可显著增加雌花数量,从而提高种子产量。研究哪些基因和信号通路参与了细胞分裂素的应答麻疯树花序芽,我们在花序监测转录活性在0,3,12,24,并使用微阵列BA处理后48小时。
结果
在实验过程中,我们检测到5555个差异表达的转录本,这些转录本可以分为12个不同的时间表达模式。我们还发现了31和131个转录本麻疯树其在模式植物中的同源基因分别在开花和植物激素信号通路中发挥作用。根据基因的转录分析在花开发中,我们假设BA处理延迟花器官形成的抑制转录,B和E类花卉organ-identity基因,这将允许更多的时间来产生更多的花原基在花序分生组织,从而增加花序分枝,显著增加每个花序的花数。BA处理也可能通过激活的转录在维持开花信号中发挥重要作用Gigantea.(胃肠道)和灭活的转录构光形态1(COP1),顶花1b (TFL1b .).此外,外源性细胞蛋白治疗可以调节参与代谢和其他植物激素的信号传导的基因的表达,表明细胞素蛋白和其他植物激素联合调节花发育麻疯树花序芽。
结论
我们的研究为更好地理解细胞分裂素处理下花期性状变化的分子机制提供了一个框架麻疯树花序芽。这些结果为木本植物多种激素信号通路间的互传机制提供了有价值的信息。
背景
麻风树L.(大戟科)是一种多年生灌木或小乔木,广泛种植于热带和亚热带气候。含油量麻疯树种子是30-40%,而且麻疯树在边际土地上生长良好,避免与粮食生产竞争。因此,麻疯树是一个潜在的生物燃料工厂[1],[2].然而,它作为生物燃料植物的潜力受其种子差的限制[3.].研究有助于种子生产的生物和遗传因素麻疯树是通过传统和分子育种方法进行遗传改良所必需的[4] - [6].麻疯树是一种雌雄同株的植物,单性花:雄花和雌花生在同一个总状花序上。在正常生长条件下,每个花序大约有15朵雌花和13个果实[7].因此,要提高种子产量麻疯树,产生足够的女性花是至关重要的。前一项研究[7应用外源细胞分裂素(6-苄基腺嘌呤,BA)麻疯树结果表明,单花序的雌花数增加了9.4倍,种子产量增加了2.3倍,为提高种子产量提供了一种有前景的策略麻疯树.
细胞分裂素是一类重要的植物激素,1955年首次在烟草组织中发现它促进细胞分裂[8].细胞分裂素参与植物生长发育的许多重要方面,如促进维管形成层活性,控制器官发育,调控茎和根分枝,以及应对生物和非生物胁迫[9] - [11.].它们在维持茎尖分生组织(shoot apical meristem, SAM)的活性和功能方面也起着重要作用[9],[12.].茎鞘细胞由位于茎尖的一小群分裂细胞组成,负责植物所有地上部分(包括生殖器官)的启动[13.].已经鉴定了至少三种可能的途径用于维持干细胞的稳态,这对于分娩活动是必要的拟南芥[14.].许多基因,如SHOOT MERISTEMLESS(扫描隧道显微镜),WUSCHEL(本人),CLAVATA(图表),孤独的人(日志),AINTEGUMENTA(蚂蚁),像蚂蚁6(AIL6.),像蚂蚁7(AIL7.),参与这个过程[14.] - [22.].
KNOTTED1-like同源框(诺克利)通过促进表达增加细胞分裂素的生物合成ISOPENTENYL转移酶(IPT.),它在细胞分裂素生物合成中编码一种限速酶。外源细胞分裂素的应用或细胞分裂素生物合成基因的表达拯救了细胞分裂素STM.突变体(22.],[23.].WUS直接抑制的表达拟南芥反应调节剂5,6,7,和15 (ARR5, 6, 7,和15),是细胞分裂素信号通路中的负调控因子,细胞分裂素信号激活表达本人通过clv依赖和clv独立途径[24.] - [26.].LOG催化水稻分生组织内细胞分裂素生物合成的最后一步日志突变体在拍摄分发功能中具有缺陷,显示小圆锥和异常的花动器官和分支模式[22.].细胞分裂素氧化酶/脱氢酶(CKX)催化细胞分裂素的降解,调节生殖分生组织的活性拟南芥.一个ckx3ckx5双突变体产生更大的花序和花分生组织,种子产量提高约55% [27.],[28.].在水稻中,突变体具有降低的表达OSCKX2.花序分生组织中细胞分裂素的积累,有助于增加小穗和生殖器官的数量[29.].因此,内源性细胞分裂素假设由SAM [发起更多的花原基促进生殖分生组织的大小和生殖器官的数量28.].此外,细胞分裂素影响从植物切换到生殖生长阶段,并参与花发育的调控[30.] - [34.].Cytokinin促进的应用拟南芥开花通过激活ft的孪生姐妹(TSF.),FD,constans过表达抑制因子1(SOC1).相比之下,开花轨迹T.(英国《金融时报》)是不需要的,表明英国《金融时报》和TSF.属于不同的花卉信号通路的是不同的环境和内部信号响应[11.].
我们前期的研究表明,外源施用BA显著增加了花的总数和雌花比例麻疯树[7].要了解细胞分裂素作用的分子机制麻疯树利用微阵列技术分析BA处理后不同时间点基因表达的动态变化。鉴定了参与细胞分裂素和其他植物激素代谢和信号转导、开花和花器官发育以及细胞分裂的差异表达基因。本研究结果为确定细胞分裂素在花发育中的作用机制提供了依据麻疯树.
结果与讨论
6-苄基腺嘌呤(BA)对紫穗槐开花结果的影响麻疯树
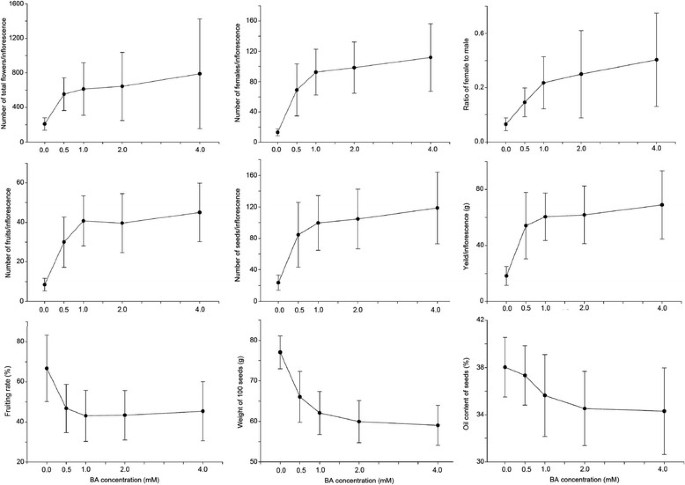
BA的应用改变了开花特征麻疯树并显著增加了雌花的数量,以提高种子产量[7].为了选择适宜的BA浓度,我们对其进行处理麻疯树用0、0.5、1.0、2.0、4.0 mM BA测定花序总花数、雌花数、雌雄花比、果实数、结实率、种子数、种子产量、百粒重、每花序种子含油量。结果表明,施用BA是显著增加雌花和雌果数量,从而提高种子产量的有效途径麻疯树(数据1和2).总花数,雌花数,女男花,果实数,种子数量,和种子产量所有与BA浓度的增加为0.5〜4.0毫摩尔的比例,而结实率,重量100个的种子,和种子油含量降低(表1).4.0 mM BA处理的每花序雌花数、雌果数和雌粒数分别是对照的7.7倍、4.4倍和4.0倍。如图所示3.,1.0 mm Ba是生物反应中的过渡点,因此选择用于随后的实验。实际上,本研究中使用的单个1.0mm的BA处理的效果类似于三天间隔的三种连续处理,160mg / L(0.71mm)Ba [7]:这两种方法都使最终种子产量增加了2.3倍1).
对BA在花序芽上应用的差异表达基因的响应
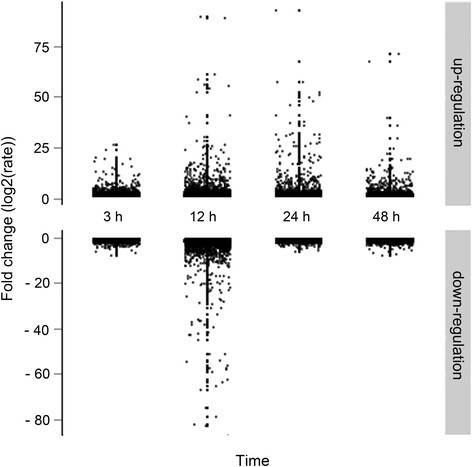
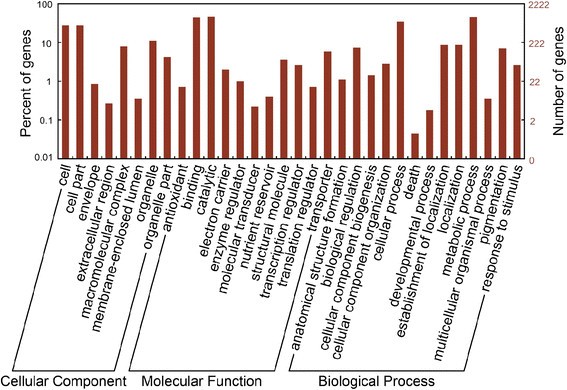
为了识别响应BA的基因,我们设计了41651个序列特异性寡核苷酸探针,代表20555个转录本,利用微阵列技术监测BA处理后0、3、12、24和48 h花序芽中基因的转录水平。10569个探针代表5555份转录本在时间过程中发生了显著变化(附加文件)1).花序芽中上调的转录本多于下调的转录本,除了在12小时的时间点,在所有时间点中转录本的差异总数最大(图)4),表明这是对外源性细胞分裂素反应的一个重要阶段。此外,根据不同的分子功能和生物过程,这些差异表达的转录本(约27%)被注释为32个基因本体论(GO)类别(图)5),说明花序芽对外源细胞分裂素反应的分子机制尚不明确。
BA处理下差异表达基因的表达谱
为了进一步了解BA应用响应的遗传和生物学过程,将转录本聚类为12组,代表不同的时间表达模式(图)6和附加文件2).其中,聚类2和5在3 h时表达上调,聚类1表达下调,表明这些基因在细胞分裂素反应早期就被诱导了;例如钙离子结合蛋白(CUST_18202)、赤霉素20氧化酶(CUST_5901)和赤霉素受体GID1 (CUST_19936)。簇4、6、9、10和11的基因表达在3 ~ 24 h时间点发生了显著变化,说明在这一阶段发生了显著的转录调控。第7和8组基因表达在3 ~ 12 h时变化明显,在48 h时保持不变。此外,簇3和簇12的表达谱在24 ~ 48 h时间点发生了明显变化,提示它们可能代表了BA响应途径的下游基因。
为了验证微阵列分析的结果,我们进行了对12个代表代表不同的表达模式的12簇的选定转录物定量实时逆转录PCR(QRT-PCR)分析(图6).qRT-PCR表达谱与各自簇的表达谱一致;然而,在某些时间点的表达变化的大小比在集群中更大(图)6),表明qRT-PCR比微阵列分析更敏感。根据qRT-PCR结果,我们得出了聚类中转录本的表达谱(图6)准确地反映了参与响应外源性细胞分裂素的基因表达的时间变化。
响应BA差异表达基因的功能分析
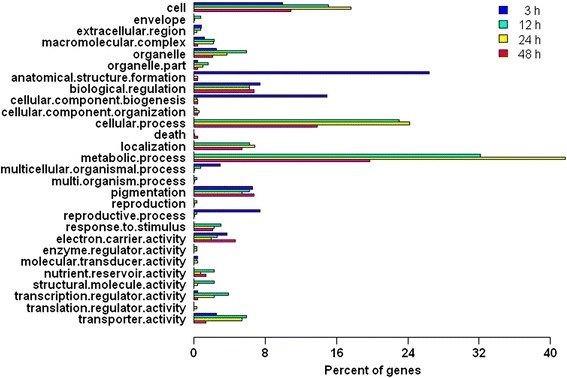
为了了解差异表达基因的生物学功能,对变化≥2倍的基因进行GO分析(图)7).在所有应用后时间点中,“解剖结构形成”、“细胞成分生物发生”和“生殖过程”类别的转录本数量在3 h时间点最高(分别为28%、16%和8%),“代谢过程”、“细胞过程”、“本土化”和“对刺激的反应”这两个类别最低。然而,“细胞”、“生物调节”、“色素沉着”、“细胞器”、“电子载体活性”和“转运体活性”在四个时间点上是相似的。结果表明,参与“解剖结构形成”、“细胞组分生物发生”和“生殖过程”功能的基因在3 h时间点特别表达,促进了花序中细胞的生成,这可能是促使花数增加的主要因素。我们假设这些特异性表达的基因首先被细胞分裂素诱导,然后依次激活“代谢过程”、“细胞过程”、“定位”和“对刺激的反应”类别中的基因,从而影响植物的生长和开花麻疯树.
花发育相关基因的转录分析
BA的应用对开花特征有显着影响麻疯树,从而提高了种子产量。在我们的数据集中有31个转录本与紫花楸开花和花发育相关基因同源拟南芥(表2).BA处理对9个基因表达有显著差异(≥2倍)。的杯状容器子叶1(CUC1.),Gigantea.(胃肠道)被上调,和APETALA3(AP3.),构光形态1(COP1),NGATHA 2(NGA2.),SEPALLATA 1 2和3.(SEP1,2,和3),Serifstick.(STK)随着实验时间的推移而降低。
有趣的是,胃肠道,一种与时钟相关的蛋白质,参与控制昼夜节律和调节开花时间[35.],[36.], BA处理快速诱导(3 h时点),12 h时点表达量比0 h时高88倍。CUC1.,属于NAC家族,这有助于形成SAM和通过激活分离子叶扫描隧道显微镜在拟南芥[37.],[38.,提示在12 ~ 48 h时间点诱导CUC1.有助于促进和维持SAM的形成,产生更多的花原基。然而,CUC2.和CUC3.是不敏感的BA治疗麻疯树.这与在拟南芥,在那里CUC2.和CUC3.,但不CUC1.,被花序分生组织细胞分裂素上调[39.].
在花器官特性基因中,AP1., a类基因拟南芥,AP3.(b),SEP1.,sep2.,SEP3.(e级)40]在12 h时下调,而AP2.(a级),AG)(丙类)41.]对BA应用不敏感。这些结果表明,BA处理可以抑制A-、B-和e类基因的表达,这与我们观察到的BA处理的花序开花时间比对照长(数据未显示)一致。最近,AP1.作用于细胞分裂素上游,通过直接抑制细胞分裂素生物合成基因来调节细胞分裂素水平LOG1激活细胞分裂素降解基因CKX3在萼片腋分生组织抑制活性42.].
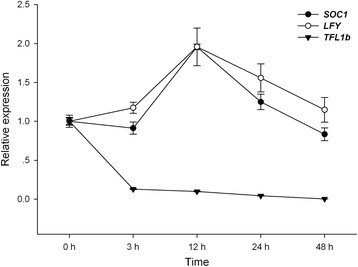
对的表达式进行了验证SOC1,多叶的(LFY.),顶花1b (TFL1b .)在花序芽中麻疯树经qRT-PCR处理后。的转录水平SOC1和LFY.在12小时时上调,和TFL1b在实验过程中被下调(图8).我们推测BA处理可能通过激活开花信号的表达来维持开花信号胃肠道,LFY.,SOC1和灭活COP1和TFL1b.BA处理还可能通过抑制花器官识别基因A-、B-和e -的转录来延缓花器官的形成,从而使花原基在花序分生组织中产生更多的时间,并激活花原基的表达CUC1.,这将导致花的数量显著增加麻疯树.
植物性别决定相关基因的转录分析麻疯树
如表所示1,BA治疗显着提高了女性对雄花的比例,表明细胞质素可能影响男性和女性花的分化麻疯树.在本研究中使用的寡核苷酸探针中,CUST_36773(表2)与性别决定基因同源TASSELSEED2(TS2),它编码玉米心皮败育所需的短链醇脱氢酶[43.].在BA治疗花序芽时,j . curcas TS2同源物(CUST_36773)分别下调2.3倍,3.4倍和3.2倍,分别在12-H,24-H和48-H时间点(表2).结果表明,BA处理通过抑制雄花雌蕊原基的表达,激活了雌蕊原基的发育TS2相同器官中麻疯树,这就增加了雌花与雄花的比例。然而,植物的性别决定是一个复杂和动态的过程,并受到遗传、激素和环境条件的影响[44.],[45.].需要进一步的研究来阐明性别测定机制麻疯树.
花序芽细胞分裂素信号转导相关基因的转录分析
内源性细胞分裂素调控植物生长发育的许多重要方面,在SAM的形成和维持中起着关键作用。为进一步探讨其反应机制麻疯树在我们的数据集中,我们分析了27个同源的转录本拟南芥参与胞内素信号转导途径的基因(附加文件3.).的表达式ARR3和ARR8调节,IPT5表明外源细胞分裂素促进了ARR表达的增加,促进了信号的感知和传递,抑制了IPTs的激活,IPTs催化了细胞分裂素信号通路中内源性细胞分裂素生物合成的第一个关键反应。这些发现与其他涉及细胞分裂素治疗的研究结果一致[46.] - [48.].然而,一些基因在细胞分裂素信号转导中起重要作用,如拟南芥组氨酸激酶3(AHK3),拟南芥组氨酸的磷酸替代片2(AHP2),ARR1,同源盒蛋白1像3(KNAT3),扫描隧道显微镜,IPT9,其转录水平仅发生微小变化,说明这些基因的表达只需发生微小变化即可发挥其功能,而不是对外源BA不敏感。许多转录因子在低水平表达;因此,使用微阵列方法很难准确评估它们的变化[46.],[49.].此外,乙酰-CoA羧化酶1(ACC1),拟南芥血红蛋白2(AHB2),拟南芥同源盒蛋白2(ATHB2),QUASIMODO2(QUA2)亦由施用BA引起;然而,它们在细胞分裂素信号中的作用尚不清楚。
与其他植物激素的细胞蛋白串联
八种主要类型的植物激素坐标植物生长和通过调节各种细胞过程,以应对内在和环境线索:脱落酸(ABA),毒素,芸苔类固醇(BRS),细胞蛋白(CKS),乙烯,赤霉素(气体),茉莉酸(JA)和水杨酸(SA)[47.].要了解其他植物激素在花序芽中的作用响应BA治疗,我们鉴定了各种激素调节途径的同源基因拟南芥通过与拟南芥激素数据库的序列比较[48.].除了27 cytokinin-related基因,104年记录被确认在我们的数据集,其中包括23名脱落acid-related基因,32 auxin-related基因,11 brassinosteroid-related基因,11 ethylene-related基因,九gibberellin-related基因,茉莉acid-related 11基因,和七个水杨acid-related基因(附加文件3.).
在ABA信号通路中,脱落酸受体(一间酒吧),PYRABACTIN抵抗4(PYL4)编码两个参与感知ABA信号的ABA受体[50],[51].在本研究中,转录水平PYL4和一间酒吧3 h时下调3.5倍,12 h时下调20.6倍。脱落酸1(ABA1.),其编码Zeaxanthin环氧酶,其催化玉米黄蛋白转化为氧化萘素和virtaxanthin,在ABA生物合成途径中产生环氧树脂蛋白前体[52],在12 h时下调。同时,1-DEOXY-D-XYLULOSE-5-PHOSPHATE合酶(dx),它编码一种关键酶,催化塑型类异戊二烯(ABA生物合成的类胡萝卜素前体)生物合成的限制步骤[53],在3 h时下调4倍。此外,9顺式 - 环氧加氧酶3(nced3.),编码ABA生物合成途径中的关键酶[54],在12 h时下调3.8倍。这些结果表明,BA处理通过抑制ABA生物合成和ABA感知相关基因的表达来抑制ABA信号传导。说明内源细胞分裂素可能在抑制ABA作用和维持花芽发育过程中发挥相似的作用麻疯树.
在生长素信号通路中,MASSUGU2(MSG2 / IAA19)编码调节胚轴生长和侧根形成与生长素应答FACTOR7(ARF7)一起生长素调节蛋白55];在12小时的时间点显示了2倍的上调。Iaa羧甲基转移酶1(Iamt1.),它将吲哚-3-乙酸(IAA)甲基化形成甲基-IAA酯,过表达该酯会引起戏剧性的低催眠叶表型[56],在12 h时下调2.1倍。SUPERROOT 1(SUR1)编码C-S裂解酶,其涉及吲哚芥子油苷的生物合成和其突变体显示与吲哚-3-乙醛肟的积累的高表型生长素IAA促进生物合成[57]在12-H时间点下调4.3倍。透明的外种皮4(TT4.)编码查耳酮合成酶是在类黄酮合成的第一个酶,是一种植物生长素输送抑制剂[58];它在12-H时间点下调了2.8倍。琼斯et al。发现细胞分裂素的应用或异位生物合成能迅速诱导幼嫩枝和根组织中生长素的增加,提出细胞分裂素通过控制某些生长素生物合成基因的转录来促进生长素的合成[59].然而,我们的结果表明,细胞分裂素处理通过抑制生长素生物合成途径的负调控因子而导致生长素水平的增加。此外,表示MYB77,生长素信号转导的正调控因子[60,在48 h时下调,说明当时生长素信号被抑制,与我们的细胞分裂素促进生长素增加的结论相矛盾。因此,我们假设MYB77可以通过抑制植物蛋白运输来帮助养生长素在花序芽中积聚,表明MYB77的角色可能不同拟南芥和麻疯树.
一个UDP糖基转移酶基因(UGT73C5)编码一种催化BRs糖基化的酶,导致它们失活[61];它被下调在12小时时间点5倍。构成性光形态发生与侏儒症(CPD / DWF3),它编码在BR生物合成中起重要作用的细胞色素P450甾体侧链羟化酶[62],在3 h时上调3倍。这些结果表明,细胞分裂素通过抑制BR的糖基化和促进BR的生物合成而引起BR的增加,从而抑制了BR的表达方法促进开花拟南芥[63].
在乙烯信号通路中,多蛋白桥接因子1c(MBF1c)编码一种增强植物对生物和非生物胁迫的耐受性的共激活剂,并参与水杨酸和乙烯信号通路[64];在实验的时间过程中,它的表达增加了4倍以上,特别是在24小时时间点(37.4倍)。高吲哚硫代葡萄糖苷(HIG1 / MYB51),它编码吲哚硫代葡萄糖苷生物合成的关键转录因子,并对乙烯刺激作出反应[65],[66], 3 h时上调,12 h时下调。这些结果表明MBF1c和HIG1 / MYB51是细胞蛋白和乙烯信号通路中的候选串扰基因。
赤霉素20-OXIDASE 1(GA20ox1)在3 ~ 48 h内上调GIBBERELLIN-INSENSITIVE矮1 b和1C.(GID1b和1C.)在48 h时上调;然而,赤霉素2-OXIDASE 1(GA2ox1)在12 ~ 48 h下调。GA20ox1编码一种酶,与赤霉素3β羟化酶一起催化活性赤霉素的形成GID1s编码赤霉素信号通路中作为正调控因子的赤霉素受体[67],[68].Ga2Ox1在主要的分解代谢途径中的作用,这些途径负调节胃肠杆菌素信号传导[69].结果表明,细胞分裂素通过增加赤霉素的转录来促进赤霉素的产生GID1s和GA20ox1减少GA2ox在花序芽。
异常花序分生组织1 (ABNORMAL花序分生组织1,AIM1)、氧化ALLENE SYNTHASE (AOS/CYP74A)、OPR3 (OXOPHYTODIENOATE-REDUCTASE 3)和SUPPRESSOR OF SA-INSENSITIVITY 2 (SSI2/FAB2)是茉莉酸信号通路的正向调节因子拟南芥[70] - [74]:BA治疗后它们都上调。AIM1突变体具有严重无菌性的无菌性异常的花卉术语表型,以及敲除突变体AOS.基因为雄性不育拟南芥[70],[71,表明细胞分裂素促进茉莉酸的增加麻疯树花卉发展。然而,JMT.,它编码茉莉酸羧甲基转移酶,催化茉莉酸的甲基化[74],为正调控因子,在3 ~ 48 h下调,提示茉莉酸甲酯可能在茉莉酸甲酯的JA信号通路中发挥不同的作用麻疯树和拟南芥.此外,BENZOIC ACID CARBOXYL METHYLTRANSFERASE 1 (BSMT1)催化水杨酸信号通路中水杨酸和苯甲酸的甲基化,以响应生物和非生物胁迫[75].BSMT1在3 h时上调,表明水杨酸甲酯参与了对BA处理的响应。
基于以上结果,我们认为外源BA通过调节植物体内各代谢途径相关基因的表达水平来影响主要植物激素的作用麻疯树.这些植物激素可以共同规范发展麻疯树BA处理后的花,尽管它们在这一过程中的确切作用仍有待确定。阐明多种信号通路间的串扰机制也很重要。
结论
施用BA能显著提高水稻的花数和种子产量麻疯树.为了阐明这种反应的机制,我们进行了转录分析麻疯树BA处理后的花序芽。共鉴定出5555个差异表达的转录本,这些转录本可分为12个不同的调控模式簇,属于32个基因本体论类别。基于我们对开花相关基因和植物激素信号通路的分析,我们假设BA的施用通过激活开花启动基因的转录和抑制花器官形成相关基因的转录来增加花的数量。此外,外源细胞分裂素处理可以通过调节主要植物激素代谢途径相关基因的转录来影响它们的生产。BA处理抑制了内源细胞分裂素的合成和脱落酸的信号转导,促进了生长素、油菜素内酯、赤霉素、茉莉酸和水杨酸的信号转导,提示这些植物激素可能共同调控了油菜的发育麻疯树花。本研究为了解细胞分裂素处理对花期性状影响的分子机制奠定了基础麻疯树,为木本植物多种激素信号通路间的互传机制提供了有用的信息。
材料和方法
植物材料及处理
麻风树L.是中国云南省的一种栽培植物[76].一岁麻疯树中国科学院西双版纳热带植物园位于云南省勐腊县勐仑镇(北纬21°54′,东经101°46′,海拔580 m),以2 × 2 m /株的密度进行了野外试验。选择合适浓度的合成细胞分裂素6-苄基氨基嘌呤(BA)进行处理麻疯树选取180个花序芽(直径约0.5-1 cm),分成5个处理组,每个处理组36个花序芽。用手动喷雾器将不同浓度BA(0、0.5、1.0、2.0或4.0 mM)的工作溶液喷到花序芽上,湿润花序芽至径流点。在BA工作液中加入Tween-20 (polyorate -20, Shanghai Sangon Biological Engineering Technology & Services Co., Shanghai, China)作为润湿剂,最终浓度为0.05% (v/v)。调查了发育期的总花数、雌花数、雌雄花比、果实数、结果率、种子数、每花序种子产量、百粒重和种子含油量。
用于微阵列分析,花序芽用含有0.05%Tween-20的1.0 mM的BA溶液处理。花序芽在0,BA处理3,12,24,和48小时后收集。花序芽的收集的样品立即在液氮中冷冻并储存在-80℃直至RNA提取。三个生物学重复了每个时间点进行。实验是在2010年5月进行。
序列收集和探针设计
收集了41,735个遗传序列(附加文件4).其中,在本实验室对其cDNA文库进行测序,获得了30184条表达序列标签(ESTs)麻疯树花蕾及胚[77].其他序列来自NCBI(最多2010)。8,157个unigenes由来自不同的16,875个ests产生麻疯树组织[78],[79]和蓖麻花5619个est中3394个ungenes。为麻疯树使用Agilent eArray软件设计了41,651个60 bp寡核苷酸序列特异性探针(附加文件5).
RNA提取,杂交,微阵列数据采集,归一化和分析
使用Trizol(Invitrogen,Carlsbad,Ca,USA)从花序芽中提取总RNA。使用Nanodrop Nd-1000(Thermo Scientific,Waltham,Ma,USA)测定RNA浓度。RNA完整性被Agilent 2100 Bioanalyzer(Agilent,Santa Clara,CA,USA)确认,并用Qiagen Rneasy套件(荷兰venlo)纯化了总RNA。使用一步骤方法将两种微克RNA逆转录至cDNA。通过T7 RNA聚合酶转录到RNA中的CDNA,通过40℃的AA-UTP改性,用QIAGENRNEASY MINI试剂盒纯化并使用生物分析仪定量。在25℃下用Cy3荧光染料标记四微克CRNA,并用QIAGENRNEASY MIII试剂盒纯化。用4×44k阵列分离八百七十五纳克Cy3 CrNA和杂交。杂交后,根据制造商的指示洗涤阵列,并使用Agilent扫描仪扫描两次,其中10%和100%照片倍增管(PMT)。来自阵列的原始数据由日志标准化2使用genspring GX软件(安捷伦)进行转换和分析。变化倍数阈值≥2并校正的差异表达探针P-values≤0.05为选择值。使用Cluster软件进行层次聚类分析,使用Java TreeView软件查看结果[80],[81].
序列的组装和注释
差异表达探针对应的序列由CAP3 (Sequence Assembly Program)软件组装[82].差异表达的ungenes使用Interproscan(版本4.8)注释[83], GO注释结果由WEGO (Web Gene Ontology annotation Plot)绘制[84].
qRT-PCR验证基因表达
使用SYBR绿色荧光标记在Lighcycler 480 II(Roche,Penzberg,德国)上进行QRT-PCR。使用Primescript RT试剂盒(Takara,Otsu,Japan)从总RNA合成cDNA。基因的相对表达水平由2计算−ΔΔCT方法。所有定量pcr均重复2-3次生物学重复。用于qRT-PCR的引物列于附加文件6.
可获得的支持数据
寡核苷酸芯片数据已存入基因表达综合(GEO)数据库,登录号为GSE54366http://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE54366.支持本文结果的所有其他数据文件都在Labarchives存储库中可用,可访问http://dx.doi.org/10.6070/h4p848ww.
附加文件
参考文献
- 1。
不公平的D:生物燃料:一种小小的灌木,它可以——也许。自然科学学报。2007,449(7):652-655。10.1038 / 449652。
- 2。
Sato S, Hirakawa H, Isobe S, Fukai E, Watanabe A, Kato M, Kawashima K, Minami C, Muraki A, Nakazaki N:一棵油树基因组序列分析,麻风树中国生物医学工程学报,2011,31(1):1 - 8。10.1093 / dnares / dsq030。
- 3.
Sanderson K:奇迹杂草计划未蓬勃发展。自然。2009,461(7262):328-329。10.1038 / 461328A。
- 4.
Marques DDA, Siqueira WJ, Colombo CA, Ferrari RA:育种与生物技术麻风树.麻风树,新能源作物面临的挑战第2卷:遗传改良和生物技术。编辑:Bahadur B, Sujatha M, Carels N.纽约:施普林格;2013: 457 - 478。10.1007 / 978 - 1 - 4614 - 4915 - 7 - _23。
- 5.
作者简介:杨志强,男,博士,主要研究方向为遗传转化麻风树:现状和未来展望。麻风树,新能源作物面临的挑战第2卷:遗传改良和生物技术。编辑:Bahadur B, Sujatha M, Carels N.纽约:施普林格;2013: 535 - 546。10.1007 / 978 - 1 - 4614 - 4915 - 7 - _28。
- 6.
王志强,王志强,王志强。植物再生与遗传转化研究进展麻疯树.忽视和未充分利用的作物的生物技术。编辑:Jain SM,Dutta Gupta S.Netherlands:Springer;2013:319-342。10.1007 / 978-94-007-5500-0_13。
- 7.
Pan B-Z, Xu Z-F:苄胺处理显著提高了生物燃料植物的种子产量麻风树.植物生长规律学报,2011,30(2):166-174。10.1007 / s00344 - 010 - 9179 - 3。
- 8.
DNA分解产物6-糠胺嘌呤的形成。J是化学Soc。1955,77(23):6400 - 6400。10.1021 / ja01628a115。
- 9.
维尔纳·T,Schmulling T:在植物发育细胞分裂素行动。CurrOp植物BIOL。2009年,12(5):527-538。10.1016 / j.pbi.2009.07.002。
- 10。
Perilli S,Moubayidin L,Sabatini S:细胞蛋白功能的分子基础。CurrOp植物BIOL。2009,13(1):21-26。10.1016 / J.PBI.2009.09.018。
- 11.
D’aloia M, Bonhomme D, Bouche F, Tamseddak K, Ormenese S, Torti S, Coupland G, Perilleux C:细胞分裂素促进开花拟南芥通过转录激活FT级级蛋白酶TSF。工厂J.2011,65(6):972-979。10.1111 / J.1365-313x.2011.04482.x。
- 12.
细胞分裂素对茎和根分生组织功能的控制。植物生态学报。2007,10(5):442-446。10.1016 / j.pbi.2007.08.010。
- 13。
刘志强,刘志强,刘志强,等。植物茎尖分生组织的细胞参数及其与茎尖分生组织的关系拟南芥.植物学报,1998,10(8):1375-1390。10.1105 / tpc.10.8.1375。
- 14。
3个拟南芥AIL/PLT基因联合作用调节茎尖分生组织功能植物学报,2012,71(1):108-121。10.1111 / j.1365 - 313 x.2012.04975.x。
- 15。
陈志强,陈志强,陈志强:水稻茎尖分生组织的形成拟南芥:在野生型和拍摄meristemless突变体的发展的分析。发展。1993年,119(3):823-831。
- 16.
Endrizzi K,Moussian B,Haecker A,Levin JZ,Laux T:拍摄不分化细胞需要拍摄不分化的细胞所必需的拟南芥拍摄和花卉公司的行为和行为不同的监管水平,而不是Metistem Genes Wuschel和Zwille。工厂J.996,10(6):967-979。10.1046 / J.1365-313x.1996.10060967.x。
- 17.
Long JA, Moan EI, Medford JI, Barton MK:一个由STM基因编码的KNOTTED类同源结构域蛋白的成员拟南芥.自然。1996年,379(6560):66-69。10.1038 / 379066a0。
- 18.
Mayer Kfx,Schoof H,Haecker A,Lenhard M,Jurgens G,Laux T:Wuschel在调节干细胞命运中的作用拟南芥分生组织。细胞。1998,95(6):805-815。10.1016 / s0092 - 8674(00) 81703 - 1。
- 19.
克拉克SE,运行MP,迈耶罗维茨EM:CLAVATA1,分生组织的调节和花卉发展拟南芥.发展。1993,119(2):397-418。
- 20.
卡耶JM,克拉克SE:CLAVATA2,分生组织的调节和器官发育拟南芥.发展。1998,125(19):3843-3851。
- 21.
CLAVATA3是一种特殊的茎和花分生组织发育调节剂,与CLAVATA1影响相同的过程。发展。1995,121(7):2057-2067。
- 22.
Kurakawa T, Ueda N, Maekawa M, Kobayashi K, Kojima M, Nagato Y, Sakakibara H, Kyozuka J:通过细胞分裂素激活酶直接控制茎分生组织活性。自然科学学报。2007,445(7):652-655。10.1038 / nature05504。
- 23.
Yanai O, Shani E, Dolezal K, Tarkowski P, Sablowski R, Sandberg G, Samach A, Ori N:拟南芥KNOXI蛋白激活细胞分裂素的生物合成。中国生物医学工程学报,2005,15(17):1566-1571。10.1016 / j.cub.2005.07.060。
- 24.
到JPC,Haberer G,费雷拉FJ,DeruereĴ,梅森MG,沙勒GE,阿隆索JM,埃克JR,基贝尔JJ:A型拟南芥反应调节因子是细胞分裂素信号转导的部分冗余负调节因子。植物学报,2004,16(3):658-671。10.1105 / tpc.018978。
- 25.
wu: WUSCHEL通过直接调控细胞分裂素诱导的反应调节因子来调控分生组织功能。自然科学学报。2005,438(7):1172-1175。10.1038 / nature04270。
- 26.
通过细胞分裂素信号的多重反馈回路控制干细胞数量拟南芥分生组织。美国国家科学院学报。acta photonica sinica, 2009, 38(3): 372 - 372。10.1073 / pnas.0908122106。
- 27.
Sakakibara H:细胞分裂素:活性、生物合成和转运。植物学报,2006,57:431-449。10.1146 / annurev.arplant.57.032905.105231。
- 28.
Bartrina I, Otto E, Strnad M, Werner T, Schmulling T:细胞分裂素调节生殖分生组织的活动,花器官的大小,胚珠的形成,从而影响种子产量拟南芥.植物学报,2011,23(1):69-80。10.1105 / tpc.110.079079。
- 29.
Ashikari M, Sakakibara H, Lin S, Yamamoto T, Takashi T, Nishimura A, Angeles ER, Qian Q, Kitano H, Matsuoka M:细胞分裂素氧化酶调节水稻产量。中国科学:地球科学。2005,32(6):741-745。10.1126 / science.1113373。
- 30.
花的唤起和形态发生的控制。植物生理学报,1998,39(1):175-219。10.1146 / annurev.pp.39.060188.001135。
- 31.
Estruch JJ, Granell A, Hansen G, Prinsen E, Redig P, Onckelen H, Schwarz-Sommer Z, Sommer H, Spena A:花发育和花同源基因表达受细胞分裂素的影响。植物学报,1993,4(2):379-384。10.1046 / j.1365 - 313 x.1993.04020379.x。
- 32。
Chaudhury AM, Letham S, Craig S, Dennis ES:amp1-具有高细胞分裂素水平和改变胚胎模式的突变体,更快的营养生长,结构性光形态发生和早熟开花。植物学报,1993,4(6):907-916。10.1046 / j.1365 - 313 x.1993.04060907.x。
- 33。
何元文,Loh CS:三康醇、铈和镧诱导拟南芥早抽薹与内源异戊烯腺苷(iPAdos)浓度增加有关。中国生物医学工程学报,2002,21(4):427 - 434。10.1093 / jexbot / 53.368.505。
- 34。
Corbesier L, Prinsen E, Jacqmard A, Lejeune P, Van Onckelen H, Périlleux C, Bernier G:拟南芥花转化过程中叶片、叶片分泌物和茎尖分生组织的细胞分裂素水平。中国生物医学工程学报,2003,21(3):427 - 434。10.1093 / jxb / erg276。
- 35。
研究发现:一种调控水稻光周期开花的昼夜节律控制基因拟南芥并编码了一种具有几个可能的跨膜结构域的蛋白质。中国海洋大学学报(自然科学版),1999,18(17):4679-4688。10.1093 / emboj / 18.17.4679。
- 36。
Park DH,Somers de,Kim Ys,Choy Yh,Lim HK,Soh Ms,Kim HJ,Kay Sa,Nam Hg:控制昼夜节律和光周期开花拟南芥GIGANTEA基因。中国科学:地球科学,2019,36(4):531 - 534。10.1126 / science.285.5433.1579。
- 37。
K-i H, Takada S, Tasaka M: CUC1基因激活sam相关基因的表达,诱导不定芽形成。植物学报,2003,36(5):687-696。10.1046 / j.1365 - 313 x.2003.01911.x。
- 38。
艾达男,石田T,Fukaki H,藤泽H,田坂L:在参与器官分离基因拟南芥:杯状子叶突变体分析。acta botanica sinica, 2017, 36(6): 841-857。10.1105 / tpc.9.6.841。
- 39。
Li X, Su Y, Zhao X, Li W, Gao X, Zhang X .: CUC2和CUC3部分介导了CUC2和CUC3对水稻花发育的影响拟南芥.基因。2010,450(1-2):109-120。10.1016 / J.GENE.2009.11.003。
- 40.
Pelaz S, Ditta GS, Baumann E, Wisman E, Yanofsky MF: B和C花器官识别功能需要SEPALLATA MADS-box基因。自然科学。2000,405(6783):200-203。10.1038 / 35012103。
- 41.
Bowman JL,Smyth Dr,Meyerowitz em:引导花卉发展的基因拟南芥.acta botanica sinica, 2017, 36(1): 1 -5。10.1105 / tpc.1.1.37。
- 42.
韩艳,张超,杨华,焦艳:细胞分裂素途径介导的APETALA1在植物分生组织建立中的作用拟南芥.美国国家科学院学报。2014年,111(18):6840-6845。10.1073 / pnas.1318532111。
- 43.
DeLong A, Calderon-Urrea A, delaporta SL:玉米性别决定基因TASSELSEED2编码一个短链乙醇脱氢酶,该酶在特定时期的花器官流产中必需。细胞。1993,74(4):757-768。10.1016 / 0092 - 8674 (93) 90522 - r。
- 44.
王志强,王志强:番木瓜的性别决定机制。植物科学学报,2014,46(6):762 - 762。10.1016 / j.plantsci.2013.10.018。
- 45.
作者简介:王志刚,男,博士,博士,主要研究油菜素内酯对玉米性别的控制作用。美国国家科学院学报。2011, 108(49): 19814-19819。10.1073 / pnas.1108359108。
- 46.
Bhargava, Clabaugh I, To JP, Maxwell BB, Chiang Y-H, Schaller GE, Loraine A, Kieber JJ:利用微阵列meta分析和RNA-Seq鉴定拟南芥细胞分裂素响应基因。植物营养与肥料学报。2013,32(1):1 - 8。10.1104 / pp.113.217026。
- 47.
黄志强,王志强,王志强,等。植物生长发育的激素调控与适应性研究。遗传学报。2009,10(5):305-317。10.1038 / nrg2558。
- 48.
彭泽,周X,李立立力,俞XC,李海,江泽民,曹格,白的,王XC,江CF,鲁赫,侯Xh,曲lj,王泽,佐,富xd,su z,Li SG, Guo HW: Arabidopsis Hormone Database: a comprehensive genetic and phenotypic information database for plant hormone research in Arabidopsis. Nucleic Acids Res. 2009, 37: D975-D982. 10.1093/nar/gkn873.
- 49.
Vaquerizas JM, Kummerfeld SK, Teichmann SA, Luscombe NM:一项人类转录因子的调查:功能,表达和进化。中国科学(d辑),2009,30(4):531 - 534。10.1038 / nrg2538。
- 50.
沈永勇,王小芳,吴福强,杜绍勇,曹铮,尚勇,王小龙,彭春春,于小春,朱淑艳:mg -螯合酶H亚基是脱落酸受体。自然科学。2006,443(7113):823-826。10.1038 / nature05176。
- 51.
Nishimura N, Sarkeshik A, Nito K, Park S- y, Wang A, Carvalho PC, Lee S, cadell DF, Cutler SR, Chory J: PYR/PYL/RCAR家族成员是体内主要的ABI1蛋白磷酸酶2c相互作用蛋白拟南芥.工厂J.2010,61(2):290-299。10.1111 / J.1365-313x.2009.04054.x。
- 52.
Barrero JM, Piqueras P, González-Guzmán M, Serrano R, Rodríguez PL, Ponce MR, Micol JL: ABA1基因的突变分析拟南芥表明ABA参与营养发育。中国生物医学工程学报,2012,31(4):531 - 534。10.1093 / jxb / eri206。
- 53.
埃斯特韦斯JM,坎特罗A,REINDL A,Reichler S,莱昂,P:1-脱氧d木酮糖-5-磷酸合酶,用于在植物中质体异戊二烯生物合成限制性酶。J Biol Chem。2001年,276(25):22901-22909。10.1074 / jbc.M100854200。
- 54.
Iuchi S, Kobayashi M, Taji T, Naramoto M, Seki M, Kato T, Tabata S, Kakubari Y, Yamaguchi-Shinozaki K, Shinozaki K: 9-顺式环氧类胡萝卜素双加氧酶(9-顺式环氧类胡萝卜素双加氧酶)基因调控水稻抗旱性的研究拟南芥.植物学报,2001,27(4):325-333。10.1046 / j.1365 - 313 x.2001.01096.x。
- 55.
Tatematsu K, Kumagai S, Muto H, Sato A, Watahiki MK, Harper RM, Liscum E, Yamamoto KT:MASSUGU2Aux/IAA19是一种生长素调节蛋白,与转录激活因子NPH4/ARF7共同作用,调节下胚轴的不同生长反应和侧根的形成拟南芥.植物学报。2004,16(2):379-393。10.1105 / tpc.018630。
- 56。
秦光军,顾海云,赵永东,马志强,史光良,杨勇,Pichersky E,陈洪涛,刘明辉,陈志林,曲丽娟:吲哚-3-乙酸羧基甲基转移酶的调控拟南芥叶的发展。植物学报,2005,17(10):2693-2704。10.1105 / tpc.105.034959。
- 57。
Mikkelsen MD, Naur P, Halkier BA:拟南芥葡萄糖苷生物合成的C-S裂解酶中的突变体对砧鞘稳态吲哚-3-乙醛肟的关键作用。工厂J. 2004,37(5):770-777。10.1111 / J.1365-313x.2004.02002.x。
- 58。
Brown De,Rashotte Am,Murphy As,Normanly J,Tague BW,Peer Wa,Taiz L,Muday GK:FlavOnoids作为体内养阴运输的负调节器拟南芥.植物营养与肥料学报。2001,22(2):524-535。10.1104 / pp.126.2.524。
- 59。
琼斯B,Gunneras SA,皮特森SV,塔可夫斯基P,格雷厄姆N,五月S,Dolezal K,Sandberg的G,Ljung的K:在生长素合成的细胞分裂素调节拟南芥包括一个由生长素和细胞分裂素信号转导调节的稳态反馈回路。植物学报。2010,22(9):2956-2969。10.1105 / tpc.110.074856。
- 60.
Shin R, Burch AY, Huppert KA, Tiwari SB, Murphy AS, Guilfoyle TJ, Schachtman DP: The拟南芥转录因子MYB77调控生长素信号转导。植物学报。2007,19(8):2440-2453。10.1105 / tpc.107.050963。
- 61.
Poppenberger B, Fujioka S, Soeno K, George GL, Vaistij FE, Hiranuma S, Seto H, Takatsuto S, Adam G, Yoshida S, Bowles D: UGT73C5的拟南芥glucosylates brassinosteroids。美国国家科学院学报。[j] .环境科学学报,2003,22(4):453 - 457。10.1073 / pnas.0504279102。
- 62.
Szekeres M, Németh K, Koncz-Kálmán Z, Mathur J, Kauschmann A, Altmann T, Rédei GP, Nagy F, Schell J, Koncz C: Brassinosteroids挽救CYP90(一种细胞色素P450)的缺陷,控制细胞的伸长和去黄化拟南芥.细胞。1996年,85(2):171-182。10.1016 / S0092-8674(00)81094-6。
- 63.
Domagalska MA, Schomburg FM, Amasino RM, Vierstra RD, Nagy F, Davis SJ:油菜素内酯信号的减弱增强FLC的表达并延迟开花。发展。2007,134(15):2841-2850。10.1242 / dev.02866。
- 64.
梁洪涛,张晓东,张晓东,等:转录共激活因子多蛋白桥接因子1c基因表达对环境胁迫的耐受性增强。植物营养与肥料学报。2005,29(3):429 - 434。10.1104 / pp.105.070110。
- 65.
Gigolashvili T, Berger B, Mock H-P, Müller C, Weisshaar B, Flügge U-I:转录因子HIG1/MYB51调节吲哚硫代葡萄糖苷的生物合成拟南芥.植物学报,2007,50(5):886-901。10.1111 / j.1365 - 313 x.2007.03099.x。
- 66.
粘土NK,阿迪奥AM,Denoux C,JANDER G,奥苏贝尔FM:用于所需芥子油苷的代谢物拟南芥先天免疫反应。中国科学:地球科学。10.1126 / science.1164627。
- 67.
张志玲,张志玲,张志玲,孙涛,张志玲:赤霉素GID1受体的基因表达及功能分析拟南芥.植物细胞。2006,18(12):3399-3414。10.1105 / TPC.106.047415。
- 68.
陈志强,陈志强,陈志强,等:赤霉素20氧化酶的克隆与表达。美国国家科学院学报。中国科学(d辑),1994,91(18):8552-8556。10.1073 / pnas.91.18.8552。
- 69.
托马斯SG,菲利普斯AL,海顿,P:分子克隆和赤霉素2-氧化酶的功能性表达,参与赤霉素失活多功能酶。美国国家科学院学报。1999年,96(8):4698-4703。10.1073 / pnas.96.8.4698。
- 70.
Richmond TA, Bleecker AB: β氧化缺陷导致拟南芥花序发育异常。植物学报,1999,11(10):1911-1923。
- 71.
J-h P, Halitschke R, Kim HB, Baldwin IT, Feldmann KA, Feyereisen R:氧化丙烯合成酶的敲除突变导致雄性不育和损伤信号转导缺陷拟南芥由于茉莉酸生物合成块。工厂J.2002,31(1):1-12。10.1046 / J.1365-313x.2002.01328.x。
- 72.
Stintzi一:拟南芥雄性不育突变体opr3缺乏茉莉酸合成所需的12-氧植物二烯酸还原酶。美国国家科学院学报。[j] .地球科学进展,2019,30(4):457 - 461。10.1073 / pnas.190264497。
- 73.
Kachroo P, Venugopal SC, Navarre DA, Lapchyk L, Kachroo A:水杨酸和脂肪酸去饱和通路在ssi2介导的信号通路中的作用。植物营养与肥料学报。2005,29(4):427 - 434。10.1104 / pp.105.071662。
- 74.
SEO HS,Song JT,Cheong J-J,Lee Y-H,Lee Y-W,Hwang I,Lee JS,Do Choi Y:茉莉酸羧基甲基转移酶:jasmonate监管植物反应的关键酶。美国国家科学院学报。2001,98(8):4788-4793。10.1073 / pnas.081557298。
- 75.
Chen F, D’auria JC, Tholl D, Ross JR, Gershenzon J, Noel JP, Pichersky E: An拟南芥通过生物化学基因组学方法鉴定的水杨酸甲酯生物合成基因具有防御作用。植物学报,2003,36(5):577-588。10.1046 / j.1365 - 313 x.2003.01902.x。
- 76.
钟自强:麻风树这是一个很有前途的生物燃料工厂。热带植物研究,1984,25:62-65。
- 77.
陈明生,王国军,王瑞林,王静,宋世强,徐志峰:生物柴油植物表达序列标记分析麻风树不同发育阶段的胚胎。植物学报,2011,181(6):696-700。10.1016 / j.plantsci.2011.08.003。
- 78.
Costa GGL, Cardoso KC, Del Bem LEV, Lima AC, Cunha MAS, De campose - leite L, Vicentini R, Papes F, Moreira RC, Yunes JA:生物能源作物富含油脂种子的转录组分析麻风树李志刚,李志刚,李志刚,等。基于遗传算法的生物信息学研究进展[j] .生物医学工程学报,2010,32(1):1- 8。
- 79.
Gomes KA, Almeida TC, Gesteira AS, Lôbo IP, Guimarães ACR, Miranda AB, Sluys MAV, Cruz RS: Cascardo JCM。Carels N:从种子中提取est,以辅助麻疯树对油脂和活性化合物的选择育种。基因组学进展。2010,3(1):29-56。
- 80.
De Hoon MJ, Imoto S, Nolan J, Miyano S:开源集群软件。生物信息学。2004,20(9):1453-1454。10.1093 /生物信息学/ bth078。
- 81.
Java Treeview——微阵列数据的可扩展可视化。生物信息学。2004,20(17):3246-3248。10.1093 /生物信息学/ bth349。
- 82.
黄旭,马丹A: CAP3: DNA序列组装程序。中国生物医学工程学报,2019,39(9):1043 - 1046。10.1101 / gr.9.9.868。
- 83.
Zdobnov EM, Apweiler R: interproscan - InterPro签名识别方法的集成平台。生物信息学。2001,17(9):847-848。10.1093 /生物信息学/ 17.9.847。
- 84.
叶军,方L,郑H,张Y,陈军,张Z,王静,李S,李R,Bolund L:WEGO:用于绘制GO注释的网络工具。核酸RES。2006年,34:W293-W297。10.1093 / NAR / gkl031。
致谢
云南省科技拔尖人才计划项目(no . 2009CI123);云南省自然科学基金项目(no . 2011FA034);国家自然科学基金项目(no . 31370595); Z.-F. csc135项目(no . xtg - t02)。徐。计算工作在中国科学院昆明植物研究所高性能计算中心完成。作者感谢西双版纳热带植物园中心实验室提供的研究设施。
作者信息
从属关系
通讯作者
额外的信息
利益争夺
两位作者宣称他们没有相互竞争的利益。
作者的贡献
实验由MSC、BZP和ZFX设计。MSC、GJW、JN和LN进行BA处理和样品采集。MSC和ZFX对数据进行了分析并起草了手稿。所有作者阅读并批准了最终的手稿。
电子辅料
12870 _2014_318_moesm1_esm.zip
附加文件1:10,569代表使用微阵列分析鉴定的5,555个差异表达转录物的探针。(拉链6 MB)
主要植物激素相关转录本的表达分析
额外的文件3:j . curcas。(XLS 115 KB)
寡核苷酸引物用于qRT-PCR验证从微阵列中选择的转录本和表达分析
额外的文件6:LFY,SOC1和TFL1b。(XLS 18 KB)
作者为图像提交的原始文件
下面是作者提交的原始图片文件的链接。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。
本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。
如欲查阅本许可证副本,请浏览https://creativecommons.org/licenses/by/4.0/.
Creative Commons公共领域奉献豁免(https://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
陈女士,潘女士,BZ。王,GJ。et al。百合花序芽转录反应分析麻风树暴露于细胞分裂素处理。BMC植物杂志14,318(2014)。https://doi.org/10.1186/s12870-014-0318-z
已收到:
接受:
发表:
关键字
- 细胞分裂素
- 开花
- 物理螺母
- 植物激素
- 木本植物
- 微阵列