摘要
背景
诱导对抗病原体的地下植物防御可能对低于地下微生物共生产生负面影响。虽然有相当数量的研究已经利用化学素质化学品实验诱导这种防御,但令人惊讶的是,实际的地上病原体影响根关联的微生物。我们在此报道,普通豆的地上真菌病原体(菜豆)诱导了一种防御反应,抑制根瘤菌在地下形成根瘤和丛枝菌根真菌(AMF)的定植。
结果
接种根瘤菌或AMF的植物叶片用两种活菌处理刺盘孢属、炭疽-一种多面手的半营养植物病原菌及其生物学特性C球孢子碎片。在病原体处理后,测得多酚氧化酶(PPO),几丁质酶,叶片,根部,以及根瘤菌结节的数量以及AMF定子的程度。活病原体和病原体片段都显着增加了叶片中的PPO,逐碱酶和β-1,3-葡聚糖酶活性,但根部只有PPO活性增加。与对照相比,治疗厂的根瘤菌结节数和AMF定植程度显着降低。
结论
我们证明了地上真菌病原体可以影响地下两种不同类型的微生物共生体-根瘤菌和AMF的共生关系。我们的结果表明,系统诱导的PPO活性在功能上参与了这种地上-地下相互作用。我们预测,我们在这里展示的自上而下的影响可以极大地影响植物在营养和水分有限的土壤中的表现;非生物胁迫条件通常由地下的微生物共同缓解。
背景
在自然环境中,植物同时与多种地上和地下生物相互作用[1].虽然这些相互作用对植物是有益的,但同时,植物不得不面对包括病原微生物和食草动物在内的各种拮抗物的攻击。来自多种病原体或食草动物的同时攻击常常导致植物依赖多种防御机制[2]. 其中许多植物防御是可诱导的,也就是说,防御特性只有在植物拮抗剂的初始攻击后才能表达,这就是诱导抗性(IR)[1].植物中常用的两种IR途径是茉莉酸/乙烯依赖诱导的系统抗性(ISR)和水杨酸依赖的系统获得抗性(SAR) [3.]. ISR途径在坏死性病原体的损伤后被诱导[4.]而SAR途径被用来对抗生物营养性病原体[5.]. 虽然利用这些途径对不同的拮抗剂作出反应通常是正确的,但在自然界中发现的例外情况是,在植物寄主中,嗜蜜病原体引起SAR反应[4.]、[5.]. 然而,ISR和SAR途径的优势在于它们在生物胁迫下的兼性表达模式,从而在不需要防御特性的情况下最小化植物的生产成本[6.].
然而,IR可能代价高昂[7.]. 除了诱导主动抗性机制外,SAR的诱导还可导致植物生产力和适应性的降低,这是植物从生长和繁殖到防御的分配途径转变的结果[8.]. 与这种从生长到防御的转变相关的另一个常见现象是光合作用的减少[9.] - [12]. 总的来说,有大量的证据表明叶片抗性表达的负面影响可能是由于同化物的生产减少或重新分配造成的[13].
除了由于资源分配约束而产生成本外,防御性状可能会对互动植物共生产生负面影响,从而导致生态成本[14]. 当考虑到与植物相关的微生物时,一些真菌和细菌包括破坏性的植物拮抗剂,而其他物种则代表了几乎所有陆地生态系统中的关键植物共生者[15]、[16].因此,植物必须面对地上表达对病原体的有效抗性的冲突,同时保持与地下的互动微生物的共生。鉴于许多抗病原体防御的广泛且相对不明的特征,对共生微生物的负反馈效应似乎很可能。事实上,通过利用化学诱导水杨酸产生的阿基苯甲脲-S-甲基(ASM),若干研究报告了IR对微生物植物共生主义的负面影响。3.]、[17].最初销售以帮助控制小麦和大麦的粉状霉菌,ASM增加了病因相关蛋白质(PR)的表达 - 抑制几丁酶,过氧化物酶和β-1-3-葡聚糖酶[3.]. 这些蛋白质可以抵抗未来与病毒、细菌和真菌的广泛生物相互作用[18].然而,在含有几种豆科型物质中示出了在化学诱导后对根结节形成的抑制。例如,已显示ASM作为种子浸泡或叶面喷雾到大豆的喷雾剂导致结节数减少Bridyrhizobium japonicum[3.]. 此外,直接施用水杨酸(SA)而不是ASM已证明地下根瘤菌的定殖率降低,豆血红蛋白含量降低,固氮酶活性降低[19] - [21]. 就与AMF的互动而言,情况并不那么明朗[3.]、[22] - [24,然而,总体上类似的影响似乎是可能的[17].研究表明,通过对叶片进行叶面喷施ASM或对根部进行土壤灌水,红外的化学诱导可以降低AMF定植的频率和程度[3.]、[17]、[22] - [24].因此,就与根瘤菌或AMF等互相植物的植物关联而言,ISR和SAR途径可以通过生产对植物拮抗剂的防御性化合物产生健康成本,这些化合物对地下互相反感者具有有害影响[3.]、[19] - [21].
令人惊讶的是,没有研究表明活的天然地上真菌病原体对地下根瘤菌和AMF植物共生菌的影响。从人工诱导子转移到生物实验系统对理解自然界中这种观察的相关性至关重要。根瘤菌和AMF在几乎所有陆地生态系统中都是关键物种,可以通过级联效应改变植物的防御表型[25] - [27]. 鉴于真菌性植物病原菌的普遍存在,人们对这方面的知识非常缺乏。为了填补这一空白,我们利用天然植物病原菌根瘤菌AMF系统揭示了地上病原菌对植物防御性状和两类地下共生体的影响。具体来说,在我们的实验中,我们处理普通的豆类植物(菜豆)与叶面病原体(刺盘孢属、炭疽).过多的真菌,刺盘孢属、炭疽,是兼性多面手半营养植物病原。植物组织的感染是通过伤口或气孔以及穿透完整的植物表面发生的[28]、[29].在这个阶段,真菌生活生物营养和发展原发性感染菌丝[30.]、[31.].当宿主组织在感染过程中被破坏时,真菌在几天后发育次要病症菌丝并产生新的孢子。自从刺盘孢属、炭疽最初作为生物营养体存在,后来作为坏死营养体存在,在感染过程中可能诱导不同的植物防御机制。真菌的初始生物营养性感染应导致水杨酸的上调,水杨酸具有系统获得性抗性(SAR)和相关PR蛋白的特征,例如几丁质酶和β-1,3-葡聚糖酶。然而,在植物组织内坏死营养菌丝发育后,茉莉酸/乙烯依赖诱导的系统抗性(ISR)途径及其相关的PR蛋白(如多酚氧化酶(PPO))的表达应增加[4.]、[5.]、[32.]、[33.].为了应对C球孢子处理后,我们测定了PPO、几丁质酶和β-1,3-葡聚糖酶的活性,它们是参与植物对病原体攻击反应的关键PR蛋白[18]、[34.],并对接种病原菌的植物中根瘤菌和AMF同时在地下定殖进行了定量研究。为了理清真菌病变形成导致的光合面积减少与PPO活性增强的影响,我们还在一定浓度下应用了真菌细胞碎片(不是导致病变,而是诱导PPO活性),并测量了真菌细胞碎片对AMF和根瘤菌定植的影响。据我们所知,我们的研究首次从功能上解决了地上病原菌对地下微生物共生体的影响。
结果
根瘤菌和AMF定殖试验初报
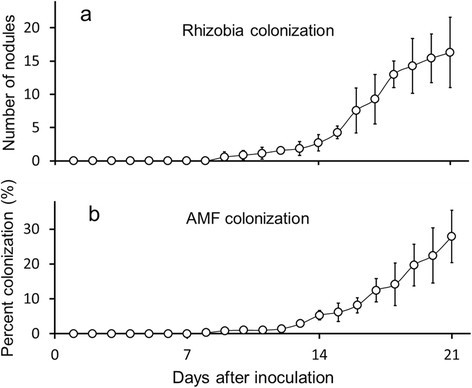
用于根瘤菌和AMF定殖率初步评估的植物(图1,附加文件1)以及用于接种和病原体处理实验的实验植物(包括对照植物)(图2那3.那4.和5.额外的文件2那3.那4.和5.)属于不同的植物。由于后勤原因,在病原体治疗中使用的植物组前一个月培养了用于初步定植观察的植物。在初步定植试验中,在接种后,在接种后9天开始发育9天(每株植物的平均数量为16.3天(每天破坏性收获); 147个)(图1a) 是的。菌根真菌(AMF)定殖的显微定量显示,AMF结构在第9天也出现了。AMF在第21天的平均定殖率为27.9%(n=7株/天);147(总计)(图1b) 是的。
PPO行为剩下
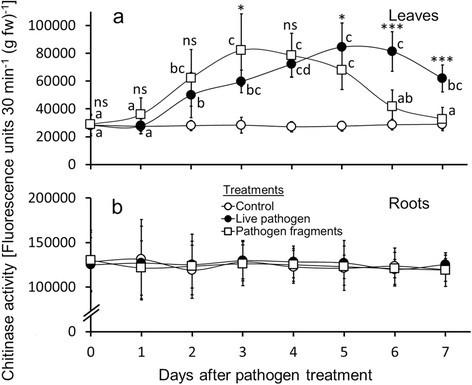
在多酚氧化酶(PPO)[μmolo的活性中,观察到随时间的显着变化。2H−1.(g弗兰克-威廉姆斯)−1.]在植物叶片中诱导的两个活的C球孢子(F7,64 = 54.533;P.<0.001)和C球孢子碎片(F7,64 = 30.253;P.<0.001)(n=每天分析9株植物;63)(图2a、 附加文件3.). 在整个试验过程中,用水而不是孢子悬浮液或真菌碎片处理的对照植物的PPO活性表现出很低且非常相似的PPO活性(F7,64 = 0.232;P.=0.976). 在接种活菌的叶片中,PPO活性在两天后显著增加,在第三天进一步显著增加。酶活性在第五天开始下降,在整个实验过程中进一步下降。接种病原菌片段的叶片比接种活菌的叶片PPO活性增加更快。PPO活性在第一天显著增强,在这个峰值之后随着实验时间的推移而降低。与活动峰值相比,我们观察到第四天的活动显著减少,第七天的活动进一步显著减少。因此,与真菌片段处理相比,接种活病原菌后叶片中PPO活性的增加被延迟,但PPO活性在很长一段时间内保持在高于真菌片段水平的水平,直到实验结束。在第1天和第2天比较两种处理(活病原菌与真菌片段)时,真菌片段诱导的叶片显示出显著高于活病原菌接种的叶片的PPO活性(图3)2一种)。虽然在第三天,在治疗之间测量了PPO活性的显着差异,但我们观察到在第四天,五个,六和七天接种活病原体的叶片中的酶活性显着更高。
PPO活性根
根中PPOs活性随病原菌处理的不同而有显著差异(F7,64 = 54.323;P.<0.001)和真菌碎片(F7,64 = 35.567;P.< 0.001)。根系中PPO表达的模式与叶片相似,植物较慢但接种于活病原体悬浮液的植物的较慢,与用真菌碎片治疗的植物中的七个近日七分之一(n = 9)每天分析的植物;总计63。与对照相比,PPO活性的增加在第四天(活病原体)和三次(真菌片段)中变得显着,分别在第五和四天进一步增加。对于用真菌碎片诱导的植物,我们观察到第六天的显着降低,并与第四天的活动峰值相比进一步减少。用真菌片段接种的叶子表现出适度,非显着降低PPO活性,直到七天的实验结束。通常,与叶片相比,根系中PPO活性的诱导表现出与叶片相比的特征时间滞后,因为在用活病原体和施用病原体片段后四天达到最大活性,并且在施用病原体碎片(图2b,附加文件4.). 根中PPO活性最高值仅略低于叶。
叶片几丁质酶活性
与生活接种叶子C球孢子(F7,64 = 31.162;P.<0.001)和真菌碎片(F7,64 = 17.035;P.<0.001)对叶片几丁质酶活性均有显著影响p .寻常的(数字3.a、 附加文件3.). 对照植株叶片几丁质酶水平在整个试验期间没有增加。在活病原菌处理中,PPO活性在第二天开始显著高于对照组。我们观察到在第三天和第四天进一步增加,第五天达到最高水平。试验结束7天后,这些接种叶片的PPO活性保持在对照植株的两倍以上。与活菌处理相比,真菌片段诱导的叶片PPO活性迅速上升,在第3天达到峰值,在试验结束时下降到基线水平。在片段诱导叶片中,PPO活性在第2天显著增加,第6天显著下降。
几丁质酶activity-roots
与…对比p .寻常的叶片,根逐蛋白酶活性显示出对叶面接种的叶状胰岛素活性没有显着变化,与病原体或与病原体片段的叶子治疗(图3.b,附加文件4.).
β1,3-glucanase行为剩下
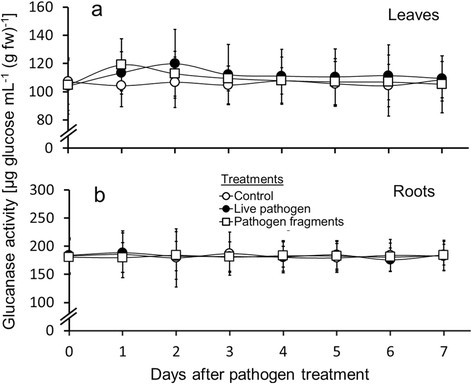
用活菌和碎片的真菌治疗叶片在两天的叶片中增加β-1,3-葡聚糖酶活性,在病原体和病原体片段的情况下为活病病原体和第一天。然而,β-1,3-葡聚糖酶活性的变化不显着(图4.a、 附加文件3.).虽然不显著,但β-1,3-葡聚糖酶活性的总体变化规律与其他病原菌诱导的酶活性(PPO和几丁质酶)相一致,与用活真菌接种实验相比,片段的增加速度更快,但时间更短。
β1,3-glucanase activity-roots
以类似的方式与叶β-1,3-葡聚糖酶活性,在根系中的病原体处理和对照植物之间没有显着差异(N = 9植物每天分析;总计63个)(图4.b,附加文件4.).然而,在整个实验中,根β-1,3-葡聚糖酶活性比病原体治疗和对照组的叶β-1,3-葡聚糖酶活性高50%。
用活病原体接种植物的促核,并用真菌碎片治疗
活病毒和病原体片段均导致治疗后第14天和第21天和21天的根瘤菌结节数量显着降低(N = 9株每天评估的植物; 18总计)与对照植物相比(图5.a、 附加文件5.). 与对照相比,在第14天,活病原菌和病原菌片段处理的根瘤数量分别显著减少86%和80%(F2,24 = 34.343,P.<0.001),而活病原和病原片段处理的根瘤数量在第21天分别比对照植物减少77%和75%(F2,24 = 47.286,P.< 0.001)。为了测试前期实验中定殖数据的可移植性(图1a)到病原体治疗植物(图5.A),我们比较了两组对照植株在第14天和第21天的根瘤菌定植情况。我们观察到两组植物之间的根瘤菌定殖没有显著差异(第14天:t检验,P.= 0.638;21天:t检验,P.=0.948).
接种活病原菌并用真菌碎片处理的植物中AMF的定殖
在第14天和第21天,与对照相比,活的病原菌和病原菌片段使AMF定殖的根系比例显著降低(n = 每天评估9株植物;18(总计)(图5.b,附加文件5.). 与对照组相比,在第14天,用活病原菌和病原菌片段处理可使AMF定殖的根系比例分别减少79%和76%(F2,24 = 25.506,P.< 0.001)。与活病原体和病原体片段治疗的对照植物相比,在第21天,在第21天,在第21天的根系中占菌根的根百分比减少了84%和79%。F2,24 = 73.656,P.< 0.001)。为了测试前期实验中定殖数据的可移植性(图1b)到病原体治疗植物(图5.b) ,我们比较了两组对照植物在第14天和第21天的AMF定殖率。在AMF建立的初始筛选中,AMF定殖率与用于病原体处理的植物相比没有显著差异(第14天:t检验,P.=0.744; 第21天:t检验,P.=0.693).
用活病原菌接种和真菌碎片处理的植物,研究地下根瘤菌和AMF定殖的附加试验
在另一个及时的独立实验中,重新检查了地下定植率,活病原体和病原体碎片在治疗后第14天和第21天都导致结节显著减少(n = 每天评估9株植物;与对照植物相比[见附加文件2和5.].与对照植物相比,活病原体和病原体片段在第14和21天(N = 9株植物每天评估的植物18),也导致在第14天和第21天在第14天和第21天沉积的根百分比显着降低。这些结果与初始检查下降的根瘤菌和AMF的初始殖民率的模式非常相似。
酶活性与地下定殖的关系
PPO活性在根系中存在的负相关性和具有根瘤菌的地下殖民的率(R = -0.893,P.<0.001)和AMF(r = -0.895,P.<0.001)(Pearson的双尾相关性)(表1).然而,几丁质酶活性和根瘤菌殖民化之间没有显着的相关性(R = 0.016,P.= 0.939)或几丁质酶活性和amf殖民化(r = -0.013,P.=0.950)地下。此外,根中β-1,3-葡聚糖酶活性与根瘤菌定殖没有显著相关性(r = -0.163,P.= 0.417)或AMF定植(r = 0.061,P.= 0.764)(表1).
讨论
植物防御机制表达在对病原菌或食草动物的地上攻击的反应中,可以影响地下与有益微生物的共生。这种防御和共生之间的相互作用对植物通过有益的微生物共生体获得营养和水分的能力有着重要影响。以往的研究表明,在大豆叶面喷施acibenzolar-S-methyl(ASM)后,根瘤菌和丛枝菌根真菌(AMF)的定殖都有所减少[3.]、[17]、[23]. 然而,使用人工药剂对防御相关机制的化学诱导可能无法真正模拟植物保护自身免受自然界病原真菌侵害的能力,也无法显示对地下微生物的实际抑制作用。与ASM诱导相比,通过活病原体诱导抗性(IR)以及对地下共生微生物的影响,据我们所知尚未得到证实。分析这种生物防御刺激与理解自然系统中的过程有关。
以前的研究表明,植物对取食韧皮部的昆虫也会通过增加致病相关蛋白(PR)的表达来做出反应。这些植物反应随后影响了地上和地下共生微生物群落,尽管结果不一。迈耶等等。[35.]发现银叶白蝇取食后,番茄植株叶片对白粉病的抗性增强。相反,杨等等。[36.当植物在实验暴露于粉虱喂养时,证明了对地下细菌和真菌微生物的积极影响。我们的研究是第一个利用真菌细胞和来自真菌的片段来诱导植物防御机制导致地下的植物防御机制。此外,我们表明,与病原体片段的实验性接种和病原体片段的处理导致与根际两种非常不同微生物的相互作用相当降低,无根瘤菌和AMF;尚未观察到的新发现(但看到Faessel等等。[3.),其中应用ASM显著降低了根瘤菌的定植率,也降低了菌根真菌的定植强度和丛枝菌的比例。
在我们的研究中,我们观察到病原体诱导的防御对这两种地下共生体强度的强烈影响。根瘤菌结瘤数菜豆与对照组相比,用活真菌病原体和真菌碎片处理的植物根显著减少(图1)5.a) 是的。同样,在用活病原菌和真菌片段处理的豆科植物中,AMF定殖的根系比例显著降低(图1)5.b) 是的。
我们的数据表明,诱导抗性(IR)的效果可能是由于病原体处理植物中的多酚氧化酶(PPO)活性增加(表1). 在我们的植物系统中,PPO活性的增加是唯一在系统水平上作出反应的参数。在对病原菌处理的反应中,我们观察到叶片PPO活性的增加,这在病原菌片段中尤其迅速。在根部我们观察到类似的反应。根系PPO活性的增加延迟了1~2d;表明系统性的信号传递,可能是水杨酸[20]、[21].青豆的研究进展(phopololus lunatus.)表明PPO活性具有很高的防御能力刺盘孢属、炭疽支持PPO在辩护响应中的关键作用C球孢子同样在这个工厂系统中[37.]、[38.]. PPOs主要储存在类囊体内腔,直到从组织损伤或病原体攻击中释放出来,在细胞内酚类物质氧化为活性醌的过程中起关键作用。这些醌具有很强的氧化性,能产生活性氧(ROS),对病原体起到有效的防御作用。此外,活性醌可以通过烷基化降低植物组织中蛋白质的利用率,从而降低对病原体和食草动物的营养价值[39.]、[40].在Groundgrought与根瘤菌和AMF降低以下的定子率可能是PPO活性氧化的结果。与PPO活性相比,我们在升高的几丁质酶或β-1,3-葡聚糖酶活性方面没有检测到系统响应。酶活性两种酶活性对叶中的治疗(活病原体和病原体片段)显示出不同的反应(图2a和3.a),但在实验期内,根部的活动保持不变(图2b和3.b) 是的。然而,叶片和根部的PPO活性的全身增加,最有可能由水杨酸活性引起的,也应该导致章节中的几丁质酶和β-1,3-葡聚糖酶活性增加[34.].在病原体治疗和对照植物的根部中,可以使用微生物互动分子-Rezobia和AMF引起的初始定殖。进一步诱导仅叶片的几丁质酶和β-1,3-葡聚糖酶活性可以是地上病原体和病原体片段处理的结果。
在植物化感发期间使用的伊啶糖苷(Ig)的基因型差异也可能在我们的实验中导致地下降低的殖民率。进入车前草产生更高水平的免疫球蛋白化合物桃叶珊瑚苷和梓醇表明AMF定殖水平降低[41.]. 原始殖民地车前草由AMF的根也可能导致涂层素浓度的增加。但是,我们没有分析我们的IG生产中的内在差异Phaseoulus寻常的植物不能进一步得出关于其对降低殖民化影响的可能性的结论。在与玻璃销接种和来自玻璃销的病原体片段的接种过程中的机械损伤也可能导致地下AMF定植物的变化。苜蓿经过重复伤害的植物已经证明了AMF丰富的增加,并且通过茉莉酸的上调来逐渐降低对真菌病原体的敏感性[42.]. 某些基因型p .寻常的对机械损伤有不同程度的反应,从而影响AMF在地下定殖的程度。需要进一步分析茉莉酸对创伤的反应,以证实这种效应p .寻常的.
除了IR对微生物根系共生体的直接影响外,从植物生长到防御的分配途径的改变也可能导致根瘤菌或AMF的定殖减少。此外,光合作用的减少可能会限制植物营养生长和形成根系共生体的能力[9.] - [12].除了导致光合作用减少的细胞过程外,由于病原体病变的形成而造成的光合作用叶面积的损失也可能减少植物光合产物的可用性。例如,在最近的一项研究中,我们可以显示叶面积损失对利马豆花外花蜜生产的定量影响(p . lunatus),主要由光合作用直接产生的糖组成[43.]. 因此,有证据表明诱导抗性的负面影响可能是由于同化物的生产减少或重新分配造成的[13]. 然而,当我们观察到活病原菌和真菌碎片对两种地下共生菌的处理效果相似时,我们可以排除光合叶面积引起观察效果的可能性。虽然用活的真菌病原体处理导致了病斑的形成并明显减少了光合叶面积,但用真菌碎片处理并没有造成任何可见的叶损伤,但在PPO诱导和微生物共生强度降低方面产生了类似的效果。然而,这两种微生物的根定殖仍有可能受到对防御化合物的资源分配的抑制。值得注意的是,在没有地下微生物的植物中,病原体处理导致生物量的减少。评估光合产物从生长到防御的重新分配,可以进一步证明防御化合物是否是导致地下定殖率降低的原因[1]、[14]、[38.].根瘤菌和AMF都会导致植物主机中的大量碳汇。植物中产生的所有光合酸盐的20%可被细菌/真菌伙伴消耗[44.].光合产物的重新分配从微生物共生体转向防御化合物的生产,可能使植物更不适合宿主。微生物互作对植物诱导抗性性状产生影响的可能性也存在。未来的研究应分析未接种根瘤菌或未接种AMF的植物在地上病原菌处理后PPO、β-1,3-葡聚糖酶和几丁质酶的活性水平。这些额外的病原体处理将有助于比较不存在地下互惠生物的植物的诱导抗性性状,尽管这些条件在自然界中不太可能存在[45.].β1日以来3-glucanase和几丁质酶活性在治疗后的根并没有改变生活病原体和病原体片段,但存在在更高水平的实验比叶子,有可能是接种根瘤菌和AMF感应这些防御化合物引起的根源。与之相反,地上病原菌处理后叶片和根中PPO活性更接近,具有系统诱导的特点。
以前的工作表明,对组成型表达PPO基因的突变植物中的真菌病原体较低的敏感性[39.]、[46.].我们的研究结果表明,植物PPO活性的诱导从地上部分延伸到地下部分。这可能对受病原体攻击的植物产生严重的后果,这些植物依赖根际的互惠者获取营养和水分。虽然我们的工作首次证明了在使用病原真菌治疗后PPO的表达增加,而与之相伴的是地下互惠性的减少,但有几个方向需要进一步研究。
尽管我们关于AMF定植减少的结果与de Roman的结果相似等等。[17和Tosi & Zazzerini [23]结果表明,用叶面喷施和浸种两种方法诱导IR后14天内,AMF的定殖受到短暂的影响。我们在21天内的结果显示,在最初的抑制后,根定殖率的增加很小。因此,今后的研究应着眼于真菌诱导PPO活性后较长的一段时间。此外,德罗曼等等。[17和Tosi & Zazzerini [23]检测了几丁质酶和β-1,3-葡聚糖酶的水平,发现只有叶子的酶活性增加,而不是根。两项研究都没有检测PPO活性对化学诱导的反应。7天后,真菌片段处理后的根和叶PPO活性恢复到对照植株附近的水平。这就需要进一步研究PPOs在根中的持久性或残留性。
结论
在这里,我们表明,多酚氧化酶(PPOs)的表达作为一种有效的抗病原体防御可能会显著抑制植物形成地下共生体的能力。据我们所知,我们的结果首次证明了植物对地上病原菌攻击的防御反应阻碍了与地下根瘤菌和菌根真菌的联系。在我们的研究中,在接触真菌病原体的植物中观察到了诱导的PPO活性,这很可能是这种现象的机制基础。尽管自然界中的植物在面对病原真菌攻击时可能已经存在共生关系,但防御化合物(如PPOs)的产生可以减少或消除共生微生物。在农业环境中生长的植物在致病性攻击之前,可能没有时间与地下的互惠共生者建立重要的联系,特别是在常规耕作的土壤中。我们的结果更准确地反映了农业中遇到的情况;没有明显地下联系的幼嫩植物受到病原体的攻击。因此,我们的研究结果应该被认为是高度相关的作物是依赖于互惠协会,同时,易受真菌病原体在营养和水分有限的土壤。防御和共生的复杂相互作用在很大程度上决定了植物适宜性的结果,并且鉴于植物病原菌的普遍存在,对自然和农业生态系统中的植物生产力具有广泛的相关性。
方法
植物
常见的豆植(菜豆L.'布什蓝湖')是从种子(美国草甸公司,威利斯顿,佛蒙特州)。种子在消毒的湿纸巾中预发芽,当种子形成0.5厘米长的胚根时,用于种植。植物在光照时间为13:11h的温室中进行栽培。温室内的光由HQI-BT 400 W(欧司朗)和RNP-T⁄LR 400 W(镭)灯的组合(1:1)提供。在阳光明媚的中午(+额外照明)和餐桌高度测量光可用性,结果平均为625μmol/s−1.M−2.全灯(Li-250光计; Li-Cor Biosciences,林肯,内布拉斯加州,美国)。温度为27:19°C(光:暗),我们保持相对空气湿度为70-80%。植物在容器(每壶一株植物)中生长,直径12厘米,在阳光混合#1,LC1(泥炭苔,粗珍珠岩,带有石膏,白云岩石灰石和润湿剂的起始营养物; SungroHorticulture®,Bellevue,WA)175g每壶,每天浇水。
根瘤菌
菜豆与N有着密切的联系2-根瘤菌科固定土壤细菌。特定于菜豆(豆科根瘤菌生物商phaseoli)从位于美国肯特兰的INTX microbials LLC获得。在我们的研究中,细菌在含有1g酵母提取物(默克,纽约)、10g甘露醇(默克,纽约)、800ml去离子水和200ml土壤提取物的液体培养基(pH7.0)中培养。从160 g干燥的未施肥的壤土(取自休耕草地覆盖区域)制备土壤提取物,该土壤悬浮在400 mL去离子水中,添加0.4 g碳酸钠,并在121°C下在1260 mbar压力下高压灭菌30 min。在植物接种前三天,根瘤菌在28°C和180 rpm的实验室摇床上培养(Eppendorf,Westbury,NY)。然后用自来水按1:10的比例稀释细菌溶液,并用100毫升这种溶液浇灌植物。根瘤菌接种在预发芽大豆种子种植后的第1天。
丛枝菌根真菌(AMF)
用商品化的AMF接种剂接种实验植物[粉状接种剂,Bio Organics™,俄勒冈州拉松(聚集性血管球那G沙漠珊瑚那G单孢菌。不规则藻那漏斗状苔藓那珠状巨孢囊霉那Paraglomus brasilianum),每株10毫升(8克)]。AMF与根瘤菌同时接种。在播种种子的基材周围使用无菌玻璃巴斯德移液管。我们在每个洞里填上2克接种粉,并给植物稍微浇水。
真菌病原体的治疗
菌株62146炭疽菌gloeosporiodes(Penzig)本研究中使用的Penzig&Saccardo是从Leibniz Institute-dsmz德国微生物和细胞培养物收集(Braunschweig,德国)获得的,并证明是在易于殖民的成功菜豆在我们以前的研究中[37.]、[38.].刺盘孢属、炭疽在燕麦培养基上(直径为9.5厘米)培养,pH 5.0(4%(v / v)粉,1.5%(v / v)琼脂)。将培养物在25℃的温度下储存在培养箱中,相对空气湿度为85%,并且在10 min光的光线下(150μmolm−2.S−1.)每12小时诱导孢子发育。当植物长出未展开的初生叶(种植后7天)时,我们应用两种不同的病原体处理,一种是活真菌(孢子悬浮液),另一种是真菌碎片。为了给植物接种病原菌,小叶用浓度为10%的孢子悬浮液处理5.孢子ml.−1.. 孢子样品取自4天大的真菌培养物,用5毫升蒸馏水稀释。用改进的双纽鲍尔计数箱对孢子浓度进行了显微测定。在显微镜下对每种悬浮液的7个样品进行计数(对角线正方形一行计数)。用0.9mm玻璃针在下表面损伤小叶(每个小叶一处损伤),并用移液管将5μL孢子悬浮液移到伤口上[37.].我们还应用了真菌细胞碎片——不是导致病变,而是诱导植物的防御反应。为使植株接触真菌片段,直接从培养基中刮取真菌菌丝和孢子,在处理前将1 mg真菌组织(鲜重)置于1 mL无菌去离子水中超声5min。在应用真菌片段时,按照上述方法对活病原菌的每片初生叶进行损伤,然后用空气刷将每片叶2ml细胞片段悬浮液喷施于叶下表面。我们将等份的超声波悬浮液与麦芽提取物(2% (v/v))放在琼脂平板上,以测试片段的活力。在上述培养条件下,2周内未见真菌生长。我们的结论是超声处理足以制备不含活细胞的真菌悬浮液。
具有根瘤菌和菌根真菌的根殖民定量
根瘤菌的建立以根瘤形成和可见根瘤的形成为基础。为了量化结瘤,对根进行破坏性收割,仔细清洗,并对每株植物进行根瘤计数。
从每棵植物的4个清洗过的根的不同位置取1 g新鲜根样本,以评估菌根真菌的定殖情况。根节段放置于组织资产中(VWR, West Chester, PA)。所有根标本用10% (v/v) KOH清除,2% (v/v) HCl酸化,用0.05% (v/v)台潘蓝溶液染色,乳甘油保存[47.].将根切成1厘米的薄片,每棵植物至少40厘米的根放在一个含乳甘油的显微镜载玻片上。显微镜观察采用AmScope FM320三目镜显微镜,放大倍数分别为100倍和400倍。使用放大交叉法在100个随机点上与显微镜目镜十字准线相交的根上检查菌根真菌结构[48.].在100个相交的菌根性真菌结构的存在或不存在用于计算每个植物菌根真菌的根长定殖百分比[49.]. 第二个实验是比较根瘤菌和AMF对真菌病原体和病原体碎片处理的地下定殖率的初步结果。
多酚氧化酶活性的定量
所有的酶分析都是在同一个初生叶上进行的,以减少叶片性状的变异。每一片叶子,我们切下三个叶片圆盘(直径2厘米),立即称重(XA204 Delta Range,梅特勒托莱多,瑞士),并转移到预冷(在冰上)2毫升Eppendorf®管。试管放置在装满液氮的干燥托运人中,运到实验室并在取样后24小时内处理。根样品(每株0.5 g横向洗过的根样品,从根系的同一部分)被相同地处理。多酚氧化酶(PPOs)的酶活性通过测定O2多酚及其衍生物氧化成醌过程中的消耗[50.]. 对于PPOs的提取,小叶或根以三倍体积(v鲜重)均质−1.) Sörensen微雌蕊缓冲液。提取在25°C的Eppendorf®试管(1.5 mL)中进行。随后,样品离心(8000 x g, 10 min, 4℃),上清液用于PPO活性分析。用Clark电极系统(Yellow Springs Instruments, OH, USA)通过测量伴随的氧耗量来测定活性。该电极被校准为100% O2使用O饱和2- 饱和Sörensen缓冲液(磷酸盐 - 柠檬酸盐缓冲液,pH 5.6)。我们使用了4-甲基肠道(Merck,NY)作为标准。在每个PPO活性分析之前在搅拌下测量4-甲基胱甘露肠道的自动氧化。测量自动氧化的溶液由2.9mlsörensen缓冲液和100μl4-甲基基替金属(225 mm l−1.). O中的解决方案2电极由100 μL上清液和2.8 mL O2- 饱和缓冲液。在搅拌1分钟后,100μl4-甲基基甲醚(225 mm L.−1.), O2用极谱法测定6分钟的耗量2耗尽包括酶o2底物氧化过程中的耗尽、底物的自氧化等2植物提取物的消耗过程。因此,我们减去底物的自氧化值和O2样品的消耗量(以O2电极(分别不含样品或基质溶液)2损耗。
几丁质酶活性测定
几丁质酶粗匀浆β-1,3-葡聚糖酶活性测定方法是在液氮中研磨植物和根样品,并在0.1 M柠檬酸钠缓冲液中均质,pH为5.0,比例为1:2 (w/v)。离心10分钟,10,000 x g;Eppendorf 5810R),上清作为粗酶制剂[51.].根据REN,用荧光测定测定几丁酶活性等. [52].五μl甲基jusblifrylβ-D-n,n',n'-三乙酰壳聚糖水合物(0.5 mg mL−1.;Sigma)加入95 μL植物提取物(叶根和样品)中,置于黑色96孔微孔板中。样品在40°C摇床中孵育30分钟。荧光测量使用分子器件SpectraMax Plus384.微孔板阅读器(激发365 nm,发射450 nm)。所有数值均以每克鲜重的荧光单位报告。提取缓冲液作为参考。
β-1,3-葡聚糖酶活性测定
β-1,3-葡聚糖酶的活性在96孔微孔板中使用de Román描述的方法测定等等。[17]还有索莫吉[53].Laminaria digitata.使用层状蛋白(Sigma)作为底物。180μl反应制剂的总体积含有50μL植物提取物(叶片和根样品),10μLLAMINARIN(20mg mL−1.在50mM Na-乙酸盐缓冲液中,pH5.0),60μl铜反应和60μl砷反应(见Somogyi [53)。在650 nm波长下用分光光度计测定吸光度。通过与0 ~ 200 μg mL葡萄糖标准曲线的比较,确定了糖的释放量−1..
统计
我们使用了事后分析(Tukey’s HSD,P.<0.05)进行单因素方差分析,分析不同试验植物处理(接种活菌)对根瘤菌定殖(根瘤数)和AMF定殖的影响刺盘孢属、炭疽那C球孢子碎片和水处理;控件)。分别在接种后14天和接种后21天进行分析。T检验用于检测两种根系共生体的初步定殖率差异(图1)1),以及与后续实验的一部分的相同治疗的对照植物的定植速率(图5.).我们还使用了Hoc分析(Tukey的HSD,P.<0.05)进行单因素方差分析,以分析活细胞实验处理后酶活性(PPO、几丁质酶、β-1,3-葡聚糖酶)的差异C球孢子那C球孢子片段和水(对照)。最后,用Pearson的双尾相关性分析了酶活性和两种微生物以下地区的关系(表格1).使用SPSS(IBM SPSS统计21)进行所有统计分析。
支持数据的可用性
所有支持数据(关于微生物定植率和酶活性的原始数据)包括作为附加文件。
附加文件
缩写
- AMF公司:
-
丛枝菌根真菌
- ASM:
-
Acibenzolar-s-methyl
- 搞笑:
-
环烯醚萜苷
- 红外:
-
诱发反应
- 行业特殊风险:
-
诱导系统性反应
- PPO:
-
多酚氧化酶
- PR:
-
致病相关蛋白
- SAR:
-
系统获得性耐药
参考
- 1.
无数植物对食草动物的反应。植物生长规律,2000,19:195-216。
- 2.
植物防御策略的宏观进化。生态学报,2007,22:103-109。10.1016 / j.tree.2006.10.012。
- 3.
Faessel L,NASSR N,Lebeau T,Walter B:大豆抑制瘤抑制和菌根化的化学诱导的抗性。植物土壤。2010年,329:259-268。10.1007 / s11104-009-0150-7。
- 4.
Glazebrook J:生物营养型和坏死营养型病原体防御机制的对比。植物病理学年鉴。2005年,43:205-227.10.1146/annurev.phyto.43.040204.135923。
- 5。
Kunkel BN,Brooks DM:病原体防御中信号通路间的串扰。植物生物学。2002年,5:325-331.10.1016/S1369-5266(02)00275-3。
- 6.
Agrawal A,Strauss S,Stout M:狂野和女性健身组分的诱导应对和耐受性的诱导应答和耐受性。进化。1999年,53:1093-1104。10.2307 / 2640814。
- 7.
Ballhorn DJ,Godschalx AL,Kautz S:利马豆化学和机械防御的共变异(phopololus lunatus.l .)。J Chem Ecol。2013,39:413-417。10.1007 / S10886-013-0255-6。
- 8.
Heil M,Hilpert A,Kaiser W,Linsenmair KE:化学诱导病原防御后生长和结实率降低:系统获得性抗性(SAR)是否产生分配成本?。经济学杂志。2000年,88:645-654.10.1046/j.1365-2745.2000.00479.x。
- 9
Logemann E,Wu S,Schroder J,Schmelzer E,Somssch I,Hahlbrock K:紫外光下的基因激活,真菌诱导子或真菌感染脆油与细胞周期相关基因的抑制有关。植物J。1995年,8:865-876.10.1046/j.1365-313X.1995.8060865.x。
- 10
Scheideler M、Schlaich NL、Fellenberg K、Beissbarth T、Hauser NC、Vingron M、Slusarenko AJ、Hoheisel JD:监测从内务管理到病原体防御代谢的转变拟南芥使用cDNA阵列。J Biol Chem。2002,277:10555-10561。10.1074 / JBC.M104863200。
- 11
Swarbick PJ,Schulze Lefert P,Scholes JD:大麦叶片对白粉病的敏感性和抗性(小种特异性和广谱)的代谢后果。植物细胞环境。2006年,29:1061-1076.10.1111/j.1365-3040.2005.01472.x。
- 12
Schwachtje J,Baldwin It:为什么草食攻击重新配置初级新陈代谢?植物理性。2008,146:845-851。10.1104 / pp.107.112490。
- 13
Kaplan I,Halitschke R,Kessler A,Sardanelli S,Denno RF:在地下植物组织中的草食病中的构成和诱导防御。生态。2008,89:392-406。10.1890 / 07-0471.1。
- 14。
植物的困境:是生长还是保护。Q Rev Biol. 1992, 67: 283-335。10.1086/417659。
- 15.
Moyersoen B:根微生物共生的进化趋势。刘文汇,刘文汇,刘文汇,等。10.1098 / rstb.1996.0120。
- 16.
陆生植物的根和菌根的共同进化。新植醇。2002,37(4):426 - 426。10.1046 / j.1469-8137.2002.00397.x。
- 17.
De Román M,Fernández I,Wyatt T,Sahrawy M,Heil M,Pozo MJ:诱导叶片抗性机制暂时损害与丛枝菌根真菌的根系联系。经济学杂志。2011年,99:36-45.10.1111/j.1365-2745.2010.01752.x。
- 18.
Durrant WE,Dong X:系统获得性抵抗。植物病理学年鉴。2004年,42:185-209.10.1146/annurev.phyto.42.040803.140421。
- 19.
Martinez Abarca F、Herrera Cervera JA、Bueno P、Sanjuan J、Bisseling T、Olivares J:水杨酸参与建立草木樨根瘤菌-苜蓿共生。植物与微生物相互作用。1998年11月:153-155.10.1094/MPMI.1998.11.2.153。
- 20
Ramanujam M,Jaleel V,Kumaravelu G:水杨酸对结瘤、含氮化合物和相关酶的影响黑吉豆.BIOL植物。1998年,41:307-311。10.1023 /答:1001859824008。
- 21
Lian B,Zhou X,Miransari M,Smith DL:水杨酸对大豆幼苗发育和根瘤形成的影响。农业科学杂志。2000185:187-192.10.1046/j.1439-037x.2000.00419.x。
- 22
Salazar Costa H,Rios-Ruiz Wf,Rodrigues Lambais M:acido salicilico indibe a formacao de micorrizas asbusculares e modifica a expressao de incininase eβ-1,3-葡聚糖酶em raze de feijoeiro。科学农业。2000,57:19-25。
- 23
Tosi L,Zasserini A:相互作用单轴霉属helianthi那苔藓球茎和两种植物活化剂在向日葵植物中。EUR J植物途径。2000,106:735-744。10.1023 /答:1026543126341。
- 24
Sonnemann I,Finkhaeuser K,Wolters V:植物诱导抗性是否影响地下群落?。应用土壤生态。2002年,21:179-185.10.1016/S0929-1393(02)00037-9。
- 25
Younginger B,Barnouti J,Moon DC:菌根真菌、盐胁迫和竞争对草食动物的交互作用大叶巴克利菌. Ecol Entomol公司。2009年,34:580-587.10.1111/j.1365-2311.2009.01105.x。
- 26。
Thamer S,Schädler M,Bonte D,Ballhorn DJ:地下共生的双重好处:固氮根瘤菌促进生长并防御产氰植物中的专门食草动物。种植土壤。2011,341:209-219.10.1007/s11104-010-0635-4。
- 27。
Ballhorn DJ,Kautz S,Schädler M:通过挥发物产生诱导植物防御依赖于根瘤菌共生。食道痛。2013年,172:833-846.10.1007/s00442-012-2539-x。
- 28.
Wijesundera RLC,Bailey JA,Byrde RJW:果胶裂解酶的生产菜豆炭疽病菌在培养和感染的大豆中(菜豆)组织。微生物学杂志。1984, 130: 285-290.
- 29.
Bailey Ja,O'Connell RJ,Pring RJ,Nash C:感染策略刺盘孢属物种。Colletotrichum:生物学,病理和控制。编辑:Bailey Ja,Jeger MJ。瓦莱德福:CAB INTERINATIONS;1992年:88-120。
- 30.
Nicholson RL:酚类化合物及其在抗病性中的作用。Annu Rev phytopathol。1992年,30:369-389。10.1146 / annurev.py.30.090192.002101。
- 31.
贝尔斯特罗斯·尼古尔森·罗尔森省:玉米炭疽病的生物学。植物DIS。1999年,83:596-608。10.1094 / PDIS.1999.83.7.596。
- 32
Spoel Sh,Dong X:在植物免疫反应期间使荷尔蒙串扰感。细胞宿主微生物。2008,3:348-351。10.1016 / J.chom.2008.05.009。
- 33
Lee S,Hong Jc,Jeon WB,Chung Ys,Sung S,Choi D,Joung YH,OH BJ:水杨酸诱导的非中小学未成熟辣椒果实对抗刺盘孢属、炭疽与成熟果实的抗性相似。《植物细胞报告》,2009年,28:1573-1580.10.1007/s00299-009-0756-5。
- 34
Van Loon L,Van Strien E:发病相关蛋白家族,它们的活性,以及PR-1型蛋白的比较分析。植物病理生理学。1999年,55:85-97.10.1006/pmpp.1999.0213。
- 35
Mayer Rt,Inbar M,McKenzie Cl,Shatter R,Borowicz V,Albrecht U,Powell Ca,Doostdar H:Silverleaf粉虱的多重型相互作用,宿主植物,竞争食草动物和植物病变。拱形昆虫生物学理发学。2002,51:151-169。10.1002 / Arch.10065。
- 36
杨建伟,易浩,金浩,李B,李S,吉姆西,柳CM:粉虱侵染辣椒引起叶片和根系对病原菌的防御反应,并改变地下微生物区系。经济学杂志。2011年,99:46-56.10.1111/j.1365-2745.2010.01756.x。
- 37
Ballhorn DJ,Pietrowski A,Lieberei R:利马豆发绀和抗真菌病原菌之间的直接权衡(phopololus lunatus.l .)。生态学报,2010,31(6):649 - 652。10.1111 / j.1365-2745.2009.01591.x。
- 38。
Ballhorn DJ:针对真菌病原体和Lima Bean的昆虫草食物的同时抗性的约束(phopololus lunatus.L.)。化学经济杂志。2011年,37:141-144.10.1007/s10886-010-9905-0。
- 39。
Thipyapong P,Hunt M,Steffens J:反义下调多酚氧化酶导致疾病易感性增强。足底。2004,220:105-117.10.1007/s00425-004-1330-6。
- 40.
Thipyapong P,Stout MJ,Attajarusit J:通过反义/感测技术对多酚氧化酶的功能分析。分子。2007,12:1569-1595。10.3390 / 12081569。
- 41.
De Deyn Gb,Biere A,Van der Putten WH,Wagenaar R,Klironomos JN:化学防御,菌根殖民化和生长反应Plantago Lanceolata.中国生态学报,2009,30(3):457 - 461。10.1007 / s00442 - 009 - 1312 - 2。
- 42.
重复的叶片伤害改变了植物的定殖截形苜蓿通过有益和致病微生物根。植物细胞环境。2012,35:1344-1357。10.1111 / J.1365-3040.2012.02495.x。
- 43.
Ballhorn DJ,Kay J,Kautz S:叶面积去除对利马豆间接防御的定量影响(phopololus lunatus.)在自然界。化学经济杂志。2014,40:294-296.10.1007/s10886-014-0392-6。
- 44
哈里森MJ:在丛枝菌根共生中的信号传导。Annu Rev Microbiol。2005,59:19-42。10.1146 / annurev.micro.58.030603.123749
- 45
无微生物植物:事实还是人工产物?植物保护学报,2011,(1):1- 6。10.3389 / fpls.2011.00100。
- 46
多酚氧化酶在转基因番茄植株中的过表达增强了番茄的抗病性。植物保护学报,2002,21(2):1 - 7。10.1007 / s00425 - 002 - 0750 - 4。
- 47
Phillips J,Hayman D:用于清除根系和染色寄生虫和骨髓性骨髓菌根真菌的改进程序,用于快速评估感染。riss br mycol soc。1970,55:158-161。10.1016 / S0007-1536(70)80110-3。
- 48
McGonigle-TP,Miller-MH,Evans-DG,Fairchild-GL,Swan-JA:一种客观测定水泡丛枝菌根真菌根系定殖的新方法。新植物醇。1990年,115:495-501.10.1111/j.1469-8137.1990.tb00476.x。
- 49
Ballhorn DJ,Millar JA:菌根殖民化和光限制对利马豆生长和繁殖的影响(phopololus lunatus.L.)。J Appl Bot食品质量。2013, 179: 172-179.
- 50
Richter H,Lieberei R,Von Schwartzenberg K:苔藓植物多酚氧化酶编码基因的鉴定和表征肺孢子虫.植物生物(Stuttg)。2005年,7:283 - 291。10.1055 / s - 2005 - 837598。
- 51.
Mauch F,Hadwiger La,Boller T:乙烯:症状,不是诱导豌豆荚中豆荚酶和β-1,3-葡聚糖酶的信号,通过病原体和Elictors诱导豌豆荚。植物理性。1984,76:607-611。10.1104 / pp.76.3.607。
- 52.
任Y,Wee ke,Chang Fn:测定吲哚糖酶活性的当前方法的缺乏。Biochem Biophys Res Communce。2000,268:302-305。10.1006 / BBRC.2000.2118。
- 53.
Somogyi M:糖测定注释。生物化学杂志。1952, 195: 19-23.
致谢
我们感谢Adrienne Godschalx的宝贵意见和讨论。感谢波特兰州立大学的资助。
作者信息
从属关系
通讯作者
额外的信息
利益争夺
作者们宣称他们没有相互竞争的利益。
作者的贡献
DB和SK设计研究并收集数据;并通过分析数据编写了论文;DB、BY和SK修改了论文。所有作者都阅读并批准了最后的手稿。
电子辅助材料
植物殖民率与根瘤菌和丛枝菌根真菌(AMF)。
附加文件1:图形的原始数据1. 数据集显示了普通大豆的定殖率(菜豆)具有根瘤菌和丛枝菌根真菌的植物(PDF(37 KB)
附加的独立试验显示活病原菌和病原菌片段对根瘤菌和丛枝菌根真菌在根上定殖的影响。
额外的文件2:常见的豆植物被根瘤菌和AMF接种并用活液处理刺盘孢属、炭疽和C球孢子片段同时。在第14天和第21天,病原体治疗植物根系的定植(一)根瘤菌(根瘤数量)和(二)根显示丛枝菌根(AMF)定殖的百分比被量化。所示数值为平均值 ± 标准差;n=9株/天。根据事后分析(Tukey's HSD;P.单向ANOVA后<0.05)。(TIFF 124 KB)
作者为图片提交的原始文件
权利和权限
本文经BioMed Central Ltd.许可发布。这是一篇根据知识共享署名许可条款发布的开放获取文章(http://creativecommons.org/licenses/by/4.0)如果原始工作正确记入,则允许在任何媒体中进行无限制使用,分发和再现。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
Ballhorn,D.J.,杨亨,B.S.&Kautz,S。一个地上的病原体抑制地下根瘤菌和丛枝菌根真菌菜豆.BMC植物BIOL.14,321(2014)。https://doi.org/10.1186/s12870-014-0321-4
收到:
公认:
出版:
关键词
- 刺盘孢属、炭疽
- 诱发反应
- 植物防御
- 植物-病原相互作用
- 多酚氧化酶
- 权衡