摘要
背景
Coccinia茅葫芦科雌雄异株种,具有异型性染色体。雄性和雌性植株的染色体构成分别为22 + XY和22 + XX。男性的Y染色体明显较大,对决定男性起决定性作用。性变性已被用于研究性同体硅宾latifolia(石竹科),但上胚层未见报道Coccinia茅.此外,器官识别基因在性别表达中的作用Coccinia之前没有评估过。两性表型的研究c .茅包括一种罕见的gynomoecious(健身房)形式和AgNO3.介导性修饰为理解雌雄异株开花植物的性表达提供了新的视角。
结果
形态计量学分析表明雌花中存在退化雄蕊,组织学研究表明雄花中不存在心皮首字母。GyM植株虽有XX性染色体,但雄蕊发生在雌雄同体花中,花粉不可育。硝酸银(AgNO3.)对GyM等野生型雌花的雄蕊生长有促进作用,但花粉不育。微分表达式CgPI可能与不同花表型的发展有关。
结论
三个主要因素,雌蕊抑制(SuF)、雄蕊促进因子(SPF)和雄性生育能力(mF)控制雌雄异株的性表达c .茅被认为位于Y染色体上,对决定男性起决定性作用。然而,具有XX性染色体的GyM植物雌雄同体花雄蕊的特征性发育表明,y连接的SPF调控通路被某种程度地绕过了。我们的实验结果和所有其他先前的染色体和分子细胞遗传学数据都强有力地支持这一观点c .茅该系统可作为研究雌雄异株开花植物性别表达的潜在模型系统。
背景
绝大多数被子植物是雌雄同体,有两性花,近10%的开花植物是单性花[1].性系统与单性花和雌雄花的众多组合相结合。约有6%的被子植物是雌雄异株,在独立的个体上开雄花和雌花[2],[3.].文献研究表明,雌雄异株植物是由其双性祖先独立多次进化而来的[4] - [6].
与动物相比,雌雄异株植物的性染色体进化起源相对较近[7],[8].雌雄异株植物的性别决定可能是受基因或环境控制的现象[9].有些雌雄异株植物有可育的两性亲缘[10],是研究性染色体的优良系统。在雌雄异株植物中,性染色体的出现是非常罕见的,只有19种植物具有异型性染色体[10].异型性染色体在我国有广泛的研究硅宾latifolia(石竹科),其中雄性和雌性植物分别携带XY和XX性染色体[11].据报道,Y染色体是所有染色体中最大的[12它由三个性别决定区域组成,即雌性激素抑制因子(SuF)、雄蕊促进因子(SPF)和雄性生育因子(mF)[13],[14].其他被充分研究的雌雄异株植物也是如此Rumex acetosa显示X与常染色体比率[15],[16]和杨树以ZW系统而闻名[17用于性别测定.在木瓜中,性别决定由一对最近进化的性染色体控制,Y控制雄性和YH雌雄同体(控制18].因此,对不同雌雄异株植物性染色体的研究为更好地理解植物性染色体的进化提供了思路。
由于植物性别决定基因在雌雄同株植物的性别决定位点上没有重组抑制,所以迄今为止,植物性别决定基因都是通过基于地图的克隆方法从雌雄同株植物中鉴定出来的。19].近年来的基因组技术增强了对X-和Y-连锁基因的识别,并使X-连锁基因的剂量补偿检测成为可能美国latifolia(20.] - [22].在木瓜中,YH染色体(HSY)及其对应的3.5 Mb X染色体进行测序和注释,以鉴定性别决定基因[23] - [25].
现在有很好的文献证明硝酸银(AgNO3.)以及硫代硫酸银(Ag2年代2O3.)对许多雌雄异株和雌雄同株植物有雄性化作用[26] - [29].拜尔(30.报道了AgNO3.作为抗乙烯剂,通过抑制雌性生殖器官诱导雄花。也有证据表明AgNO3.可通过抑制乙烯改变性别[29],[31],[32].然而,一项研究硅宾latifolia,反驳了这一假设,并提出性别改变可能是通过应用硫代硫酸银时对磺酰基酶的抑制介导的[28].Janousek等.(33结果表明,5-氮胞苷处理了美国latifolia由于低甲基化而形成雌雄同体花。这表明表观遗传控制可能在性别决定和修饰中发挥作用。另一个由黑穗病菌引起的性别改变的独特案例(Microbotryum violaceum)感染硅宾latifolia.报道了该真菌可诱导南芥(XX基因型)雌花花药发育伊岚latifolia(34].然而,在这种情况下,花粉被发现是不育的,这表明Y染色体在花粉的育性中起决定性作用。对雌雄异株植物性别修饰的研究可以提高我们对基因控制程序如何被修饰到改变状态的认识。
不像硅宾latifolia(石竹科), Rumex acetosa(蓼科),番木瓜(番木瓜科),菠菜oleracea(藜科),杨树(杨柳科)[16],[17],[35],[36],它们的特征很好地解释了性别决定的机制,Coccinia茅具有下位子房的瓜科植物(Cucurbitaceae)相对较少受到关注。Coccinia是由27种组成的小属,性质均为雌雄异株[37].它是为数不多的雌雄异株植物之一,有异型性染色体的报道。雄性和雌性植株的染色体构成分别为22 + XY和22 + XX [38].文献调查表明,中国的性别二态性c .茅是由一个大Y染色体决定的[38] - [41],似乎起源较近[37].然而,参与性别决定的基因c .茅尚不清楚。基因组的c .茅几乎是?的六分之一硅宾latifolia与葫芦科植物的四个全序列基因组密切相关[42],[43].Y染色体的c .茅是陆地植物中最大的一种;它是异色的,不同于的Y染色体的优色美国latifolia(43].
除了男性和女性的性别形式c .茅,库马尔和Viseveshwaraiah [38]报告了雌雄同株的形式,雌雄同体植物的雄花是不育的。此前,Holstein和Renner [37的性表现型c .媒介物同节的有雄花和雌花/果实的在本研究中,我们发现了一种罕见的雌雄同株植物(以下简称GyM),在同一株植物上有雌雄同体花(GyM- h)和雌花(GyM- f)。这种天然生长的GyM植物的存在为研究植物性别决定的遗传基础提供了很好的机会c .茅.
了解植物的花发育和性别表达c .茅我们的目标是通过形态计量学、组织学、染色体和分子方法对性表型进行综合表征。在本研究中,观察到AgNO的叶面喷洒3.能在野生型雌花中诱导雌雄同体花。为了确定器官识别基因(OIGs)是否在性别分化中有任何作用,我们在雄性、雌性和GyM植物中进行了表达研究。据我们所知,没有这样的报告c .茅可以在文献中找到。
结果
三种性别表现型之间的形态差异
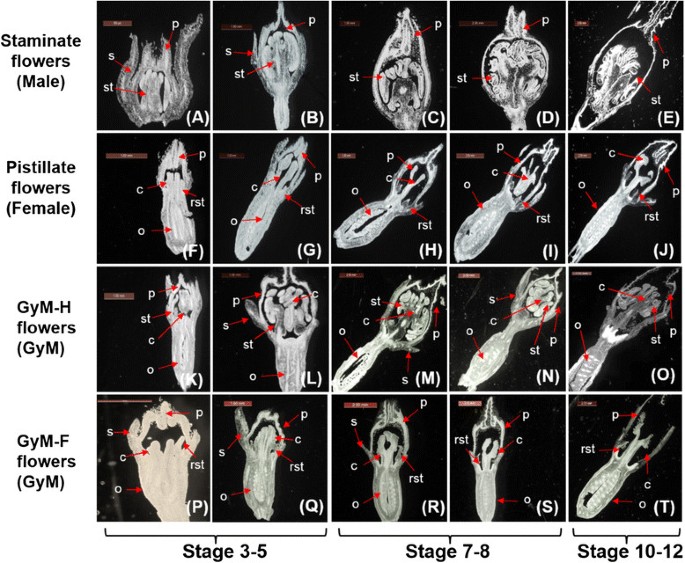
虽然这三种表现型在花序、萼片和花瓣性状上有显著的相似之处,但成熟花的形态却有明显的差异。成熟的雄花由三个轮生组成,有五个萼片,五个花瓣和五个(2 + 2 + 1)合蕊1A, E)。相反,雌花由四个轮生组成。虽然萼片和花瓣与雄花相同,但雄蕊被发现是退化雄蕊。雌蕊由三个心皮组成,具有融合花柱和三个二裂柱头(图1B, F)。GyM植物有两种不同类型的花(i)雌雄同体花(GyM- h)和(ii)雌蕊花(GyM- f)1:图S1)。GyM-H花有四个轮盘,几乎类似于女性的花;唯一不同的是,这里的雄蕊逐渐发育为成熟的雄蕊(图1C、G)。还观察到一些GyM-H花表现出雄蕊不完全生长2:图S2A)以及花瓣状雄蕊(附加文件2:图S2C)。发现GyM植物的GyM- f花的花器官组织与野生型雌性植物相似(图1D, H)。我们观察了GyM- f花和GyM- h花在GyM植物中的随机位置分布,发现在4 - 7月份,GyM- f花和GyM- h花的比例约为30:70。系统发育分析采用垫K和的环境年代GCU部件-的环境G科克大学基因间间隔区,揭示了GyM属植物的另一性表型Coccinia茅(附加文件3.:图S3)。除了三种性表现型Coccinia茅(附加文件4:表S1),构建系统发育树的序列使用了先前发表的数据[37].雌株果实的种子含量(种子数和每个果实的种子重量)高于雄株果实的种子含量5:图S4A, B)。
组织学分析
为了了解性器官的顺序发育,在花发育的不同阶段对所有三种性表型进行了组织学分析(图2一个t)。
雄花:雄花的组织学观察(3-4期,附加文件6:图S5A)显示萼片、花瓣和雄蕊没有心皮首字母的迹象2A).即使在花发育的后期,也没有观察到任何发育的心皮。然而,不能完全排除在花发育的原始阶段心皮首字母存在的可能性。在雄花发育的连续阶段观察到雄蕊的进一步生长(图2罪犯)。最后,在第12阶段(附加文件6:图S5A),花瓣即将开放时,花药内已发现成熟花粉(图S5A)2E,额外的文件7:图S6)。
雌花:而雌花(阶段3-4,附加文件6:图S5B)显示存在萼片,花瓣,雄蕊首字母和心皮具有四个轮系的下子房(图2F).虽然雄蕊的发育在早期阶段仍然停滞不前,但雌蕊的生长在发育的各个阶段都很明显(图2胃肠道)。第12阶段(附加文件6:图S5B),当花瓣即将开放时,雌蕊已经发育完全(图5)2J)。
GyM:在发育早期的四个连续轮生的GyM- h花中,可以观察到萼片、花瓣、雄蕊和心皮的首字母以及下子房的存在2K,额外的文件2:图开通)。雌蕊和雄蕊在后续的发育阶段进一步生长2L-N)和第12阶段(附加文件6:图S5C),发现雌蕊和雄蕊的生长是完全的(图2O)。然而,研究发现GyM植物中GyM- f花的发育与野生型雌性植物完全相同(图2- t)。
染色体的研究
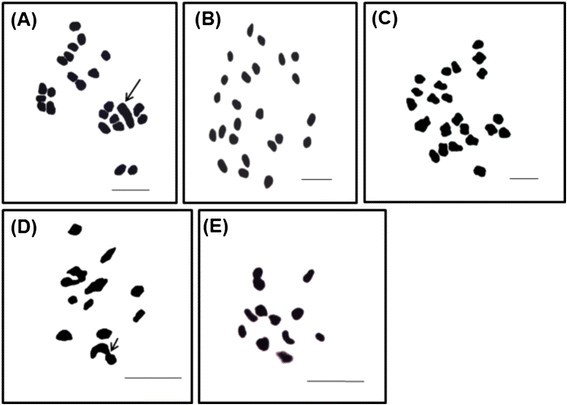
为了更好地了解GyM植物的雌雄关系c .茅在相同的环境中生长,进行了细胞学比较研究。雄性、雌性和GyM植株的体细胞染色体数均为2n= 24(表1).性染色体是异型性的,在雄性植物中Y染色体明显较大(图3.A).在野生型雌株和GyM植物中,染色体构成为22 + XX(图3.B, C)。野生型雌株和GyM植物的核型有相当大的相似性(图1)3.B, C)。男性的减数分裂研究显示X和Y染色体端到端配对3.D).相反,在GyM植物的GyM- h花中发现了正常的同源染色体配对(图3.E)。
AgNO3.诱发性修改
不同浓度的硝酸银(AgNO3.)溶液喷在雄株、雌株和GyM植株的基叶上8:表S2)。施用AgNO后,野生型雌花新生花蕾的雄蕊生长明显增强3.解决方案(图4而模拟);雄花的花结构没有变化。组织学研究进一步证实了野生型雌花雄蕊生长的剂量依赖性(图4H-K;额外的文件8:表S2)。然而,浓度高于35毫米则有致死作用。在30和35毫米AgNO的剂量下3.,经10 ~ 12天的观察,新花的形态与GyM-H花相当(图1)4d)。有趣的是,施用AgNO后,GyM植株的成熟花均雌雄同体3.表明即使是雌蕊花蕾的雄蕊也已发育成成熟的雄蕊9:图S7)。
交配实验与花粉育性
设计配种试验,研究雄花和GyM-H花花粉的育性2).雄性与去势GyM-H杂交的坐果率为83.33%。GyM-H与野生型雌花杂交无坐果记录。结果表明,90%的坐果发生在雄性与野生型雌性的杂交中2).同样,野生型雄花与GyM植株雌蕊花杂交的坐果率也达到93%。然而,在GyM-H和GyM-F花的杂交和自交GyM-H中没有坐果效果2).
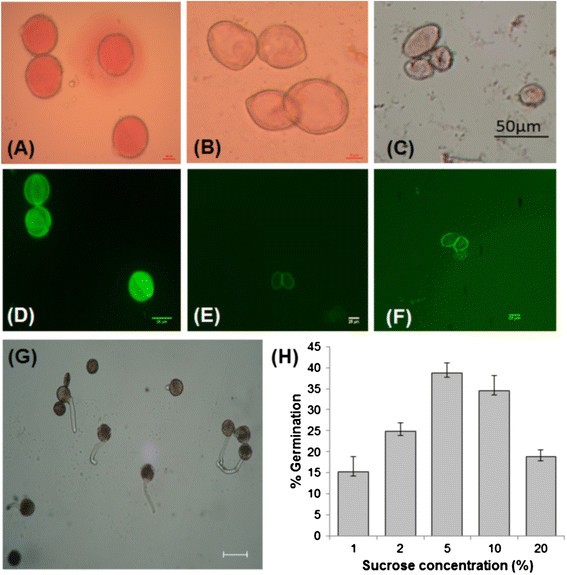
花粉活力测定采用雄株开放花、GyM-H和AgNO转化花分离得到3.对待女性。雄花花粉进行乙酰胭脂红染色;而GyM-H花和AgNO转化花的花粉3.处理过的母株没有保留任何污渍(图5a - c)。这些结果在FDA的测试中得到了再次确认(图5D-F)。此外,还测定了雄株、GyM株和AgNO株的花粉萌发情况3.对待女性。雄花花粉在5%含一定量Ca(NO)的蔗糖溶液中萌发率最高,为38%3.)2和H3.薄3.(图5G H)。相比之下,GyM和AgNO的雌雄同体花花粉3.处理后的母株在不同的萌发培养基中均无萌发现象。由以上结果可知,雄花的花粉具有可育性,GyM-H和AgNO转化花的花粉具有可育性3.经处理的母株在性质上是不育的。
器官识别基因(OIGs)的鉴定与表达分析
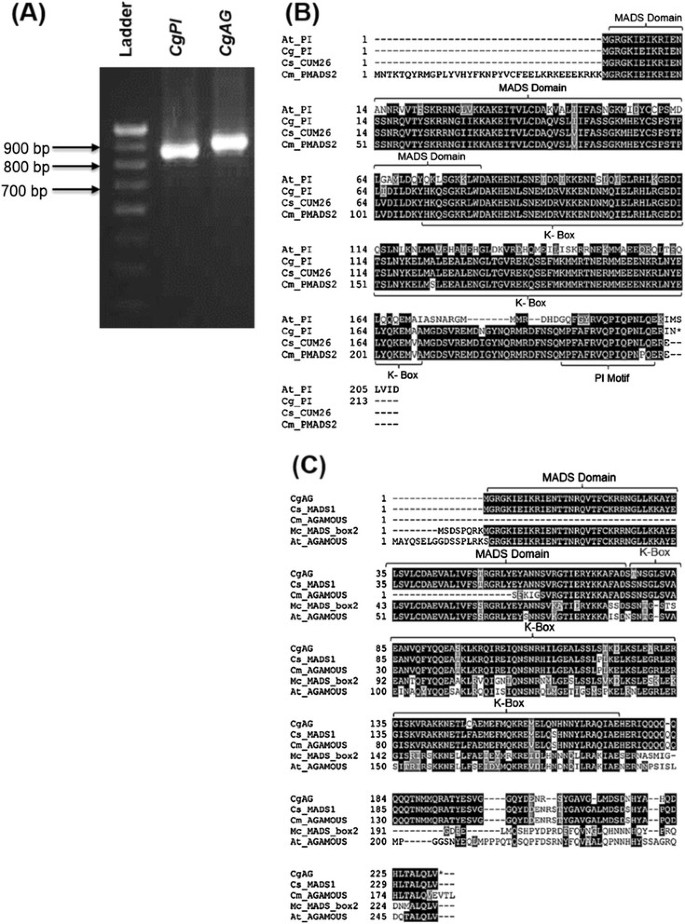
为了了解B类和C类器官识别基因(OIGs)是否在雄性、雌性和GyM植物发育花的性别中起决定作用,CgPI(B类OIG)和CgAG分离出1株C类OIG,采用实时荧光定量PCR (qRT-PCR)方法进行表达分析。基于PI (PISTILLATA)和AG) (无性生殖的),产量约350bpPISTILLATA(CgPI)和~250 bp的无性生殖的(CgAG)通过RT-PCR反应获得同源物。的部分序列CgPI[DDBJ: AB859715]CgAG[DDBJ:AB859714]已经沉积在DDBJ中。从RACE的5 '和3 '产物和扩增子中推导出完整的转录本序列CgPI(~ 893个基点)CgAG(~952 bp)6A)。互补脱氧核糖核酸CgPI和CgAG编码的蛋白质分别为212和232个氨基酸。推导出的两个基因的氨基酸序列在与其他基因对齐时具有高度的保守性PISTILLATA和无性生殖的就像基因(图6B, C)。在推导的氨基酸序列上发现了两个一致区域,MADS结构域和K-box(图1)6B, C)。
完整的长度CgPI和CgAG转录本分离和推导氨基酸序列的多重序列比对。(一)全长扩增CgPI和CgAG从花蕾中收获的总RNA转录本。(B)CgPI与其他piistillata样基因的比较。(C)CgAG与其他agamouss样基因的比较。保守的区域用黑色阴影表示。At_PI,Cg_PI,Cs_CUM26和Cm_pMADS2是PISTILLATA就像基因拟南芥,大球藻,黄瓜和Cucumis梅洛分别.Cg_AG,Cs_MADS1,Cm_AGAMOUS,Mc_MADS_box2,At_AGAMOUS是无性生殖的就像基因Coccinia茅,Cucumis巨大成功,Cucumis梅洛,苦瓜和拟南芥分别。MADS域和K-box由NCBI的保守域数据库识别并进行相应标记。
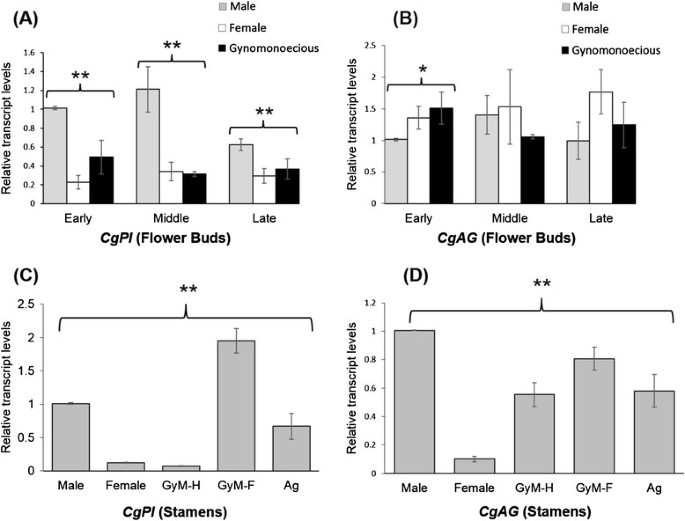
CgPI在雄花蕾、野生型雌花蕾和GyM花蕾中均有表达(图1)7一个)的表达CgAGC类基因对雄蕊和心皮发育至关重要,在雄性、野生型雌性和GyM花蕾中也有发现(图7B).我们的结果表明,这两个基因在所有发育阶段都有表达(附加文件6:图S5)(早、中、后期)雄、雌、GyM植物的花。CgPI在发育的早期、中期和晚期,这三种性形式的表达有显著差异(图7),而CgAG仅在花蕾早期有显著差异表达(图7B)我们也注意到CgPI雄花的表达量高于野生型雌花的表达量。而GyM花则表现为中等水平CgPI早期和晚期芽的表达(图7A).此外,我们的雄蕊特异性表达分析结果显示两者存在显著差异CgPI和CgAG雄性雄蕊间、GyM-H、AgNO含量3.经过处理的雌株、GyM-F和野生型雌株的退化雄蕊(图7C, D)。令人惊讶的是,GyM-F的发育雄蕊表现较高CgPI表达量高于GyM-H花雄蕊(图7C)。
器官识别基因(OIGs)表达分析检测结果。的表达模式CgPI(一)和CgAG(B)在雄花、雌花和雌花的花蕾中c .茅通过实时定量PCR (qRT-PCR)检测不同发育阶段(早期、中期和晚期)的细胞。雄蕊的特异性表达模式CgPI(C)和CgAG(D)从雄花(发育后期)、雌花(发育初期)、雌雄同体花(GyM- h)和雌花(GyM- f,发育初期)和AgNO的转化花3.植物治疗。误差条表示三个生物重复的SD(标准差),每个生物重复有三个技术重复。星号表示采用单因素方差分析确定的统计学差异(*P <0.05, **P <0.01)。早期:从3理查德·道金斯到5th阶段,中间:6th到8th后期阶段:9th到12th阶段。
讨论
心皮和雄蕊的分化过程遵循独立的途径
相比硅宾latifolia,在雄花中发现发育的雌蕊[44],[45组织学研究显示即使在发育早期也没有心皮首字母(3-4阶段,附加文件6:图S5A)中的雄花c .茅(图2A、B)。尽管雌株发生雄蕊启动,但其生长在早期阶段(阶段4-5,附加文件6:图S5B)2G-I)导致在成熟花中保留不育的退化雄蕊。这表明在研究中报道的雌花雄性分化途径中存在功能性干扰硅宾latifolia(14].在GyM-H花中,雄蕊和雌蕊同时发育,直至成熟2K, L)和停止雄蕊或心皮的生长没有观察到(图2M-O)。然而,在GyM植物的雌蕊花中,雄蕊生长停滞在花朵的早期阶段,就像野生型雌花一样2Q, R)。雌蕊花(GyM-F)发育的退化雄蕊和GyM-H花心皮发育完全的合雄雄蕊的发育表明,心皮和雄蕊的分化过程遵循独立的途径。
Gynomonoecious(健身房)c .茅,不是y缺失突变体吗
在研究雄性和雌性之间的形态差异的同时,我们记录了印度东北部(特里普拉)存在一种GyM植物,它表现出类似于雄性和雌性性别形式的形态特征检测结果。基于构建的树的形态表征和系统发育分析垫K和的环境年代GCU部件-的环境G科克大学基因间间隔区清楚地确立了GyM植物是另一种性表型的身份c .茅.
2号二倍体染色体的记录n男女均为24人3.A,B)和雄性植物中异型性染色体的存在证实了之前的发现,并验证了XY性别决定系统[38],[43],[46] - [48].X和Y染色体的端对端配对特征(图3.D)表示伪常染色体区域(PAR)之间的重组[43其他研究人员认为,X和Y染色体之间存在非重组区域,以解释某些雌雄异株植物性别决定的遗传基础[13],[49].雄性植物心皮起始位点的缺失表明Y染色体在非重组区具有显性雌蕊抑制基因美国latifolia(13].GyM植物的核型与野生型雌性植物的核型高度相似(表2)1;数字3.B, C)。雌雄同体花中期I的最小二价与雄性异型对的X染色体大小不匹配(图3.D, E)。因此,假设最小的染色体为X染色体还需要进一步检验[43在这个阶段,由于X特异探针的不可用性,它仍然不确定c .茅.GyM植株缺少雄性特异Y染色体,同源染色体配对正常(图3.C,E)表明GyM植株具有22 + XX染色体,包含产生雌花和雌雄同体花的遗传信息。雌雄同体表达的不稳定性表明GyM植株在基因典型上是雌性个体,而不是Y-缺失突变体。首先,在没有Y染色体的情况下,GyM植物雌雄同体(GyM- h)花的雄蕊是如何发育的?其次,是什么因素促成了同一株植物雌雄同体花(GyM-H)和雌花(GyM-F)的发育?
缺乏Y染色体的GyM植株雄蕊发育的刺激因素
与雄花的可育和可活花粉相比(图5A,D), GyM-H花的花粉在本质上是不育的,即使在发育的后期也仍然不成熟(图5B, E)。育种实验的结果否定了自花受精的可能性,因此,只有当来自雄性的花粉作为供体时,才会通过异体或交叉授粉发生坐果2).这说明活的和可育的花粉只在雄性植株中产生,雄性育性因子位于Y染色体上。显然,男性的生育能力是由Y染色体控制的,它在决定性别方面起着决定性的作用c .茅(50].类似于硅宾latifolia(13],[14,我们的实验结果表明在c .茅在Y染色体的进化过程中,至少有三个关键因子:雌性抑制因子、雄蕊促进因子和雄性生育因子组装并可能重排。然而,基因典型雌花GyM- h花的雄蕊与不育花粉的发育表明,刺激雄蕊发育的因素可能存在于基因组的其他地方,而雄性生育因子可能不存在。Scutt等.(51被感染的女性美国latifolia具有XX性染色体的雄蕊可发育成形态正常的雄蕊。然而,Farbos等.(14已经证明了这一点硅宾latifolia,雌性激素抑制因子(GSF/SuF)和y染色体的雄蕊促进因子(SPF)区域是连锁的优势性状,在XX性染色体的雌性植物中没有SPF。在Y染色体缺失或Y染色体缺失的情况下,研究了GyM-H花雄蕊发育的机制c .茅尚不清楚,但需要进一步调查。
硝酸银诱导雄蕊发育的现象与GyM植株相似
硝酸银可促进菊科植物雌株雄蕊发育c .茅模拟了GyM植物中雄蕊发育的途径(图4d)。Y染色体在这两种性表型和AgNO转化花的花粉中均不存在3.处理过的雌花在本质上是不育的,就像GyM-H花的花粉一样(图5C、F)。这表明野生型雌性的雄蕊发育是由一种未知的途径诱导的,它独立于文献报道的y介导的机制硅宾latifolia(28].但目前还不清楚这种信号是如何从树叶传递到花朵从而导致性别改变的。然而,硝酸银的作用是短暂的,正常雌花需要15-20天才能发育。这可能是由于有效的AgNO3.浓度低于阈值水平不能阻碍导致雄蕊生长受阻的雌蕊形成的分子机制。看来AgNO3.在适宜的浓度下,可促进野生型雌性和GyM-F的雄蕊发育c .茅可能是由于雄性分化途径的功能干扰的暂时性延迟。在这种情况下,雄性抑制因子在未处理的植物中存在的可能性和AgNO去抑制的可能性3.不能排除野生型雌株和GyM-F分子的存在。
OIGs的差异表达与三种不同花表型的发育
B和C功能基因即。CgPI和CgAG显示相同CUM26和MADS1的Cucumis巨大成功分别。qRT-PCR研究表明硅宾latifolia(52的雄花c .茅有更高的CgPI与野生型雌花相比的表达(图7A)。这一观察结果也适用于雄蕊特异性表达分析(图7C).高表达CgPI目前还不能解释GyM-F花雄蕊表达减少的原因,需要进一步的研究。本研究表明,OIGs可能在雄性、雌性和GyM植物中受到差异调控,导致雄性、野生型雌性和GyM- h以及GyM- f花的发育。为此,需要进一步的研究来了解的作用ACS(aminocyclopropane-1-carboxylate合成酶)和WIP1(伤口诱导蛋白1)基因,该基因被证明在相关物种中控制着性别表达,Cucumis梅洛(53],[54].甜瓜性别决定位点A编码一种乙烯生物合成酶CmACS-7,抑制雌花雄蕊发育。甜瓜的G位点编码CmWIP1这是一种抑制雄花心皮发育的转录因子。此外,它已被证明的作用ACS基因被保存在家族的另一个成员身上Cucumis巨大成功(55].这些基因在性别表达和修饰中的作用还需要进一步的功能验证研究。
结论
毫无疑问,男性的Y染色体具有“抑制女性”的功能c .茅是两性二态论建立的一个初始事件。即使在没有Y染色体的情况下,野生型雌株和GyM植物的雄蕊起始过程也会发生,但雄蕊进一步发育的停滞表明雄蕊促进功能(SPF)可能受到干扰。GyM-H的花粉和AgNO的转化花3.处理后的雌株不育,表明雄蜂育性因子位于Y染色体上,该染色体仅负责花粉育性。GyM植物的意义c .茅在于它能与不育花粉发育雄蕊,这在包括雌蕊花在内的其他任何植物中都没有报道过硅宾物种(56],[57].具有XX性染色体和AgNO的GyM两性花雄蕊的特征性发育3.修饰的野生型雌花是由一种未知的机制介导的,它绕过了与y相关的SPF调节通路。我们的实验结果和所有其他先前的染色体和分子细胞遗传学数据都强有力地支持这一观点c .茅该系统可作为研究雌雄异株开花植物性别表达的潜在模型系统。
方法
植物材料和花发育的阶段
野生型块茎根,雄性,雌性和GyMCoccinia茅采集自西特里普拉,种植在IISER浦那和特里普拉大学的试验田(植物标本室券为gynomoeciousc .茅是否在附加文件中提供10:图S8)。近两年来,无性系一直在试验田内维持。定期采集雄性、雌性和GyM植物的叶子和花,并在液氮中冷冻,用于各种实验目的。根据花蕾的大小,我们将花的萌发过程按升序分为12个不同的阶段。在12个不同阶段中,前两个阶段在立体显微镜下进行了研究,只对3个阶段的花蕾进行了研究理查德·道金斯到12th阶段(额外的文件6:图S5)考虑进行分期特异性组织学研究。在qRT-PCR表达分析中,花芽被分为三个不同的类别,即早期(从3理查德·道金斯到5th阶段),中期(6th到8th阶段)和晚期(9th到12th阶段)用于实验目的。另外,从雄花(发育后期)、GyM-H和AgNO转化花中也收获了雄蕊3.对雌花及野生型雌花和GyM-F花的退化雄蕊进行表达分析。
花蕾的组织学
了解雄性、雌性和GyM植物的花发育模式,不同阶段的花蕾6:图S5),取下后置于1:3醋酸-乙醇溶液中固定,4℃保存过夜。按照Cai和拉什布鲁克的描述制备不同发育阶段的花蕾纵向切片(L.S.) [58],但须作以下修改。固定组织分别用75%乙醇脱水40 min、95%乙醇脱水40 min,最后用100%乙醇洗涤3次,每次间隔45 min。然后用50-50%乙醇-二甲苯处理材料45分钟,然后用100%二甲苯清除材料45分钟。在59°C下用旁覆体蜡替换二甲苯。然后将组织嵌入到副质体块中。在50°C的水条件下,将10 μm的薄副质体切片安装在载玻片上。用100%二甲苯清洗载玻片上的蜡。最后在徕卡mz16fa显微镜下记录清除玻片的图像。
有丝分裂和减数分裂染色体分析
为了分析有丝分裂和减数分裂染色体,研究人员通过修饰的乙酰-火红素和乙酰-胭脂红染色技术进行了研究[59].幼叶尖在10-15°C的对二氯苯饱和溶液中预处理5 h,然后在1:3乙酸-乙醇混合物中固定过夜。固定叶尖用5 N HCl在10°C下水解15分钟,用2%乙酰肉豆素染色过夜,最后用45%醋酸压扁。在减数分裂染色体制备过程中,幼芽在1:3乙酸-乙醇混合物中固定2-3 h,然后用45%乙酸处理30 min。用1%醋胭脂胺染色剂涂抹合适的花药,记录野生型雄花和gymh花的I期中期。显微摄影使用尼康Eclipse E200显微镜,使用索尼Cybershot DSC-W320相机(数字化光学变焦- ×4, 1410万像素),×10目镜和×100油浸镜头。每张照片都在水平和垂直分辨率下进行适当放大和数字处理,男性和女性有丝分裂中期染色体分辨率为350 dpi, GyM有丝分裂染色体分辨率为72 dpi。雄性和GyM-H花芽的减数分裂中期染色体也在350 dpi下处理,以获得更好的分辨率。
配对设计与坐果分析
测定了黄花蓟马的雄株和GyM植株花粉的育性c .茅设计了4个对照交叉实验和1个自花授粉实验(表2).GyM-H花在交配前被阉割。每组实验装10朵花。控制授粉7天后取棉布袋,对每朵花进行观察。所有实验组均重复3次。
花粉萌发及活力测定
用不同浓度的蔗糖(1%、2%、5%、10%和20%)分别将成熟雄花和GyM-H花的新鲜花粉孵育于含2mm Ca(NO)的萌发培养基中,测定其发芽率3.)22 mM H3.薄3.(60].在室温下孵育1 h后进行发芽评分。为了测定雄株成熟花的花粉育性,对GyM-H和AgNO转化花进行了研究3.对待女性的植物;用1%乙酰胭脂红溶液染色5 min,在光镜下记录。根据Heslop-Harrison和Heslop-Harrison所描述的方案,进行二乙酸荧光素(FDA)试验以检查花粉的活力[61].
全长的鉴定和分离无性生殖的(CgAG)和PISTILLATA (CgPI)同源染色体
分离AGAMOUS (CgAG)及雌蕊花(CgPI)同源染色体c .茅从收获的花蕾中分离出总RNA,并汇集所有三种性形态的RNA。简并引物(附加文件11:表S3)是由PI和AG同源物的保守序列设计的(附加文件12:表S4)使用iCODEHOP [62].大约2 μg的总RNA使用SuperScript进行RT-PCR反应®III铂一步RT-PCR系统®Taq(英杰公司- 12574 - 018)。反应的第一步是在50°C孵育20分钟合成cDNA,然后94°C孵育2分钟,在94°C孵育15 s, 50°C孵育30 s, 68°C孵育35 s,共孵育40个周期。最终延伸在68°C 5 min。扩增产物在2%琼脂糖凝胶上分解,克隆到pGEMT载体,最后序列验证。这些序列被用来设计5 '和3 ' RACE的引物,以获得全长转录本序列(附加文件11:表S3)。使用SMARTer RACE cDNA合成试剂盒(Clontech)生成RACE准备cDNA。使用设计的引物和试剂盒提供的通用引物从cdna中进一步扩增5 '和3 '序列。放大的5 '和3 '区域CgPI和CgAG序列验证。引物被设计用来扩增全长转录本。推导出的氨基酸序列使用Clustal Omega与其他雌蕊和AGAMOUS样基因进行比对,一致序列使用Boxshade server进行阴影处理[55].使用NCBI的保守域数据库(CDD)搜索识别保守域[63].
定量实时PCR (qRT-PCR)分析
在三个阶段(早、中、后期)提取全花蕾RNA进行qRT-PCR表达分析。从雄性、雌性、GyM-H、GyM-F和AgNO转化花(发育后期)的雄蕊中提取RNA3.按照制造商的说明使用RNeasy植物迷你套件(Qiagen)处理母株。使用Nanodrop 2000c分光光度计(Thermo Scientific, Wilmington, USA)测定产量和RNA纯度,并通过凝胶电泳可视化。200纳克(200 ng)的总RNA被用于互补DNA (cDNA)的合成,由SuperScript III逆转录酶(Invitrogen)使用寡聚(dT)引物CgPI和CgAG基因。所有反应均采用18S rRNA基因归一化。对于18S, 50纳米克(50 ng)的总RNA用于互补DNA (cDNA)合成,使用基因特异性的反向引物(附加文件)11:表S3)。qRT-PCR在Roche LightCycler 96上用基因特异性的正向和反向引物进行11:表S3)。使用KAPA SYBR绿色主混合物(KAPA Biosystems)进行反应,在95°C孵育5分钟,然后在95°C孵育10 s, 60°C孵育20 s,循环40次。用熔融曲线分析检测PCR的特异性,用2——∆∆CT方法(64].
叶面喷洒AgNO3.在母株和GyM植物中
为了评估AgNO3.影响,不同浓度的AgNO3.将溶液(20 mM, 25 mM, 30 mM, 35 mM和40 mM)定期喷洒在雌株和GyM植株的叶片上8:表S2)花期前。叶面喷洒35 mM AgNO 12天后3.将转化后的花芽在不同时期采收,在1:3醋酸-乙醇混合物中固定,进行阶段性组织学研究。
所有支持数据仅作为附加文件包含。
作者的信息
Amita G. Ghadge:印度浦那理工学院理学硕士本科生;Kanika Karmakar:特里普拉大学植物系研究学者;Ravi S. Devani:印度浦那大学生物学部初级研究员;Jayeeta Banerjee:印度浦那大学生物学部科学家;Boominathan Mohanasundaram:印度浦那大学生物学部初级研究员;Rabindra K. Sinha:特里普拉大学植物学教授;Sangram Sinha:特里普拉大学植物学教授,Anjan K. Banerjee:浦那IISER生物学部教员。
附加文件
参考文献
- 1.
杨波尔斯基C,杨波尔斯基H:显花植物区系中性别形态的分布。学报,1992,3:1-62。
- 2.
Renner SS, Ricklefs RE:开花植物中的雌雄异株及其相关基因。中国生物技术学报,2003,22(5):596-606。10.2307 / 2445418。
- 3.
植物性别决定与性染色体。遗传学报,2002,38(4):394 - 3101。10.1038 / sj.hdy.6800016。
- 4.
answorth C, Parker J, Buchanan-Wollaston V:植物的性别决定。中国生物医学工程学报,1998,38:167-223。10.1016 / s0070 - 2153(08) 60247 - 1。
- 5.
Guttman DS, Charlesworth D:一种雌雄异株植物中的x -连锁基因,有退化的y -连锁同系物。自然学报,1998,393(6682):263-266。10.1038/30492。
- 6.
安斯沃思C:男孩和女孩出来玩:雌雄异株植物的分子生物学。中国生物医学工程学报,2000,26(2):381 - 381。10.1006 / anbo.2000.1201。
- 7.
Moore RC, Kozyreva O, Lebel-Hardenack S, Siroky J, Hobza R, Vyskot B, Grant SR:雌雄异株植物性别连锁基因DD44的遗传和功能分析硅宾latifolia,为性染色体进化的早期事件提供了线索。中国生物医学工程学报,2003,26(1):381 - 381。
- 8.
Rautenberg A, Sloan DB, Aldén V, Oxelman B:系统发育关系硅宾multinervia和硅宾部分Conoimorpha(石竹科)。系统工程学报,2012,37(1):226-237。10.1600 / 036364412 x616792。
- 9.
delaporta SL, Calderon-Urrea A:开花植物的性别决定。植物生态学报,2004,25(4):361 - 361。10.1105 / tpc.5.10.1241。
- 10.
Ming R, Bendahmane A, Renner SS:陆生植物的性染色体。植物生态学报,2011,32(4):485- 414。10.1146 / annurev - arplant - 042110 - 103914。
- 11.
植物多倍体细胞学和性别鉴定的研究Melandrium专辑.植物学报,1994,10:1-131。
- 12.
松永生,平津梅,河野生,黑岩等:细胞学分析Melandrium专辑:基因组大小、染色体大小和荧光原位杂化。细胞生物学杂志,1994,59(1):135-141。10.1508 / cytologia.59.135。
- 13.
雌雄异株开花植物的性别决定机制。热那特,1958,9:217-281。10.1016 / s0065 - 2660(08) 60163 - 7。
- 14.
Farbos I, Veuskens J, Vyskot B, Oliveira M, Hinnisdaels S, Aghmir A, Mouras A, Negrutiu I:白色秋秋花的性二态性:Y染色体缺失导致花的无性表型。中国生物医学工程学报,1999,29(3):381 - 381。
- 15.
植物的剂量性染色体系统。植物生态学报,1998,15(1):37 - 38。10.1016 / 0168 - 9452 (91) 90274 - c。
- 16.
Ainsworth C, Crossley S, Buchanan-Wollaston V, Thangavelu M, Parker J:雌雄异株植物sorrel雌雄花表现出不同的MADS box基因表达模式。植物生态学报,2004,22(3):366 - 366。10.1105 / tpc.7.10.1583。
- 17.
Yin T, Difazio SP, Gunter LE, Zhang X, Sewell MM, Woolbright SA, Allan GJ, Kelleher CT, Douglas CJ, Wang M, Tuskan GA:早熟性染色体的基因组结构和新证据杨树.基因组学报,2008,18(3):422-430。10.1101 / gr.7076308。
- 18.
于强,Navajas-Pérez R,童E, Robertson J, Moore P, Paterson A, Ming R:木瓜雌雄异株和雌雄异株Y染色体的近期起源。热带植物学报,2008,1(1):49-57。10.1007 / s12042 - 007 - 9005 - 7。
- 19.
张洁,Boualem A, Bendahmane A, Ming R:性别决定的基因组学。植物学报,2014,18:110-116。10.1016 / j.pbi.2014.02.012。
- 20.
Bergero R, Charlesworth D: 1000万年前植物性染色体系统中Y转录组的保存。植物生物学杂志,2011,21(17):1470-1474。10.1016 / j.cub.2011.07.032。
- 21.
Chibalina Margarita V, Filatov Dmitry A:单倍体纯化选择可延缓植物Y染色体退化。动物学报,2011,21(17):1475-1479。10.1016 / j.cub.2011.07.045。
- 22.
穆伊尔A,泽姆普N,德尚C,穆塞特S,威德默A,马莱GAB:拉皮新创X染色体剂量补偿的进化硅宾latifolia一种具有年轻性染色体的植物。科学通报,2012,10 (4):e1001308-10.1371/journal.pbio.1001308。
- 23.
Na J- k, Wang J, Murray J, Gschwend A, Zhang W, Yu Q, Perez R, Feltus F, Chen C, Kubat Z, Moore P, Jiang J, Paterson A, Ming R:番木瓜性染色体性别特异区物理图谱的构建。中国生物医学工程学报,2012,13(1):176-10.1186/1471-2164-13-176。
- 24.
王杰,那建科,于强,Gschwend AR,韩杰,曾峰,Aryal R, VanBuren R, Murray JE,张伟,Navajas-Pérez R, Feltus FA, Lemke C,童ej,陈C, Man Wai C, Singh R,王明丽,Min XJ, Alam M, Charlesworth D, Moore PH,蒋杰,Paterson AH, Ming R:木瓜X和Y的测序h染色体揭示了早期性染色体进化的分子基础。中国生物医学工程学报,2012,29(4):359 - 359。10.1073 / pnas.1207833109。
- 25.
Gschwend AR, Yu Q, Tong EJ, Zeng F, Han J, VanBuren R, Aryal R, Charlesworth D, Moore PH, Paterson AH, Ming R:木瓜X染色体的快速分化与扩增。中国生物医学工程学报,2012,29(4):359 - 359。10.1073 / pnas.1121096109。
- 26.
Chailakhyan MK:植物生长、开花和性别表达的遗传和激素调控。中国生物学报,1997,16(6):717-736。10.2307 / 2442417。
- 27.
Lazarte JE, Garrison SA:变性芦笋officinalis中国地质大学学报(自然科学版),1998,25(5):591 - 594。
- 28.
Law TF, Lebel-Hardenack S, Grant SR:银促进雌性白色秋秋花雄蕊发育(硅宾latifolia[石竹科])。中国生物技术学报,2002,29(6):369 - 369。10.3732 / ajb.89.6.1014。
- 29.
硝酸银对黄瓜性别表达的影响。园艺学报,2002,579:203-206。
- 30.
银离子:黄瓜和番茄中的一种有效抗乙烯剂。HortSci。1976年,11:175 - 196。
- 31.
赵晓春,曲鑫,Mathews DE, Schaller GE:乙烯通路突变对乙烯受体ETR1表达的影响拟南芥.植物生理学报,2004,25(4):366 - 366。10.1104 / pp.011635。
- 32.
托马斯•DT:在体外桑树性别表达的修饰(桑属阿尔巴)用乙烯利和硝酸银。植物细胞组织器官培养,2004,32(3):381 - 381。10.1023 / B: TICU.0000018390.65934.93。
- 33.
王晓燕,陈晓燕,王晓燕,等。雌雄异株植物性表型的表观遗传调控Melandrium专辑.Mol Gen Genet MGG。科学通报,2004,25(4):433 - 436。10.1007 / BF02174037。
- 34.
内田W,松永S,杉山R, Kazama Y,川野S:二态黑穗病菌诱导的花药形态发育Microbotryum violaceum在雌雄异株植物的雌花中硅宾latifolia.植物生态学报,2003,29(2):441 - 441。10.1007 / s00425 - 003 - 1110 - 8。
- 35.
Pfent C, Pobursky KJ, Sather DN, Golenberg EM:表征SpAPETALA3和SpPISTILLATA, B类花鉴定基因中菠菜oleracea,以及它们与性别二态性的关系。中国生物医学工程学报,2004,25(3):347 - 347。10.1007 / s00427 - 004 - 0459 - 4。
- 36.
Urasaki N, Tarora K, Shudo A, Ueno H, Tamaki M, Miyagi N, Adaniya S, Matsumura H:木瓜性别决定基因的数字转录组分析(番木瓜).科学通报,2012,7 (7):e40904-10.1371/journal.pone.0040904。
- 37.
Holstein N, Renner SS:有年份的系统发育和收集记录显示,非洲属的生物群系不断发生变化Coccinia(葫芦科)。中国生物化学学报,2011,11:28-10.1186/1471-2148-11-28。
- 38.
Kumar LSS, Viseveshwaraiah S:性机制Coccinia籼怀特岛和攻击。自然学报,1952,170(4321):330-331。10.1038 / 170330 a0。
- 39.
Chakravorti AK:细胞学Coccinia籼参照其性染色体行为的w.&a。中国地质大学学报(自然科学版),2004,27(3):74-86。
- 40.
Bhaduri PN, Bose PC:一些常见葫芦类植物的细胞遗传学研究,特别涉及染色体碎片作为物种形成的物理基础。中国生物医学工程学报,2004,24(2):356 - 356。10.1007 / BF02989384。
- 41.
Roy RP, Roy PM:性别决定机制Coccinia籼.中国机械工程学报,1997,26(1):1-4。
- 42.
进化、生物地理学和专题研究Coccinia(葫芦科)。博士论文。路德维希-马克西米利安大学,慕尼黑;2012.
- 43.
Sousa A, Fuchs J, Renner SS:分子细胞遗传学(FISH, GISH)Coccinia茅:葫芦科约3千年前的一种,在开花植物中Y/常染色体分化度最大。中国生物医学工程学报,2013,38(2):378 - 378。10.1159 / 000345370。
- 44.
Ye D, Oliveira M, Veuskens J, Wu Y,安装P, Hinnisdaels S, Truong AT, Brown S, Mouras A, Negrutiu I:雌雄异株的性别决定Melandrium。X/Y染色体系统允许互补性克隆策略。植物生态学报,1998,21(1):1 - 6。10.1016 / 0168 - 9452 (91) 90275 - d。
- 45.
Grant S, Houben A, Vyskot B, Siroky J, Pan W-H, Macas J, Saedler H:开花植物性别决定的遗传学研究。科学通报,1994,15(3):214-230。10.1002 / dvg.1020150304。
- 46.
开花植物的性染色体与性分化。染色体研究,1998,10:87-98。
- 47.
Guha A, Sinha RK, Sinha S:平均包装率作为雌雄异株瓜类核型分析的参数。中国植物学报,2004,29(1):369 - 369。10.1080 / 00087114.2004.10589379。
- 48.
Bhowmick BK, Jha TB, Jha S:雌雄异株葫芦的染色体分析Coccinia茅(l)沃伊特。染色体科学,2012,15(1):9-15。
- 49.
Lardon A, Georgiev S, Aghmir A, Le Merrer G, Negrutiu I:白秋梅的性二态性:Y染色体缺失揭示了心皮数量的复杂控制。中国生物医学工程学报,1999,29(3):369 - 369。
- 50.
明瑞,王娟,Moore PH, Paterson AH:开花植物的性染色体。中国生物技术学报,2007,29(2):371 - 371。10.3732 / ajb.94.2.141。
- 51.
Scutt CP, Li T, Robertson SE, Willis ME, Gilmartin PM:雌雄异株的性别决定硅宾latifolia.Y染色体与黑穗病寄生菌(黑粉菌属violacea)对花发育过程中基因表达的影响。植物生理学报,2004,24(3):369 - 379。10.1104 / pp.114.3.969。
- 52.
哈德纳克S,叶D,赛德勒H,格兰特S:雌雄异株植物白秋梅雌雄花发育过程中MADS box基因表达的比较。植物生态学报,2004,25(6):369 - 369。10.1105 / tpc.6.12.1775。
- 53.
Boualem A, Fergany M, Fernandez R, Troadec C, Martin A, Morin H, Sari M-A, Collin F, Flowers JM, Pitrat M, Purugganan MD, doggimont C, Bendahmane A:乙烯生物合成酶的保守突变导致瓜中的雄激素异构体。科学通报,2008,29(5):533 - 536。10.1126 / science.1159023。
- 54.
Martin A, Troadec C, Boualem A, Rajab M, Fernandez R, Morin H, Pitrat M, Dogimont C, Bendahmane A:转座子诱导的表观遗传变化导致了瓜的性别决定。自然学报,2009,461(7267):1135-1138。10.1038 / nature08498。
- 55.
Boualem A, Troadec C, Kovalski I, Sari M-A, Perl-Treves R, Bendahmane A:一种保守的乙烯生物合成酶导致两个雄性激素雄性化Cucumis物种。科学通报,2009,4 (7):e6144-10.1371/journal.pone.0006144。
- 56.
Lafuma L, Maurice S:雌雄同株物种的生殖特性,硅宾italica(石蕊花科),注意雌雄异株表型。中国生物医学工程学报,2006,29(4):369 - 369。10.1111 / j.1095-8312.2006.00597.x。
- 57.
Dufay M, Lahiani E, Brachi B:雌雄同株的性别变异与近交抑制硅宾高寒草场(石竹科)。植物生态学报,2010,29(1):447 - 447。10.1086/647916。
- 58.
蔡s,拉什布鲁克CC:激光捕获从磁带转移石蜡切片植物细胞的显微解剖促进了结构完整的RNA的恢复,用于全球基因分析。植物学报,2006,32(4):369 - 369。10.1111 / j.1365 - 313 x.2006.02886.x。
- 59.
《染色体技术:理论与实践》。英国伦敦:Butterworths Co. Ltd;1980.
- 60.
Brewbaker JL, Kwack BH:钙离子在花粉萌发和花粉管生长中的重要作用。中国生物学报,2003,26(5):559 - 565。10.2307 / 2439772。
- 61.
杨文华,杨文华,杨文华:酶诱导荧光法测定花粉活力;二醋酸荧光素的细胞内水解。染色技术,1997,45(3):115-120。
- 62.
Rose TM, Schultz ER, Henikoff JG, Pietrokovski S, McCallum CM, Henikoff S:用于远亲序列扩增的一致性-简并杂交寡核苷酸引物。核酸学报,1998,26(7):1628-1635。10.1093 / nar / 26.7.1628。
- 63.
Marchler- bauer A, Lu S, Anderson JB, Chitsaz F, Derbyshire MK, DeWeese-Scott C, Fong JH, Geer LY, Geer RC, Gonzales NR, Gwadz M, Hurwitz DI, Jackson JD, Ke Z, Lanczycki CJ, Lu F, Marchler GH, Mullokandov M, Omelchenko MV, Robertson CL, Song JS, Thanki N, Yamashita RA, Zhang D, Zhang N, Zheng C, Bryant SH: CDD:蛋白质功能注释的保守域数据库。核酸学报,2011,39(增刊1):D225-D229。10.1093 / nar / gkq1189。
- 64.
Livak KJ, Schmittgen TD:利用实时荧光定量PCR分析相关基因表达数据−ΔΔCT方法。方法,2001,25(4):402-408。10.1006 / meth.2001.1262。
- 65.
Tamura K, Peterson D, Peterson N, Stecher G, Nei M, Kumar S: MEGA5:使用最大似然、进化距离和最大简约法的分子进化遗传学分析。分子生物学与病原学杂志,2011,28(10):2731-2739。10.1093 / molbev / msr121。
确认
作者非常感谢慕尼黑大学的Susanne Renner教授和Aretuza Sousa博士在准备我们的稿件时的批判性阅读和宝贵建议。RD和BM获得新德里CSIR的研究奖学金。感谢印度政府DBT(批准号:BT/421/NE/TBP/2013)和IISER Pune主任的财政支持。我们感谢Vijay Vittal, IISER Pune先生的技术帮助和Nitish Lahigude先生维护工厂。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者声明他们没有竞争利益。
作者的贡献
AKB, RKS和SS设计并撰写了手稿,AGG, KK, RD, JB和BM完成了所有的实验。所有作者阅读并批准稿件。
电子辅料
12870 _2014_325_moesm1_esm.pdf
附加文件1:图S1。:Floral phenotypes on gynomonoecious (GyM) plant. GyM plant showing both hermaphrodite (GyM–H) and pistillate (GyM–F) flowers on the same twig. (PDF 47 KB)
12870 _2014_325_moesm2_esm.pdf
附加文件2:图S2。:Morphology of hermaphrodite (GyM–H) flowers of gynomonoecious (GyM) plant. Mature hermaphrodite (GyM-H) flower of gynomonoecious (GyM) showing incomplete development of stamens (A) and petaloid stamens (C). Longitudinal sections of early developmental stage of hermaphrodite (GyM–H) flower of gynomonoecious (GyM) plant (B). p: petals, s: sepals, c: carpels, st: stamens, rst: rudimentary stamens, o: ovary, pst: petaloid stamens. Scale bars are 1 cm in A and 1 mm in B. (PDF 53 KB)
12870 _2014_325_moesm4_esm.pdf
附加文件4:表S1。:List of accession numbers of the sequences of the species used in phylogenetic tree for both垫K和的环境年代GCU部件-的环境G科克大学基因间的间隔。所有其他序列都来自于Holstein和Renner之前的工作[37].(PDF 20 KB)
12870 _2014_325_moesm5_esm.pdf
附加文件5:图S4。:种子含量分析Coccinia茅.对来自不同果实的种子进行洗涤、计数和称重,以评估每个果实的种子产量。(A)雌雄同株植物(GyM)单果种子重量图形表示。图中为均值±标准差。(*P <0.05,t以及);n = 10。(B)雌雄同株植物(GyM)每果实平均种子数图形表示。图中为均值±标准差。(*P <0.05,t以及);n = 10。(PDF 21 KB)
12870 _2014_325_moesm6_esm.pdf
附加文件6:图S5。:花在Coccinia茅.花的发育阶段是根据花蕾的长度分配的。(A)雄花蕾,(B)雌花蕾,(C)雌雄同株花蕾。比例尺=1厘米。(PDF 124 KB)
12870 _2014_325_moesm7_esm.pdf
附加文件7:图S6。:纵向部分(L.S) of staminate flower buds of male plant showing pollen development. (A) and (B) are the sections of staminate flower of stages 8 and 12 respectively. p: Petals, st: stamens, pg: pollen grains. Scale bars are 2 mm. (PDF 238 KB)
12870 _2014_325_moesm8_esm.pdf
附加文件8:表S2。:性修改in pistillate flower ofCoccinia茅不同剂量硝酸银处理后的雌株。(PDF 5 KB)
12870 _2014_325_moesm9_esm.pdf
附加文件9:图S7。:硝酸银(AgNO3.)溶液对雌蕊花发育的影响。(A-D)硝酸银处理的雌蕊花(GyM)不同发育阶段的花纵剖面(喷洒35 mM硝酸银溶液后)。p,花瓣;年代,萼片;c,心皮;圣,雄蕊;rst,基本的雄蕊;o,卵巢。A处比例尺为1 cm;B、C及d各2毫米(PDF 94kb)
12870 _2014_325_moesm10_esm.pdf
附加文件10:图S8。: GynomonoeciousCoccinia茅有雌花和雌雄花。(植物标本室券:TU Campus, Karmakar, 433)。34个KB (PDF)
12870 _2014_325_moesm12_esm.pdf
补充文件12:表S4。:List of accession numbers of the sequences of the species used for designing degenerate primers. (PDF 5 KB)
权利和权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。
本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。
欲查看此许可证的副本,请访问https://creativecommons.org/licenses/by/4.0/.
创作共用公共领域奉献放弃书(https://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
加奇,a.g.,卡玛卡,K,德瓦尼,R.S.et al。植物三种性表型的花发育、花粉育性和性表达分析Coccinia茅.BMC植物杂志14,325(2014)。https://doi.org/10.1186/s12870-014-0325-0
收到了:
接受:
发表:
关键字
- Coccinia茅
- 下位的
- 上位的
- 雌雄异体的
- 雌性两性花同株
- 多晶型的性染色体
- 性修改
- 机关单位的基因
- 硝酸银