抽象的
背景
属于的树木麻黄科和Betulaceae.家庭在林业中起着重要的生态作用,是退化土地恢复和再造林的有用工具。这些功能与它们与该属固氮土壤细菌建立共生关系的能力有关弗兰基亚。然而,控制建立这些共生的分子机制很差。这项工作的目的是识别涉及Actinorhizal Symbiase的建立和运作的潜在转录因素。
结果
我们确定了202个推定转录因子在Silico.北京市40个家庭调查分析Casuarina glauca.(木麻黄科)全国35户195人糯桤木(Betulaceae.)EST数据库。基于已发表的转录组数据集和定量PCR分析,我们发现在其中调节39%和26%的转录因子C. glauca.和A. Glutinosa-Frankia相互作用。系统发育研究证实了豆科植物中存在共同的关键转录因子,如NSP、NF-YA和ERN相关蛋白,证实了固氮根瘤共生体中存在共同的共生信号通路。我们还鉴定了一个属于我们命名的锌指C1-2i亚家族的放射根特异性转录因子CGZF1在C. glauca.和agzf1.在A.糯。
结论
我们鉴定了特定强调GRAS,NF-YA,ERF和C的成员的推定的结论相关转录因子2H2家庭。有趣的是,将非豆科植物和豆科植物的TF与来自辐射根物种的信号元件进行比较,发现了一个新的根瘤特异性C亚群2H2TF可以专门参与Actinorhizal Symbioss。在Silico.转录因子家族的鉴定,转录分析和系统发育重建为研究的特定分子调节的研究奠定了响应弗兰基亚感染。
背景
尽管在大气中有丰富,但氮是植物生长最有限的营养素之一。它只能被植物吸收为nh4.+还是不3.-. 然而,一些重氮营养型土壤微生物能还原氮,其中一些微生物能与特定的植物科联系在一起。其中一些共生关系导致细菌在植物细胞内的特殊根结构(称为根瘤)中的调节。根瘤共生体存在于少数豆科植物中,cannabaceae.(副脑桥)和Actinorhizal植物。Actinorhizal植物属于八个可神去家族,可以用丝状土壤细菌形成共混物弗兰基亚. 尽管它们在生态学上的重要性和知识的最新进展,放射根共生体的形成和功能的分子基础仍然知之甚少[1]-[4.].最近,在三种散发株植物中进行转录组分析,C. glauca.那A.糯和格洛梅拉塔曼陀罗[5.],[6.[导致在接种后,在接种后,优先在Actinorhizal结节中表达的几种基因的发现和表征弗兰基亚. 对基因表达的全面分析表明,由根瘤和丛枝菌根(AM)共生体所需的信号元件组成的共同共生途径(SYM)的基因在放线菌根植物中也是保守的[5.],[6.].此外,在AM,根瘤菌和Actinorhizal Symbioss期间表达的基因的比较转录组分析表明,存在于这三个内蛋白组织中诱导的核心基因组的存在[7.].
在过去的十年中,遗传学研究模型物种的豆科共生(莲花japonicus.和Medicago Truncatula.)阐明了转录因子(TF)在结节形成不同阶段的作用[8.].第一个被描述为扮演角色的TF莲花japonicus.结节是最常见的尼恩(结节起始)突变导致抑制感染和原基形成的基因[9.].尼恩是在结节器官的早期阶段诱导的转录因子[10]并且涉及许多结节形成过程[11]. 在addition,尼恩已在豌豆、大豆和大豆中鉴定出同源基因M. Truncatula.,他们在普通中行动符号基因[12].最近,有研究表明L日本血吸虫那尼恩通过靶向两个核因子调节皮质细胞分裂,LjNF公司-YA1型和LjNF公司-YB1型,是根瘤器官发生所必需的[13].此外,证明TF环循环转移尼恩以磷酸化依赖性方式表达导致根末结节发育[14].nsp1.和nsp2.(结瘤信号通路)编码GRAS TF的基因也具体参与根瘤菌-豆类共生[15]-[17]而最近的研究表明他们参与丛枝菌根ysfbiosis [18],[19]. NSP1/NSP2形成异二聚体并激活ERN1公司(乙烯响应因子)通过与促进剂的富富区域结合所需的TF,又刺激了表达依诺德11在预感染过程中表达的基因[17]. 在Medicago Truncatula.MtNF-YA1和MtNF-YA2也控制依诺德11直接表达MtERN1公司激活[20.].最近,马斯德(Symbiosome分化的调节剂),半胱氨酸-2 /组氨酸-2(c2H2)TF能促进细菌向固氮类细菌的分化[21.].携带这些数据显示,豆类中特定的TF植物感染和结节器官组织。
本研究的目的是确定TF,它可以调节参与细胞凋亡的基因的表达C青冈-/A。法兰克胶放射根共生体。在这两种植物的根和根瘤中表达的14000个单基因中,我们鉴定出202个和195个TF,分布在40个和35个科中C. glauca.和A.明胶,分别。进行全局分析这些基因的表达谱,以鉴定结节与根部的上调和下调的TF编码基因,以及特异性的TF。几个表达水平C. glauca.和A.糯通过定量PCR确认TF。在模型豆类中进行的系统发育分析,与Actinorhizal植物有关的物种,以及散发菌植物C. glauca.和A.糯我们发现ZF1(锌指1)相关转录因子可能是辐射根共生的特异性调控因子。
结果
鉴定C. glauca.和A.糯转录因子
为了鉴定Actinorhizal植物中的转录因子,Tblastn搜索C. glauca.和A.糯使用来自TF数据库的DNA绑定域进行UNIGENE数据库拟南芥作为查询序列。这些数据库包含14327个A.糯和14,868个unigenesC. glauca.[5.].两个Unigene集的爆炸分析显示了405和358个基因可能编码TFC. glauca.和A.明胶,分别。为了去除假阳性,进行Tblastx以检查拟南芥基因和Actinorhizal序列之间的跨物种序列同源物,用1E的E值截止−10. 使用这种方法,我们将其缩小到202和195个潜在的转录因子,分布在40和35个家族中C. glauca.和A.明胶,分别(附加文件1和2). 13个家系(包括M型、E2F/DP和GeBP)均未发现潜在成员C. glauca.和A.糯unigene数据库。每个预测C. glauca.和A.糯TF基因是一个任意数。其他文件1和2列出两个物种的每个预测基因,以及所有ungenes的登录号,最接近的拟南芥tf和详细的爆炸信息。在TF家庭中,MYB超级家族和ERF家族最大,每种物种总额为39吨。第三大家庭是c2H2家庭,有18个家庭成员C. glauca.20英寸A.糯,其次是Wrky,NAC和BHLH系列。剩下的家庭由1到19名成员国代表(表1).
放射根转录因子的表达谱
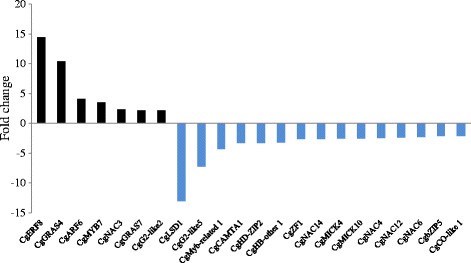
微阵列数据是从以前发表的研究中检索到的[5.],[7.]. 首先,我们使用了一个简单的比较转录组学工具木麻黄转录组纲要(CTC)以比较微阵列数据并在不同条件下产生表达谱。使用CTC,我们确定了54个压抑的转录因子和25个诱导的转录因子C. glauca.与未接种的根相比,结瘤/根折变≥2或≤−2和ap值 ≤ 0.01 (Figure1和附加文件3.). C2H2家族是最常见的表达上调类,其次是ERF和bHLH家族(补充资料)4.). 11种转录因子在大肠杆菌中的诱导表达C. glauca.通过定量PCR证实结节,这也显示出与微阵列数据相似的诱导值(附加文件)5.). 诱导CGZF1通过半定量PCR验证,因为在校准Q-PCR分析所需的非接种根中,其表达在未接种的根部(附加文件6.).
类似地,我们将可用的微阵列数据组合在一起A.糯生成一个阿尔纳斯转录组概要(ATC)。这使我们能够鉴定出30个推测的转录因子诱导和22个其他抑制因子A.糯与未接种的根相比(图1和附加文件7.). 与中观察到的结果相似C. glauca.结节多数MYB和WRKY表达下调,而C2H2在结节中诱发(附加文件8.).归纳A.糯7种转录因子的结节也通过定量PCR(附加文件)得到证实5.).
AM和辐射根共生体中TF基因表达的比较
这一组表达数据促使我们探讨在AM分子中的TF基因表达C. glauca.. 菌根根的数据是从最近的出版物中检索到的[7.].转录组数据突出显示15下调和7个上调的转录因子C. glauca.菌根根(图2和附加文件9.).NAC和GRAS系列的转录因子数量最多受到腐败的根源(附加档案)4.).比较结节中的表达和菌根菌的表达导致鉴定在根末结节中诱导的TFS,但不是在AM期间。仅有的CGZF1那CGHD-ZIP2.和cgg2-like5.分别属于c2H2HD-ZIP和G2样家族对病毒感染有明显的诱导作用弗兰基亚对AM真菌无反应(图1和2).尽管根结节符号系统被假设以源自症状,但比较分析表明只有一个转录因子命名Cgerf8.(NOD UP / MYC UP)在结节和腐败的根部诱导C. glauca.. 有趣的是,Cgerf8.被确定为与ERN基因有关M. Truncatula.已知是由根序我呢[5.].
Altinorhizal种类的GRAS,NF-YA和ERF转录因子家族
在豆类中,已经确定了几种TFS在细菌点燃因子的转导中起关键作用的TFS。这些包括克拉斯,NF-ya和ERF系列的成员(即NSP1、NSP2、NF-YA1、NF-YA2、ERN1、ERN2和ERN3)[15],[20.],[22.]. 因此,我们首先关注这些家庭。我们使用tBLASTn算法筛选额外的数据库,以便在第三种放线菌中鉴定GRAS、NF-YA和ERF-TFs,D. glomerata.[6.]豆科蔷薇目和葫芦目放射根植物的近缘(http://www.phytozome.net/search.php?show=blast& method=node_rosales-cucurbitales.)和拟南芥(Tair)。
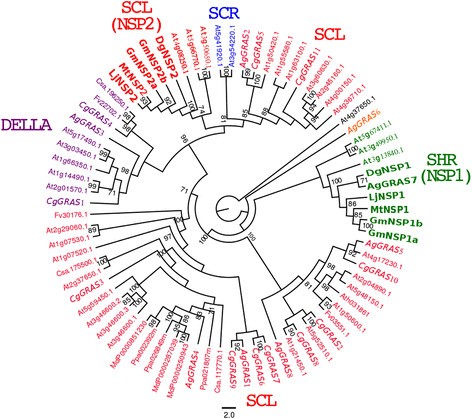
利用最大似然法对GRAS蛋白家族进行全序列比对,构建了GRAS蛋白家族的系统发育树。完成11个C. glauca.序列和八A.糯从各自的数据集收集。基于系统发育分析,定义了四种不同的亚属亚属:稻草人样(SCL),稻草人(SCR),短型(SHR)和Della。树拓扑比在水稻和拟南芥中发现的树拓[23.],[24.]. 没有来自的序列C. glauca.接近NSP1和NSP2。发现了rosales和cucurbitales的结果。但是,两个序列来自A.糯和D. glomerata.命名为AgGRAS7 (AG-J07f_002_D03)和DgNSP1分别属于NSP1组(图3.).
GRAS蛋白家族的系统发育树。三种gras蛋白C. Sativus.那P. Persica那M家蝇和F. VESCA.每一个都是通过在phytozome中执行BLAST-P搜索和两个序列DgNSP1(comp755_c1_seq1)和DgNSP2(comp1841_c1_seq1)检索的D. glomerata.(https://fido.nsc.liu.se/) [6.]. 我们还包括36个序列,可在基因组的A. Thaliana.,2来自m . truncatula2来自L. japonicus,4来自G.最大值,11来自C. glauca.和8来自A.糯. 斜体,转录因子C.Glauca.和A.Glutinosa.。GRAS系列包括4个亚属,称为SCL,SCR,SHR和DELLA。NSP1和2分别属于SHR和SCL Subfamilies。aggras7.与之密切相关DgNSP1型(绿色胖字母)。没有来自的序列C. glauca.存在于NSP1和NSP2组(红色脂肪字母)。这棵树是用木头扎根的A. Thaliana.序列AT3G37650.1。用于评估分支机构的统计支持。折叠具有少于70%的Bootstrap支持的分支。
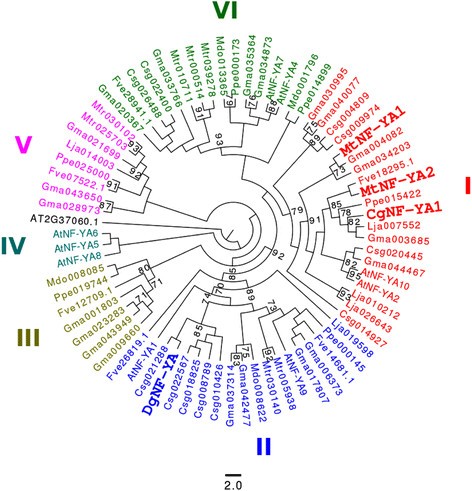
属于NF-YA家族的植物基因编码长度可变的TFs [25.]. 它们的DNA结合域与核开花时间调节因子CONSTANS(CO)的CCT结构域有一定的相似性[26.],[27.]. NF-YA蛋白有两个结构域(蛋白结合域和DNA结合域),这两个结构域在迄今为止所有高等真核生物中都是高度保守的[25.].为了阐明在转录组中鉴定的NF-YA基因的系统发育情况,我们使用仅使用NF-YA域的最大似然法建立了一棵树。最初收集的序列中的五种具有不完全的DNA和蛋白质结构域C. glauca.和A.糯数据集和被排除在进一步分析之外。NF-YA树包括6个主要类群(类群I–VI),这些类群也存在于豆科植物中(图4., [25.])。有趣的是,我的群体群体MtNF-YA1型和MtNF-YA2型从M. Truncatula.包括CGNF-YA1从C. glauca.。在目前的研究中,Dgcomp3430_c0_seq7从d.glomerata.在第二组。一些属于Ⅱ组的基因主要在种子中表现出强烈的表达[26.],[28.].
NF-ya蛋白家族的系统发育树。我们包括NF-YA蛋白A. Thaliana.(9种蛋白质),M. Truncatula.(9),L日本血吸虫(5)和G. Max.(21)。序列C. Sativus.(11),P. Persica(6),M家蝇(4)和F. VESCA.(6)使用在植物血红型和一种序列中进行的BLAST-P搜索来检索D. glomerata.(https://fido.nsc.liu.se/) [6.]. 在the present study, NF-YA tree comprises six groups: I to VI.CGNF-YA1属于第I组。DGNF-ya.(comp3430\ c0\ seq7)属于第二组。这棵树是用木头扎根的A. Thaliana.序列AT3G37650.1(NF-YB)。用于评估分支机构的统计支持。折叠具有少于70%的Bootstrap支持的分支。
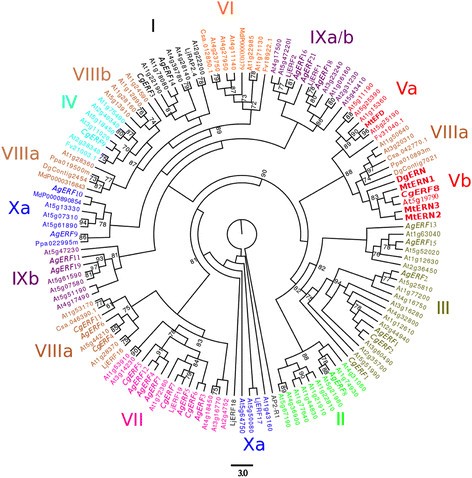
为了研究放线菌根中ERF基因的系统发育关系,利用AP2/ERF结构域的氨基酸序列进行了多重比对分析。在最初收集到的序列中,有10个序列的AP2结构域不完整C. glauca.和A.糯数据集并被排除在进一步的分析之外。ERF树在米饭,棉花和拟南芥中发现了10个主要群体(群体I-X)(图5., [29.],[30.])。最后一个C. glauca.和A.糯除第六组外,其余各组均有ERF-TF的表达。第七组包括5个不同年龄组的ERF-TF拟南芥中,以放射根ERF转录因子最为典型,有3个序列C. glauca.五个序列A.糯。然而,观察到群体的几种变化(图5.).组IX分为三个亚组[29.]. 在the present study, the phylogenetic tree showed that subgroup IXb was no longer related to subgroup IXa and IXc. Group IX contained five sequences fromA.糯来自模型豆类的两个序列莲花japonicus.包括LjERF1。LjERF1型起到结瘤的积极调节作用[31.].Agerf18序列是否与LjERF1型。第五组分为两个亚组[29.]. 在the present study, the phylogenetic tree showed subgroups Va and Vb grouped with Group VIIIa. Interestingly, Group Vb which contained ERN1, ERN2 and ERN3 fromM. Truncatula.,还包括两个ERF,CGERF8和DGCOMP6569,来自C. glauca.和D. glomerata,分别。在AP2/ERF结构域外存在的共同基序支持了V群聚类的可靠性。CgERF8和Dgcomp6569以及ERNs具有CMV-3或CMV-4基序,如水稻和水稻拟南芥(数据未显示)[29.].
乙烯 - 反应因子(ERF)蛋白质家族的系统发育树。三个ERF蛋白C. Sativus.那P. Persica那M家蝇和F. VESCA.每个都使用在植物血统和2序列DGERN(COMP6569_C0_SEQ1)和DGContig2454(Contig2454)中进行的BLAST-P搜索来检索D. glomerata.(https://fido.nsc.liu.se/) [6.]. 我们还包括来自A. Thaliana.4从M. Truncatula.7个来自L日本血吸虫. 斜体,转录因子C.Glauca.和A.Glutinosa.. ERF家族由十个组组成,称为I到X。CgERF8和DgERN属于第五组(红色脂肪字母)。它们比MtERN2和MtERN3更接近MtERN1。该树是根植于APETALA2 AP2域R1(At4g36920)。使用100个引导复制来评估对分支的统计支持。引导支持率低于70%的分支崩溃。
C2H2Actinorhizal共生中的转录因子
从整体上分析,其成员的大量存在及其在放线-根共生过程中的调控作用,使其成为一个重要的共生体2H2家庭特别有趣。因此,我们决定进一步研究这个家庭,特别是其两个成员,CGZF1和agzf1.。表达数据显示,这个家庭的四个转录因子被诱导,表达七个C. glauca.结节而不是在非接种的根部(图1; 附加文件4.).CGZF1在旋转旋转期间诱导,没有c2H2诱导于C. glauca.菌根(图1和2和其他文件3.和4.).的分析A.糯结节转录组显示一个C2H2在结节中表达下调,3个表达上调(图1)1; 附加文件8.).值得注意的是,就像在C. glauca.TF基因表达数据集2H2特遣部队,agzf1.,表现出最强的基因诱导A.糯图中红色三角形所示的结节1. C2H2家族的特征是存在一个包含一个或两个“QALGGH”保守基序的“锌指”DNA结合域[32.].CgZF1在85-105和142-162位置包含两个QALGGH motif。此外,在CgZF1的c端176和180位置鉴定出一个具有特征(S)/(F)DLN(L)/(F)XP的EAR(乙烯响应元件结合相关的两亲性抑制)抑制域。众所周知,“EAR域”负责抑制基因表达[33.],[34.].c中的这个域的存在2H2C1-2i蛋白提示它们是靶基因的转录抑制因子。最后,一个核定位信号(NLS)也在其N末端的31–36位被确认参与了蛋白质向细胞核的转移。AgZF1与C. glauca.CgZF1揭示了DNA结合的位置,包括两个“QALGGH”保守基序,一个EAR结构域和一个NLS在蛋白质序列中,与CgZF1高度一致(79%)10).
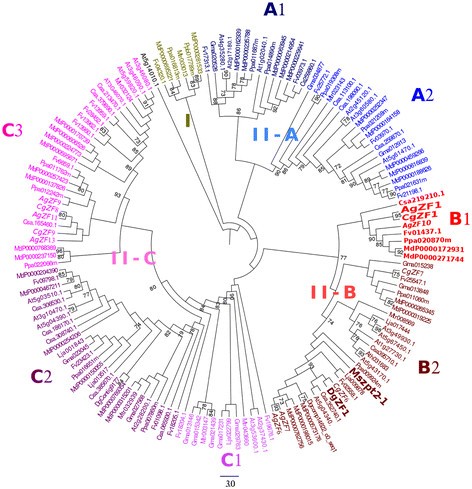
为了进一步描述CgZF1和AgZF1之间的关系,基于完整蛋白质序列的比对生成了一个系统发育树(图1)6.).序列M. Sativa.Mszpt2-1被添加到数据集中,因为它编码一个C2H2TF在豆科植物共生中起作用[35.].系统发育树介绍了两个主要群体,I和II组。小组我没有包含C. glauca.那A.糯和A. Thaliana.C2H2TF。II组分为名为A,B和C的三个亚组。亚组II-B和II-C占有七个和五C2H2分别是来自Actinorhizal植物的TFS。有趣的是,亚组II-B中的一个群集CGZF1和agzf1.仅由来自Rosales,Fagales和Cucuritales的序列组成,并且没有包含任何豆类序列。我们的分析还证实CGZF1和AgzF1蛋白序列非常接近并且最可能是直喉(79%相似性,数据未显示数据;引导价值,95%,图6.). 这表明ZF1样转录因子是在蚕豆目和蔷薇目/葫芦目/壳斗科分支分化后进化的,放射根壳斗科的共同祖先招募了这些基因来实现与结瘤相关的功能。
c的系统发育树2H2C1-2i蛋白家族。最大似然树代表24 c之间的关系2H2蛋白质来自A. Thaliana.,13从G.最大值,7来自M. Truncatula.和A.糯, 5L日本血吸虫和c . glauca3序列DGZF1(CONTIG7810),DGCOMP14622_C0_SEQ1(COMP14622_C0_SEQ1)和DGContig9177(CONTIG9177)来自D. glomerata。这棵树是用木头扎根的A. Thaliana.序列AT5G14010.1 (C1-1i)。斜体表示转录因子C.Glauca.和A.Glutinosa.. C2H2C1-2i家族包含两组,称为I和II。第II组分为名为A,B和C的三个亚组。子组也分为几个集群。簇II-B1含有来自rosales和葫芦属的植物和相关序列的序列,包括CGZF1和AgZF1(红色脂肪写作)。序列M. Sativa.Mszpt2-1被添加到数据集中,因为它编码一个C2H2C1-2i型转录因子。节点表示来自100个复制的引导值(≥70%)。
讨论
寻找公认的转录因子是表征控制辐射根共生的建立和功能的信号通路的重要的第一步。这一分析使我们能够识别202个和195个转录因子C. glauca.和A.明胶,分别。在计算机中生成的转录组数据的使用C. glauca.表明,调用转录因子的一半是在结节和菌根中调节的(附加文件11).在A.糯26%在结节中有明显的调节。此外,转录组的数据指出,共同调节CGZF1和agzf1,属于c2H2家庭。
在Silico.已经使用几种植物模型进行了研究,以优化转录因子的自动注释,并获得植物TF地图集。例如,已经确定了2,023个转录因子A. Thaliana.,1613英寸M. Truncatula.,1,275 in.L日本血吸虫和3557年G. Max.[36.].这些转录因子的特征在于其DNA结合结构域,其特异于每个家庭。这导致了58个家庭的识别A. Thaliana.,56英寸M. Truncatula.和L日本血吸虫和57 in.G. Max.[36.]. 推测的转录因子分布在40个家系中C. glauca.和35 in.A.糯。这些和其他植物模型之间的差异可以通过这一事实来解释C. glauca.和A.糯基因组数据来自14,327个unigenesA.糯和14,868个unigenesC. glauca.. 为了更好地理解放线菌根共生的生物学特性,利用下一代测序技术进行大规模cDNA测序将为鉴定新的TF基因和构建放线菌根基因表达图谱提供一种手段。
在确定的转录因子中,cgnin.(casuarina glauca nodule inception)显示出高度相似之处MTNIN.(Medicago Truncatula Nodule Inception)以及利宁(莲花japonicus nodule inception).cgnin.在结节(折叠变化= 27)中强烈诱导,没有显着诱导腐败的根源(图1和2). 我们还发现了另一种叫做Cgerf8.编码一个ERF转录因子。该基因在两者中都被诱导C. glauca.结节和mycorrhizae。在M. Truncatula.,一种编码属于ERF家族的转录因子的基因MtERN2公司[37.]呈现与相同的表达式配置文件Cgerf8.。这两个基因共享55%的相似性和特定结构域的保存(数据未显示)。此外,我们确定了CGNF-YA1,近在咫尺MtNF-YA1型和MtNF-YA2型,两个TFs参与激活MtERN1公司[20.].CGNF-YA1在Actinorhizal结节中诱导(折叠变化= 3,296,见图1). 无顺序C. glauca.属于NSP1和NSP2组。在A.糯,Aggras7属于NSP1组,与DGNSP1密切相关(引导值= 71%)。因此,我们建议CGNIN,AGNSP1那CGNF-YA1和Cgerf8.可能是功能性同源物尼安,NSP1那NF-YA公司和ERN1公司在豆科植物中。通过潜在的Actinorhizal正交基因的豆类突变体的功能互补可用于测试该假设。
使用转录组数据进行调用转录因子的表达分析,以研究其表达C青冈-/A。法兰克胶互动。这项调查显示25个诱导的TFSC. glauca.或A.糯结节。最近,192个基因编码的假定转录因子在结节中强烈诱导鉴定M. Truncatula.[38.]. 这些TFs被分为8个功能组,这些功能组的基因在细胞中受到不同的调控M. Truncatula.根瘤在7种实验条件下接种野生型和3种点头-突变株草木樨中华根瘤菌. 转录因子主要属于C2H2,MyB,Wrky和ERF家庭似乎是特定于结节的,而ERF和WRKY家族的成员在TF数据集中过于代表[38.]. 同样的,转录组分析L日本血吸虫鉴定出20个在结瘤过程中表达上调的TF,表明ERF家族成员是最丰富的TF[31.].值得注意的是,在我们的研究中,TF的ERF和WRKY家族成员也非常丰富,表达分析显示其中9个在放射根瘤中被诱导。ERF和WRKY转录因子通常涉及对非生物和生物胁迫的防御反应[39.]-[41.].正如豆类和根瘤长素的假设,ERF和WRKY TFS可以参与下游防御反应的调节,以抑制过量弗兰基亚氮气充足条件下感染。
三个基因命名CGZF1那CGHD-ZIP2.和cgg2-like5.属于c2H2,HD-ZIP和G2类似的家庭分别是特定的C青冈相互作用。TF命名agzf1.表现出同样强的诱导作用A.糯结节,CGZF1. 此外,这两个基因也被认为具有相同的蛋白质结构和系统发育分析表明,他们很可能是直系同源。在豆类中,两个C2H2TFS参与结核功能。在M. Truncatula.,MtRSD抑制分泌途径基因的转录,VAMP721a型,这表明MtRSD直接参与了共生体和类细菌的分化[21.].MTRSD是一个c2H2但与CgZF1和AgZF1的系统发育关系较远(数据未显示)。在M. Sativa.,一种叫做mszpt2-1参与氮固定细胞的分化[35.]. Mszpt2-1具有两个QALGGH基序和一个EAR基序以及CgZF1和AgZF1。Mszpt2-1、CgZF1和AgZF1属于同一个C2H2第II组(图6.).功能互补研究将确定是否CGZF1和agzf1.在功能上相当于豆类中鉴定的推定的正非基因。最近的研究表明,含有耳廓的阻遏物在植物生物和非生物胁迫中起着防御反应作用[42.].CGZF1和AGZF1可以抑制Actinorhizal植物的防御基因的表达,以响应信号弗兰基亚允许结节中的新细胞定植。最后,CGZF1和agzf1.可作为研究放线菌-根共生互作调控的功能标记。
结论
这在Silico.TFS鉴定和转录组分析C. glauca.而且在A.糯我们所做的是在阐明辐射根和菌根共生的分子事件上迈出了关键的一步。结合系统发育研究,这些分析使鉴定结瘤特异性基因C. glauca.命名CGZF1及其正轨A.糯命名agzf1.。这两个新的基因最可能是负调节因子,可能在辐注素共生中发挥至关重要的作用。发展有效的改造技术C. glauca.[43.现在允许我们进行功能研究CGZF1。
支持数据的可用性
本文报道的EST序列已存入GenBank(登录号:CO036851–CO0388878)和EMBL(登录号:FQ312199–FQ377516)数据库。标准化和原始微阵列数据值已存入基因表达综合数据库(www.ncbi.nlm.nih.gov/geo;加入号码。gpl10929和gse24153为C. glauca.和A.糯分别)。
方法
数据库搜索
来自的58个dna结合域蛋白序列预测拟南芥用作TBLASTN针对预测的查询序列C. glauca.和A.糯在先前描述的数据库中的蛋白质(http://www.ncbi.nlm.nih.gov/nucest/; 登记号CO036851至CO0388878和FQ312199至FQ377516)[5.]。拟南芥DNA结合域序列可从DATF(拟南芥转录因子数据库:http://planttfdb.cbi.edu.cn/2.0版)。TAIR数据库(http://www.arabidopsis.org/Blast/)用来确认每个假定转录因子与58个家族中的一个家族的联系。tBLASTx用于检测e值截止值为1e的基因间的跨物种序列同源性−10根据TAIR数据库对基因进行了注释。
放线菌根瘤和菌根中TF的表达数据
假定的TF在C. glauca.(登录号GPL10929)A.糯(登录号GSE24153)从微阵列数据中检索[5.],[7.]. 如果一个转录因子的折叠变化大于或等于2,其p值小于或等于0.01,则认为该转录因子是差异表达的。
对于定量RT-PCR分析,通过超速离心从根和根瘤中纯化总RNA[44.] 为了C. glauca.以及使用RNeasy plant mini kit(Qiagen,Courtabouf,法国,见[45.]) 为了A.糯. 使用纳米滴(Thermo Fisher Scientific,Courtabouf,France)对RNA进行定量,并根据制造商的说明(Agilent,Santa Clara,CA,USA)使用生物分析仪2100进行分析。为了C. glauca.使用SuperScript®逆转录酶III试剂盒(Invitrogen Life Science,Carlsbad,CA,USA)对0.5-1μg RNA进行反转录分析。为了A.糯分析,使用转录器转录酶和寡核苷酸(DT)为9μgRNA进行逆转录。15底漆(罗氏,曼海姆,德国)。逆转录(RT)和实时定量PCR(QRT-PCR)与结节和非接种根的三种生物学重复进行。使用Beacon Designer软件(Palo Biosoft International,Palo Alto,CA,USA)设计了底漆。如前所述进行定量RT-PCR分析[5.]使用支持信息(附加文件)中列出的引物13). 为了C. glauca.,使用Stratagene Mx3005P热循环仪(Agilent,Palo Alto,CA,USA)和Brilliant II SYBR Green QPCR主混合物(Agilent,Palo Alto,CA,USA)进行扩增,预变性步骤为95°C下5分钟,然后在95°C下进行40个循环,10秒,在60°C和72°C下进行30秒,15秒。为了A.糯在lightcycler480(Roche)上用lightcycler480-SYBR-greeni-Master(Roche)在以下条件下进行扩增:95℃下扩增5min;在95°C下循环45次20秒,在60°C下循环20秒,在72°C下循环15秒。这个C. glauca泛素基因(cgubi)以及A.糯基因(agubi.)被用作[44.]分别是[5.].
半定量PCR分析
cDNA.从C. glauca.未感染的根、根瘤、非菌根根和菌根通过逆转录RNA获得,如中所述[5.].CGZF1用特异的正、反义引物进行PCR扩增CGZF1(附加文件13).库比作为对照。扩增是使用基因放大器®聚合酶链反应系统2400(perkin Elmer)在94℃下,在94℃下为2分钟的预饱和步骤编程为23℃,在62℃和72℃下在94℃和30s的32℃下进行32个循环45秒。
转录因子之间的系统发育关系
使用来自四个TF系列的蛋白质序列的最大似然法进行系统发育分析:C2H2,ERF,GRAS和NF-YA,在C. glauca.和A.糯。我们使用了实施的默认算法和设置www.philogeny.fr。简而言之,使用肌肉产生全长序列或保守结构域的基于蛋白质的对准[46.],然后使用Gblocks管理此对齐[47.]去除排列不整齐的位置和缝隙,用PhyML计算系统发育树[48.]. 用FigTree(“http://tree.bio.ed.ac.uk/software/figtree/”). 我们使用AT5G14010.1、AP2-R1、AT4G36710.1和AT2G37060.1为C2H2,ERF,GRAS和NF-YA树。基于DNA结合结构域的序列对准,用于ERF和NF-YA的序列比对,以及C的完整序列2H2和克拉斯。这四个TF家族的DNA结合结构域或蛋白质序列A. Thaliana.(http://planttfdb.cbi.edu.cn/index.php?sp=At)M截形(http://planttfdb_v1.cbi.pku.edu.cn:9010/web/index.php?sp=mt),L日本血吸虫(http://planttfdb_v1.cbi.pku.edu.cn:9010/web/index.php?sp=lj),G. Max.(http://planttfdb.cbi.edu.cn/index.php?sp=Gma),Cucumis sativus那波斯李那Malus Domestica.和Fragaria Vesca.(http://www.phytozome.net/search.php?show=blast& method=node_rosales-cucurbitales.)已添加到数据集。引导值表示100次重复的百分比。
附加文件
缩写
- 美东时间:
-
表达序列标签
- 聚合酶链反应:
-
聚合酶链反应
- 存在:
-
定量实时 - 聚合酶链反应
- TAIR:
-
拟南芥信息资源
- 爆破:
-
基本局部对齐搜索工具
- NCBI:
-
国家生物技术信息中心
- 日期:
-
拟南芥转录因子数据库
- CD:
-
编码序列
参考
- 1.
Perrine-Walker F,Gherbi H,Imanishi L,Hocher V,Ghodhebane-Gtari F,Lavenus J,Meriem Benabdoun F,Nambiar-Veetil M,Svistoonoff S,Laplaze L:Actinorhizal Symbiase中的共生信号传导。Curr蛋白Pept Sci。2011,12:156-164。10.2174 / 138920311795684896
- 2。
Santi C,Bogusz D,Franche C:非豆科植物的生物固氮。安·博特。2013,111:743-767。10.1093/aob/mct048。
- 3.
Pawlowski K,Demchenko KN:放射根共生的多样性。原生质体。2012年,249:967-979.10.1007/s00709-012-0388-4。
- 4.
Svistoonoff S,Hocher V,Gherbi H:放射根-根瘤共生体:关于结瘤起源的信号是什么?。植物生物学。2014,20C:11-18.10.1016/j.pbi.2014.03.001。
- 5。
Hocher V、Alloisio N、Auguy F、Fournier P、Doumas P、Pujic P、Gherbi H、Queiroux C、Da Silva C、Wincker P、Normand P、Bogusz D:放射根共生体的转录组学揭示了整个共同共生信号级联的同源物。植物生理学。2011年,156:700-711.10.1104/pp.111.174151。
- 6。
Demina IV,Persson T,Santos P,Plaszczyca M,Pawlowski K:放线根植物Datisca glomerata根瘤与根转录组的比较:放线根根瘤含有一类特殊的防御素。公共科学图书馆一号。2013年8月:e72442-10.1371/journal.pone.0072442。
- 7。
Tromas A, Parizot B, Diagne N, Champion A, Hocher V, Cissoko M, Crabos A, Prodjinoto H, Lahouze B, Bogusz D, laplize L, Svistoonoff S:内共生体的心脏:转录组学揭示了丛枝菌根、放线菌根和豆类-根瘤菌共生的保守遗传程序。PLoS ONE。2012年,7:e44742 - 10.1371 / journal.pone.0044742。
- 8。
Oldroyd GED,Harrison MJ,Paszkowski U:为内共生重新编程植物细胞。科学。2009年,324:753-754.10.1126/science.1171644。
- 9。
Schauser L,Roussis A,Stiller J,Stougaard J:控制共生根瘤发育的植物调节剂。自然。1999, 402: 191-195. 10.1038/46058.
- 10
helkmann AB, Sandal N, Bek AS, Madsen LH, Jurkiewicz A, Nielsen MW, Tirichine L, Stougaard J:细胞分裂素诱导荷花根瘤原基是受根皮质调控的。Mol植物微生物相互作用的MPMI。2011年,24:1385 - 1395。10.1094 / mpmi - 05 - 11 - 0142。
- 11
Marsh JF,Rakocevic A,Mitra RM,Brocard L,Sun J,eschstrauth A,Long SR,Schultze M,Ratet P,Oldroyd GED:截短苜蓿素对由自身活性钙/钙调素依赖性蛋白激酶诱导的根瘤非根瘤菌根瘤器官发生是必需的。植物生理学。2007年,144:324-335.10.1104/pp.106.093021。
- 12
Borisov AY、Madsen LH、Tsyganov VE、Umehara Y、Voroshilova VA、Batagov AO、Sandal N、Mortensen A、Schauser L、Ellis N、Tikhonovich IA、Stougaard J:豌豆根瘤发育所需的Sym35基因是日本莲中Nin的同源基因。植物生理学。2003年,131:1009-1017.10.1104/pp.102.016071。
- 13。
Soyano T,Kouchi H,Hirota A,Hayashi M:结瘤起始直接靶向NF-Y亚基基因,调控日本莲根瘤发育的基本过程。公共科学图书馆Genet。2013年9月:e1003352-10.1371/journal.pgen.1003352。
- 14。
Singh S,Katzer K,Lambert J,Cerri M,Parniske M:剑水蚤,一种DNA结合转录激活因子,协调共生根瘤的发育。细胞宿主微生物。2014,15:139-152。10.1016/j.chom.2014.01.011。
- 15.
Smit P,Raedts J,Portyanko V,DebelléF,Gough C,Bisseling T,Geurts R:GRAS蛋白家族的NSP1对根瘤菌Nod因子诱导的转录是必需的。科学。2005,308:1789-1791.10.1126/science.1111025。
- 16。
KalóP,Gleason C,Edwards A,Marsh J,Mitra RM,Hirsch S,Jakab J,Sims S,Long SR,Rogers J,Kiss GB,Downie Ja,Oldroyd Ged:豆类中的核磁信号传导需要NSP2,所以克拉斯转录调节因素系列。科学。2005,308:1786-1789。10.1126 / Science1110951。
- 17。
Cerri MR、Frances L、Laloum T、Auriac M-C、Niebel A、Oldroyd GED、Barker DG、Fournier J、de Carvalho Niebel F:截形苜蓿ERN转录因子:与NSP1/NSP2 GRAS因子的调控相互作用以及根瘤菌感染期间的表达动态。植物生理学。2012年,160:2155-2172.10.1104/pp.112.203190。
- 18。
Liu W、Kohlen W、Lillo A、Op den Camp R、Ivanov S、Hartog M、Limpens E、Jamil M、Smaczniak C、Kaufmann K、Yang W-C、Hooiveld GJEJ、Charnikhova T、Bouwmeester HJ、Bisseling T、Geurts R:截短苜蓿和水稻中的曲内酯生物合成需要共生的GRAS型转录因子NSP1和NSP2。植物细胞。2011年,23:3853-3865.10.1105/tpc.111.089771。
- 19。
DELAUX P-M,Bécardg,Combier J-P:NSP1是Myc信令路径的组件。新植物。2013,199:59-65。10.1111 / nph.12340。
- 20。
Laloum T, Baudin M, Frances L, Lepage A, Billault-Penneteau B, Cerri MR, Ariel F, Jardinaud M-F, Gamas P, de Carvalho-Niebel F, Niebel A:两个ccaat box-binding转录因子冗余调控豆科植物-根瘤菌内共生的早期步骤。中国生物医学工程学报,2014,33(3):457 - 461。
- 21。
Sinharoy S,Torres-Jerez I,Bandyopadhyay K,Kereszt A,Pislariu CI,Nakashima J,Benedito Va,Kondorosi E,Udvardi Mk:Symmiosome分化的C2H2转录因子调节因子抑制分泌途径基因Vamp721A的转录,促进了SymmioSome发育Medicago Truncatula。植物细胞。2013,25:3584-3601。10.1105 / TPC.113.114017。
- 22。
Andriankaja A,Boisson-Dernier A,Frances L,Sauviac L,Jauneau A,Barker DG,De Carvalho-Niebel F:AP2-ERF转录因子通过新颖的顺式调节基序介导点头依赖于根毛中的NOD系数依赖性MT Enod11活化。植物细胞。2007,19:2866-2885。10.1105 / TPC.107.052944。
- 23。
PYSH LD,Wysocka-Diller JW,Camilleri C,Bouchez D,Benfey PN:拟南芥GRAS基因家族:稻草人样基因的序列表征和基本表达分析。植物J细胞摩尔Biol。1999,18:111-119。10.1046 / J.1365-313x.1999.00431.x。
- 24。
田C,万P,Sun S,Li J,Chen M:水稻和拟南芥GRAS基因家族的基因组分析。植物mol biol。2004,54:519-532。10.1023 / B:计划500038256.89809.57。
- 25
Laloum T,De Mita S,Gamas P,Baudin M,Niebel A:CCAAT盒在植物中有结合转录因子:Y这么多?趋势植物SCI。2013,18:157-166。10.1016 / J.Plants.2012.07.004。
- 26
Wenkel S,Turck F,Singer K,Gissot L,Le gourierec J,Samach A,Coupland G:CONSTANS和CCAAT盒结合复合体共享一个重要的功能域并相互作用以调节拟南芥的开花。植物细胞。2006年,18:2971-2984.10.1105/tpc.106.043299。
- 27
Distelfeld A,Tranquilli G,Li C,Yan L,Dubcovsky J:四倍体小麦VRN2基因座的遗传和分子表征。植物理性。2009,149:245-257。10.1104 / pp.108.129353。
- 28
Lévesque-Lemay M,Albani D,Aldcorn D,Hammerlindl J,Keller W,Robert LS:生殖组织中CCAAT结合因子反义转录物的表达影响了植物生育能力。植物细胞代表2003,21:804-808。
- 29
Nakano T,Suzuki K,Fujimura T,Shinshi H:拟南芥和稻米ERF基因家族的基因组分析。植物理性。2006,140:411-432。10.1104 / pp.105.073783。
- 30.
冠军A,Hebrard E,Parra B,Bournaud C,Marmey P,Tranchant C,妮可M:棉花ERF转录因子的分子多样性和基因表达揭示了IXA成员对茉满红,乙烯和Xanthomonas的反应。莫尔植物途径。2009,10:471-485。10.1111 / J.1364-3703.2009.00549.x。
- 31
Asamizu E、Shimoda Y、Kouchi H、Tabata S、Sato S:通过对日本莲结瘤相关转录因子的系统分析,揭示了LjERF1在结瘤过程中的正调控作用。植物生理学。2008,147:2030-2040。10.1104/pp.108.118141。
- 32
Englbrecht CC,Schoof H,Böhm S:拟南芥基因组中C2H2锌指蛋白的保存、多样化和扩展。BMC基因组学。2004, 5: 39-10.1186/1471-2164-5-39.
- 33
Fujimoto SY,Ohta M,Usui A,Shinshi H,Ohme Takagi M:拟南芥乙烯反应元件结合因子作为GCC盒介导的基因表达的转录激活子或抑制子。植物细胞。2000年,12:393-404.10.1105/tpc.12.3.393。
- 34
OHTA M,Matsui K,Hiratsu K,Shinshi H,Ohme-Takagi M:II级ERF转录压缩机的镇压域分享了主动抑制的重要主题。植物细胞。2001,13:1959-1968。10.1105 / TPC.13.8.1959。
- 35
Frugier F,Poirier S,Satiat-Jeunemaîtreb,kondorosi a,crespi m:krüppel样锌指蛋白涉及氮固定根结节器官组织。基因开发。2000,14:475-482。
- 36
张H,金杰,唐L,赵y,顾x,高g,罗杰:planttfdb 2.0:更新和改进综合植物转录因子数据库。核酸RES。2011,39(数据库问题):D1114-D1117。10.1093 / nar / gkq1141。
- 37。
Oldroyd GED,Downie JA:豆科植物根瘤形态发生与根瘤菌感染的协调。植物生物学年鉴。2008年,59:519-546.10.1146/annurev.arplant.59.032607.092839。
- 38。
Moreau S,Verdenaud M,Ott T,Letort S,De Billy F,Niebel A,Gouzy J,De Carvalho-Niebel F,Gamas P:在Medicago Truncatula的根结节发育过程中转录重新编程。PLoS ONE。2011,6:e16463-10.1371 / journal.pone.0016463。
- 39。
Prém,atallah m,冠军a,de Vos M,PieterseCmj,Memelink J:AP2 / ERF域转录因子ORA59在植物防御中整合茉莉酸和乙烯信号。植物理性。2008,147:1347-1357。10.1104 / pp.108.117523。
- 40
程敏聪,廖沛民,郭文伟,林T-P:拟南芥乙烯反应因子1通过与不同顺式作用元件结合来调节非生物胁迫反应基因的表达,以响应不同的胁迫信号。植物生理学。2013年,162:1566-1582.10.1104/pp.113.221911。
- 41
WRKY转录因子在防御信号通路中的作用。中国生物医学工程学报,2007,(1):1 - 6。10.1016 / j.pbi.2007.04.020。
- 42
Kazan K:含耳型压缩机的防御和应激基因的负调节。趋势植物SCI。2006,11:109-112。10.1016 / J.Plants.2006.01.004。
- 43。
Smouni A、Laplaze L、Bogusz D、Guermache F、Auguy F、Duhoux E、Franche C:研究说明:35S启动子在转基因热带放线菌木麻黄中没有组成性表达。功能植物生物学。2002年,29:649-656.10.1071/PP01121。
- 44。
Hocher V,Auguy F,Argout X,Laplaze L,Franche C,Bogusz D:木麻黄放线根瘤和根的表达序列标签分析。新植物醇。2006年,169:681-688.10.1111/j.1469-8137.2006.01644.x。
- 45。
Alloisio N,Queiroux C,Fournier P,Pujic P,Normand P,Vallenet D,MédigueC,Yamaura M,Kakoi K,Kucho K:弗兰基亚Alni共生体转录组。Mol植物微生物相互作用的MPMI。2010年,23:593-607。10.1094 / mpmi-23-5-0593。
- 46。
edgarrc:MUSCLE:高精度和高通量的多序列比对。核酸研究,2004,32:1792-1797.10.1093/nar/gkh340。
- 47。
Castresana J:从多重比对中选择保守区块用于系统发育分析。分子生物学。2000年,17:540-552.10.1093/oxfordjournals.molbev.a026334。
- 48。
Dereeper A、Guignon V、Blanc G、Audic S、Buffet S、Chevenet F、Dufayard J-F、Guindon S、Lefort V、Lescot M、Claverie J-M、Gascuel O:Phylogeny.fr:针对非专家的强大系统发育分析。核酸研究2008,36(网络服务器问题):W465-W469。10.1093/nar/gkn180。
致谢
ID和AT得到了IRD南方科学社区能力建设部(IRD-DPF)的资助。我们感谢Mame Oureye Sy博士(UCAD)访问qPCR,感谢Katharina Pawlowski博士帮助我们寻找ZF1、ERN、NF-YA、NSP1和NSP2的同源序列格洛梅拉塔曼陀罗数据库。
作者信息
隶属关系
通讯作者
附加信息
相互竞争的利益
提交人声明他们没有竞争利益。
作者的贡献
ID、KG、AT和AC执行数据库搜索和分析数据。AC、MC、NA、PF、LC和VH进行QRT-PCR实验。ID、SS和AC进行系统发育分析。英国石油公司提供了分析工具。AT、VH、SS、HG、DD、LL和AC提供了想法和分析数据。LL和AC发起了这个项目,并设计了实验。ID、DD和AC获得资金。身份证,AT和AC写的手稿。所有作者在提交前都对手稿进行了评论和批准。
电子补充材料
潜在的转录因子
附加文件1:C. glauca.。(XLS 558 KB)
潜在的转录因子
附加文件2:A.糯。(XLS 324 KB)
推测转录因子在细胞中上调和下调
附加文件3:C. glauca.结节。(XLS 46 KB)
细胞内转录因子家族的分布
附加文件4:C. glauca.结节和mycorrhizae。(XLS 22 KB)
验证少数转录因子监管
附加文件5:C. glauca.和A.糯实时定量PCR检测结节。(XLS 34 KB)
转录组数据的RT-PCR验证。编号 = 未接种根 = 结核,核磁共振 = 非菌根与MR = 菌根。
额外的文件6:CGZF1 = C. glauca锌手指1,cgubi = c . glauca泛素(控制)。通过半定量RT-PCR证实来自CGZF1的微阵列的表达数据。表达库比构成并规范了CgZF1。(PPT 204 KB)
推测转录因子在细胞中上调和下调
额外的文件7:A.糯结节。(XLS 39 KB)
细胞内转录因子家族的分布
额外的文件8:A.糯结节。(XLS 30 KB)
推测转录因子在细胞中上调和下调
额外的文件9:C. glauca.mycorrhizae。(XLS 29 KB)
CGZF1和ZF1样蛋白的多序列比对
附加文件10:桤木、甜瓜、草莓、桃和Malus Domestica.。(文档46 KB)
调控转录因子的百分比
附加文件11:C. glauca.结节和mycorrhizae。(PPT 199 KB)
GRAS、NF-YA、ERF和C的蛋白质序列
附加文件12:2H2C1-2i TF用于产生系统发生树木。(文档34 KB)
作者的原始提交的图像文件
权利和权限
开放存取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。
本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。
如欲浏览本许可证的副本,请浏览https://creativecommons.org/licenses/by/4.0/。
知识共享公共领域放弃(https://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非信用额度中另有规定。
关于这篇文章
引用本文
Diédhiou,I.,Tromas,A.,Cissoko,M.等。鉴定Actinorhizal Symbioss的潜在转录调节因子Casuarina glauca.和糯桤木。BMC植物BIOL.14,342 (2014). https://doi.org/10.1186/s12870-014-0342-z
收到:
公认:
发表:
关键词
- 转录因素
- 共生
- Actinorhizal植物
- 信号通路
- C2H2转录因子