摘要
背景
利用更适合下游加工的木质纤维素生物质组成的植物工程对下一代生物燃料的生产具有很高的兴趣。木质纤维素生物质含有高比例的戊糖残基,它比己糖更难转化为燃料。因此,提高生物质中己糖/戊糖的比例是提高生物量的途径之一。利用基因工程方法研究了拟南芥纤维细胞细胞壁中果胶半乳糖的含量是否可以特异性增加,从而为易发酵的半乳糖提供了潜在的来源。
结果
首先,我们测试了过表达各种植物udp -葡萄糖4-外膜酶(UGEs)是否能增加udp -半乳糖的利用率,从而增加半乳糖的生物合成。在拟南芥植株中表达1个杨树UGE和3个拟南芥UGE并不能显著增加细胞壁结合半乳糖的数量。然后我们研究了在UGE2和β-1,4-半乳糖合成酶GalS1。Co-overexpression的在UGE2和GalS1导致拟南芥茎细胞壁半乳糖水平增加80%以上,提供了这些蛋白协同作用的证据。此外,在UGE2和GalS1的过表达与次级细胞壁生物合成的NST1主调控因子的过表达一起导致纤维细胞壁厚度增加以及细胞壁半乳糖水平升高。免疫荧光显微镜证实,增加的半乳糖以β-1,4-半乳糖的形式存在于次生细胞壁中。
结论
这种方法清楚地表明,同时过表达在UGE2和GalS1将细胞壁半乳糖增加到比单独过表达这些蛋白质中的任何一种都高得多的水平。此外,在改善生物量组成的同时,增加纤维细胞中半乳的含量对植物的生长发育没有影响,因此对总生物量没有影响。因此,我们可以证明,这里描述的基因堆叠方法是一种很有前途的方法,可以设计用于生物燃料生产的先进原料。
背景
植物细胞壁是由多糖组成的复杂结构,影响植物的形态、防御、生长和信号传导。它们还构成了地球上最丰富的生物材料,有可能为工业生物技术提供廉价糖的来源。在木质纤维素生物质中,细胞壁多糖主要由纤维素和葡萄糖醛酸氧酐组成,葡萄糖醛酸氧酐是一种半纤维素,嵌入高度交联的木质素聚合物中,保护多糖免受化学和酶的降解。半纤维素部分主要由戊糖(如木糖和阿拉伯糖)组成,这些戊糖不像己糖那样容易被酵母发酵成燃料。为了降低成本和提高生物燃料生产效率,改变细胞壁组成的工程植物的两个主要目标是通过减少木质素含量或改变木质素组成来减少顽固性[1]、[2]或减少葡萄糖醛酸的含量,同时增加由较大比例的可发酵己糖组成的多糖的含量[3.]。
β-1,4-半乳聚糖是鼠李糖半乳酸I的侧链,通常在木质纤维素生物质中含量不高。然而,由于β-1,4-半乳聚糖完全由半乳糖残基组成,可以很容易地通过酵母发酵,因此增加这种多糖的含量可能会改善生物燃料用途的生物质组成。在这项研究中,我们使用基因工程方法特异性地增加了干细胞壁中β-1,4-半乳聚糖的数量。
细胞壁多糖是由糖基转移酶合成的,糖基转移酶催化形成糖苷键形成糖苷。在这个过程中,来自活性糖底物的单糖被转移到糖基受体上。供体糖通常是核苷酸糖,而受体可以是寡糖或多糖、脂质、蛋白质、核酸或其他小分子[4]。近年来,拟南芥糖基转移酶GALACTAN SYNTHASE 1 (GalS1)被证实是一种β-1,4-半乳糖合成酶。在拟南芥野生型植物中,GalS1的组成性过表达导致叶片中细胞壁结合的半乳糖增加50% [5]。丧失功能的突变体Gals1或者它的同系物Gals2和Gals3叶中细胞壁结合的半乳糖比茎中减少得多[5],这表明茎中udp -半乳糖的供应可能受到限制。
核苷酸糖是由不同类型的相互转化酶合成的,如表戊二酶、脱羧酶和脱氢酶。这些酶大部分位于细胞质中,但也有一些在高尔基腔中[6]。核苷酸糖池的变化可以影响细胞壁多糖的生物合成,例如udp -葡萄糖脱氢酶(UGD)双突变体ugd2 / ugd3,其细胞壁阿拉伯糖、木糖、阿皮糖和半乳糖醛酸水平显著降低[7]。类似地,udp -木糖4-外聚酶(UXE)突变体mur4细胞壁阿拉伯糖减少了50%8]。
核苷酸糖udp -半乳糖由udp -葡萄糖通过udp -葡萄糖4-外甲酰基酶(UGE)形成。拟南芥中存在5种UGE同工酶(在UGEs),所有这些都已被功能表征在活的有机体内[9]-[11]。这五种基因的表达模式、动力学和氨基酸序列的差异在UGEs表明这些同工酶在植物中具有重叠但不相同的功能。已经产生了过表达uge的植物和敲除突变体,但每种uge的特定作用无法从这些实验中明确地得出结论。只有AtUGE4基因敲除突变体ROOT HAIR DEFICIENT(rhd1 / UGE4rhd1)产生一个可见的表型。的根uge4与野生型相比,突变体较短,由于木葡聚糖和II型阿拉伯半乳聚糖合成缺陷,根表皮细胞肿胀[10]、[12]、[13]。所有五个在在组成型花椰菜病毒35S启动子的控制下,UGEs可以挽救这种表型[9]。两倍,三倍,四倍在UGE突变体,Rösti等[10观察到生长缺陷和细胞壁组成的变化,这表明五种UGE同工酶的部分功能重叠。作者的结论是在UGE2和在UGE4影响营养物质生长和细胞壁碳水化合物的生物合成在UGE1和在UGE5在压力情况下行动在UGE3似乎对花粉发育很重要。对全球共表达谱的分析得出结论在UGE1和在UGE3与推测的海藻糖-6-磷酸合成酶基因共表达,而在UGE2,−4和−5与各种已知的糖基转移酶和其他细胞壁生物合成酶共表达,表明在UGE1和在UGE3可能优先作用于udp -半乳糖(UDP-Gal)到udp -葡萄糖(UDP-Glc)方向在UGE2,−4和−5可能在UDP-Glc到UDP-Gal方向上起作用在活的有机体内[9]。
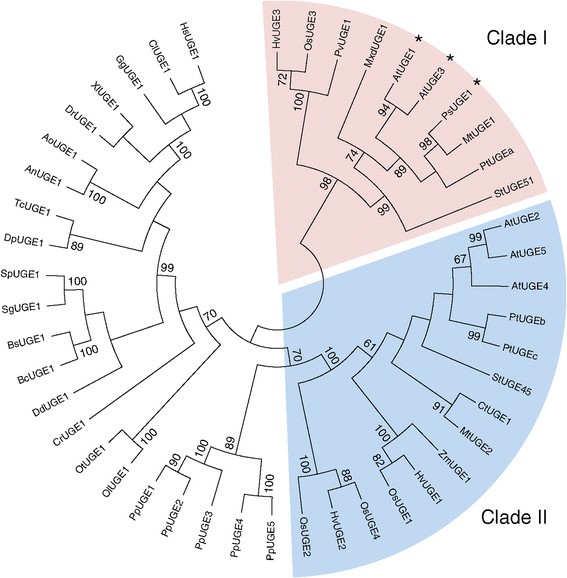
所有UGE同工酶都能将UDP-Glc和UDP-Gal相互转化在体外,尽管它们在底物亲和力和反应要求上有所不同[9]、[11]。有趣的是,两个同工酶,在UGE1和在UGE3也被证明能使udp -木糖(UDP-Xyl)和udp -阿拉伯糖(UDP-Ara)相互转化[11]。这种双功能性反映在氨基酸序列的不同上在乌盖斯。不同生物中UGE同源物的系统发育分析表明,植物中的UGE分布在两个植物特异性分支中在UGE1和在UGE3在进化枝I中组合在一起,而在UGE2,−4,和−5在进化枝II中组合在一起(图2)1).除了在UGE1和在UGE3,豌豆PsUGE1也被证明可以使UDP-Xyl和UDP-Ara相互转化[11]。PsUGE1也位于UGE分支I中,表明该分支包含额外的双功能UGE。两个马铃薯UGEs的过表达(圣UGE45和圣UGE51)导致马铃薯块茎细胞壁中半乳糖的增加[14与可用的UDP-Gal的数量而不是半乳糖转移酶的数量可能是细胞壁半乳糖积累的限制因素的假设相一致。
udp -葡萄糖4-表戊酶的枝状图。给出了不同生物中UGEs的系统发育关系。Kotake等人描述的两个维管植物UGE科[j]。11突出显示。已记录的UDP-Xyl - 4- epimase活性的uge用星号标记。该树是使用Neighbor-Joining方法生成的,该方法是从1000个重复(MEGA6程序)中推断出的bootstrap共识树。指示引导值大于60%。物种和加入编号在方法部分描述。
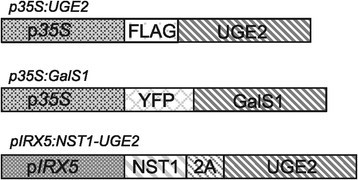
在本研究中,我们通过过表达拟南芥和杨树的不同UGEs,以提高细胞壁半乳糖水平,从而改善C6/ C5糖的比例。除了1个杨树和3个拟南芥UGEs组成性过表达外,我们还表达了1个拟南芥UGEs (在UGE2)受次级细胞壁特异性启动子pIRX5和主转录因子NST1的控制。IRX5是次级细胞壁中纤维素合酶复合体的催化亚基之一[15],其表达受转录因子NST1诱导[16]。pIRX5启动子下NST1的表达已被证明可以创建一个转录正反馈回路,增强次级细胞壁生物合成基因的整体表达,从而增加纤维细胞中的次级细胞壁沉积[2]。最后,本构和纤维特异性启动子在UGE2构建体在过表达半乳糖合成酶GalS1的转基因植物背景下表达[5]。
而单独表达四种uge中的任何一种都不会显著改变半乳糖含量,无论使用哪种启动子,共过表达在UGE2和GalS1导致茎细胞壁半乳糖含量增加高达80%。
结果与讨论
杨树trichocarpaUGEc是双功能的在体外
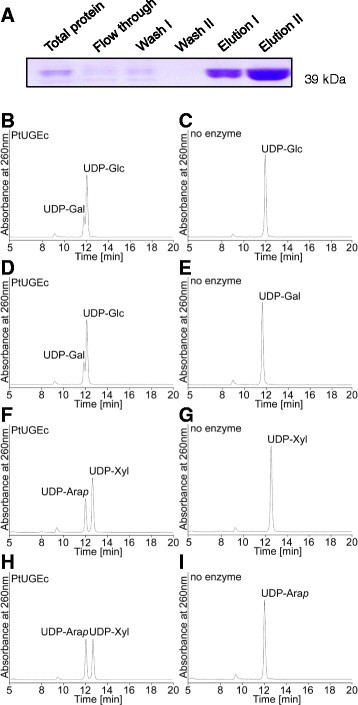
为了比较不同转基因基因在工程上的表现,我们首先从杨树中克隆了一个转基因基因,因为在生物燃料作物(如杨树)的工程方法上,使用杨树基因进行最终翻译可能是更好的选择。的uge编码杨树trichocarpa基因组,我们选择了一个,称为PtUGEc (XP_002299469, POPTR_0001s10700g)。由于其与非双功能序列的相似性较高在II级枝中优先参与将UDP-Glc相互转化为UDP-Gal的uge(图2)1),PtUGEc似乎是产生更多半乳糖的好选择。的在体外纯化的he -的活性PtUGEc(图2A)在不同核苷酸糖(UDP-Glc, UDP-Gal, UDP-Xyl, UDP-Ara)的反应中进行测试。孵育30分钟后udp -糖的比例表明PtUGEc酶具有双功能,可相互转化UDP-Glc和UDP-Gal,以及UDP-Xyl和UDP-Ara(图2)2B).酶促反应不需要添加NAD+,很可能是因为NAD的非共价结合和共纯化+和酶一起,就像大麦一样高压UGE1 [17]。在以UDP-Gal或UDP-Glc开始的反应中,最终的UDP-Gal和UDP-Glc浓度相同,表明达到了平衡水平。从UDP-Xyl和UDP-Ara开始的反应都没有完全达到平衡水平,这表明UDP-Xyl/UDP-Ara的反应速率比UDP-Gal/UDP-Glc的反应速率慢。的双功能酶特性PtUGEc对于属于II枝的UGE来说有些出乎意料,因为来自该枝的其他UGE已被发现对UDP-Glc/UDP-Gal相互转化具有特异性。然而,决定双功能与单功能的结构特征尚不清楚。
所有的UGE结构都是对UGE4rhd1表型
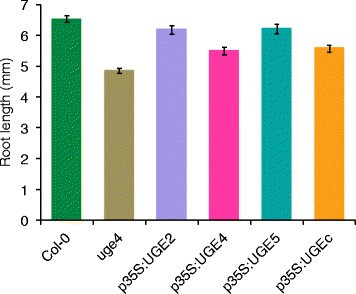
为了验证UGE结构的功能,PtUGEc和拟南芥在UGE2,在UGE4,在在花椰菜花叶病毒35S启动子调控下,UGE5蛋白在拟南芥中过表达uge4突变体的背景。的功能丧失UGE4导致根伸长率降低和根表皮细胞肿胀,这可能是细胞壁基质碳水化合物生物合成缺陷的结果[12]、[18]。因此,一个简单的视觉屏幕可以确认野生型表型的互补,从而不仅可以确定UGE蛋白的表达,还可以确定其功能。四种不同的UGE结构都抑制了根表皮的肿胀和根长度的缩短,证实了Barber等人先前发表的UGE互补结果。[9并证明杨树PtUGEc是功能性的在足底(图3.).然而,与野生型相比,我们的UGE过表达植株的根长略有减少,这表明互补并不完全。的表达在UGE2和在UGE5的结果是几乎完全互补。
过表达UGE的植株叶片和干细胞壁上的半乳糖含量均未增加
所有在UGE2,在UGE4,在UGE5或PtUGEc过表达拟南芥植株的生长表型与野生型Col-0和空载体对照植株相似。采用高效阴离子交换色谱-脉冲安培检测法(HPAEC-PAD)分析了植物叶片和茎中非纤维素多糖的单糖组成。在T2代中,每个构建体分析2 ~ 4个独立的转基因系。每个结构的代表行数据如图所示4。与空载体对照植株相比,转基因拟南芥UGE系叶片细胞壁的糖组成无明显变化(图2)4A)或在干细胞壁上(图4B)。
最近,我们发现了GalS1的过表达在足底可导致叶片中总细胞壁半乳糖显著增加40% [5]。因此,UDP-Gal底物似乎并不限制半乳糖进入叶片细胞壁,因此UGE酶相互转化的增加并不一定会导致细胞壁半乳糖的增加。
细胞壁结合的半乳糖水平在共过表达者的干细胞壁中增加
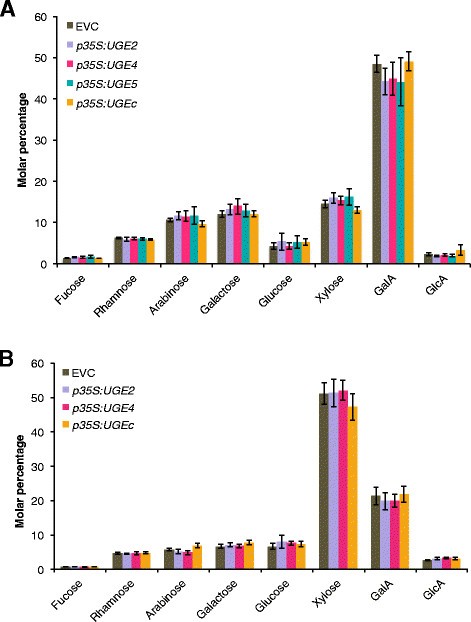
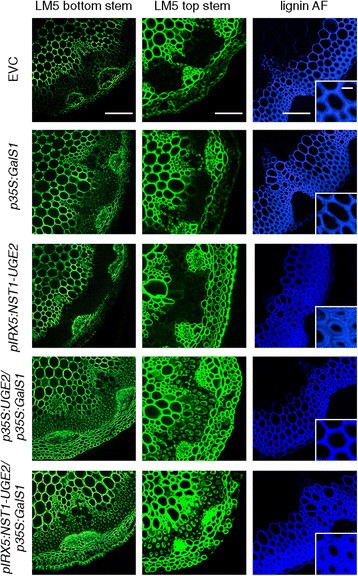
由于过度表达在UGE2,在UGE4,在UGE5或Pt单独使用UGEc并不会导致茎中总半乳糖的显著增加,我们通过共表达设计了一种基因堆叠方法在UGE2和半乳糖合成酶GalS1。之所以选择AtUGE2,是因为它能有效地互补uge4根表型(图23.).虽然我们最初倾向于使用杨树的UGE,但由于PtUGEc的双特异性和不完全互补能力,并不是一个好的选择uge4。我们设计了两种不同的结构在UGE2表达式。一个受35S启动子控制(p35区域:UGE2)和第二个特定纤维结构(pIRX5: NST1-UGE2).特定纤维结构是由IRX5启动子,此外还表达转录因子NST1,导致纤维细胞的正人工反馈回路和壁厚增加,如先前报道[2]。在这个构念中UGE2表达的是相同的吗pIRX5启动子,从NST1口蹄疫病毒的2A序列允许多种蛋白协调表达[19]。在T2代中,对每个构建的三个独立细胞系的干细胞壁组成进行分析。对于每个构建,独立线之间没有差异,在T3代中选择一条线进行结果确认(图2)5).的表达p35区域:UGE2和pIRX5: NST1-UGE2,分别在植物组成性过表达GalS1 (p35区域:GalS1)导致半乳糖水平显著升高(p≤0.01),从茎部细胞壁单糖组成分析可见(图2)5).而p35区域:UGE2 / p35区域:GalS1植物的半乳糖含量增加了80%以上pIRX5: NST1-UGE2 / p35区域:GalS1与空病媒控制(EVC)植物相比,半乳糖水平只增加了44%(图2)5).植物表达p35区域:GalS1单独使用时,茎壁结合的半乳糖含量只有轻微的增加,而在单独使用时,没有观察到半乳糖的增加pIRX5: NST1-UGE2构建被纳入野生型背景。植物中木糖含量明显增加pIRX5: NST1-UGE2在纤维细胞壁密度增加、木聚糖含量增加的植物中,NST1的反馈回路结构可能会过表达。但木糖含量与对照差异不显著(p > 0.05)。这些结果表明,GalS1限制了半乳糖在茎叶中的合成,而UGEs则不限制。然而,当GalS1过表达时,在UGE2或其他uge似乎限制了半乳在拟南芥植物茎部细胞壁中积累的数量。细胞壁半乳糖增加80%可能并不是我们所能达到的极限。由UGE2形成的UDP-Gal必须被运输到高尔基腔中供GalS1使用,当UGE2和GalS1都过表达时,运输可能会受到限制。最近,一种UDP-Gal转运蛋白URGT1已被表征,其过表达导致叶片细胞壁半乳氨酸增加[20.]。我们目前正在研究过表达转运蛋白与UGE2和GalS1的影响。
共过表达植物茎细胞壁单糖组成分析在UGE2和GalS1。T3代植株茎中单糖组成均有表达p35区域:GalS1或pIRX5: NST1-UGE2或者共同过度表达pIRX5: NST1-UGE2 / p35区域:GalS1或p35区域:UGE2/p35区域:GalS1是确定。单糖水平以摩尔百分比±SD表示(n = 5)。两种共表达结构显著增加了半乳糖水平(p≤0.01,用星号表示)pIRX5: NST1-UGE2 / p35区域:GalS1和p35区域:UGE2/p35区域:GalS1其他糖与空病媒控制植物(EVC)无差异(p > 0.05)。在T2代对每个结构的三个独立系进行分析,结果相同。数据分析采用两两t检验,家庭误差率采用Holm-Bonferroni校正。联欢晚会,α-d-galacturonic酸;GlcA,α-d-glucuronic酸。
的半乳糖的增加p35区域:UGE2 / p35区域:GalS1和pIRX5: NST1-UGE2 / p35区域:GalS1通过茎段免疫荧光显微镜进一步研究共过表达植物(图2)6).虽然免疫荧光显微镜不容易定量,但LM5半乳抗原表位的检测在黄芪的茎段和茎段的次生细胞壁中特异性增强p35区域:UGE2 / p35区域:GalS1和pIRX5: NST1-UGE2 / p35区域:GalS1的过表达子,与过表达子行相比p35区域:GalS1或pIRX5: NST1-UGE2单独,还是空矢量控制。此外,纤维特异性pIRX5的构建还导致细胞壁高度增厚,这是IRX5启动子下过表达NST1的结果,这是利用共聚焦显微镜通过木质素自身荧光观察到的6).一方面,这种生物质密度的增加对于提高木质纤维素生物能源生产的成本效益是非常可取的。然而,另一方面,木聚糖的增加反而导致更强的顽固性,并抵消了由于半乳糖沉积增加而获得的C6/C5糖比的增加。因此,未来可以通过同时下调纤维细胞中的木聚糖沉积来改善半乳聚糖过表达的实现。这可以通过使用缺乏木聚糖的突变体来实现,这些突变体通过将木聚糖生物合成重新引入木质部导管来补充,以恢复植物的野生型生长,如最近所述[3.]。可想而知,纤维细胞中的木质素含量也需要降低。
结论
救助uge4根表型证实了本构表达杨树的功能性p35区域:UGEc三种拟南芥p35区域:UGE2,p35区域:UGE4和p35区域:UGE5构造。四种UGE蛋白中的任何一种单独过表达都不会增加拟南芥叶片或茎中总细胞壁半乳糖含量。然而,我们的基因堆叠方法,结合过表达AtUGE2和GalS1的研究清楚地表明,有可能设计出半乳糖含量比乳糖含量更高的植物GalS1通过将多个过表达的基因组合到一个植株中来过表达植株。与野生型或空病媒控制植物相比,获得的拟南芥植株茎部半乳糖水平增加了80%以上。重要的是,这些转基因植物没有表现出生长和发育的损害。我们的研究表明,基因堆叠方法有望改善生物燃料应用特性的工程植物。
方法
系统发育分析
在MEGA6 [21]。采用自举一致树(bootstrap consensus tree)来表示用Neighbor-Joining方法分析的分类群的进化史。在bootstrap测试中,相关类群聚集在一起的复制树的百分比显示在只保留频率≥60%的类群的分支旁边。物种和基因库入库号为:黑曲霉[XP_001401007];在,拟南芥[AEE28928, UGE1;AEE84827 UGE2;AEE34065 UGE3;AEE34241 UGE4;AEE82951 UGE5);袄,米曲霉[XP_001827449];公元前蜡样芽胞杆菌[ZP_01180393];废话,枯草芽孢杆菌[P55180];Cl,犬属红斑狼疮[XP_544499];铬、衣藻reinhardtii[XP_001698706];Ct,Cyamosis tetragonoloba[O65781];弟弟,盘基网柄菌discoideum[XP_643834];Dp,Drosohila pseudoobscura[XP_001352806];博士,鲐鱼类[NP_001035389];Gg,背带吊裤带[XP_417833];海关,智人[Q14376];高压,大麦芽[AAX49504, UGE1;AAX49505 UGE2;AAX49503 UGE3);太,Medicago truncatula[ACJ85116, UGE1;ACJ84690 UGE2);Mxd,家蝇[BAF51705];Ol,Ostreococcus lucimarinus[XP_001419325];操作系统,栽培稻[BAF18426, UGE1;BAF23582 UGE2;BAF25641 UGE3;BAF24783 UGE4);不,Ostreococcus金牛座的[CAL54894];页,Physcomitrella金属盘[XP_001768301, UGE1;XP_001777464 UGE2;XP_001775163 UGE3;XP_001751529 UGE4;XP_001771084 UGE5);Ps,Pisum一[AB381885];Pt,杨树trichocarpa[XP_002304478, UGEa: XP_002303653, UGEb;XP_002299469;]雀稗vaginatum[BAE92559];Sg,链球菌gordonii[AAN64559];圣,茄属植物tuberosum[AAP42567, UGE45;AAP97493 UGE51);Sp,链球菌引起的肺炎[ZP_01825231];Tc,种有害castaneum[XP_968616];Xl,非洲爪蟾蜍光滑的[NP_001080902];Zm评选,玉米[AAP68981]。
植物材料和载体
所有拟南芥(l)Heynh。使用的野生型和突变型植物系为生态型Columbia-0 (Col-0)。的在UGE4突变uge4/rhd1-1(At1g64440, CS2257)从拟南芥生物资源中心(ABRC,http://www.arabidopsis.org).过表达YFP-GalS1的植物(p35区域:GalS1)已被描述[5]。杨树trichocarpaNisqually-1叶片组织由Lee Gunter博士(橡树岭国家实验室)捐赠。入口向量包含AtUGE2,AtUGE4和AtUGE5从ABRC中获得cDNA (At4g23920, At1g64440, At4g10960)和gateway兼容的植物转化载体pMDC32和pMDC43。目标载体pTKan-pIRX5-GWR3R2制作方法如下[1],但它有attR2和attR3重组位点。用于产生转基因植物的基因构建如图所示7。
载体的生成和植物的转化
使用Phusion Polymerase (Thermo Scientific),引物fU2-F, fU2-R (在UGE2);4- f, 4- r (AtUGE4);fU5-F, fU5-R (在UGE5);和f - f, f - r (PtUGEc)(表1),并利用Gateway技术(Life Technologies)克隆到载体pMDC32和pMDC43中。表达的纤维在UGE2构建分两步生成。首先将编码NST1-2A-AtUGE2融合蛋白的序列组装在网关pDON-P3P2载体(Life Sciences)上,生成pDON-NST1-2A-AtUGE2-L3L2质粒。利用In-Fusion HD克隆系统(Clontech)构建pDON-NST1-2A-AtUGE2-L3L2载体,组装PCR产物在UGE2和pDON-L3L2矢量包含NST1-2A编码序列(由GenScript, Piscatway, NJ合成),使得编码序列为在将UGE2插入到NST1-2A的3 '端和attL2序列的5 '端。在用Phusion Polymerase分别用ntU2-F/ntU2-R引物对和F-pDON-attL2/R-pDON-NST1-2A引物对合成UGE2和pDON-NST1-2A-L3L2 PCR产物。然后通过LR重组(Life technologies)将融合的NST1-2A-AtUGE2基因从pTKan-pIRX5-GWR3R2中转移,在纤维特异性pIRX5启动子的控制下表达NST1-2A-AtUGE2。PtUGEc cDNA是从杨树叶组织中分离的RNA中合成的。RNA使用RNeasy Plant Minikit (Qiagen)提取,DNase I (Sigma)处理,cDNA使用iScript™Reverse Transcription Supermix (Biorad)生成。克隆的UGE开放阅读框经测序证实与已发表的序列一致(见图2)1查询登记号码)。的稳定变换答:芥野生型Columbia-0,uge4/rhd1-1突变体或GalS1过表达系,将构建体转化为农菌株C58-1 pGV3850和植株采用花浸法转化[22)(表2).在含有潮霉素的MS培养基上选择转化体,转移到土壤中。证实表达转基因的植株在T2和T3代进行了繁殖和进一步鉴定。
植物生长条件和测量
所有植株在120 μmol m的光周期中生长14 ~ 16 h−2年代−1光子通量密度。根长测量植株垂直生长在MS板上,发芽后6天进行扫描。利用ImageJ对约50株幼苗的根长进行了测量[23]。
细胞壁单糖组成分析
将5周龄植物的茎段(茎长5cm)或整片叶片在液氮中研磨,制备乙醇不溶性残留物(AIR),并按所述进行酶解淀粉[24]。脱浆后的AIR样品(1 mg)用2 M三氟乙酸(TFA)水解,用HPAEC-PAD测定单糖组成,方法如下[25]、[26]。
他的表达和净化PtUGEc
Pt将UGEc导入到含有n端6xhis标签和IPTG诱导启动子的pDEST17表达载体(Invitrogen)中。在BL21 Star细胞(Invitrogen)中加入终浓度为1 mM的IPTG诱导基因表达,并在18°C下培养过夜。PtUGEc采用HIS-Select镍亲和凝胶纯化(Sigma-Aldrich)从裂解细胞微球的上清液中纯化。使用含有0.2 mg/ml溶菌酶、50 U/ml苯并酶(均为Sigma-Aldrich)和蛋白酶抑制剂鸡尾酒(罗氏)的CelLytic B 2X进行细菌细胞的裂解。HIS-taggedPtUGEc用PD-10脱盐柱(Amersham Biosciences)脱盐。样品30 μg His-PtUGEc蛋白在Novex 8-16% Tris甘氨酸梯度凝胶(Invitrogen)上分离,考马斯亮蓝染色。
他- - - - - -PtUGEc活性测定
5 μg纯化的he -PtUGEc与1 mM udp -葡萄糖在50 mM Tris-HCl (pH 8.0)中混合,1 mM DTT在30°C下混合30分钟。在90°C下孵育10分钟,定量前通过0.45 μm过滤器(Millipore)过滤,终止反应。为了测试更多的核苷酸糖底物,使用如上所述的相同反应混合物,用UDP-Gal, UDP-Xyl或UDP-Ara取代UDP-Glc。所有反应均采用纯化蛋白在90°C下煮沸10分钟的阴性对照。终止反应中udp -糖的分离和定量采用HPAEC分析,使用Dionex Ultimate 3000系统(Thermo Fisher),检测波长为262 nm。样品在CarboPac PA20柱(Thermo Fisher)上分离,并根据Rautengarten用甲酸铵梯度洗脱等。[27]。标准溶液含有UDP-Glc、UDP-Gal(均为Sigma Aldrich)、UDP-Ara和UDP-Xyl(均为Carbosource Service)作为参考。
Immunofluorence显微镜
收获6周龄植株(每行3根茎)主茎的顶部和基部3cm,在4°C固定液(4%多聚甲醛,50 mM哌嗪- n - n ' -bis(2-乙磺酸),5 mM EGTA, pH 6.9)中固定过夜。将固定的茎切片包埋在7%琼脂糖中,使用徕卡VT1000S振动器进行切片。茎段用单克隆LM5兔抗体(PlantProbes, Leeds, UK)标记,该抗体识别1,4-链β-半乳糖[28]。根据Verhertbruggen等人的方法进行标记。[29]。切片装在载玻片上,使用LSM 710共聚焦显微镜(卡尔蔡司)拍照。用405nm二极管激光监测木质素自身荧光。使用Zen软件包(卡尔蔡司)获取图像,并使用ImageJ进行分析[23]。
缩写
- 联欢晚会:
-
α-D-galacturonic酸
- GlcA:
-
α-D-glucuronic酸
- GalS1:
-
半乳糖体SYNTHASE1
- GT:
-
糖基转移酶
- 望远镜:
-
NAC二次壁增厚促进因子
- 南京:
-
NAM ATAF1/2和CUC2
- 虽然算法:
-
UDP-glucose 4-epimerase
- UDP:
-
尿苷二磷酸
参考文献
Eudes A, George A, Mukerjee P, Kim JS, Pollet B, Benke PI, Yang F, Mitra P, Sun L, Cetinkol OP, Chabout S, Mouille G, Soubigou-Taconnat L, Balzergue S, Singh S, Holmes BM, Mukhopadhyay A, Keasling JD, Simmons BA, Lapierre C, Ralph J, Loque D:木质素侧链截断单体的生物合成和结合,减少木质素聚合和增强糖化。植物学报,2012,31(2):444 - 444。10.1111 / j.1467-7652.2012.00692.x。
杨峰,Mitra P, Zhang L, Prak L, Verhertbruggen Y, Kim JS,孙磊,郑凯,唐凯,Auer M, Scheller HV, Loque D:植物二次细胞壁沉积工程。华北农学报,2013,31(1):1 -3。10.1111 / pbi.12016。
杨芳,刘杰,刘建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军。木聚糖生物合成突变体对植物生物燃料性能的影响。生物技术与生物燃料,2012,5:84-10.1186/1754-6834-5-84。
李建军,李建军,李建军,等。糖基转移酶的研究进展。生物化学学报,2008,37(4):521-555。10.1146 / annurev.biochem.76.061005.092322。
Liwanag AJ, Ebert B, Verhertbruggen Y, Rennie EA, Rautengarten C, Oikawa A, Andersen MC, Clausen MH, Scheller HV:拟南芥果胶生物合成:GALS1是β -1,4-半乳糖-1,4-半乳糖转移酶。植物学报,2012,24:5024-5036。10.1105 / tpc.112.106625。
Bar-Peled M, O 'Neill MA:植物核苷酸糖的形成、相互转化和糖回收。植物学报,2011,32(2):779 - 779。10.1146 / annurev - arplant - 042110 - 103918。
rebol R, Geserick C, Pabst M, Frey B, Wittmann D, Lutz-Meindl U, Leonard R, Tenhaken R:糖醛酸生物合成下调导致植物细胞壁膨胀和果胶多糖变化相关的严重发育缺陷。生物化学学报,2011,28(6):398 - 398。10.1074 / jbc.M111.255695。
王晓明,王晓明,王晓明,等。拟南芥中l -阿拉伯糖的合成及其在植物中的应用。植物学报,2003,15(5):523-531。10.1105 / tpc.008425。
王晓东,王晓东,王晓东,王晓东,等。拟南芥芽胞苷-葡萄糖/半乳糖- 4-甲酰基酶异构体的研究。生物化学学报,2006,28(1):17276-17285。10.1074 / jbc.M512727200。
Rösti J, Barton CJ, Albrecht S, Dupree P, Pauly M, Findlay K, Roberts K, Seifert GJ: udp -葡萄糖4-外旋酶异构体UGE2和UGE4协同提供udp -半乳糖的细胞壁生物合成和生长拟南芥。植物学报,2007,19(3):559 - 559。10.1105 / tpc.106.049619。
高武,高田,高田,高田,高田,高田,高田,金田,金田,松冈,高山,王晓明,王晓明,Tsumuraya Y:糖醛酸苷-葡萄糖4-外链酶在植物体内的作用。中国生物医学工程学报,2009,24(4):559 - 567。10.1042 / BJ20091025。
张建军,张建军,张建军,张建军。半乳糖在拟南芥细胞壁合成中的应用。中国生物医学工程学报,2002,12(2):444 - 444。10.1016 / s0960 - 9822(02) 01260 - 5。
引用本文:Nguema-Ona E, Andeme-Onzighi C, Aboughe-Angone S, Bardor M, Ishii T, Lerouge P, Driouich A:拟南芥reb1-1突变。对含半乳糖细胞壁多糖结构和定位的影响。植物生理学报,2006,35(4):557 - 557。10.1104 / pp.105.074997。
Oomen RJFJ, Dao-Thi B, Tzitzikas EN, Bakx EJ, Schols HA, Visser RGF, Vincken JP:过表达两种不同的马铃薯UDP-Glc 4-外膜酶可提高马铃薯块茎细胞壁的半乳糖含量。植物科学学报,2004,32(1):397 - 3104。10.1016 / j.plantsci.2003.12.033。
高等植物中纤维素的生物合成和沉积。中国生物医学工程学报,2008,31(2):369 - 369。10.1111 / j.1469-8137.2008.02385.x。
Mitsuda N, Iwase A, Yamamoto H, Yoshida M, Seki M, Shinozaki K, Ohme-Takagi M: NAC转录因子NST1和NST3是拟南芥木本组织次生壁形成的关键调控因子。植物学报,2007,19(3):779 - 779。10.1105 / tpc.106.047043。
张强,Hrmova M, Shirley NJ, Lahnstein J, Fincher GB:大麦(Hordeum vulgare L.) udp - d -葡萄糖4-外膜酶的基因表达模式及催化性能。中国生物医学工程学报,2006,31(4):394 - 394。10.1042 / BJ20051329。
王晓明,王晓明,王晓明,等。拟南芥芽胞细胞形态、半乳糖蛋白表达和表皮微管组织的变化。植物学报,2002,25(5):949-958。10.1007 / s00425 - 002 - 0836 - z。
杨建军,杨建军,杨建军,杨建军,杨建军。转基因植物中多蛋白协同表达的研究进展。植物学报,1999,17:453-459。10.1046 / j.1365 - 313 x.1999.00394.x。
Rautengarten C, Ebert B, Moreno I, Temple H, Herter T, Link B, Doñas D, Moreno A, samuzz - aguayo S, Blanco MF, Mortimer J, Schultink A, Reiter WD, Dupree P, Pauly M, Heazlewood JL, Scheller HV, Orellana A:拟南芥高尔基体udp -鼠李糖/ udp -半乳糖转运蛋白家族。美国国家科学促进会。科学通报,2014,31(2):563- 568。10.1073 / pnas.1406073111。
田村K, Stecher G, Peterson D, Filipski A, Kumar S: MEGA6:分子进化遗传学分析版本6.0。中华生物医学工程学报,2013,30(3):725- 729。10.1093 / molbev / mst197。
郭文杰,李文杰,李文杰,等。农杆菌介导的拟南芥转化方法的研究进展。植物学报,1998,16:735-743。10.1046 / j.1365 - 313 x.1998.00343.x。
张建军,张建军,张建军。基于图像处理的图像处理方法。生物光子学,2004,(11):36-42。
Harholt J, Jensen JK, Sorensen SO, Orfila C, Pauly M, Scheller HV:阿拉伯糖基转移酶1参与拟南芥果胶阿拉伯糖合成。植物生理学报,2006,35(4):559 - 559。10.1104 / pp.105.072744。
Øbro J, Harholt J, Scheller HV, Orfila C:龙骨块茎中含有复杂的阿拉伯半乳聚糖结构。植物化学学报,2004,35(5):529 - 538。10.1016 / j.phytochem.2004.05.002。
Yin L, Verhertbruggen Y, Oikawa A, Manisseri C, Knierim B, Prak L, Jensen JK, Knox JP, Auer M, Willats WG, Scheller HV:拟南芥正常发育需要CSLD2、CSLD3和CSLD5的协同活动。植物学报,2011,41(4):1024-1037。10.1093 / mp / ssr026。
Rautengarten C, Ebert B, Herter T, Petzold CJ, Ishii T, Mukhopadhyay A, Usadel B, Scheller HV: UDP-arabinopyranose和UDP-arabinofuranose在拟南芥植株发育中相互转化是必需的。植物学报,2011,4:1373-90。10.1105 / tpc.111.083931。
张晓明,张晓明,张晓明,等。番茄果胶半乳聚糖(1- > 4)- β - d -半乳聚糖单克隆抗体的克隆及应用。植物生理学报,1997,26(3):559 - 561。
杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军:阿拉伯糖多糖在植物细胞壁发育过程中的应用。植物学报,2009,29(4):413- 422。10.1111 / j.1365 - 313 x.2009.03876.x。
致谢
这项工作由联合生物能源研究所进行,由科学办公室、生物和环境研究办公室支持,通过劳伦斯伯克利国家实验室和美国能源部签订的DE-AC02-05CH11231合同。RS得到了德国研究基金会(Deutsche Forschungsgemeinschaft)研究金的支持。BE的经费由丹麦战略研究委员会提供。我们感谢Sherry Chan女士对植物生长的协助和Lee Gunter博士为杨树的cDNA纯化提供材料。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
本文中描述的部分策略已包含在HVS作为发明人的专利申请中。其余的作者声明他们没有竞争利益。
作者的贡献
HVS设计并协调了这项研究;VMG、RS、AJML、BE、DL、CR进行实验;VMG、RS、BE、CR、HVS进行数据分析;VMG, RS和HVS撰写稿件,所有作者阅读并批准最终稿件。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。
本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。
如欲查阅本许可证副本,请浏览https://creativecommons.org/licenses/by/4.0/。
创作共用公共领域免责声明(https://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
冈道夫,v.m.,斯托佩尔,R.,艾伯特,B.。et al。基因堆叠方法导致拟南芥中半乳糖水平高度增加的工程植物。BMC Plant Biol14,344(2014)。https://doi.org/10.1186/s12870-014-0344-x
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-014-0344-x
关键字
- 植物细胞壁
- UDP-glucose 4-epimerase
- 半乳糖体
- 果胶
- 拟南芥
- 杨树
- 基因叠加
- GalS1
- NST1
- 人工正反馈回路