摘要
背景
黄酮类3′,5′-羟化酶(F3′5′h)是茶树黄烷-3-醇合成中的重要分支点酶,属于CYP75A亚家族,可催化黄酮、黄酮、二氢黄酮醇和黄酮醇转化为3′,4′,5′-羟化衍生物。然而,b环羟基化是否发生在黄酮和/或二氢黄酮醇的水平上,在活的有机体内仍然是未知的。
结果
的茶树F3 ' 5'H(CsF3的5是什么)基因从茶cDNA文库中分离得到。表达模式分析显示CsF3的5是什么表达具有组织特异性,在芽中表达量很高,在根中表达量极低。CsF3的5是什么光照和蔗糖增强了表达。表达的CsF3的5是什么产生新的飞燕色素衍生物,增加转基因烟草花冠中花青素衍生物的含量,使转基因烟草的花色更深。为了证实CsF3’5’h酶的功能,我们在酵母中进行了CsF3’5’h酶的异源表达在体外。修饰后的异源表达CsF3的5是什么(CsF3的5是什么基因融合葡萄信号肽,FSI结果表明,4′-羟化黄酮(柚皮素,N)是CsF3′5′h的最佳底物,可有效转化为3′4′-和3′4′5′-两种形式。3 ' 4 ' 5 ' -羟基化产物与3 ' 4 ' -羟基化产物的比例投资策略基金会转基因细胞显著高于VvF3的5是什么细胞。
结论
CsF3 ' 5 ' h是茶树合成三羟基黄烷-3-醇的关键调控分子,能有效地将4 ' -羟化黄烷酮转化为3 ' 4 ' 5 ' -和/或3 ' 4 ' -羟化产物。这些发现为进一步研究茶树类黄酮的生物合成提供了重要依据。这些研究将有助于加速类黄酮代谢工程,以提高b环三羟基产物的产量。
背景
黄酮类化合物是天然存在于植物中的多酚类抗氧化剂,具有重要的药理活性,包括抗氧化、抗诱变、抗癌和抗菌等特性。1]。大多数高等植物中的类黄酮可分为六个主要亚群:查尔酮、黄酮、黄酮醇、黄烷-3-醇(儿茶素)、花青素和原花青素(PAs,也称为缩合单宁、黄烷-3-醇和黄烷-3,4-二醇聚合物)[2]。
类黄酮B环的结构是类黄酮抗氧化活性的主要决定因素[3.],黄酮类化合物根据其b环的羟基化模式可分为3个亚类,包括b环4′-羟基化、3′- 4′-二羟基化和3′- 4′- 5′-三羟基化化合物。b环上羟基的数量影响抑制脂质过氧化的能力[4]、[5]。例如,Liu和Yang报道,当浓度高达100 mg·L时,表没食子儿茶素-3-没食子酸酯(EGCG)的抗氧化活性大于表没食子儿茶素(ECG)−1[6]。
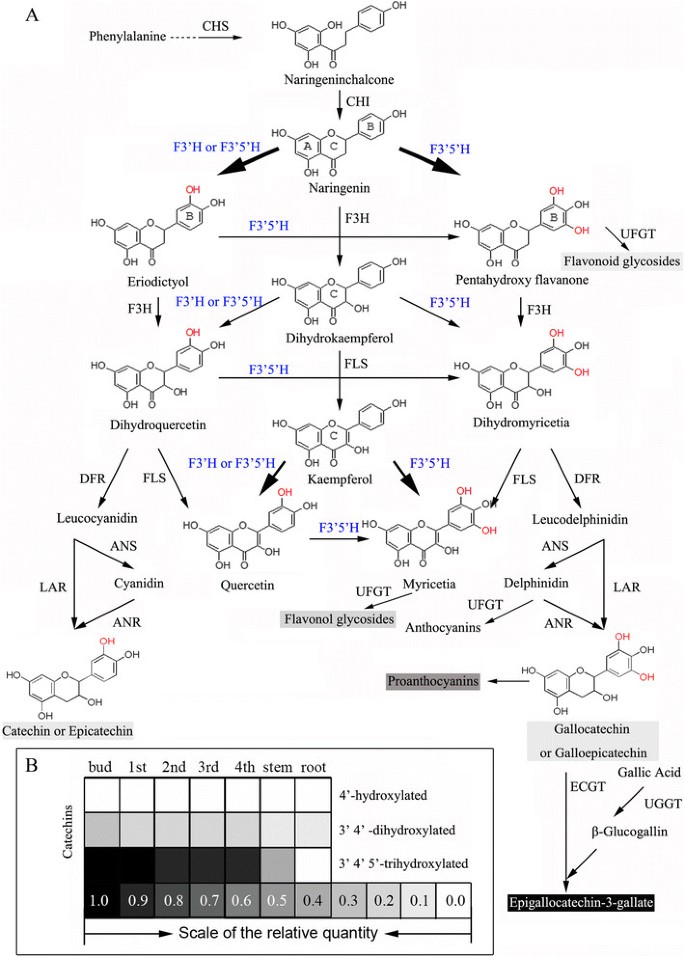
在类黄酮生物合成途径中,b环的羟基化模式由两种依赖细胞色素p450的单加氧酶(p450)决定:类黄酮3′-羟化酶(F3′,5′-羟化酶)和类黄酮3′,5′-羟化酶(F3′,5′)。F3’5’h对5’位的羟基化是一个特别重要的步骤,它决定了植物中形成的b环三羟基类黄酮终产物(EGCG或delphinidin),如图所示1。
黄酮类化合物的生物合成途径及终产物积累茶树。(一)类黄酮的生物合成途径。CHS,查尔酮合成酶;查尔酮异构酶;F3H,黄酮3-羟化酶;F3'H,类黄酮3 ' -羟化酶;F3 ' 5 ' h,类黄酮3 ',5 ' -羟化酶;DFR,二氢黄酮醇4还原酶;FLS,黄酮醇合成酶;LAR,白花青素还原酶;ANS,花青素合成酶; ANR, anthocyanidin reductase; UFGT, UDP-glycose flavonoid glycosyltransferase; UGGT, UDP-glucose galloyl-1-O-β-D-glucosyltransferase; ECGT, epicatechins: 1-O-galloyl-β-D-glucose O-galloyltransferase;(B)不同类黄酮化合物的相对含量。不同类黄酮化合物相对量数据引用自Jiang (Jiang XL, 2013)。
F3’5是什么S先前已从多种植物中克隆并进行了功能分析,包括葡萄(葡萄) [7]、[8]、牵牛花(佩妮矮牵牛)、骁龙(金鱼草majus) [9]、金银花(Pericallis矮牵牛) [10],西红柿(茄属植物lycopersicum) [11],大叶长春花(长春花大) [12]和土豆(茄属植物tuberosum) [13]。通过在转基因植物和酵母中的异源表达,F3 ' 5'Hs被证明可以羟基化多种类黄酮底物,包括柚皮素(N)、二氢山奈酚(DHK)、山奈酚(K)和芹菜素[8]、[14]。然而,这些酶的最佳底物仍有待确定。
茶(茶树)是一种重要的商业作物,其叶子可以加工成流行的无酒精饮料。由于类黄酮含量高,流行病学和病理学研究表明,喝茶可能对人类癌症有潜在的保护作用[15]、[16]和高血压[17],并有助于减轻体重[18]。黄酮类化合物的总浓度约为茶叶干质量的12-24% [19]。我们之前已经证明,儿茶素是茶叶中含量最多的类黄酮之一,其次是原花青素(PAs)、黄酮醇、黄酮和花青素(图2)1) (20.]、[21]。近年来,一些类黄酮结构和调控基因被克隆出来,并对这些基因的功能进行了研究[22]-[25]。
虽然4 ' -羟基儿茶素在茶叶中非常罕见或检测不到[22]、3’4’5’-三羟基儿茶素(没食子儿茶素(GC)、EGC和EGCG)是幼叶和茎中含量最高的黄酮类化合物,其浓度明显高于3’4’-二羟基儿茶素(儿茶素(C)、表儿茶素(EC)和ECG)(图2)1B).因此,表征B环羟基化模式显然对了解茶树类黄酮的生物合成有重要贡献。
然而,目前还不可能制备活性膜结合F3 ' 5'H酶茶树目前尚不清楚b环羟基化是否发生在黄酮和/或二氢黄酮醇的水平上,在活的有机体内。旨在分析在活的有机体内研究CsF3 ' 5'H的表达模式,并对该基因的功能进行表征在体外,我们将CsF3的5是什么茶cDNA文库中的基因。我们发现CsF3的5是什么在萌芽时高度表达,但表达很少或没有CsF3的5是什么在根目录中检测到。CsF3的5是什么光照和蔗糖处理均能增强表达,过表达CsF3的5是什么与野生型相比,转基因烟草产生了飞燕草素衍生物,花的颜色更红。修饰的异源表达CsF3的5是什么酵母实验结果表明,4′-羟化黄酮(柚皮素,N)是CsF3′5′h的最佳底物,改性后的3′4′5′-与3′4′-羟化产物的比例CsF3的5是什么转基因细胞显著高于对照VvF3的5是什么细胞。
结果
菌株的分离与鉴定CsF3的5是什么基因
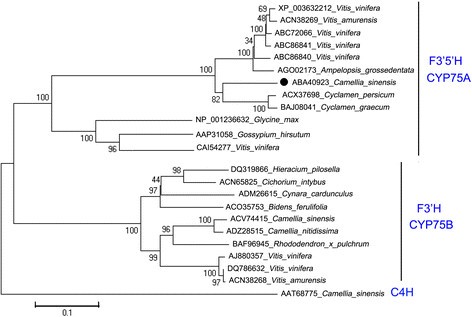
Cs的F3’5是什么从3号茶叶cDNA文库中成功克隆出该基因(NCBI cDNA accession number: DQ194358, protein number: ABA40923),编码510个氨基酸残基。对编码序列进行BLAST检索(NCBI),结果显示83,82和81%的同源性仙客来persicum(ACX37698)、仙客来(BAJ08041)和葡萄(XP_003632212)基因。系统发育树(图22)利用NCBI数据库中检索到的几种植物F3’5’h和F3’h酶的蛋白质序列生成。该树显示F3 ' h和F3 ' 5 ' h分别属于CYP75B和CYP75A簇。CsF3’5’h被归为CYP75A亚家族,与的F3’5’h酶关系最为密切仙客来persicum,仙客来graecum和葡萄。
的表达模式CsF3的5是什么在茶
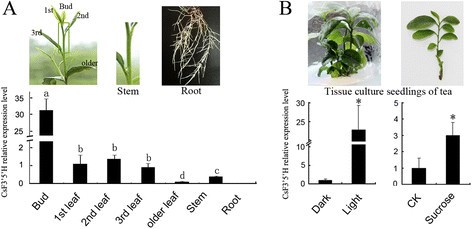
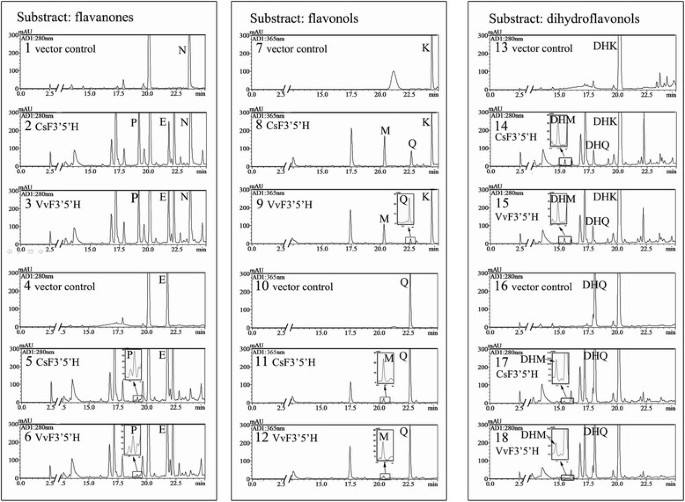
的表达模式CsF3的5是什么用qRT-PCR法检测茶叶中的GADPH基因(登录号:FS952640),预期表现为组成型表达模式,作为对照[21]。CsF3的5是什么表达具有组织特异性,在叶和茎中表达量高(图2)3.A,在芽中转录物达到顶峰。我们还评估了茶叶粗提取物的底物特异性,测量了N和二氢槲皮素(DHQ)的羟基化,分别产生了Eriodictyol (E)和二氢杨梅素(DHM)(图2)4)。粗提物酶活性分别为0.072和0.023 pcat·g−1蛋白质,分别。令人惊讶的是,N的羟基化并没有产生3 ' 4 ' 5 ' -羟基化产物(5,7,3 ',4 ',5 ' -五羟基黄酮,P)。
有趣的是,CsF3的5是什么茶树根中几乎检测不到转录本,3’4’-二羟基儿茶素单体和聚合物(EC和ECG)在茶树根中积累,而3’4’5’-三羟基儿茶素未在茶树根中积累[21,表示极低CsF3的5是什么这种表达可能直接导致根中b环三羟基儿茶素的缺失。
我们用茶树种子胚培养的组培苗来评价光照和蔗糖对茶树幼苗生长的直接影响CsF3的5是什么表达式。CsF3的5是什么在光照和蔗糖诱导的幼苗中,表达量分别显著提高了22.69倍和3.00倍(图2)3.B,表明CsF3的5是什么光照和蔗糖均能有效诱导表达。
CsF3 ' 5'H基因的功能分析烟草
35S本构表达向量:CsF3的5是什么基因被引入烟草G28 (烟草' G28 '),缺乏F3 ' 5'H基因,花呈粉红色[26]。获得了20株独立的转基因烟草植株。大多数转基因植株的花呈现出明显的颜色变化,从宿主的淡粉色到洋红色(图2)5一个)。
转基因烟草CsF3’5’h和qRT-PCR过表达后的花色。(一)野生型(CK)和CsF3’5’h转基因烟草花(1号系)。(B)烟草花的野生型(CK), CsF3 ' 5'H转基因(1、3、9和15号系)和CK和转基因系花CsF3 ' 5'H的qRT-PCR。(C)对照和1号系烟草花中花青素(530 nm)和黄酮醇苷(340 nm)的HPLC图谱;2:自保”;3:槲皮素-3- o -芦丁苷,4:山奈酚-3- o -芦丁苷)。(D)CK、CsF3’5’h转基因(1、3、9、15)烟草花中花青素含量及病媒控制数据代表三个独立测量的平均值±SD。(E)CK、CsF3’5’h转基因(line1、Line3、line9)和载体对照中烟草花类黄酮相关基因的qRT-PCR分析*表示P < 0.05显著水平。#表示各检测系与CK(野生型和病媒对照)比较显著水平。
的表达式CsF3的5是什么用qRT-PCR检测了几个品红花转基因品系的基因,其中品红花的基因为β肌动蛋白(登录号:EU938079)作为参比基因(图5B, E),我们发现不同程度的CsF3的5是什么基因在抗草甘膦转基因烟草中的表达。探讨过表达的黄酮是否会影响黄酮的生物合成途径CsF3的5是什么类黄酮途径基因(CHS(查尔酮合成酶,登录号:AF311783),气(查尔酮异构酶,登记号:KJ730247), F3H(黄烷酮3-羟化酶,登记号:AF036093), F3'H(类黄酮3′-羟化酶,登记号:KF856279), DFR(二氢黄酮醇4-还原酶,登记号:EF421430), FLS的(黄酮醇合成酶,登记号:DQ435530),答(花青素合成酶,登记号:JQ866631),一定(花青素还原酶,登记号:XM_009786976), UFGT(UDP-glycose类黄酮糖基转移酶,注册号:GQ395697)烟草对野生型(G28)和转基因系进行qRT-PCR检测。的表达水平Chs, f3h, ans, anr, ufgt与野生型和病媒对照相比,转基因系中基因数量显著增加(图2)5E),提示转基因系中CsF3’5’h的过表达刺激了这些基因的表达。
采用反相高效液相色谱(HPLC)和液相色谱-质谱(LC-MS)法测定花中糖基化黄酮类化合物的含量。在转基因株系的花瓣中检测到3 ',5 ' -羟基化黄酮醇冰苷(myricetin-3-O-rutinoside, MYR),但在野生型烟草(G28)中未检测到。然而,花中MYR的浓度太低,无法量化(图2)5C)。
采用反相高效液相色谱法提取花瓣色素,化学转化为花青素,对花青素成分进行分析。表达CsF3 ' 5 ' h基因的花瓣含有一种新的3 ',5 ' -羟基化花青素(delphinin, DEL),并增加了氰化(CYA)衍生物的含量。在转基因烟草植株中,飞鸽素占总花青素化合物的比例最高可达31.09% (line-1,图)5D),转基因烟草花瓣中花青素的平均浓度比野生型高出1.51倍,说明CsF3’5’h编码一种具有b环3’,5’-羟基化功能的蛋白,CsF3’5’h在转基因株系中过表达可刺激花青素的合成。
不齐的CsF3的5是什么酵母中的表达
酵母菌株酿酒酵母WAT11,设计用于过度表达拟南芥P450还原酶[27],是P450表达的合适异源宿主[11]、[28]。将pYES-DEST 52a CsF3 ' 5'H载体转化为WAT11。然而,这些转基因细胞并没有产生功能性的F3’5H蛋白(图2)6),因此设计了密码子优化的酵母CsF3 ' 5'H序列(yCsF3 ' 5'H)并转化为WAT11,其活性仅为0.9 pkat·L左右−1培养,以N为底物。
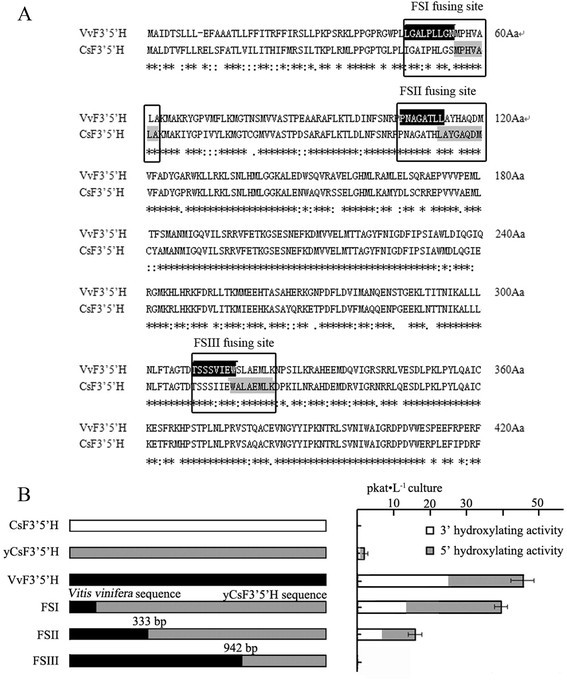
转基因细胞,藏着葡萄F3 ' 5'H(VvF3 5是什么,NCBI cDNA加入号:XM_003632164)基因,获得了48.00 pkat·L的高总F3’5’h活性−1以N为底物培养。用预测的信号肽,两者都有F3’5是什么被翻译成前体蛋白并传递到内质网。我们假设不完美的识别茶树信号肽可能是在酿酒酵母细胞,并通过融合来验证这个假设CsF3的5是什么与VvF3的5是什么基于氨基酸序列同源性,在序列的三个不同点(图2)6A)。yCsF3 ' 5 ' h的5 ' -序列分别在55 Aa (Fusion sequence I, FSI)、153 Aa (Fusion sequence II, FSII)、308 Aa (Fusion sequence III, FSIII)处被VvF3 ' 5 ' h取代。
葡萄序列被融合到yCsF3的5是什么克隆到质粒pYES-DEST 52a中转化WAT11细胞。含有FSI的细胞在信号区和前导肽区被替换,导致F3 ' 5'H活性高,在39.26 pkat·L范围内−1与参考构念(yCsF3 ' 5'H)相比,显著增加(图2)6B),这些结果表明CsF3的5是什么信号肽可能无法完全识别酿酒酵母细胞。FSII转化的细胞也产生了F3’5’h活性,但明显较低(在12.37 pkat·L范围内)−1文化)。一般情况下,嵌合体的整体活性往往较低,如柠檬烯3-羟化酶与柠檬烯6-羟化酶的嵌合体,大多数达到野生型嵌合体的5%以下[29]。出乎意料的是,在FSIII转化的细胞中未检测到F3 ' 5'H活性。相比之下VvF3的5是什么FSIII融合基因仅在3′端序列发生改变。
最后,我们评估了表达FSI和FSI细胞的底物特异性VvF3的5是什么。基于前人的发现和儿茶素合成途径中的其他中间化合物,我们评估了N、E、K、槲皮素(Q)、DHK、DHQ、天竺葵苷(PEL)、CYA和C的催化作用(图1)7、附加文件1:图S1,表1)。以pYES-DEST 52a载体转化的WAT11细胞为对照。通过VvF3 ' 5'H观察到,FSI更倾向于b环4 ' -羟基化化合物(包括N, K和DHK)而不是3 ',4 ' -羟基化化合物(包括E, Q和DHQ)。以PEL、CYA和C为底物,在两种转基因细胞中均未检测到活性。这两种蛋白对N的活性最高,对K和DHK的活性显著,产物为3 ' 4 ' -和3 ' 4 ' 5 '。有趣的是,对于以N为底物的FSI, 3 ' 4 ' 5 ' -与3 ' 4 ' -羟基化产物的比例(2.07:1)显著高于VvF3 ' 5 ' h(0.98:1)。
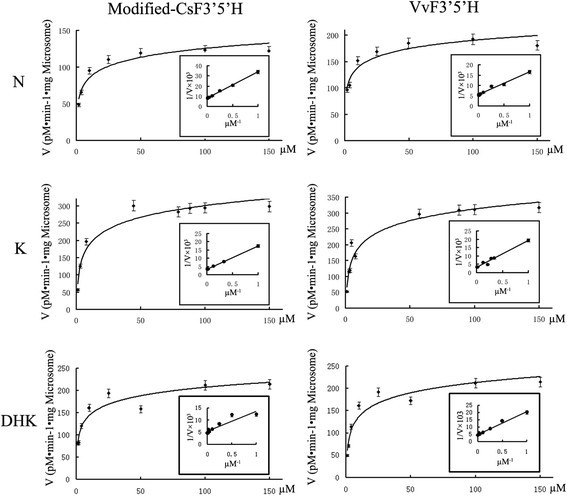
pYES-DEST 52a -转化WAT11细胞微粒体投资策略基金会和- - - - - -VvF3的5是什么以N、K和DHK为底物,检测nadph依赖性类黄酮3′,5′-羟基化。对照的pYES-DEST 52a转化细胞的微粒体未检测到活性。相比之下,K米提取的微粒体的值投资策略基金会以N、K、DHK为底物的转化细胞,分别为3.22 μM、4.33 μM、3.26 μM(表2)2,图8),表明N可能是CsF3’5’h酶的最佳底物。FSI取得了显著较高的K值米值比以K和DHK为底物时的VvF3′5′h高,但K较低米而最大反应速率(V马克斯)与以K和DHK为底物的FSI和VvF3 ' 5'H的值显著低于以K和DHK为底物的值。
讨论
的作用CsF3的5是什么在茶叶中的儿茶素形成中
所有的类黄酮在b环的4 '位置被羟基化。b环羟基化模式决定了花青素的颜色,因此在观赏植物颜色工程中得到了广泛的研究。F3 ' 5'H基因通常被称为蓝色基因[30.],先前的研究表明F3 ' 5 ' h催化黄酮类化合物在3 '和5 '位置的羟基化,从而确定b环的羟基化模式[28]。
黄酮类化合物是茶叶中重要的次生代谢产物,占鲜叶和嫩茎干重的18% ~ 36%。3 ',4 ',5 ' -三羟基化黄烷-3-醇(儿茶素)是茶叶中含量最多的黄酮类化合物,其含量明显高于3 ' 4 ' -二羟基化儿茶素。儿茶素的合成代谢和分解代谢过程是动态的,受到复杂的调控,但由于缺乏易于评估的报告基因,F3 ' 5'H基因活性与儿茶素相对含量之间的联系尚不清楚。
在这里,我们证明了CsF3的5是什么基因在叶和茎中高度表达,但在根中表达极低,如先前报道[25]。我们在前期研究中发现茶树根中b环黄酮醇和黄烷-3-醇缺乏三羟基,表明CsF3 ' 5'H参与控制茶树中三羟基黄烷-3-醇的合成。
我们发现CsF3的5是什么基因转录在芽期达到峰值,我们无法解释CsF3 ' 5'H在叶片终产物积累中的作用。大部分黄酮类化合物如没食子酸儿茶素、PAs和花青素含量在芽或第一片叶中最高,随着叶片的发育逐渐下降[21]。这些结果表明,F3 ' 5'H的表达与茶叶中黄酮类化合物终产物的积累密切相关。
光照或蔗糖处理7 d后,CsF3’5’h表达量显著升高,表明CsF3的5是什么光照和蔗糖均能有效诱导表达。克隆分析显示CsF3的5是什么基因启动子包含几个光响应启动子元件(未显示),进一步表明光可能是控制的关键因素CsF3的5是什么转录。
CsF3’5’h转基因烟草花青素积累
野生型烟草花冠中的主要花青素是花青素[31]。如上所示,大多数转基因植物花瓣都含有海豚蛋白。有趣的是,转基因烟草植株中的花青素和海豚素含量显著高于野生型植株,这表明CsF3’5’h同时进行了3’、5’-和3’-羟基化在活的有机体内,与F3’5’hs的异源表达结果一致Pericallis×矮牵牛[10]塞内西奥·克伦图斯[32],牛头草[9]和茄属番茄[11]。然而,b环的羟基化模式无法通过烟草转基因实验来阐明。类黄酮途径是植物体内一个复杂的代谢网络,从一般的苯丙素代谢开始,产生无数的终产物。类黄酮生物合成的酶可能作为多酶复合物起作用,促进活性位点的直接转移或通道[33]。因此,包括游离黄烷酮和黄烷醇在内的中间体的总体浓度极低vivo[2]。
CsF3的5是什么转基因烟草植株比野生型植株的花更深更红。qRT-PCR结果显示,黄酮类途径基因包括Chs, f3h, ans, anr, ufgt在转基因系中,CsF3’5’h过表达可以刺激。F3 ' 5'H是这些途径中至关重要的微粒体细胞色素P450酶,可能有助于将复合物固定在微膜上[33]。因此,我们的结果表明CsF3的5是什么可能通过形成更多的酶复合物来刺激烟草花瓣中花青素产物的代谢通量。
然而,在这项研究中,转基因系没有产生蓝色的花。这些发现表明,蓝花并不一定是通过控制花青素含量而产生的[34]。事实上,先前的研究报道花青素含量、共色素、金属离子类型和浓度、液泡pH、花青素定位和表面细胞形状都对最终的花朵颜色有影响[35]。然而,我们的发现确实揭示了一个明显的影响CsF3的5是什么花表型上的基因。该基因可应用于观赏植物花色的分子设计。
CsF3 ' 5'H在酵母中的异源表达
为了进一步证实CsF3’5’h酶在类黄酮途径中的催化作用,我们在酵母中进行了CsF3’5’h的异源表达。据我们所知,茶树F3 ' 5'H该基因此前尚未在酵母中成功表达。为了在酵母中有效表达CsF3 ' 5'H,设计了一个密码子优化的酵母CsF3 ' 5'H序列(yCsF3 ' 5'H),但仅检测到少量活性。通常,n端信号肽的存在可以将P450蛋白转运到内质网(ER)。我们进一步优化yCsF3的5是什么通过将n端序列替换为来自于VvF3的5是什么基因。幸运的是,转基因细胞表达融合F3’5是什么基因的F3’5’h活性较高,表明CsF3的5是什么可能在酿酒酵母细胞。出乎意料的是,另一个融合基因(FSIII)仅在3 '端序列发生了变化VvF3 5是什么,未达到可检测的F3 ' 5'H活性。这些结果表明,F3’5’h具有酶活性的区域可能位于F3’5’h的c端。事实上,之前的报告已经表明,两者的功能差异F3'H和F3’5是什么由c端决定[36]。
F3 ' 5 ' hs已被证明可以羟基化广泛的类黄酮底物,包括N, DHK, K和芹菜素,可能允许形成3 ',4 ' -和3 ',4 ',5 ' -羟基化的类黄酮。然而,F3 ' 5'H酶的最佳底物需要进一步确定,在活的有机体内和在体外。F3 ' 5'H酶Catharanthus roseus也叫和矮牵牛花柚皮素和芹菜素的活性最高[37], N和DHK同样被羟基化Osteospermum矮牵牛F3 ' 5'H,而F3 ' h来自非洲菊矮牵牛表现出对N [36]。相比之下,番茄的F3 ' 5'H基因(茄属植物lycopersicum)偏爱柚皮素,以K开头米1.20 μM [11]。
为了评估CsF3’5’h (FSI)的底物特异性,选择黄酮(N和E)、黄酮醇(K和Q)、二氢黄酮醇(DHK和DHQ)、花青素(PEL和CYA)和儿茶素(C)作为底物。4′-羟化黄酮(N)是CsF3′5′h酶的最佳底物,可有效转化为3′4′-和3′4′5′-两种形式。有趣的是,以N为底物的FSI转基因细胞中,3 ' 4 ' 5 ' -与3 ' 4 ' -羟基化产物的比例显著高于VvF3 ' 5 ' h细胞。修改CsF3的5是什么因此,基因可以调节类黄酮代谢,提高特定b环三羟基产物的产量。
基质的广泛接受与多种途径通向相同中间体的可能性是一致的,并且竞争可能发生在vivo。所使用的基材在活的有机体内大多尚未被精确识别[37]。我们还检测了茶叶总酶提取物的b环羟基反应模式。有趣的是,以N为底物时,未检测到3 ' 4 ' 5 ' -羟基化黄酮产物(P),仅检测到3 ' 4 ' -羟基化产物(E)。目前尚不清楚产物P是否可以有效地转化为其他终产物或产物E是由另一个P450基因(F3'H)合成的。因此,需要进一步的分析来进一步描述b环羟基化的机制在活的有机体内。
结论
在这项研究中CsF3的5是什么从茶cDNA文库中分离到该基因。系统发育分析显示茶树F3 ' 5'H这个基因属于CYP75A亚家族。qRT-PCR分析表明CsF3的5是什么在芽中高度表达,但在根中表达很少。CsF3’5’h的过表达导致转基因烟草花冠产生新的飞鸽苷衍生物,增加了花青素衍生物的含量,使转基因烟草的花更深、更红。为了证实CsF3’5’h酶的功能,我们在酵母中进行了CsF3’5’h酶的异源表达在体外。修饰y的异源表达CsF3的5是什么酵母的FSI结果表明,4′-羟基化黄酮柚皮素是CsF3′5′h酶的最佳底物;柚皮素有效地转化为3 ' 4 ' -和3 ' 4 ' 5 ' -形式。重要的是,3 ' 4 ' 5 ' -羟基化产物与3 ' 4 ' -羟基化产物的比例在改性y中明显更高CsF3的5是什么转基因细胞比VvF3’5’h细胞多。本文的研究结果为更好地理解……的作用提供了基础茶树类黄酮b环羟基化的F3 ' 5'H;在体外和在活的有机体内。
方法
植物材料
的样本茶树简历。蜀砂(品种批准号:CHN20022008),产自中国合肥安徽农业大学实验茶园(北纬31.86,东经117.27,海拔20 m)。收集5个不同时期的叶片(芽、第1叶、第2叶、第3叶、老叶)、茎和根,速冻在液氮中,保存在- 80°C。
采用健康组培苗进行光照和蔗糖诱导试验。幼苗在含3%蔗糖的N6培养基中正常明暗循环(光/暗:14 h/10 h)培养,每隔20天将约5 g(鲜重)转移到新鲜培养基中进行继代培养。从光处理和蔗糖处理中选择6个单独的培养瓶。光处理时,暴露于50±5 μmolm−2年代−1光照(冷白色,55 W, Philips,荷兰)7天,用铝箔覆盖的培养瓶作为全暗对照。对于蔗糖处理,将幼苗在上述培养基或添加90mm /L蔗糖的培养基中继代培养7天。通过三个独立的实验,从叶片中分离总RNA,进行实时定量聚合酶链反应(qRT-PCR)。用canon 600D相机(Cannon, Japan)拍摄茶树幼苗形态。
酵母菌(酿酒酵母简历。WAT11)和烟草品种(烟草简历。G28),分别由Conagen Inc (Bedford, MA, USA)和中国科学技术大学(合肥,中国安徽)提供。
端到端聚合酶链反应
对NCBI数据库中的CsF3’5’h基因进行标准的端到端PCR反应,引物根据cDNA序列设计(由Invitrogen公司合成,上海,中国;额外的文件2:表1)。端到端PCR用Phusion®高保真DNA聚合酶(New England Biolabs, USA)合成cDNA链。PCR产物使用MiniBEST琼脂糖凝胶提取试剂盒(Takara,大连,中国)进行凝胶纯化,连接到pMD18-T载体上,转化为大肠杆菌DH5α能态细胞测序。使用DNAMAN 7软件(Lynnon, Canada)对结果进行汇总。简单地说,端到端PCR在以下条件下进行:98°C 30秒,98°C 30秒,58°C 10秒,72°C 40秒,最后在72°C延长10分钟。
qRT-PCR表达验证
总RNA从茶树根据制造商的说明,使用RNAiso Plus (Takara,大连,中国)和RNAiso-mate for Plant Tissue (Takara,大连,中国)的器官。
所有引物均针对NCBI数据库进行blast,以保证特异性。根据管家基因甘油醛-3-磷酸脱氢酶的表达水平将值归一化(GAPDH)在茶树[21]和烟草中的肌动蛋白[38]。采用PrimeScript®RT reagent Kit (Takara, DaLian, China)合成qRT-PCR的首链cDNA样品。PCR混合物含有cDNA模板(约0.01 μg/μL), SYBR Green PCR Master Mix (Takara) 10 μL, 200 nmolL−1每个基因特异性引物的终体积为20 μL。使用CFX96™光学反应模块(Bio-Rad, USA)进行实时PCR: 95°C 30 s,然后在96孔光学反应板中95°C 5 s和60°C 30 s(根58°C 30 s)进行40个循环。通过熔化曲线分析(55-95°C)验证扩增特异性。数据以三个重复的平均值表示,根据GAPDH或actin的表达水平归一化。相对表达式由2——ΔΔCt方法。△CT= CT,目标- cT,内部标准,−△△CT=−(△CT,目标-△CT,控制), where CT,目标和CT,内部标准分别为目标基因和管家基因的周期阈值。
烟草CsF3’5’h转基因植株的转化
使用Gateway®克隆系统构建由Xiang教授提供的载体[39[中国科学技术大学]CsF3的5是什么端到端PCR获得PCR产物,并连接到pMD18-T载体上。的CsF3的5是什么- pMD18-T质粒在大肠杆菌DH5α菌株作为PCR模板。用于连接atb适配器的PCR引物对在附加文件中列出2表S1。纯化PCR产物,转移到pMD18-T上,测序确认。根据制造商的说明书(Invitrogen, USA),使用Gateway®BP Clonase®Enzyme mix将正确的质粒克隆到进入载体pDONR207中。得到的pDONR207-克隆在庆大霉素板上选择,并通过限制性内切酶酶切验证。然后使用Gateway®LR Clonase™(美国Invitrogen公司)将进入载体转移到Gateway植物转化目的载体pCB2004中。重组菌落pCB2004-CsF3’5是什么在卡那霉素平板上选择pCB2004和对照pCB2004载体,用限制性内切酶酶切验证,然后在2500 V下电穿孔转化EHA105,时间约5.5 ms。
用PCR方法确定了含有每个目标构建体的单个菌落,并将其用于烟草的遗传转化。EHA105-pCB2004 -CsF3的5是什么与eha105 -空pCB2004分别接种于含有50 mg/L卡那霉素和50 mg/L大观霉素的LB液体培养基中。细胞在28°C的黑暗中生长,200 rpm至OD, 20-22 h600= 0.6,离心(6000 rpm, 10 min)成球,用含有100 μmol/L乙酰丁香酮(Sigma, R40456)的MS液洗涤两步。烟叶转化采用叶盘法,选择25 mg/L的硫代膦[40]。
酵母菌株的构建酿酒酵母用于CsF3 ' 5'H表达的' WAT11 '载体
PCR产物VvF3 5是什么,FS, FSII, FSIII通过端到端PCR获得,凝胶纯化,并使用Top克隆连接到pENTR™/TEV/D-TOPO载体上(pENTR™/TEV/D-TOPO®克隆试剂盒,Invitrogen,美国)。然后,入口向量pENTR-VvF3 5是什么,pENTR -CzyF3 5 'h-1,pENTR -CzyF3”5 'h-2,和pENTR-CzyF3”5 'h-3使用Gateway®LR Clonase™酶(Invitrogen, USA)将其克隆到目的载体pYES-dest52上。得到的pYES-dest52-VvF3 5是什么,pYES-dest52 -投资策略基金会,pYES-dest52 -FSII,和pYES-dest52-FSIII都变成了酿酒酵母WAT11使用frozen - ez酵母转化II™(美国zimo研究公司)。
酵母细胞在含20 g/l葡萄糖的10 ml SD-U液体培养基中,28℃培养12 h,从SGlu平板上接种一个菌落。将收集的菌体转移到含有20 g/l半乳糖的10 ml SD-U培养基中,28℃培养5 h。
为了进行底物特异性实验,将N、E、DHK、DHQ、K和Q分别加入酵母培养物中,最终浓度为5 μM,在28°C下孵育10 h。通过超声处理15 min并加入乙酸乙酯终止反应。每个反应的产物用10 ml乙酸乙酯提取3次,蒸发后再溶解于150 μl甲醇中,在280 ~ 370 nm范围内进行HPLC分析。
微粒体的制备
在酵母培养物中,通过添加半乳糖来指示蛋白质的合成,并用MgCl制备微粒体酵母部分2正如奥尔森所描述的等。[11]。根据Bradford法估计蛋白质量。微粒体溶解于1.0 ~ 1.5 ml TEG(30%甘油在50 mM Tris-HCl中加入1 mM EDTA)冰中。所有缓冲液/溶液和离心机预冷至4°C。
酶萃取茶树
2 g左右的茶叶在液氮下均质,以0.1 mol / l提取总蛋白−1含有等量PVPP的磷酸盐缓冲盐水(PBS, pH 7.4),然后在4°C下,15000g离心10分钟。用上清液评价F3’5’h活性。采用考马斯亮蓝G-250分光光度法测定酶提取物的蛋白质浓度。
酶化验
所有酶分析均在磷酸盐缓冲液中进行。在多酶结合反应体系中,F3 ' 5'H检测溶液在28°C下孵育30分钟(对于微粒体)或1小时(对于粗酶提取物),在100 mM磷酸盐缓冲液(pH 7.0)中,含有1 mM NADPH, 1 - 300 μM底物。加入乙酸乙酯终止酶反应。各反应产物用等体积乙酸乙酯提取3次,蒸发后再溶解于500 μl甲醇中,在280 ~ 370 nm范围内进行HPLC分析。
类黄酮色素的制备与分析
用1.6 ml含20%水的甲醇从约500 mg冷冻烟草花中提取花青素苷元。4℃,6000 g离心5 min后,用等体积的乙酸乙酯提取3次上清液,将提取物加入1/3体积的4 M HCl水溶液中,90℃,热处理1 h,在530 nm处HPLC检测水解产物。
HPLC和MS分析
在UPLC-QQQ-MS/MS (Waters 2478, Waters Instruments)上,干燥气流量为12 L min,在负电离模式下,在175 V破碎电压下,在m/z 100 ~ 2000范围内进行电喷雾电离,获得质谱−1,干燥气体温度350℃,雾化器压力35psi,毛细管电压3500v。
高效液相色谱由带真空脱气器的四元泵、恒温柱室、自动进样器和二极管阵列检测器(DAD)组成。采用Phenomenex Synergi 4u Fusion-RP80色谱柱(5 μm, 250*4.6 mm),流速1.0 mL min−1。柱箱温度设定为25℃。流动相为1%醋酸水溶液(A)和100%乙腈(B)。梯度在5 min时从0 - 10% B (v/v)线性增加,在15 min时为15% B,在20 min时为40% B,在22 min时为60% B,并保持在10% B至25 min。DAD设置在280和340 nm,实时监测峰强度。在200 ~ 600 nm范围内连续记录紫外光谱,用于植物成分鉴定。
其中N、E、P、DHK、DHQ和DHM在280 nm处定量,K、Q和杨梅素(M)在365 nm处定量。除P外,所有产品均通过质谱(MS)和峰面积与标准品进行鉴定和定量。由于没有5,7,3 ',4 ',5 ' -五羟基黄酮的标准样品,因此采用LC-MS鉴定P,并以E为摩尔当量定量其相对浓度。所有样本一式三份进行定量和多元统计分析。
生物信息学和统计分析
系统发育树是利用MEGA5的ClustalW软件从NCBI数据库中检索到的几种植物F3’5’h、F3’h和肉桂酸4-羟化酶(C4H)的蛋白质序列构建而成的(系统发育树的加入号见图)2)。根据邻域连接法构建了系统发育树。在少于50%的引导复制中复制的分区对应的分支崩溃。进化距离采用p-distance法计算。在MEGA5(网页:http://www.megasoftware.net/)。
数据以三个独立测量值的平均值±标准差表示。用Student 's测定组间差异的统计学意义t-使用SPSS软件(SPSS, Chicago, IL, USA)进行检验。P < 0.05为差异有统计学意义。
支持数据
支持本文结果的数据集包含在本文(及其附加文件)中。从NCBI网站上检索到的几种植物F3’5’h、F3’h和C4H酶的cDNA和蛋白序列(http://www.ncbi.nlm.nih.gov/)。
附加文件
缩写
- ANR:
-
花青素还原酶
- 答:
-
花青素合成酶
- C:
-
儿茶素
- C4H:
-
肉桂酸4-羟化酶
- 气:
-
查耳酮异构酶
- CHS:
-
查耳酮合酶
- DFR:
-
Dihydroflavonol 4-reductase
- DHK:
-
Dihydrokaempferol
- DHM:
-
Dihydromyricetin
- DHQ:
-
Dihydroquercetin
- 艾凡:
-
圣草酚
- F3H:
-
黄烷酮3-hydroxylase
- F3'H:
-
类黄酮3 ' -羟化酶
- F3’5是什么:
-
类黄酮3 ',5 ' -羟化酶
- 读者:
-
黄酮醇合成酶
- 凯西:
-
山柰酚
- 政治:
-
Leucoanthocyanidin还原酶
- M:
-
杨梅酮
- 护士:
-
柚苷配基
- 病人:
-
5,7,3 ', 4 ', 5 ' -五羟基黄酮
- 问:
-
槲皮素
- UFGT:
-
糖苷类黄酮糖基转移酶
参考文献
Cabrera C, artaco R, Gimenez R:绿茶的有益作用——综述。昆虫学报,2006,25(2):79-99。10.1080 / 07315724.2006.10719518。
类黄酮生物合成。遗传学、生物化学、细胞生物学和生物技术的彩色模型。植物生理学报,2009,26(2):559 - 563。10.1104 / pp.126.2.485。
黄黄酮类化合物b环的快速反应动力学研究。生物化学学报,2001,28(5):1161-1168。10.1006 / bbrc.2001.4705。
李尔仁,姜光华,赵国光:黄酮类化合物对人体健康的影响:老课题,新挑战。生物工程学报,2007,31(2):1390 - 1390。10.2174 / 187220807780809445。
Seeram NP, Nair MG:饮食成分花青素、花青素和儿茶素的脂质过氧化抑制和结构-活性相关研究。农业食品化学学报,2002,50(19):5308-5312。10.1021 / jf025671q。
刘婷婷,杨天成:水溶性天然抗氧化剂对共轭亚油酸在油水乳液体系中光敏氧化的影响。食品科学与技术,2008,33(4):556 - 561。10.1111 / j.1750-3841.2008.00717.x。
Castellarin SD, Di Gaspero G, Marconi R, Nonis A, Peterlunger E, Paillard S, adamb - blondon A- f, Testolin R:红色葡萄(Vitis vinifera L.)的颜色变化:基因组组织,类黄酮3 ' -羟化酶,类黄酮3 ',5 ' -羟化酶基因的表达和红花青素/蓝飞燕素基花青素的相关代谢谱。中国生物医学工程学报,2006,31(1):1- 12。
王晓明,王晓明,王晓明,等。黄酮类化合物3′,5′-羟化酶的研究进展。生物医学工程学报,2010,11(1):562-10.1186/1471-2164-11-562。
Ishiguro K, Taniguchi M, Tanaka Y:黄酮类3′,5′-羟化酶基因的功能分析在鸢尾属花的颜色和进化中起关键作用。植物学报,2012,31(3):451-456。10.1007 / s10265 - 011 - 0455 - 5。
孙艳,黄慧,孟玲,胡凯,戴绍林:包皮草类黄酮3′,5′-羟化酶基因同源物的分离及功能分析。植物物理学报,2013,49(2):151-159。10.1111 / ppl.12034。
王晓明,王晓明,王晓明,王晓明,等。黄酮类化合物3′5′-羟化酶CYP75A31的分离纯化及酶活性分析。植物生态学报,2010,32(1):1-10。
莫里,小林海,Hoshi Y, Kondo M, Nakano M:黄酮类化合物3′,5′-羟化酶基因在长春花中的表达及对花颜色的影响。植物学报,2004,22(6):415-421。10.1007 / s00299 - 003 - 0709 - 3。
王晓明,王晓明,王晓明,等。茄科植物花青素色素沉着位点的基因分析。理论与应用,2004,18(3):423-432。10.1007 / s00122 - 003 - 1455 - 1。
DE Vetten N, Ter Horst J, van Schaik h p, DE Boer A, Mol J, Koes R:黄酮类化合物3 ',5 ' -羟化酶(flavonoid 3 ', 5 ' -hydroxylase)是一种细胞色素P450。科学通报,1999,36(2):778-783。10.1073 / pnas.96.2.778。
Nakachi K, Suemasu K, Suga K, Takeo T, Imai K, Higashi Y:饮用绿茶对日本患者乳腺癌恶性肿瘤的影响。中华肿瘤杂志,1998,19(3):559 - 561。10.1111 / j.1349-7006.1998.tb00556.x。
Sasazuki S, Tamakoshi A, Matsuo K, Ito H, Wakai K, Nagata C, Mizoue T, Tanaka K, Tsuji I, Inoue M, Tsugane S,日本癌症预防策略发展评估研究小组:绿茶消费与胃癌风险:基于日本人群流行病学证据的系统评价。中华临床杂志,2012,42(4):335-346。10.1093 / jjco / hys009。
霍奇松JM, Croft KD, Woodman RJ, Puddey IB, Fuchs D, Draijer R, Lukoshkova E, Head GA:红茶降低血压变异率的随机对照试验。中华临床医学杂志,2013,37(5):943-950。10.3945 / ajcn.112.051375。
Auvichayapat P, Prapochanung M, Tunkamnerdthai O, Sripanidkulchai BO, Auvichayapat N, Thinkhamrop B, Kunhasura S, Wongpratoom S, Sinawat S, Hongprapas P:绿茶对肥胖泰国人减肥的有效性:随机对照试验。中国生物医学工程学报,2009,32(3):486-491。10.1016 / j.physbeh.2007.10.009。
何春涛,林建康,沙希迪。F:茶叶及其制品的化学成分及其促进健康的特性。CRC出版社,纽约2008。
王艳,高丽,单艳,刘艳,田艳,夏涛:遮荫对茶树类黄酮生物合成的影响o . Kuntze)。植物科学,2012,41(1):7-16。10.1016 / j.scienta.2012.04.013。
姜欣,刘燕,李伟,赵玲,孟芳,王燕,谭华,杨华,魏超,万鑫,高玲,夏涛:茶树组织特异性、发育依赖性的酚类物质积累谱及基因表达模式[j]。PLoS ONE。2013, 8 (4): e62315-10.1371/journal.pone.0062315。
Punyasiri PA, ababysinghe IS, Kumar V, Treutter D, Duy D, Gosch C, Martens S, Forkmann G, Fischer TC:茶树茶树黄酮类化合物生物合成:表儿茶素和儿茶素主要途径的酶特性。生物化学学报,2004,31(1):22-30。10.1016 / j.abb.2004.08.003。
Singh K, Rani A, Kumar S, Sood P, Mahajan M, Yadav SK, Singh B, Ahuja PS:黄酮类化合物途径的早期基因黄酮3-羟化酶与茶中儿茶素的浓度呈正相关。植物物理学报,2008,28(9):1349-1356。10.1093 / treephys / 28.9.1349。
茶中儿茶素积累与参与儿茶素生物合成的基因mRNA积累的关系。植物生理生化,2009,47(2):94-97。10.1016 / j.plaphy.2008.11.002。
Ashihara H,邓文文,Mullen W, Crozier A .茶树幼苗黄烷-3-醇的生物合成及生物合成酶基因的表达。植物化学,2010,71(5):559-566。10.1016 / j.phytochem.2010.01.010。
王晓明,王晓明,王晓明,王晓明,等。黄酮类化合物-3′,5′-羟化酶基因的克隆与表达[j]。生物工程学报,1999,31(3):391 - 391。10.1016 / s0014 - 5793(99) 01425 - 8。
Pompon D, Louerat B, Bronine A, Urban P:酵母在优化氧化还原环境下p450的表达。方法酶学杂志,1996,27(2):51-64。10.1016 / s0076 - 6879(96) 72008 - 6。
Seitz C, Eder C, Deiml B, Kellner S, Martens S, Forkmann G:黄酮类3’,5’-羟化酶和黄酮类3’,5’-羟化酶cdna的克隆、功能鉴定和序列分析揭示了黄酮类3’,5’-羟化酶的独立进化。植物化学学报,2006,31(3):369 -381。10.1007 / s11103 - 006 - 0012 - 0。
M ., M ., R .:单氨基酸取代(F363I)将薄荷(−)-柠檬烯羟化酶的区域化学从C6-转化为c3 -羟化酶。[j] .中国科学:自然科学,2000,37(5):448 - 453。10.1073 / pnas.97.22.11948。
Holton TA, Brugliera F, Lester DR, Tanaka Y, Hyland CD, ting JG, Lu C-Y, Farcy E, Stevenson TW, Cornish EC:细胞色素P450基因的克隆与表达。1993
Aharoni A, De Vos CH, Wein M, Sun Z, Greco R, Kroon A, Mol JN, O 'Connell AP:草莓FaMYB1转录因子对转基因烟草花青素和黄酮醇积累的影响。植物学报,2001,28(3):319-332。10.1046 / j.1365 - 313 x.2001.01154.x。
何红,柯红,何婷婷,肖巧艳,D思兰:外源小叶菊F3’5’H基因的抑制和过表达对菊花花色的影响。PLoS ONE。2013, 8 (11): e74395-10.1371/journal.pone.0074395。
苯丙素和类黄酮途径中酶复合物的证据。植物物理学报,1999,107(1):142-149。10.1034 / j.1399-3054.1999.100119.x。
王晓明,王晓明,王晓明,王晓明,王晓明。黄酮类化合物3′,5′-羟化酶基因的克隆及其在烟草中的应用。中国生物医学工程学报,2003,32(1):391 - 391。10.1271 / bbb.67.161。
田中宇,刘建军,张建军,等。生物技术对植物花色的影响。中国生物医学工程学报,2009,35(3):535 -536。10.3390 / ijms10125350。
王晓明,王晓明,王晓明,等。黄酮类3′,5′-羟化酶与黄酮类3′,5′-羟化酶功能差异的研究。生物工程学报,2007,35(6):379 - 379。10.1016 / j.febslet.2007.06.045。
王志强,王志强,王志强,Schröder J:花楸花黄酮羟化酶基因的克隆、表达、酶学性质及细胞特异性表达。植物学报,1999,19(2):183-193。10.1046 / j.1365 - 313 x.1999.00524.x。
庞勇,皮尔金军,Wright E,王铮,Dixon RA:模式豆科植物紫花苜蓿原花青素生物合成的早期步骤。植物生理学报,2007,35(3):691 - 691。10.1104 / pp.107.107326。
雷振宇,赵鹏,曹建军,崔荣,陈旭,熊立志,张启峰,Oliver DJ,项昌博:植物基因功能分析的高通量二元载体。植物学报,2007,29(4):556-567。10.1111 / j.1744-7909.2007.00442.x。
郭文杰,李文杰,李文杰,等。农杆菌介导的拟南芥转化方法的研究进展。植物学报,1998,16(6):735-743。10.1046 / j.1365 - 313 x.1998.00343.x。
致谢
我们感谢康纳根公司的慷慨馈赠,酵母菌株酿酒酵母WAT11,以及城笔翔实验室。(中国科学技术大学,合肥,中国)为烟草叶片中F3’5’h的表达提供了很好的帮助。国家自然科学基金项目(no . 3117047,31170282, 31270730, 31470689),安徽省科技计划项目(no . 13Z03012),国家863计划项目(no . 2013AA102801),安徽省生物学重点学科建设。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们没有竞争利益。
作者的贡献
WYS构思了这项研究,进行了所有的实验,并起草了手稿。XYJ进行酶分析,并协助起草稿件。GLP进行生物信息学和统计学分析。YO协助生物学实验的建立和进行,以及稿件的修改。WXZ进行了酵母和烟草的转化。HXJ制备酵母微粒体。JXL进行UPLC-QQQ-MS分析。LYJ制备RNA。TX构思了这项研究,协调并帮助起草了手稿。所有作者都阅读并批准了最终的手稿。
电子补充资料
12870 _2014_347_moesm1_esm.pdf
附加文件1:图S1。:UPLC-QQQ-MS analysis of products frompYES-dest52-FS用不同底物测定。(一)质谱分析;(B)质谱分析;(C)质谱分析;(D)质谱分析;(E)DHQ质谱分析;(F)DHM的质谱分析。(pdf 78kb)
12870 _2014_347_moesm2_esm.pdf
附加文件2:表S1。:Sequences of primers used for cloning, fusion, and expression analysis of F3′5′H. (PDF 204 KB)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。
本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。
如欲查阅本许可证副本,请浏览https://creativecommons.org/licenses/by/4.0/。
创作共用公共领域免责声明(https://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
王,y。,徐,YJ。,Gao, LP.et al。茶树类黄酮3′,5′-羟化酶的功能分析(茶树):在儿茶素的积累中起关键作用。BMC Plant Biol14,347(2014)。https://doi.org/10.1186/s12870-014-0347-7
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-014-0347-7
关键字
- 茶树
- 类黄酮3 ' 5 '羟化酶
- 功能分析
- 不同的表达
- 儿茶素