摘要
背景
在植物中,气器官的生长到其特征尺寸依赖于细胞增殖和扩张的协调。这两种不同的过程在器官发育过程中先后发生,并有一段重叠的时期。然而,在器官生长过程中,细胞增殖和扩张的协同调控机制仍不清楚。
结果
本研究鉴定了一个新的拟南芥器官大小有关(OSR)基因,OSR2,参与调控器官生长过程中的细胞扩张过程。OSR2主要表达于细胞扩张生长的组织或器官,而OSR2导致器官增大,主要是通过增强细胞扩张。我们进一步证明OSR2功能冗余ARGOS-LIKE(陆军研究实验室),另一个OSR在器官生长中调节细胞扩张的基因。并对三倍体和四倍体进行了形态学和细胞学分析osr突变体验证了四个OSR成员差异但合作参与细胞增殖和细胞扩张的调节,从而最终器官的大小。
结论
我们的研究结果显示OSR2在器官生长过程中具有调节细胞扩张的功能,这进一步表明OSR成员参与了细胞增殖和扩张的调节,从而调节最终器官的大小。这些发现和我们之前的研究强烈表明,osr介导的器官生长可能代表了植物器官发生过程中协同调控细胞增殖和扩张的一种进化机制。
背景
对于多细胞生物来说,器官大小是身体形态的基本属性[1].在动物中,器官的最终大小主要由细胞生长、增殖和凋亡决定。这些过程主要由两种主要途径介导:调节细胞生长的雷帕霉素靶点(TOR)途径和协调控制细胞生长、增殖和凋亡的河马途径[2]、[3.].在植物中,由于细胞凋亡通常不会促进大多数器官的形态发生[4],器官发育至其特征大小主要取决于细胞的增殖和扩张[5]、[6].最近对拟南芥的研究已经确定了一些参与细胞增殖或细胞扩张调控的基因,现在已知这些基因会影响最终器官的大小[7]、[8].然而,许多这样的因素似乎涉及多种途径来影响细胞数量或大小[8],表明植物的器官大小控制机制比动物的更复杂[1]、[9].这可能部分是因为植物不能动,必须对不断变化的环境做出高度的反应[1].
在植物决定性器官如叶子和花器官的发育过程中,细胞的增殖和扩张发生在两个不同但重叠的阶段[5]、[6].例如,在叶片发育的早期阶段,叶原基内的细胞经历了一个细胞增殖和分化的时期;随后,细胞的扩张从叶尖开始,并沿着基瓣方向逐步进行,这是一个由细胞增殖向扩张过渡的过程[10]- [12].最后,叶片通过有丝分裂后的细胞扩张生长,并达到其特有的最终大小。最近对拟南芥的研究强烈表明,从细胞增殖阶段过渡到细胞扩张阶段的时间似乎是整个器官大小的关键决定因素[12]- [15].这一观点得到了大量与器官大小控制有关的已确定因素的支持,这些因素已知会改变细胞增殖的持续时间,从而改变细胞总数和最终器官大小[6]- [8].例如,一些参与器官大小控制的正调控因子,如AINTEGUMENTA (ANT)、生长素调节基因参与器官大小(ARGOS)、KLUH/CYP78A5 (KLU),可以延长细胞增殖期,从而增加细胞数量[9]、[16]- [18].有一些负调控因子,如DA1和ENHANCE OF DA1 (EOD1)/BIG BROTHER (BB),具有限制细胞增殖周期从而限制器官大小的作用[19]- [21].此外,在拟南芥中,参与器官生长过程中细胞扩张调控的因子已被确定,包括调控粒子3a - atpase 2a (RPT2a)、EXPANSIN10 (EXP10)、argo - like (ARL)和雷帕霉素靶蛋白(TOR) [22]- [26].这些因素要么影响细胞扩张的时间,要么影响细胞扩张的速度,因此我们知道它们会改变细胞和器官的最终大小。有趣的是,在器官生长过程中,存在一种协调细胞增殖和扩张的“代偿机制”[27]- [29].例如,an3突变体的细胞数量比野生型的少,但细胞数量比野生型的大an3细胞似乎产生并传递一种细胞间信号,可以增强有丝分裂后的细胞扩张[30.].似乎当一个器官内的细胞数量下降到阈值水平以下时,植物通常会引发有丝分裂后细胞的进一步扩张,以弥补细胞数量的减少[29]、[30.].在植物器官发生过程中,细胞增殖和扩张的协调机制还远未被人们所了解。
拟南芥器官大小相关(OSR)家族参与调控气生器官的大小[17]、[23]、[31].阿哥斯的创始成员OSR同源物,控制气器官的生长,主要是通过促进细胞持续表达延长细胞增殖时间蚂蚁而且CycD3; 1[17].然而,ARGOS-LIKE(陆军研究实验室),相近的同源物阿哥斯,被发现可以通过影响细胞扩张来调节器官的大小[23].我们最近的研究证明了这一点器官大小RELATED1(OSR1)通过影响细胞增殖和扩张来促进器官生长[31].OSR1, ARGOS和ARL共享一个保守的OSR域,足以促进器官生长[31].此外,这三个OSR不同植物激素对基因的调控存在差异,提示它们可能通过调节不同的信号来影响细胞的增殖和/或扩张过程。事实上,最近的一项研究表明玉蜀黍ARGOS1(ZAR1)具有类似的功能阿哥斯.过度的ZAR1在玉米中,促进玉米器官生长,增加产量,提高对干旱胁迫的耐受性[32].OSR非常有趣的是,具有相似OSR结构域的不同OSR成员可以介导细胞增殖和/或细胞扩张,这两种不同的细胞事件被广泛认为是单独控制的[9]、[33]、[34].
在拟南芥基因组中有四个OSR同源物,它们可能是由基因复制事件产生的[31].为了进一步了解进化功能OSR基因,我们调查了第四个的作用OSR的基因,OSR2(At2g41225)。我们在这里报道OSR2以一种多余的方式主要影响细胞的扩张,从而参与对器官生长的调节陆军研究实验室.进一步的分析osr2 argos-1 ARLi三,argos-1 osr1 ARLi OSR2i四重突变体揭示了这四个OSR基因在调控细胞增殖和/或扩增中具有冗余和协同作用。我们对这四种函数散度的表征OSR基因揭示了植物器官发生过程中细胞增殖和扩张的协调调控机制。
结果
OSR2主要表达在通过细胞扩张生长的器官中
我们之前报道过拟南芥OSR1参与了器官生长的调节,它主要通过增强细胞增殖来促进最终器官的大小[31].我们还发现,三个已鉴定的OSR蛋白共享一个保守的OSR域,具有相同的LPPLPPPP基序和两个公认的跨膜螺旋,这足以促进器官的生长[31].的拟南芥基因组还有另一个基因,At2g41225,它编码的蛋白质只有67个氨基酸,在系统发育上属于OSR成员(附加文件1:图S1A) [31].将其氨基酸序列与OSR1、ARGOS和ARL进行比对,发现At2g41225具有保守的LPPLPPPP基序和OSR结构域的C端跨膜螺旋。然而,它没有N端跨膜螺旋,而是有Phobius和iPSORT预测的一个质膜定位信号肽(附加文件1:图S1B) (http://www.ebi.ac.uk//Tools/pfa/phobius;http://ipsort.hgc.jp).此外,At2g41225位于旁边OSR1在基因组中,这两个基因可能起源于一个基因复制事件[31].因此我们将At2g41225指定为器官大小相关的2(OSR2).
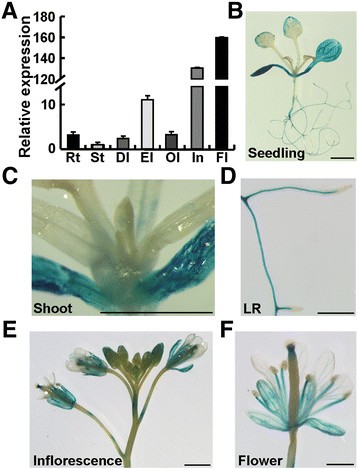
去探索是否OSR2在器官发生过程中是否有我们最初监测的功能OSR2用qRT-PCR分析各器官的表达。如图所示1一个,OSR2主要表达在叶、花序和花等扩张器官中。然后我们检测了组织特异性表达OSR2使用T3独立的转基因植物携带一个OSR2子:β葡萄糖醛酸酶(proOSR2:格斯)构造。在2周龄的幼苗中,叶片上部和侧根的伸长区(LR)等细胞扩张和伸长活跃的器官或器官区GUS表达量较高;在子叶中也检测到丰富的表达(图1罪犯)。然而,在幼叶、嫩枝和根尖中观察到微弱或几乎没有GUS信号,这些地方的细胞主要进行细胞增殖过程(图3)1罪犯)。在花序和发育中的花器官中,GUS染色主要集中在芽、萼片和花丝中(图2)1E、F)。通过对发育初期叶片中GUS信号的检测,发现在幼体阶段GUS信号较弱,而在发育初期叶片中GUS信号含量较高。随后,在完全展开的叶片中,GUS信号几乎消失1:图就是S1C)。这些观察结果表明OSR2主要在细胞扩张生长的器官中表达。
由于之前确定的三个OSR成员已知er本地化[31],我们进一步研究了OSR2在植物叶表皮细胞中的定位proOSR2: OSR2-GFP转基因植物。不同于其他的OSR蛋白,OSR2-GFP融合蛋白信号在质膜中被检测到(附加文件1:图S1D),表明OSR2为质膜定位。
异位表达OSR2主要通过增强细胞扩张来扩大器官
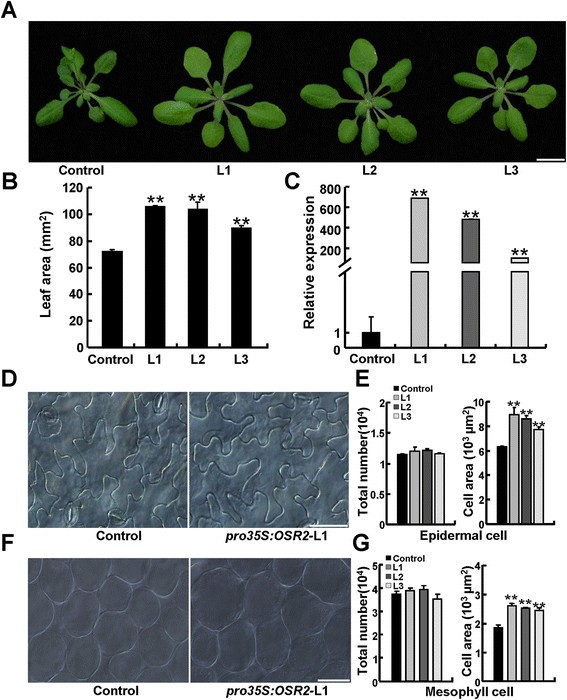
研究…的作用OSR2在器官发育方面,我们产生了转基因拟南芥(Col-0)植物pro35S: OSR2构造。35个T1转基因株系(独立转基因事件)均过表达OSR2与空病媒对照植株相比,在不同程度上表现出较大的器官。仔细检查三个独立的T3纯合子线(L1, L2, L3),发现异位表达OSR2叶片、子叶、根、花器官和角果等器官的大小都明显增加2一个额外的文件1:图S2A, B)。对充分展开的第三片叶片进行详细的量化,可以看出叶片的平均面积pro35S: OSR2L1、L2和L3植株与对照植株相比分别增加了46.8、44.4和24.1%2B). qRT-PCR分析证实器官尺寸的增大确实与升高密切相关OSR2在这些转基因株系中的表达(图2C).转基因植物过度表达OSR2与对照相比,这些植株的根、下胚轴、角果和叶柄都变长了,植株高度也增加了1:图S2C-F)。另外,开花时间在OSR2转基因植物推迟了约4天(附加文件1:图S2E)。
形态学和细胞学特征pro35S: OSR2转基因植物。(一)28日龄对照和3个独立系的形态pro35S: OSR2转基因植株(L1 ~ L3)。酒吧,1厘米。(B)完全展开的第三叶的叶片面积控制和三片pro35S: OSR2转基因线。每个基因型至少检测5片叶片;数据以平均值±标准差表示;学生的t-test: **P < 0.01。(C)中存在的分析OSR2在对照和转基因植物中的表达(一).数据来自3个生物重复,以平均值±SE表示;学生的t-test: **P < 0.01。(D, E)对照和三叶完全展开的第三叶表皮细胞面积和估计细胞数量pro35S: OSR2中描述的转基因植物(一).每行至少检测5片叶片,数据以平均值±SE表示;学生的t-test: **P < 0.01。酒吧,50μm。(F, G)对照和对照三叶完全展开后的叶肉细胞面积和估计细胞数量pro35S: OSR2(三系)转基因植物。酒吧,50μm。数据以平均值±标准差表示;学生的t-test: **P < 0.01。
然后我们以叶片和子叶为代表器官,研究细胞增殖和细胞扩张对增大器官的贡献p35区域:OSR2植物。如图所示2与对照叶片相比,L1、L2和L3植株完全展开的第三叶的表皮细胞平均大小分别增加了42.3、36.4和22.7%。转基因植株的叶片表皮细胞数未发生明显变化(图1)2E).同样,叶肉细胞在p35区域:OSR2叶片扩大,而估测的细胞数量与对照叶片没有差异(图2F, G)。一致地,异位表达OSR2导致子叶中叶肉细胞更大,同样,子叶中的叶肉细胞数量与对照没有差异(附加文件1:图S3A-C)。这些观察表明,增大的器官p35区域:OSR2主要是由于增强的细胞扩张而不是细胞增殖。
OSR2影响器官生长过程中的细胞扩张速度
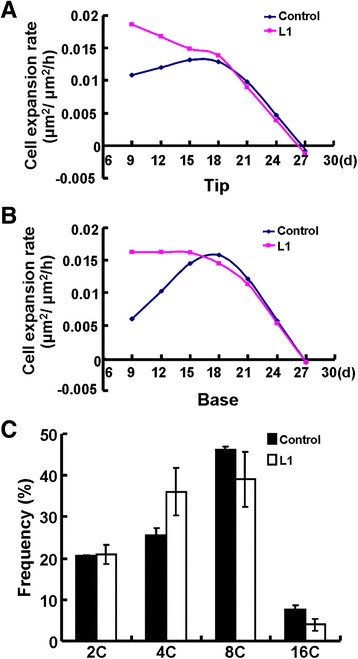
定义确切的角色OSR2在细胞扩张速率和持续时间方面,我们进一步比较了对照和对照第三叶顶端和基部表皮细胞的扩张动力学p35区域:OSR2L1植物。如图所示3.A和B,细胞顶端和底部的扩张速度p35区域:OSR2在第9 ~ 16天,叶片确实远高于对照,而在第21天,两种基因型的细胞扩张速度几乎相同;细胞扩张在第27天停止(图3.A、B)。这些观察结果强烈表明,异位表达OSR2主要影响细胞的扩张速度,而不是细胞扩张期的持续时间。
众所周知,细胞核内再复制决定细胞的最终大小[35]、[36],我们研究了是否扩大的细胞在p35区域:OSR2叶片可归因于核内重复的改变。对27日龄植株完全展开叶片细胞核的流式细胞仪分析显示,虽然4C和8C的细胞百分比在两种基因型之间略有不同,但2C到16C的细胞总体分布在两种基因型之间基本相同(图2)3.C).这个结果表明OSR2-介导的细胞扩张与叶细胞核DNA核内复制无关。
OSR2功能冗余陆军研究实验室介导细胞扩张
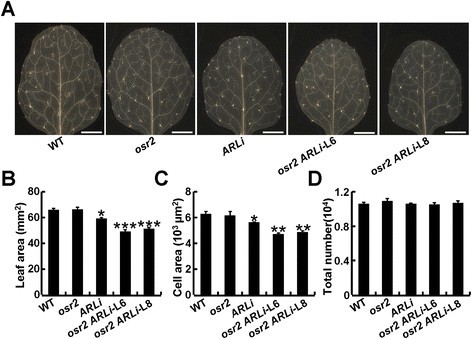
进一步研究。的作用OSR2在器官生长中,我们获得了T-DNA插入突变体osr2(Salk_142851, Col-0),来自拟南芥生物资源中心(ABRC),其中T-DNA片段插入到OSR2(附加文件1:图S4A)。RT-PCR分析表明osr2是一个OSR2(附加文件1:图S4B)。然而,osr2与野生型(WT)相比,植物的器官大小没有明显的缩小(图4A).由于的组织特异性表达模式OSR2和陆军研究实验室(据报道,另一名OSR成员通过细胞扩张调节器官生长[23),我们推测OSR2可能有功能冗余与陆军研究实验室.为了验证这一点,我们引入了一个陆军研究实验室具体的rna干扰构造(pro35S:陆军研究实验室的RNAi)转化为WT和osr2植物产生ARLi而且osr2 ARLi植物。qRT-PCR分析验证了陆军研究实验室很明显在独立的T3行中被删除了(附加文件1:图S4C, D).第三片叶的最终尺寸ARLi与野生型和转基因相比,转基因植株减少了约9%osr2.相比之下,叶大小在osr2 ARLi植物L6和L8分别下降约24.4和22.7%(图4B).通过对第三片叶子中表皮细胞的数量和大小的仔细检查,一致证实敲除OSR2导致表皮细胞变小ARLi但对细胞数量无明显影响(图4C, D)。一直以来,转基因植物都具有35S启动子驱动的特异性OSR2 RNAi构造(pro35S: OSR2 RNAi)没有表现出任何器官大小的表型。然而,引入一个pro35S: OSR2 RNAi构造成ARLi植物叶片尺寸增大减小(附加文件1:图S4E和F),确认OSR2徒多余地与陆军研究实验室在器官生长过程中对细胞扩张的调节。
正如前面提到的三位OSR基因对不同激素的反应不同[17]、[23]、[31],我们还研究了其转录调控OSR2植物激素。有趣的是,对不同激素处理的幼苗进行qRT-PCR分析发现,与陆军研究实验室,OSR2由油菜素内酯(epi-BL)诱导(附加文件1图S5A),这种诱导在BR信号突变体中被破坏bri1-6而且bin2(附加文件1:图S5B)。此外,引入了一个p35区域:OSR2构造成bri1-6而且bin2能否部分恢复叶片和叶柄的生长,以及在bri1-6而且bin2叶片细胞通过过表达OSR2(附加文件1:图S5C-F)。这些发现表明OSR2也可能参与br相关的细胞扩张,进一步支持可能的功能冗余之间OSR2而且陆军研究实验室在器官的生长。
OSR在器官发生过程中,基因协同调控细胞增殖和扩张
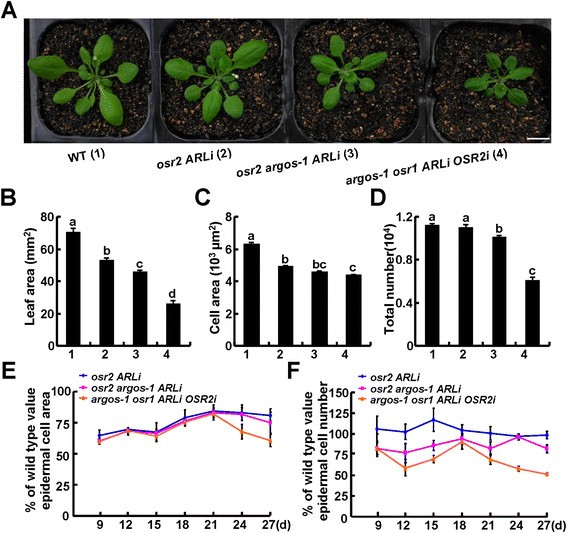
我们之前的研究揭示了这一点阿哥斯而且OSR1通过以一种多余的方式主要影响细胞增殖来调节器官生长[31].为了研究OSR家族成员在器官生长中的合作作用,我们生成了一个osr2 argos-1 ARLi三重突变体和argos-1 osr1 ARLi OSR2i四重突变体引入pro35S: OSR2 RNAi构造成argos-1 osr1 ARLi植物(图5A). qRT-PCR分析证实陆军研究实验室被撞倒在osr2 argos-1 ARLi三重突变体,且两者均有表达陆军研究实验室而且OSR2转录本下降argos-1 osr1 ARLi OSR2i四重突变(附加文件1:图S6A, B).如预期,介绍阿哥斯变异osr2 ARLi植物进一步缩小了它们器官的最终尺寸,这种缩小在四重突变体中得到了增强argos-1 osr1 ARLi OSR2i植物(图5A、B)。对这些植物第三叶表皮细胞的细胞学分析表明,这种减少主要是由细胞数量的减少引起的5C,D),确认的作用阿哥斯而且OSR1在细胞增殖。这些不同的角色OSR通过检查这些基因型在器官生长过程中的细胞增殖和扩张动力学,进一步验证了细胞增殖或扩张的基因(图5E、F)。值得注意的是,我们观察到叶片的表皮细胞OSR四重突变体略小于四重突变体osr2 ARLi植物(图5C, E)。这与之前的发现是一致的OSR1对器官发生过程中的细胞扩张有一定影响[31].
合作的角色OSR2和其他OSR基因在细胞增殖和扩张。(一)28日龄WT的形态osr2 ARLi, osr2 argos-1 ARLi,而且argos-1 osr1 ARLi OSR2i植物。酒吧,1厘米。(罪犯)的叶面积(B),表皮细胞区(C),估算表皮细胞数量(D)30天生植物的第三片叶子(一).每个基因型至少检测5片叶子;数据以平均值±标准差表示;字母(a ~ d)表示基因型间差异有统计学意义(P < 0.05),经spss13.0, Chicago, IL, USA检验。(E, F)野生型和野生型发育第三叶的细胞动力学osr突变体植物。表皮细胞大小(E)估算表皮细胞数量(F)为9 ~ 27日龄植株的突变/WT比值。每个基因型至少检测了五片叶片。
讨论
描述的OSR2定义了一个新的参与器官生长调控的OSR成员
器官的发育依赖于细胞增殖和扩张的协调;这两种不同的细胞活动决定了器官的整体大小。细胞增殖决定器官的细胞数量,在器官生长和最终大小控制中起着重要作用[8].有丝分裂后细胞的扩张决定了最终细胞的大小,对器官发育和大小调节也至关重要[37].最近,一些参与调控细胞扩张和细胞大小的基因也被报道影响最终器官的大小,例如EXP10,RPT2a,TOR,陆军研究实验室,表皮生长因子受体结合蛋白1(EBP1) [8].这里,我们展示过OSR2参与器官生长过程中细胞扩张的调节。OSR2在细胞扩张和伸长的器官或组织中表达OSR2通过提高细胞扩张率来增加整体器官的大小。虽然失去功能的突变体OSR2没有明显的表型,我们的详细检查显示OSR2是多余地与陆军研究实验室,另一种OSR成员曾被证明会影响细胞扩张,从而影响最终器官的大小[23].的表达模式一致OSR2在不同的器官和反应OSR2激素处理后的表达与对照组相当陆军研究实验室,支持了这些基因在器官生长中具有功能冗余的假设。因此,我们的工作确定OSR2作为一种新的植物器官生长和最终器官大小的调节剂,从而提供了一种替代用途OSR2为了控制植物的生物量。
osr介导的器官生长可能是协同调控细胞增殖和扩张的一种进化机制
有四个OSR系统发育分析表明,这4个基因可能起源于基因复制事件。阿哥斯而且陆军研究实验室聚集成一个群OSR1而且OSR2聚集成一个单独的组[31].OSR1而且OSR2位于拟南芥基因组的相邻位置。令人惊讶的是,阿哥斯而且OSR1主要表达于通过细胞增殖生长的器官或组织中,并在蚂蚁并冗余地调节细胞增殖的时间,从而调节最终器官的大小[17]、[31].OSR2而且陆军研究实验室主要表达在细胞扩张/伸长发生的器官和组织中,我们的工作表明这些基因介导细胞扩张过程,从而器官大小。有趣的是,一个共同进化家族的不同成员在调节细胞增殖或扩张方面有着不同的功能,这两种基本的细胞事件长期以来一直被认为在多细胞生物中是被单独控制的[9]、[33]、[34].因此,osr介导的器官生长可能代表了一种在器官水平上协同控制细胞分裂和扩张的进化机制。由于osr只存在于植物中,而且OSR突变只导致器官生长表型,很可能OSR调控通路代表了一种植物响应生长信号或环境线索来改变其生长和最终器官大小的机制。事实上,OSR不同激素处理对基因进行转录调控。阿哥斯已知生长素和细胞分裂素可诱导表达;OSR1乙烯诱导表达,ABA和BR抑制表达;的表达陆军研究实验室而且OSR2由BR诱发[17]、[23]、[31];玉蜀黍ARGOS1(ZAR1)被认为可以调节玉米器官的最终大小,从而有助于提高产量,特别是在干旱胁迫条件下[32].
OSR家族成员在植物器官发生中的分子作用
我们对OSR成员的描述提出了一个关键的问题:OSR家族的不同成员如何参与两种不同的细胞事件的调控?更重要的是,尽管细胞分裂和细胞扩张在细胞和器官水平上是严格协调的,但这两个过程通常被认为是由不同的机制控制的[9]、[33]、[34].到目前为止,几乎没有证据表明这两个事件具有相同的分子机制。此外,我们之前的工作证明了OSR域足以促进器官的生长,并且OSR1对细胞的扩张过程也有一定的影响[31].显然,参与不同OSR细胞增殖和/或扩张的基因依赖于它们在发育器官中的时空表达;阿哥斯而且OSR1主要表达于细胞增殖期,而陆军研究实验室而且OSR2主要表达于细胞扩增期[17]、[23]、[31].目前尚不清楚它们是如何通过类似的OSR结构域促进细胞分裂或扩张的调控作用。我们之前的研究表明,三个OSR蛋白可能定位于ER,而本研究表明OSR2定位于质膜。我们仍然不知道是er定位的OSR蛋白还是质膜定位的OSR2是功能性的还是加工性的。因为OSRs是小蛋白,我们也不能排除OSRs作为肽信号的可能性。最后,更有可能的是,不同的OSR成员可能与多种蛋白质发生不同的相互作用,这反过来会导致OSR在细胞增殖或扩张中的作用发生分歧。因此,识别与OSR蛋白相互作用的蛋白,并对其下游靶点进行解剖和表征将是至关重要的。这些努力对于阐明osr介导的器官水平细胞增殖和扩张的分子机制是必要的。
结论
总之,我们揭示了拟南芥OSR2参与调控器官发生过程中细胞的扩张,从而调控器官的大小。我们发现的差异和合作的作用OSR强烈提示osr介导的器官生长可能是植物器官发生过程中协同调控细胞增殖和扩张的一种进化机制。
方法
植物材料和生长条件
拟南芥本研究采用生态型Columbia (Col-0)。osr2(Salk_142851 Col-0)argos-1(SAIL_896_G10, Col-0)产自拟南芥生物资源中心(ABRC)osr1(GABI_436G04)来自诺丁汉拟南芥储备中心(NASC) (http://www.arabidopsis.org).所有种子经0.5%次氯酸钠消毒15分钟后,在1/2 Murashige和Skoog (MS)培养基上萌发,在22℃的培养室内,光照16 h /暗光8 h,光照强度80-90 μmol m−2年代−1.7日龄幼苗移栽到土壤中,在生长室内22±1°C,与培养室内相同的光周期和光照[38].
序列比对
OSR2、OSR1、ARGOS和ARL的全长氨基酸序列均从拟南芥信息资源(air)数据库中获得。使用MUSCLE程序对4种蛋白质进行比对分析(http://www.ebi.ac.uk/Tools/msa/muscle/),并使用Genedoc软件手工优化[39]、[40].用CLUSTALW2 (http://www.ebi.ac.uk/Tools/msa/clustalw2).
质粒构建与拟南芥转化
生成pro35S: OSR2而且proOSR2: OSR2-GFP的编码序列OSR2通过RT-PCR扩增,连接到pEASY-Blunt载体(TransGen Biotech,中国)并测序。的OSR2将酶切后的片段克隆到pVIP96或pMDC83质粒中[17]、[41].为proOSR2:格斯而且proOSR2: OSR2-GFP构建一个1880bp的基因组片段OSR2将启动子克隆到pMDC163载体和pMDC83质粒中OSR2[41].对于构建的RNAi,一个142 bp的cDNA片段特异于陆军研究实验室或一个193 bp的cDNA片段特异于OSR2克隆到含有正反两个方向RNAi片段的pBluescript SK质粒中[42],然后克隆到pVIP96或pMDC83中生成pro35S:陆军研究实验室的RNAi或pro35S: OSR2 RNAi分别构造。在生成这些构造时使用的所有引物在附加文件中详细说明1S1:表。
所有生成的构造都被引入拟南芥生态型哥伦比亚(Col-0)由根癌土壤杆菌-通过所述的花浸渍法进行介导转化[43].每个构建体至少生成18个含有单个T-DNA插入的独立株系,并使用其T3代植株的3个独立株系进行详细分析。
激素治疗及基因表达分析
将9日龄幼苗转移到含5 μm IAA、5 μm kinetin (KT)、100 μm GA3、5 μm ACC、50 μm ABA或1 μm 24-epi-油菜素内酯(epi-BL)的1/ 2ms液体培养基中3 h,采用TRIzol试剂(Invitrogen)分离不同材料的总RNA。RNA经DNaseI消化后,用Superscript-III逆转录酶(Invitrogen)逆转录成cDNA,用于后续的RT-PCR或qRT-PCR分析。转录丰度甘油醛-3-磷酸脱氢酶c亚基(GAPC)或ACTIN2分别作为RT-PCR和qRT-PCR分析的内对照。根据制造商的说明,在Rotor-Gene3000仪器(Corbett Research)上使用SYBR Premix Ex Taq Mix进行qRT-PCR分析,3次生物重复。用于表达分析的引物在附加文件中详细说明1S1:表。
转基因纯合子植物的幼苗或单个器官proOSR2:格斯构建GUS染色实验。这些在50毫米磷酸钠溶液(pH7.0)中包含5毫米K4Fe(CN) 6,5毫米K3Fe(CN) 6,0.1% Triton X-100和1毫米5-溴-4-氯-3-吲哚基-b-葡萄糖醛酸(Gluc), 37°C孵育数小时[31].
形态学和细胞学分析
形态学上,用在黑暗中生长的6日龄黄化幼苗测量下胚轴长度;用8日龄幼苗测定子叶面积和根长;选取28天生的植株测量叶柄长度;选取50日龄植株,测定株高和角果长。
为了测定细胞的大小和数量,将扩张或完全扩张的第三片叶子和子叶切除,放在去色素溶液中30分钟或室温下过夜。然后将脱色液与碱性溶液在室温下交换15-20分钟。这些材料通过乙醇系列再水化10-15分钟,然后在水中转移,以可视化和测量细胞[44].在显微镜下观察叶片顶端、中央、基部的叶肉细胞和表皮细胞,并拍照(Olympus BX51),利用ImageJ 1.4.3.67软件测量叶片和细胞面积(http://rsb.info.nih.gov/ij/).每片叶子的总细胞数用总叶面积乘以每片面积的平均细胞数估计。将测得的叶片不同发育阶段表皮细胞大小移入原木中,测定细胞扩张速率2然后拟合局部五点二次函数,根据Nelissen的方法计算其一阶导数等.[45].
流式细胞术和共聚焦显微镜
对照植株和过度表达的转基因植株完全展开的第三叶OSR2在萌发后27天,用剃刀切除DAG,然后在冷的核隔离缓冲液中悬浮[46].使用流式细胞仪(BD Biosciences,http://www.bdbiosciences.com/).
目的:研究含转基因植物表皮细胞OSR2的细胞定位proOSR2: OSR2-GFP在共聚焦显微镜(徕卡)下观察GFP信号。FM4-64染色证实OSR2-GFP融合蛋白的质膜定位。
加入数据
本文所述基因的序列数据可在拟南芥信息资源(TAIR)数据库中找到:OSR2(At2g41225),OSR1(At2g41230),陆军研究实验室(At2g44080),阿哥斯(At3g59900),GAPC(At3g04120)和ACTIN2(At3g18780)。
支持数据的可用性
支持本文结果的数据包含在本文及其附加文件中。
额外的文件
缩写
- ABRC:
-
拟南芥生物资源中心
- DAG:
-
天,发芽
- epi-BL:
-
Epi-brassinolide
- 格斯:
-
β葡萄糖醛酸酶
- KT:
-
激动素
- LR:
-
横向根
- 女士:
-
Murashige和斯库
- OSR:
-
器官大小有关
- RNAi:
-
rna干扰
- TAIR:
-
拟南芥信息资源
- TOR:
-
雷帕霉素的靶点
- WT:
-
野生型
参考文献
- 1.
Horiguchi G, Ferjani A, Fujikura U, Tsukaya H:细胞增殖和细胞扩张在控制叶片大小中的协调作用拟南芥.植物学报,2006,119(1):37-42。10.1007 / s10265 - 005 - 0232 - 4。
- 2.
河马信号在器官大小控制中的作用。基因工程,2007,21(8):886-897。10.1101 / gad.1536007。
- 3.
潘东,董军,张勇,高XS:结节性硬化症复合体:来自果蝇人类疾病。中国生物医学工程学报,2004,14(2):78-85。10.1016 / j.tcb.2003.12.006。
- 4.
Krizek BA:制造更大的植物:最终器官大小的关键调节器。植物学报,2009,12(1):17-22。10.1016 / j.pbi.2008.09.006。
- 5.
大小问题:植物器官大小的发育控制。植物学报,2001,4(6):533-539。10.1016 / s1369 - 5266(00) 00212 - 0。
- 6.
Anastasiou E, Lenhard M:达到自己的标准。植物学报,2007,10(1):63-69。10.1016 / j.pbi.2006.11.002。
- 7.
Gonzalez N, Beemster GT, Inzé D:大卫和歌利亚:微小的杂草拟南芥能教会我们什么来提高作物的生物量产量?植物学报,2009,12(2):157-164。10.1016 / j.pbi.2008.11.003。
- 8.
Gonzalez N, Vanhaeren H, Inzé D:叶大小控制:细胞分裂和扩张的复杂协调。植物学报,2012,17(6):332-340。10.1016 / j.tplants.2012.02.003。
- 9.
植物器官大小控制:AINTEGUMENTA在器官发生过程中调节生长和细胞数量。美国国家科学院。2000, 97(2): 942-947。10.1073 / pnas.97.2.942。
- 10.
李志强,刘志强,刘志强,刘志强:拟南芥叶片发育过程中细胞周期和细胞体积的变化。中国生物医学工程学报,1999,15(2):322 - 327。10.1006 / dbio.1999.9443。
- 11.
Kazama T, Ichihashi Y, Murata S, Tsukaya H:细胞周期阻滞前沿进程的机制由aKLUH / CYP78A5-依赖的移动生长因子拟南芥.植物生理学报,2010,51(6):1046-1054。10.1093 /卡式肺囊虫肺炎/ pcq051。
- 12.
王志强,王志强,王志强,王志强,王志强,王志强,王志强,王志强,王志强,王志强,王志强,王志强,王志强,王志强拟南芥:一个不那么循序渐进的过程。开发细胞。2012,22(1):64-78。10.1016 / j.devcel.2011.11.011。
- 13.
王涛,王晓燕,王晓燕,王晓明:KUODA1对活性氧稳态的调控作用及其调控机制研究进展。通讯。2014,5:3767-
- 14.
植物器官生长的遗传控制。中国生物医学工程学报,2011,31(2):319-333。10.1111 / j.1469-8137.2011.03737.x。
- 15.
Hepworth J, Lenhard M:通过调节细胞数量和大小来调节植物侧面器官的生长。植物学报,2014,17:36-42。10.1016 / j.pbi.2013.11.005。
- 16.
异位表达AINTEGUMENTA在拟南芥植物中导致花器官的增长。地球科学进展,1999,25(3):224-236。10.1002 / (SICI) 1520 - 6408年的时候(1999年)25:3 < 224::AID-DVG5 > 3.0.CO; 2 y。
- 17.
胡燕,谢青,蔡乃辉:拟南芥生长素诱导基因阿哥斯控制侧面器官的大小。植物细胞。2003,15(9):1951-1961。10.1105 / tpc.013557。
- 18.
李志强,李志强,李志强,李志强等:植物器官大小的控制方法KLUH / CYP78A5端依赖细胞间信号。开发学报,2007,13(6):843-856。10.1016 / j.devcel.2007.10.001。
- 19.
Disch S, Anastasiou E, Sharma VK, Laux T, Fletcher JC, Lenhard M: E3泛素连接酶BIG BROTHER以剂量依赖的方式控制拟南芥器官大小。中国生物医学工程学报,2006,16(3):272-279。10.1016 / j.cub.2005.12.026。
- 20.
李艳,郑丽萍,刘志强,刘志强。种子对种子终末种子器官大小的影响DA1基因家族在拟南芥.中国生物医学工程学报,2008,22(10):1331-1336。10.1101 / gad.463608。
- 21.
徐然,李艳:中介复合物亚基25 in对器官最终大小的控制拟南芥.发展。2011,138(20):4545-4554。10.1242 / dev.071423。
- 22.
Cho HT, Cosgrove DJ:扩展素表达的改变可以调节植物的叶片生长和花梗脱落拟南芥.美国国家科学院。2000, 97(17): 9783-9788。10.1073 / pnas.160276997。
- 23.
胡艳,鲍鸿茂,蔡乃辉:拟南芥ARGOS-LIKE基因在器官生长过程中调节细胞扩张。植物学报,2006,47(1):1-9。10.1111 / j.1365 - 313 x.2006.02750.x。
- 24.
Deprost D, Yao L, Sormani R, Moreau M, Leterreux G, Nicolai M, Bedu M, Robaglia C, Meyer C:拟南芥TOR激酶与植株生长、产量、抗逆性和mRNA翻译有关。环境科学与技术,2007,30(4):449 - 456。10.1038 / sj.embor.7401043。
- 25.
王淑玲,李玉玲,王淑玲,李玉玲。26S蛋白酶体功能的缺失导致拟南芥茎叶器官细胞大小增加,细胞数量减少。植物生理学报,2009,30(1):393 - 393。10.1104 / pp.109.135970。
- 26.
杨志田,杨志勇,杨志勇,杨志勇,山本H,田池田A:拟南芥RPT2a 19S蛋白酶体亚基对叶片器官大小的调控作用。植物学报,2009,60(1):68-78。10.1111 / j.1365 - 313 x.2009.03932.x。
- 27.
对叶片形态突变体的解释:叶片形态发生中代偿系统的遗传证据,为细胞和有机体理论之间提供了新的联系。中国生物医学工程学报,2002,21(4):429 - 436。10.1016 / s0074 - 7696(02) 17011 - 2。
- 28.
细胞周期:植物生长控制的关键?植物学报,2003,8(4):154-158。10.1016 / s1360 - 1385(03) 00046 - 3。
- 29.
控制多细胞器官的大小:集中在叶子上。科学通报,2008,6 (7):e174-10.1371/journal.pbio.0060174。
- 30.
张建平,张建平,张建平,等:叶片发育过程中器官大小的非细胞自主协调调控。开发,2010,137(24):4221-4227。10.1242 / dev.057117。
- 31.
冯刚,秦泽,严杰,张欣,胡勇:拟南芥器官大小RELATED1调节器官的生长和最终器官的大小阿哥斯而且陆军研究实验室.叶绿醇。2011,191(3):635-646。10.1111 / j.1469-8137.2011.03710.x。
- 32.
郭梅,马鲁普,J伟,温克尔C, goncales - butruille M, Weers BP, Cerwick SF, Dieter JA, Duncan KE, Howard RJ,侯泽,Löffler CM, Cooper M, Simmons CR: MaizeARGOS1(ZAR1)转基因等位基因增加杂交玉米产量。应用生物学报,2014,65(1):249-260。10.1093 / jxb / ert370。
- 33.
Johnston GC, Pringle JR, Hartwell LH:酵母中细胞分裂与生长的协调酿酒酵母.中国生物医学工程学报,1997,16(1):1 - 5。10.1016 / 0014 - 4827(77) 90154 - 9。
- 34.
Neufeld TP, de la Cruz AFA, Johnston la, Edgar BA:生长和细胞分裂的协调果蝇翅膀。中国生物医学工程学报,1998,9(7):1183-1193。10.1016 / s0092 - 8674(00) 81462 - 2。
- 35.
野美拉氏菌,李志刚,王晓燕:拟南芥表皮组织内多倍体与细胞大小的关系。植物细胞。1993,5(11):1661-1668。10.1105 / tpc.5.11.1661。
- 36.
Sugimoto-Shirasu K, Roberts K:“Big it up”:植物内复制和细胞大小控制。植物学报,2003,6(6):544-553。10.1016 / j.pbi.2003.09.009。
- 37.
张志强,张志强。叶片发育与细胞发育的关系。植物学报。2014,5:362-10.3389/fpls.2014.00362。
- 38.
景艳,崔东,鲍芳,胡卓,秦卓,胡燕:色氨酸缺乏通过抑制拟南芥细胞扩张影响器官生长。植物学报,2009,57(3):511-521。10.1111 / j.1365 - 313 x.2008.03706.x。
- 39.
GeneDoc:一个用于编辑和注释多个序列比对的工具。EMBNEW新闻1997年,14。
- 40.
刘艳,崔胜,吴峰,闫松,林欣,杜鑫,庄坤,陈志强,张志强,张志强,张志强,张志强。拟南芥MIKC*型MADS盒子基因在水稻花粉成熟中的功能保护作用。植物细胞。2013,25(4):1288-1303。10.1105 / tpc.113.110049。
- 41.
一种用于植物基因高通量功能分析的通道克隆载体。植物生理学报,2003,33(2):462-469。10.1104 / pp.103.027979。
- 42.
马赵顾秦G H, Y, Z, G,杨Y, Pichersky E,陈H,刘M,陈Z,瞿LJ: indole-3-acetic酸羧基甲基转移酶调节拟南芥叶片发育。植物细胞。2005,17(10):2693-2704。10.1105 / tpc.105.034959。
- 43.
Clough SJ,弯曲AF:花浸渍:一种简化的方法农杆菌属介导的变换拟南芥.植物学报,1998,16(6):735-743。10.1046 / j.1365 - 313 x.1998.00343.x。
- 44.
杨凯,王慧,薛松,曲欣,邹军,乐军:拟南芥气孔末端分裂对a型细胞周期蛋白依赖激酶和细胞周期蛋白的需求。应用生态学报,2014,65(9):2449-2461。10.1093 / jxb / eru139。
- 45.
李志强,李志强,李志强等:单子叶和双子叶植物叶片细胞分裂的运动学分析:理解生长和开发精细分子采样策略的基础。方法中国生物医学杂志,2013,959:247-264。10.1007 / 978 - 1 - 62703 - 221 - 6 - _17。
- 46.
Galbraith DW, Harkins KR, Maddox JM, Ayres NM, Sharma DP, Firoozabady E:完整植物组织细胞周期的快速流式细胞分析。科学通报,1983,220(4601):1049-1051。10.1126 / science.220.4601.1049。
确认
我们非常感谢dr。感谢王志勇(斯坦福大学卡内基科学研究所)和朱圣伟(中国科学院植物研究所)提供的bri1-6而且bin2−/ +种子。我们也感谢中国科学院植物研究所金静波博士对OSR2细胞定位的技术支持。乐杰,邹俊杰(中国科学院植物研究所)细胞学分析。本研究由国家自然科学基金(31121065和31260066)资助。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者声明他们之间没有利益冲突。
作者的贡献
ZQ和YH设计了实验,并参与了稿件的撰写;ZQ的实验和分析最多;XZ和GF生成了构建的转基因株系;XRZ帮助分析了一些数据;YH监督和协调所有实验。所有作者阅读并批准稿件。
电子辅料
图S2。
附加文件1:图S1。:Cluster and alignment of OSR2 and OSR proteins. Phenotypes ofp35区域:OSR2转基因植物。图S3。植物子叶的细胞学特征p35区域:OSR2转基因植物。图S4。描述的osr2而且osr突变体。图S5。OSR2参与br介导的细胞扩张。图S6。的分子特征osr突变体。表S1。本研究使用的引物。(PDF 403 KB)
权利和权限
开放获取本文根据知识共享署名4.0国际许可协议授权,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和源代码,提供知识共享许可协议的链接,并说明是否进行了修改。
本文中的图像或其他第三方材料均包含在本文的知识共享许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的知识共享许可中,并且您的预期使用不被法定法规允许或超过允许的使用,您将需要直接从版权所有者获得许可。
如欲查阅本牌照副本,请浏览https://creativecommons.org/licenses/by/4.0/.
知识共享公共领域转让豁免书(https://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在对数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
秦众,张旭,张旭,张旭。et al。拟南芥的器官大小相关2参与调节器官生长过程中的细胞扩张。BMC植物杂志14,349(2014)。https://doi.org/10.1186/s12870-014-0349-5
收到了:
接受:
发表:
关键字
- 拟南芥
- 细胞扩张
- 细胞增殖
- OSR
- 器官大小