摘要
背景
果实的成熟和成熟是基因调控的过程,涉及植物激素、生长调节剂和多种生物和环境因素的复杂相互作用。番茄(茄属植物lycopersicum)已被用作调控特定成熟途径(包括乙烯、类胡萝卜素和细胞壁代谢)的生物学和遗传学研究的模型。该模型也被用于研究上游信号转导和转录调控因子的功能。到目前为止,已经报道了许多影响果实发育和成熟的成熟相关转录因子。NAC转录因子具有植物特异性,在植物侧根形成、次生细胞壁合成、胚胎、花器官、营养器官和果实发育等多个阶段都发挥着重要作用。
结果
实时荧光定量PCR的组织特异性分析表明SlNAC1在未成熟的绿色果实中大量积累;的表达式SlNAC1随着果实成熟逐渐增加,在破果期后7 d达到最高。的过度表达SlNAC1通过改变类胡萝卜素通路通量,降低乙烯合成,主要是通过降低系统-2乙烯生物合成基因的表达,导致类胡萝卜素减少,从而导致成熟果实呈黄色或橙色。酵母单杂交实验结果表明,SlNAC1可与番茄红素和乙烯合成相关基因的调控区相互作用。这些结果也表明,SlNAC1通过影响乙烯的合成和类胡萝卜素的积累来抑制果实的成熟SlNAC1超表达。此外,过度表达SlNAC1降低了果实的硬度和果皮的厚度,产生了更多的脱落酸,导致果实过早软化。因此,在SlNAC1过表达系,乙烯依赖和脱落酸依赖通路都受到调控SlNAC1果实成熟调控网络。
结论
SlNAC1对番茄果实的成熟有广泛的影响和调控SlNAC1通过乙烯依赖和脱落酸依赖途径过表达番茄果实成熟。因此,本研究为番茄果实成熟调控网络的现有模型提供了新的见解。
背景
水果的成熟是一个受基因调控的过程,包括颜色、味道、质地和香气的许多代谢变化;这些变化受内源激素和遗传调控因子以及外部信号(温度、光照和水合作用)的控制[1]。这一过程已被刺激使用番茄作为肉质果实发育和成熟的优秀模型;番茄具有成熟突变体特征清晰、基因组大小小、遗传图谱密度高、生命周期短、高效的瞬时稳定转化和完整的基因组序列等优点,已成为一种很好的模型[2]-[4]。
根据番茄在成熟初期的呼吸和乙烯的诱导,学者们将其归类为更年期水果。暴露于外源乙烯也能引起更年期果实的成熟。格里尔生家族(5]以番茄为模型,综述了乙烯诱导更年期果实成熟的研究进展。反义基因被用来抑制基因的表达ACO1和ACS2,分别编码1-氨基环丙烷-1-羧酸氧化酶(ACO)和ACC合成酶(ACS);ACO和ACS是参与乙烯生物合成的主要酶。在番茄中,ACS是由一个多基因家族编码的,该家族至少有8个成员,基因组序列中还有3个假定的基因[4]。在番茄中,ACO是由一个多基因家族编码的,该多基因家族包含至少4个特征ACO和基因组序列中的其他3个假定基因[4]。先前的研究也描述了乙烯对更年期成熟过程中基因表达的影响[6]-[9]。乙烯诱导的表达ACS2和ACS4,在番茄果实成熟过程中起重要作用[10]、[11]。的上调ACS1A和ACS4在成熟起始阶段产生乙烯,乙烯诱导ACS2和ACS4调节乙烯的自催化合成,这一过程通常见于更年期成熟。ACS2和ACO1控制番茄果实中乙烯的产生[12]。
植物激素脱落酸(ABA)不仅调控种子休眠、植物生长发育和对环境胁迫的响应[13]-[15]但在果实发育后期也表现出类似乙烯的变化模式[2]、[16]。由于ABA缺失突变体的ABA含量比正常水平低75%,植株和果实都没有表现出野生型的正常生长;ABA缺失突变体果实的总果重和平均果重均较野生型果实降低,植株重量比野生型低50%,表明ABA不仅是植物生长所必需的,而且在果实发育和成熟过程中也不可或缺[16]。此外,外源ABA的施用可以增加甜樱桃果实的色素沉淀,促进甜樱桃果实的成熟[17]。外源ABA促进果实成熟,氟脲酮或NDGA处理通过抑制ABA延缓果实成熟[18]。孙等人。[19]报道了RNA干扰抑制SlNCED1导致转基因果实ABA积累减少,从而导致编码主要细胞壁分解代谢酶的基因下调。这些研究表明ABA在果实成熟过程中起着重要作用。
已经鉴定出参与完全抑制正常成熟的罕见突变的基因;这一进展被认为是确定番茄成熟的转录控制的重大突破[20.]。这些突变包括rin(成熟抑制剂),也不(non-ripening)和中国北车(无色non-ripening)。基因克隆的努力已经证明了这一点rin源于番茄MADS-box转录因子基因最后一个外显子的缺失(LeMADS-RIN);rin是促进番茄果实成熟所必需的[21]。突变rin影响所有相关的成熟途径;这一发现支持了该基因作为成熟的主要调节因子的功能[22]。染色质免疫沉淀结合DNA微阵列分析和转录组分析已经鉴定出241个RIN直接靶基因,这些基因包含RIN结合位点,并在果实成熟过程中表现出RIN依赖的正或负调控[23]。的目标RIN包括已知的基因,如ACS2,ACS4,NR(不成熟的),E8,PG(聚半乳糖醛酸酶),TBG4(galactanase 4),EXP1(棒曲霉素1),PSY1(植烯合成酶1),也不,中国北车,TDR4,HB-1和RIN本身(24]-[26]。另一项研究揭示了新的靶点,包括bHLH(碱性螺旋-环-螺旋),NAC (NAM, ATAF1/ATAF2, CUC2),碱性亮氨酸拉链(bZIP)转录因子(TF),锌指蛋白和APETALA2a(23]。
除了RIN,中国北车和也不,其他TF基因,包括AGAMOUS-LIKE1,Hd-zip同源盒蛋白-1,乙烯响应因子6,FRUITFULL1,FRUITFUL2,SlMADS1和APRR2-Like,在番茄果实成熟中的作用[27]-[36]。也不NAC结构域家族成员,在番茄果实成熟级联中发挥乙烯上游作用;也不突变导致非成熟表型类似于观察到的rin(2]。SlNAC4通过影响乙烯合成和类胡萝卜素积累正向调节果实成熟[37]。然而,其他参与果实成熟的NAC转录因子的作用机制仍不清楚。
SlNAC1与番茄卷叶病毒复制附属蛋白相互作用,增强病毒复制[38]。该基因也与非生物胁迫有关[39]、[40]和病原体感染反应[41]。在本研究中,SlNAC1在果实组织中大量积累,并随着果实成熟而增加。的过度表达SlNAC1降低了总类胡萝卜素和番茄红素的积累、乙烯的产生、果实硬度和果皮厚度,但增加了脱落酸(ABA)含量。转基因果实中番茄红素和乙烯合成相关基因表达下调,叶黄素、β-胡萝卜素和ABA合成相关基因表达上调,细胞壁代谢相关基因表达上调。此外,酵母单杂交实验结果表明,SlNAC1与SlPSY1,SlACS2和SlACO1。这些结果表明,SlNAC1通过乙烯依赖和aba依赖途径调控番茄果实的成熟SlNAC1超表达。
结果
SlNAC1参与番茄果实的成熟吗
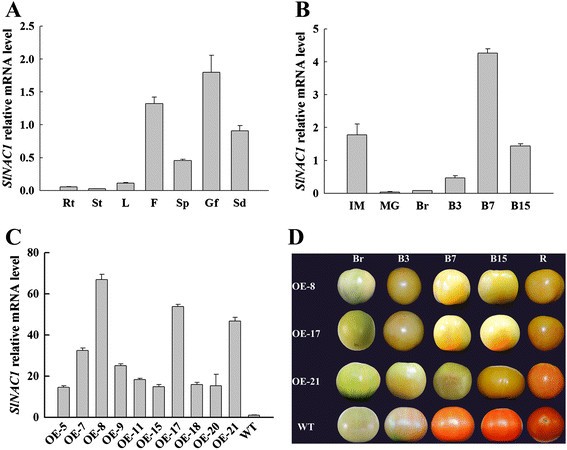
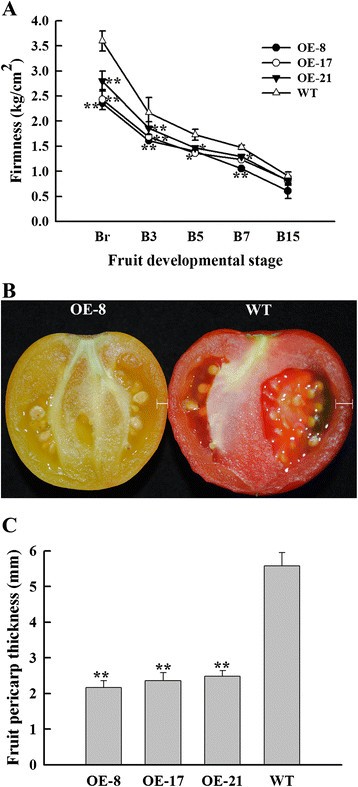
的表达式配置文件SlNAC1采用实时荧光定量PCR (qRT-PCR)对根、茎、叶、花、萼片、青果和种子进行了定量分析。SlNAC1在花、绿色果实和种子中均有较高的表达量,且转录量最多SlNAC1而在根、茎和叶中表达量较低(图2)1A).这些结果表明SlNAC1可能与果实发育有关。与此相符的是SlNAC1在破绿未熟期积累较多,到成熟期减少,直至破绿后7 d逐渐增加(图1B).这些结果表明SlNAC1可能在番茄果实组织中起作用。
qRT-PCR分析SlNAC1OE和WT果实的表达和表型。(一)成绩单的SlNAC1在不同的组织中积累。Rt,根;圣,阀杆;L,叶;F,花;Sp,萼片;Gf,绿色果实;Sd,种子。以青果果皮组织为研究对象。(B)的相对mRNA水平SlNAC1水果成熟了。以不同发育阶段的水果果皮组织为实验材料。(C)qRT-PCR表达分析SlNAC1采用RT-PCR方法对B7期果实果皮组织总RNA进行定量分析。(D)OE和WT果实的表型与发育阶段。IM,青涩绿;MG,成熟绿色;Br,断路器;B3,断路器后3天;B7、断路器后7天;B15,断路器后15d;R,成熟。数据为三个独立实验的均值±标准差。WT表达式数据归一化为1。
测试是否SlNAC1在CaMV 35S启动子下过表达该基因的全长cDNA,获得了转基因番茄株系。获得10个独立过表达(OE)转基因株系。其中OE-8、OE-17和oe -21表达水平较高SlNAC1(图1C),并被选中进行进一步的实验。在图1D,与野生型株系相比,3个OE株系的成熟果实呈黄色或橙色。这些数据表明过表达SlNAC1抑制正常的果实成熟。
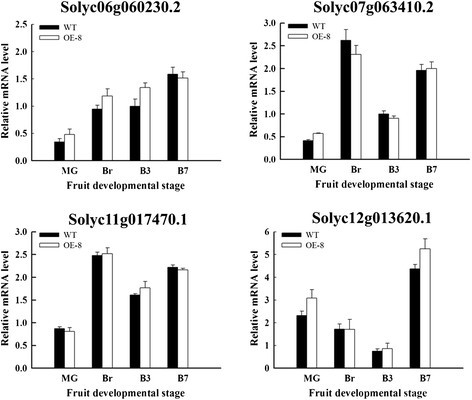
在植物转录因子数据库(http://planttfdb.cbi.pku.edu.cn/) [42]。只是确认一下SlNAC1在转基因植物中过表达,我们测试了另外四种基因的表达北亚包含同源性较高的序列SlNAC1,如数据库中的系统发育树所示。在图2,这四种基因的表达水平北亚在不同时期,OE和WT果实间差异不显著。这些数据表明过度表达SlNAC1不影响密切相关的NAC基因的表达。
过度的SlNAC1基因影响果实着色及相关基因的表达
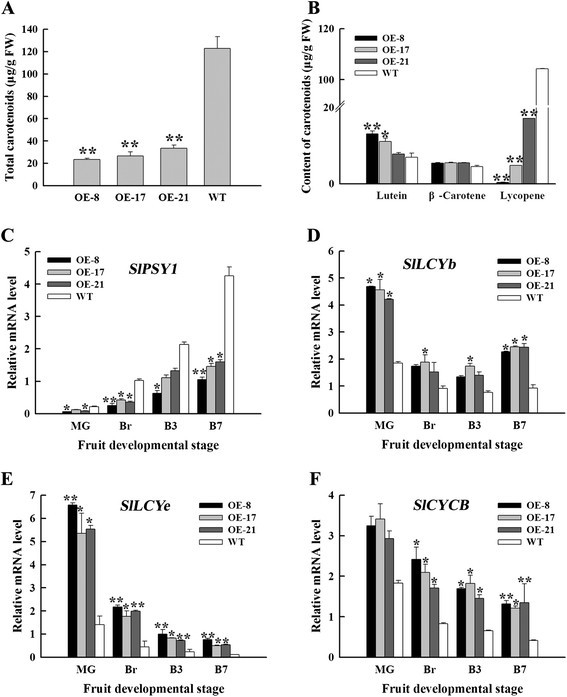
番茄红素是成熟番茄果实的红色色素沉淀的原因;在大多数品种的类胡萝卜素中,番茄红素占70%至90%,而β-胡萝卜素占其余比例的大部分(5%至40%)[43]、[44]。在本研究中,OE-8、OE-17和OE-21的OE果实总类胡萝卜素含量分别显著降低至WT果实的19.1%、21.6%和27.3%(图3.A). OE果实叶黄素含量累积量是WT果实的1.1 ~ 1.9倍,β-胡萝卜素含量累积量也是WT果实的1.2倍左右。然而,OE水果中的番茄红素含量与WT水果相比降低了83.5%至99.6%(图3.B).这些数据与水果色素沉着一致。
考虑到OE水果类胡萝卜素组成的明显变化,我们分析了参与类胡萝卜素生物合成的基因转录水平(附加文件)1:图S1)。PSY1是番茄类胡萝卜素生物合成的限速酶,在番茄成熟过程中通过通路调控通量[45]、[46]。qRT-PCR结果提示SlPSY1在OE水果中下调,导致成熟水果中的番茄红素和总类胡萝卜素减少(图3.然而,C)。SlLCYb(番茄红素β环化酶),SlLCYe(番茄红素ε环化酶)和SlCYCB(染色体特异性番茄红素β-环化酶)在OE果实中上调,表明番茄红素代谢为β-胡萝卜素和叶黄素(图)3.D3.F).这些结果表明,OE果实色素沉着的改变与观察到的番茄红素合成和分解相关基因表达的变化是一致的。
过度的SlNAC1通过下调与乙烯生物合成相关的基因来减少乙烯的排放
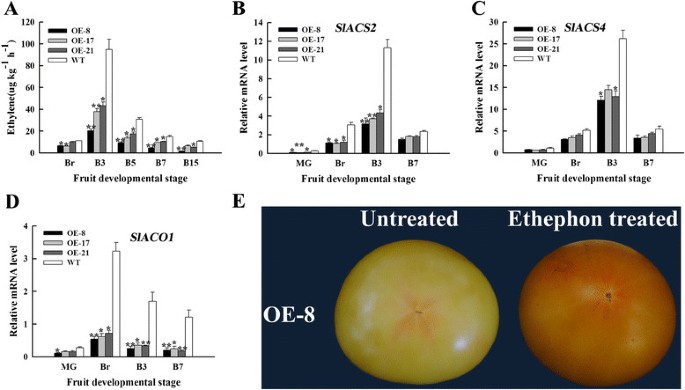
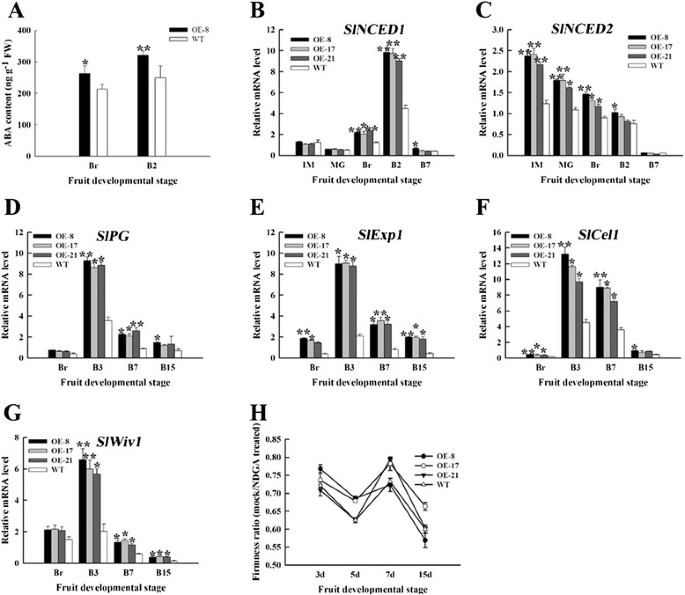
乙烯通过上调调控类胡萝卜素和番茄红素在成熟过程中的积累SlPSY1(47]。果实在测定Br后释放乙烯,以确定观察到的表型是否由乙烯含量的变化引起。大洋芋和野生型果实乙烯生产模式相似,大洋芋和野生型果实乙烯生产的更年期峰值均出现在B3,但大洋芋果实乙烯生产的更年期峰值明显低于野生型果实;这些峰值下降了54%至79%(图4A).然后我们检测了乙烯生物合成相关基因的相对mRNA水平。的表达SlACS2,SlACS4和SlACO1OE果实与WT果实相比表现出不同程度的抑制;这一结果与乙烯的生产是一致的(图4B4D)。在OE-8系破裂期果实经乙烯利处理7 D后,处理后果实表型可部分恢复(图4E).这些结果说明SlNAC1番茄果实的过度表达部分依赖于乙烯。
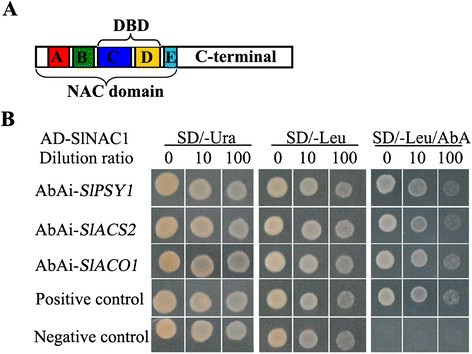
可以与SlNAC1相互作用SlPSY1,SlACS2和SlACO1YIH实验
转录因子通常通过与它们的启动子结合来促进或抑制相应的转录来调控基因表达。所以我们想知道SlNAC1是否能直接结合到SlPSY1,SlACS2和SlACO1。高度保守的正电荷子域C和D(图5A) NAC tf可以与DNA结合[48]。CACG [49]和C/TACG [50]序列是由拟南芥ANAC。塞尔斯等人[38]报道了SlNAC1的n端169个氨基酸残基包含五个保守的亚域,这些亚域组成了NAC结构域,SlNAC1在酵母中起转录激活剂的作用。在这些研究的基础上,我们选择了含有SlNAC1的C和D子结构域的片段以及含有C/TACG序列的启动子区域进行酵母单杂交检测。如图所示5B,共转化后的酵母菌株含有SlNAC1的DNA结合域和SlPSY1,SlACS2,SlACO1可以在SD/-Ura、SD/-Leu和SD/-Leu/AbA营养不良培养基上生长,提示SlNAC1可能与SlPSY1,SlACS2和SlACO1体内。这一结果表明,SlNAC1通过调控这些基因的表达来调控番茄红素和乙烯的合成。
过度的SlNAC1引起广泛的成熟变化
果实软化与成熟有关,乙烯能加速果实软化。因此,我们测量了水果的硬度(软化率),以确定OE水果是否比WT水果软化得晚。我们的研究结果表明,在同一时期,OE水果的硬度低于WT水果,这意味着OE水果的软化更早,这与乙烯释放不一致(图6A).此外,OE成熟果实果皮厚度明显降低(图6B)在B15阶段减少超过50%(图6C).果皮厚度降低与OE成熟果实硬度降低相关,表明果皮厚度对果实软化的贡献。此外,OE水果的种子大小比WT水果大,并且OE水果比WT水果产生更多的种子(数据未显示)。这些结果表明SlNAC1导致了果实发育和成熟的广泛变化。
过度的SlNAC1导致ABA的积累
乙烯与OE果实软化不一致,说明乙烯以外的其他因素可能对番茄果实软化起作用。孙等人。[51]报道了ABA通过调控主要分解代谢基因的表达影响番茄果实成熟过程中的细胞壁分解代谢,ABA峰值往往出现在乙烯峰值之前。为了确定OE-8和WT果实软化速率的差异是否是ABA变化引起的,我们测定了OE-8和WT果实在Br期和B2期的内源ABA含量。数字7A表明,同时期OE-8果实ABA含量高于WT果实。类似地,的表达式SlNCED1(9-顺式环氧类胡萝卜素双加氧酶)和SlNCED2在OE果实中,与WT果实相比,其含量上调,特别是在成熟早期(图7B和7C).此外,OE水果细胞壁代谢相关基因的表达水平,如香格里拉,SlExp1,SlCel1(endo-1,4-β纤维素)和SlWiv1(细胞壁转化酶),与WT果实相比增强(图7D7为了进一步验证,OE和WT水果在破碎阶段用NGDA(去二氢愈创木酸,一种ABA合成的抑制剂)处理。NDGA处理后的果实硬度较未处理的果实有所提高(图7H).这些结果表明SlNAC1导致ABA积累,这至少有助于果实软化。
ABA含量、ABA合成和细胞壁代谢相关基因的表达及NDGA处理。(一)OE-8与WT果实ABA含量差异。(B)的表达SlNCED1。(C)的表达SlNCED2。(D)来(G)细胞壁代谢相关基因的qRT-PCR分析。的表达式香格里拉(D),SlExp1(E),SlCel1(F)和SlWiv1(G)在OE和WT果实间检测到。(H)模拟果实与NDGA处理果实硬度之比。IM,青涩绿;McG,成熟绿;Br,断路器;B2,断路器后2 d;B3,断路器后3天;B7、断路器后7天;B15,断路器后15天。数据为三个独立实验的均值±标准差。星号表示OE水果与WT水果差异有统计学意义(*P < 0.05, **P < 0.01)。
讨论
成熟番茄果实中红色色素的形成是由番茄红素(红色)和β-胡萝卜素(橙色)的积累引起的,这两种胡萝卜素占果实类胡萝卜素总量的大部分[52]。NOR是NAC转录因子及其突变体的成员也不表型相似吗rin在那也不果实不能产生更年期乙烯或成熟但在分子水平上对乙烯有反应,同样也不能成熟对乙烯有反应[53]。与WT成熟的番茄相比,NOR RNAi番茄的果皮在B + 4阶段出现了成熟缺陷(轻微的橙色),表明类胡萝卜素成分发生了变化。此外,SlNAC4 RNAi果实的胎盘在B + 7期未能获得红色色素和软化外观[37]。我们的结果表明,水果过度表达SlNAC1显示为黄色/橙色(图1D)SlNAC1过表达果实与普通果实不同也不和SlNAC4RNAi水果。黄色/橙色果实是由番茄红素积累减少和叶黄素和β-胡萝卜素升高引起的(图3.B),部分解释了为什么OE水果不能完全变红。qRT-PCR分析显示,类胡萝卜素生物合成途径的主要通量调节因子PSY1由于过表达而显著降低SlNAC1(图3.C)。此外,OE果实的染色体和叶绿体番茄红素β-环化酶(CYCB、LCYb和LCYe)较WT果实上调(图3.D3.F).的上调SlPSY1以及对SlCYCB至少部分依赖于乙烯;在番茄果实成熟过程中,番茄红素与β-胡萝卜素的相对比例是由这两个过程所介导的[43]、[52]、[54]。这些数据表明SlNAC1在过表达系中通过调控类胡萝卜素生物合成途径参与番茄果实色素沉着。在酵母单杂交实验的基础上(图5B),我们可以假设SlNAC1可能在类胡萝卜素通路流向叶黄素和β-胡萝卜素和远离番茄红素的调节中起作用SlNAC1OE水果。
番茄在生理上被归类为更年期水果,这是基于成熟开始时呼吸和乙烯的剧烈诱导。乙烯是水果成熟的关键调节激素[55]。乙烯排放SlNAC1过表达线减少(图4A),暗示SlNAC1是OE果实成熟过程中乙烯生物合成的负调节因子。番茄果实成熟过程中乙烯的合成受到调控ACS和华基因家族[12]。在番茄中占主导地位ACS记录,即ACS1A,ACS2和ACS4,积累在成熟的果实中。这两个ACS2和ACS4调节自催化乙烯合成的爆发,这一过程通常在更年期成熟中观察到[12]。奥勒等人[56发现ACS2是主要的ACS在成熟的果实中,该基因的抑制阻止了成熟。的上调ACS2(12),ACO1(57导致乙烯和类胡萝卜素的积累。与OE果实中乙烯产量减少一致的是,参与乙烯合成的关键基因的转录水平(SlACS2,SlACS4和SlACO1)均受到不同程度的抑制(图4B4D)。此外,外源乙烯利处理部分恢复了OE果实的表型(图4E).这些结果表明SlNAC1可能通过与乙烯途径相互作用而影响OE果实的成熟。TAGL1正调节乙烯合成;此外,乙烯减少和转向叶黄素和β-胡萝卜素积累发生在成熟的果实作为抑制TAGL1(36]。酵母单杂交实验结果表明,SlNAC1可以结合到酵母的调控区域SlPSY1,SlACS2,SlACO1(图5B).根据之前的报道和酵母单杂交的结果,我们推测SlNAC1负调控OE水果乙烯的合成。
番茄MADS盒TFRIN作为最早的代理催熟调节剂之一,乙烯依赖型催熟调节剂和乙烯依赖型催熟调节剂都是必需的。RIN参与调控番茄红素积累和乙烯生产结合到他们的启动子,如ACS2,ACS4,ACO1和PSY1,这需要中国北车(22]、[58]、[59]。的过度表达SlNAC1以及对RIN(21],中国北车(60],HB-1(33],TAGL1(36]或SlNAC4(37都减少了番茄红素的积累和乙烯的合成,导致类似的不成熟果实。此外,RIN,中国北车,HB-1,TAGL1和SlNAC4是否都被报道为袭击目标RIN(24]-[26]、[37]。因此,两者之间可能存在某种关系SlNAC1和RIN调节番茄果实成熟。然而,目前尚不清楚,将进行进一步调查。
软化是果实成熟的另一个重要标志,与果实品质和贮藏时间有关。多肉水果的软化是由其果肉细胞壁的结构和组成的变化引起的。在更年期水果中,果胶和纤维素的降解依赖于软化过程中的乙烯[61]-[63]。果实硬度分析结果表明,OE果实软化速率与乙烯产量不一致(图4一个和6A),表明在番茄果实中可能存在乙烯不依赖的软化途径。据报道SlNCED1RNA干扰抑制降低了转基因果实中ABA的积累,下调了主要细胞壁分解代谢酶的编码基因,从而增加了转基因果实的硬度[51]。乙烯、总类胡萝卜素、番茄红素和β-胡萝卜素的含量及相对转录水平SlACS2,SlACS4,SlACO1和SlPSY1增强了SlNCED1抑制果[19]。OverexpressingSlNAC1增加ABA含量和编码细胞壁代谢的基因表达水平,导致果实硬度降低(图6一个和7).此外,乙烯水平,总类胡萝卜素,番茄红素,和相对转录水平SlACS2,SlACS4,SlACO1和SlPSY1减少了SlNAC1过表达水果(图3.和4).这些结果与先前的研究不一致。这些变化表明ABA对果实硬度有负向调控作用。尽管如此,详细的机制SlNAC1调控ABA合成目前尚不清楚。Vrebalov等人[36发现果皮细胞层数的减少会导致比正常情况下更薄的果皮组织。在我们的研究中,OE水果的果皮厚度程度低于WT水果(图6B和6C).这个较低的值说明OE果实的果皮组织中细胞层数较少;就这样,一层较薄的果皮形成了。Saladie´等人。[64]的研究表明,果实膨胀是番茄果实硬度的主要决定因素,因此,果皮厚度的直接变化加上对水分潴留的影响可能是导致番茄果实软化的原因TAGL1压抑的水果。从而降低硬度或增加软化SlNAC1果实过表达可能是由于果皮薄造成的。总的来说,SlNAC1在番茄果实成熟过程中通过乙烯依赖和aba依赖途径发挥作用SlNAC1超表达。
结论
SlNAC1转录本在根、茎、叶、花、萼片、果实和种子等多个组织中积累,随着果实成熟而积累,在B7时达到最高水平。SlNAC1通过调控番茄红素和乙烯生物合成影响番茄果实色素沉着。此外,SlNAC1可能通过影响外源ABA的合成和改变果皮厚度来调控番茄果实软化。这些数据为番茄果实成熟提供了一种新的调控因子,可能有助于进一步绘制番茄果实成熟的调控网络。
方法
植物材料和生长条件
野生型番茄品种(茄属植物lycopersium简历。6)和T2我们于2012年5月在温室收集的OE世代品系是在25°C/18°C的气候控制温室中,白天/晚上在自然光下种植的。在指定的时间采集不同的组织。果实在以下阶段收获:未成熟的绿色(IM);成熟绿(MG);断路器(Br);断路器后2、3、7、15天(B2、B3、B7、B15)。花在开花时被标记以测量成熟时间。
转基因番茄植株的产生
一对基因特异性引物(表1)用于克隆SlNAC1构造过表示向量。将这些片段插入表达载体pBI121 at中Bam你好,萨尔我的网站,然后转化成根癌土壤杆菌菌株LBA4404。番茄WT子叶外植体的转化如前所述[65]。
类胡萝卜素提取及高效液相色谱(HPLC)
采用Fraser等人改进的方法,在B20时从水果果皮组织中提取番茄色素。66]和Bino等人。[67]。按照Verbalov等人的描述进行HPLC分析。[36]。用含0.1%丁基羟基甲苯(BHT)的甲醇1.25 ml提取冷冻番茄粉(0.25 g)。样品摇晃5分钟,然后加入1.25 ml Tris-HCl缓冲混合物(pH 7.5, 50 mM)(含1 M NaCl)。样品摇晃10分钟;然后,在这些样品中加入含0.1% BHT的冷氯仿1毫升,然后再摇10分钟。随后,样品在4°C下以4500 rpm离心15分钟。收集氯仿相;然后用1毫升冷氯仿混合物重新提取样品的水相。氯仿组分在N2流。干燥的残留物重新悬浮在1毫升的甲基中t-丁基醚(MTBE),涡旋,用0.45 μm和4 mm聚四氟乙烯膜过滤器过滤,收集用于分析。所使用的溶剂均为HPLC级。提取物保存在4°C,然后在整个制备过程中屏蔽强光。Agilent1200泵系统(Agilent Technologies, USA),带有YMC-Pack反相C30柱(250 mm × 4.6 mm;5 μm)用于化合物分离。流动相为乙腈:甲醇(3:1,v/v) (A)和MTBE (B), A和B均含有0.05%的三乙胺。梯度洗脱过程总结如下:B在8分钟内上升至55%,并在8分钟至35分钟内保持。色谱柱在30°C下运行,流速为1 ml min−1且样品进样量为20 μl。紫外光谱在450nm处进行监测。试验采用3个生物重复(每个重复3个技术重复),结果相似。选用5个不同时期收获的果实作为生物复制。
乙烯测量和乙烯利处理
果实收获后暴露在空气中3小时,以消散收获过程中受伤释放的乙烯。水果密封在罐子里,然后放置在室温下2小时。用注射器将顶空气体按比例混合。将大约1毫升完全混合的顶空气体注入配备火焰电离检测器的岛津GC-14C气相色谱仪。然后将样品与已知浓度的标准气体进行比较。试验分为3个生物重复,每个重复至少10个果实。乙烯利处理时,将处于破碎期的果实置于3000 μl的乙烯利溶液中−15分钟,密封在罐子里再7天。
中存在
使用RNAprep植物试剂盒从植物组织中分离总RNA (TIANGEN BIOTECH,http://www.tiangen.com)根据制造商的协议。DNase i处理的RNA使用M-MLV逆转录酶试剂盒(TIANGEN BIOTECH)进行逆转录。实时PCR采用Bio-Rad CFX96TM实时PCR系统和SYBR实时Master Mix (TIANGEN)进行。样本(从不同的收成收集的五种水果)由三个生物学重复(每个重复三个技术重复)表示;采用标准曲线法。每个基因分析均包括无模板、阴性和单引物对照。EF-1α作为内参基因计算相对转录水平。用2——ΔΔCT方法(68]。用于定量RT-PCR的引物见表1。
酵母单杂交试验
利用Matchmaker Gold酵母单杂交文库筛选系统(Clontech, CA, USA)验证了SlNAC1与基因启动子的相互作用SlPSY1,SlACS2和SlACO1。将SlNAC1的DNA结合域(含C和D子域)克隆到pGADT7载体上;启动子区域(大约位于含有C/TACG序列的转录起始位点上游1000 bp至1500 bp)SlPSY1,SlACS2和SlACO1克隆到pAbAi载体的MCS中。酵母细胞的转化和积极相互作用的确认,如Matchmaker Gold酵母单杂交系统用户手册所述。本实验所用引物列于表中1。
水果硬度测量
硬度测试仪(GY-2)被用来测定水果的硬度,如Wu和Abbott [69]。在一个水果的赤道上放置一个扁平探针,并以1mm s的位移速率使用−1以3毫米的距离按压一个完整的番茄果实。在3毫米压缩时记录的最大力被用于估计水果的硬度,这是根据至少10个测试水果的平均值和每个水果至少三次压缩得出的。
ABA测定和NDGA处理番茄果实
在适当的时间收获番茄果实样本,并在−80°C冷冻。然后将冷冻的样品在液氮中研磨成粉末。采用Fu等方法提取和检测番茄果实中的ABA [70]。NDGA处理如Zhang等所述[18]。简而言之,在断路器的番茄果实从植物中收获,然后分为两组。用医用注射器从果蒂处注入0.5 ml 100 μM NDGA(组1)和蒸馏水(组2,对照)。每个处理3个重复,共10个番茄果实。处理后的果实在20°C和95%相对湿度(RH)下贮藏3、5、7和15 d。
统计分析
数据以均数±标准差表示。使用Student 's分析OE系与WT系之间的显著差异t-test (*P < 0.05, ** P < 0.01)。
支持数据的可用性
本文中的序列数据可在GenBank数据库(http://www.ncbi.nlm.nih.gov/Genbank),以下列登记编号:SlNAC1(AY498713);SlPSY1(EF157835);SlLCYb(EF650013);SlLCYe(Y14387);SlCYCB(AF254793);SlACS2(X59139);SlACS4(M88487);SlACO1(X58273);SlNCED1(Z97215);SlNCED2(EU912387);香格里拉(X05656);SlExp1(U82123);SlCel1(U13054);SlWiv1(AB004558)和EF-1α(X144491)。此外,在PlantTF中发现了Solyc06g060230.2、Solyc07g063410.2、Solyc11g017470.1和Solyc12g013620.1的序列(http://planttfdb.cbi.pku.edu.cn/)或SGN (http://solgenomics.net/)数据库。
额外的文件
参考文献
- 1.
Costa F, Alba R, Schouten H, Soglio V, Gianfranceschi L, Serra S, Musacchi S, Sansavini S, Costa G, Fei ZJ, Giovannoni J:利用同源和异源基因表达谱工具表征苹果果实成熟过程中的转录动态。中国生物医学工程学报,2010,10:229-10.1186/1471-2229-10-229。
- 2.
乔凡诺尼·JJ:果实成熟突变体为成熟控制提供了新的见解。中国植物学报,2007,30(3):349 - 349。10.1016 / j.pbi.2007.04.008。
- 3.
杨晓明,杨晓明,杨晓明,等:番茄成熟关键基因的分离与分析。应用物理学报,2002,29(3):344 - 344。10.1093 / jxb / erf057。
- 4.
Zouine M, Latché A, Rousseau C, Regad F, Pech JC, Philippot M, Bouzayen M, Delalande C, Frasse P, Schiex T, Noirot C, Bellec A, Klopp C, Berges H, Mariette J, Vautrin S, Causse M, Rothan C:番茄基因组序列为肉质水果进化提供了见解。自然科学学报,2012,34(4):344 - 344。10.1038 / nature11119。
- 5.
乙烯与果实成熟的控制。果实成熟的分子生物学与生物化学。编辑:Seymour GB, Giovannoni JJ, Tucker GA, Poole M. 2013, Wiley In Press, Boston
- 6.
布利克AB,肯德H:乙烯:植物中的气体信号分子。中国生物医学工程学报,2000,16:1-18。10.1146 / annurev.cellbio.16.1.1。
- 7.
Klee HJ:番茄乙烯介导过程在受体水平上的控制。应用物理学报,2002,29(3):377 - 382。10.1093 / jxb / erf062。
- 8.
Stepanova AN, Ecker JR:乙烯信号:从突变体到分子。中国植物学报,2000,3:353-360。10.1016 / s1369 - 5266(00) 00096 - 0。
- 9.
杨晓明,杨晓明,杨晓明,杨晓明,杨晓明:乙烯诱导信号转导的研究进展。科学通报,1995,27(3):357 - 357。10.1126 / science.270.5243.1807。
- 10.
林肯JE, Campbell AD, Oetiker J, Rottmann WH, Oeller PW, Shen NF, theologiis A:番茄果实成熟和创伤诱导的1-氨基环丙烷-1-羧酸合成酶基因LE-ACS4 (Lycopersicon esculentum).表达大肠杆菌,结构表征,表达特征,系统发育分析。中国生物医学工程学报,2003,26(4):344 - 344。
- 11.
Olson DC, White JA, Edelman L, Harkins RN, Kende H: 1-氨基环丙烷-1-羧酸合酶两个基因在番茄果实中的差异表达。中国科学院学报(自然科学版),2001,29(3):344 - 344。10.1073 / pnas.88.12.5340。
- 12.
Barry CS, Llop-Tous MI, Grierson D: 1-氨基环丙烷-1-羧酸合酶基因在番茄乙烯合成系统-1向系统-2转变过程中的表达调控。中国农业科学,2002,23(4):489 - 497。10.1104 / pp.123.3.979。
- 13.
ABA在种子中的作用和相互作用。植物科学进展,2003,8:213-217。10.1016 / s1360 - 1385(03) 00060 - 8。
- 14.
Finkelstein RR:脱落酸感知的研究终于开花结果了。植物学报,2006,18:786-791。10.1105 / tpc.106.041129。
- 15.
Shinozaki K, Yamaguchi-Shinozaki K:干旱胁迫响应和耐受性相关基因网络。应用物理学报,2007,38(3):344 - 344。10.1093 / jxb / erl164。
- 16.
王强,王志强,王志强,王志强,王志强,等。番茄突变体脱落酸缺乏的研究high-pigment 3导致质体数量增加,果实番茄红素含量增加。植物学报,2008,53:717-730。10.1111 / j.1365 - 313 x.2007.03362.x。
- 17.
任娟,陈萍,戴世杰,李萍,李强,季凯,王亚萍,冷萍:脱落酸和乙烯在甜樱桃果实成熟中的作用:分子研究。新西兰作物学报,2011,39:1-14。10.1080 / 01140671.2010.508819。
- 18.
张敏,袁波,冷萍:ABA在番茄乙烯生物合成和果实成熟中的作用。应用物理学报,2009,30(1):54 - 56。10.1093 / jxb / erp026。
- 19.
孙玲,袁波,张敏,王玲,崔敏,王强,冷萍:果实特异性rnai介导的对植物生长的抑制作用SlNCED1增加番茄果实中番茄红素和β-胡萝卜素的含量。应用物理学报,2012,29(3):344 - 344。10.1093 / jxb / ers026。
- 20.
王晓明,王晓明,王晓明,王晓明。果实发育与成熟研究。中国植物学报,2013,29(4):344 - 344。10.1146 / annurev - arplant - 050312 - 120057。
- 21.
Vrebalov J, Ruezinsky D, Padmanabhan V, White R, Medrano D, Drake R, Schuch W, Giovannoni J:番茄果实成熟所必需的MADS-box基因ripening-inhibitor(rin)轨迹。科学通报,2002,29(6):343-346。10.1126 / science.1068181。
- 22.
马特尔C, Vrebalov J, Tafelmeyer P, Giovannoni J:番茄MADS-box转录因子成熟抑制剂与众多成熟过程中的启动子相互作用无色NONRIPENING端依赖的方式。中国生物医学工程学报,2011,27(3):344 - 344。10.1104 / pp.111.181107。
- 23.
Fujisawa M, Nakano T, Shima Y, Ito Y:番茄MADS盒转录因子直接靶点的大规模鉴定成熟抑制剂揭示了果实成熟的规律。植物学报,2013,25:371-386。10.1105 / tpc.112.108118。
- 24.
藤泽,中野,伊藤Y:番茄果实成熟调控因子的潜在靶基因鉴定RIN染色质免疫沉淀。中国生物医学工程学报,2011,11:26-10.1186/1471-2229-11-26。
- 25.
Fujisawa M, Shima Y, Higuchi N, Nakano T, Koyama Y, Kasumi T, Ito Y:番茄成熟调控因子的直接靶点RIN通过转录组和染色质免疫沉淀分析鉴定。植物学报,2012,29(3):357 - 357。10.1007 / s00425 - 011 - 1561 - 2。
- 26.
秦刚,王勇,曹波,王伟,田松:果实成熟过程中MADS框转录因子RIN的调控网络。植物学报,2012,30(4):344 - 344。10.1111 / j.1365 - 313 x.2011.04861.x。
- 27.
Bemer M, Karlova R, Ballester AR, Tikunov YM, Bovy AG, Wolters-Arts M, Rossetto PB, Angenent GC, Maagd RA:番茄FRUITFULL同源染色体TDR4 / FUL1和MBP7 / FUL2调节水果成熟的乙烯无关方面。中国生物医学工程学报,2012,27(3):344 - 344。10.1105 / tpc.112.103283。
- 28.
Chung MY, Vrebalov J, Alba R, Lee J, McQuinn R, Chung JD, Klein P, Giovannoni J:番茄(茄属植物lycopersicum) APETALA2/ERF基因,SlAP2a,是果实成熟的负调节因子。植物学报,2010,29(4):344 - 344。10.1111 / j.1365 - 313 x.2010.04384.x。
- 29.
董婷婷,胡志林,邓玲,王勇,朱明明,张建林,陈桂平:番茄MADS-box转录因子的研究,SlMADS1,是果实成熟的负调节因子。中国生物医学工程学报,2013,29(3):344 - 344。10.1104 / pp.113.224436。
- 30.
Itkin M, Seybold H, Breitel D, Rogachev I, Meir S, Aharoni A:番茄状的是果实成熟调控网络的一个组成部分。植物学报,2009,30(4):344 - 344。10.1111 / j.1365 - 313 x.2009.04064.x。
- 31.
Karlova R, Rosin FM, Busscher-Lange J, Parapunova V, Do PT, Fernie AR, Fraser PD, Baxter C, Angenent GC, Maagd RA:转录组和代谢产物分析显示APETALA2a是番茄果实成熟的主要调节因子。植物学报,2011,23:923-941。10.1105 / tpc.110.081273。
- 32.
李建明,郑建刚,McQuinn R, Chung MY, Fei Z, Tieman D, Klee H, Giovannoni J:结合转录组、遗传多样性和代谢产物分析,揭示了番茄果实的乙烯响应因子SlERF6在成熟和类胡萝卜素积累中起重要作用。植物学报,2012,30(4):344 - 344。10.1111 / j.1365 - 313 x.2011.04863.x。
- 33.
林志,洪艳,尹明,李春,张凯,Grierson D:番茄HD-Zip同源盒蛋白,LeHB-1在花器官发生和成熟过程中起重要作用。植物学报,2008,29(3):344 - 344。10.1111 / j.1365 - 313 x.2008.03505.x。
- 34.
潘y, Bradley G, Pyke K, Ball G, Lu CG, Fray R, Marshall A, Jayasuta S, Baxter C, Wijk R, Boyden L, Cade R, Chapman NH, Fraser PD, Hodgman C, Seymour GB:网络推理分析发现APRR2-Like基因与番茄和辣椒果实色素积累相关。中国生物医学工程学报,2013,26(3):357 - 357。10.1104 / pp.112.212654。
- 35.
岛Y,北川M,藤泽M,中野T,加藤H,金原J,嘉纯T,伊藤Y:番茄FRUITFULL同系物通过形成MADS-box转录因子复合物参与果实的成熟RIN。中国生物医学工程学报,2013,29(3):344 - 344。10.1007 / s11103 - 013 - 0071 - y。
- 36.
Vrebalov J, Pan IL, Arroyo AJ, McQuinn R, Chung M, Poole M, Rose J, Seymour G, Grandillo S, Giovannoni J, Irish VF:番茄SHATTERPROOF基因调控肉质果实的膨胀和成熟TAGL1。植物科学学报,2009,29(4):344 - 344。10.1105 / tpc.109.066936。
- 37.
朱敏,陈刚,周松,涂艳,王艳,董涛,胡志:一种新的番茄NAC (NAM/ATAF1/2/CUC2)转录因子SlNAC4作为果实成熟和类胡萝卜素积累的正向调节因子。植物生理学报,2014,55(1):119-135。10.1093 /卡式肺囊虫肺炎/ pct162。
- 38.
Selth LA, Dogra SC, Rasheed MS, Healy H, Randles JW, Rezaian MA:一种NAC结构域蛋白与番茄卷叶病毒复制附属蛋白相互作用并增强病毒复制。中国生物医学工程学报,2005,17:331 - 324。10.1105 / tpc.104.027235。
- 39.
马恩宁,左永强,梁晓青,尹波,王东东,孟QW:多重胁迫响应转录因子SlNAC1提高番茄的耐冷性。中国生物医学工程学报,2013,29(3):344 - 344。10.1111 / ppl.12049。
- 40.
欧阳波,杨涛,李慧,张磊,张勇,张娟,费喆,叶铮:番茄根系早期盐胁迫响应基因的抑制消减杂交和芯片分析。应用物理学报,2007,38(3):357 - 357。10.1093 / jxb / erl258。
- 41.
黄伟,苗明,库德杰,牛鑫,欧阳波,张娟,叶震,库尔杰,刘勇,肖峰:SlNAC1是一种与应激相关的转录因子,在转录和翻译后水平上都进行了微调。环境科学学报,2013,27(3):344 - 344。10.1111 / nph.12096。
- 42.
金建平,张辉,孔林,高刚,罗景昌:植物转录因子的功能和进化研究的门户。中国生物工程学报,2014,42:D1182-D1187。10.1093 / nar / gkt1016。
- 43.
Alba R, Payton P, Fei Z, McQuinn R, Debbie P, Martin GB, Tanksley SD, Giovannoni J:转录组和代谢产物分析揭示了番茄果实发育过程中乙烯的多个控制点。植物学报,2005,17:2954-2965。10.1105 / tpc.105.036053。
- 44.
Burns J, Fraser PD, Bramley PM:常见食用水果和蔬菜中类胡萝卜素,生育酚和叶绿素的鉴定和定量。植物化学学报,2003,29(3):344 - 344。10.1016 / s0031 - 9422(02) 00710 - 0。
- 45.
弗雷泽PD, Bramley PM:植物烯脱氢酶的纯化从Phycomyces blakesleeanus。生物化学学报,2004,27(4):357 - 357。10.1016 / 0005 - 2760(94) 90189 - 9。
- 46.
Fraser PD, Romer S, Shipton CA, Mills PB, Kiano JW, Misawa N, Drake RG, Schuch W, Bramley PM:以果实特异性方式表达额外植物烯合酶的转基因番茄植株的评价。自然科学进展,2002,29(3):349 - 349。10.1073 / pnas.241374598。
- 47.
Maunders MJ, Holdsworth MJ, Slater A, Knapp JE, Bird CR, Schuch W, Grierson D:乙烯刺激番茄成熟相关mrna的积累。植物细胞环境学报,1987,10:177-184。
- 48.
Puranik S, Sahu PP, Srivastava PS, Prasad M: NAC蛋白在胁迫耐受中的调控和作用。植物科学进展,2012,17:369-381。10.1016 / j.tplants.2012.02.004。
- 49.
Tran LS, Nakashima K, Sakuma Y, Simpson SD, Fujita Y, Maruyama K, Fujita M, Seki M, Shinozaki K, Yamaquchi-Shinozaki K:拟南芥胁迫诱导NAC转录因子的分离与功能分析。植物科学学报,2004,16:481- 498。10.1105 / tpc.104.022699。
- 50.
杨晓明,李志刚,李志刚,李志刚:NAC转录因子的dna结合特异性及其分子功能研究。植物科学学报,2005,29(3):344 - 344。10.1016 / j.plantsci.2005.05.035。
- 51.
孙玲,孙勇,张敏,王玲,任娟,崔敏,王勇,季凯,李鹏,李强,陈萍,戴松,段超,吴勇,冷萍:9-顺式环氧类胡萝卜素双加氧酶对转基因番茄果实质地的影响。中国生物医学工程学报,2012,29(3):344 - 344。10.1104 / pp.111.186866。
- 52.
Fraser PD, Truesdale MR, Bird CR, Schuch W, Bramley PM:番茄果实发育过程中的类胡萝卜素生物合成(组织特异性基因表达的证据)。中国农业科学,2004,27(4):457 - 457。
- 53.
林志刚,李志刚:乙烯对野生型大豆基因表达的调控rin番茄(Lycopersicon esculentum)水果。中国农业科学,2004,27(3):357 - 357。10.1104 / pp.88.2.370。
- 54.
罗宁,李志强,李志强,等:番茄中β -胡萝卜素形成的新途径。中国科学:自然科学,2000,29(2):366 - 366。10.1073 / pnas.190177497。
- 55.
Barry CS, Giovannoni JJ:乙烯和水果成熟。植物生长学报,2007,26:143-159。10.1007 / s00344 - 007 - 9002 - y。
- 56.
卢文伟,李志刚,李志刚,李志刚。反义RNA对番茄果实衰老的可逆抑制作用。科学通报,2001,29(4):344 - 344。10.1126 / science.1925603。
- 57.
Barry CS, Blume B, Bouzayen M, Cooper W, Hamilton AJ, Grierson D:番茄1-氨基环丙烷-1-羧酸氧化酶基因家族的差异表达。植物学报,1996,9:525-535。10.1046 / j.1365 - 313 x.1996.09040525.x。
- 58.
Ito Y, Kitagawa M, Ihashi N, Yabe K, Kimbara J, Yasuda J, Ito H, Inakuma T, Hiroi S, Kasumi T: dna结合特异性,转录激活潜能,和rin番茄果实成熟调节剂的突变效应RIN。植物学报,2008,29(3):344 - 344。10.1111 / j.1365 - 313 x.2008.03491.x。
- 59.
Kumar R, Sharma MK, Kapoor S, Tyagi AK, Sharma AK: rin突变果实的转录组分析和差异调控基因启动子的硅晶片分析为番茄成熟中lemads - rin调控的乙烯依赖和乙烯不依赖方面提供了深入的见解。中国生物医学工程学报,2012,27(3):344 - 344。10.1007 / s00438 - 011 - 0671 - 7。
- 60.
Manning K, Tör M, Poole M, Hong Y, Thompson AJ, King GJ, Giovannoni JJ, Seymour GB:一种编码SBP-box转录因子的基因自然发生的表观遗传突变抑制番茄果实成熟。王志强。2006,38(4):344 - 344。10.1038 / ng1841。
- 61.
Ergun M, Jeong J, Huber DJ, Cantliffe DJ: 1-甲基环丙烯对“加利亚”瓜成熟和软化的抑制作用。植物科学,2005,40:170-175。
- 62.
Hiwasa K, Kinugasa Y, Amano S, Hashimoto A, Nakno R, Inaba A, Kubo Y:乙烯对梨软化的起始和发展都是必要的(梨。)水果。应用物理学报,2003,34(3):379 - 379。10.1093 / jxb / erg073。
- 63.
Nishiyama K, Guis M, Rose JK, Kubo Y, Bennett KA, Wangjin L, Kato K, Ushijima K, Nakano R, Inaba A, Bouzayen M, Latche A, Pech JC, Bennett AB:乙烯对果实软化和细胞壁分解的调控Charentais瓜。应用物理学报,2007,38(3):357 - 357。10.1093 / jxb / erl283。
- 64.
Saladié M, Matas AJ, Isaacson T, Jenks MA, Goodwin SM, Niklas KJ, Xiaolin R, Labavitch JM, Shackel KA, Fernie AR, Lytovchenko A, O 'Neill MA, Watkins CB, Rose JK:影响番茄果实软化和完整性的关键因素的重新评价。中国植物学报,2007,44(2):344 - 344。10.1104 / pp.107.097477。
- 65.
闫丽玲,翟启忠,魏金娟,李玉生,王波,黄婷婷,杜敏敏,孙建强,康林,李柏生,李春春:番茄脂氧合酶D在创伤诱导茉莉酸盐生物合成及植物对植食性昆虫免疫中的作用。公共科学学报,2013,9 (12):e1003964-10.1371/journal.pgen.1003964。doi: 10.1371 / journal.pgen.1003964
- 66.
弗雷泽PD, Pinto ME, Holloway DE, Bramley PM:技术进展:高效液相色谱与光电二极管阵列检测在植物类异戊二烯代谢分析中的应用。植物学报,2000,24:551-558。10.1046 / j.1365 - 313 x.2000.00896.x。
- 67.
Bino RJ, de Vos CH R, Lieberman M, Hall RD, Bovy A, Jonker HH, Tikunov Y, Lommen A, Moco S, Levin I:光超反应高色素2 dg番茄突变:果实代谢组的改变。环境科学学报,2005,26(3):344 - 344。10.1111 / j.1469-8137.2005.01362.x。
- 68.
Livak KJ, Schmittgen TD:利用实时定量PCR技术分析相关基因表达数据——ΔΔCT方法。方法,2001,25:402-408。10.1006 / meth.2001.1262。
- 69.
Wu T, Abbott JA:番茄保存完整或切片的硬度和力松弛特性。生物技术,2002,24:59-68。10.1016 / s0925 - 5214(01) 00133 - 8。
- 70.
付娟,褚娟,孙晓霞,王娟,闫春:用超高效液相色谱-串联质谱(UPLC-MS/MS)单次固相萃取纯化-同位素稀释法同时测定损伤番茄中多种含羧基植物激素。中华泌尿外科杂志,2012,28:1081-1087。10.2116 / analsci.28.1081。
确认
我们感谢博士们的专业知识。褚金芳,孙晓红,闫存玉(中国科学院遗传与发育生物学研究所国家植物基因研究中心(北京)),测定了番茄果实的ABA含量。国家重点基础研究与发展计划项目(2009CB118505)和国家自然科学基金项目(31071338,31171474)资助。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
NNM鉴定了凭证标本并进行了番茄转化,进行了大量分子遗传研究和数据分析。NNM也起草了手稿。HLF进行了酵母- 1杂交实验。XM和DL参与表型分析。DYY参与了向量构建和数据分析。CAW和QWM构思了本研究,参与了本研究的设计和协调,并起草了手稿。所有的作者都阅读并批准了最终的手稿。
电子辅助材料
12870 _2014_351_moesm1_esm.tiff
附加文件1:图S1。:The schematic presentation of the carotenoid biosynthesis pathway in plants. DMAPP, dimethylallyl diphosphate; GGPP, geranylgeranyl pyrophosphate; PSY, phytoene synthase; PDS, phytoene desaturase; ZDS, ζ -carotene desaturase; LCYb, lycopene β -cyclase; LCYe, lycopene ε -cyclase; CHYb, β -carotene hydroxylase; ZEP, zeaxanthin epoxidase; VDE, violaxanthin de-epoxidase. (TIFF 301 KB)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。
本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。
如欲查看本牌照的副本,请浏览https://creativecommons.org/licenses/by/4.0/。
创作共用公共领域奉献弃权书(https://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
马,N.,冯,H.,孟,X。et al。番茄过表达SlNAC1转录因子改变果实色素沉着和软化。BMC植物生物学14日,351(2014)。https://doi.org/10.1186/s12870-014-0351-y
收到了:
接受:
发表:
关键字
- 脱落酸
- 乙烯
- 水果成熟
- 基因表达
- SlNAC1
- 番茄