摘要
背景
茶树(茶树(l)是经济上最重要的木本作物之一。近年来,在茶树育种中发现了许多叶色基因型,已成为绿茶加工的重要材料。虽然部分茶树叶色突变体的生理特性已被揭示,但导致茶树叶色表型的分子机制尚不清楚。
后果
通过茶树育种,筛选出黄叶茶品种中黄2号(ZH2)。与龙井43 (LJ43)相比,广泛种植的绿茶品种ZH2表现出叶绿素含量显著降低的叶绿素表型。透射电镜分析表明,ZH2的叶绿体超微结构被破坏,基粒堆积较差。ZH2的茶氨酸和游离氨基酸含量显著高于LJ43,而类胡萝卜素、儿茶素和花青素含量低于LJ43。基因芯片分析表明,与LJ43相比,ZH2枝条中259个氨基酸代谢、光合作用和色素代谢相关基因的表达发生了显著改变。通过对4902个差异表达基因的通路分析,发现24个通路被显著调控,包括“半胱氨酸和蛋氨酸代谢”、“甘氨酸、丝氨酸和苏氨酸代谢”、“类黄酮生物合成”、“卟啉和叶绿素代谢”和“类胡萝卜素生物合成”。此外,一些差异表达基因可以被定位到“茶氨酸生物合成”、“叶绿素生物合成”和“类黄酮生物合成”途径。这些途径中相关基因表达的变化可能是导致ZH2表型不同的原因。
结论
鉴定了一个新的缺叶绿素茶树品种。生化特性分析和基因表达谱使用定制的寡核苷酸芯片。本研究为进一步深入研究白花苜蓿品种表型的分子机制提供了依据茶树.
背景
茶厂(茶树(l)O. Kuntze),是世界上经济上最重要的木本作物之一,用于生产一种非酒精饮料。1].茶树种质中存在很大的遗传变异[2]、[3.].近年来在茶树育种中培育出了许多叶色品种,已成为绿茶加工中的重要材料。例如,在中国种植的两种白化茶品种“白叶1号”(安吉白茶)和“小雪叶”,在早春环境温度低于20°C时,幼苗呈白色[4]、[5].叶绿体的发育和叶绿素的积累一个和b在这两个白化品种的白化阶段被阻断[5] - [7].除了在“Baiye 1”和'Xiaoxueya'中对应于低叶绿素内容物的叶子颜色变化,叶子化学成分也有变化,这是茶的感官质量和健康影响的重要决定因素[4]、[8].与普通绿茶相比,这两个品种的叶片中检测到更高的总游离氨基酸浓度[4]、[8].白化品种因其独特的叶色和丰富的游离氨基酸而受到越来越多的关注,并受到中国茶叶消费者的欢迎。
叶绿素、类胡萝卜素和类黄酮/花青素是叶片组织中三个主要的色素类,其中叶绿素和类胡萝卜素是光合生物捕获光能的主要色素。已有研究表明,失绿叶片的发育与叶绿素代谢和叶绿体发育有关[5]、[7]、[9] - [12].叶绿素的生物合成发生在叶绿体的基粒中。叶绿素生物合成涉及一系列酶的步骤,其中包括谷氨酸转化为叶绿素一个和叶绿素b[13].叶绿素生物合成途径主要分为3个部分:(i) 5-氨基乙酰丙酸(ALA)的形成;(ii)由8个ALA分子形成原卟啉IX; (iii)产生叶绿素的mg -原卟啉途径[14].在植物中已经发现了大量叶绿素缺乏的叶色突变体,并对影响叶绿素生物合成的调控途径进行了研究。
据报道,缺乏叶绿素的大麦突变体b由于缺乏转化叶绿素的酶,表现为绿藻表型一个在叶绿素b[15].自交系A661在低于15°C的温度下生长时,其叶绿素含量显著降低[16].Mg的螯合作用2+在原卟啉IX中形成mg -原卟啉复合物是叶绿素生产中唯一的重要步骤。催化这种插入的酶被称为mg -螯合酶,它由三个亚基组成,ChlD、ChlH和ChlI,当其中任何一个亚基发生突变时,mg -螯合酶活性就会消失[14]、[17]、[18].在多种植物中发现了编码mg螯合酶亚基的基因缺陷的氯突变体[14].突变体的拟南芥ch42-3和gun5缺乏ChlI和ChlH,分别与Mg螯合不足2+转化为原卟啉IX [19]、[20.].有突变的水稻植株OsChlH,OsChlD和OsChlI显示氯表型[9]、[11].大麦突变体缺乏ChlH,ChlD或ChlI无法合成叶绿素[10].减少或过度积累ChlI导致叶绿素的损失[21].除了编码mg螯合酶的基因外,其他与失绿叶片相关的基因也已被鉴定出来,如OsYGL1,它编码一个叶绿素合酶,负责催化叶绿素酯化,OsYLC1,这是一个叶绿体定位基因oslyl1.,它编码香叶酰香叶酰还原酶[12]、[22]、[23].这些基因会影响叶绿素的生物合成和改变叶绿素含量。
叶绿素含量降低的植物是研究叶绿素表型和叶绿体发育的分子调控机制的理想遗传材料。与已知基因组序列的模式植物研究相比,茶树基因组信息的缺乏导致了茶树分子生物学研究的滞后。虽然部分茶树叶色基因型的生理特性已被揭示,但其调控叶绿素缺失的分子机制尚不清楚。
本研究比较了普通绿茶品种龙井43 (LJ43)和新叶绿素缺乏型氯代茶品种中黄2 (ZH2)的生化特性。对两个品种的叶片叶绿素含量和叶绿体超微结构进行了研究。此外,还测定了叶中类胡萝卜素、茶氨酸、氨基酸和类黄酮的含量。为了揭示这两种茶叶品种之间差异的潜在分子机制,我们使用了一种定制的基于寡核苷酸的微阵列[24[鉴定了两种品种中的基因表达,并鉴定了差异表达基因,包括与氨基酸代谢,光合作用和颜料代谢相关的基因。
方法
植物材料和样品的制备
两棵茶树(茶树(l)本研究以昆子(O. Kuntze)栽培品种‘龙井43 (LJ43)’和‘中黄2 (ZH2)’为材料。该植株已在中国农业科学院茶叶研究所(TRI, CAAS, N 30°10 ',E 120°5 ')田间生长5年。LJ43是一个普通的绿茶品种,在中国广泛种植,特别是在浙江省。ZH2是通过系统筛选,从浙江某天然黄叶突变体中筛选出的黄叶品种。
对于化学分析和微阵列分析,第一个新出芽的新鲜芽(两片叶子和一个芽)在春季取样,并进行三个独立的生物重复。每个重复从10多个随机选择的茶树中采集。样品分为两个重复,一个蒸5分钟,在80°C下干燥并研磨成粉末用于化学分析,另一个储存在−用液氮快速冷冻后80°C进行微阵列分析。
叶绿素、-胡萝卜素和叶黄素含量的测定
用80%丙酮从100 mg的干燥样品中提取叶绿素。提取液在645 nm和663 nm分光光度法测定。叶绿素含量按Arnon [25],而叶黄素和-胡萝卜素含量则如前所述通过高效液相色谱法测定[26].
茶氨酸,游离氨基酸,儿茶素和花青素的测定
为了测定茶氨酸和儿茶素,将100 mg干燥样品在50 ml水中于90℃下提取30 min,每10 min振荡1次。将滤液稀释后,用0.45 μm尼龙过滤器再过滤,用高效液相色谱分析[27].花青素含量的测定方法如前所述[28].
用茚三酮比色法测定总游离氨基酸。简单地说,在沸水浴中提取3 g干样品,在450ml H中提取45分钟2O(每10分钟摇晃一次)。过滤后,通过添加H将滤液体积增加至500 ml2将1 ml溶液转移到25 ml烧瓶中。加入0.5 ml含有63 mM Na的缓冲液(pH 8.0)2HPO4和3毫米kh2阿宝4, 0.5 ml 2%茚三酮溶液(2 g茚三酮和80 mg SnCl2.2H.2加入O溶于100 ml水),在沸水浴中孵育15 min,加入H,体积增至25 ml2O.使用分光光度计测定570nm处的溶液的吸收值。通过不同浓度的谷氨酰胺产生的标准曲线计算总游离氨基酸含量。
透射电子显微镜(TEM)分析
根据Du等人描述的方法,通过透射电镜观察叶绿体的超微结构[5].叶片(新梢)切成小片,用2.5%戊二醛固定,4℃过夜。然后用0.1 M磷酸盐缓冲液(pH 7.0)洗涤样品3次(每次15分钟),随后在1% (v/v)的OsO中重新固定4再用0.1 M磷酸盐缓冲液清洗。将固定样品分别用50%、70%、80%、90%和95%的乙醇分级脱水,每一步脱水15 min,然后用100%乙醇浸泡20 min。然后用环氧树脂和丙酮(v/v = 3/1)包埋1 h。最后在70℃纯环氧树脂包埋过夜。
包埋后,用Reichert-Jung超切切片机(Reichert-Jung, Heidelberg, Germany)切割70 - 90nm厚的切片。切片用饱和乙酸铀酰在50%乙醇和0.2% (w/v)柠檬酸铅中染色15分钟。在JEM-1230显微镜(JEOL, Akishima, Tokyo, Japan)下检查了这些图像。
微阵列数据分析
如前所述,从ZH2和LJ43茶树叶片样品中提取0.5 g至1 g总RNA [29用于基因芯片和qRT-PCR检测。60聚寡核苷酸探针和微阵列由eArray (Agilent)设计。芯片上的探针基于我们实验室从454 RNA-seq数据集中获得的42440个ungene序列[24]。微阵列数据保存在NCBI基因表达综合数据库(GEO)中,登录号为GSE52255[24].
使用特征提取软件(10.7.1.1,Agilent Technologies)对阵列图像进行分析,获得原始数据。使用genspring完成原始数据的基础分析。原始数据采用分位数算法归一化。每个条件中至少有一个条件的探测P“选择进一步的数据分析。随后基于观察到的折叠变化和使用a的差异表达基因鉴定t-test-calculatedP价值。差异表达基因定义为在基因表达试验中表现为AP-value < 0.05 and a fold change >根据京都基因和基因组百科全书(KEGG)确定了重要途径。路径选择采用Fisher精确检验,显著性阈值定义为aP-value < 0.05和错误发现率(FDR) < 0.05。
实时定量rt - pcr
用5微克RNA合成cDNA。RNA样本用RNase-free DNase I(扩增级,Invitrogen公司,Carlsbad, CA, USA)处理以去除残留的基因组DNA。第一链cDNA合成使用SuperScript®III逆转录酶(Invitrogen, Carlsbad, CA, USA)。应用生物系统公司7500序列检测系统(Carlsbad, CA, USA)使用SYBR®Premix Ex Taq™II (TaKaRa Biomedicals)进行实时定量RT-PCR。引物对被测基因的扩增效率见附加文件1.对每个cDNA样品进行三份定量测定,并使用18S rRNA参考基因作为内部对照。相对于使用2的18s rRNA的水平计算相对转录水平——ΔΔCt公式(30.].所有数据均以平均值±SD (n= 3)。所有qRT-PCR引物序列见附加文件2.
数据的统计分析
数据用三个独立生物学重复的平均值±SD表示。通过单因素方差分析确定显著性,组间差异为最低显著性差异(LSD)。t-测试(P< 0.05)。
后果
叶绿素缺乏的氯鱼族种植的生长性能
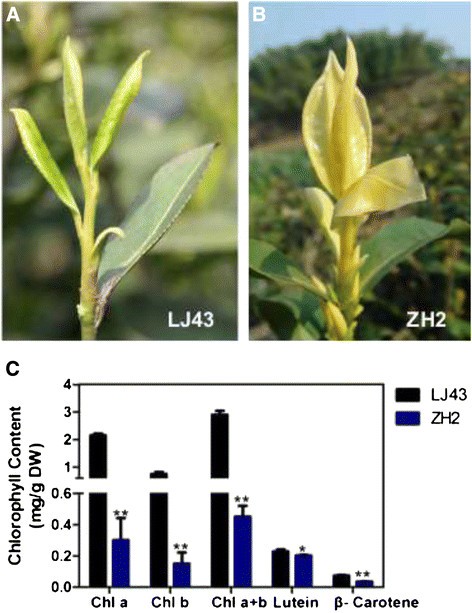
从一个自然突变体中获得了一个黄叶品种,命名为ZH2。在春季,ZH2呈现出黄色的新芽,这与在中国广泛种植的绿茶品种LJ43不同(图)1A和B)。众所周知,叶片变绿是叶绿素生物合成的结果,对茶树的两片叶片和一个芽进行了叶绿素含量测定。结果表明,在ZH2中,叶绿素含量均高于对照一个和叶绿素b含量显著低于LJ43(分别约为LJ43的14%和20%);数字1C).这些结果表明,ZH2叶片变黄是叶绿素水平降低的结果,而叶绿素含量降低可能是叶绿素合成异常的结果。
类胡萝卜素是脂溶性色素,是光合机构的重要组成部分。β-胡萝卜素和叶黄素是茶叶中发现的主要类胡萝卜素,是两种营养重要的植物源类胡萝卜素[31].水稻色素缺失突变体ylc1表现出褪绿表型,叶绿素和叶黄素水平降低[22].测定了两个品种的β -胡萝卜素和叶黄素含量。结果表明,ZH2的幼枝中-胡萝卜素和叶黄素的含量分别降低到LJ43的48.8%和88.6%(图2)1C)。
LJ43和ZH2叶绿体的超微结构
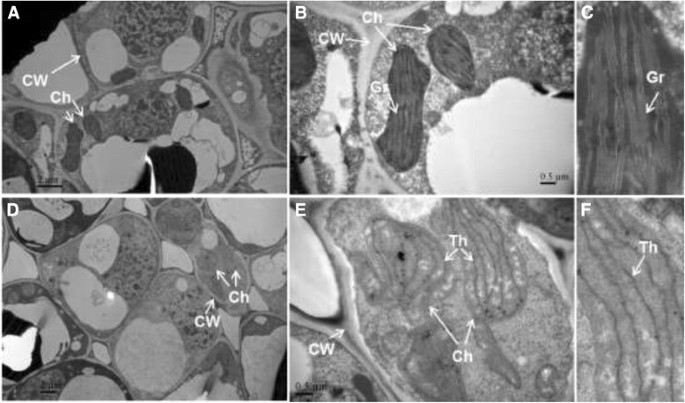
光系统包括位于基粒中的叶绿素和其他色素。组成基粒的囊状膜被称为类囊体。为了解ZH2叶片变黄的原因,我们通过透射电镜研究了负责叶片变绿的叶绿体的超微结构。透射电镜分析显示,LJ43植物叶绿体具有典型的超微结构,由基粒和类囊体组成2而在ZH2的叶绿体中,基粒堆叠消失,只剩下少量类囊体(图2)2d到f)。这结果表明,Zh2的叶子颜色的变化可能是难题造成伤害的结果。
LJ43和ZH2的茶氨酸、氨基酸和类黄酮含量
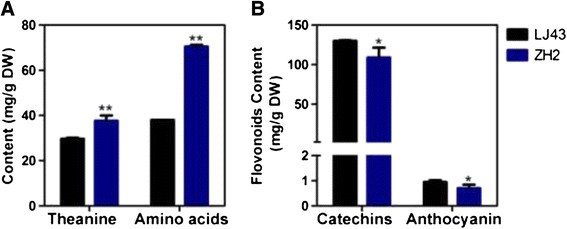
氨基酸对绿茶的感官品质很重要[32].茶氨酸最早在茶叶中发现,是茶树中含量最丰富的游离氨基酸,对人体健康有益[33] - [37]对LJ43和ZH2的两片叶和一个芽中的茶氨酸和总游离氨基酸含量进行了分析。结果表明,ZH2叶片中的茶氨酸和总游离氨基酸含量显著高于LJ43(图1)3.一个)。
黄酮类化合物对茶叶质量很重要,通过一条支路合成,该支路产生无色化合物(如黄酮醇)和有色色素(如花青素)[38].儿茶素占绿茶类黄酮总量的60%至80% [39].对枝条中儿茶素和花青素含量的测定表明,ZH2低于LJ43(图)3.B)。
基因表达的微阵列分析
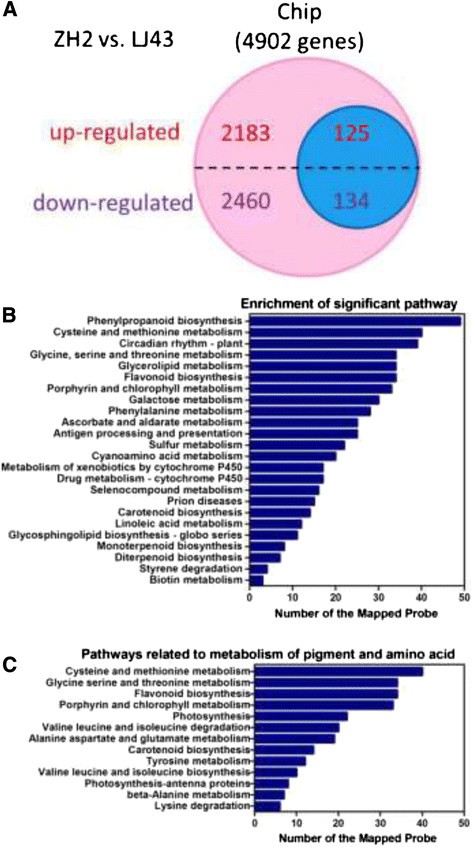
为了研究ZH2的性能,我们研究了ZH2和LJ43之间基因表达的差异,以阐明ZH2植物不同表型的原因。使用自定义微阵列评估ZH2和LJ43中的整体基因表达。显著(P< 0.05)。图中列出了ZH2与LJ43相比差异2倍以上的表达4A.共鉴定出差异表达基因4,902个,其中ZH2中表达上调的基因2,308个,表达下调的基因2,594个(图)4A).蓝色圆圈表示氨基酸代谢、色素(叶绿素、类胡萝卜素和类黄酮)代谢和光合作用相关基因(125个上调,134个下调)(图)4一个额外的文件3.).
基于基因本体论(GO)对差异表达基因(P-value < 0.05, fold-change > 2)在ZH2和LJ43之间。显著的GO项在临界值处确定P值< 0.05。AgriGO在4902个至少有一个显著GO项的差异表达基因中注释了3182个,并根据“生物过程”、“分子功能”和“细胞成分”类别及其子类别对注释的探针进行了分类(见表)1).在这三个成分中,“生物过程”类别中的“代谢过程”子类别占了GO注释的大部分,其次是“分子功能”下的“结合”(见表)1).
为了识别生物学途径,这些基因用来自BLASTX比对KEGG数据库的相应酶委员会(EC)编号进行注释。通过将这4902个差异表达基因与KEGG中的Gene id关联,绘制出255条通路(附加文件)4).在这些途径中,有24个途径,包括“半胱氨酸和蛋氨酸代谢”、“甘氨酸、丝氨酸和苏氨酸代谢”、“类黄酮生物合成”、“卟啉和叶绿素代谢”和“类胡萝卜素生物合成”,被认为是重要的P-value < 0.05 and FDR < 0.05(图4B).这些途径被认为是ZH2异常表型的重要因素。259个基因(附加文件3.)从图中所示的上下调节数据集4A(蓝色圆圈)分为12个通路,每个通路的富集情况如图所示4C。
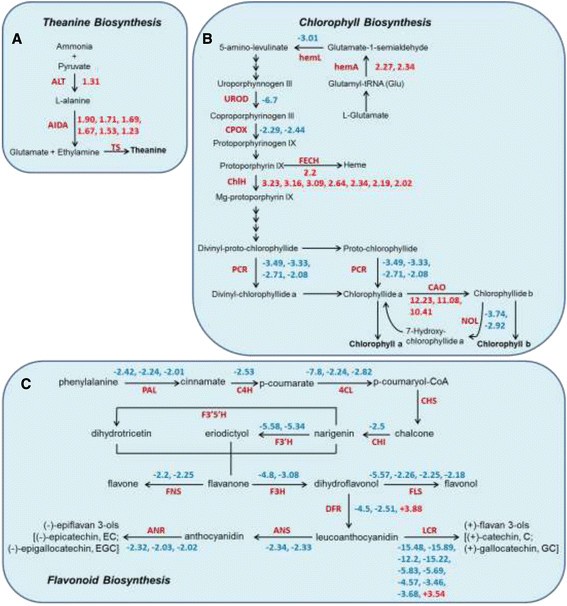
当检查感兴趣的途径时,可以将几种差异表达的基因映射到“茶氨酸生物合成”,“叶绿素生物合成”和“黄酮类生物合成”途径。Theanine由谷氨酸和乙胺通过Theanine合成酶合成(TS) [40].乙胺似乎是由丙氨酸脱羧酶(阿伊达) [40].TS和阿伊达在我们的数据集中没有找到。的阿伊达如图5A是从精氨酸脱羧酶同源物中选择的(ADC.),其领域与阿伊达[41]、[42].丙氨酸氨基转移酶(ALT) 和阿伊达明显(P-value < 0.05),说明ZH2中茶氨酸含量较高可能是参与茶氨酸生物合成的两个基因转录水平较高的结果(图2)5一个)。
这是三种途径中基因转录水平显著变化的示意图。(一)参与“茶氨酸生物合成”途径的基因(注意,AIDA是从精氨酸脱羧酶(ADC)同源物中选择的)。(B)参与叶绿素生物合成途径的基因。(C)参与“类黄酮生物合成”途径的基因。“类黄酮生物合成”途径是根据史教授绘制的et al。[41].数字代表折叠变化;正数表明(P< 0.05)上调基因,而阴性基因则显著(P< 0.05)下调基因。
叶绿素生物合成途径中9个基因表达差异(P-价值观 < 0.05,折叠变化 > 2、 4个上调和5个下调基因)。5-氨基乙酰丙酸(ALA)转化为叶绿素的关键连续酶的表达一个在ZH2中发生了不同程度的改变(图5B)。CHLH是Mg-Chelatase的亚基,在Zh2上调。编码酶如早期酶促步骤中的成绩单,从形成谷氨酸-1-半醛与原生卟啉IX,显示出较低的水平。还抑制了用于将Mg-原卟啉IX转换为叶绿素的关键酶(图5B)。
与LJ43相比,ZH2的儿茶素和花青素含量较低(图2)3.B).为了检测ZH2中与“类黄酮生物合成”相关的基因表达是否发生了改变,我们使用EC数字搜索了差异表达的基因,发现ZH2中与“类黄酮生物合成”相关的基因表达显著下调(图)5C),这与ZH2嫩枝中儿茶素和花青素含量较低一致。
部分差异表达基因的定量RT-PCR验证
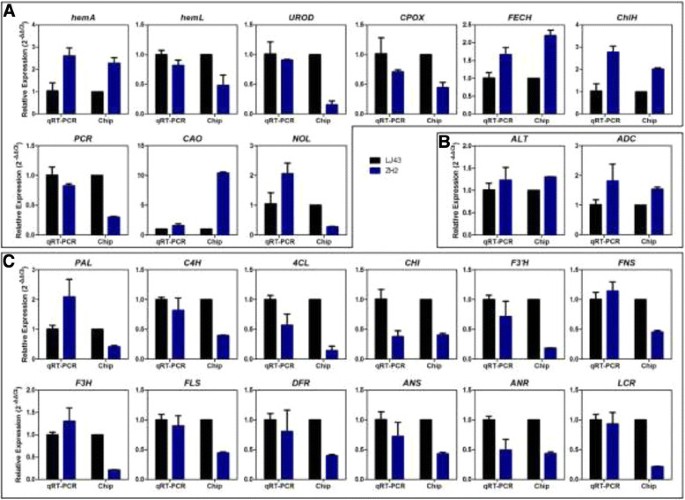
为了确认微阵列数据和叶绿素生物合成、茶氨酸生物合成和类黄酮生物合成相关基因的表达变化,进行了qRT-PCR。检测到23个基因(包括2个茶氨酸合成基因、9个叶绿素合成基因和12个类黄酮合成基因)的表达。通过qRT-PCR检测到的19个基因的表达模式与微阵列数据中观察到的表达模式相似,而4个基因(CSNOL,CSPAL,CSFN,CSF3H)显示了不同的表达式模式(图6).RACE从这23个基因中随机选取10个基因进行克隆,以支持qRT-PCR在两个品种中检测到的差异表达基因是可信的(附加文件)5).总的来说,qRT-PCR结果与微阵列数据具有良好的相关性。
讨论
茶叶品种由于其叶片的化学成分不同,呈现出独特的颜色变化而受到越来越多的关注。在这项研究中,我们报道了一个新的叶绿素缺乏的氯茶品种,呈现黄色的新梢表型(图1)在茶树育种过程中选择了ZH2品种,并对ZH2进行了遗传和生化鉴定。
色素分析表明,ZH2的幼枝表型与叶绿素、-胡萝卜素和叶黄素水平呈正相关(图2)1)叶绿体中基粒发育受阻似乎阻碍了ZH2中叶绿素和类胡萝卜素的生物合成,ZH2叶片中的光合作用受到抑制。最近,Feng等人发现,类胡萝卜素和叶绿素丰度的降低伴随着白化茶中游离氨基酸丰度的增加屋檐[43].这种发现符合我们的结果,表明Zh2在Zh2中降低了叶绿素和叶氏菌和叶黄素的类胡萝卜素的内容物(图1叶绿素和类胡萝卜素对光合器官的生物发生是重要的。类胡萝卜素是在几乎所有类型的质体的膜中合成的,包括叶绿体[44]、[45].在叶绿体中,类胡萝卜素在类囊体膜中形成光合复合体,在保护叶绿素不受破坏方面起着重要作用[46]、[47].因此,类胡萝卜素水平的降低与叶绿素水平的降低有关,色素含量的异常与叶绿体的异常发育有关。这一结果也将有助于我们进一步了解与类胡萝卜素生物合成和光合机构的发展有关的氯现象。
叶绿素含量的变化可能是叶片变黄的原因之一。叶绿素生物合成相关基因表达的改变可能导致ZH2的氯表型。镁螯合酶在叶绿素生成中起重要作用。在植物中,这种酶复合物由三个亚基组成,分别是ChlD、ChlH和ChlI。镁螯合酶缺乏是许多叶绿素缺乏突变体的共同特征。植物缺乏ChlH表现出有缺陷的叶绿素和叶绿素表型[9]、[10]、[20.].虽然ZH2呈现出与突变体类似的叶片表型,如Oschlh,表示CsChlH被发现在Zh2上有上调(数字5乐队6A).考虑mg螯合酶的另外两个亚基,ChlD和ChlI,当它们发生突变时,也可以在植物中引起一个氯表型[11]、[19,我们检查了的表达CsChlD和CsChlI在微阵列数据中。我们发现CsChlI(ZH2与LJ43,P-value = 0.011, fold change = 1.16)CsChlD(ZH2与LJ43,P-value = 0.000031, fold change = 1.27)在ZH2中也略有上调。这表明ZH2中mg -螯合酶的三个亚基的表达并没有中断,也说明ZH2的氯表型与mg -螯合酶亚基的缺失不相关,这在其他植物中已经报道过。然而,这些基因可能在转录后水平上发生了变化,从而影响了ZH2表型。
在茶树, Ma(2012)利用5k cDNA芯片分析了“安吉白茶”品种不同白化阶段的差异表达基因CsChlH在淡白色芽期上调,与我们的研究结果一致[48].据报道,基因的表达减少或增加ChlI转基因烟草降低镁螯合酶活性和叶绿素合成[21].活性镁螯合酶需要每个亚基的平衡比例,过量的ChlI亚基可能会扰乱酶复合物的正确组装[21].在本研究中,CsChlH表现出更高的诱导水平CsChlD和CsChlI这可能会破坏三个亚基的平衡,从而影响ZH2中mg -螯合酶的活性。
在ZH2中发现,参与“叶绿素生物合成”途径早期酶促步骤的基因编码酶被抑制(图)5B). ALA合成相关活性降低以及由此产生的原卟啉IX含量降低与mg -螯合酶活性降低直接相关[49].曹叶绿素是必需的b合成,和表达曹在没有足够叶绿素的植物中表达上调b[50].本研究显示,该基因的转录水平增加CsCAO这与ZH2的叶绿素含量较低是一致的b内容(数据1C和5B).有趣的是,ZH2的叶绿素表型在遮荫处理下消失(未发表数据),我们推测ZH2叶绿素代谢紊乱的叶绿素表型可能受到光的调控。未来可以通过遮荫处理来研究弱光对叶绿体表型和基因表达模式的影响。
通过微阵列分析,确定了差异表达基因。其中有24条途径被显著调控,其中许多途径与氨基酸代谢和色素代谢有关,而这些途径与ZH2中观察到的叶绿素和氨基酸的不同含量密切相关(图2)4B).此外,许多对植物生长和发育重要的次级代谢过程,如“类黄酮生物合成”被显著富集[51].有报道称茶树白化过程中儿茶素含量下降,这与我们的研究结果一致[43]、[52].与“类黄酮生物合成”相关的基因在ZH2中被抑制(图2)5C).这种抑制可能是ZH2中发现的花青素色素和儿茶素含量降低的原因(图2)3.B).花青素/类黄酮是植物组织中红色、蓝色和紫色花青素色素的来源[53].花青素水平的降低可能与ZH2叶片颜色的变化有关。一些次级代谢过程,虽然不是“类黄酮生物合成”,也显著富集(图)4B),表明ZH2的次生代谢产物发生了改变,因此今后研究ZH2的代谢谱很有意义。
在本研究中,我们比较了一个氯代茶树品种(ZH2)和一个普通绿茶品种(LJ43)的生化成分和转录组,发现在生化成分和转录组谱上有许多差异。微阵列分析显示,一些差异表达的基因可以被定位到KEGG的“茶氨酸生物合成”、“叶绿素生物合成”和“类黄酮生物合成”途径。这三个途径中相关基因的表达变化可能是ZH2茶氨酸含量和氯表型升高的原因。因此,本研究为进一步了解该品种表型的分子机制提供了依据茶树.然而,由于无法获得茶树基因组序列信息,本研究中注释的基因可能无法发挥预期的功能,我们不能排除我们对差异表达基因的分析可能受到不恰当注释的影响。由于ZH2和LJ43不具有相同的遗传背景,我们在本研究中发现的许多变化可能是推测的和初步的。但由于游离氨基酸、儿茶素、黄酮类化合物和色素等表型性状的含量受遗传因素控制,因此ZH2和LJ43之间的差异可能是基因表达的变化造成的。我们还发现,氯表型是遗传的F1结果表明,在ZH2中观察到的氯现象受光照和时间的影响。因此,本研究的结果可能为阐明茶树叶绿素表型的基本机制提供了新的思路。今后,我们将进一步研究调控ZH2氯表型的调控因素(如环境因素和遗传因素)。
结论
综上所述,我们分析了新品种中黄2号(ZH2)的生理特性,并使用4X 44k定制寡核苷酸芯片(GSE52255)进行了基因表达谱分析。ZH2叶片叶绿素含量较低,叶绿体超微结构异常,表明叶绿素生物合成受到部分抑制。在其他叶色突变品种中观察到茶树而ZH2的茶氨酸和游离氨基酸含量较高。差异表达分析结果显示,有4902个基因在两个品种中存在差异表达,其中有24个调控途径存在显著差异,包括氨基酸代谢途径和色素代谢途径。这可能与ZH2较高的氨基酸含量和叶绿素缺乏表型有关。进一步的分析表明,许多差异表达基因可以被定位到基于KEGG的“茶氨酸生物合成”、“叶绿素生物合成”和“类黄酮生物合成”途径。这三个途径中相关基因的表达变化可能是ZH2茶氨酸含量和氯表型升高的原因。我们的研究为进一步了解该品种表型的分子机制提供了依据茶树.
附加文件
缩写
- ADC:
-
精氨酸脱羧酶
- 《阿伊达》:
-
丙氨酸脱羧酶
- 阿拉巴马州:
-
Ainolevulinic酸
- ALT:
-
丙氨酸氨基转移酶
- ANR:
-
花青素还原酶
- ANS:
-
花青素合成酶
- 曹:
-
脱植基叶绿素的加氧酶
- C4H:
-
肉桂醛4-羟化酶
- 气:
-
Chalcone异构酶
- ChlH:
-
镁切酶亚单位H.
- CHS:
-
查耳酮合酶
- 4 cl:
-
4-coumarate辅酶a连接酶
- CPOX:
-
Coproporphyrinogen氧化酶
- DFR:
-
Dihydroflavonol 4-reductase
- 欧共体:
-
酶委员会
- FDR:
-
错误发现率
- 他进来:
-
亚铁螯合酶
- F3H:
-
黄烷酮3-hydroxylase
- F3'H:
-
黄酮类化合物3'-羟化酶
- F3’5是什么:
-
类黄酮3 ',5 ' -羟化酶
- 读者:
-
黄酮醇合成酶
- fn:
-
黄酮合成酶
- 地理:
-
基因表达综合
- 走:
-
基因本体论
- -:
-
Glutamyl-tRNA还原酶
- hemL:
-
谷氨酸-1-半醛氨基转移酶
- 凯格:
-
Kyoto基因和基因组的百科全书
- 电感电容电阻测量:
-
Leucoanthocyanidin还原酶
- NOL:
-
叶绿素b还原酶
- 朋友:
-
苯丙氨酸氨溶解
- PCR:
-
原叶绿素酸脂还原酶
- TEM:
-
透射电镜
- TS:
-
茶氨酸合成酶
- UROD:
-
Uroporphyrinogen三世脱羧酶
参考文献
- 1.
陈玲,周志新,杨宇军:茶树遗传改良与育种(茶树):从个体选择到杂交和分子育种。acta physica sinica, 2012, 32(1): 457 - 461。10.1007 / s10681 - 006 - 9292 - 3。
- 2.
陈静,王鹏,夏勇,徐敏,裴胜:遗传多样性与分化茶树云南栽培茶及其野生近缘种的形态、生物化学和等位酶研究。植物遗传资源学报,2005,52(1):41-52。10.1007 / s10722 - 005 - 0285 - 1。
- 3.
茶树的遗传变异与分化(茶树)的RAPD和AFLP变异。植物营养与肥料学报,2011,30(4):527 - 534。
- 4.
杜勇,梁勇,王浩,王凯,卢军,张刚,林伟,李明,方强:白化茶树品种化学成分的研究。中国农业科学,2016,35(5):531 - 534。
- 5.
杜勇,陈辉,钟伟,吴丽,叶军,林超,郑旭,卢杰,梁勇:温度对低温诱导茶树叶片叶绿素积累和超微结构的影响。生物技术学报,2008,7(12):1881-1885。
- 6.
程浩,李S,陈敏,余芳,颜杰,刘烨,陈磊:安吉白茶非凡性状的生理生化本质。茶叶科学学报,1999,19:87-92。
- 7.
李强,黄军,刘世丽,李军,杨旭,刘勇,刘志:白化茶树幼叶发育三个阶段的蛋白质组学分析。蛋白质组学。2011,9(44):1-12。
- 8。
关键词:白化病,白化,氨基酸,突变体1”。茶叶科学。1996,16:153-154。
- 9。
郑锴,许志强,刘志强,崔雅,郑永强,宫瑶,广奇卡,安广:水稻叶绿素缺乏突变体的T-DNA诱捕系统研究。植物生理学报。2003,44(5):463-472。10.1093 /卡式肺囊虫肺炎/ pcg064。
- 10.
Jensen PE, Petersen BL, Stummann BM, Henningsen KW, Willows RD, Vothknecht UC, Kannangara CG, Wettstein D:大麦中mg -螯合酶亚基的结构基因:Xantha-f,−g和h。王志强。中国海洋大学学报(自然科学版)。
- 11.
Li J, liu J, liu S, zhao S, Koh H, Seo H, Paek N:水稻氯-1和氯-9编码叶绿素合成和叶绿体发育的关键酶mg -螯合酶ChlD和ChlI亚基。acta botanica sinica, 2017, 36(3): 362 - 367。10.1007 / s11103 - 006 - 9024 - z。
- 12.
吴志强,张晓霞,何斌,高立生,王静,郭欣,苏宁,王丽,姜玲,王超,翟华,万军:一种叶绿素缺乏突变体,在叶绿素生物合成中叶绿素酯化作用减弱。植物生理学。2007,145(1):29-40。10.1104 / pp.107.100321。
- 13.
李志强,李志强,李志强。叶绿素生物合成。acta botanica sinica(云南植物学报),2012,30(4):427 - 434。10.1105 / tpc.7.7.1039。
- 14.
四吡咯生物合成的调控网络——研究细胞内信号参与质体代谢和发育控制的研究。acta botanica sinica, 2010, 31(5): 657 - 662。10.1007 / s004250100593。
- 15.
李志刚,李志刚:叶绿素b缺失大麦突变体叶绿素生物合成系统的分析。中国图象图形学报,1998,18(1):71-80。10.1023 /: 1006023122582。
- 16.
Rodríguez VM, Velasco P, Garrido JL, Revilla P, Ordás A, Butrón A:玉米自交系A661冷诱导白化病的遗传调控。中国生物医学工程学报。2013,34(12):1357 - 1367。10.1093 / jxb / ert189。
- 17.
Kannangara CG, Vothknecht UC, Hansson, von Wettstein D:镁螯合酶:与核糖体和突变互补研究的关联,确定大麦Xantha-G亚基是Rhodobacter亚基BchD的功能对等物。acta photonica sinica, 2012, 39(1): 1 - 5。10.1007 / s004380050394。
- 18.
Papenbrock J, Grafe年代,克鲁斯E, F Hanel,格林B: Mg-chelatase烟草:背影D cDNA序列编码的识别第三单元,分析三个亚基之间的相互作用的酵母2台混合动力系统,由co-expression、还原酶活性的重组的背影,背影的背影。植物J . H和1997,12 (5):981 - 990。10.1046 / j.1365 - 313 x.1997.12050981.x。
- 19。
李志强,李志强,李志强,等:叶绿素生物合成。镁螯合酶的第二个Chl I基因在拟南芥中的表达仅支持有限的叶绿素合成。植物营养与肥料学报。2002,28(2):429 - 434。10.1104 / pp.010625。
- 20.
Mochizuki N, Brusslan J, Larkin R, Nagatani A, Chory J:拟南芥基因组解耦5 (GUN5)突变体揭示了mg -螯合酶H亚基参与质体到核信号转导。中国科学(d辑:地球科学),2001,19(4):593 - 598。10.1073 / pnas.98.4.2053。
- 21.
Papenbrock J,Pfündele,模拟H,Grimm B:减少和增加亚基CHL的表达,Chl I降低了Mg Chelatase活性并减少了转基因烟草植物中的叶绿素合成。工厂J.2000,22(2):155-164。10.1046 / J.1365-313x.2000.00724.x。
- 22.
王任周K, Y, Lv J, Y,刘F, F周,赵年代,陈年代,彭C,张X,郭X, Z、王J,吴F,江L, Wan J:年轻的叶片萎黄病1、叶绿素、叶黄素所需chloroplast-localized基因积累在叶片发育早期的大米。植物学报。2013,237(1):279-292。10.1007 / s00425 - 012 - 1756 - 1。
- 23.
周y,龚z,杨z,元y,朱茹,王m,元f,吴s,王z,yi c,xu t,ryon m,gu m,梁g:光诱导黄叶的突变1个基因,它们编码甲苯基甲基还原酶,影响水稻中叶绿素生物合成和光敏感性。Plos一个。2013,8(9):e75299-10.1371 / journal.pone.0075299。
- 24.
王L,王x,悦c,曹h,周y,杨y:使用454焦磷酸微阵列的开发44k自定义寡核微阵列进行大规模基因表达分析茶树.中国科学:地球科学。10.1016 / j.scienta.2014.05.024。
- 25.
分离叶绿体中的铜酶:beta vulgaris中的多酚氧化酶。植物生理学报,1994,24:1-15。10.1104 / pp.24.1.1。
- 26.
王X,陈力,马C,姚M,杨Y:茶树种质中β-胡萝卜素和叶黄素含量的基因型变异,茶树(l)o . Kuntze。食品学报。2010,23(1):9-14。10.1016 / j.jfca.2009.01.016。
- 27.
彭L,歌曲X,Shi X,Li J,YE C:一种改进的HPLC方法,用于同时测定酚类化合物,嘌呤生物碱和茶山茶花物种。食品科学,2008,21(7):559-563。10.1016 / j.jfca.2008.05.002。
- 28.
Kerio LC,Wachira FN,Wanyoko JK,Rotich MK:肯尼亚茶叶中花青素的特征:提取和鉴定,《食品化学》2012,131(1):31-38.10.1016/j.foodchem.2011.08.005。
- 29.
Chang S,Puryear J,Cairney J:从松树中分离RNA的一种简单有效的方法。植物分子生物学报告。1993, 11 (2): 113-116. 10.1007/BF02670468。
- 30.
利用实时荧光定量PCR技术对相关基因表达数据进行分析——ΔΔCT方法方法2001,25(4): 402 - 408。
- 31.
茶中的色素。在里面茶叶生物化学。第1章。第3版。Wan XC编辑。中国农业出版社;2003:21-28。
- 32.
梁义,鲁杰,尚科:甘草素对茶叶化学成分和茶叶质量的影响(Camellia Sinensis L.)。J SCI食物农业。1996,72(4):411-414。10.1002 /(SICI)1097-0010(199612)72:4 <411 :: AID-JSFA672> 3.0.co; 2-9。
- 33.
Yokogoshi H,Kato Y,Sagesaka YM,Takihara Matsuura T,Kakuda T,Takeuchi N:茶氨酸对自发性高血压大鼠血压和脑5-羟基吲哚的降低作用。Biosci Biotenol Biochem.1995,59(4):615-618.10.1271/bbb.59.615。
- 34.
Juneja LR,Chu D,Okubo T,Nagato Y,Yokogoshi H:L-Theanine-一种绿茶独特的氨基酸及其在人类中的放松效果。趋势食品SCI技术。1999年,10(6-7):199-204。10.1016 / s0924-2244(99)00044-8。
- 35.
Kakuda T:绿茶成分茶氨酸和儿茶素的神经保护作用。生物医学杂志。2002,25:1513-1518。10.1248 / bpb.25.1513。
- 36.
宋聪,郑健,吴健,金克:茶氨酸对成年男性脑α波释放的影响。韩国营养学杂志,2003,36(9):918-923。
- 37.
Cooper R:绿茶和茶氨酸:对健康的好处。食品科学与营养。2012,63 (S1): 90-97。10.3109 / 09637486.2011.629180。
- 38.
黄酮类化合物:生物化学途径调控和进化的彩色模型。植物科学进展,2005,10(5):236-242。10.1016 / j.tplants.2005.03.002。
- 39.
Higdon JV,Frei B:茶儿茶素和多酚:健康效应、代谢和抗氧化功能。Crit Rev食品科学营养杂志2003,43(1):89-143.10.1080/10408690390826464。
- 40.
邓伟,小田,石原:不同器官中乙胺含量和茶氨酸的生物合成茶树幼苗。自然科学学报。2009,64c: 387-390。
- 41.
史超,杨华,魏超,余欧,张震,姜超,孙军,李勇,陈强,夏涛,万旭:深度测序茶树转录组显示候选基因用于茶叶的主要代谢途径。BMC基因组学。2011,12(1):131-10.1186 / 1471-2164-12-131。
- 42.
基于系统发育研究的丙氨酸消旋酶结构家族氨基酸脱羧酶的功能分类。中国生物化学学报,2007,24(1):79-89。10.1093 / molbev / msl133。
- 43.
冯玲,高敏,侯锐,胡旭,张玲,万旭,魏胜:白化茶树幼苗叶片质量成分的测定。中国食品科学。2014,27(6):514 - 514。10.1016 / j.foodchem.2014.01.044。
- 44.
种子和非绿色组织中类胡萝卜素的积累和功能。植物学报。2006,29(3):435-445。10.1111 / j.1365-3040.2005.01492.x。
- 45.
李丽,袁洪:染色体发生与类胡萝卜素积累。中国生物化学学报。2013,32(5):591 - 598。10.1016 / j.abb.2013.07.002。
- 46.
从源到汇:植物类胡萝卜素生物合成的调控。植物科学进展,2010,15(5):266-274。10.1016 / j.tplants.2010.02.003。
- 47.
安德森IC,Robertson DS:类胡萝卜素在保护叶绿素免受光学挖掘中的作用。植物理性。1960,35:531-534。10.1104 / pp.35.4.531。
- 48.
马超,陈玲,王旭,金娟,马军,姚敏,王铮:“安吉白茶”不同白化阶段的差异表达分析(茶树(L.)O. Kuntze)使用cDNA微阵列。SCI Hortic。2012,148:246-254。10.1016 / J.Scienta.2012.09.033。
- 49.
镁螯合酶活性在四吡咯生物合成途径早期步骤中的作用。植物生理学报。2000,122(4):1161-1170。10.1104 / pp.122.4.1161。
- 50.
Espineda CE, Linford AS, Devine D, BrusslanAtCAO基因编码叶绿素a加氧酶,是植物中叶绿素b合成所必需的基因拟南芥.中国科学(d辑:地球科学),1999,16(4):527 - 534。10.1073 / pnas.96.18.10507。
- 51.
b.s, Hoffmann L, Geoffroy P, Lapierre C, Pollet B, Legrand M:黄酮的积累拟南芥木质素合成的抑制影响生长素运输和植物生长。植物学报,2007,19(1):148-162。10.1105 / tpc.106.044495。
- 52.
熊璐,李娟,李艳,袁玲,刘松,黄佳,刘铮:白化茶树中儿茶素水平及儿茶素生物合成相关基因表达的动态变化(茶树l .)。植物营养与肥料学报。2013,31(4):453 - 457。10.1016 / j.plaphy.2013.06.019。
- 53.
类黄酮生物合成。遗传学、生物化学、细胞生物学和生物技术的彩色模型。植物营养与肥料学报。2001,22(2):457 - 461。10.1104 / pp.126.2.485。
确认
中国农业科研体系专项资金(CARS-23);浙江省农业新品种培育重大专项(no . 2012C2905-3);浙江省“三农”问题研究项目(no . 2013-11)。关键词:黄土,边坡,稳定性,稳定性作者感谢上海OE生物科技有限公司的景峰女士对数据分析的帮助。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
作者的贡献
XCW和YJY参与了研究的设计和协调。LW、CY、HLC、YHZ、JMZ进行生化分析和基因表达分析。LW, CY和XCW撰写了论文。所有作者阅读并批准了最终的手稿。
王鲁、岳川对这项工作贡献巨大。
电子补充材料
12870 _2014_352_moesm3_esm.xlsx
259个差异表达基因与氨基酸代谢、色素(叶绿素、类胡萝卜素和类黄酮)代谢和光合作用有关。(XLSX 132 KB)
12870 _2014_352_moesm4_esm.xlsx
附加文件4:映射到ZH2和LJ43之间差异表达基因的255条路径。(XLSX 30 KB)
12870 _2014_352_moesm5_esm.docx
附加文件5:从微阵列数据中随机选择10个基因,利用RACE从两个茶叶品种中克隆。(多克斯1 MB)
作者为图像提交的原始文件
权利和权限
本文由BioMed Central Ltd授权发表。这是一篇基于知识共享署名许可协议(http://creativecommons.org/licenses/by/4.0.),允许在任何媒介上不受限制地使用、分发和复制,但须注明原作的出处。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
王磊,岳超,曹华。et al。一个新的缺叶绿素茶树品种的生化和转录组分析。BMC植物杂志14,352(2014)。https://doi.org/10.1186/s12870-014-0352-x
收到了:
接受:
发表:
关键字
- Chlorina
- 叶绿素缺乏
- 基因表达
- 微阵列
- 茶树